Особенности иммунной системы у детей: 404 File not Found — The DSMU Repository
Особенности иммунитета у новорожденных при перинатальной патологии
Field, C. J. (2005) The immunological components of human milk and their effect on immune development in infants. J Nutr, 135(1), 1–4.
Hanson, L. A., Korotkova, M., Lundin, S., Håversen, L., Silfverdal, S. A., Mattsby-Baltzer, I., et al. (2003) The transfer of immunity from mother to child. Annals of the New York Academy of Sciences, 987(1), 199–206. doi: 10.1111/j.1749-6632.2003.tb06049.x
Daminova, M. A., Safina, A. I., & Khamzina, G. A. (2013) Novoe v klassifikacii i diagnostike ostrogo povrezhdenijya pochek u novorozhdennyh [New in the classification and diagnosis of acute kidney injury (AKI) newborn]. Vestnik sovremennoj klinicheskoj mediciny, 6(6), 62–70. [in Russian].
Shunko, E. E., Omelchenko, L. V., Putkaradze, R. V., & Laksha, O. T. (2014) Osoblyvosti imunnoi systemy u novonarodzhenykh v krytychnomu stani, vplyv na stan zdorovia v rannomu dytynstvi [Features of the immune system in newborns in critical condition, the impact on health in early childhood].
Tonni, G., Leoncini, S., Signorini, C., Ciccoli, L., & De Felice, C. (2014) Pathology of perinatal brain damage: background andoxidative stress markers. Arch Gynecol Obstet, 290(1), 13–20. doi: 10.1007/s00404-014-3208-6.
Aversa, S., Pellegrino, S., Barberi, I., Reiter, R. J., & Gitto, E. (2012) Potential utility of melatonin as an antioxidant during pregnancy and in the perinatal period. J Matern Fetal Neonatal Med, 25(3), 207–221. doi: 10.3109/14767058.2011.573827.
Perrone, S., Tataranno, M.L., Negro, S., Longini, M., Marzocchi, B., Proietti, F., et al. (2010) Early identification of the risk for free radical-related diseases in preterm newborns. Early Hum Dev, 86(4), 241–4. doi: 10.1016/j.earlhumdev.2010.03.008.
Особенности строения, развития и функционирования иммунной системы детского организма
мирования адаптивного иммунитета – созревание способности
переключения изотипов иммуноглобулинов с IgM на IgG (внача-
ле приобретается возможность синтеза IgG1, IgG3, а затем IgG2
и IgG4). В целом системный и особенно местный иммунитет ос-
В целом системный и особенно местный иммунитет ос-
таются еще недостаточно эффективными, сохраняется высокая
восприимчивость к инфекциям. Это связано с недостаточностью
регуляторной функции CD4+Tх 1 типа, продукции γ-интерферо-
на, взаимодействия CD4+ Tх 2 типа с В-лимфоцитами.
Четвертый период проявляется между 4-м и 6-м годами разви-
тия ребенка. Он связан со второй перестройкой в кроветворении
и изменением содержания основных типов форменных элементов.
Следует отметить, что к этому возрасту у большинства детей им-
мунологические параметры уже близки к уровню взрослых. Им-
мунная система ребенка имеет достаточный персональный опыт по
организации специфической защиты от естественной локальной и
системной инфекции, а также иммунного ответа на вакцинные пре-
параты. Достаточно четко формируется группа часто и длительно
болеющих респираторной патологией детей (ЧДБ). Частота рес-
пираторных инфекций в течение года может достигать 6–10 раз.
Особенностью иммунной системы таких детей является сниженный
уровень секреторного иммуноглобулина А или его селективный де-
фицит. У значительной части детей при этом отмечается повыше-
ние биосинтеза иммуноглобулинов Е, что является свидетельством
доминирования функции CD4+ T-клеток Tх 2 типа над субпопуляци-
ей Tх 1 типа. Для таких детей характерно более частое развитие
атопических, паразитарных и иммунокомплексных процессов.
Пятый период приходится на подростковый возраст и обуслов-
лен половой дифференциацией и процессами созревания орга-
низма. Он начинается в возрасте 13–14 лет у мальчиков и 11–13 лет
у девочек. Половые гормоны — андрогены и эстрогены — воздейс-
твуют на органы и клетки-мишени иммунной системы, стимулируют
или ингибируют определенные субпопуляции, регуляторные и эф-
фекторные механизмы. При этом отмечается снижение массы лим-
фоидных органов. Под действием андрогенов происходит подав-
ление клеточного и стимуляция гуморального звена иммунитета. В
В
этот период возможно формирование ряда иммунопатологических
процессов, которые впоследствии могут способствовать развитию
определенных иммунопатологических заболеваний. Базируются
они на основе некоторых первичных или сформировавшихся к это-
му времени вторичных иммунодефицитных состояний.
Таким образом, становление иммунной системы ребенка
продолжается многие годы и представляет собой сложный, мно-
гоэтапный процесс. Каждый период характеризуется опреде-
ленными онтогенетическими особенностями, в основе которых
лежат геномические, функциональные, структурные, нейрогумо-
ральные перестройки, детерминированные возрастной стратеги-
ей развития организма. Периоды повышенной чувствительности
иммунной системы к действию эндо- и экзогенных повреждаю-
щих факторов (критические периоды) определяют проявление
наследственных вариаций силы иммунного ответа и иммунопа-
тологических диатезов. Знание особенностей строения, развития
Знание особенностей строения, развития
и функционирования иммунной системы детского организма не-
обходимо для адекватной диагностики, лечения и профилактики
широкого спектра заболеваний детского возраста.
И С П О Л Ь З О В А Н Н А Я
Л И Т Е Р А Т У Р А
1. Белозеров Е.С., Буланьков Ю.И., Митин Ю.А. Болезни иммунной системы.
– Элиста: АПП «Джангар», 2005. – Т. 2.
2. Бобова Л.П., Кузнецов С.Л., Сапрыкин В.П. Гистофизиология крови и органов кровет-
ворения и иммуногенеза: учеб. пособие. – М.: ООО «Издательство Новая Волна», 2003.
3. Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. – М.:
ООО «Медицинское информационное агентство», 2001.
4. Бурместер Г.–Р. Наглядная иммунология / пер. с англ. – М.: БИНОМ, Лабора-
тория знаний, 2007.
5. Галактионов В.Г. Иммунология. – М.: Академия, 2004.
6. Дранник Г.Н. // Клиническая иммунология и аллергология. – Одесса: Астро
Принт, 1999. – С. 294–300.
– С. 294–300.
7. Корнев М.А., Петрова Т.Б. Развитие и возрастные изменения органов иммун-
ной системы человека: учеб.–метод. пособие. – СПб.: ГПМА, 2000.
8. Лесков В.П. Клиническая иммунология для врачей. – М.: Медицина, 1997.
9. Сапин М.Р., Никитюк Д.Б. Иммунная система, стресс и иммунодефицит. – М.:
АПП «Джангар», 2000.
10. Сапин М.Р., Этинген Л.Е. Иммунная система человека. – М.: Медицина, 1996.
11. Стефани Д.В., Вельтищев Ю.Е. Клиническая иммунология и иммунопатоло-
гия детского возраста: руководство для врачей. – М.: Медицина, 1996.
12. Титов Л.П. // Медицина. –1997. – № 2. – С. 36–38.
13. Титов Л.П. // Медицина. – 1997. – № 3. – С. 34–35.
14. Титов Л.П. // Медицина. – 1997. – № 4. – С. 32–35.
15. Титов Л.П. // Медицина.–1998.–№1.– С.29–33.
16. Титов Л.П. // Весцi НАН Беларусi. Сер. мед.–бiял. навук. – 2001. – № 2. – С. 68–71.
17. Титов Л.П. // Весцi НАН Беларусi. Сер. мед.–бiял. навук. – 2006. –№ 2.
–№ 2.
18. Титов Л.П. Иммунология: терминол. словарь. – Минск: Белорусская наука,
2004.
19. Титов Л.П., Карпов И.А. // Мед. журнал.–2007. – № 1. –С. 4–14.
20. Хаитов Р. М. // Аллергия и клин. иммунология. – 1999. – № 1. – С. 6–20.
21. Ярилин А.А. // Rus. J. Immunol. – 1998. – Vol. 3 (2). – P. 5–20.
22. Ярилин А.А. Основы иммунологии. – М.: Медицина, 1999.
23. Fuzzi B., Rizzo R., Cristoli L. et al. // Eur. J. Immunol. – 2002. – Vol. 32 (2). – P.
311–315.
24. Leviton A., Paneth N., Reuss M.L. et al. // Pediatr. Research. – 1999. – Vol. 45 (5).
25. Seghaye M.-C., Heyl W., Grabitz R.G. et al. // Biology of the Neonate. – 1998.
– Vol. 73 (4). – P. 220–227.
Проблемные статьи и обзоры
ЭТО ПОЛЕЗНО ЗНАТЬ
ИММУНОГЕННОСТЬ МЕНИНГОКОККОВОЙ ТЕТРАВАЛЕНТНОЙ
ГЛИКОКОНЪЮГИРОВАННОЙ ВАКЦИНЫ У МЛАДЕНЦЕВ
Несмотря на превентивные меры, ежегодная частота
менингококковой инфекции (МИ) в США составляет от 1400
до 2800 случаев, 10–14% которых заканчиваются летально,
а ~20% имеют тяжелые исходы. Максимальная заболевае-
Максимальная заболевае-
мость МИ отмечается среди детей первых месяцев жизни и
подростков. 75% эпизодов МИ вызываются менингококками
серогрупп C, W-135 или Y. В настоящее время в США для про-
филактики МИ проводится вакцинация подростков 12–18 лет
тетравалентной (серогруппы А, С, W-135, Y) менингококковой
гликоконъюгированной (МГ) вакциной, которая не использу-
ется у детей до 2 лет из-за плохой иммуногенности. Недавно
была создана новая усовершенствованная тетравалентная
МГ вакцина (MenACWY), которая в качестве белка-носителя
содержит CRM197 – нативный мутант дифтерийного токси-
на, а также адъювант фосфат алюминия. Могоцентровое
открытое рандомизированное контролируемое исследова-
ние безопасности, реактогенности и иммуногенности новой
MenACWY для младенцев показало ее высокую иммуно-
генность у детей первых месяцев жизни. Для первичного
курса вакцинации наиболее эффективно введение трех доз
вакцины по схемам 2–3–4 или 2–4–6 мес. Двукратная пер-
Двукратная пер-
вичная иммунизация в 2 и 4 мес обеспечивала высокий уро-
вень серопротекции в отношении менингококков С, W-135 и
Y, а уровень защиты против серогруппы А был ниже. Новая
MenACWY хорошо переносилась детьми, выраженные мест-
ные реакции встречались редко.
D.M. Snape et al. // JAMA. – 2008. – Vol. 299, N 2. – P.
173–184.
Особенности иммунной системы у детей | Лекарство от гриппа и ОРВИ
Иммунитет бывает естественным (с рождения) и приобретенным (адаптивный). Естественный иммунитет — это иммунитет, который человек получает при рождении. Он заключается в генетически обусловленной невосприимчивости организма ко многим инфекционным возбудителям. Обеспечивается этот вид иммунитета наличием кожного покрова и слизистых оболочек, активностью бактерицидных веществ в биологических жидкостях, отсутствием чувствительных к возбудителям клеток, повышенной устойчивостью организма к возбудителям, функционированием специальных клеток иммунной системы (которые утилизируют возбудителей), активностью защитных белков, повышением температуры тела.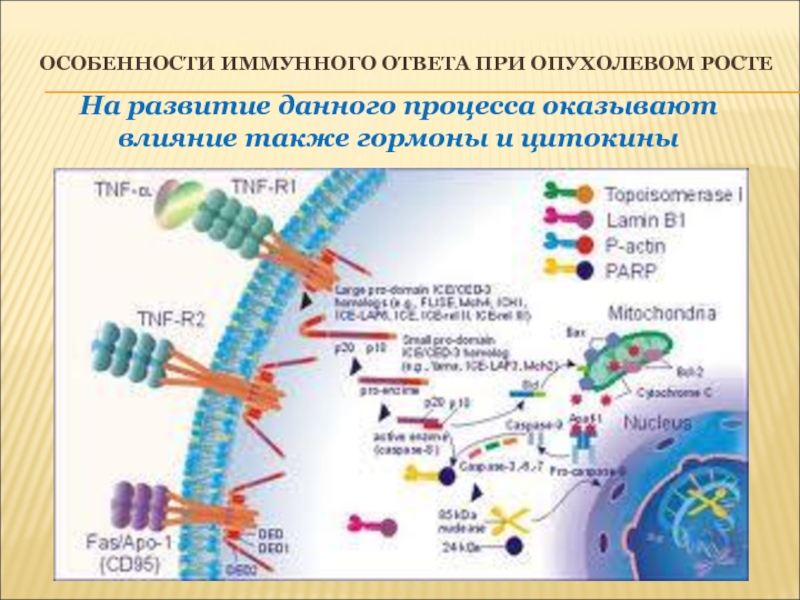
Защита организма от вирусов обеспечивается факторами специфического и неспецифического иммунитета. Неспецифическая защита — это функционирование системы защитных белков. Характерной чертой специфической защиты является иммунная память, которая сохраняется после первого контакта организма с вирусом.
Становление иммунной системы человека является длительным процессом. От рождения и до завершения формирования собственной иммунной системы детский организм очень восприимчив к вирусам и патогенным микроорганизмам.
Особенности иммунной системы ребенка в критические периоды формирования
- І критический период — период новорожденности. Характеризуется слабой устойчивостью к условно-патогенной микрофлоре; склонностью к возникновению гнойно-воспалительных процессов; высокой чувствительностью к вирусным инфекциям.
- ІІ критический период — от 3 до 6 месяцев жизни. Иммунный ответ имеет преимущественно первичный характер без сохранения иммунной памяти.

- ІІІ критический период -2-3 года. Расширение контактов ребенка обусловливает увеличение частоты инфекционных заболеваний. Продолжается формирование приобретенного иммунитета.
- IV критический период — 4-6 года. Завершается становление приобретенного иммунитета. Заболевания верхних дыхательных путей приобретают хронический или рецидивирующий характер в связи с недостаточностью местного иммунитета.
- V критический период — 12-13 лет. Начинают активно функционировать половые железы, в связи с чем отмечаются половые различия в иммунном статусе.
Иммунитет и аллергия — как они связаны?
Каждый из нас наверняка слышал о том, что аллергические реакции напрямую зависят от состояния иммунной системы. Но каким образом нарушения иммунитета обуславливают появление аллергии?
Что такое иммунитет?
Иммунитет (от лат. immunitas, что значит «освобождение» или избавление от чего-либо) – это невосприимчивость и сопротивляемость организма инфекциям, а также воздействию чужеродных веществ, которые обладают токсичными свойствами.
Иммунитет делится на врожденный и приобретенный.
- Врожденный, или неспецифический, иммунитет обусловлен физиологическими и анатомическими особенностями организма, наследственно закрепленными на клеточном или молекулярном уровне. К этому виду иммунитета относятся такие свойства, как невосприимчивость всех людей к собачьей чумке или невосприимчивость некоторых к туберкулезу.
- Приобретенный иммунитет возникает после контакта с инфекцией или чужеродным белком. Он делится на активный и пассивный.
- Активный приобретенный иммунитет развивается после перенесенного заболевания или же после введения вакцины. То есть после контакта с возбудителем болезни.
- Пассивный приобретенный иммунитет связан с поступлением в организм готовых антител. Антитела, или иммуноглобулины – это специфические вещества, которые могут вырабатываться клетками иммунной системы и предназначены для нейтрализации инфекционных тел и токсичных продуктов их жизнедеятельности. Но антитела могут и поступать в организм извне в виде сыворотки, а также при передаче их с молоком матери или внутриутробным способом.

Что входит в нашу иммунную систему?
Иммунная система включает в себя два типа защиты: клеточную и гуморальную. Клеточный тип – это иммунокомпетентные клетки (например, Т-лимфоциты), отвечающие за уничтожение чужеродных инфекционных микроорганизмов, попадающих в наше тело. Гуморальный тип объединяет иммунокомпетентные клетки (например, В-лимфоциты), которые продуцируют специфические антитела для борьбы с инфекцией и токсичными чужеродными молекулами.
Органы иммунной системы
Органы иммунной системы делят на центральные и периферические.
- — Красный костный мозг является центральным органом кроветворения и производства клеток иммунной системы. Он располагается в плоских и трубчатых костях.
- Тимус, или вилочковая железа, – центральный орган иммунной системы, в котором происходит окончательное созревание Т-лимфоцитов из предшественников, которые поступают из красного костного мозга.
- Лимфатические узлы – это периферические органы иммунной системы, располагающиеся по ходу лимфатических сосудов.
 Они участвуют как в механизмах гуморального (В-типа), так и клеточного (Т-типа) иммунитета, в том числе и в развитии аллергических реакций.
Они участвуют как в механизмах гуморального (В-типа), так и клеточного (Т-типа) иммунитета, в том числе и в развитии аллергических реакций. - Селезенка – самый крупный орган иммунной системы. Он также участвует в Т- и в В-иммунитете, а также обеспечивает превращение моноцитов в макрофаги.
Как взаимосвязаны иммунитет и аллергия?
Аллергия – это сверхчувствительность иммунной системы, возникающая при повторных воздействиях аллергена на организм. На сегодняшний день описано 5 типов реакций такой гиперчувствительности. Но аллергией называется только одна из них, обусловленная выработкой и воздействием иммуноглобулина Е в ответ на попадание в организм чужеродных белков.
Аллергия характеризуется чрезмерной деятельностью тучных клеток, которая переходит в общий воспалительный ответ. Также он может приводить к различным доброкачественным симптомам:
- насморку;
- кожному зуду;
- рези в глазах;
- отекам;
- крапивнице;
- чиханию и кашлю.

Кроме того, при выраженных реакциях могут развиваться и опасные для жизни состояния, такие как анафилактический шок или отек Квинке.
Следует различать аллергию и аутоиммунные реакции. Аутоиммунный процесс возникает в случае, когда защитные механизмы начинают атаковать клетки собственных тканей организма. Аллергия всегда является реакцией на чужеродные соединения.
Почему развивается аллергия?
Многочисленные исследования свидетельствуют о наследственной предрасположенности к аллергиям. Ребенок, чьи родители страдают этой патологией, подвержен большему риску возникновения аллергии, чем дети от здоровых пар.
Теория влияния гигиены утверждает, что соблюдение гигиенических норм предотвращает контакты организма со многими патологическими микроорганизмами и токсичными веществами. Это приводит к недостаточной нагрузке на иммунную систему, особенно у детей. Наш организм сконструирован так, что он должен постоянно противостоять определенному уровню угроз и внешних проникновений. И если такой постоянной «тренировки» и поддержания тонуса иммунной системы не происходит, то она начинает все более выражено реагировать на вполне безобидные вещества.
И если такой постоянной «тренировки» и поддержания тонуса иммунной системы не происходит, то она начинает все более выражено реагировать на вполне безобидные вещества.
Статистические данные свидетельствуют, что различные иммунологические заболевания в странах третьего мира встречаются гораздо реже, чем в развитых. Более того, чем больше времени проходит от момента иммиграции, тем чаще иммигранты из развивающихся стран страдают иммунными расстройствами. И по мере роста благосостояния, а, соответственно, чистоты и соблюдения гигиенических норм в стране у ее населения увеличивается количество случаев возникновения аллергии.
Теория увеличения потребления продуктов химической промышленности также подтверждается научными исследованиями. Многие химические продукты сами по себе могут являться довольно сильными аллергенами. Кроме того, они зачастую создают предпосылки для возникновения аллергических реакций, поскольку способны нарушать функции эндокринной и нервной системы.
Однако однозначного объяснения, почему одинаковые факторы действуют на одних людей и не действуют на других, пока не существует. С уверенностью можно сказать одно: здоровый образ жизни, правильное сбалансированное питание, отказ от вредных привычек и забота о собственном организме станут отличным подспорьем для недопущения развития аллергии.
С уверенностью можно сказать одно: здоровый образ жизни, правильное сбалансированное питание, отказ от вредных привычек и забота о собственном организме станут отличным подспорьем для недопущения развития аллергии.
Майорова Л.Н.
Иммунитет у ребенка
Иммунитет — это невосприимчивость организма к различным инфекционным возбудителям, их токсинам (ядам), а так же к различным другим чужеродным органическим веществам.
Иммунная охрана организма осуществляется как клетками иммунной системы (клеточный иммунитет), так и продуктами их жизнедеятельности (гуморальный иммунитет). Виды иммунитета Существует несколько видов иммунитета:
• видовой иммунитет
• приобретенный: естественный иммунитет (активный и пассивный)
Видовой иммунитет передается по наследству. Например, человек не может заразиться определенной инфекцией от животных (чумой).
Следующий вид иммунитета приобретенный: естественный иммунитет, вырабатывается при длительном контакте с возбудителями инфекции, при этом заражения не происходит.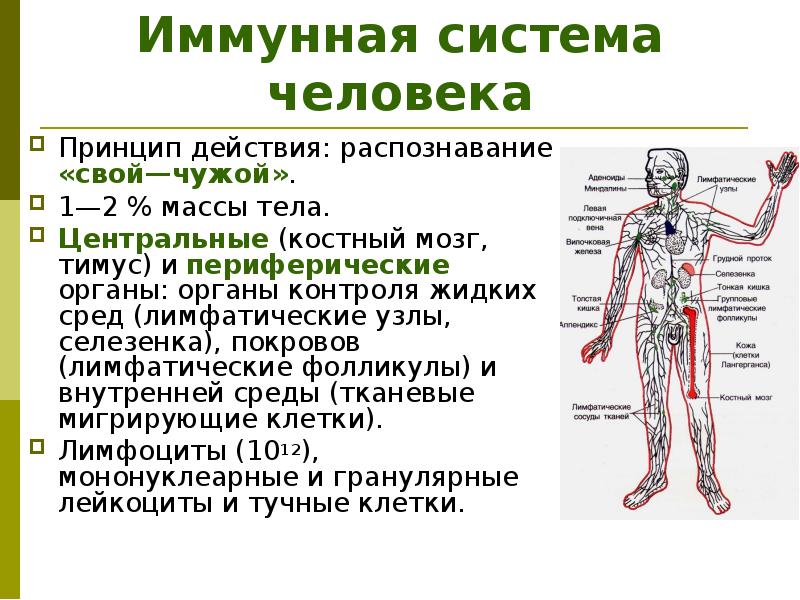
Пассивный иммунитет, который развивается в ответ на введение специальных сывороток с антителами (при инфекционных заболеваниях).
Особенности иммунитета у детей Иммунитет детей имеет ряд особенностей на определенных этапах развития. Детский иммунитет характеризуется наличием 5 основных критических периодов:
• Первый критический период в течение первых 28 дней жизни ребенка. В этот период дети имеют иммунитет, приобретенный от матери во время внутриутробного развития. В этот же период очень высока чувствительность ребенка к вирусным инфекциям, против которых он не защищен материнскими антителами. На 5 сутки жизни осуществляется первый перекрест в формуле белой крови и устанавливается абсолютное и относительное преобладание лимфоцитов. В этот период особенно важно сохранять грудное вскармливание.
• Второй критический период в возрасте 4-6 месяцев обусловлен разрушением материнских антител. В этот период особенно важно начать вакцинацию, с последующей ревакцинацией для формирования активного иммунитета против определенных видов инфекций. В этом возрасте дети особенно подвержены воспалительным процессам органов дыхания и кишечным инфекциям, нарастает частота пищевой аллергии.
В этот период особенно важно начать вакцинацию, с последующей ревакцинацией для формирования активного иммунитета против определенных видов инфекций. В этом возрасте дети особенно подвержены воспалительным процессам органов дыхания и кишечным инфекциям, нарастает частота пищевой аллергии.
• Третий критический период приходиться на возраст 2 лет. Это связанно с активным познанием мира ребенка в этот период. В этот период у ребенка могут проявиться различные врожденные аномалии и атопический диатез. Более подробно смотри статью «Атопический дерматит у детей». В этот же период жизни формула характеризуется абсолютным и относительным лимфоцитозом (физиологический лимфоцитоз).
• Четвертый критический период в возрасте 4-6 лет. Характеризуется уже накопленным активным иммунитетом, который сформировался под воздействием вакцинации и перенесенных вирусных и инфекционных заболеваний. В этот период возможно формирование многих хронических заболеваний. Для предотвращения этого необходимо своевременное и правильное лечение острых процессов.
• Пятый критический период в возрасте 12-15лет. Происходит на фоне бурной гормональной перестройки для девочек 12-13 лет, для мальчиков 14-15 лет. На фоне повышенной секреции половых гормонов уменьшается объем лимфоидных органов. В этот период окончательно формируется сильный и слабый типы иммунного ответа. В период полового созревания (пятый критический период) организм ребенка впервые сталкивается с неблагоприятными экзогенными (внешними) факторами, такими как курение, алкоголь и употребление различных синтетических наркотических средств.
Причин и факторов, снижающих иммунитет очень много. Основные из них это прежде всего неправильное питание, с низким содержанием белка и витаминов, что приводит к транзиторному снижению иммунитета, наличие хронических очагов инфекции (кариозные зубы, синусит, тонзиллит, пиелонефрит, цистит и др.), наличие хронических болезней органов пищеварения, инфекционных болезней в анамнезе, экологически неблагоприятная обстановка на территории проживания ребенка, нарушение состава кишечной микрофлоры, неадекватное использование антибиотиков.
Иммуномоделирующее лечение
Прежде чем начинать иммуномоделирующее лечение необходимо оценить и скорректировать следующие моменты:
• качество питания ребенка. Сбалансированное питание ребенка должно быть, прежде всего, разнообразным, включать белки, витамины и микроэлементы и состоять из продуктов растительного и животного происхождения.
• условия жизни ребенка, спокойная психоэмоциональная обстановка в семье, родительская любовь и ласка, также способствует правильному формированию иммунитета.
• оценка состояния внутренних органов, санация очагов хронической инфекции, для этого необходима консультация педиатра или семейного врача
Когда необходимо начать иммуномоделирующее лечение?
Использование иммунокорректирующих средств оправданно в следующих случаях:
• Ребенок слишком часто болеет, больше 6 раз в год простудными заболеваниями.
• Ребенок плохо реагирует на стандартное лечение, длительность заболевания выше, чем в среднем у детей данного возраста.
• Обычные простуды протекают, как правило, с осложнениями (бронхиты, отиты, ангины).
Иммунокоррекция должна проходить обязательно под наблюдением врача. Она может быть неспецифической и специфической.
Неспецифическая иммуностимуляция включает в себя, прежде всего грудное вскармливание, а в дальнейшем сбалансированное питание, закаливание, правильная организация сна и отдыха.
Группы препаратов, используемые для специфической иммунокоррекции.
Препараты, которые могут непосредственно воздействовать на иммунную систему, делятся на 3 группы:
1. Иммуностимуляторы
2. Индукторы иммунологической толерантности (эта группа препаратов способствует повышению функциональной активности иммунной системы).
3. Иммуносупрессоры (препараты поддержки иммунной системы, изменяющие некоторые специфические иммунные ответы).
Иммуностимуляторы — это препараты способствующие процессам возрастного созревания иммунной системы, включают в себя следующие группы препаратов: • витамины (Пиковит, Гровит, Мултитабс, Киндер биовиталь, Витрум Кидс, Мултивитамол и др.)
• препараты, содержащие полиненасыщенные жирные кислоты (Омега-3, рыбий жир, оливковое масло.
• пробиотики (Бифидум бактерин, бактисубтил, линекс, лактацид, субтил, бифиформ). Индукторы иммунологической толерантности — эта группа препаратов состоит из 5 подгрупп:
• препараты растительного происхождения изготавливаются из лекарственных растений, обладающих иммуностимулирующими и адаптогенными свойствами. Данная группа препаратов может быть назначена без обследования иммунного статуса ребенка, но дозировка и длительность использования должна быть обязательно согласована с врачом. В эту группу входят: препараты Эхинацеи пурпурной (Иммунал, настойка эхинацеи доктора Тайса), как правило, их назначают для лечения ОРВИ и для профилактики простудных заболеваний. Препараты женьшеня, радиолы розовой, элеутерококка — эти препараты желательно использовать у детей в возрасте после 6 лет.
• препараты группы интерферонов, используются в первую очередь при вирусных заболеваниях, гриппе, а также при вирусных гепатитах, герпесе. Интерфероны бывают 2 поколений: первое поколение, это препараты синтезированные из донорской крови (интерферон человеческий лейкоцитарный), в настоящее время не используется. Второе поколение синтетические интерфероны (Гриппферон, Виферон, Кипферон).
• препараты способствующие выработке собственных интерферонов (индукторы интерферонов): Арбидол, Анаферон, Циклоферон. Данные препараты обладают выраженным противовирусным и иммуностимулирующим действием. Препараты индукторы эндогенных (собственных) интерферонов не рекомендуется применять одновременно с препаратами из предыдущей подгруппы, так как возможна неадекватная реакция организма на сочетание этих препаратов. Использование препаратов этой группы целесообразно с первых часов болезни (как только вы заметите первые признаки начинающийся вирусной инфекции).
• препараты бактериального происхождения для повышения иммунитета (Бронхомунал П,Бронхомунал, ИРС-19б, Ликопид, Рибомунил). Данные медикаменты содержат фрагменты бактерий, но не несут никакой инфекционной опасности для заражения, обладая при этом иммуностимулирующим действием. Использование данных средств, требует обязательной консультации врача специалиста.
• препараты изготовленные из вилочковой железы (тимуса): Тималин, Т-активин, Тимостимулин и другие использование препаратов данной группы ограниченно и требует постоянного контроля врача иммунолога.
Необходимо помнить, что иммунитет- это основная защита нашего организма. Неправильное вмешательство в работу этой тонкой системы может привести к серьезным последствиям и сделать организм вашего ребенка открытым для любых воздействий извне. Поэтому прежде, чем начинать использование иммуностимулирующих средств, необходимо проконсультироваться с врачом.
Иммунная система в первые месяцы жизни развивается по определенному плану
Ученые из Каролинского института (Швеция) провели масштабное исследование развития иммунной системы у новорожденных от рождения до трех месяцев.
Авторы работы рассматривают иммунную систему человека как сенсорную систему для факторов окружающей среды. Подобно зрению и слуху, она зависит в своем развитии от каналов ввода информации. Взаимодействие иммунной системы новорожденных детей с микробами кишечника, кожи и дыхательных путей влияет на риск развития в дальнейшем иммунных заболеваний, таких как аллергия, астма и диабет первого типа.
Новорожденные дети восприимчивы к инфекциям, особенно если они рождаются раньше срока, но в чем причина — до сих пор не вполне понятно. Но поскольку кровь для анализов обычно брали из пуповины после родов, такие образцы не отражали изменений, происходящих с иммунной системой после контакта с бактериями. Очевидно, что исследования развития иммунной системы у детей помогут лучше защищать новорожденных от инфекций, разрабатывать более эффективные вакцины и уменьшить риск развития иммунных заболеваний.
В лонгитюдном исследовании, проведенном шведскими учеными, участвовали 100 новорожденных детей, появившихся на свет в больнице Каролинского университета, как недоношенных, так и родившихся в срок. У каждого ребенка в течение первых трех месяцев жизни брали по 100 мкл крови — в момент рождения (пуповинная кровь), на первой, четвертой и 12-й неделе. Методом масс-цитометрии определяли 58 популяций клеток иммунной системы, с помощью иммуноанализа — 267 белков плазмы крови. У четырех недоношенных и четырех доношенных детей также сделали анализ транскриптома на 1 и 12 неделе жизни, чтобы оценить изменения в экспрессии генов.
Преждевременные роды часто вызываются воспалительными процессами, и чтобы сравнить состояния иммунной системы у недоношенных и рожденных в срок детей, исследователи проанализировали концентрации белков в пуповинной крови. У детей, родившихся существенно раньше срока, обнаружили, в частности, высокую экспрессию хемокинов CXCL11 и интерлейкинина-8 (CXCL8) — провоспалительных цитокинов, стимулирующих миграцию иммунных клеток к месту инфицирования. А у доношенных детей были более высокие уровни лептина — пептидного гормона, регулирующего энергетический обмен, что, по мнению авторов, связано с более существенным накоплением жира в последнем триместре.
Исследование показало, что в первые месяцы жизни ребенка иммунная система претерпевает драматические изменения. Различия между доношенными и недоношенными детьми в начале жизни были значительными, но затем быстро уменьшались, причем развитие иммунной системы подчинялось общим закономерностям в обеих группах детей. Движущей силой, по-видимому, был контакт с антигенами внешней среды. С другой стороны, кишечные микробиомы детей существенно различались, доношенные дети, выписанные домой через несколько дней, и недоношенные, проводившие в больнице месяцы, росли в совершенно разных условиях. Следовательно, причина не только во внешних факторах: должны быть еще какие-то физиологические триггерные процессы, общие для всех детей. Примечательно, что у детей с дисбактериозом нормальное развитие иммунной системы было нарушено.
На основании этих наблюдений ученые предложили модель стереотипных адаптивных изменений иммунной системы под воздействием одного или множественных экологических факторов. Авторы отмечают, что сходство фенотипов иммунной системы не означает, что иммунные ответы будут одинаковыми. В их планах — расширение исследований и дальнейшие наблюдения за детьми, с тем, чтобы понять, как связаны особенности созревания иммунной системы в младенчестве с развитием аллергий и других иммунных заболеваний.
Источник:
http://www.pcr.ru/news/immunnaya-sistema-v-pervye-mesyatsy-zhizni-razvivaetsya-po-opredelennomu-planu/
Иммунитет: защита и нападение
Воспаление представляет собой реакцию ткани на инфекцию или повреждение и имеет следующие симптомы:
- покраснение вследствие усиления кровотока;
- отек вследствие накопления жидкости и клеток в тканях;
- боль вследствие повреждения ткани и раздражения нервных волокон;
- повышение температуры — местное (вследствие усиления кровотока) и/или системное (повышение температуры тела).
В процесс воспаления включаются белки плазмы крови — комплемент и цитокины. Комплементом называется ряд белков плазмы, вступающих в серию каскадных химических реакций в ответ на инфекцию. Это своего рода многоступенчатая сигнальная система, которая маркирует чужеродные микроорганизмы и привлекает в очаг инфекции специальные клетки — «убийцы» патогенов.
В ответ на сигнал тревоги начинается контратака защитной системы организма — запускается клеточный иммунный ответ. В неспецифическом иммунном ответе принимают участие два типа клеток крови — фагоциты и NK-клетки (или натуральные киллеры).
Фагоциты представляют собой крупные лейкоциты, поглощающие и буквально переваривающие внутри себя микроорганизмы и другие чужеродные частицы. Этот процесс называется фагоцитозом. Фагоциты наиболее чувствительны к микроорганизмам, помеченным белком-комплементом или антителами (эти частицы — уже часть адаптивного или специфического иммунного ответа). Кроме клеток, которые атакуют нарушителя по тревоге, в кровотоке также циркулирует регулярный «патруль» или особый вид лейкоцитов — натуральные киллеры. Их мишенью являются злокачественные клетки и клетки, инфицированные вирусами. Врожденный иммунитет быстро активируется на ранних стадиях инфекции. Его механизмы защиты могут ограничивать распространение патогенов в организме, но возможности для устранения чужеродных частиц ограничены и остаются прежними при повторном заражении тем же патогеном. Поэтому для борьбы с инфекцией обычно требуется участие третьей линии защиты — адаптивной иммунной системы (приобретённый иммунитет).
Адаптивный (приобретенный) иммунитет развивается после первой встречи с чужеродным агентом. Основными его качествами являются специфичность и иммунологическая память.
У специфического иммунитета в ответ на попадание в организм «чужака» в запасе имеется целая стратегия, которой позавидовали бы многие полководцы. «Основные войска» специфического иммунитета — лимфоциты. Это — специализированные лейкоциты, находящиеся в лимфатической системе. Лимфоциты характеризуются очень длительным периодом жизни — от нескольких лет до десятилетий! Известны три типа лимфоцитов: B-клетки, Т-клетки и натуральные киллеры (о них мы уже рассказывали).
Для развития адаптивного иммунитета требуется специфическая мишень — антиген. Антиген представляет собой вещество (обычно крупную молекулу), которая активирует иммунный ответ. Один микроорганизм обычно имеет большое количество антигенов, например, поверхностные структуры, такие как компоненты клеточной стенки, полисахариды капсулы, жгутики и т. д., или внеклеточные белки, такие как токсины или ферменты, вырабатываемые микроорганизмом.
Сначала происходит выработка В-клетками оружия против нарушителей — белка, который прореагирует с антигеном и сделает его безвредным. Эти белки носят название антител, называемых также иммуноглобулинами (Ig). Антитела очень специфичны и способны связываться только с антигеном той же структуры, что изначально стимулировал их образование. Когда антитело находит соответствующий ему антиген, они соединяются наподобие ключа, вставляемого в замочную скважину.
Затем приобретенный иммунитет начинает действовать сразу на два фронта: гуморальный иммунный ответ направлен на антигены, присутствующие в плазме крови, а клеточный иммунный ответ — на патогены, присутствующие внутри клеток.
В процессе гуморального иммунного ответа В-клетки, активированные специфическими антигенами, начинают усиленно делиться с образованием большого количества идентичных клеток-клонов, каждая из которых способна бороться с данным антигеном. Антитела B-клеток также привлекают фагоциты, уничтожающие и переваривающие антиген-мишень.
Клеточный иммунитет использует «специализированные силы» — T-хелперы и цитотоксические T-клетки, непосредственно атакующие и уничтожающие «войска противника» — инфицированные клетки.
После того, как война с инфекцией выиграна, В- и Т-клетки, активированные антигенами, переходят в состояние покоя и становятся лимфоцитами памяти, специфичными по отношению к данному антигену или патогену. При повторном заражении аналогичным или очень похожим (антигенно-аналогичным) микроорганизмом, они обеспечивают быстрый и мощный иммунный ответ. Высокие концентрации нужных антител достигаются уже через 1 — 2 дня после инфицирования.
Итак, приобретенный иммунитет характеризуется тремя основными особенностями:
- Специфичность: каждое антитело или активированная Т-клетка реагирует только со специфичным антигеном, вызвавшим ее образование. При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
- Память: после того, как в процессе адаптивного иммунного ответа произошло образование специфичного антитела или Т-клетки, производство антител или активация Т-клеток происходит быстрее и в больших количествах. Данная особенность является основой эффекта многих вакцин.
- Толерантность к собственным тканям: механизмы адаптивного иммунного ответа в норме способны отличать собственные структуры организма от чужеродных.
Дети и иммунная система
ИММУННАЯ СИСТЕМА
«Наша иммунная система — это ряд клеток, тканей и органов, которые на протяжении всей нашей жизни защищают нас от различных вторгающихся патогенов, сохраняют здоровье и позволяют противостоять многим повторным инфекциям», — говорит д-р Ашури, педиатрический специалист по инфекционным заболеваниям в CHOC. «Когда младенцы являются младенцами, они получают иммунные клетки от мамы через плаценту и грудное молоко, если они кормят грудью. Со временем организм ребенка становится зрелым и может бороться с инфекциями.Здоровый образ жизни, включающий достаточный отдых, низкий уровень стресса, сбалансированное питание и упражнения, помогает укрепить иммунную систему у людей всех возрастов ».
ПОДДЕРЖКА ИММУННОЙ СИСТЕМЫ РЕБЕНКА
«Грудное вскармливание, вероятно, является одним из лучших способов поддержать иммунную систему ребенка, когда она развивается», — объясняет д-р Ашури. «Получение младенцам рекомендованных вакцин в запланированное время также помогает защитить их от различных инфекций, которым они подвержены в этом возрасте.Мы рекомендуем родителям и детям также делать прививку от гриппа каждый год и иметь последнюю вакцину Tdap, чтобы защитить детей от коклюша (коклюша). Чем больше вакцинировано на
человек в сообществе, тем лучше для всех. В районах, где снизились показатели вакцинации, наблюдались вспышки кори, коклюша и других болезней, которые можно предотвратить ».
ДЕТСКИЕ И ДЕТСКИЕ
«Правильное мытье рук важно для предотвращения распространения простуды, вируса гриппа и других инфекций.Когда дети не могут мыть руки, им следует использовать дезинфицирующее средство для рук, чтобы убить микробы. Прививка детей от гриппа также предотвращает заражение детей гриппом », — говорит доктор Ашури. Она добавляет: «Со временем, когда иммунная система распознает определенные вирусы, она станет лучше предотвращать инфекции, особенно если человек ведет сбалансированную диету и ведет хороший образ жизни. Прием витаминов тоже не повредит, но они не заменят хорошо сбалансированную диету ».
БЫСТРЫЕ ФАКТЫ
- Число младенцев, умерших в результате вспышки коклюша (коклюша) в Калифорнии в 2010 году.Это была самая страшная вспышка за 60 лет.
- Зарегистрировано более 9000 случаев: 10
- Процент населения США, ежегодно болеющего сезонным гриппом (гриппом): от 5 до 20
- Количество детей, ежегодно госпитализированных в США с респираторными инфекциями: 500000
Эволюция иммунной системы человека от младенчества до старости
Abstract
В данной статье рассматривается развитие иммунного ответа в неонатальном, младенческом и взрослом возрасте, включая беременность, заканчивающуюся спадом в пожилом возрасте.Возникает картина ребенка, рожденного с незрелой, врожденной и адаптивной иммунной системой, которая созревает и приобретает память по мере его роста. Затем в старости он приходит в упадок. Эти изменения рассматриваются наряду с рисками различных типов инфекций, аутоиммунных заболеваний и злокачественных новообразований.
Ключевые слова: адаптивный иммунитет, врожденный иммунитет, инфекции
1. Введение
И один человек в свое время играет много ролей,
Его действиям семь возрастов.
Более 1600 генов участвуют в врожденных и адаптивных иммунных ответах [1]. Эти гены имеют большое значение для поддержания жизни во враждебной среде. Тем не менее, иммунная система является относительно незрелой при рождении и должна развиваться в течение жизни, подвергаясь воздействию множества внешних проблем в детстве, в молодом и зрелом возрасте (включая беременность), до упадка старости ().
( a ) Семь возрастов женщины. ( b ) Схематический график дополнительных смертей от сезонного или пандемического гриппа на протяжении жизни человека, представленный как число смертей на 1000 человек (адаптировано из [2]).Обратите внимание, что, хотя беременность увеличивает риск тяжелого гриппа, во время тяжелых пандемий, таких как 1918/1919, также наблюдались избыточные смертельные случаи среди ранее здоровых молодых людей, которые не были беременными. ( c ) Схематический график различных звеньев иммунного ответа на грипп на протяжении жизни человека.
2. Онтогенез иммунной системы в раннем возрасте
Сначала младенец,
Мычание и рвота в руках медсестры.
In utero среда плода требует, чтобы иммунная система оставалась толерантной к материнским аллоантигенам.После рождения внезапное колоссальное воздействие антигенов окружающей среды, многие из которых происходят из кишечных комменсальных бактерий, требует быстрых изменений, чтобы вызвать определенные иммунные реакции, соответствующие раннему возрасту.
(a) Врожденная иммунная система
Врожденная иммунная система обеспечивает раннюю первую линию защиты от вторжения патогенов. Вовлеченные клетки — нейтрофилы, моноциты, макрофаги и дендритные клетки, которые все взаимодействуют с адаптивной иммунной системой. Эти клетки развиваются и созревают в течение жизни плода, но в разное время, и функция всех компонентов врожденного иммунитета у новорожденных слабее по сравнению с более поздней жизнью.
Зрелые нейтрофилы присутствуют в конце первого триместра и резко увеличиваются в количестве, стимулируемые гранулоцитарно-колониестимулирующим фактором, незадолго до рождения. Затем их количество возвращается к стабильному уровню в течение нескольких дней, но они проявляют слабую бактерицидную функцию, слабую реакцию на воспалительные стимулы, сниженную адгезию к эндотелиальным клеткам и уменьшенный хемотаксис [3]. Эти дефициты более заметны у недоношенных детей, у которых также ниже сывороточный IgG и комплемент. Следовательно, новорожденные, и особенно недоношенные, имеют нарушенные функции нейтрофилов [4], что подвергает ребенка риску бактериальных инфекций.
У недоношенных и новорожденных классические моноциты и макрофаги также являются незрелыми. У них снижена экспрессия TLR4 [5] с нарушением врожденных сигнальных путей [6-8], что приводит к снижению цитокиновых ответов по сравнению со взрослыми. Следовательно, происходит плохое восстановление тканей, нарушенный фагоцитоз потенциальных патогенов и плохая секреция биоактивных молекул. Однако, хотя частота макрофагов в легких у недоношенных и доношенных детей снижается, уровни этих клеток у взрослых достигаются в течение нескольких дней после рождения [9].
По сравнению с кровью детей или взрослых, пуповинная кровь содержит меньше дендритных клеток миелоидного типа (mDC). Они экспрессируют более низкие уровни HLA класса II, CD80 и CD86 на клеточной поверхности, чем взрослые mDC [10]. Они секретируют низкие концентрации IL-12p70 в ответ на активацию врожденных стимулов [11]. Таким образом, праймирование Т-клеточных ответов Th2 и CD8 снижено по сравнению со взрослыми, что коррелирует с повышенной восприимчивостью к инфекциям, вызываемым вирусами Mycobacterium tuberculosis и Salmonella spp . Напротив, новорожденные mDC, стимулированные с помощью TLR4, секретируют подобные взрослым концентрации провоспалительных цитокинов [12], которые способствуют иммунным ответам Th27.
Плазмацитоидные дендритные клетки (pDC) выделяют высокие концентрации интерферона I типа (IFN) в ответ на стимуляцию TLR7 и TLR9 у взрослых. Однако у новорожденных pDC строго ограничена секреция интерферона α / β при воздействии различных вирусов, несмотря на то, что уровни экспрессии TLR7 и TLR9 аналогичны взрослым [13]. Следовательно, врожденные иммунные ответы на вирусы, такие как респираторно-синцитиальный вирус, вирус простого герпеса и цитомегаловирус, являются слабыми по сравнению с более поздними периодами жизни.
Естественные киллерные (NK) клетки у взрослых сдерживают репликацию и распространение вируса до установления адаптивного иммунитета [14]. Они регулируются ингибирующими рецепторами, которые распознают HLA-A, B, C и E, и, следовательно, способствуют самотолерантности. На ранних сроках беременности NK-клетки гипочувствительны к клеткам-мишеням, лишенным молекул класса I главного комплекса гистосовместимости (MHC) (таких как трофобласт [15]), и очень чувствительны к подавлению иммунитета за счет трансформирующего фактора роста-β (TGF-β).Цитолитическая функция NK увеличивается во время беременности, но при рождении все еще составляет лишь половину от взрослого уровня. Новорожденные NK-клетки менее чувствительны к активации IL-2 и IL-15 и продуцируют ограниченные концентрации IFN-γ. Однако порог активации клеток ниже, что обеспечивает некоторую противовирусную защиту [15].
Три независимых пути, которые активируют систему комплемента, имеют решающее значение для защиты хозяина и воспаления. Компоненты комплемента способствуют опсонизации, являются хемоаттрактантами для врожденных клеток, опосредуют лизис клеток и влияют на выработку антител.Концентрация почти всех циркулирующих компонентов в сыворотке новорожденных на 10–80% ниже, чем у взрослых [16], при пониженной биологической активности. Уровни комплемента повышаются после рождения, при этом некоторые сывороточные факторы достигают концентрации взрослого человека в течение месяца (например, фактор B), но другие развиваются медленнее [16]. Поскольку у младенцев низкая концентрация иммуноглобулина, эффекторные функции комплемента зависят от альтернативных путей активации и путей активации связывания лектина, запускаемых полисахаридами и эндотоксинами.
В целом, врожденная иммунная система при рождении приглушена, цена, вероятно, заплачена плодом не только за переносимость необщих материнских антигенов, но и за игнорирование значительного стресса и ремоделирования, которые происходят во время развития.Это делает новорожденного, особенно недоношенного, относительно восприимчивым к бактериальным и вирусным инфекциям.
(b) Адаптивная иммунная система
Т-клетки развиваются в тимусе, который является самым большим при рождении и в течение первых лет жизни. Зрелые одиночные CD4 + и CD8 + положительные Т-клетки впервые обнаруживаются в тимусе на 15 неделе и в большом количестве на периферии задолго до рождения [17,18]. Однако неонатальные Т-клетки значительно отличаются от взрослых клеток, что отражает внутриутробную жизнь плода, где воздействие чужеродных антигенов в значительной степени ограничивается ненаследственными материнскими аллоантигенами.Функция ранних Т-клеток отличается от взрослых Т-клеток. Например, хотя наивные Т-клетки CD4 + у плода сильно реагируют на аллоантигены, они имеют тенденцию развиваться по направлению к регуляторным Т-клеткам Foxp3 + CD25 + (T reg ) через влияние TGF-β [19], и таким образом активно продвигают терпимость к себе. Периферические Т reg составляют около 3% от общего количества CD4 + Т-клеток при рождении [20], и эти клетки сохраняются в течение длительного периода времени [21], придавая иммунному ответу в раннем возрасте противовоспалительный профиль [22 ].
Активация чужеродным антигеном поздних эмбриональных или неонатальных Т-клеток приводит к ответу, искаженному в сторону иммунитета Th3 [23], который усиливается неонатальными дендритными клетками и эпигенетическими особенностями [24,25]. Таким образом, очень ранний адаптивный Т-клеточный иммунитет характеризуется толерогенной реактивностью, сниженным распознаванием алло-антигена и слабыми ответами на чужеродные антигены.
У новорожденных, в дополнение к обычным Т-клеткам, которые распознают пептидные антигены в контексте классических молекул MHC, существуют популяции γδ Т-клеточных рецепторов (TCR) -положительных и врожденных-подобных αβ-TCR-позитивных Т-клеток.К ним относятся функционально компетентные клетки iNKT, которые быстро продуцируют IFN, ассоциированные со слизистой оболочкой инвариантные Т-клетки (MAIT) [26] и недавно описанные интерлейкин-8 (CXCL8) -секретирующие наивные Т-клетки, которые связывают врожденный и адаптивный иммунитет [27]. Клетки MAIT развиваются в тимусе, но их созревание может происходить в тканях слизистой оболочки плода до микробной колонизации. Т-клетки, продуцирующие CXCL8, производят важные эффекторные функции у новорожденных людей, поскольку они могут активировать антимикробные нейтрофилы и γδ Т-клетки.Они, по-видимому, особенно активны на барьерах слизистой оболочки недоношенных и доношенных детей, хотя их частота уменьшается с возрастом. В отличие от крови взрослых, где репертуар γδ TCR ограничен, γδ T-клетки неонатальной крови обнаруживают множество комбинаций рецепторных цепей, которые меняются с беременностью [27]. γδ Т-клетки могут продуцировать значительные количества IFN-γ после кратковременной поликлональной стимуляции, компенсируя незрелость более классического ответа Т-клеток Th2-типа на неонатальные инфекции [28,29].
Два типа В-клеток возникают через разные пути развития [30]. Клетки B1 спонтанно секретируют низкоаффинный IgM с ограниченным диапазоном антигенной специфичности (включая обычные бактериальные полисахариды), имеют меньше соматических мутаций и служат первой линией защиты [31]. Клетки B1 секретируют IL-10 и TGF-β и, таким образом, способствуют ответу Th3. При рождении B1-клетки составляют 40% B-клеток периферической крови, и эта частота остается высокой в течение нескольких месяцев [32]. Обычные В-клетки (обозначенные как клетки В2) происходят из многолинейного общего лимфоидного предшественника CD34 + и генерируют широкий репертуар иммуноглобулиновой специфичности из-за экспрессии терминальной дезоксинуклеотидилтрансферазы, которая увеличивает разнообразие в соединении сегментов гена иммуноглобулина V-D-J.В-клетки обычно присутствуют во вторичных лимфоидных органах и в костном мозге, где они вносят вклад в гуморальный ответ адаптивной иммунной системы.
Большинство ответов антител, в том числе на бактериальные белки, бактериальные полисахариды и вакцины на основе конъюгированных полисахаридов и белков, зависят от помощи Т-клеток. Они полагаются на взаимодействие между TCR и участие корецепторов, включая CD28 и лиганд CD40, на Th3 или фолликулярных Т-хелперных клетках с их соответствующими партнерами по связыванию HLA-пептидом, CD80 / 86 и CD40 на антиген-специфических В-клетках.Однако неонатальные В-клетки экспрессируют низкие уровни этих корецепторов, что ограничивает их способность отвечать [33]. Более того, низкие уровни рецептора для фрагмента C3d комплемента (CD21) препятствуют ответам на комплексы полисахарид-комплемент [34]. Вместе эти особенности вносят вклад в притупление гуморальных иммунных ответов с неполным переключением классов иммуноглобулинов [35], хотя генерируются В-клетки памяти [36]. В-клетки новорожденных и младенцев в возрасте до 2 месяцев демонстрируют снижение соматической гипермутации по сравнению со взрослыми, что ограничивает созревание аффинности антител [37].Наконец, стромальные клетки костного мозга в раннем возрасте не способны поддерживать долгосрочную выживаемость плазмобластов и дифференцировку в плазматические клетки, так что любые антитела IgG, вырабатываемые после иммунизации, быстро снижаются, в отличие от детей старшего возраста и взрослых [38]. Следовательно, эффективность адаптивной иммунной системы по раннему ответу на Т-клеточно-зависимые антигены у новорожденных заметно снижена по сравнению с детьми старшего возраста и взрослыми. Это физиологическое поведение особенно актуально для программ вакцинации.Вместе с нарушением врожденного иммунитета слабый ответ Th2 и антител хорошо объясняет, почему неонатальная смертность может быть высокой в условиях повышенного воздействия патогенов.
3. От детства до взрослой жизни
Потом нытье школьник с сумкой
И сияющее утреннее лицо, ползет как улитка
В школу нехотя.
Молодой человек, даже когда врожденная и адаптивная иммунные системы начинают созревать, подвергается риску заражения многими патогенными вирусами, бактериями, грибами и паразитами.Тем не менее, у него или нее есть хорошие шансы выжить в развитых странах. До того, как появилось хорошее питание, гигиена и комплексная вакцинация, младенцы и дети младшего возраста были очень смертными. В 1900 году коэффициент младенческой смертности в Великобритании составлял 140 на 1000, а к 2000 году упал до 7 на 1000 [39]. Это снижение смертности было пропорционально больше у младенцев и детей по сравнению с другими возрастными группами [40]. На лучшую профилактику и контроль инфекций приходится большая часть этой осени. Однако во многих странах уровень младенческой смертности остается выше 50 на 1000, что указывает на эволюционное давление, которое должно было привести к выбору работающей защитной иммунной системы.Кроме того, такое давление выбрало крайний генетический полиморфизм в MHC, который через представление пептидов Т-клеткам и NK-клеткам является ключевым регулятором почти всех иммунных ответов.
В младенчестве иммунная система постепенно созревает. Критически важная ранняя защита от многих инфекционных заболеваний, ранее перенесенных матерью, обеспечивается пассивными антителами IgG, передаваемыми от матери трансплацентарно и с молоком. Как только это исчезнет, маленькие дети станут более уязвимыми к инфекциям, хотя к тому времени они будут лучше вооружены созревающей врожденной и адаптивной иммунной системой.В настоящее время риски значительно снижаются за счет вакцинации, которая стимулирует защитные иммунные реакции в созревающей иммунной системе. Тем не менее, дети все еще могут заразиться вирусными, бактериальными и паразитарными инфекциями, с которыми необходимо бороться и контролировать иммунные реакции. Такая стимуляция антигеном не только способствует выздоровлению, но и приводит к иммунологической памяти [41,42]. Таким образом, со временем защита, обеспечиваемая иммунным ответом, увеличивается, и молодые люди реже страдают от инфекций. Это накопление иммунологической памяти является развивающейся особенностью адаптивного иммунного ответа.Память сохраняется до старости [41], но затем может исчезнуть.
Помимо явных инфекций и прививок, новорожденный подвергается воздействию других антигенов. Он или она происходит из относительно стерильной среды in utero и затем быстро подвергается воздействию множества микробов [43]. Первый серьезный контакт с бактериями происходит во время прохождения через родовые пути, а затем при оральном, кожном и респираторном контакте с окружающей средой. С этого момента воздействие микроорганизмов продолжается.Многие бактерии, колонизирующие кишечник и другие участки слизистой оболочки, необходимы для здорового образа жизни, включая переваривание пищи и получение жизненно важных питательных веществ. Они также влияют на развитие иммунной системы [44].
Примерно 20% всех лимфоцитов находятся в кишечнике [45], подвергаясь воздействию многих возможных чужеродных иммуногенов. Иммунные клетки кишечника контролируют границу с потенциально опасным источником инфекций. Кишечные бактерии влияют на развитие клеток Th27 [46], клеток T reg [47] и Т-клеток памяти [48–50].При рождении почти все Т-клетки несут гликопротеин CD45RA, типичный для наивных Т-клеток, которые никогда не сталкивались с чужеродным антигеном. В CD45RA-отрицательных CD4 Т-клетках также имеется относительно большое количество regs Т . В детстве количество клеток T reg снижается, а клетки памяти Th2, Th27 и Th3 постепенно увеличиваются, чтобы сравняться с количеством наивных Т-клеток [51]. Хотя некоторые из этих Т-клеток памяти могли быть стимулированы инфекциями конкретными патогенами и вакцинацией, многие из них могут быть активированы микробиомом не только в кишечнике, но также в дыхательных путях и коже.Эти примированные Т-клетки памяти могут отвечать на последующие инфекции посредством перекрестных реакций [48, 52, 53]. Например, взрослые, которые никогда не контактировали с ВИЧ-1, имеют в своем репертуаре Т-клетки памяти, которые реагируют с пептидами ВИЧ, представленными на клеточной поверхности белками HLA; эти Т-клетки, вероятно, снова пробудятся при возникновении ВИЧ-инфекции [48,50], как и другие микробы [52]. Перекрестная реактивность возникает из-за дискретных коротких (8-15 аминокислот) пептидов (эпитопов), которые входят в пептид-связывающие бороздки на молекулах HLA класса I или II на поверхности клетки и затем распознаются Т-клетками.Внутри последовательностей микробиома существует множество идеальных и почти идеальных совпадений с известными вирусными пептидными эпитопами, такими как эпитопы ВИЧ-1 [48,50]. Они легко могут быть ответственны за создание Т-клеток памяти, специфичных для эпитопов патогенов, с которыми человек никогда не сталкивался.
Сегментированные нитчатые бактерии в кишечнике необходимы для развития клеток Th27 [47] и Clostridium spp. индуцируют клетки T reg толстой кишки [54,55]. У здоровых мышей наблюдаются иммунологические дефекты, в том числе меньшее количество пейеровских бляшек, более мелкие лимфоидные фолликулы и аномальные зародышевые центры в лимфоидной ткани тонкого кишечника [56].Этот иммунодефицит можно скорректировать за несколько дней, добавив одну мышь с нормальной кишечной флорой в клетку с стерильными животными [56,57]. Таким образом, данные на животных подтверждают мнение о том, что микробиом формирует развитие как Т-, так и В-клеток памяти.
Подобные события происходят и для В-клеток. Углеводные антигены групп крови ABO перекрестно реагируют с бактериальными антигенами кишечника и стимулируют ответы антител IgM. Антитела к белку gp41 ВИЧ-1 могут происходить из В-клеток, рецепторы антител которых перекрестно реагируют с белком Escherichia coli [58].
По мере роста ребенка иммунный репертуар также формируется интеркуррентными инфекциями и вакцинациями [59]. Патогенные инфекции могут быть задокументированы по симптоматическим заболеваниям, перенесенным ребенком или взрослым, но для многих вирусов, таких как грипп, инфекция может быть субклинической, но все же достаточной для стимуляции или усиления иммунных ответов [60]. Как правило, защита, обеспечиваемая иммунным ответом, как антителами, так и Т-клетками, очень эффективна. Большинство детских инфекций случаются только один раз, и тогда защита длится всю жизнь.
Поддержание долговременной B-клеточной памяти примечательно, учитывая, что иммуноглобулин IgG имеет период полураспада in vivo около 25 дней [61]. Плазматические клетки, продуцирующие антитела, которые развиваются во время иммунного ответа, мигрируют в костный мозг, где они живут очень долго. Кроме того, может происходить непрерывная регенерация В-клеток памяти, контактирующих с персистирующим антигеном и Т-хелперами. Антигены в виде частиц годами сохраняются в лимфатических узлах, удерживаемых фолликулярными дендритными клетками [62].Персистентность антигена и перекрестно-реактивные антигены, вероятно, помогают поддерживать жизнь этих В-клеток, время от времени делящихся и секретируя антитела.
Примечательно, что мать может передать достаточно антител для защиты своего ребенка, когда он был инфицирован 20–30 лет назад. Передача защитных антител от матери к ее ребенку чрезвычайно важна, особенно в средах, где 15% или более младенцев и детей умирают от инфекции. Парадоксально, но мать, которая избежала опасной детской инфекции благодаря коллективному иммунитету, может фактически подвергнуть своего ребенка риску, будучи неспособной передавать специфические защитные антитела.
Существует большое количество бессимптомных хронических инфекций, в основном вирусных, которые вызывают иммунные реакции. Примерами являются цитомегаловирус (CMV), вирус Эпштейна-Барра (EBV) и Mycobacterium tubercolosis ( Mtb ), но полный список длинный и продолжает расти [63]. EBV, CMV и Mtb вызывают очень сильные Т-клеточные ответы CD4 и CD8 у людей. ЦМВ-специфический ответ Т-лимфоцитов CD8 может приводить к разрастанию олигоклональных Т-клеток, достигающих более 10% циркулирующих Т-лимфоцитов CD8.Эти Т-клетки важны, потому что они контролируют вирус, и их истощение, например, с помощью иммуносупрессивной терапии, может активировать инфекцию (например, Mtb, , EBV, CMV) с разрушительными последствиями.
Эволюция ответов антител в В-лимфоцитах подробно рассмотрена в другом месте [64]. Короче говоря, наивные В-клетки с рецепторами антител, специфическими для иммуногена, связывают антиген в зародышевом центре лимфатических узлов и получают частичный сигнал. Связанный антиген интернализуется и переваривается в лизосомах.Несколько образующихся пептидов связываются с молекулами HLA класса II этой клетки и затем представляются на поверхности клетки, где Т-фолликулярные хелперные клетки с соответствующими Т-клеточными рецепторами отвечают и доставляют дополнительные сигналы, включая IL-21, к В-клетке. Эти сигналы запускают деление В-клеток, переключение классов генов антител и соматическую гипермутацию. В этом случае предпочтение отдается В-клеткам, которые экспрессируют мутировавшие антитела, связывающие иммуноген с более высокой аффинностью. Отбор антител с лучшим связыванием продолжается в течение месяцев, что в конечном итоге приводит к получению антител с высоким сродством из сильно мутировавших генов зародышевой линии.Антитела с высоким сродством более эффективны при нейтрализации или опсонизации вторгшихся микробов и их патогенных продуктов.
Процесс соматической гипермутации не происходит в Т-клетках, даже если они имеют антителоподобные гены рецепторов Т-клеток, потому что наличие высокоаффинного Т-клеточного рецептора не дает никаких преимуществ. Связывание рецептора Т-клетки с комплексом пептид-HLA на антигенпрезентирующих клетках имеет низкое сродство. Он усиливается несколькими парами корецептор-лиганд, которые не являются антиген-специфическими, давая Т-клетке сигнал делиться и функционировать.
В результате иммунного заражения отвечающие Т- и В-клетки могут временно увеличиваться до очень больших количеств [65], иногда более 10% всех циркулирующих Т-клеток, но они быстро сокращаются в результате активации клеток, индуцированных активацией. смерть и истощение в течение более длительного периода времени. Таким образом, по мере того, как патоген контролируется и исчезает, некоторые Т- и В-клетки памяти сохраняются в течение длительного времени в количестве, которое намного превышает количество наивных Т-клеток и Т-клеток «наивной памяти», которые были там до заражения.
По мере того, как человек становится старше, он или она развивает расширяющийся репертуар, включающий Т- и В-клетки памяти, вызванные предыдущими инфекциями и вакцинациями, а также репертуар наивной памяти, сформированный воздействием микробиома, пищевых антигенов и вдыхаемых антигенов. Учитывая большую сложность репертуаров Т- и В-клеток и большой стохастический элемент в выборе того, какие клетки будут реагировать на данный стимул, а также соматические мутации в В-клетках, точный состав будет отличаться у каждого человека, даже у монозиготных близнецов [ 66].Добавьте к этому значительную генетическую изменчивость в реакции людей, определяемую высокополиморфными генами HLA [67] и генами врожденного иммунитета, и неудивительно, что иммунные ответы любого взрослого человека значительно различаются.
(a) Беременность
Подробное изучение иммунологии беременности выходит за рамки настоящего обзора (см. [68,69]). Однако успешное размножение имеет центральное значение в эволюции и имеет иммунологические проблемы.Как новорожденный сохраняет механизмы, с помощью которых плод сводит к минимуму свои иммунные реакции на мать, обсуждалось выше. Еще большая загадка заключается в том, как мать переносит полуаллогенный трансплантат, не отвергая его и без иммуносупрессии, необходимой для принятия трансплантата органа [70]. На материнском интерфейсе трофобласта в месте первоначальной имплантации и в плаценте есть особенности, которые нарушают нормальный иммунный ответ отторжения трансплантата. К ним относятся экспрессия только неполиморфных неклассических антигенов HLA на трофобласте [71], локальное подавление иммунитета, опосредованное инфильтрацией NK-клеток [72], моноцитов и регуляторных Т-клеток [69,73], а также ингибирование активации Т-клеток. катаболизмом триптофана [74].Примерно во время имплантации местная воспалительная реакция создает стабильный участок плаценты [68]. Есть данные, что мать изменяет баланс своих Т-клеточных ответов на Th3, а не на Th2 [68]. Таким образом, у беременных женщин могут наблюдаться ремиссии аутоиммунного заболевания [75], и они более подвержены тяжелым осложнениям гриппа [76] и некоторых других инфекций. Эта иммунная модуляция, необходимая для благополучия плода, иногда может быть вредной для матери.
(b) Злокачественные новообразования и аутоиммунные заболевания
Основная роль иммунной системы, вероятно, состоит в защите от инфекций.Другие роли, такие как разрушение мутировавших клеток, могут быть очень важны, но в большей степени в пожилом возрасте после размножения. Многие опухоли отключают Т-клетки, специфичные для опухолевых антигенов, путем связывания с рецепторами «контрольной точки», такими как PD-1 или CTLA4, и новые методы лечения, которые блокируют эти взаимодействия рецептор-лиганд, имеют большой терапевтический потенциал [77,78]. Однако побочные эффекты такой терапии и пассивного переноса противораковых Т-клеток включают аутоиммунные реакции, предполагающие баланс между реакциями против собственного иммунитета, предотвращающими рак и вызывающими аутоиммунитет [79].Во взрослой жизни баланс обычно работает, но у одной трети западных людей развивается рак, обычно в более позднем возрасте, в то время как у 5–10% развивается клиническое аутоиммунное заболевание, поэтому баланс точно установлен и со временем может измениться. Ослабление иммунной системы в пожилом возрасте (см. Ниже) может улучшить аутоиммунитет, но за счет повышенного риска рака.
Микроорганизмы вызывают около четверти всех видов рака (например, ВЭБ, вирусы гепатита В и С, вирус папилломы человека и Helicobacter pylori ).Специфические Т-клеточные реакции обычно сдерживают эти микробы. Однако, если иммунитет нарушен в результате старения (см. Ниже), иммуносупрессивной терапии или определенных инфекций, особенно ВИЧ-1, эти виды рака возникают [80].
Таким образом, если в раннем детстве развился полностью эффективный иммунный ответ, он созревает по мере накопления памяти и поддерживает здоровье человека в критические периоды жизни, включая деторождение. Он не только защищает от потенциально смертельных инфекций, но также контролирует ряд устойчивых инфекций, некоторые из которых могут вызывать рак.Он также может иметь дело с мутантными клетками, которые могут стать злокачественными. Он может быть чрезмерно реактивным и вызывать аутоиммунное заболевание или аллергию, что является платой за общую пользу.
4. Снижение иммунитета с возрастом
Последняя сцена из всех,
На этом заканчивается эта странная, насыщенная событиями история,
Это второе ребячество и простое забвение,
Без зубов, без глаз, без вкуса , без всего.
С возрастом иммунная система подвергается глубокому ремоделированию и ухудшению, что оказывает большое влияние на здоровье и выживаемость [81,82].Это иммунное старение предрасполагает пожилых людей к более высокому риску острых вирусных и бактериальных инфекций. Более того, уровень смертности от этих инфекций в три раза выше среди пожилых пациентов по сравнению с более молодыми взрослыми пациентами [83]. Инфекционные заболевания по-прежнему являются четвертой по частоте причиной смерти пожилых людей в развитом мире. Более того, аберрантные иммунные ответы у пожилых людей могут усугублять воспаление, возможно, способствуя возникновению других бедствий старости: рака, сердечно-сосудистых заболеваний, инсульта, болезни Альцгеймера и деменции [84].
Во время обычного сезона гриппа около 90% дополнительных смертей происходит среди людей старше 65 лет. Более того, слабый иммунный ответ является причиной снижения эффективности вакцин [82,85]. Иммунное старение также приводит к реактивации латентных вирусов, таких как вирус ветряной оспы, вызывая опоясывающий лишай и хроническую невралгию.
Ухудшение иммунной системы с возрастом может нарушить гомеостатическое равновесие между микробиотой и хозяином. Таким образом, снижение бактериального разнообразия в кишечнике коррелирует с диареей, ассоциированной с Clostridium difficile, , основным осложнением для пожилых людей в больницах [86].Более того, отклонения от профиля кишечной микробиоты, установленного в молодости, связаны с воспалительными заболеваниями кишечника [87]. Увеличение с возрастом количества провоспалительных патобионтов и уменьшение количества иммуномодулирующих видов может способствовать развитию воспалительных заболеваний и поддерживать их [86].
В то же время стареющая иммунная система не может поддерживать полную толерантность к аутоантигенам, что приводит к увеличению числа аутоиммунных заболеваний. [88]. Вероятно, это связано с лимфопенией, возникающей с возрастом, что приводит к избыточной гомеостатической пролиферации лимфоцитов [89], а также к снижению регуляторной функции Т-клеток и уменьшению клиренса апоптотических клеток макрофагами [81].
Рак чаще всего встречается у пожилых людей; средний возраст для диагностики рака в промышленно развитых странах приближается к 70 годам. Основная причина, очевидно, в накоплении клеточных и генетических повреждений на протяжении всей жизни; однако, учитывая роль иммунного ответа в борьбе с раком, снижение иммунных функций у пожилых людей должно способствовать более высокому риску [90]. Это иммунное нарушение явно противоречит увеличению аутоиммунитета, поскольку противоопухолевые реакции могут быть направлены против самого себя; однако, вероятно, преобладает общий упадок иммунной системы, и опухоли больше не отторгаются столь же эффективно.Более того, усиление воспаления, обнаруживаемое с возрастом, способствует возникновению рака.
Повышенная заболеваемость из-за ослабления иммунной системы является прямым следствием нарушения регуляции адаптивного иммунитета у пожилых людей. Низкое количество наивных Т-лимфоцитов по сравнению с Т-клетками [41,42] является следствием сниженного выхода тимуса из инволютивного тимуса. Вследствие этой возрастной лимфопении Т-клетки пролиферируют и увеличивают объем «виртуальной памяти» [91], но в то же время способность устанавливать иммунологическую память в ответ на антигены de novo снижается, что ставит под угрозу вакцинацию.Нарушаются такие функции, как продукция цитокинов Т-клетками CD4 и CD8, изменяется экспрессия ключевых поверхностных маркеров и инвертируется соотношение CD4 + к CD8 + Т-клеток [81]. Расширенные ответы Т-клеток, которые удерживают под контролем латентные вирусы, такие как ВЭБ и ЦМВ, сокращают пространство для CD8 + Т-клеток, специфичных для других потенциально летальных вирусов [92], усугубляемых сниженным выходом наивных Т-клеток тимуса.
Хотя количество периферических В-клеток не уменьшается с возрастом, состав этого компартмента меняется.Подобно Т-клеткам, наивные В-клетки заменяются клетками памяти, испытавшими антиген, некоторые из которых «истощены» (CD19 + IgD — CD27 — ), и они демонстрируют пониженное созревание аффинности и переключение изотипа [81 ].
В целом изменения в компартментах Т- и В-клеток препятствуют адекватному иммунному ответу на новые острые и латентные вирусные инфекции и вакцинации.
Врожденный иммунный ответ также снижается с возрастом. Наблюдаются изменения в количестве врожденных клеток со смещением гематопоэза в сторону миелоидных клонов [93,94].Старые нейтрофилы менее функциональны с пониженной фагоцитарной способностью и выработкой супероксида отчасти из-за пониженной экспрессии рецептора Fc γ [95]. Точно так же у стареющих макрофагов снижается респираторный выброс. Вместе с DC они обнаруживают сниженную фагоцитарную функцию и экспрессию HLA II [81]. Таким образом, иммунологическое «молчаливое» удаление апоптозных и возрастающих количеств стареющих клеток ставится под угрозу и может способствовать провоспалительному фенотипу. Действительно, когда у старых мышей искусственно удаляли стареющие клетки, животные жили дольше и были более здоровыми [96].
Возможно, наиболее важным изменением в стареющей врожденной иммунной системе является увеличение провоспалительных цитокинов IL-1β, IL-6, IL-18 и TNFα [97]. Возникающее в результате воспаление слабой степени, вероятно, способствует атеросклерозу, деменции и раку, неразрывно связывая воспаление и старение других тканей [84,98].
Клеточные и молекулярные основы иммунного старения еще недостаточно изучены. Три фенотипа характеризуют стареющие клетки: истощение теломер, сопровождающее каждый раунд пролиферации, ведущее к остановке деления клеток или «репликативному старению»; повышенная митохондриальная нагрузка / дисфункция и активные формы кислорода; и секреторный фенотип, связанный со старением (SASP), определяемый как секреция провоспалительных цитокинов, хемокинов и протеаз стареющими клетками [99].Хотя большинство данных было получено на фибробластах, стареющие иммунные клетки, вероятно, обладают схожими характеристиками. Эти свойства влияют на митотически активные клетки путем истощения или остановки деления (например, гемопоэтические стволовые клетки — HSC или Т-клетки), а также на постмитотические иммунные клетки, вызывая клеточную дисфункцию (например, нейтрофилов).
Истощение теломер является защитным механизмом против рака, так как каждый раунд пролиферации может вносить мутации [100]. Только эпителиальные лимфоциты и стволовые клетки, включая гемопоэтические (HSC), экспрессируют удлиняющий теломеры фермент теломеразу у взрослых [101], что требует тщательного баланса с риском рака.Как Т-клетки памяти, так и HSC обычно делятся редко, чтобы минимизировать истощение теломер, но надежно либо в ответ на инфекцию (лимфоциты памяти), либо для обновления тканей (стволовые клетки) на протяжении всей жизни. На конечной стадии стареющие CD27 — CD28 — Т-клетки имеют самые короткие теломеры и демонстрируют сниженную пролиферацию после активации, но тем не менее обладают мощными эффекторными функциями. Эти клетки накапливаются в пожилом возрасте и у пациентов с аутоиммунными заболеваниями и хроническими вирусными инфекциями [102].Вторая характеристика старых клеток — усиление митохондриальной дисфункции и, как следствие, окислительное повреждение белков и ДНК. Функция DC у старых мышей может быть восстановлена путем введения антиоксидантов [103]. Окислительный стресс вызывает разрывы ДНК и может быть причиной истирания теломер, которое связывает первые две причины старения. Накопление окислительного повреждения может быть связано со снижением лизосомальной функции и аутофагии [104]. Аутофагия, разрушающая объем цитоплазматического материала путем доставки его к лизосомам, снижается с возрастом, в том числе в человеческих CD8 + Т-клетках [105].Мыши без аутофагии в их кроветворной системе обнаруживают преждевременно состарившуюся кроветворную систему [106]. Отсутствие реакции Т-клеток памяти на вакцинацию против гриппа, наблюдаемую у пожилых людей, можно восстановить с помощью соединения, индуцирующего аутофагию [107]. Третьим более недавним дополнением к этим фундаментальным изменениям старых клеток является приобретение SASP, способствующего увеличению секреции провоспалительных цитокинов и воспалению слабой степени [99].
5. Эволюция иммунной системы человека
Будучи долгоживущими видами, люди развили механизмы врожденного иммунитета и иммунологической памяти, чтобы выжить при повторных инфекциях.Однако на протяжении жизни человека эти иммунные механизмы изменяются, сначала для адаптации к переходу от плода к младенцу, а затем для созревания и расширения во время роста, слегка изменяясь во время беременности и, наконец, уменьшаясь в процессе старения. Выход наивных лимфоидных клеток и способность формировать новую иммунологическую память становятся все менее важными, поскольку пожилой человек столкнется и установит банк памяти для многих патогенов в течение своей жизни. Существует вероятность того, что миелоидный сдвиг и повышенная секреция провоспалительных цитокинов во время старения важны для улучшения фагоцитоза увеличивающегося числа стареющих клеток, что поднимает вопрос о том, могут ли изменения в стареющей иммунной системе служить цели.
Иммунная система была в первую очередь сформирована эволюцией, чтобы эффективно реагировать на острые инфекции у молодых людей, адаптироваться к беременности и передавать защиту младенцам, а также адаптирована для борьбы со многими хроническими инфекциями, длящимися десятилетиями. Помимо борьбы с вирусами, бактериями, грибками и паразитами, иммунная система также берет на себя другие функции, такие как восстановление тканей, заживление ран, удаление мертвых и раковых клеток и формирование здоровой микробиоты кишечника. Предполагая отсутствие серьезного избирательного давления на людей старше репродуктивного возраста, нам, возможно, придется заплатить за генетические черты, выбранные для обеспечения приспособленности в раннем возрасте, за счет более позднего развития иммунологических фенотипов, таких как хроническое воспаление.Массовое старение и повышенная долговечность — это недавние явления, происходящие в оптимизированной среде. Как предположил Хейфлик [108], старение может быть артефактом цивилизации, и, следовательно, изменения в стареющей иммунной системе могут быть просто следствием эволюционного непредсказуемого воздействия антигена на протяжении всей жизни человека.
В некоторых аспектах иммунная система пожилого организма напоминает иммунную систему новорожденного, со сниженной антимикробной активностью нейтрофилов и макрофагов, сниженной презентацией антигена ДК и снижением киллинга NK, а также несколько нарушенными адаптивными ответами лимфоцитов.Таким образом, как очень молодая, так и старая иммунная система одинаково подвержены риску при борьбе с типичной вирусной инфекцией, такой как грипп, тогда как молодой (небеременный) взрослый организм, по-видимому, идеально подготовлен для этой задачи (). Эволюция иммунной системы внутри индивидуума, возможно, отражает центральную роль молодого взрослого человека в выживании вида благодаря его репродуктивному потенциалу.
Иммунная система (для родителей) — Nemours Kidshealth
Что такое иммунная система?
Иммунная система — это защита организма от инфекций.Иммунная система (ih-MYOON) атакует микробы и помогает нам оставаться здоровыми.
Какие части иммунной системы?
Многие клетки и органы работают вместе, чтобы защитить тело. Лейкоциты, также называемые лейкоцитами (LOO-kuh-sytes), играют важную роль в иммунной системе.
Некоторые типы белых кровяных телец, называемые фагоцитами (FAH-guh-sytes), поглощают вторгшиеся организмы. Другие, называемые лимфоцитами и (LIM-fuh-sytes), помогают организму запоминать захватчиков и уничтожать их.
Одним из типов фагоцитов является нейтрофил (NOO-truh-fil), который борется с бактериями. Если у кого-то может быть бактериальная инфекция, врачи могут назначить анализ крови, чтобы узнать, вызвало ли оно много нейтрофилов в организме. Другие типы фагоцитов выполняют свою работу, чтобы убедиться, что организм реагирует на захватчиков.
Двумя типами лимфоцитов являются B-лимфоциты и T-лимфоциты . Лимфоциты берут начало в костном мозге и либо остаются там и созревают в В-клетки, либо переходят в вилочковую железу для созревания в Т-клетки.В-лимфоциты похожи на военную разведывательную систему организма — они находят свои цели и посылают средства защиты, чтобы заблокировать их. Т-клетки похожи на солдат — они уничтожают захватчиков, которых обнаруживает система разведки.
Как работает иммунная система?
Когда организм ощущает чужеродные вещества (называемые антигенами), иммунная система распознает антигены и избавляется от них.
В-лимфоцитов запускаются, чтобы вырабатывать антитела (также называемые иммуноглобулинами ).Эти белки фиксируются на определенных антигенах. После того, как они вырабатываются, антитела обычно остаются в нашем организме на тот случай, если нам снова придется бороться с тем же микробом. Вот почему тот, кто заболевает какой-либо болезнью, например ветряной оспой, обычно не заболевает ею снова.
Таким же образом иммунизация (вакцина) предотвращает некоторые заболевания. Иммунизация вводит в организм антиген таким образом, чтобы никто не заболел. Но это позволяет организму вырабатывать антитела, которые защитят человека от будущих атак со стороны микробов.
Хотя антитела могут распознавать антиген и фиксироваться на нем, они не могут уничтожить его без посторонней помощи. Это работа Т-клеток . Они разрушают антигены, помеченные антителами или инфицированными или каким-либо образом измененными клетками. (Некоторые Т-клетки на самом деле называются «клетками-киллерами».) Т-клетки также помогают сигнализировать другим клеткам (например, фагоцитам), чтобы они выполняли свою работу.
Антитела также могут:
- нейтрализует токсины (ядовитые или повреждающие вещества), вырабатываемые различными организмами
- активирует группу белков под названием комплемент , которые являются частью иммунной системы.Комплемент помогает убивать бактерии, вирусы или инфицированные клетки.
Эти специализированные клетки и части иммунной системы обеспечивают защиту организма от болезней. Эта защита называется иммунитетом.
У людей есть три типа иммунитета — врожденный, адаптивный и пассивный:
- Врожденный иммунитет: Каждый человек рождается с врожденным (или естественным) иммунитетом, типом общей защиты. Например, кожа действует как барьер, препятствующий проникновению микробов в организм.И иммунная система распознает, когда определенные захватчики являются чужими и могут быть опасными.
- Адаптивный иммунитет: Адаптивный (или активный) иммунитет развивается на протяжении всей нашей жизни. У нас развивается адаптивный иммунитет, когда мы подвергаемся болезням или когда мы иммунизируемся против них вакцинами.
- Пассивный иммунитет: Пассивный иммунитет «заимствован» из другого источника и длится непродолжительное время. Например, антитела в материнском грудном молоке дают ребенку временный иммунитет к заболеваниям, которым подверглась мать.
Иммунной системе требуется время, чтобы развиться, и ей нужны вакцины. Своевременно получая все вакцины, рекомендованные вашему ребенку, вы можете помочь сохранить его здоровье, насколько это возможно.
Как иммунная система детей может избежать COVID
Дети редко проявляют симптомы COVID-19, даже если они инфицированы Фото: Thomas Lohnes / Getty
Дети младшего возраста составляют лишь небольшой процент заражений COVID-19 1 — тенденция, которая озадачила ученых.Теперь появляется все больше доказательств того, почему: детская иммунная система, кажется, лучше подготовлена к устранению SARS-CoV-2, чем у взрослых.
«Дети очень хорошо приспособлены к реакции — и очень хорошо оснащены, чтобы реагировать — на новые вирусы», — говорит Донна Фарбер, иммунолог из Колумбийского университета в Нью-Йорке. Даже если они инфицированы SARS-CoV-2, дети, скорее всего, будут иметь легкое или бессимптомное заболевание. 2 .
Еще один признак того, что реакция детей на вирус отличается от реакции взрослых, заключается в том, что у некоторых детей появляются симптомы COVID-19 и появляются антитела, специфичные к SARS-CoV-2, но никогда не дают положительных результатов на вирус при стандартном тесте ОТ-ПЦР.В одном исследовании у троих детей в возрасте до десяти лет из одной семьи развились антитела против SARS-CoV-2 3 — и у двоих из них даже наблюдались легкие симптомы, — но ни один из них не дал положительных результатов на ОТ-ПЦР, несмотря на то, что их тестировали 11 раз в течение 28 дней, в то время как в тесном контакте со своими родителями, у которых был положительный результат теста.
Быстрый ответ
Иммунная система этих детей видит вирус и «создает этот действительно быстрый и эффективный иммунный ответ, который отключает его, прежде чем он сможет воспроизвести до такой степени, что он окажется положительным на диагностическом тесте мазка», — говорит Мелани Ниланд, иммунолог, изучавший семью из Детского научно-исследовательского института Мердока в Мельбурне, Австралия.
Исследования показывают, что даже у детей, которые испытали тяжелое, но редкое осложнение, называемое мультисистемным воспалительным синдромом, в ответ на инфекцию SARS-CoV-2, частота положительных результатов ОТ-ПЦР составляет всего от 29% до 50% 4 , 5 , 6 .
Фарбер говорит, что типы антител, которые развиваются у детей, позволяют понять, что происходит. В исследовании 7 32 взрослых и 47 детей в возрасте 18 лет и младше она и ее коллеги обнаружили, что дети в основном вырабатывают антитела, нацеленные на спайковый белок SARS-CoV-2, который вирус использует для проникновения в клетки.Взрослые вырабатывали аналогичные антитела, но также вырабатывали антитела против белка нуклеокапсида, который необходим для репликации вируса. Фарбер говорит, что белок нуклеокапсида обычно выделяется в значительных количествах только тогда, когда вирус широко распространен в организме.
У детей не было антител, специфичных к нуклеокапсиду, что говорит о том, что они не страдают широко распространенной инфекцией, говорит Фарбер. По ее словам, детский иммунный ответ, похоже, способен уничтожить вирус до того, как он начнет реплицироваться в больших количествах.
Адаптивная и врожденная иммунная система
Фарбер предполагает, что причина, по которой дети могут нейтрализовать вирус, заключается в том, что их Т-клетки относительно наивны. Т-клетки являются частью адаптивной иммунной системы организма, которая учится распознавать патогены, с которыми сталкивается в течение всей жизни. Фарбер говорит, что, поскольку детские Т-клетки в основном необучены, они могут иметь большую способность реагировать на новые вирусы — явление, которое она изучает более подробно.
Но другие данные свидетельствуют о том, что ситуация не так проста: исследование 8 людей с COVID-19, в которое вошли 65 детей и молодых людей в возрасте до 24 лет, а также 60 взрослых, показало, что у взрослых был более сильный тестостерон. -клеточный ответ на вирус спайк белка, чем у детей и молодых людей.Но Фарбер говорит, что в исследовании измерялись ответы Т-клеток памяти, которые у детей гораздо менее развиты, чем наивная активность Т-клеток.
Способность детей нейтрализовать вирус также может быть связана с тем фактом, что у них сильный врожденный иммунный ответ с рождения, говорит Аласдер Манро, изучающий детские инфекционные заболевания в Университетской больнице Саутгемптона, Великобритания. «Было высказано предположение, что скорость и масштаб их врожденного иммунного ответа могут защищать от инициации инфекции», — говорит он.Но этот эффект трудно изучать, и возникает вопрос, почему он не наблюдается у других вирусов, которые могут вызывать тяжелые заболевания у детей, говорит он.
Прочие факторы
Дети также являются основным резервуаром сезонных коронавирусов, вызывающих простуду. Некоторые исследователи предположили, что антитела к этим коронавирусам могут обеспечивать некоторую защиту от SARS-CoV-2, но доказательства неоднозначны: 9 , 10 , говорит Манро.
Между тем, есть свидетельства того, что, когда дети подвергаются воздействию вируса, они получают меньшую дозу, чем взрослые, потому что их носы содержат меньше рецепторов ACE2 11 , которые вирус использует для получения доступа к клеткам.Это также может объяснить, почему COVID-19 менее распространен среди детей, чем среди взрослых, говорят исследователи.
Манро говорит, что маловероятно, что существует единственное объяснение того, почему COVID-19, по-видимому, меньше влияет на детей, чем на взрослых. «Биология редко бывает такой простой».
Симптомы и причины первичного иммунодефицита
Подробно
Мы понимаем, что вы можете узнать больше о ВЗОМТ вашего ребенка, чтобы подобрать наиболее подходящее лечение.На следующих страницах мы предоставили ответы на часто задаваемые вопросы, и наши специалисты могут полностью объяснить состояние вашего ребенка.
Что такое иммунная система?
Иммунная система обнаруживает и атакует инфекционные организмы, включая бактерии, вирусы и грибки. Иммунная система состоит из нескольких различных типов лейкоцитов. У каждого типа лейкоцитов есть особые функции. Например, нейтрофилы важны для борьбы с бактериями и грибками, тогда как лимфоциты обычно борются с вирусами.Некоторые Т-лимфоциты могут убивать другие клетки, инфицированные вирусом, а В-лимфоциты вырабатывают антитела, которые представляют собой белки, борющиеся с инфекцией. Обычно много разных типов белых кровяных телец работают вместе, чтобы бороться со всеми видами инфекций. Таким образом, иммунная система действительно является системой, и проблема в любой части системы может привести к тому, что незначительные инфекции станут серьезными.
Что такое первичный иммунодефицит?
Первичные иммунодефицитные расстройства (PIDD) — это группа наследственных состояний, влияющих на иммунную систему.С момента рождения иммунная система ребенка с PIDD не функционирует должным образом и не может бороться с инфекциями из-за проблем с лейкоцитами, такими как T-лимфоциты или B-лимфоциты. Из-за дефектной иммунной системы дети могут быстрее и на более длительное время болеть обычными детскими инфекциями. Эти дети также подвержены заражению от обычно безвредных организмов. Большинство PIDD не смертельны, но все же важно, чтобы они были диагностированы и вылечены на ранней стадии, чтобы они не стали опасными для жизни.
Существует более 180 известных типов PIDD. Некоторые дети с PIDD рождаются без определенных типов лейкоцитов. Например, у детей с тяжелым комбинированным иммунодефицитом отсутствуют Т-лимфоциты; у людей с синдромом Костманна нейтрофилов нет. У детей с другими заболеваниями, такими как синдром Вискотта-Олдрича, количество лимфоцитов нормальное, но их лимфоциты выполняют лишь частичную функцию.
Существует шесть основных типов PIDD в зависимости от того, какая часть иммунной системы поражена.
- Недостаток В-лимфоцитов (антител)
- Дефицит Т-лимфоцитов
- комбинированный дефицит В- и Т-клеток
- Дефекты фагоцитов
- дополнить недостатки
- Прочие формы и причины неизвестного происхождения
Дефицит В-клеток является наиболее распространенным типом PIDD
Что вызывает первичный иммунодефицит?
Приобретенный иммунодефицит возникает после инфекций или воздействия окружающей среды у людей, которые ранее были полностью здоровыми.PIDD присутствуют при рождении, хотя симптомы могут проявиться не раньше, чем в более зрелом возрасте, иногда даже в подростковом или взрослом возрасте. Таким образом, PIDD не вызваны воздействием окружающей среды, лекарствами, травмами, диетой или событиями, происходящими во время беременности.
PIDD — это генетические нарушения, а это означает, что каждая клетка в организме ребенка обычно несет дефектный или мутировавший ген, вызывающий заболевание. У некоторых детей с PIDD есть родственники с таким же заболеванием. Иногда родители ребенка несут ген, который подвергает будущих детей риску родиться с той же проблемой.В других случаях дефектный ген развился у ребенка спонтанно, и в этом случае будущие братья и сестры ребенка не подвергались риску.
Признаки и симптомыХотя генетический дефект, вызывающий PIDD, присутствует при рождении, у детей с PIDD симптомы могут не развиваться до тех пор, пока им не исполнится несколько месяцев. В некоторых случаях они диагностируются только в более позднем детстве или даже в зрелом возрасте. Поскольку PIDD влияют на иммунную систему, у детей с этими расстройствами развиваются частые, тяжелые или необычные инфекции.Часто простуда приводит к тяжелым бактериальным инфекциям, чаще всего к пневмонии, бронхиту, синуситу и ушным инфекциям (отиту).
Предупреждающие знаки о том, что у вашего ребенка может быть PID:
- инфекций
- 4 или более новых инфекции в год, включая инфекции кожи и слизистых оболочек глаз, рта и области гениталий
- инфекций требуют внутривенного введения антибиотиков
- 2 или более глубоких инфекции, таких как сепсис
- молочница стойкая (грибковое поражение ротовой полости)
- 2 или более серьезных инфекции носовых пазух в год
- Антибиотики практически не действуют в течение 2 и более месяцев
- 2 и более пневмонии в течение года
- видимых знаков
- экзема тяжелая
- серьезные кожные инфекции
- Неспособность расти и набирать вес в младенчестве
- Увеличенные лимфатические узлы
- тяжелые хронические проблемы с пищеварением, такие как спазмы и диарея
- внутренние знаки
- аутоиммунные заболевания, такие как волчанка, ревматоидный артрит или диабет 1 типа
- Воспаление и инфекция внутренних органов, например печени
- Увеличенная селезенка
- PIDD в семействе
Ребенок, у которого есть только один из этих симптомов или признаков, вряд ли болен ВЗОМТ.Но если у ребенка есть несколько из этих симптомов или повторные инфекции в течение короткого периода времени, у ребенка может быть ВЗОМТ.
FAQВ: Будет ли мой ребенок в порядке?
A: Большинство детей с PIDD живут активной жизнью. Иногда настолько, что об их состоянии не подозревают. Раннее выявление, диагностика и лечение имеют решающее значение для снижения риска хронических заболеваний, необратимого повреждения органов или даже смерти.
В: Мог ли я предотвратить заражение моего ребенка ВЗОМТ?
A: No.Пока что исследования показывают, что причиной ВЗОМТ является только генетика. При этом вы можете соблюдать надлежащую гигиену, обеспечивать здоровую диету, избегать контакта с инфекциями и принимать прописанные лекарства, чтобы инфекции не атаковали ослабленную иммунную систему вашего ребенка.
В: Может ли ПИДД проявиться в более позднем возрасте, даже если он передается по наследству?
A: Да. Существует форма PIDD, называемая общим вариабельным иммунодефицитом, симптомы которой могут проявиться в любой момент жизни, хотя для большинства людей она определяется генетически.
В: Может ли мой ребенок передать свой PIDD или заразиться PIDD?
A: Нет. PIDD является наследственным и генетическим. Таким образом, ваш ребенок не может заразиться или заразиться PIDD от контакта с другим человеком или его микробами. Однако, если у вашего ребенка есть PIDD, он может быть более уязвим для инфекций.
В: Есть ли лекарство?
A: Да. При трансплантации стволовых клеток используются стволовые клетки донора, обычно родителя или родственника, для построения нормально функционирующей иммунной системы.Донор обычно является родителем или родственником, поэтому антигены похожи, и организм пациента принимает стволовые клетки донора. Однако таким образом лечат только самые серьезные PIDD. Большинству детей с PIDD трансплантация стволовых клеток не требуется.
В: Есть ли другие методы лечения ВЗОМТ?
A: Да. Многие люди с PIDD, которым не требуется трансплантация стволовых клеток, получат заместительную терапию IgG. Это дает им антитела, которые они не могут вырабатывать сами.Многие пациенты также будут принимать различные виды антибиотиков и другие лекарства для предотвращения определенных типов инфекций.
Вопросы, которые следует задать врачу вашего ребенкаПосле того, как вашему ребенку поставят диагноз PIDD, вы можете почувствовать себя перегруженным информацией. Можно легко потерять из виду возникающие у вас вопросы.
Многие родители считают полезным записывать вопросы по мере их возникновения — таким образом, когда вы разговариваете с врачами вашего ребенка, вы можете быть уверены, что на все ваши вопросы будут даны ответы.Если ваш ребенок достаточно взрослый, вы можете предложить ему записать то, что он хочет, своему врачу.
Вот несколько вопросов для начала:
- Как лекарства или лечение PIDD повлияют на успеваемость моего ребенка?
- Как лекарства или лечение PIDD могут взаимодействовать с другими текущими схемами лечения моего ребенка?
- Потребуется ли изменить диету моего ребенка во время приема лекарств или лечения PIDD?
- Что я могу сделать, чтобы уменьшить вероятность заражения моего ребенка инфекциями?
- Как я могу предоставить своему ребенку инструменты, чтобы помочь самому себе, если меня там нет?
- Как их PIDD повлияет на их взрослую жизнь?
- Какие услуги поддержки доступны, чтобы помочь моему ребенку узнать о его PIDD?
- Какие шаги мне следует предпринять, если мой ребенок страдает тяжелой инфекцией?
- О каких еще состояниях могут свидетельствовать эти симптомы?
- Как я могу определить, является ли симптом ВЗОМТ, другим состоянием или, возможно, даже ВЗОМТ в сочетании с другим состоянием?
- Как я могу подготовить своего ребенка к любому тесту?
Помимо того, что вы готовы задавать вопросы, вы, возможно, захотите подготовиться и получить информацию, чтобы ответить на следующие вопросы вашего врача:
- Когда вы впервые заметили эти симптомы у своего ребенка?
- Какова частота этих симптомов?
- Какова обычная продолжительность этих симптомов?
- Какова частота заражения?
- Какова обычная продолжительность инфекции?
- Как ваш ребенок реагирует на антибиотики при инфекциях?
- Какая у вас была предыдущая схема приема антибиотиков для вашего ребенка?
- Есть ли в семейном анамнезе PIDD?
Как развивается иммунная система вашего ребенка
Иммунная система младенцев не так сильна, как у взрослых.Кормление грудью и вакцинация ребенка помогут защитить его от серьезного заболевания.
Что такое иммунная система?
Иммунная система — это сеть клеток и белков, которая защищает организм от инфекции.
Если бактерии, вирус или другое чужеродное вещество попадают в организм, белые кровяные тельца идентифицируют его и вырабатывают антитела и другие реакции на инфекцию. Они также «запоминают» атаку, чтобы в следующий раз легче с ней бороться.
Иммунная система ребенка на момент рождения еще не сформировалась.Он развивается на протяжении всей жизни, поскольку они подвергаются воздействию различных микробов, которые могут вызвать заболевание.
Иммунная система у младенцев
Антитела передаются от матери к ребенку через плаценту в течение третьего триместра (последние 3 месяца беременности). Это дает ребенку некоторую защиту при рождении. Тип и количество антител, передаваемых ребенку, зависит от уровня иммунитета матери.
Во время родов бактерии из влагалища матери передаются ребенку.Это помогает создать колонию бактерий в кишечнике, что способствует их иммунитету.
После рождения ребенок получает больше антител с молозивом и грудным молоком. Но иммунная система младенцев все еще не так сильна, как у взрослых. Недоношенные дети подвергаются большему риску заражения, потому что их иммунная система еще более незрелая и им не передалось столько антител от матерей.
Младенцы вырабатывают собственные антитела каждый раз, когда подвергаются воздействию вируса или микроба, но для полного развития этого иммунитета требуется время.
Пассивный иммунитет, переданный от матери при рождении, также длится недолго и начнет снижаться в первые несколько недель и месяцев после рождения.
Как укрепить иммунную систему вашего ребенка
Каждый раз, когда ваш ребенок заболевает, у него вырабатываются новые антитела, которые будут защищать его в будущем. А пока вы можете сделать несколько важных вещей, чтобы защитить своего ребенка.
Грудное вскармливание
Грудное молоко содержит множество элементов, которые поддерживают иммунную систему вашего ребенка.К ним относятся белки, жиры, сахара, антитела и пробиотики. Когда мать вступает в контакт с микробами, у нее вырабатываются антитела, которые помогают ей бороться с инфекцией. Они передаются ребенку с грудным молоком. Поскольку матери и младенцы обычно подвергаются воздействию схожих микробов, это означает, что ребенок находится под защитой.
Дети, находящиеся на грудном вскармливании, реже заражаются и поправляются быстрее, чем дети, находящиеся на искусственном вскармливании. Однако грудное вскармливание не может защитить вашего ребенка от серьезных, опасных для жизни инфекций, таких как полиомиелит, дифтерия или корь.Кроме того, для матерей, которые не могут кормить грудью или предпочитают не кормить грудью, детская смесь является здоровой альтернативой.
Вакцинация
Вакцинация детей — самый безопасный и эффективный способ защитить их от серьезных заболеваний.
Вакцинация вызывает иммунный ответ так же, как вирус или бактерии. Это означает, что если ваш ребенок столкнется с настоящим заболеванием в будущем, его иммунная система распознает микроб и отреагирует достаточно быстро, чтобы бороться с болезнью или предотвратить серьезные осложнения.
Беременным женщинам делают прививки от коклюша в третьем триместре, чтобы они передали иммунитет своим детям.
Вашему ребенку будут сделаны первые прививки при рождении, затем еще несколько прививок в 6 недель, 4 месяца и 6 месяцев и в течение первых нескольких лет жизни.
Диета и пищевые добавки
Прием антибиотиков может убить некоторые кишечные бактерии, важные для иммунитета. Пробиотики часто рекомендуются как способ повышения иммунитета младенцев после приема антибиотиков.Пробиотики безопасны для использования на поздних сроках беременности и после рождения ребенка. Однако данные о том, приносят ли они пользу детям или взрослым, неоднозначны. Поговорите со своим врачом, прежде чем рассматривать возможность давать ребенку пробиотики.
В большинстве случаев грудное молоко и смеси обеспечивают все необходимые вашему ребенку витамины и минералы. Дополнительные витаминные добавки младенцам не рекомендуются.
Когда ваш ребенок начинает есть твердую пищу, для поддержания здоровья иммунной системы будет достаточно разнообразных свежих продуктов, включая различные виды протертых овощей и фруктов.Постарайтесь продолжать грудное вскармливание, пока вы вводите твердую пищу.
Позвоните по телефону «Беременность, роды и рождение ребенка» по номеру 1800 882 436, чтобы поговорить с медсестрой по охране здоровья матери и ребенка.
Чего вы не знаете об иммунной системе ребенка и ее нарушениях
30. 12. 2016
Для начала немного теории
Вообще говоря, термин «иммунное расстройство» относится к аспектам нашей иммунной системы, которые защищают нас от чужеродных веществ, когда они попадают в наш организм, чтобы предотвратить болезнь.Однако иммунная система исключительно сложна. С одной стороны, это реакция организма на проникновение в наш организм микроорганизмов (микробов, бактерий и т. Д.). С другой стороны, стоит противоположность иммунитета, то есть аллергии, когда организм реагирует на антигены непропорционально и усиленно. К ним часто относятся триггеры, которые, как правило, не причинят нам вреда (пыль, пыльца и т. Д.). Другая крайность — аутоиммунитет, состояние, при котором мы реагируем на антигены нашего собственного тела, как если бы они были чужеродными веществами.
У очень маленьких детей тип рождения может повлиять на их иммунитет
У взрослых иммунная система полностью развита. Однако у детей он начинает развиваться только после рождения. Таким образом, новорожденных можно сравнить с чистым листом бумаги, на котором первые строки текста пишутся непосредственно при рождении, то есть при воздействии антигенов при прохождении через родовые пути и непосредственном их воздействии.
В первые месяцы жизни ребенок все еще защищен антителами, поступающими в его кровоснабжение от матери.Однако они постепенно исчезают, и ребенок начинает вырабатывать собственные антитела против отдельных антигенов после их воздействия. «Вот почему так важно, чтобы роды проходили естественным путем, когда стерильный пищеварительный тракт ребенка заселяется физиологической флорой матери во время путешествия по родовым путям. Это не относится к детям, рожденным с помощью кесарева сечения. Роды с помощью кесарева сечения — это растущая тенденция, при которой у нас рождается гораздо больше детей с помощью кесарева сечения, чем спонтанно.Это связано с тем, что колонизация их пищеварительного тракта не совсем физиологична. Кроме того, если ребенок не находится на грудном вскармливании, структура флоры отличается от тех детей, которые родились естественным путем », — поясняет опытный педиатр MUDr. . Петр Жачек.
Дети, рожденные через кесарево сечение и не вскармливаемые грудью, имеют бактериальную флору пищеварительного тракта, отличную от бифидогенной. Поэтому они могут оказаться в невыгодном положении с точки зрения дальнейшего развития иммунной системы, особенно когда это касается аллергии.Этот «дефицит» возникает из-за того, что в их пищеварительном тракте наблюдается задержка колонизации лактобактериями, которые уже должны присутствовать в нормальных условиях. Их так называемая бифидогенная флора часто несколько отличается от флоры других детей. «Дети, рожденные через кесарево сечение, имеют повышенную вероятность сенсибилизации к вдыхаемым антигенам и астме, чем дети, рожденные через влагалище. Риски еще больше увеличиваются в случаях, когда родители страдают аллергией », — добавляет MUDr.Жачек.
В период яслей часто требуется повышенная подверженность болезням
Посещение яслей — важная веха для ребенка по разным причинам. Это также важно с точки зрения развития иммунной системы. Переход от относительно изолированного окружения семьи к тому, что он подвергается воздействию коллектива людей, означает, что ребенок внезапно оказывается окруженным множеством новых источников инфекционных заболеваний, которым ребенок еще не подвергался.Поэтому часто это период времени, когда ребенок может чаще болеть. Однако это также зависит от того, насколько хорошо развита иммунная система ребенка. Если он уже хорошо развит, вероятность заражения намного ниже. Когда иммунная система ослаблена, ребенок более подвержен инфекциям и чаще болеет.
Положительная новость обо всем этом заключается в том, что благодаря различным заболеваниям иммунная система ребенка развивается лучше. «Иммунная система от природы достаточно сильна, чтобы гарантировать, что когда мы вступаем в контакт с вирусной, бактериальной или любой другой инфекцией, мы можем реагировать на нее, переносить болезнь, но не поддаваться ей.В результате мы будем невосприимчивы к нему. Повторное воздействие одной и той же антигенной структуры (например, ветряной оспы) приведет к тому, что болезнь не будет развиваться. Конечно, ситуация меняется, когда человек подвергается заболеванию с несколько измененной антигенной структурой — например, при гриппе, когда антигенный компонент меняется каждый год, а антиген вируса гриппа немного другой. Затем болезнь повторится снова. Это также происходит, и не только в детстве, с обычными бактериями, такими как стрептококки, которые вызывают частые заболевания », — поясняет MUDr.Петр Жачек.
Когда родителям следует уделять повышенное внимание?
В целом можно сказать, что иммунные нарушения приводят к повышенной восприимчивости к инфекциям, которые имеют тенденцию повторяться. Они, как правило, длятся долгое время, и пациенты, получающие лечение, плохо реагируют на лечение, что часто приводит к другим осложнениям. Ребенка с увеличенными аденоидами можно рассматривать как типичный пример, связанный с иммунными нарушениями. Однако «увеличенные аденоиды не являются иммунным заболеванием.Основная причина не в ослаблении иммунной системы, а в механической непроходимости носоглотки. Эта ситуация представляет собой питательную среду для бактерий, несущих с собой различные последствия », — поясняет педиатр Петр Жачек.
Хроническая, нелеченная или неправильно управляемая инфекция ослабляет иммунную систему, что приводит к общему ослаблению всего организма. «Я был бы определенно обеспокоен, если бы в течение 6 месяцев у ребенка было более шести острых инфекций, т.е.е. заболеть один раз в месяц на срок от недели до десяти дней. В таком случае я бы подумал о проведении иммунологических тестов. Было бы хорошо посетить педиатра, у которого было бы достаточно времени, чтобы посвятить его ребенку и родителям, разобраться в истории болезни ребенка и том, как развивалась болезнь. Также врач должен определить, регулярно ли ребенок ходит на профилактические осмотры, а в случае болезни — к врачу », — поясняет MUDr. Жачек. С помощью специализированных обследований можно определить причины частых заболеваний и назначить соответствующее лечение.
Как мы можем укрепить иммунную систему ребенка?
«Уровень иммунитета организма зависит от того, насколько ребенок упитан и закален, а также от окружающей среды, которой он / она подвергается — не загрязняется ли среда, курит ли семья и т. Д. Все это влияет на неспецифический иммунитет. Когда кто-то живет в сильно загрязненной окружающей среде, основная защита нарушается, и это еще больше облегчает проникновение бактерий и вирусов в организм.Общее ослабление, когда тело подвергается воздействию холода и недостаточно выносливо, позволяет легче заразиться. Затем мы пытаемся выяснить, есть ли в организме ослабленный специфический иммунитет, будь то противовирусный или связанный с антителами. Решение заключается в последующей поддержке и применении соответствующих лекарств », — утверждает педиатр Петр Жачек .


 Они участвуют как в механизмах гуморального (В-типа), так и клеточного (Т-типа) иммунитета, в том числе и в развитии аллергических реакций.
Они участвуют как в механизмах гуморального (В-типа), так и клеточного (Т-типа) иммунитета, в том числе и в развитии аллергических реакций.