Антимюллеров гормон что показывает: Анализ на АМГ (антимюллеров гормон) | Высокий и низкий АМГ
Анализ на антимюллеров гормон (АМГ)
Диагностическое направление
Оценка репродуктивного здоровья
Общая характеристика
АМГ – димерный гликопротеин, относится к семейству бета-трансформирующих факторов роста.У мужчин в процессе эмбрионального развития АМГ секретируется клетками Сертоли и отвечает за регрессию мюллеровых протоков.Секреция АМГ начинается сразу после дифференцировки гонад по мужскому типу на 7-8 неделе эмбрионального развития.До наступления половой зрелости АМГ продуцируется яичками, а затем его уровень постепенно снижается до постпубертатных значений. AMГ положительно коррелирует с концентрацией сперматозоидов и объемом спермы.У женщин АМГ продуцируется гранулезными клетками мелких растущих фолликулов яичников и коррелирует с числом антральных фолликулов и возрастом. Не обнаруживается у девочек до периода половой зрелости. После достижения пубертата уровень АМГ определяется в пределах референтных значений до периода пременопаузы, затем постепенно снижаясь.
Показания для назначения
1. У женщин: исследование овариального резерва в рамках диагностики причин овуляторной дисфункции, причин субфертильности и бесплодия. Дополнительное исследование при диагностике СПКЯ. Диагностика и контроль лечения гранулезоклеточных опухолей яичника. Диагностика преждевременной яичниковой недостаточности (первичной, ятрогенной). 2.
 Дифференциальная диагностика интерсексуальных состояний.
Дифференциальная диагностика интерсексуальных состояний.Маркер
Маркер овариального резерва у женщин репродуктивного периода и дисфункции гонад у мужчин в пубертате и репродуктивном возрасте.
Клиническая значимость
1. Важная составляющая большинства форм преждевременной яичниковой недостаточности.2. Оценка овариального резерва, как часть обследования при бесплодии.3. Прогноз эффективности стимуляции овуляции и синдрома гиперстимуляции яичников в циклах ЭКО.4. Дополнительный тест в диагностике СПКЯ (особенно, нормоандрогенных форм).5. Обследование детей при нарушении полового созревания, оценка функции яичек у младенцев и детей.6. Диагностика и мониторинг лечения пациенток с гранулезоклеточными опухолями яичников.7. Составляющая диагностики бесплодия у мужчин.
Состав показателей:
Антимюллеров гормон
Метод: Хемилюминесцентный иммуноанализДиапазон измерений: 0,02-24
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Условия доставки
Контейнер
Объем
Сыворотка
24 Час. при температуре от 2 до 25 градусов Цельсия
при температуре от 2 до 25 градусов Цельсия
Вакутейнер с разделительным гелем (ИФА)
Объем:
5.5 Миллилитров
Правила подготовки пациента
 Важно: Согласовать с врачом день прохождения исследования. Возможно: В течение рабочего дня отделения МЛ «ДІЛА».Перерыв не менее 6 часов после приема пищи (должна быть исключена жирная пища).
Важно: Согласовать с врачом день прохождения исследования. Возможно: В течение рабочего дня отделения МЛ «ДІЛА».Перерыв не менее 6 часов после приема пищи (должна быть исключена жирная пища).Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- (транзиторное) комбинированные гормональные контрацептивы, дефицит витамина Д
Интерпретация:
- СПКЯ, гранулезоклеточные опухоли яичников, присутствие тестикулярной ткани у детей с интерсексуальным половым развитием
- Снижение овариального резерва, ожирение в позднем репродуктивном возрасте, менопауза, преждевременная яичниковая недостаточность, дисгенезия гонад, анорхизм, преждевременное половое развитие у мальчиков, задержка полового развития у девочек.

ЗАГАДОЧНЫЙ АНТИМЮЛЛЕРОВ ГОРМОН. Почему так важен для женщины?
Когда самое подходящее время для беременности? Ведь к этому моменту хочется стабильного финансового и семенного положения, а время идет, и биологические часы не стоят на месте. Способность женщины к зачатию уменьшается с возрастом. Одним из показателей возможного бесплодия является уровень антимюллерова гормона. С репродуктологом клиники репродукции «Вита ЭКО» Еленой Голеневой разберемся, что это за гормон, когда необходимо контролировать уровень АМГ, какие нормы для него существуют.
Елена Михайловна, что это за гормон?
Антимюллеров гормон (АМГ) вырабатывается в яичниках и показывает их потенциал. Его количество позволяет довольно точно определить так называемый «овариальный резерв» – сколько фолликулов потенциально готовы к овуляции, а значит, – насколько велика вероятность зачатия. Также уровень АМГ является лабораторным показателем приближения менопаузы.
Также уровень АМГ является лабораторным показателем приближения менопаузы.
Когда следует контролировать уровень АМГ?
1. Всем женщинам после тридцати лет, даже если не планируется беременность.
2. Обязательно смотреть АМГ перед операциями на яичниках. При низком уровне необходимо проконсультироваться с репродуктологом, так как после хирургического вмешательства на яичниках АМГ может снижаться до критически низких цифр, что резко снижает шансы на наступление беременности.
В каких случаях еще необходим анализ на гормон?
Кроме определения фолликулярного запаса яичников, результат анализа может быть использован для других показаний:
• Прогнозы успеха для проведения ЭКО
• Точное назначение гормональной стимуляции для лечения бесплодия
• Снижение риска гиперстимуляции
• Диагностика преждевременного истощения яичников или раннего климакса
• Диагностика синдрома поликистозных яичников
Как правильно сдавать анализ?
Хотя уровень АМГ не зависит от фазы менструального цикла, обычно его сдают вместе с другими гормональными анализами, на 3-5 день цикла. Специальной подготовки перед сдачей крови на АМГ не требуется.
Специальной подготовки перед сдачей крови на АМГ не требуется.
Какая норма антимюллерова гормона у женщины?
Наиболее высокие показатели АМГ наблюдаются в репродуктивном периоде жизни женщины: 2 – 7 нг/мл. После 37 лет с уменьшением запаса фолликулов в яичнике уровень АМГ начинает снижаться. При показателях ниже единицы ЭКО за счет средств ОМС, скорее всего, пройти не получится, так как во время стимуляции яичников созревает меньше пяти фолликулов. Соответственно, шансы на наступление беременности снижаются. Низкий уровень АМГ – не приговор, а всего лишь повод обратиться к репродуктологу в ближайшее время.
Низкий уровень АМГ является косвенным признаком снижения качества яйцеклеток. Но, в большей степени, это зависит от возраста женщины. Гормон нельзя повысить лекарствами! Но можно подобрать индивидуальный протокол стимуляции яичников. При крайне низком уровне АМГ (менее 0,3 нг/мл) и неудачных попытках ЭКО с собственными яйцеклетками, есть вариант использования донорских клеток в дальнейших программах ЭКО.
Не теряйте драгоценное время! Запишитесь на прием к репродуктологу!
г. Вологда, ул. Герцена, д. 50
Звоните! (8172) 26-44-26
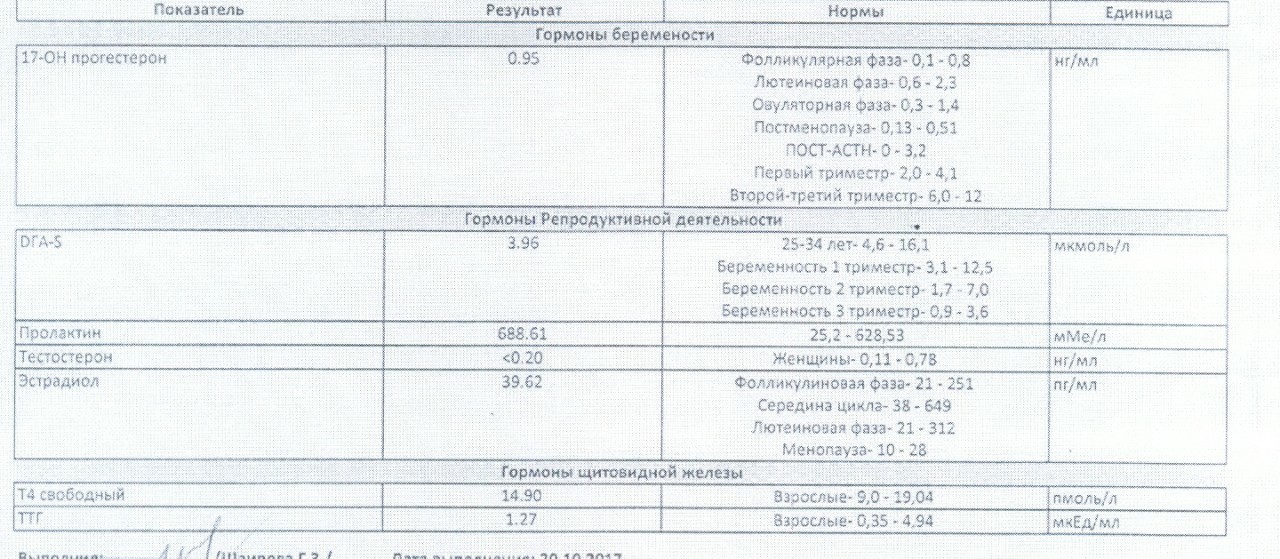
Оценка гормонального фона в Самаре
Один из важных этапов обследования женщины, столкнувшейся с бесплодием — оценка гормонального профиля.
В этой ситуации мы преследуем 2 цели:
- исключить\подтвердить — отсутствие овуляции как причину бесплодия,
- оценить уровень гормонов, влияющих на вынашивание беременности, здоровье малыша.
Ответить на первый вопрос помогает гормон прогестерон. Его уровень оценивается за 7 дней до предполагаемой менструации. О наличии овуляции говорит уровень прогестерона более 30 нмоль\л (9 нг\мл).
Со вторым пунктом сложнее — здесь объем обследования зависит от каждой конкретной ситуации.
Минимум — оценка функции щитовидной железы — уровень ТТГ, Т4 свободного, эти анализы рекомендованы всем женщинам, планирующим беременность. Это связано и с недостатком йода в ряде регионов России (в том числе и в Самаре) и с сильным влиянием работы щитовидной железы на беременность. Сдать на эти гормоны можно в любой день, утром.
Это связано и с недостатком йода в ряде регионов России (в том числе и в Самаре) и с сильным влиянием работы щитовидной железы на беременность. Сдать на эти гормоны можно в любой день, утром.
Пролактин
Часто назначаемый гормон — пролактин. Это один из самых капризных гормонов — его нужно сдавать строго утром в 8.00, с 1 по 7 дни менструального цикла, проснувшись за 3 часа до сдачи крови, не нервничая, исключив половую жизнь, раздражение груди за сутки до анализа. Рост этого гормона — одна из частых причин отсутствия овуляции. В норме он должен быть высоким только во время беременности и кормления грудью.
Мужские половые гормоны
При их избытке также подавляется овуляция. К мужским половым гормонам относятся 17-ОН прогестерон, ДЭАС и тестостерон (обычно назначается общий тестостерон и СССГ — секс-стероид связывающий глобулин — это позволяет рассчитать уровень свободного тестостерона). Их можно сдать с 1 по 10 дни менструального цикла, строго утром 8. 00.
00.
ЛГ и ФСГ
Гормоны — начальники яичников — ЛГ и ФСГ назначаются для оценки запаса яйцеклеток и правильности работы яичников. Их можно оценивать только до 4 дня менструального цикла.
АМГ
Последний годы активно назначается АМГ — антимюллеров гормон, этот гормон показывает наиболее точно запас яйцеклеток в яичниках. Раньше считалось, что его лучше оценивать с 1 по 3 день менструального цикла, сейчас доказано, что он не меняется в течение цикла — его можно сдавать в любое время.
Очень важно правильно сдавать кровь на гормоны, иначе мы рискуем получить неправильный результат, на который нельзя будет опираться.
Направления на все необходимые гормональные исследования Вы можете получить на приеме у врача. После получения результатов проводится интерпретация данных с оценкой овуляторного статуса и постановкой диагноза.
Овариальный резерв и аутоиммунные заболевания щитовидной железы | Григорян
Среди эндокринных расстройств у женщин репродуктивного возраста лидирует патология щитовидной железы. Субклинический гипотиреоз может приводить к нерегулярности менструального цикла, синдрому «хронической» ановуляции, ассоциации гипотиреоза с бесплодием, что свидетельствует о влиянии тиреоидного статуса на рост и созревание фолликулов [1]. Данное наблюдение привело к рекомендациям в назначении препаратов тироксина желающим забеременеть женщинам при уровне тиреотропного гормона (ТТГ) от 2,5 мкМЕ/мл и выше [2]. Однако результаты клинических исследований, касающихся данного вопроса, противоречивы. Так, исследование Reh и соавт. показало отсутствие различий в частоте наступления беременности и родов в программах экстракорпорального оплодотворения (ЭКО) при выборе порогового значения ТТГ 2,5 или 4,5 мкМЕ/мл [3], в другом исследовании уровень ТТГ менее 2,5 мкМЕ/мл и уровень антимюллерова гормона (АМГ) более 1,4 нг/мл оказались независимыми предикторами достижения успешной беременности с родами при необъяснимом бесплодии [4]. Выявлена взаимосвязь между наличием аутоиммунной патологии щитовидной железы и снижением фертильности даже при нормальном уровне ТТГ [5, 6, 7], однако результаты также противоречивы.
Субклинический гипотиреоз может приводить к нерегулярности менструального цикла, синдрому «хронической» ановуляции, ассоциации гипотиреоза с бесплодием, что свидетельствует о влиянии тиреоидного статуса на рост и созревание фолликулов [1]. Данное наблюдение привело к рекомендациям в назначении препаратов тироксина желающим забеременеть женщинам при уровне тиреотропного гормона (ТТГ) от 2,5 мкМЕ/мл и выше [2]. Однако результаты клинических исследований, касающихся данного вопроса, противоречивы. Так, исследование Reh и соавт. показало отсутствие различий в частоте наступления беременности и родов в программах экстракорпорального оплодотворения (ЭКО) при выборе порогового значения ТТГ 2,5 или 4,5 мкМЕ/мл [3], в другом исследовании уровень ТТГ менее 2,5 мкМЕ/мл и уровень антимюллерова гормона (АМГ) более 1,4 нг/мл оказались независимыми предикторами достижения успешной беременности с родами при необъяснимом бесплодии [4]. Выявлена взаимосвязь между наличием аутоиммунной патологии щитовидной железы и снижением фертильности даже при нормальном уровне ТТГ [5, 6, 7], однако результаты также противоречивы.
Целью настоящего обзора, выполненного в рамках гранта РНФ № 17-75-30035, является систематизация современной информации о влиянии аутоиммунной патологии щитовидной железы на репродуктивную функцию женщин. Для понимания методологических подходов к изучению указанной проблемы необходимо коротко остановиться на основных понятиях репродуктивной медицины.
Под овариальным резервом понимают функциональный резерв яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой и адекватному ответу на овариальную стимуляцию. Овариальный резерв отражает количество находящихся в яичниках фолликулов (примордиальный пул и растущие фолликулы) и зависит от физиологических и патофизиологических факторов. Подавляющее большинство показателей овариального резерва характеризует гормонзависимую стадию роста фолликулов. К ним относятся определение базальных уровней фолликулостимулирующего гормона (ФСГ), ингибина В, эстрадиола, лютеинизирующего гормона (ЛГ), а также ультразвуковое определение числа антральных фолликулов и объема яичников [8]. Однако в последние годы в результате целого ряда исследований установлено, что наиболее чувствительным маркером овариального резерва является сывороточный уровень АМГ, продуцируемого клетками гранулезы фолликулов от преантральных стадий созревания до стадии больших антральных фолликулов [8, 9]. Овариальный резерв наряду с возрастом пациентки, видом протокола контролируемой гиперстимуляции яичников и дозой гонадотропина является одним из важнейших факторов, оказывающих влияние на успех вспомогательных репродуктивных технологий.
Однако в последние годы в результате целого ряда исследований установлено, что наиболее чувствительным маркером овариального резерва является сывороточный уровень АМГ, продуцируемого клетками гранулезы фолликулов от преантральных стадий созревания до стадии больших антральных фолликулов [8, 9]. Овариальный резерв наряду с возрастом пациентки, видом протокола контролируемой гиперстимуляции яичников и дозой гонадотропина является одним из важнейших факторов, оказывающих влияние на успех вспомогательных репродуктивных технологий.
Одно из первых исследований, посвященных оценке связи наличия аутоиммунных антител и фертильности, провели Wilson C. и соавт. в 1975 г. [10]. Авторы показали отсутствие зависимости между наличием антитиреиодных антител (АТА) и репродуктивной функцией. Однако спустя 20 лет, в исследовании Roussev R.G. и соавт. [11] частота выявления АТА у больных с бесплодием оказалась равна 8% против 0% в группе контроля.
В 1997 г. Geva E. и соавт. [12] провели исследование, в которое включили 40 больных с идиопатическим (необъяснимым) бесплодием, 40 пациенток с бесплодием вследствие обструкции маточных труб и 40 здоровых, ранее не рожавших женщин. Оценивали уровни АТА к микросомальной фракции тироцитов и к тиреоглобулину (АТ-ТГ). Частота выявления АТА составила 20% в группе идиопатического бесплодия, 17,5% – в группе с патологией маточных труб и только 5% в группе здоровых добровольцев (p<0,05 при сравнении по данному параметру между здоровыми женщинами и обеими группами больных бесплодием).
Оценивали уровни АТА к микросомальной фракции тироцитов и к тиреоглобулину (АТ-ТГ). Частота выявления АТА составила 20% в группе идиопатического бесплодия, 17,5% – в группе с патологией маточных труб и только 5% в группе здоровых добровольцев (p<0,05 при сравнении по данному параметру между здоровыми женщинами и обеими группами больных бесплодием).
В дальнейшем такая корреляция была подтверждена: в одном ретроспективном исследовании частота выявления ATA у больных, вошедших в программы ВРТ, составила 19% против 15% в группе контроля [13], в другом исследовании частота выявления аутоантител (включая антитела к тиреопероксидазе (АТ-ТПО) и АТ-ТГ) также оказалась выше в группе больных с бесплодием. В то же время в исследовании 2001 г. Reimand K. и соавт. [14] показали отсутствие различий в частоте выявления АТА в группе женщин с бесплодием и в группе контроля.
В нескольких исследованиях показана ассоциация между выявлением АТА и специфическими причинами бесплодия. Так, Poppee K. и соавт. [15] провели проспективное исследование с участием 438 женщин (средний возраст 32±5 лет) с бесплодием различной этиологии и 100 здоровых женщин, сопоставимых по возрасту. Целью исследования явилось сравнение распространенности аутоиммунных заболеваний щитовидной железы и латентных нарушений ее функции. В 45% случаев основной причиной бесплодия являлась патология у партнерши, из них 11% – эндометриоз, 30% – заболевания маточных труб и 59% – овариальная дисфункция. Мужской фактор имел место в 38% случаев, идиопатическое бесплодие – в 17%. В целом средний уровень ТТГ оказался достоверно выше в группе женщин с бесплодием по сравнению со здоровыми женщинами (1,3 против 1,2 мМЕ/л). Выходящий за нормальные пределы уровень ТТГ встречался в группах одинаково часто. АТ-ТПО чаще определялись у женщин из бесплодных пар, чем у здоровых (14% и 8% соответственно), однако различия не достигали статистической значимости. В то же время в парах с женским фактором бесплодия носительство АТА выявлялось гораздо чаще, чем в группе контроля: 18% против 8%, при этом наибольший процент позитивных по АТ-ТПО женщин наблюдался у больных эндометриозом с бесплодием.
и соавт. [15] провели проспективное исследование с участием 438 женщин (средний возраст 32±5 лет) с бесплодием различной этиологии и 100 здоровых женщин, сопоставимых по возрасту. Целью исследования явилось сравнение распространенности аутоиммунных заболеваний щитовидной железы и латентных нарушений ее функции. В 45% случаев основной причиной бесплодия являлась патология у партнерши, из них 11% – эндометриоз, 30% – заболевания маточных труб и 59% – овариальная дисфункция. Мужской фактор имел место в 38% случаев, идиопатическое бесплодие – в 17%. В целом средний уровень ТТГ оказался достоверно выше в группе женщин с бесплодием по сравнению со здоровыми женщинами (1,3 против 1,2 мМЕ/л). Выходящий за нормальные пределы уровень ТТГ встречался в группах одинаково часто. АТ-ТПО чаще определялись у женщин из бесплодных пар, чем у здоровых (14% и 8% соответственно), однако различия не достигали статистической значимости. В то же время в парах с женским фактором бесплодия носительство АТА выявлялось гораздо чаще, чем в группе контроля: 18% против 8%, при этом наибольший процент позитивных по АТ-ТПО женщин наблюдался у больных эндометриозом с бесплодием. В группе пар с бесплодием повышение уровня АТА сопровождалось значимо большей частотой выявления гипо- и гиперфункции щитовидной железы по сравнению с женщинами из той же группы, но с нормальным уровнем АТ-ТПО. Таким образом, в данном исследовании среди женщин с бесплодием значимо чаще встречалась аутоиммунная патология щитовидной железы, причем более всего указанная закономерность была характерна для больных эндометриозом. Аналогичные результаты получили Abalovich M. и соавт. [16] (частота выявления АТА в группе больных бесплодием с эндометриозом 25% против 14% в группе здоровых женщин). Есть также сообщения о большей частоте выявления АТА у больных бесплодием с синдромом поликистозных яичников (СПКЯ) [7, 17] и преждевременной недостаточностью яичников [16].
В группе пар с бесплодием повышение уровня АТА сопровождалось значимо большей частотой выявления гипо- и гиперфункции щитовидной железы по сравнению с женщинами из той же группы, но с нормальным уровнем АТ-ТПО. Таким образом, в данном исследовании среди женщин с бесплодием значимо чаще встречалась аутоиммунная патология щитовидной железы, причем более всего указанная закономерность была характерна для больных эндометриозом. Аналогичные результаты получили Abalovich M. и соавт. [16] (частота выявления АТА в группе больных бесплодием с эндометриозом 25% против 14% в группе здоровых женщин). Есть также сообщения о большей частоте выявления АТА у больных бесплодием с синдромом поликистозных яичников (СПКЯ) [7, 17] и преждевременной недостаточностью яичников [16].
В таблице 1 представлено сравнение частоты позитивности по АТА у больных бесплодием и у здоровых женщин.
Таблица 1. Сравнение частоты позитивности по АТА у больных бесплодием и у здоровых женщин.
Ссылка | Частота выявления АТА при бесплодии | Частота выявления АТА у здоровых женщин | Уровень значимости различий (p) |
Geva et al. | 20% (идиопатическое есплодие) 17,5% (трубное бесплодие) | 5% | <0,05 |
Poppee et al. [15] | 18% (при женском факторе бесплодия) | 8% | <0,05 |
Abalovich et al. [16] | 25% (бесплодие + эндометриоз) | 14% | <0,05 |
Grassi G. и соавт. [18] изучили уровень ТТГ, свободного тироксина, а также уровни антител к микросомам и антител к тиреоглобулину у 149 женщин с бесплодием. В случае отклонения каких-либо из изученных лабораторных параметров от нормы дополнительно проводили ультразвуковое исследование (УЗИ) щитовидной железы и определяли неспецифические аутоиммунные антитела. Несмотря на то что авторы обнаружили более высокую частоту выявления АТА у больных с бесплодием, само по себе наличие такого лабораторного феномена не влияло на вероятность наступления беременности.
Muller A.F. и соавт. [19] в исследовании с участием 173 женщин, которым проводилось ЭКО, определяли уровни АТ-ТПО и ТТГ. В рамках дополнительного исследования случай-контроль также измеряли уровни антикардиолипиновых антител. Целью исследования явилась оценка частоты выкидышей в зависимости от указанных выше параметров. У 54 из 173 женщин наступила беременность (31%), при этом частота достижения беременности у больных, позитивных по АТА, оказалась выше – 48% (12 из 25) против 28% (42 из 148). В группе позитивных по АТ-ТПО больных частота выкидышей составила 33% (4 из 12), в группе сравнения – 19% (8 из 42), однако различия не достигали статистической значимости. Наличие антикардиолипиновых антител в данном исследовании также не было связано с частотой выкидышей. Авторы пришли к выводу, что наличие АТА до беременности, во-первых, не уменьшает вероятность наступления беременности и, во-вторых, не связано с повышением риска выкидышей в программах ЭКО.
Kilic S. и соавт. [20] в исследовании с участием 69 женщин с идиопатическим бесплодием изучили исходы ЭКО, толщину эндометрия и эмбриологические параметры в зависимости от статуса по АТА. В исследование вошли женщины, сопоставимые по возрасту, индексу массы тела (ИМТ), базальному гормональному профилю и протоколу индукции овуляции. В зависимости от результатов тестирования на АТА были выделены три группы: негативные (n=31), позитивные (n=23), позитивные в медикаментозном эутиреозе (n=15). Различий между группами в количестве полученных и оплодотворенных яйцеклеток, толщине эндометрия, характеристиках эмбрионов выявлено не было. Однако частота достижения клинической беременности оказалась статистически значимо ниже в группе больных с наличием АТ-ТПО (p=0,024). В таблице 2 приведено сравнение частоты успешной беременности у больных бесплодием в зависимости от статуса по АТА.
В исследование вошли женщины, сопоставимые по возрасту, индексу массы тела (ИМТ), базальному гормональному профилю и протоколу индукции овуляции. В зависимости от результатов тестирования на АТА были выделены три группы: негативные (n=31), позитивные (n=23), позитивные в медикаментозном эутиреозе (n=15). Различий между группами в количестве полученных и оплодотворенных яйцеклеток, толщине эндометрия, характеристиках эмбрионов выявлено не было. Однако частота достижения клинической беременности оказалась статистически значимо ниже в группе больных с наличием АТ-ТПО (p=0,024). В таблице 2 приведено сравнение частоты успешной беременности у больных бесплодием в зависимости от статуса по АТА.
Таблица 2. Частота наступления беременности в программах ЭКО у больных бесплодием в зависимости от статуса по АТА
Ссылка | Позитивные по АТА | Негативные по АТА | Уровень значимости различий (p) |
Muller et al. | 48% | 28% | 0,05 |
Kilic et al. [20] | 13,3% (у больных с медикаментозно компенсированным гипотиреозом) 30,4% (у больных с эутиреозом) | 41,9% | 0,24 (при сравнении групп негативных по АТА и позитивных по АТА) |
Несмотря на более чем 40-летнюю историю изучения связи аутоиммунных заболеваний щитовидной железы и фертильности, интерес к этой проблеме не уменьшается до сих пор. В последние годы проведено несколько хорошо спланированных исследований, призванных с учетом доступных на данном этапе развития медицинской науки методов исследования, включая изучение высокочувствительных биомаркеров, установить влияние статуса по АТА на овариальный резерв.
Целью исследования В.А. Гурьевойи соавт. [21] явилось установление овариального резерва у женщин групп риска и значимости факторов, его определяющих. В исследование были включены 174 женщины репродуктивного возраста с нарушенной фертильной функцией, которые составили основную группу, в группу сравнения вошли 30 женщин с ненарушенной репродукцией. На этапе отбора женщины были рандомизированы по возрасту, социальному статусу, роду занятий, месту проживания, соматической и гинекологической патологии. Оценку состояния овариального резерва у женщин сравниваемых групп проводили путем определения уровня половых гормонов в сыворотке крови (ФСГ, ЛГ, эстрадиола и АМГ), а также оценивали ультразвуковые параметры овариального резерва (объем яичников и количество антральных фолликулов). Для определения вероятного аутоиммунного повреждения яичников исследовались АТА. У 8,8% женщин с нарушенной репродукцией было выявлено повышение АТА, средние показатели которого составили 380±111,4 МЕ/мл. У 5,5% женщин со сниженным овариальным резервом был установлен диагноз аутоиммунный тиреоидит, эутиреоидный, и в 30,8% случаев – гипотиреоз.
На этапе отбора женщины были рандомизированы по возрасту, социальному статусу, роду занятий, месту проживания, соматической и гинекологической патологии. Оценку состояния овариального резерва у женщин сравниваемых групп проводили путем определения уровня половых гормонов в сыворотке крови (ФСГ, ЛГ, эстрадиола и АМГ), а также оценивали ультразвуковые параметры овариального резерва (объем яичников и количество антральных фолликулов). Для определения вероятного аутоиммунного повреждения яичников исследовались АТА. У 8,8% женщин с нарушенной репродукцией было выявлено повышение АТА, средние показатели которого составили 380±111,4 МЕ/мл. У 5,5% женщин со сниженным овариальным резервом был установлен диагноз аутоиммунный тиреоидит, эутиреоидный, и в 30,8% случаев – гипотиреоз.
Pirgon O. и соавт. (2016) [22] изучили овариальную функцию и овариальный резерв у девушек с впервые выявленным хроническим аутоиммунным тиреоидитом (тиреоидитом Хашимото) в состоянии эутиреоза. В исследование случай-контроль вошли 30 девушек (средний возраст 15,1±1,4 г) с высоким титром АТА и диффузной неоднородностью щитовидной железы по данным УЗИ и 30 здоровых сопоставимых по возрасту девушек.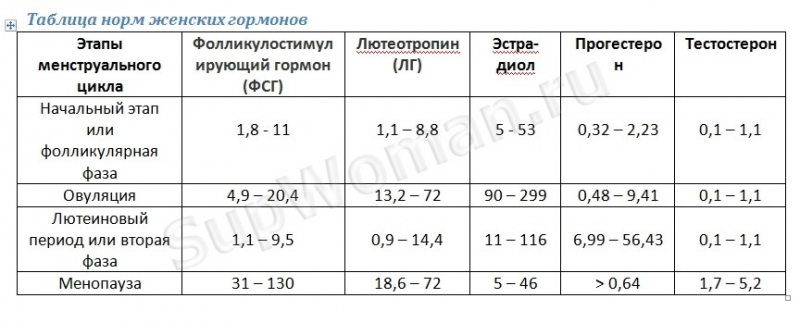 Оценивали такие параметры, как уровень антиовариальных антител (АОА), отношение уровней ЛГ к уровню ФСГ (ЛГ/ФСГ), уровни эстрадиола, АМГ, ингибина-В, общего тестостерона, количество антральных фолликулов, объем яичников и длину матки. Различий между группами по таким параметрам, как отношение ЛГ/ФСГ, уровень эстрадиола и ингибина В не было. В то же время уровни АОА, АМГ и тестостерона были достоверно выше в группе больных аутоиммунным тиреоидитом (p=0,02, p=0,07 и p=0,03 соответственно). У девушек с аутоиммунным тиреоидитом уровень АОА положительно коррелировал с отношением ЛГ/ФСГ (p=0,03), уровнями АМГ (p=0,01) и ингибина В (p<0,001). Авторы пришли к выводу, что по результатам всех проведенных тестов у девушек с хроническим аутоиммунным тиреоидитом сохраняется нормальный овариальный резерв. При этом повышение титра АОА, ассоциированное с повышением АТА, требует настороженности в отношении возможности развития преждевременной недостаточности яичников у этих девушек, что планируется оценить в отдаленной перспективе.
Оценивали такие параметры, как уровень антиовариальных антител (АОА), отношение уровней ЛГ к уровню ФСГ (ЛГ/ФСГ), уровни эстрадиола, АМГ, ингибина-В, общего тестостерона, количество антральных фолликулов, объем яичников и длину матки. Различий между группами по таким параметрам, как отношение ЛГ/ФСГ, уровень эстрадиола и ингибина В не было. В то же время уровни АОА, АМГ и тестостерона были достоверно выше в группе больных аутоиммунным тиреоидитом (p=0,02, p=0,07 и p=0,03 соответственно). У девушек с аутоиммунным тиреоидитом уровень АОА положительно коррелировал с отношением ЛГ/ФСГ (p=0,03), уровнями АМГ (p=0,01) и ингибина В (p<0,001). Авторы пришли к выводу, что по результатам всех проведенных тестов у девушек с хроническим аутоиммунным тиреоидитом сохраняется нормальный овариальный резерв. При этом повышение титра АОА, ассоциированное с повышением АТА, требует настороженности в отношении возможности развития преждевременной недостаточности яичников у этих девушек, что планируется оценить в отдаленной перспективе./22/22_2.jpg)
Tuten A. и соавт. [23] также изучили влияние статуса по АТА на овариальный резерв. В исследование включили 22 женщины репродуктивного возраста с аутоиммунным тиреоидитом Хашимото в стадии гипотиреоза, получавших терапию тироксином, группу контроля составили 49 здоровых женщин, сопоставимых по возрасту. Авторы показали, что овариальный резерв у больных аутоиммунным тиреоидитом не только не был снижен, но и превышал таковой у здоровых добровольцев (достоверно более высокий уровень АМГ), при этом количество антральных фолликулов у женщин двух групп было сопоставимо. Тем не менее авторы указывают, что АТА ассоциированы с развитием СПКЯ, с наличием которого в латентной стадии и может быть связано повышение уровня АМГ.
Magri F. и соавт. [24] провели крупное исследование с целью изучить зависимость между статусом по АТА и овариальным резервом. В исследование вошли 288 женщин моложе 40 лет с пониженной фертильностью в состоянии эутиреоза. Позитивными по АТА была 55 из них. До проведения контролируемой гиперстимуляции яичников измеряли сывороточные уровни АМГ, ФСГ, ЛГ, эстрадиола, ТТГ. Рассчитывали также отношение между сывороточной концентрацией эстрадиола (E2) в день извлечения яйцеклеток и общей введенной дозой рекомбинантного ФСГ (E2/рФСГ). Сывороточный уровень АМГ достоверно коррелировал со значением отношения E2/рФСГ, общей введенной дозой рФСГ и количеством зрелых (M II) яйцеклеток независимо от статуса по АТА. При низких значениях АМГ наличие АТА не оказывало дополнительного влияния на исходы контролируемой гиперстимуляции яичников, однако при высоких значениях АМГ наличие АТА оказывало существенное воздействие на отношение E2/рФСГ, общую дозу рФСГ и количество зрелых яйцеклеток. Авторы пришли к заключению, что при низком уровне АМГ отмечается плохой ответ на контролируемую гиперстимуляцию яичников независимо от наличия АТА, в то время как при высоком уровне АМГ, свидетельствующем о хорошем овариальном резерве, АТА ухудшают исходы контролируемой гиперстимуляции яичников.
Рассчитывали также отношение между сывороточной концентрацией эстрадиола (E2) в день извлечения яйцеклеток и общей введенной дозой рекомбинантного ФСГ (E2/рФСГ). Сывороточный уровень АМГ достоверно коррелировал со значением отношения E2/рФСГ, общей введенной дозой рФСГ и количеством зрелых (M II) яйцеклеток независимо от статуса по АТА. При низких значениях АМГ наличие АТА не оказывало дополнительного влияния на исходы контролируемой гиперстимуляции яичников, однако при высоких значениях АМГ наличие АТА оказывало существенное воздействие на отношение E2/рФСГ, общую дозу рФСГ и количество зрелых яйцеклеток. Авторы пришли к заключению, что при низком уровне АМГ отмечается плохой ответ на контролируемую гиперстимуляцию яичников независимо от наличия АТА, в то время как при высоком уровне АМГ, свидетельствующем о хорошем овариальном резерве, АТА ухудшают исходы контролируемой гиперстимуляции яичников.
Крупное поперечное ретроспективное исследование N.P. Polyzos и соавт. [25] также посвящено изучению вопроса, приводят ли аутоиммунные заболевания щитовидной железы к снижению овариального резерва. Информация из карт 4894 женщин была взята из архива центра репродуктивной медицины университетской больницы Брюсселя. Оценивали влияние уровней АМГ, свободного тироксина, ТТГ и АТ-ТПО на исход. Судя по уровню АМГ, у 3929 пациенток отмечался нормальный овариальный резерв, сниженный – у 487 и высокий – у 478. Уровни ТТГ и свободного тироксина не различались между группами с разным овариальным резервом. Частота выявления АТ-ТПО среди женщин с низким, нормальным и высоким уровнями АМГ также не различалась (12,1%, 10,3% и 9,8% соответственно, p=0,423). Субклинический или скрытый гипотиреоз также выявлялся с одинаковой частотой в разных группах. При этом у больных с генетическими причинами сниженного овариального резерва частота латентного или субклинического гипотиреоза была достоверно выше, чем в группе с необъяснимым снижением (25% против 3,2%, p=0,002, и 18,8% против 1,6%, p=0,004). При этом гипотиреоз встречался одинаково часто при снижении овариального резерва разной этиологии.
Информация из карт 4894 женщин была взята из архива центра репродуктивной медицины университетской больницы Брюсселя. Оценивали влияние уровней АМГ, свободного тироксина, ТТГ и АТ-ТПО на исход. Судя по уровню АМГ, у 3929 пациенток отмечался нормальный овариальный резерв, сниженный – у 487 и высокий – у 478. Уровни ТТГ и свободного тироксина не различались между группами с разным овариальным резервом. Частота выявления АТ-ТПО среди женщин с низким, нормальным и высоким уровнями АМГ также не различалась (12,1%, 10,3% и 9,8% соответственно, p=0,423). Субклинический или скрытый гипотиреоз также выявлялся с одинаковой частотой в разных группах. При этом у больных с генетическими причинами сниженного овариального резерва частота латентного или субклинического гипотиреоза была достоверно выше, чем в группе с необъяснимым снижением (25% против 3,2%, p=0,002, и 18,8% против 1,6%, p=0,004). При этом гипотиреоз встречался одинаково часто при снижении овариального резерва разной этиологии.
В то же время Saglam F. и соавт. [26] пришли к противоположному результату. В исследование включали женщин репродуктивного возраста (моложе 40 лет), 85 с наличием АТА и 80 здоровых добровольцев. Подробно изучали репродуктивный анамнез (количество беременностей, их исходы), а также в фолликулярную фазу проводили измерение уровней гонадотропинов, стероидов, АМГ и ингибина В. Количество беременностей и живорождений было меньше в группе женщин с аутоиммунными заболеваниями щитовидной железы (p<0,01). Различий в уровнях ФСГ, эстрадиола или ингибина В не было. Однако уровень АМГ оказался достоверно ниже у больных с носительством АТА по сравнению с контролем (1,16±0,17 против 1,28±0,25 нг/мл, p=0,001). Даже после поправки на возраст наличие АТА значимо и независимо определяло более низкий уровень АМГ (множественный регрессионный анализ, t=2,674, p=0,008). Авторы пришли к заключению, что, по всей видимости, аутоиммунные заболевания щитовидной железы предопределяют снижение овариального резерва. Ayesha и соавт. [27] показали, что аутоиммунные заболевания щитовидной железы – наиболее частая аутоиммунная патология у больных с преждевременной недостаточностью яичников.
и соавт. [26] пришли к противоположному результату. В исследование включали женщин репродуктивного возраста (моложе 40 лет), 85 с наличием АТА и 80 здоровых добровольцев. Подробно изучали репродуктивный анамнез (количество беременностей, их исходы), а также в фолликулярную фазу проводили измерение уровней гонадотропинов, стероидов, АМГ и ингибина В. Количество беременностей и живорождений было меньше в группе женщин с аутоиммунными заболеваниями щитовидной железы (p<0,01). Различий в уровнях ФСГ, эстрадиола или ингибина В не было. Однако уровень АМГ оказался достоверно ниже у больных с носительством АТА по сравнению с контролем (1,16±0,17 против 1,28±0,25 нг/мл, p=0,001). Даже после поправки на возраст наличие АТА значимо и независимо определяло более низкий уровень АМГ (множественный регрессионный анализ, t=2,674, p=0,008). Авторы пришли к заключению, что, по всей видимости, аутоиммунные заболевания щитовидной железы предопределяют снижение овариального резерва. Ayesha и соавт. [27] показали, что аутоиммунные заболевания щитовидной железы – наиболее частая аутоиммунная патология у больных с преждевременной недостаточностью яичников.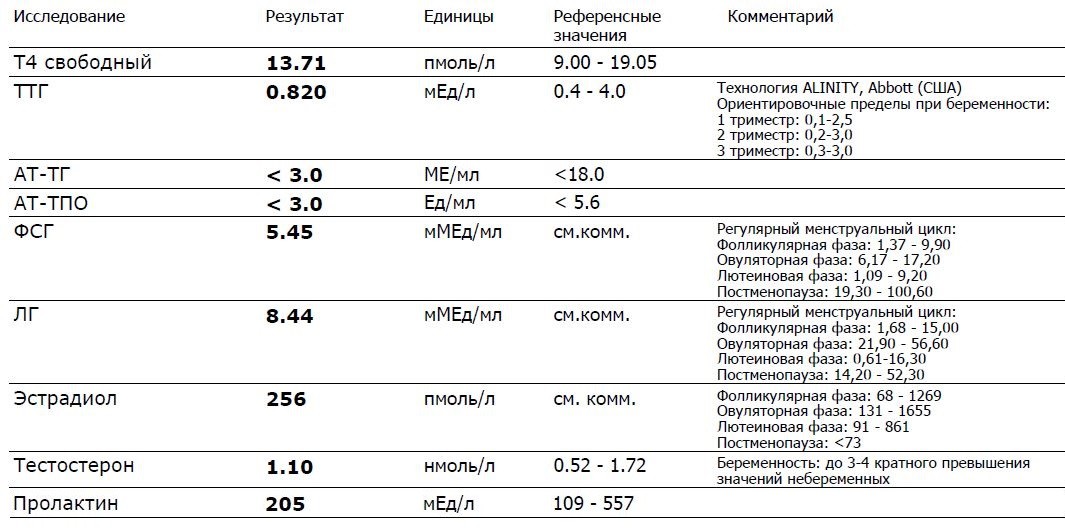
Weghofer A. и соавт. [28] решили выяснить, что же на самом деле влияет на овариальный резерв: сниженная функция щитовидной железы или ее аутоиммунная патология. В исследование включили 225 больных бесплодием женщин, средний возраст 38,4±5 лет. За нормальный уровень ТТГ приняли интервал от 0,4 до 4,5 мкМЕ/мл и оценили уровень АМГ в зависимости от уровня ТТГ менее 3 или от 3 и более мкМЕ/мл. Также определяли уровень АТА: АТ-ТПО, АТ-ТГ и антитела к тиреоидным рецепторам. Средний уровень АМГ составил 1,3±2,0 нг/мл, средний уровень ТТГ 1,8±0,9 мкЕД/мл. АТА были выявлены у 11,1% больных. У женщин с уровнем ТТГ менее 3 мкМЕ/мл уровень АМГ оказался достоверно выше, чем у больных с ТТГ ≥ 3 мкМЕ/мл (p=0,03). Это различие сохранялось после поправки на статус по АТА и возраст. По мнению авторов, их наблюдение подтверждает тот факт, что овариальный резерв зависит именно от функции щитовидной железы, а не от носительства АТА. В связи с этим они полагают, что с целью увеличения овариального резерва может быть целесообразно назначение тироксина больным с уровнем ТТГ ≥ 3 мкМЕ/мл.
Таким образом, литературные данные независимо от давности проведенных исследований и диагностических возможностей как для выявления аутоиммунной патологии щитовидной железы, так и для определения овариального резерва, противоречивы. В то же время очевидно, что даже выявление корреляции между носительством АТА и снижением параметров, характеризующих овариальный резерв, не доказывает причинно-следственных связей. Авторы, утверждающие существование такой связи, предлагают различные гипотезы патогенеза недостаточности яичников и патологии беременности при аутоиммунных заболеваниях щитовидной железы. Одно из объяснений – субклинический гипотиреоз или неспособность щитовидной железы адекватно ответить на запрос, возникающий при гиперстимуляции яичников или во время беременности [29, 30].
Интересная гипотеза на основании результатов собственного исследования высказана Monteleone P. и соавт. [31]. В проспективное наблюдательное исследование включили 31 пациентку с первичным бесплодием в связи с мужским или трубным фактором с базальным уровнем ФСГ на третий день менее 10 МЕ/л и хорошим ответом на контролируемую гиперстимуляцию яичников (более 3 фолликулов не менее 18 мм в конце цикла стимуляции).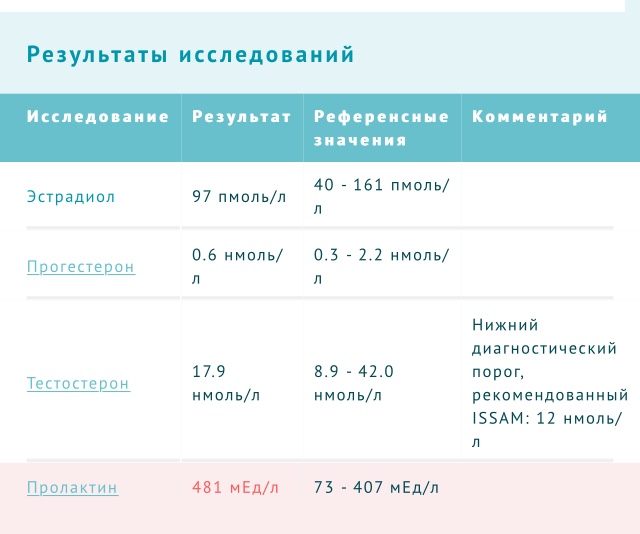 Определяли уровни АТА (АТ-ТГ, АТ-ТПО), по результатам больных разделили на две группы: позитивных по АТА (n=14) и негативных по АТА (n=17, группа контроля). В качестве критериев исключения выступали другие аутоиммунные заболевания, СПКЯ и эндометриоз. При выполнении процедур ВРТ в день извлечения яйцеклетки путем тонкоигольной аспирации отбирали образцы фолликулярной жидкости для анализа на уровень АТА. Оказалось, что у больных, позитивных по АТА, они определяются и в фолликулярной жидкости, причем уровень их составляет приблизительно половину от уровня в плазме крови. При этом наличие АТА ассоциировалось со снижением частоты успешного оплодотворения, получения эмбрионов класса А и наступления беременности, а также с увеличением частоты раннего невынашивания. По мнению авторов, АТА могут вызывать антителозависимую цитотоксичность в растущем фолликуле, повреждать созревающую яйцеклетку, снижая ее потенцию к дальнейшему развитию и последующей имплантации эмбриона.
Определяли уровни АТА (АТ-ТГ, АТ-ТПО), по результатам больных разделили на две группы: позитивных по АТА (n=14) и негативных по АТА (n=17, группа контроля). В качестве критериев исключения выступали другие аутоиммунные заболевания, СПКЯ и эндометриоз. При выполнении процедур ВРТ в день извлечения яйцеклетки путем тонкоигольной аспирации отбирали образцы фолликулярной жидкости для анализа на уровень АТА. Оказалось, что у больных, позитивных по АТА, они определяются и в фолликулярной жидкости, причем уровень их составляет приблизительно половину от уровня в плазме крови. При этом наличие АТА ассоциировалось со снижением частоты успешного оплодотворения, получения эмбрионов класса А и наступления беременности, а также с увеличением частоты раннего невынашивания. По мнению авторов, АТА могут вызывать антителозависимую цитотоксичность в растущем фолликуле, повреждать созревающую яйцеклетку, снижая ее потенцию к дальнейшему развитию и последующей имплантации эмбриона.
Есть и другие доказательства того, что АТА могут перекрестно реагировать с клетками яичника, в том числе с яйцеклетками. Так, Kelkar R.L. и соавт. [32] показали, что у 5 из 8 женщин с преждевременной недостаточностью яичников и наличием антител к прозрачной оболочке яйцеклетки (zona pellucida) выявлялись АТА, при этом антитела к прозрачной оболочке перекрестно реагировали с антигенами прозрачной оболочки яйцеклеток других видов (овцы, обезьяны, свиньи, мыши), а из других тканей у мышей имели сродство только к щитовидной железе. Следовательно, можно предположить и аффинность АТА к яйцеклеткам.
Так, Kelkar R.L. и соавт. [32] показали, что у 5 из 8 женщин с преждевременной недостаточностью яичников и наличием антител к прозрачной оболочке яйцеклетки (zona pellucida) выявлялись АТА, при этом антитела к прозрачной оболочке перекрестно реагировали с антигенами прозрачной оболочки яйцеклеток других видов (овцы, обезьяны, свиньи, мыши), а из других тканей у мышей имели сродство только к щитовидной железе. Следовательно, можно предположить и аффинность АТА к яйцеклеткам.
ЗАКЛЮЧЕНИЕ
Таким образом, данные о влиянии носительства АТА на репродуктивную функцию женщин противоречивы, а целесообразность включения их в скрининговое обследование у женщин, получающих лечение в рамках программ ВРТ, дискутабельна. На данный момент нет единого подхода к интерпретации результатов такого тестирования и доказательных рекомендаций относительно изменений лечебной тактики в зависимости от статуса пациенток по АТА. Для ответа на эти вопросы необходимо проведение крупных, хорошо спланированных рандомизированных контролируемых клинических исследований, которые позволят выявить возможные патогенетические связи между снижением овариального резерва и наличием аутоиммунной патологии щитовидной железы, а также сформулировать рекомендации по персонифицированному лечению больных для улучшения репродуктивного здоровья.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках гранта Российского научного фонда «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация» (Грант РНФ № 17-75-30035).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
1. Poppe K, Velkeniers B. Female infertility and the thyroid. Best Pract Res Clin Endocrinol Metab. 2004;18(2):153-165. doi: 10.1016/j.beem.2004.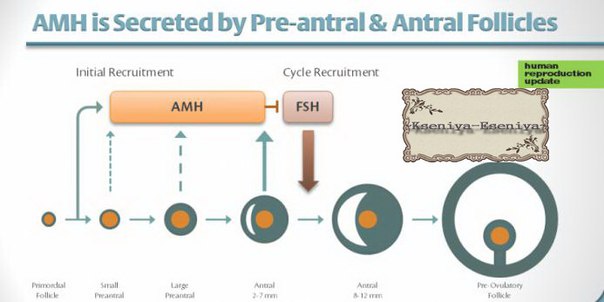 03.004
03.004
2. Mintziori G, Anagnostis P, Toulis KA, Goulis DG. Thyroid diseases and female reproduction. Minerva Med. 2012;103(1):47-62. PMID: 22278068
3. Reh A, Grifo J, Danoff A. What is a normal thyroid-stimulating hormone (TSH) level? Effects of stricter TSH thresholds on pregnancy outcomes after in vitro fertilization. Fertil Steril. 2010;94(7):2920-2922. doi: 10.1016/j.fertnstert.2010.06.041
4. Murto T, Bjuresten K, Landgren B-M, Stavreus-Evers A. Predictive value of hormonal parameters for live birth in women with unexplained infertility and male infertility. Reprod Biol Endocrinol. 2013;11(1):61. doi: 10.1186/1477-7827-11-61
5. Krassas GE, Perros P, Kaprara A. Thyroid autoimmunity, infertility and miscarriage. Expert Rev Endocrinol Metab. 2008;3(2):127-136. doi: 10.1586/17446651.3.2.127
Thyroid autoimmunity, infertility and miscarriage. Expert Rev Endocrinol Metab. 2008;3(2):127-136. doi: 10.1586/17446651.3.2.127
6. Geva E, Lessing JB, Lerner-Geva L, et al. The Presence of Antithyroid Antibodies in Euthyroid Patients With Unexplained Infertility and Tubal Obstruction. Am J Reprod Immunol. 1997;37(2):184-186. doi: 10.1111/j.1600-0897.1997.tb00210.x
7. Janssen O, Mehlmauer N, Hahn S, et al. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol. 2004;37(2):363-369. doi: 10.1530/eje.0.1500363
8. Боярский К.Ю., Гайдуков С.Н., Чинчаладзе А.С. Факторы, определяющие овариальный резерв женщины // Журнал акушерства и женских болезней. – 2009. – Т.58. – №2. – С.65-71. [Boyarsky CY, Gaidukov SN, Chinchaladze AS. Factors which can predict ovarian reserve. Journal of obstetrics and women’s diseases. 2009;58(2):65-71. (In Russ.)]
[Boyarsky CY, Gaidukov SN, Chinchaladze AS. Factors which can predict ovarian reserve. Journal of obstetrics and women’s diseases. 2009;58(2):65-71. (In Russ.)]
9. Jamil Z, Fatima SS, Ahmed K, Malik R. Anti-Mullerian Hormone: Above and Beyond Conventional Ovarian Reserve Markers. Dis Markers. 2016;2016(2):1-9. doi: 10.1155/2016/5246217
10. Wilson C, Elstein M, Eade O., Lloyd R, Wright R. SMOOTH-MUSCLE ANTIBODIES IN INFERTILITY. Lancet. 1975;306(7947):1238-1239. doi: 10.1016/S0140-6736(75)92074-7
11. Roussev RG, Kaider BD, Price DE, Coulam CB. Laboratory Evaluation of Women Experiencing Reproductive Failure. Am J Reprod Immunol. 1996;35(4):415-420. doi: 10.1111/j.1600-0897.1996.tb00503.x
12. Geva E, Lessing JB, Lerner-Geva L, et al. The Presence of Antithyroid Antibodies in Euthyroid Patients With Unexplained Infertility and Tubal Obstruction. Am J Reprod Immunol. 1997;37(2):184-186. doi: 10.1111/j.1600-0897.1997.tb00210.x
Geva E, Lessing JB, Lerner-Geva L, et al. The Presence of Antithyroid Antibodies in Euthyroid Patients With Unexplained Infertility and Tubal Obstruction. Am J Reprod Immunol. 1997;37(2):184-186. doi: 10.1111/j.1600-0897.1997.tb00210.x
13. Kutteh W. Increased prevalence of antithyroid antibodies identified in women with recurrent pregnancy loss but not in women undergoing assisted reproduction. Fertil Steril. 1999;71(5):843-848. doi: 10.1016/S0015-0282(99)00091-6
14. Reimand K, Talja I, Metsküla K, et al. Autoantibody studies of female patients with reproductive failure. J Reprod Immunol. 2001;51(2):167-176. doi: 10.1016/S0165-0378(01)00075-4
15. Poppe K, Glinoer D, Van Steirteghem A, et al. Thyroid Dysfunction and Autoimmunity in Infertile Women. Thyroid. 2002;12(11):997-1001. doi: 10.1089/105072502320908330
Thyroid. 2002;12(11):997-1001. doi: 10.1089/105072502320908330
16. Abalovich M, Mitelberg L, Allami C, et al. Subclinical hypothyroidism and thyroid autoimmunity in women with infertility. Gynecol Endocrinol. 2007;23(5):279-283. doi: 10.1080/09513590701259542
17. Kachuei M, Jafari F, Kachuei A, Keshteli AH. Prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Arch Gynecol Obstet. 2012;285(3):853-856. doi: 10.1007/s00404-011-2040-5
18. Grassi G, Balsamo A, Ansaldi C, et al. Thyroid autoimmunity and infertility. Gynecol Endocrinol. 2001;15(5):389-396. doi: 10.1080/713602919
19. Muller A, Verhoeff A, Mantel M, Berghout A. Thyroid autoimmunity and abortion: a prospective study in women undergoing in vitro fertilization. Fertil Steril. 1999;71(1):30-34. doi: 10.1016/S0015-0282(98)00394-X
Thyroid autoimmunity and abortion: a prospective study in women undergoing in vitro fertilization. Fertil Steril. 1999;71(1):30-34. doi: 10.1016/S0015-0282(98)00394-X
20. Kilic S, Tasdemir N, Yilmaz N, et al. The effect of anti-thyroid antibodies on endometrial volume, embryo grade and IVF outcome. Gynecol Endocrinol. 2008;24(11):649-655. doi: 10.1080/09513590802531112
21. Гурьева В.А., Куракина В.А. Оценка факторов, определяющих овариальный резерв у женщин с нарушенной репродуктивной функцией // Журнал акушерства и женских болезней. – 2012. – Т.61. – №6. – С.76-81. [Gur’eva VA, Kurakina VA. Evaluation factors, determining ovarian reserve in women with reproductive function disorders. Journal of obstetrics and women’s diseases. 2012;61(6):76-81. (In Russ.)]
22. Pirgon O, Sivrice C, Demirtas H, Dundar B. Assessment of ovarian reserve in euthyroid adolescents with Hashimoto thyroiditis. Gynecol Endocrinol. 2016;32(4):306-310. doi: 10.3109/09513590.2015.1116510
23. Tuten A, Hatipoglu E, Oncul M, et al. Evaluation of ovarian reserve in Hashimoto’s thyroiditis. Gynecol Endocrinol. 2014;30(10):708-711. doi: 10.3109/09513590.2014.926324
24. Magri F, Schena L, Capelli V, et al. Anti-Mullerian hormone as a predictor of ovarian reserve in ART protocols: the hidden role of thyroid autoimmunity. Reprod Biol Endocrinol. 2015;13(1):106. doi: 10.1186/s12958-015-0103-3
25. Polyzos NP, Sakkas E, Vaiarelli A, et al. Thyroid autoimmunity, hypothyroidism and ovarian reserve: a cross-sectional study of 5000 women based on age-specific AMH values. Hum Reprod. 2015;30(7):1690-1696. doi: 10.1093/humrep/dev089
26. Saglam F, Onal ED, Ersoy R, et al. Anti-Müllerian hormone as a marker of premature ovarian aging in autoimmune thyroid disease. Gynecol Endocrinol. 2015;31(2):165-168. doi: 10.3109/09513590.2014.973391
27. Ayesha, Jha V, Goswami D. Premature Ovarian Failure: An Association with Autoimmune Diseases. J Clin Diagn Res. 2016;10(10):10-12. doi: 10.7860/JCDR/2016/22027.8671
28. Weghofer A, Barad DH, Darmon S, et al. What affects functional ovarian reserve, thyroid function or thyroid autoimmunity? Reprod Biol Endocrinol. 2016;14(1):26. doi: 10.1186/s12958-016-0162-0
29. Poppe K, Glinoer D, Tournaye H, et al. Impact of Ovarian Hyperstimulation on Thyroid Function in Women with and without Thyroid Autoimmunity. J Clin Endocrinol Metab. 2004;89(8):3808-3812. doi: 10.1210/jc.2004-0105
30. Lazzarin N, Moretti C, De Felice G, et al. Further Evidence on the Role of Thyroid Autoimmunity in Women with Recurrent Miscarriage. Int J Endocrinol. 2012;2012(8):1-4. doi: 10.1155/2012/717185
31. Monteleone P, Parrini D, Faviana P, et al. Female Infertility Related to Thyroid Autoimmunity: The Ovarian Follicle Hypothesis. Am J Reprod Immunol. 2011;66(2):108-114. doi: 10.1111/j.1600-0897.2010.00961.x
32. Kelkar RL, Meherji PK, Kadam SS, et al. Circulating auto-antibodies against the zona pellucida and thyroid microsomal antigen in women with premature ovarian failure. J Reprod Immunol. 2005;66(1):53-67. doi: 10.1016/j.jri.2005.02.003
Гормоны крови
Гормоны — биологически активные вещества, которые вырабатываются железами внутренней секреции. Они регулируют все биохимические процессы в организме (рост, развитие, обмен веществ). В организме должен поддерживаться гормональный баланс. Анализ крови на гормоны помогает выявить нарушения подобного баланса, установить причины, назначить правильный курс лечения.
Лабораторные исследования крови на гормоны показывают состояние органов и систем организма:
-
Анализ на гормон ХГЧ (хронический гонадотропин человека), вырабатываемый клетками оболочки зародыша, позволяет выявить беременность уже на 6-10 день после оплодотворения.
При подготовке к беременности проверяют следующие гормоны:
- ФСГ (фолликулостимулирующий гормон) – отвечает за рост яйцеклетки (фолликула) у женщины. Входит в группу основных половых гормонов, регулирующих репродуктивную функцию у мужчин.
- ЛГ (лютеинизирующий гормон) – обеспечивает завершение созревания яйцеклетки в фолликуле и последующую овуляцию у женщин. Влияет на созревание сперматозоидов у мужчин.
- Пролактин – отвечает за стимуляцию лактации после родов. Во время беременности снижает выделение ФСГ. В отсутствие беременности повышенное количество пролактина может препятствовать зачатию.
- Эстрадиол– влияет на все половые органы женщины.
- Прогестерон – вырабатывается после созревания яйцеклетки. Без него оплодотворенная яйцеклетка не может прикрепиться к матке. Низкий показатель гормона может спровоцировать выкидыш.
- Тестостерон – мужской половой гормон. Его пониженные показатели приводят к снижению качества спермы. У женщин повышенное количество гормона может привести к выкидышу.
- ДЭА-сульфат – вырабатывается в организме женщины. Повышенная концентрация может привести к бесплодию.
- Т3 (трийодтиронин) свободный – стимулирует кислородный обмен в тканях.
- Т4 (тироксин) свободный – стимулирует синтез белков.
- Антитела к тиреоглобулину (АТ-ТГ) – важный параметр для выявления ряда аутоиммунных заболеваний.
Гормоны гипофиза:
- ТТГ (тиреотропный гормон) – стимулирует выработку гормонов щитовидной железы (Т3 и Т4). Повышенное значение ТТГ, как правило, свидетельствует о пониженной функции щитовидной железы.
- ФСГ (фолликулостимулирующий гормон). Нормальные значения у женщин зависят от фазы менструального цикла.
- ЛГ (лютеинизирующий гормон). Нормальные значения у женщин зависят от фазы менструального цикла.
-
Пролактин. Основная функция – стимулирование развитие молочных желез и лактации. Повышенная концентрация пролактина называется гиперпролактинемией. Различают физиологическую и патологическую гиперпролактинемию. Физиологическая гиепрпролактинемия может быть вызвана кормлением грудью, беременностью, сильными физическими нагрузками, стрессом. Повышенная концентрация пролактина у женщин приводит к нарушению менструального цикла, может быть причиной бесплодия. У мужчин гиперпролактинемия ведет к снижению полового влечения и импотенции.
- АКТГ (адренокортикотропный гормон) – стимулирует синтез и секрецию гормонов коры надпочечников.
Половые гормоны:
- Тестостерон (мужской половой гормон) – вырабатывается надпочечниками и в половых железах (у мужчин – в яичках, у женщин – в яичниках). Воздействует на развитие половых органов, формирование вторичных половых признаков, рост костей и мышц.
- Эстрогены (женские половые гормоны). Основные эстрогены – прогестерон и эстрадиол – вырабатываются надпочечниками и яичниками. Нормальные значения прогестерона у женщин зависят от фазы менструального цикла. Аналогично для эстрадиола. Повышенные значения эстрогенов могут указывать на опухоли яичников и коры надпочечников, а также цирроз печени. Пониженные – на недостаточное развитие и склероз яичников.
Гормоны надпочечников:
- ДЭА-с (дегидроэпиандростерона сульфат) – необходим для синтеза тестостерона и эстрогенов. При обработке данных анализа надо также учитывать возраст пациента.
- Кортизол – участвует во многих обменных процессах, активно вырабатывается в результате реакции организма на голод или стресс.
- Альдостерон – отвечает за регулирование водно-солевого баланса в организме.
Можно сдавать кровь в течение дня, не ранее, чем через 3 часа после приема пищи или утром натощак. Чистую воду можно пить в обычном режиме.
«Семейная клиника» является партнером Лаборатории KDL. У нас Вы можете сдать любой анализ, стоимость и рекомендации по подготовке можно уточнить по телефону (843) 202-40-11.
Главные женские гормоны для здоровья и красоты
Опубликовано: 27.11.2017 Обновлено: 09.03.2021 Просмотров: 273501
Гормональный дисбаланс может возникать по самым разным причинам: из-за стресса, нарушений иммунитета, хронических заболеваний и вирусных инфекций, длительного приема гормональных препаратов и даже недосыпания.
В каких случаях необходимо обязательно сдать кровь на лабораторные исследования? В первую очередь — при нерегулярном менструальном цикле, обильных менструациях или болевых ощущениях во время цикла, а также проблемах с зачатием. Ухудшение состояния кожи — прыщи, угри, снижение либидо — не менее весомые поводы обратиться в СИТИЛАБ для сдачи анализов.
ФСГ (фолликулостимулирующий гормон)
Вырабатывается в гипофизе, способствует образованию и созреванию яйцеклеток, влияет на формирование фолликула. Достижение максимального уровня ФСГ приводит к овуляции. Тест на уровень ФСГ — один из главных для выявления патологий репродуктивной системы у женщин.32-20-003 — Фолликулостимулирующий гормон
ЛГ (лютеинизирующий гормон)
Вырабатывается в гипофизе, стимулирует выработку прогестерона, обеспечивает овуляцию и образование желтого тела. Высокий уровень ЛГ свидетельствует о преждевременной менопаузе, гипофункции яичников.32-20-002 — Лютеинизирующий гормон
Прогестерон
Уникальный гормон женщин. Синтез прогестерона осуществляется в яичниках, коре надпочечников; желтым телом, плацентой во время беременности. Его главная задача — регуляция менструального цикла. Он подготавливает эндометрий к прикреплению яйцеклетки, сохранению беременности.32-20-005 — Прогестерон
Эстрадиол
Один из главных женских гормонов — гормон красоты. Под его влиянием формируются вторичные половые признаки, округлые формы фигуры, мягкий, бархатистый тембр голоса, нежная кожа также его заслуга. Участвует в регуляции менструального цикла, контролирует обменные процессы в костной ткани, поддерживает хорошее настроение и либидо.32-20-004 — Эстрадиол (Е2)
Тестостерон
Тестостерон играет важную роль для репродуктивного здоровья женщины, участвует в формировании фолликула яичника. Повышение уровня тестостерона может привести к нарушению менструального цикла, появлению волос на лице, акне, себорейному дерматиту.32-20-008 — Тестостерон
32-20-010 — Тестостерон свободный
Ингибин В
Маркер функции клеток Сертоли и экзокринной тестикулярной функции у мужчин (состояния сперматогенеза). У женщин ингибин В является основным показателем EFORT-теста (Exogenous FSH Ovarian Reserve Test) — тест на функциональный резерв яичников. Определяет выработку жизнестойких яйцеклеток. Является маркером опухоли яичников в период мено- и постменопаузы.32-20-006 — Ингибин В
Антимюллеров гормон
Маркер овариального резерва яичников, овариального старения, дисфункции и овариального ответа. Уровень этого гормона коррелирует с количеством антральных фолликулов, от количества которых зависят шансы на успех зачатия. Чаще всего гормон повышен при синдроме поликистозных яичников, бесплодии, опухолях яичника.32-20-007 — Антимюллеров гормон (AMH/MIS)
Пролактин
Гормон, вырабатываемый лактотрофами — клетками передней доли гипофиза. Пролактин играет исключительно важную роль во многих процессах, происходящих в организме, в частности — в обеспечении нормальной работы репродуктивной системы. Повышение уровня пролактина является одной из частых причин бесплодия и наиболее частой при гормональных формах бесплодия у женщин.32-20-001 — Пролактин
Тиреотропный гормон
Оказывает стимулирующее влияние на все этапы биосинтеза гормонов щитовидной железы, которые влияют на повышение утилизации углеводов, увеличение поглощения глюкозы мышцами, стимуляцию белкового синтеза, повышение расщепления жиров и окисление жирных кислот. Помогает поддерживать вес в норме и сохранять стройность. Нарушение функции щитовидной железы приводит к развитию симптомов, вызывающих нарушение обмена веществ, а также репродуктивной функции.31-20-001 — ТТГ (тиреотропный гормон)
Стоимость гормональные исследования крови в Липецке в лаборатории Здоровье Нации
Гормональные исследования – лабораторно-диагностическая группа исследований, которые направлены на изучение концентрации и определения в крови гормонов, вырабатываемые железами человека.
Гормональные исследования включают в себя большое количество анализов на определенный гормон или группу, которые вырабатываются той или иной железой. В результате исследования, по содержанию в крови гормона, можно определить общее состояние организма и отдельных органов.
Повышенный уровень гормона или его дефицит, приводит к серьезным патологическим изменениям и заболеваниям. Содержание гормона в крови зависит от пола пациента, возраста, состояния организма и времени сдачи. Соответственно сдача анализа на гормон должна быть в определенные часы и дни, которые сообщит врач. Для полноты картины состояния организма рекомендуется провести комплекс гормональных исследований.
Показания к сдаче анализов
Гормональный дисбаланс, на фоне изменения функционирования эндокринных желез, может проявляться повышенным артериальным давлением, отеками, вялостью, тахикардией, снижением или набором веса. Подобные симптомы свидетельствуют о необходимости записаться к эндокринологу и пройти гормональное обследование. Сделать это можно в клинике «Здоровье Нации». Кроме того, специалист поможет выяснить причину следующих признаков:
- затруднение дыхания, одышка;
- повышенная потливость рук и их тремор;
- рост волос на теле в местах, где их быть не должно;
- чрезмерное мочеотделение;
- мужское и женское бесплодие;
- частые переломы конечностей;
- выраженная раздражительность, плаксивость.
С профилактической целью гормональные исследования рекомендуется проводить подросткам, а также при наступлении менопаузы. В донный период эндокринная система подвержена высокой нагрузке.
Щитовидная железа вырабатывает гормоны ТТГ, Т4, Т3. Анализ Т4 может подтвердить наличие токсического зоба, поражение гипоталамо-гипофизарной области. Анализ ТТГ подтвердит заболевания, вызывающие деструкцию клеток органа.
При нарушении функционирования половых желез исследованию подлежат:
- дигидротестостерон;
- пролактин;
- тестостерон;
- эстрадиол;
- глобулин ГСПГ;
- фолликулостимулирующий гормон.
При заболеваниях гипофизарно-надпочечниковой системы в крови определяется концентрация следующих биологически активных веществ:
- альдостерон;
- инсульноподобный фактор роста;
- соматотропин;
- кортизол.
При бесплодии и при планирования беременности потребуется сдать кровь:
- За день до сдачи анализа рекомендовано исключить из рациона жирную и жареную пищу, алкоголь, не употреблять большое количество жидкости.
- Для предотвращения получения ложных результатов следует исключить прием витаминов содержащих в составе йод за 3-5 дней до проведения.
- Забор крови для анализа осуществляется из вены утром натощак. Предпочтительное время сдачи крови — до 10–10.30 часов утра.
- Перед сдачей анализа запрещен прием чая, кофе, соков и воды, а также исключить физические нагрузки и эмоциональное перевозбуждение.
- Рекомендовано не курить за 1 час до проведения теста на гормоны щитовидной железы.
- За 20 минут до взятия крови необходимо посидеть, отдохнуть, расслабиться.
- В разных лабораториях могут применяться разные методы и единицы измерения. Чтобы оценка результатов была корректной,- рекомендовано проходить исследования в одной и той же лаборатории в одно время. Сравнение таких результатов будет более сопоставимым.
Как подготовиться к сдаче анализов
- Забор крови для анализа осуществляется из вены утром натощак. Наилучшее время сдачи крови – до 10-10:30 часов утра.
- За 3-5 дней до проведения анализа, исключите витамины содержащие йод;
- За сутки до сдачи анализа, не ешьте жирную и жареную пищу, откажитесь от алкоголя, не употребляйте большое количество жидкости;
- За час перед сдачей крови откажитесь от курения;
О преимуществах обследования на гормоны в клинике «Здоровье Нации»
- В собственной лаборатории клиники представляется возможным сдать анализы на гормоны. При этом можно выбрать удобный день.
- С результатами можно ознакомиться за максимально короткие сроки.
- В одном учреждении представляется возможным пройти полную эндокринную диагностику.
- Лабораторные исследования проводятся с использованием качественных реактивов и современного оборудования, поэтому результаты отличаются высокой точностью.
С полученными результатами необходимо обратиться к эндокринологу медицинского центра «Здоровье Нации». Если будет обнаружены отклонения от нормальных значений, врач может назначить гормональное лечение, а также пройти обследование с использованием инструментальных методов. Повторная сдача анализов может потребоваться с целью оценки проведенного лечения.
Сдать анализы на гормоны в Липецке можно в лаборатории Здоровье Нации. Наша клиника предлагает широкий спектр исследований на гормоны.
Что на самом деле означает ваш уровень AMH
Что ваш уровень AMH может и не может сказать вам
Перво-наперво: давайте проясним любые заблуждения о том, что тест AMH является «Святым Граалем» тестом на фертильность. Это не так — это всего лишь одна часть данных из многих, которые врач будет использовать для оценки вашего репродуктивного здоровья. Ваш уровень AMH — это не показатель того, можете ли вы сейчас забеременеть. Прежде всего, ваш уровень AMH говорит вам только о том, сколько яиц у вас осталось, и ничего не говорит о качестве (или генетическом здоровье) этих яиц, что на самом деле гораздо важнее, когда дело доходит до беременности.Не существует теста на качество яиц, но оно предсказуемо ухудшается с возрастом. Узнать больше о Качество яиц .
УровеньAMH не может сказать нам, есть ли у вас миома, рубцы на матке или другое заболевание, которое может затруднить зачатие. Тест AMH также не может сказать нам, насколько быстро уменьшается количество яиц, поскольку это всего лишь снимок ваших уровней в определенный момент времени.
Узнайте больше о , что действительно может сказать нам анализ резерва яичников .
Но это не значит, что это бесполезно. Особенно низкий уровень АМГ для вашего возраста может указывать на возможность ранней менопаузы, в то время как аномально высокий уровень АМГ может указывать на синдром поликистозных яичников (СПКЯ), гормональный дисбаланс, который может затруднить беременность. А в мире замораживания яиц AMH предлагает нам одну важную информацию: сколько яиц вы можете заморозить за один цикл.
Понимание «среднего» AMH
Многие женщины хотят понять, выше или ниже средний их уровень АМГ.Когда дело доходит до AMH, что на самом деле «среднее»? Поскольку АМГ обычно тестируется только у женщин, которые обращаются к врачу после трудностей с зачатием, прошлые средние значения были основаны на популяции, в которую входят многие женщины с проблемами фертильности. Чтобы по-настоящему понять, в каком диапазоне спектра находится ваш уровень АМГ, вам нужно сравнить его с популяцией женщин, у которых нет известных проблем с фертильностью. Мы провели именно такое исследование через Центр исследований и образования в области фертильности (CFRE).
В нашем исследовании, представленном на Ежегодном собрании ACOG в начале этого месяца, мы рассмотрели результаты более 2600 тестов AMH среди женщин, не страдающих бесплодием, которые пришли в Extend Fertility для оценки фертильности. Как и ожидалось, АМГ был отрицательно связан с возрастом — это означает, что по мере увеличения возраста уровни АМГ, вообще говоря, снижались.
Средний уровень АМГ по возрасту:
Возраст | Медианные уровни АМГ |
До 30 лет | 2.91 |
30–34 | 2,42 |
35–37 | 2,03 |
38–40 | 1,50 |
41–42 | .92 |
Более 42 | . 59 |
Что означает ваш уровень АМГ для цикла замораживания яиц
Как мы упоминали выше, тестирование AMH — бесценный инструмент для женщин, рассматривающих возможность замораживания яиц (и их врачей).Уровни АМГ тесно связаны с количеством яиц, которое вы сможете извлечь за один цикл замораживания яиц или ЭКО.
Здесь, в Extend Fertility, мы используем собственный алгоритм, основанный на вашем уровне AMH и возрасте, чтобы предсказать — с достоверностью 90% — сколько яиц вы сможете заморозить за один цикл. Наше прошлое исследование показало, что, хотя женщины в возрасте 34 лет и младше могут замораживать в среднем 17 яиц за цикл, у женщин старше 41 года этот показатель снижается до менее 10 яиц.
Возраст | Среднее количество замороженных яиц за цикл |
34 или моложе | 17.2 |
35–37 | 15,48 |
38–40 | 12,87 |
41 и старше | 9,67 |
Возраст | Количество замороженных яиц, необходимое для обеспечения 50% вероятности живорождения с этими яйцами позже |
34 или моложе | 7 |
35–37 | 9 |
38–40 | 11 |
41 и старше | 20 |
Возраст | Количество замороженных яиц, необходимое для обеспечения 50% вероятности живорождения с этими яйцами позже | Уровень AMH, необходимый для достижения 50% вероятности живорождения за один цикл |
34 или моложе | 7 | 1,25 |
35–37 | 9 | 1.5 |
38–40 | 11 | 1,75 |
41 и старше | 20 | 2,25 |
Итак, что все это означает для женщин, которые на самом деле рассматривают возможность замораживания яиц? Это может помочь вам выяснить, сколько циклов вам, возможно, потребуется запланировать, или каковы ваши реальные шансы на беременность в будущем, если вы сделаете только один цикл.Например, если вам 39 лет и у вас уровень АМГ ниже 1,75, вы знаете, что вам, возможно, придется спланировать несколько циклов, чтобы получить 50% шанс забеременеть позже замороженными яйцами.
Если вам кажется, что данных слишком много, не волнуйтесь. Оценка фертильности в Extend Fertility сопровождается консультацией врача, чтобы ваш врач мог интерпретировать ваши результаты AMH в контексте и сообщить вам, что это означает для вашего здоровья фертильности и ваших планов замораживания яйцеклеток.
Свяжитесь с нами, чтобы узнать больше или позвоните нам по телефону 212-810-2828, чтобы назначить оценку!
РуководствоAMH: Понимание уровней антимюллерова гормона
Последнее обновление 15 июля 2021 г.
Прежде чем мы углубимся во все, что касается AMH, вы, возможно, задаетесь вопросом, почему вы продолжаете видеть эти три буквы на сайте Modern Fertility — и все чаще в статьях о женском здоровье и в разговорах о фертильности.
Антимюллеров гормон, или АМГ, является одним из наиболее важных гормонов, влияющих на фертильность. Итак, мы хотели сделать шаг назад и собрать всю необходимую информацию AMH в одном месте.
Вот краткий снимок того, что вы узнаете:
- АМГ — один из наиболее важных гормонов, влияющих на фертильность, поскольку он служит показателем резерва яичников (то есть количества яйцеклеток).
- Ваш уровень AMH , а не скажет вам, фертильны вы или нет, но он может дать вам лучшее представление о вашем репродуктивном здоровье и помочь вам планировать будущее во многих отношениях.
- Ваши уровни AMH меняются со временем, поэтому их отслеживание является ключевым моментом.
Перейти к любому из разделов ниже
Антимюллеров гормон (АМГ) — один из лучших индикаторов количества яйцеклеток в яичниках или овариального резерва. АМГ вырабатывается клетками гранулезы в фолликулах яичников, то есть крошечных мешочках в яичниках, в которых содержатся и выделяются яйца.
Хотя ваш уровень AMH не является хрустальным шаром для вашего будущего фертильности — это означает, что он , а не , является предиктором вашей способности зачать ребенка сегодня или в определенное время в будущем — он дает вам больше информации о вашем репродуктивное здоровье: понимание резерва яичников, результатов замораживания яйцеклеток или экстракорпорального оплодотворения (ЭКО), времени наступления менопаузы и таких состояний, как синдром поликистозных яичников (СПКЯ) и преждевременная недостаточность яичников (ПНЯ). Понимание вашего уровня AMH может помочь вам определить график беременности и побудить вас к разговору с врачом.К счастью, узнать свой уровень АМГ просто с помощью современного теста на гормоны фертильности.
Стоит повторить: ни один гормональный тест, в том числе тест на АМГ, не может гарантировать беременность или подтвердить бесплодие. Думайте об этом как о тесте на холестерин. Хотя знание вашего уровня холестерина не может сказать вам, будет ли у вас сердечный приступ, это то, что вы отслеживаете с течением времени, и может стать катализатором небольших изменений в здоровье или жизни. Это также может помочь сообщить об этом вашему врачу.
Дополнительное чтение:
Исследования показали, что АМГ — лучший и самый надежный способ измерения резерва яичников даже для женщин, которые еще не страдали бесплодием.Почему? АМГ вырабатывается преантральными и антральными фолликулами в яичниках у женщин, которые проходят лечение от бесплодия, а также у женщин, которые этого не делают. Это просто часть нашей биологии, поэтому она может многое рассказать нам о женской репродуктивной системе. Преантральные и антральные фолликулы — это развивающиеся фолликулы в ваших яичниках — другими словами, они коррелируют с количеством яйцеклеток, доступных для овуляции.
Почему важно понимание нашего овариального резерва? Женщины с более низким уровнем АМГ для их возраста, вероятно, будут иметь более короткое репродуктивное окно, чем женщины с нормальным уровнем АМГ для их возраста.
По словам профессора Скотта Нельсона, который считается одним из ведущих экспертов по AMH (и который также входит в состав Медицинского консультативного совета по современной фертильности): «В медицинском сообществе хорошо известно, что женщины с низким резервом яичников имеют более короткая репродуктивная продолжительность жизни и более ранний возраст менопаузы. Когда женщины вступают в менопаузу в более раннем возрасте, это влияет на их общую фертильность на протяжении всей жизни и потенциально на их способность завершить желаемый размер семьи ».
Поскольку пары откладывают создание семьи, все больше и больше женщин пытаются завести детей, когда их репродуктивное окно вот-вот закроется.Средний возраст наступления менопаузы — 51 год, но примерно за 4-8 лет до наступления менопаузы — иногда даже до 10 лет до наступления менопаузы! — рождаемость начинает падать, что затрудняет беременность. Это известно как перименопауза. Понимание важности овариального резерва и вашего AMH может дать вам больше информации и помочь вам сделать выбор в отношении ваших репродуктивных целей и сроков до этого.
Чтобы зачать ребенка, требуется всего одна здоровая яйцеклетка (и один здоровый сперматозоид!), Поэтому низкий запас яичников не обязательно означает, что вы не сможете забеременеть.Но — полезно знать, как АМГ влияет на женскую репродуктивную систему и почему ваши репродуктивные годы могут быть короче, чем вы думали.
Знание вашего уровня АМГ (обычно измеряемого в нанограммах / миллилитр или пикомоль / литр) полезно во многих других случаях. Вот краткое изложение того, что AMH может помочь вам понять:
- Если у вас может наступить менопауза раньше или позже, чем в среднем. Возраст вашей мамы на момент начала менопаузы раньше был золотым стандартом для прогнозирования того, когда вы можете достичь менопаузы.Но AMH также оказывается полезным — это потому, что менопауза характеризуется почти исчерпанием резерва яичников, на что может указывать уровень AMH. (Фактически, недавнее исследование 2020 года показывает, что уровни АМГ однажды могут помочь врачам предсказать вашу последнюю менструацию.)
- Результаты замораживания яйцеклеток или экстракорпорального оплодотворения (ЭКО). AMH может помочь вам понять, сколько яиц может быть извлечено во время извлечения яиц для замораживания яиц и ЭКО.
- Если вы подвержены риску синдрома поликистозных яичников (СПКЯ). СПКЯ очень распространено и поражает 1 из 10 женщин. Это может быть отмечено высоким уровнем АМГ в результатах ваших тестов, что может означать, что у вас много яйцеклеток, но вы овулируете нерегулярно или нечасто (что может создать проблемы с зачатием).
- Если вы подвержены риску первичной недостаточности яичников (POI). POI — это потеря функции яичников в возрасте до 40 лет, поражающая 1 из 100 женщин. Он отмечен чрезвычайно низкими или неопределяемыми уровнями АМГ в результатах ваших тестов.
Подробнее об этом мы поговорим в следующих разделах.
За последнее десятилетие медицинское сообщество изучает AMH. С каждым исследованием мы приближаемся на один шаг к лучшему пониманию роли, которую AMH играет в фертильности и репродуктивном здоровье женщин, но поскольку исследования продолжаются, мнение медицинского сообщества об AMH может измениться.
Например, в 2015 году Американское общество репродуктивной медицины (ASRM) выступило с заявлением, в котором говорилось: «Появляется все больше доказательств в поддержку использования АМГ в качестве скринингового теста на плохую реакцию яичников, но необходимы дополнительные данные.Четыре года спустя они обновили свою позицию в отношении АМГ как маркера резерва яичников и результатов замораживания яйцеклеток и ЭКО: «Способность АМГ и количества антральных фолликулов прогнозировать выход яйцеклеток, а также плохую и чрезмерную чувствительность яичников при ЭКО была хорошо продемонстрировано ».
В начале 2019 года Американский колледж акушеров и гинекологов (ACOG) опубликовал заключение о том, что, хотя данные подтверждают использование тестов AMH у женщин, страдающих бесплодием, они не поддерживают женщин, которые еще не являются бесплодными.Во мнении отмечается, что АМГ является наиболее надежным маркером овариального резерва.
Мы согласны с тем, что недостаточно доказательств того, что одно измерение АМГ может предсказать время наступления беременности. Не существует единого теста, который можно было бы пройти, чтобы предсказать способность забеременеть прямо сейчас, и предполагать обратное — вводить в заблуждение и безответственно.
Мы считаем, что женщины хотят большего, чем просто ответ на вопрос: «Могу ли я забеременеть прямо сейчас?» и может справиться с нюансами того, какие гормоны могут (и не могут) рассказать нам о нашей фертильности.Женщинам интересно понять, как их уровень АМГ может отражать их овариальный резерв, время наступления менопаузы, потенциальный успех при замораживании яиц и ЭКО, а также такие состояния, как СПКЯ. Исследования показывают, что AMH коррелирует со всеми этими факторами. Мы будем цитировать их в оставшейся части этого руководства.
Наша система здравоохранения обычно ориентирована на решение проблемы бесплодия. Мы считаем, что все женщины заслуживают эту информацию о своем теле по доступной цене. То, как мы измеряем АМГ, со временем изменилось, и мы считаем, что необходимы дополнительные исследования по продольному снижению АМГ и исходов фертильности (таких как время до беременности, выкидыша и живорождения) в предполагаемой фертильной популяции.Дополнительные исследования, безусловно, помогут рассмотреть и разрешить эти разные точки зрения.
Есть естественные небольшие колебания АМГ на протяжении всего цикла. Ваш уровень может быть немного выше сразу после менструации (перед овуляцией) и немного ниже после овуляции (до менструации, после выхода яйцеклетки).
В этом нет ничего необычного — многие гормоны меняются в течение всего цикла. Стоит отметить, что АМГ оказался одним из наиболее постоянных маркеров овариального резерва в течение менструального цикла, что делает его особенно полезным.Фактически, АМГ колеблется меньше, чем другие репродуктивные гормоны.
По мере того, как вы становитесь старше, АМГ также снижается (что отражает уменьшение овариального резерва с возрастом). Вот что вы должны знать о своем AMH на протяжении многих лет:
- Мы родились с 1–2 миллионами яиц — этого достаточно, чтобы заселить весь город Даллас, штат Техас!
- Более половины наших яиц распадаются к моменту полового созревания (звучит тревожно, но это нормально).
- 800–1000 яиц подвергаются естественной клеточной гибели каждый месяц — но до финиша доходит только одно (овуляция).Если он оплодотворяется, это может привести к беременности, в противном случае у вас начнутся месячные. Это происходит каждый месяц, хотя, если вы принимаете гормональные противозачаточные средства (например, таблетки), у вас может не быть овуляции или менструации.
- АМГ обычно достигает пика в возрасте 25 лет, а затем АМГ (и количество яиц) начинает постепенно снижаться.
- Примерно к 35 годам (у каждой женщины все по-разному), у нас происходит более быстрое снижение резерва яичников.
- К менопаузе количество яиц и АМГ падает до неопределяемого уровня.
Если вам нужны такие же данные, как мы, то вот диаграмма, которая отражает средние уровни АМГ в возрасте от 25 до 40 лет, по данным одного исследования, проведенного Fertility and Sterility . Эта диаграмма предназначена для иллюстрации того, как AMH снижается с течением времени — каждый человек уникален, и все мы теряем яйца с разной скоростью, поэтому ваш AMH может быть выше или ниже этих уровней и по-прежнему может считаться нормальным для вашего возраста.
Дополнительное чтение:
Как современная фертильность определяет нормальный AMH
Нормальный уровень AMH находится в пределах допустимого диапазона — он предполагает, что у вас есть ожидаемое количество яиц для вашего возраста.Ниже вы можете найти таблицу, в которой указаны пороговые значения уровня AMH для разных возрастных групп в соответствии с анализом AMH Beckman Coulter Access (если вам интересно, анализ — это просто лабораторный метод для измерения чего-то интересного — в данном случае AMH).
Приведенные ниже значения «Слегка низкое» и «Нормальное» являются частью нормального диапазона, определенного методом анализа Бекмана. Modern Fertility определяет значения ниже 1,3 нг / мл, но все еще в пределах этого нормального диапазона, как «Слегка низкие». (Мы используем этот предел клинического решения, потому что значения ниже 1.3 нг / мл с большей вероятностью будут связаны с более низкими показателями успеха при лечении бесплодия, таком как замораживание яиц или ЭКО.)
Имейте в виду, что «контрольные диапазоны» между лабораториями могут различаться, потому что в каждой лаборатории используется разное оборудование. Это означает, что если ваш врач будет повторно проводить тест в лаборатории с другим оборудованием, ваш референсный диапазон может быть другим. Это не означает, что вы не можете сравнивать два результата из разных лабораторий, а скорее, что существует диапазон того, что считается «нормальным» для здоровых людей, и этот диапазон может отличаться в разных лабораториях.
| Возраст | Немного низкий АМГ (в нг / мл) | Нормальный (в нг / мл) |
|---|---|---|
| 18-25 | от 1,02 до менее 1,3 | Между 1,3 и 14,63 |
| 26-30 | от 0,69 до менее 1,3 | Между 1,3 и 13,39 |
| 31-35 | 0,36 и ниже 1,3 | Между 1.3 и 10.07 |
| 36-40 | от 0,18 до менее 1,3 | Между 1.3 и 5.68 |
| 41-45 | от 0,08 до менее 1,3 | От 1,3 до 2,99 |
Даже если у вас нормальный уровень АМГ, доктор Натаки Дуглас, председатель Медицинского консультативного совета по современной фертильности, говорит, что отслеживание АМГ с течением времени по-прежнему важно. Доктор Дуглас рекомендует пройти тестирование один раз, а затем еще раз примерно через 12 месяцев. Кроме того, когда вам следует подумать о повторном тестировании, зависит от вашего возраста, вашего уровня AMH и того, как он меняется с течением времени.
Глядя на результаты теста AMH, важно помнить, что даже если он нормальный, все равно могут возникнуть проблемы с фертильностью, потому что возраст, наряду со многими другими факторами, по-прежнему играет большую роль. Помимо резерва яичников, еще одним важным элементом головоломки является качество яйцеклеток. К сожалению, не существует теста на качество яиц, поэтому возраст является лучшим предсказателем, который у нас есть.
Последствия низкого или очень низкого уровня АМГ
Низкий уровень АМГ указывает на меньшее количество яиц, чем ожидается для вашего возраста.Ниже вы можете найти таблицу, в которой указаны пороговые значения уровня AMH для разных возрастных групп в соответствии с анализом AMH Beckman Coulter Access. (Обратите внимание, что «Очень низкий» — это обозначение современной фертильности, присваиваемое уровням, которые ниже предела обнаружения теста Бекмана.)
| Возраст | Очень низкий уровень АМГ (в нг / мл) | Низкий уровень АМГ (в нг / мл) |
|---|---|---|
| 18-25 | Ниже 0,08 | Между 0,08 и 1,01 |
| 26-30 | Ниже 0.08 | От 0,08 до 0,68 |
| 31-35 | Ниже 0,08 | От 0,08 до 0,35 |
| 36-40 | Ниже 0,08 | От 0,08 до 0,17 |
Нет никаких доказательств того, что соматические симптомы (или симптомы, наблюдаемые в организме) связаны с низким уровнем АМГ. Кроме того, большинство данных не демонстрируют связи между низким уровнем АМГ и продолжительностью времени, которое требуется для того, чтобы забеременеть. Самым большим аргументом в пользу низкого АМГ является потенциально более короткое репродуктивное окно (из-за меньшего количества яиц) и меньшие шансы на успех при замораживании яйцеклеток и ЭКО для людей, которые выбирают (или нуждаются) в использовании этих методов лечения.
Если результаты теста показывают, что у вас низкий уровень АМГ и вы находитесь в более молодом возрасте, это может быть признаком уменьшения резерва яичников. Отслеживание своего уровня с течением времени поможет вам понять, с какой скоростью снижается ваш овариальный резерв, и, хотя это случается очень редко, возможно ли для вас преждевременное истощение яичникового резерва).
Очень низкий АМГ, отсутствие менструаций и перименопаузальные симптомы могут быть признаками первичной недостаточности яичников (ПНЯ). Доктор Шон Сэмплз, акушер-гинеколог из Нэшвилла, определяет POI как «потерю яйцеклеток в яичниках или нарушение функции яичников, так что месячные и весь менструальный цикл прекращаются на большие промежутки времени или навсегда до достижения возраста 40.Учтите, что только у 1 из 100 женщин будет диагностирована ПНЯ — у 25% из них может произойти спонтанная овуляция, а от 5% до 10% забеременеют и роды после того, как им поставят диагноз ПНЯ.
Можно ли повысить уровень АМГ?
Уровни АМГ неизбежно будут снижаться по мере того, как вы становитесь старше, поэтому в какой-то момент ожидается низкий АМГ, который случится со всеми, у кого есть яичники. Но что, если у вас низкий АМГ в более молодом возрасте?
В настоящее время не существует известного «лекарства» от низкого АМГ, но изучаются возможные методы повышения уровня.Один пример: исследование, опубликованное в Journal of Human Reproductive Sciences, показало, что умеренная физическая нагрузка «связана с улучшением возрастного резерва яичников».
Однако важно понимать, что даже если повышение уровня АМГ считалось возможным на , это не остановило бы потерю яйцеклеток — если яйцо исчезло, оно исчезло.
Дополнительные показания:
Последствия высокого уровня AMH
Высокий уровень AMH означает, что у вас больше яиц, чем ожидается для вашего возраста или в среднем для вашего возраста.Ниже вы можете найти таблицу, в которой указаны пороговые значения уровня AMH для разных возрастных групп.
| Возраст | Высокий уровень АМГ (в нг / мл) |
|---|---|
| 18-25 | Выше 14,63 |
| 26-30 | Выше 13,39 |
| 31-35 | Выше 10.07 |
| 36-40 | Выше 5,68 |
Хотя высокий уровень АМГ может показаться полезным, когда дело доходит до извлечения яйцеклеток для ЭКО, есть и некоторые недостатки:
СПКЯ: Синдром поликистозных яичников (СПКЯ) — распространенное эндокринное заболевание, вызванное дисбалансом гормонов — один у десяти женщин будет диагностирован СПКЯ.Симптомы и наблюдаемые признаки включают нерегулярные или отсутствующие менструации, избыточный рост волос, увеличение веса, многие фолликулы, которые перестали развиваться в яичниках, и проблемы с фертильностью из-за нерегулярных циклов, которые затрудняют синхронизацию полового акта с овуляцией. Хотя у большинства людей с СПКЯ больше фолликулов, не все они достигают полного развития из-за дополнительных андрогенов в организме.
В медицинском сообществе продолжаются дискуссии о пороговом значении AMH для диагностики СПКЯ, но пока нет согласия в этой области.АМГ не является частью диагностических критериев СПКЯ, и высокие уровни АМГ не всегда у людей с СПКЯ. Поэтому, если у вас СПКЯ, важно поговорить со своим врачом о любых потенциальных гормональных дисбалансах, чтобы вы могли выбрать правильный режим лечения. Врачи также могут вызвать овуляцию у людей, чей организм не делает этого естественным образом, с помощью таких лекарств, как кломид (который блокирует рецепторы эстрогена, стимулирует высвобождение фолликулостимулирующего гормона и приводит к овуляции) или летрозол (который снижает уровень эстрогена, увеличивает производство ФСГ и помогает активировать овуляторный механизм, спящий при СПКЯ).
Помимо проблем с фертильностью, СПКЯ может привести к осложнениям беременности и повышению риска диабета, сердечно-сосудистых заболеваний и рака эндометрия, беспокойства и депрессии. Ранняя диагностика может помочь лучше вылечить СПКЯ и любые связанные с ним состояния. Контроль рождаемости часто используется для лечения СПКЯ. Это потому, что он удерживает яичники в гормональном состоянии и вызывает циклическое кровотечение, которое защищает от рака эндометрия и является формой контрацепции. Гормональные противозачаточные средства могут маскировать симптомы СПКЯ, но не устраняют их.Если вы принимаете гормональные противозачаточные средства, вы можете отказаться от них и не знать, что у вас СПКЯ, пока вы не попытаетесь зачать ребенка без правильных ожиданий.
Высокий уровень АМГ и синдром гиперстимуляции яичников : Высокий уровень АМГ также может подвергнуть вас риску синдрома гиперстимуляции яичников (СГЯ), если вы принимаете препараты для лечения бесплодия во время ЭКО. Согласно одному исследованию, уровень АМГ — лучший способ оценить вероятность СГЯ, который может вызывать такие симптомы, как тошнота, спазмы и вздутие живота, во время циклов стимуляции яичников для замораживания яйцеклеток или ЭКО.Фактически, результаты теста на АМГ оказались более эффективным предиктором, чем возраст, ИМТ или количество антральных фолликулов. Если вы подумываете о замораживании яйцеклеток или ЭКО, однократного тестирования уровня АМГ будет достаточно, чтобы подобрать индивидуальное лечение и подготовить вас к процедуре. В зависимости от вашего AMH ваш врач может скорректировать дозы лекарств, используемых для стимуляции развития фолликулов, чтобы снизить риск СГЯ. Стоит отметить, что в настоящее время СГЯ встречается значительно реже, поскольку мы лучше понимаем причину СГЯ и способы его предотвращения.
Дополнительное чтение:
Исследование факторов образа жизни, которые больше всего влияют на AMH, дало неоднозначные результаты. Когда American Journal of Obstetrics & Gynecology собрали данные, они обнаружили, что курящих и противозачаточных были единственными факторами образа жизни, которые, как доказано в многочисленных исследованиях, снижают АМГ. (Хотя одно исследование показало, что диета с низким содержанием витамина D также может иметь пагубный эффект.)
Раз уж мы говорим о контрацепции, давайте разберемся, как именно она влияет на уровень АМГ.Исследования показали, что гормональные контрацептивы (включая таблетки, вагинальное кольцо, гормональные ВМС и Депо-Провера) могут подавлять АМГ у некоторых женщин, а это означает, что ваш уровень контроля над рождаемостью может быть несколько ниже, чем это было бы естественно. Несмотря на это, АМГ по-прежнему считается лучшим способом измерения резерва яичников и невероятно важным биомаркером фертильности. Если вы принимаете гормональные противозачаточные средства и ваш уровень ниже ожидаемого для вашего возраста, ваш врач может порекомендовать прекратить прием противозачаточных средств на несколько месяцев перед повторным тестированием.
Недавнее крупное популяционное исследование, проведенное журналом Journal of Clinical Endocrinology & Metabolism , также изучило влияние процентного содержания жира в организме, потребления алкоголя и физических упражнений на уровень АМГ, но не было продемонстрировано значительной связи. (Даже в этом случае вес и упражнения высокой интенсивности могут повлиять на вашу фертильность иным образом.)
Наша исследовательская группа очень интересуется факторами образа жизни, которые влияют на AMH, и в настоящее время мы изучаем, как такие вещи, как уровни физических упражнений, контроль рождаемости, Курение, употребление марихуаны, алкоголь и кофеин — все это влияет на AMH.
Дополнительное чтение:
Согласно исследованию 2017 года, одно измерение AMH не сильно связано с временем до наступления беременности. У этого исследования есть некоторые недостатки: оно не отслеживало такие исходы, как выкидыш или живорождение (только беременность), оно включало только небольшое количество женщин старше 35 лет с низким уровнем АМГ, оно исключает женщин с проблемами фертильности, которые прекратили участие в исследовании для проведения лечения бесплодия, и он измеряет моментальный снимок AMH вместо отслеживания AMH с течением времени.
Некоторые исследования * действительно * показывают, что существует связь между временем наступления беременности и AMH при естественном зачатии у женщин с очень низким уровнем AMH. По словам профессора Нельсона, «пока мы ждем ясности в отношении связи между AMH и шансом на естественное зачатие, ясно, что для женщин, имеющих вспомогательное зачатие, низкий AMH связан с более низкими шансами на успех в любом возрасте — и желаемым ими. размер семьи может быть недостижимым ».
В целом, необходимы дополнительные доказательства и исследования, чтобы лучше понять связь (или ее отсутствие) между снижением АМГ с течением времени и влиянием на естественную фертильность.
Иллюстрация процесса извлечения яиц.Ваш уровень AMH играет важную роль, когда вы думаете об извлечении яйцеклеток для замораживания яиц и ЭКО. Это связано с тем, что AMH является надежным показателем того, сколько яиц можно извлечь, как показано в одном исследовании 2009 года.
Замораживание яиц: Независимо от того, высокий у вас уровень или низкий, он может дать вам дополнительную информацию, которая поможет вам принять решение, замораживать яйца или нет (на основе прогнозируемых шансов на успех во время процедур извлечения яиц).Родная доула и писательница англичанка Тейлор использовала свой уровень АМГ, чтобы подумать о том, чтобы заблаговременно заморозить яйца. Как она объясняет: «Замораживая яйца сейчас (с более высоким AMH), я могла бы сэкономить себе в будущем немного больших денег». Почему это? Поскольку с возрастом АМГ снижается, для получения жизнеспособных яиц в более позднем возрасте может потребоваться больше раундов сбора урожая.
IVF: На стимуляцию яичников, первый этап ЭКО, влияет ваш овариальный резерв. Это связано с тем, что количество яиц, которые можно извлечь, зависит от их количества.Если у вас высокий уровень АМГ, существует большая вероятность того, что вы получите большое количество яиц в результате извлечения яиц. Тем не менее, наличие большего количества яиц не обязательно означает большее количество эмбрионов. Не все яйца, которые мы производим, оказываются жизнеспособными или достаточно высокого качества для ЭКО.
Если у вас низкий АМГ, это может означать, что вам придется пройти более одного цикла ЭКО, прежде чем вы добьетесь успеха. Поскольку лечение бесплодия обходится дорого, информация о своем AMH на раннем этапе может быть полезна при финансовом планировании.
Дополнительное чтение: Почему из-за моего уровня AMH я подумываю о замораживании яиц
В исследовании, проведенном доктором Брианной Литтл Шумахер, Анн Мари Юкич и Анн Штайнер, изучалось, как уровень АМГ выше или ниже среднего влияет на исход живорождений. В ходе исследования были измерены уровни АМГ у женщин, которые пытались зачать ребенка естественным путем. Им приходилось проходить тесты на беременность каждый месяц и сообщать, забеременели ли они, не забеременели ли они или у них случился выкидыш.Результаты показали, что с поправкой на возраст у женщин с клиническим невынашиванием беременности (беременность, подтвержденная с помощью УЗИ, которая не продолжалась в течение 20 недель) были самые низкие уровни АМГ.
Если уровень участницы был меньше или равен 0,4 нг / мл («значительно уменьшенный резерв яичников», согласно авторам), у них был в 2,2 раза риск выкидыша. Исследование также показало, что у женщин с самым высоким уровнем АМГ вероятность выкидыша выше в течение четырех дней после первого положительного теста на беременность.
Итог? В этом исследовании не говорится, что более низкий (или более высокий) уровень AMH вызывает выкидыша. Исследование предполагает, что между уровнем АМГ и риском выкидыша может быть связь . Мы не можем сделать каких-либо твердых выводов о связи между AMH и выкидышем из этого единственного исследования и надеемся вскоре увидеть больше исследований в этой области.
Дополнительное чтение: АМГ и выкидыши
Поздравляю! Вы дочитали до конца статьи.Давайте резюмируем основные моменты, не так ли?
Когда дело доходит до репродуктивной карьеры, AMH играет ключевую роль. Этот гормон является лучшим предсказателем овариального резерва или количества яйцеклеток … но это не значит, что он может сказать вам, фертильны вы или нет.
Есть много причин, по которым знание вашего уровня АМГ может быть полезным, но для еще лучшего понимания необходимо гораздо больше исследований этого гормона. Большинство исследований проводится на женщинах в клиниках по лечению бесплодия, что недостаточно для большинства женщин, пытающихся забеременеть.Чем больше женщин пройдет тестирование, тем больше данных мы получим, чтобы показать миру, насколько информативен этот гормон. (Больше знаний = больше силы!)
Прежде всего, выяснение того, что вы можете о своем теле, помогает вам подготовиться к той жизни, которую вы хотите. Если вы готовы узнать свой уровень гормонов (включая АМГ) и взять под контроль планирование своей семьи, закажите современный тест на гормоны фертильности.
Это руководство было проверено с медицинской точки зрения несколькими членами Медицинского консультативного совета Modern Fertility.
Ссылки
- A. Iwase, et al. Антимюллеров гормон как маркер яичникового резерва: что мы узнали и что мы должны знать? Репродуктивная медицина и биология, 2015.
- Л.Г. Нардо и др. Уровни анти-мюллеровских гормонов и количество антральных фолликулов у женщин, участвовавших в циклах экстракорпорального оплодотворения: взаимосвязь с факторами образа жизни, хронологическим возрастом и репродуктивным анамнезом. Гинекологическая эндокринология, 2007.
- J.V. Helden, et al. Эффективность двух новых полностью автоматизированных иммуноанализа на гормоны Мюллера по сравнению с клиническим стандартным анализом.Репродукция человека, 2015.
- S.L. Broer, et al. Антимюллеров гормон предсказывает менопаузу: долгосрочное последующее исследование у нормоовуляторных женщин. Журнал клинической эндокринологии и метаболизма, 2011.
- M. Dólleman, et al. Антимюллеров гормон является более точным показателем индивидуального времени наступления менопаузы, чем возраст матери в период менопаузы. Репродукция человека, 2014.
- J.S. Финкельштейн и др. Антимюллеров гормон и приближающаяся менопауза в позднем репродуктивном возрасте: исследование женского здоровья в стране.Журнал клинической эндокринологии и метаболизма, 2020.
- J.A. Visser и др. Антимюллеров гормон: маркер резерва яичников при первичной недостаточности яичников. Nature Reviews Endocrinology, 2012.
- A. Fraissinet, et al. Использование анализа сывороточного антимюллерова гормона в качестве заменителя морфологии поликистозных яичников: влияние на диагностику и фенотипическую классификацию синдрома поликистозных яичников. Репродукция человека, 2017.
- Комитет практики Американского общества репродуктивной медицины.Тестирование и интерпретация показателей овариального резерва: мнение комитета. Фертильность и бесплодие, 2015.
- O. Shebl, et al. Возрастное распределение базального уровня АМГ в сыворотке крови женщин репродуктивного возраста и предположительно здоровой когорты. Фертильность и бесплодие, 2011.
- S. Torrealday, et al. Преждевременная недостаточность яичников — обновленная информация о последних достижениях в понимании и лечении. F1000Research, 2017.
- M. Singh, et al. Проспективное рандомизированное контролируемое исследование сывороточного антимюллерова гормона (АМГ) как прогностического маркера синдрома гиперстимуляции яичников (СГЯ) в циклах ЭКО-ИКСИ.Фертильность и бесплодие, 2013.
- R. Tal, et al. Тестирование резерва яичников: руководство пользователя. Американский журнал акушерства и гинекологии, 2017.
- N.A. Dennis, et al. Уровень сывороточного антимюллерова гормона коррелирует со статусом витамина D у мужчин и женщин, но не у мальчиков. Журнал клинической эндокринологии и метаболизма, 2012.
- S. Kallio, et al. Уровень антимюллерова гормона снижается у женщин, использующих комбинированные контрацептивы, независимо от пути введения.Фертильность и бесплодие, 2013.
- M. Dólleman, et al. Детерминанты анти-мюллерова гормона репродуктивной функции и образа жизни в крупном популяционном исследовании. Журнал клинической эндокринологии и метаболизма, 2013.
- O. Hakimi, et al. Влияние упражнений на овуляцию: систематический обзор. Спортивная медицина, 2016.
- А.З. Штайнер и др. Ассоциация между биомаркерами яичникового резерва и бесплодием у пожилых женщин репродуктивного возраста. JAMA, 2017.
- H.S. Koo и др. Вероятность наступления беременности через запланированный коитус у молодых бесплодных женщин со сниженным овариальным резервом. Журнал клинической эндокринологии и метаболизма, 2018.
- S.M. Нельсон и др. Подход к контролируемой стимуляции яичников для вспомогательного зачатия, основанный на антимюллеровских гормонах. Репродукция человека, 2009.
- B.M. Литтл Шумахер и др. Антимуллеров гормон как фактор риска выкидыша при естественной беременности. Фертильность и бесплодие, 2018.
Антимюллеров гормон: маркер овариального резерва при первичной недостаточности яичников
Конвей, Г.С. Преждевременная недостаточность яичников. руб. Med. Бык. 56 , 643–649 (2000).
Артикул CAS Google Scholar
Олбрайт, Ф., Смит, П. Х. и Фрейзер, Р. Синдром, характеризующийся первичной недостаточностью яичников и снижением роста: отчет об 11 случаях с отклонением от гормонального контроля подмышечных и лобковых волос. г. J. Med. Sci. 204 , 625–648 (1942).
Артикул Google Scholar
Welt, C.K. Первичная недостаточность яичников: более точный термин для преждевременной недостаточности яичников. Clin. Эндокринол. (Oxf.) 68 , 499–509 (2008).
Артикул Google Scholar
Нельсон Л. М. Клиническая практика. Первичная недостаточность яичников. N. Engl. J. Med. 360 , 606–614 (2009).
Артикул CAS PubMed PubMed Central Google Scholar
Де Вос, М., Деврой П. и Фаузер, Б. С. Первичная недостаточность яичников. Ланцет 376 , 911–921 (2010).
Артикул Google Scholar
те Велде, Э. Р. и Пирсон, П. Л. Изменчивость женского репродуктивного старения. Hum. Репродукция. Обновление 8 , 141–154 (2002).
Артикул Google Scholar
Coulam, C. B., Adamson, S. C. & Annegers, J. F. Частота преждевременной недостаточности яичников. Акушерство. Гинеколь. 67 , 604–606 (1986).
CAS PubMed Google Scholar
Анасти, Дж. Н. Преждевременная недостаточность яичников: обновленная информация. Fertil.Стерил. 70 , 1–15 (1998).
Артикул CAS Google Scholar
Persani, L., Rossetti, R. & Cacciatore, C. Гены, участвующие в преждевременной недостаточности яичников у человека. J. Mol. Эндокринол. 45 , 257–279 (2010).
Артикул CAS Google Scholar
Мацук, М. и Лэмб, Д. Дж. Биология бесплодия: достижения в исследованиях и клинические проблемы. Нац. Med. 14 , 1197–1213 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
Бакалов В.К. и др. . Аутоиммунный оофорит как механизм фолликулярной дисфункции у женщин с 46, XX спонтанной преждевременной недостаточностью яичников. Fertil. Стерил. 84 , 958–965 (2005).
Артикул Google Scholar
Aittomäki, K. и др. . Мутация в гене рецептора фолликулостимулирующего гормона вызывает наследственную гипергонадотропную недостаточность яичников. Cell 82 , 959–968 (1995).
Артикул PubMed PubMed Central Google Scholar
Латронико, А.С. и др. . Краткий отчет: устойчивость яичек и яичников к лютеинизирующему гормону, вызванная инактивирующими мутациями гена рецептора лютеинизирующего гормона. N. Engl. J. Med. 334 , 507–512 (1996).
Артикул CAS Google Scholar
Араки, С. и др. . Остановка развития фолликулов у пациента с дефицитом 17 альфа-гидроксилазы: фолликулогенез в сочетании с отсутствием синтеза эстрогена в яичниках. Fertil. Стерил. 47 , 169–172 (1987).
Артикул CAS Google Scholar
Конте, Ф.А., Грумбах, М. М., Ито, Ю., Фишер, К. Р. и Симпсон, Е. Р. Синдром женского псевдогермафродизма, гипергонадотропного гипогонадизма и поликистозных яичников, связанный с миссенс-мутациями в гене, кодирующем ароматазу (P450arom). J. Clin. Эндокринол. Метаб. 78 , 1287–1292 (1994).
CAS PubMed Google Scholar
Нельсон, Л. М. и др. . Развитие лютеинизированных граафовых фолликулов у пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. J. Clin. Эндокринол. Метаб. 79 , 1470–1475 (1994).
CAS PubMed Google Scholar
Нельсон, Л. М., Ковингтон, С. Н. и Ребар, Р. В. Обновленная информация: спонтанная преждевременная недостаточность яичников — это не ранняя менопауза. Fertil. Стерил. 83 , 1327–1332 (2005).
Артикул Google Scholar
Hubayter, Z.Р. и др. . Проспективная оценка функции антрального фолликула у женщин со спонтанной первичной недостаточностью яичников 46, ХХ. Fertil. Стерил. 94 , 1769–1774 (2010).
Артикул Google Scholar
Каримов К. Б. и др. . Повышенная частота скрытой хрупкой Х-связанной первичной недостаточности яичников у бесплодных женщин с признаками нарушения функции яичников. Hum.Репродукция. 26 , 2077–2083 (2011).
Артикул CAS Google Scholar
Госвами Д. и Конвей Г. С. Преждевременная недостаточность яичников. Hum. Репродукция. Обновление 11 , 391–410 (2005).
Артикул CAS Google Scholar
Skillern, A. & Rajkovic, A. Последние разработки в области определения генетических детерминант преждевременной недостаточности яичников. Секс. Dev. 2 , 228–243 (2008).
Артикул CAS Google Scholar
Кнауф, Э.А. и др. . Полногеномное исследование ассоциации у пациенток с преждевременной недостаточностью яичников предполагает, что ADAMTS19 является возможным геном-кандидатом. Hum. Репродукция. 24 , 2372–2378 (2009).
Артикул CAS Google Scholar
ван Дорен, М.Ф., Бертоли-Авеллаб, А. М. и Ольденбург, Р. А. Преждевременная недостаточность яичников и полиморфизмы генов. Curr. Opin. Акушерство. Гинеколь. 21 , 313–317 (2009).
Артикул Google Scholar
Ольденбург Р. А. и др. . Сканирование сцепления по всему геному в голландской семье выявляет локус предрасположенности к преждевременной недостаточности яичников. Hum. Репродукция. 23 , 2835–2841 (2008).
Артикул CAS Google Scholar
Кристен-Мэтр, С.& Tachdjian, G. Исследование ассоциации всего генома и преждевременная недостаточность яичников. Ann. Эндокринол. (Париж) 71 , 218–221 (2010).
Артикул CAS Google Scholar
Бонди, К. А. Уход за девочками и женщинами с синдромом Тернера: руководство Исследовательской группы по синдрому Тернера. J. Clin. Эндокринол. Метаб. 92 , 10–25 (2007).
Артикул CAS Google Scholar
Saenger, P. и др. . Рекомендации по диагностике и лечению синдрома Тернера. J. Clin. Эндокринол. Метаб. 86 , 3061–3069 (2001).
CAS PubMed Google Scholar
Шерман, С. Л. Преждевременная недостаточность яичников при синдроме ломкой Х-хромосомы. г. J. Med. Genet. 97 , 189–194 (2000).
Артикул CAS Google Scholar
Веркерк, А.J. и др. . Идентификация гена (FMR-1), содержащего повтор CGG, совпадающий с областью кластера контрольной точки, демонстрирующей вариацию длины при синдроме ломкой Х-хромосомы. Cell 65 , 905–914 (1991).
Артикул CAS Google Scholar
Fu, Y.H. et al. . Вариация CGG-повтора в хрупком Х-сайте приводит к генетической нестабильности: разрешению парадокса Шермана. Cell 67 , 1047–1058 (1991).
Артикул CAS Google Scholar
Allingham-Hawkins, D. J. et al. . Премутация ломкой Х-хромосомы является значительным фактором риска преждевременной недостаточности яичников: предварительные данные Международного совместного исследования POF in Fragile X. г. J. Med. Genet. 83 , 322–325 (1999).
Артикул CAS PubMed PubMed Central Google Scholar
Конвей, Г.С., Пейн, Н. Н., Уэбб, Дж., Мюррей, А. и Джейкобс, П. А. Предварительный скрининг ломкой Х-хромосомы у женщин с преждевременной недостаточностью яичников. Hum. Репродукция. 13 , 1184–1187 (1998).
Артикул CAS Google Scholar
Conway, G. S., Kaltsas, G., Patel, A., Davies, M. C. & Jacobs, H. S. Характеристика идиопатической преждевременной недостаточности яичников. Fertil. Стерил. 65 , 337–341 (1996).
Артикул CAS Google Scholar
Новосад, Дж. А., Калантариду, С. Н., Тонг, З. Б. и Нельсон, Л. М. Антитела к яичникам, обнаруженные с помощью непрямой иммунофлуоресценции, ненадежны при диагностике аутоиммунной преждевременной недостаточности яичников: контролируемая оценка. BMC Womens Health 3 , 2 (2003).
Артикул PubMed PubMed Central Google Scholar
Ла Марка, А. и др. . Первичная недостаточность яичников: аутоиммунные причины. Curr. Opin. Акушерство. Гинеколь. 22 , 277–282 (2010).
PubMed Google Scholar
Gatta, G., Capocaccia, R., Coleman, M. P., Ries, L. A. & Berrino, F. Выживание рака в детстве в Европе и США. Рак 95 , 1767–1772 (2002).
Артикул Google Scholar
Гатта, Г. и др. . Тенденции выживаемости при детском раке в Европе: исследование рабочей группы EUROCARE. J. Clin. Онкол. 23 , 3742–3751 (2005).
Артикул Google Scholar
Эдгар, А. Б., Моррис, Э. М., Кельнар, К. Дж. И Уоллес, У. Х. Долгосрочное наблюдение за выжившими после детского рака. Endocr. Dev. 15 , 159–180 (2009).
Артикул Google Scholar
Ванна, Л.Э., Уоллес, У. Х. и Кричли, Х. О. Поздние эффекты лечения детского рака на женскую репродуктивную систему и потенциал для сохранения фертильности. BJOG 109 , 107–114 (2002).
Артикул Google Scholar
van Dorp, W. et al. . Долгосрочные эндокринные побочные эффекты лечения детской лимфомы Ходжкина: обзор. Hum. Репродукция. Обновление http: // dx.doi.org/10.1093/humupd/dmr038.
Брум, М. Ф. и Уоллес, У. Х. Субфертильность у детей и молодых людей, лечившихся от солидных и гематологических злокачественных новообразований. руб. J. Haematol. 131 , 143–155 (2005).
PubMed Google Scholar
Shelling, A. N. Преждевременная недостаточность яичников. Репродукция 140 , 633–641 (2010).
Артикул CAS Google Scholar
Josso, N. и др. . Антимюллеров гормон: фактор Йоста. Последние прог. Horm. Res. 48 , 1–59 (1993).
CAS PubMed Google Scholar
Ли, М. М. и Донахью, П. К. Мюллерово ингибирующее вещество: гонадный гормон с множеством функций. Endocr. Ред. 14 , 152–164 (1993).
CAS PubMed Google Scholar
Josso, N., Пикард, Дж. Ю. и Тран, Д. Антимюллеров гормон. Врожденные дефекты Ориг. Artic. Сер. 13 , 59–84 (1977).
CAS PubMed Google Scholar
Дурлингер, А. Л., Виссер, Дж. А. и Теммен, А. П. Регулирование функции яичников: роль антимюллерова гормона. Репродукция 124 , 601–609 (2002).
Артикул CAS Google Scholar
Райперт-Де Мейтс, Э. и др. . Экспрессия антимюллерова гормона во время нормального и патологического развития гонад: связь с дифференцировкой клеток Сертоли и гранулезы. J. Clin. Эндокринол. Метаб. 84 , 3836–3844 (1999).
PubMed Google Scholar
Weenen, C. et al. . Паттерн экспрессии анти-Мюллерова гормона в яичниках человека: потенциальные последствия для начального и циклического набора фолликулов. Мол. Гм. Репродукция. 10 , 77–83 (2004).
Артикул CAS Google Scholar
Ши, Дж. и др. . Костный морфогенетический белок-6 стимулирует экспрессию гена рецептора фолликулостимулирующего гормона, бета-субъединиц ингибина / активина и антимюллерова гормона в клетках гранулезы человека. Fertil. Стерил. 92 , 1794–1798 (2009).
Артикул Google Scholar
Лосось, Н.А., Хэндисайд, А. Х. и Джойс, И. М. Ооциты, регулирующие экспрессию антимюллерова гормона в клетках гранулезы во время развития фолликулов яичников у мышей. Dev. Биол. 266 , 201–208 (2004).
Артикул CAS Google Scholar
Grøndahl, M. L. et al. . Антимюллеров гормон остается высоко экспрессируемым в кумулюсных клетках человека на заключительных стадиях фолликулогенеза. Репродукция.Биомед. Интернет 22 , 389–398 (2011).
Артикул CAS Google Scholar
McGee, E. A. & Hsueh, A. J. Начальное и циклическое привлечение фолликулов яичников. Endocr. Ред. 21 , 200–214 (2000).
CAS PubMed Google Scholar
Durlinger, A. L. L. и др. . Контроль за рекрутированием примордиальных фолликулов антимюллеровым гормоном в яичнике мышей. Эндокринология 140 , 5789–5796 (1999).
Артикул CAS PubMed Google Scholar
Карлссон И. Б. и др. . Антимюллеров гормон подавляет начало роста первичных фолликулов яичников человека in vitro . Hum. Репродукция. 21 , 2223–2227 (2006).
Артикул CAS Google Scholar
Дурлингер, А.Л. Л. и др. . Антимюллеров гормон подавляет начало роста примордиальных фолликулов в яичнике мыши. Эндокринология 143 , 1076–1084 (2002).
Артикул CAS Google Scholar
Gigli, I., Cushman, R.A., Wahl, C.M. & Fortune, J.E. Доказательства роли антимюллерова гормона в подавлении активации фолликулов в яичниках мышей и коре яичников быка, трансплантированных под хориоаллантоисную мембрану цыплят. Мол. Репродукция. Dev. 71 , 480–488 (2005).
Артикул CAS Google Scholar
Кевенаар М.Э. и др. . Полиморфизм гена рецептора AMH типа II связан с возрастом менопаузы во взаимодействии с паритетом. Hum. Репродукция. 22 , 2382–2388 (2007).
Артикул CAS Google Scholar
Дурлингер, А.Л. Л. и др. . Антимюллеров гормон ослабляет действие ФСГ на развитие фолликулов в яичнике мыши. Эндокринология 142 , 4891–4899 (2001).
Артикул CAS Google Scholar
Visser, J. A. et al. . Повышенная дегенерация ооцитов и атрезия фолликулов во время эстрального цикла у мышей, не обладающих антимюллеровым гормоном. Эндокринология 148 , 2301–2308 (2007).
Артикул CAS PubMed Google Scholar
ди Клементе, Н. и др. . Ингибирующее действие АМГ на экспрессию рецепторов ароматазы и ЛГ гранулезных клеток незрелых яичников крыс и свиней. Эндокринная 2 , 553–558 (1994).
CAS Google Scholar
Гроссман, М. П., Накадзима, С. Т., Фаллат, М.E. & Siow, Y. Вещество, ингибирующее Мюллериан, подавляет активность ароматазы цитохрома P450 в культуре клеток гранулезно-лютеина человека. Fertil. Стерил. 89 , 1364–1370 (2008).
Артикул CAS Google Scholar
Андерсен, К. Ю. и Бысков, А. Г. Эстрадиол и регуляция антимюллерова гормона, ингибина-A и секреции ингибина-B: анализ жидкости малых антральных и преовуляторных фолликулов человека. J. Clin. Эндокринол. Метаб. 91 , 4064–4069 (2006).
Артикул CAS Google Scholar
Кевенаар, М. Э. и др. . Полиморфизм рецепторов анти-мюллерова гормона и антимюллерова гормона II типа связан с уровнями эстрадиола в фолликулярной фазе у нормоовуляторных женщин. Hum. Репродукция. 22 , 1547–1554 (2007).
Артикул CAS Google Scholar
te Velde, E.Р., Шеффер, Г. Дж., Дорланд, М., Брукманс, Ф. Дж. И Фаузер, Б. С. Эндокринные и развивающие аспекты нормального старения яичников. Мол. Клетка. Эндокринол. 145 , 67–73 (1998).
Артикул CAS Google Scholar
Scheffer, G.J. et al. . Подсчет антральных фолликулов при трансвагинальном ультразвуковом исследовании зависит от возраста у женщин с доказанной естественной фертильностью. Fertil. Стерил. 72 , 845–851 (1999).
Артикул CAS Google Scholar
Bergada, I. et al. . Динамика всплеска сывороточного гонадотропина, ингибинов и антимюллерова гормона у здоровых новорожденных мужчин в течение первого месяца жизни. J. Clin. Эндокринол. Метаб. 91 , 4092–4098 (2006).
Артикул CAS Google Scholar
Guibourdenche, J. и др. . Уровни антимюллерова гормона в сыворотке плодов и детей человека: закономерности и клинический интерес. Мол. Клетка. Эндокринол. 211 , 55–63 (2003).
Артикул CAS Google Scholar
Хаген, К. П. и др. . Уровни антимюллерова гормона в сыворотке как маркер функции яичников у 926 здоровых женщин от рождения до зрелого возраста и у 172 пациентов с синдромом Тернера. J. Clin. Эндокринол. Метаб. 95 , 5003–5010 (2010).
Артикул CAS Google Scholar
Ли, М. М. и др. . Вещество, ингибирующее мюллериан, у людей: нормальные уровни от младенчества до взрослого возраста. J. Clin. Эндокринол. Метаб. 81 , 571–576 (1996).
CAS PubMed Google Scholar
van Rooij, I.А. и др. . Антимюллеров гормон является многообещающим предиктором наступления менопаузального перехода. Менопауза 11 , 601–606 (2004).
Артикул Google Scholar
van Rooij, I.A. et al. . Уровни антимуллерных гормонов в сыворотке лучше всего отражают снижение репродуктивной функции с возрастом у здоровых женщин с доказанной фертильностью: продольное исследование. Fertil. Стерил. 83 , 979–987 (2005).
Артикул CAS Google Scholar
де Вет, А., Лавен, Дж. С., де Йонг, Ф. Х., Теммен, А. П. Н. и Фаузер, Б. С. Уровни антимюллерова гормона в сыворотке: предполагаемый маркер старения яичников. Fertil. Стерил. 77 , 357–362 (2002).
Артикул Google Scholar
Fanchin, R. et al. . Сывороточный антимюллеров гормон в большей степени связан с фолликулярным статусом яичников, чем сывороточный ингибин B, эстрадиол, ФСГ и ЛГ на 3-й день. Hum. Репродукция. 18 , 323–327 (2003).
Артикул CAS Google Scholar
ван Рой, И. А. и др. . Уровни антимюллерова гормона в сыворотке: новый показатель резерва яичников. Hum. Репродукция. 17 , 3065–3071 (2002).
Артикул CAS Google Scholar
Хансен, К. Р., Ходнетт, Г. М., Ноултон, Н. и Крейг, Л. Б. Корреляция тестов яичникового резерва с гистологически определенным числом примордиальных фолликулов. Fertil. Стерил. 95 , 170–175 (2011).
Артикул Google Scholar
Кевенаар М.Э. и др. . Уровни антимюллерова гормона в сыворотке крови отражают размер пула примордиальных фолликулов у мышей. Эндокринология 147 , 3228–3234 (2006).
Артикул CAS Google Scholar
Сейфер, Д.Б., Бейкер, В. Л. и Лидер, Б. Возрастные значения антимюллерова гормона в сыворотке крови у 17 120 женщин, обращающихся в центры репродуктивной медицины в США. Fertil. Стерил. 95 , 747–750 (2011).
Артикул CAS Google Scholar
Келси, Т. В., Райт, П., Нельсон, С. М., Андерсон, Р. А. и Уоллес, В. Х. Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы. PLoS ONE 6 , e22024 (2011).
Артикул CAS PubMed PubMed Central Google Scholar
Нельсон, С. М. и др. . Внешнее подтверждение номограммы снижения уровня антимюллерова гормона в сыворотке крови у женщин: популяционное исследование с участием 15 834 пациенток с бесплодием. Репродукция. Биомед. Интернет 23 , 204–206 (2011).
Артикул Google Scholar
Hehenkamp, W.J. и др. . Уровни антимюллерова гормона в спонтанном менструальном цикле не подвержены значительным колебаниям. J. Clin. Эндокринол. Метаб. 91 , 4057–4063 (2006).
Артикул CAS Google Scholar
La Marca, A., Stabile, G., Artenisio, A.C. & Volpe, A. Сывороточный антимюллеров гормон на протяжении менструального цикла человека. Hum. Репродукция. 21 , 3103–3107 (2006).
Артикул CAS Google Scholar
Streuli, I. et al. . Уровни антимуллеровых гормонов в сыворотке остаются стабильными на протяжении всего менструального цикла и после перорального или вагинального введения синтетических половых стероидов. Fertil. Стерил. 90 , 395–400 (2008).
Артикул CAS Google Scholar
Tsepelidis, S. et al .Стабильные уровни антимюллерова гормона в сыворотке крови во время менструального цикла: проспективное исследование у женщин с нормоовуляцией. Hum. Репродукция. 22 , 1837–1840 (2007).
Артикул CAS Google Scholar
Робертсон, Д. М., Хейл, Г. Э., Фрейзер, И. С., Хьюз, К. Л. и Бургер, Г. Г. Изменения уровней антимюллерова гормона в сыворотке крови в овуляторном менструальном цикле в позднем репродуктивном возрасте. Менопауза 18 , 521–524 (2011).
Артикул Google Scholar
Сауэрс, М. и др. . Изменчивость антимюллерова гормона и ингибина B во время нормальных менструальных циклов. Fertil. Стерил. 94 , 1482–1486 (2010).
Артикул CAS Google Scholar
Streuli, I. et al. . Клиническое использование тестов на антимюллеровы гормоны: подводные камни и перспективы. Fertil. Стерил. 91 , 226–230 (2009).
Артикул CAS Google Scholar
Вундер, Д. М., Берсингер, Н. А., Яред, М., Кречмер, Р. и Биркхойзер, М. Х. Статистически значимые изменения уровней антимюллерова гормона и ингибина во время физиологического менструального цикла у женщин репродуктивного возраста. Fertil. Стерил. 89 , 927–933 (2008).
Артикул CAS Google Scholar
Фанчин, Р. и др. . Высокая воспроизводимость результатов измерения антимюллерова гормона в сыворотке предполагает многоэтапную фолликулярную секрецию и усиливает ее роль в оценке состояния фолликулов яичников. Hum. Репродукция. 20 , 923–927 (2005).
Артикул CAS Google Scholar
Сауэрс, М. Р. и др. . Антимюллеров гормон и ингибин B в определении старения яичников и перехода к менопаузе. J. Clin. Эндокринол. Метаб. 93 , 3478–3483 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
ван Дисселдорп, Дж. и др. . Связь концентрации антимюллерова гормона в сыворотке крови с возрастом в период менопаузы. J. Clin. Эндокринол. Метаб. 93 , 2129–2134 (2008).
Артикул CAS Google Scholar
Broer, S.Л. и др. . Антимюллеров гормон предсказывает менопаузу: долгосрочное катамнестическое исследование с участием нормоовуляторных женщин. J. Clin. Эндокринол. Метаб. 96 , 2532–2539 (2011).
Артикул CAS Google Scholar
Тегерани, Ф. Р., Шакери, Н., Солаймани-Додаран, М. и Азизи, Ф. Прогнозирование возраста наступления менопаузы по концентрации антимюллерова гормона в сыворотке. Менопауза 18 , 766–770 (2011).
Артикул Google Scholar
Тегерани, Ф. Р., Солаймани-Додаран, М. и Азизи, Ф. Единственный тест на антимуллерный гормон у женщин позднего репродуктивного возраста является хорошим предиктором менопаузы. Менопауза 16 , 797–802 (2009).
Артикул Google Scholar
Хендрикс, Д. Дж., Мол, Б. В., Банси, Л. Ф., Те Велде, Э. Р. и Брукманс, Ф.J. Подсчет антральных фолликулов в прогнозе плохой реакции яичников и беременности после экстракорпорального оплодотворения: метаанализ и сравнение с базальным уровнем фолликулостимулирующего гормона. Fertil. Стерил. 83 , 291–301 (2005).
Артикул Google Scholar
Сейфер, Д. Б., Маклафлин, Д. Т., Кристиан, Б. П., Фенг, Б. и Шелден, Р. М. Ранние уровни вещества, ингибирующего мюллериан в фолликулярной сыворотке, связаны с реакцией яичников во время циклов вспомогательных репродуктивных технологий. Fertil. Стерил. 77 , 468–471 (2002).
Артикул Google Scholar
Ла Марка, А. и др. . Измерение уровня анти-мюллерова гормона в любой день менструального цикла надежно предсказывает реакцию яичников на вспомогательные репродуктивные технологии. Hum. Репродукция. 22 , 766–771 (2007).
Артикул CAS Google Scholar
Нельсон, С.М., Йейтс, Р. У. и Флеминг, Р. Сывороточный антимюллеров гормон и ФСГ: прогнозирование живорождения и экстремальные реакции в стимулированных циклах — значение для индивидуализации терапии. Hum. Репродукция. 22 , 2414–2421 (2007).
Артикул CAS Google Scholar
Нельсон, С. М. и др. . Подход к контролируемой стимуляции яичников для вспомогательного зачатия, основанный на антимюллеровских гормонах. Hum. Репродукция. 24 , 867–875 (2009).
Артикул CAS Google Scholar
Broer, S. L. et al. . AMH и AFC как предикторы чрезмерного ответа при контролируемой гиперстимуляции яичников: метаанализ. Hum. Репродукция. Обновление 17 , 46–54 (2011).
Артикул CAS Google Scholar
Broer, S.Л., Мол, Б., Доллеман, М., Фаузер, Б. К. и Брукманс, Ф. Дж. Роль оценки анти-мюллеровских гормонов в результатах вспомогательных репродуктивных технологий. Curr. Opin. Акушерство. Гинеколь. 22 , 193–201 (2010).
Артикул Google Scholar
Broer, S. L., Mol, B. W., Hendriks, D. & Broekmans, F. J. Роль антимюллерова гормона в прогнозировании исхода после ЭКО: сравнение с количеством антральных фолликулов. Fertil. Стерил. 91 , 705–714 (2009).
Артикул CAS Google Scholar
Фадини, Р. и др. . Антимюллеров гормон как прогностический маркер для отбора женщин для лечения созревания ооцитов in vitro. J. Assist. Репродукция. Genet. 28 , 501–508 (2011).
Артикул PubMed PubMed Central Google Scholar
Gnoth, C. и др. . Актуальность измерения антимюллерова гормона в рутинной программе ЭКО. Hum. Репродукция. 23 , 1359–1365 (2008).
Артикул CAS Google Scholar
Ли Фонг, С. и др. . Антимюллеров гормон: маркер количества ооцитов, качества ооцитов и качества эмбрионов? Репродукция. Биомед. Интернет 16 , 664–670 (2008).
Артикул CAS Google Scholar
Сминк, Дж.М. и др. . Антимуллеров гормон предсказывает реакцию яичников, но не качество эмбриона или беременность после экстракорпорального оплодотворения или интрациоплазматической инъекции сперматозоидов. Fertil. Стерил. 87 , 223–226 (2007).
Артикул CAS Google Scholar
Ла Марка, А. и др. . Уровни антимюллерова гормона в сыворотке крови у женщин с вторичной аменореей. Fertil. Стерил. 85 , 1547–1549 (2006).
Артикул CAS Google Scholar
Méduri, G. et al. . Экспрессия антимюллерова гормона в сыворотке у женщин с преждевременной недостаточностью яичников. Hum. Репродукция. 22 , 117–123 (2007).
Артикул CAS Google Scholar
Бачелот, А. и др. . Фенотипирование и генетические исследования 357 последовательных пациенток с преждевременной недостаточностью яичников. евро. J. Endocrinol. 161 , 179–187 (2009).
Артикул CAS Google Scholar
Кнауф, Э.А. и др. . Антимюллеров гормон, ингибин B и количество антральных фолликулов у молодых женщин с недостаточностью яичников. J. Clin. Эндокринол. Метаб. 94 , 786–792 (2009).
Артикул CAS Google Scholar
Салливан, А.К. и др. . Связь размера повтора FMR1 с дисфункцией яичников. Hum. Репродукция. 20 , 402–412 (2005).
Артикул CAS Google Scholar
Рор, Дж. и др. . Антимюллеров гормон указывает на раннее снижение функции яичников у носителей премутации с ломкой X-умственной отсталостью (FMR1): предварительное исследование. Hum. Репродукция. 23 , 1220–1225 (2008).
Артикул CAS Google Scholar
Spath, M.А. и др. . Внутрииндивидуальная стабильность во времени стандартизированного антимюллерова гормона у носителей премутации FMR1. Hum. Репродукция. 26 , 2185–2191 (2011).
Артикул CAS PubMed PubMed Central Google Scholar
Глейхер, Н., Вегхофер, А., Октай, К. и Барад, Д. Х. Корреляция тройных повторов в гене FMR1 (ломкий X) с резервом яичников: новый тест на бесплодие? Acta Obstet.Гинеколь. Сканд. 88 , 1024–1030 (2009).
Артикул CAS Google Scholar
Gleicher, N., Weghofer, A., Oktay, K. & Barad, D. Релевантность тройных повторов CGG в гене FMR1 для яичникового резерва. Репродукция. Биомед. Интернет 19 , 385–390 (2009).
Артикул CAS Google Scholar
Глейхер, Н., Weghofer, A. & Barad, D.H. Пилотное исследование преждевременного старения яичников: I. Корреляция тройных повторов CGG в гене FMR1 с параметрами яичникового резерва ФСГ и антимюллерова гормона. Fertil. Стерил. 91 , 1700–1706 (2009).
Артикул CAS Google Scholar
Беннет, К. Э., Конвей, Г. С., Макферсон, Дж. Н., Джейкобс, П. А. и Мюррей, А. Повторы CGG среднего размера не являются частой причиной идиопатической преждевременной недостаточности яичников. Hum. Репродукция. 25 , 1335–1338 (2010).
Артикул CAS PubMed PubMed Central Google Scholar
Абир, Р. и др. . Синдром Тернера и фертильность: текущее состояние и возможные предполагаемые перспективы. Hum. Репродукция. Обновление 7 , 603–610 (2001).
Артикул CAS Google Scholar
Тониоло Д.& Rizzolio, F. X хромосома и яичниковая недостаточность. Семин. Репродукция. Med. 25 , 264–271 (2007).
Артикул CAS Google Scholar
Borgström, B. et al. . Сохранение фертильности у девочек с синдромом Тернера: прогностические признаки наличия фолликулов яичников. J. Clin. Эндокринол. Метаб. 94 , 74–80 (2009).
Артикул CAS Google Scholar
Purushothaman, R., Лазарева О., Октай К. и Тен С. Маркеры овариального резерва у девочек с синдромом Тернера. Fertil. Стерил. 94 , 1557–1559 (2010).
Артикул Google Scholar
Цигкоу А. и др. . Высокая концентрация ингибина в сыворотке отличает аутоиммунный оофорит от других форм первичной недостаточности яичников. J. Clin. Эндокринол. Метаб. 93 , 1263–1269 (2008).
Артикул CAS Google Scholar
Ла Марка, А. и др. . Первичная недостаточность яичников из-за аутоиммунитета стероидогенных клеток связана с сохранением пула функционирующих фолликулов. J. Clin. Эндокринол. Метаб. 94 , 3816–3823 (2009).
Артикул CAS Google Scholar
Глейхер Н., Вегхофер А.И Барад, Д. Х. Пилотное исследование преждевременного старения яичников: II. Различный генотип и фенотип по генетической и аутоиммунной этиологии. Fertil. Стерил. 91 , 1707–1711 (2009).
Артикул CAS Google Scholar
Клоуз, М. Э. и др. . Сохранение яичников агонистами ГнРГ во время химиотерапии: метаанализ. J. Womens Health 18 , 311–319 (2009).
Артикул Google Scholar
Nitzschke, M. et al. . Аналоги ГнРГ не защищают яичники от ультраструктурных повреждений, вызванных химиотерапией, у пациентов с лимфомой Ходжкина. Arch. Гинеколь. Акушерство. 282 , 83–88 (2010).
Артикул CAS Google Scholar
Санчес-Серрано, М. и др. . Близнецы, рожденные после трансплантации корковой ткани яичников и витрификации ооцитов. Fertil. Стерил. 93 , 268.e11–268.e13 (2010).
Артикул Google Scholar
Meirow, D. et al. . Мониторинг яичников после аутотрансплантации криоконсервированной ткани яичника: эндокринные исследования, циклы экстракорпорального оплодотворения и живорождение. Fertil. Стерил. 87 , 418.e7–418.e15 (2007).
Артикул Google Scholar
Янсе, Ф. и др. . Ограниченное значение маркеров функции яичников после ортотопической трансплантации ткани яичников после лечения гонадотоксиками. J. Clin. Эндокринол. Метаб. 96 , 1136–1144 (2011).
Артикул CAS Google Scholar
Шмидт, К. Т. и др. . Аутотрансплантация криоконсервированной ткани яичника у 12 женщин с преждевременной недостаточностью яичников, вызванной химиотерапией: опыт Дании. Fertil. Стерил. 95 , 695–701 (2011).
Артикул Google Scholar
Ли Фонг, С. и др. . Оценка овариального резерва у взрослых выживших после рака в детском возрасте с использованием антимюллерова гормона. Hum. Репродукция. 24 , 982–990 (2009).
Артикул CAS Google Scholar
Rosendahl, M. et al. .Функция яичников после удаления всего яичника для криоконсервации кусочков коры головного мозга перед гонадотоксическим лечением: последующее исследование. Hum. Репродукция. 23 , 2475–2483 (2008).
Артикул Google Scholar
ван Бик, Р. Д. и др. . Антимюллеров гормон является чувствительным сывороточным маркером функции гонад у женщин, лечившихся от лимфомы Ходжкина в детстве. J. Clin. Эндокринол.Метаб. 92 , 3869–3874 (2007).
Артикул CAS Google Scholar
Bath, LE, Wallace, WH, Shaw, MP, Fitzpatrick, C. & Anderson, RA Истощение овариального резерва у молодых женщин после лечения рака в детстве: обнаружение с помощью антимюллерова гормона, ингибина B и яичников УЗИ. Hum. Репродукция. 18 , 2368–2374 (2003).
Артикул CAS Google Scholar
Ли Фонг, С. и др. . Антимюллеров гормон как маркер функции яичников у женщин после химиотерапии и лучевой терапии злокачественных гематологических заболеваний. Hum. Репродукция. 23 , 674–678 (2008).
Артикул CAS Google Scholar
Су, Х. И. и др. . Антимуллеровый гормон и ингибин B являются гормональными показателями функции яичников у лиц, переживших рак груди в позднем репродуктивном возрасте. Рак 116 , 592–599 (2010).
Артикул CAS PubMed PubMed Central Google Scholar
Партридж, А. Х. и др. . Резерв яичников у женщин, которые остаются в пременопаузе после химиотерапии рака груди на ранней стадии. Fertil. Стерил. 94 , 638–644 (2010).
Артикул Google Scholar
Лутчман Сингх, К. и др. .Предикторы овариального резерва у молодых женщин с раком груди. руб. J. Cancer 96 , 1808–1816 (2007).
Артикул CAS PubMed PubMed Central Google Scholar
Андерсон, Р. А., Теммен, А. П., Аль-Кахтани, А., Грум, Н. П. и Камерон, Д. А. Влияние химиотерапии и длительного подавления гонадотропинов на яичниковый резерв у женщин в пременопаузе с раком груди. Hum.Репродукция. 21 , 2583–2592 (2006).
Артикул CAS Google Scholar
Ю. Б. и др. . Изменения маркеров резерва яичников и эндокринной функции у молодых женщин с раком груди, проходящих адъювантную химиотерапию. Рак 116 , 2099–2105 (2010).
CAS PubMed PubMed Central Google Scholar
Rosendahl, M. и др. . Динамика и механизмы индуцированного химиотерапией истощения фолликулов яичников у женщин фертильного возраста. Fertil. Стерил. 94 , 156–166 (2010).
Артикул CAS Google Scholar
Андерс К. и др. . Пилотное исследование прогностических маркеров аменореи, связанной с химиотерапией, среди женщин в пременопаузе с раком груди на ранней стадии. Рак Инвест. 26 , 286–295 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
Андерсон, Р. А. и Камерон, Д. А. Сывороточный антимюллеров гормон до лечения позволяет прогнозировать долгосрочную функцию яичников и массу костной ткани после химиотерапии при раннем раке груди. J. Clin. Эндокринол. Метаб. 96 , 1336–1343 (2011).
Артикул CAS Google Scholar
Кайпиа, А.& Hsueh, A. J. Регулирование атрезии фолликула яичника. Annu. Rev. Physiol. 59 , 349–363 (1997).
Артикул CAS Google Scholar
Massagué, J. Передача сигнала TGF-β. Annu. Rev. Biochem. 67 , 753–791 (1998).
Артикул Google Scholar
Массаге, Дж. И Уоттон, Д. Контроль транскрипции с помощью системы передачи сигналов TGF-бета / Smad. Embo. J. 19 , 1745–1754 (2000).
Артикул PubMed PubMed Central Google Scholar
Visser, J. A. Передача сигналов AMH: от рецептора к гену-мишени. Мол. Клетка. Эндокринол. 211 , 65–73 (2003).
Артикул CAS Google Scholar
Эриксон, Г. Ф. и Шимасаки, С. Пространственно-временной паттерн экспрессии семейства костных морфогенетических белков в типах клеток яичников крыс во время эстрального цикла. Репродукция. Биол. Эндокринол. 1 , 9 (2003).
Артикул PubMed PubMed Central Google Scholar
Границы | Антимюллеров гормон во время естественного цикла представляет значительные вариации внутри и между циклами при измерении с помощью полностью автоматизированного анализа
Введение
Антимюллеров гормон (АМГ) представляет собой димерный гликопротеин, продуцируемый гранулезными клетками преантральных и малых антральных фолликулов в яичнике, и его производство не зависит от фолликулостимулирующего гормона (ФСГ) (1).Высвобождение АМГ из клеток гранулезы приводит к измеряемым уровням в сыворотке крови, и было показано, что эти концентрации пропорциональны количеству развивающихся фолликулов в яичниках (2). Таким образом, АМГ стал одним из наиболее важных косвенных клинических маркеров резерва яичников (3) и используется клиницистами для прогнозирования ответа яичников на гиперстимуляцию при ЭКО, облегчения консультирования пациентов и индивидуализации режимов стимуляции. Более того, недавняя публикация продемонстрировала сильную положительную, не зависящую от возраста взаимосвязь между уровнем АМГ и количеством эуплоидных бластоцист, полученных после циклов ЭКО / ИКСИ (4), а также с частотой выкидышей (5).
Общеизвестно, что сывороточный АМГ демонстрирует высокую индивидуальную вариабельность, в основном связанную с разным количеством антральных фолликулов в группах женщин одного возраста (2). Это также зависит от таких факторов, как использование гормональных контрацептивов, беременность, индекс массы тела, курение (6) и использование гонадотропинов для стимуляции яичников (7, 8). Сывороточный АМГ обычно считается надежным тестом, который можно измерить в любой день естественного цикла с минимальной индивидуальной вариабельностью (6, 9–13).Однако недавние публикации вызвали сомнения в надежности единственного теста AMH, взятого ad-hoc в естественном цикле. Горкем и др. продемонстрировали, что уровни АМГ в сыворотке, по-видимому, выше во время фолликулярной фазы по сравнению с лютеиновой фазой у бесплодных женщин с нормальным, высоким и низким резервом яичников (14). Другие авторы описали важную вариабельность концентраций АМГ во время менструального цикла, которая была признана более высокой, чем колебания, ожидаемые только на основании анализа (15, 16).Более того, было высказано предположение, что у молодых женщин может быть модель колебаний внутри цикла, которая отличается от таковой у женщин старшего возраста (17). Также были выявлены циркадные колебания уровней АМГ в сыворотке крови (18).
Эти колебания AMH в течение естественного цикла ранее приписывались аналитическим вариациям, вызванным различными условиями, используемыми для хранения образцов и / или методом анализа (19). Но теперь AMH можно анализировать с помощью полностью автоматизированных анализов AMH, которые являются высокочувствительными и точными, с широким линейным диапазоном (20), что позволяет более эффективно обрабатывать образцы и сокращать возможные процедурные ошибки (20–22).
В настоящее время широко распространено мнение, что единичное измерение АМГ является точным отражением овариального резерва пациента, и врачи серьезно учитывают этот результат при консультировании женщин по поводу их репродуктивного здоровья. В свете недавних публикаций, демонстрирующих вариабельность AMH как на протяжении менструального цикла, так и между последовательными циклами, возникают вопросы относительно того, будет ли надежным единичное измерение AMH. Целью этого исследования было изучить уровни АМГ в сыворотке у здоровых женщин, ведущих велосипедный спорт, с использованием полностью автоматизированного анализа Elecsys AMH (Roche, для Cobas 601, платформа ) в определенные моменты времени естественного цикла и краткосрочные. межцикловые вариации.
Материалы и методы
Субъекты
Двадцать два здоровых добровольца были включены в это исследование, которое проводилось с апреля по декабрь 2017 года в клинике IVIRMA в Абу-Даби. В исследование были включены женщины в возрасте от 18 до 38 лет, с регулярным менструальным циклом от 28 до 32 дней и ИМТ от 18 до 28 кг / м2. Критерии исключения включали следующие факторы: прием гормональных контрацептивов в течение как минимум 2 месяцев непосредственно перед началом исследования, беременность, кормление грудью и предыдущие состояния, которые могут отрицательно повлиять на резерв яичников (операция на яичниках, химиотерапия, облучение органов малого таза).В исследование не вошли добровольцы с бесплодием. Участники заполнили письменную анкету, включая характер менструального цикла, предыдущие беременности, роды и выкидыши, этническую принадлежность, курение и возможные критерии исключения. Они были проинформированы о методах, обработке образцов и целях исследования, и все они подписали информированное согласие.
Забор крови
Образцы крови были взяты путем венепункции в клинике с 8:00 до 14:00, после чего образцы были немедленно переданы в лабораторию, расположенную в том же центре, для немедленной обработки и дальнейшего анализа.Во время естественного цикла образцы собирали на 2/3 день (AMH_01), 10 день (средняя фолликулярная фаза, AMH_MFP), день подъема ЛГ (AMH_LHR), средняя лютеиновая фаза (AMH_MLP) и 2/3 день последующей менструация (AMH_02). Всплеск ЛГ был определен для целей нашего исследования как начавшийся, когда концентрация ЛГ поднялась на 180% по сравнению с последним значением сыворотки, доступным у этого пациента, и продолжала расти после этого (23). Для этого контролировали уровень ЛГ, эстрадиола и прогестерона, начиная с 10-го дня естественного цикла, а затем каждые 3 дня до тех пор, пока не был диагностирован всплеск ЛГ (24, 25).Лютеиновая фаза была подтверждена повышенным уровнем прогестерона в сыворотке (> 3 нг / мл) через 8 дней после всплеска ЛГ.
Каждый раз брали один образец крови объемом 5 мл. Кровь центрифугировали и сыворотку разделяли на две части: одну для анализа AMH и одну для анализа гонадотропинов и стероидных гормонов. Анализ на ФСГ, ЛГ, эстрадиол и прогестерон проводили с использованием конкурентного иммуноанализа, производимого Roche, на платформе Cobas 601 ® . Результаты для этих гормонов были получены и оценены в тот же день сбора крови.Образцы сыворотки для AMH были разделены на аликвоты, заморожены при -20 ° C в тот же день сбора и сохранены для анализа партии. Все образцы от каждого участника исследования были проанализированы в одинаковых условиях в один и тот же день с использованием автоматического анализа Elecsys ® AMH (для платформы Cobas 601, Roche ® ) в соответствии с инструкциями производителя. Ожидаемая погрешность анализа составляла <5%, как описано производителем; Коэффициент вариации внутри анализа и между анализами для автоматизированного анализа Elecsys ® AMH был зарегистрирован как 0.5–1,4 и 0,7–1,9% соответственно (26).
Статистический анализ
База данных исследований была создана для всех оцениваемых переменных. Данные экспорта были правильно анонимизированы и проанализированы с помощью SPSS 22.0.
Демографические переменные и гормональные показатели были суммированы со средним значением и стандартным отклонением. Чтобы описать гормоны и их динамику, мы каждый раз определяли среднее значение и стандартное отклонение и представляли его в виде диаграмм. Кроме того, мы выполнили полиномиальную интерполяцию для динамических значений и представили вариации со средней полиномиальной интерполяцией и полосой дисперсии.
значения AMH были представлены для динамического описания AMH с использованием 4-ступенчатой полиномиально-экспоненциальной интерполяции данных. Эта полиномиально-экспоненциальная интерполяция также использовалась для вменения недостающих данных (10 недостающих точек данных). Пациенты не были разделены на категории в соответствии с исходным AMH, поскольку ранее нельзя было предположить однородную вариабельность в кластерных группах.
Тест корреляции Пирсона был проведен между значениями AMH и другими гормонами вместе с временными отметками, а кластерный анализ был проведен для корреляции между динамическими паттернами AMH и демографическими параметрами.Для оценки любых динамических паттернов AMH, связанных с демографическими параметрами, мы применили кластерный анализ по коэффициентам полинома AMH, которые были рассчитаны ранее. Статистически значимым считалось значение p 0,05.
Этическое разрешение
Исследование было одобрено внутренним этическим комитетом под номером REFA011 и зарегистрировано на сайте clinic.trials.gov: NCT03106272.
Результаты
Всего было проанализировано 100 образцов от 22 женщин со средним возрастом 30 лет.7 ± 4,11 года и ИМТ 23,2 ± 3,63 кг / м 2 (таблица 1). Все образцы были проанализированы с помощью автоматического анализа Elecsys ® AMH для платформы Cobas 601 (Roche ® ).
Таблица 1 . Исходные характеристики участников.
Внутрицикловые и межцикловые вариации
Значения сывороточных концентраций АМГ, полученные во время различных фаз менструального цикла, показаны в Таблице 2, а колебания, представленные в уровнях АМГ для каждой участницы, представлены на Рисунке 1.Для каждого участника было обнаружено значительное продольное колебание уровней АМГ, выраженное как коэффициент вариации (CV) внутри цикла 20,7%. Это было рассчитано для всех индивидуальных показаний за день цикла (CV = среднее значение 0,207 ± SD 0,143; [CI95: 0,148, 0,267]; тест Шапиро = 0,0016). Для этих вариаций не наблюдалось никакой картины колебаний.
Таблица 2 . Значения AMH, полученные каждый день измерения для всех 22 участников, включая среднее, минимальное и максимальное значение.
Рисунок 1 . Представление значений AMH с использованием полиномиально-экспоненциальной интерполяции данных для каждого пациента в каждый момент времени. AMH_01: 2/3 день цикла. AMH_MFP: 10 день цикла, средняя фолликулярная фаза. AMH_LHR: день подъема LH. AMH_MLP: 8-й день после подъема ЛГ, середина лютеиновой фазы. AMH_02: 2/3 день последующего цикла.
При сравнении результатов между 2/3 днями цикла в обоих последовательных циклах средняя абсолютная межцикловая вариация АМГ составила 0,75 нг / мл с диапазоном от 0.03 до 2,81 нг / мл. Межцикловая CV составляла 0,28 (CI95: 0,16-0,39; p <0,0001). Следовательно, у наших участниц наблюдалась 28% разница между значениями АМГ, измеренными на 2/3 день двух последовательных менструаций.
Среднее значение AMH, полученное в каждый день измерения для всех 22 участников, значительно варьируется в течение цикла, как показано данными в Таблице 2, а также на графике прямоугольной диаграммы (Рисунок 2), где колебания внутри цикла показаны межцикловые вариации.
Рисунок 2 . Коробчатая диаграмма значений AMH, полученных в каждый момент времени. Линия в середине поля, представляющая медианное значение AMH. Прямоугольник, представляющий 25 и 75% квартиль. Верхние усы простираются от петли до наибольшего значения не дальше 1,5 * IQR (межквартильный диапазон). Нижний ус простирается от петли до самого низкого значения. AMH_01: 2/3 день цикла. AMH_MFP: 10 день цикла, средняя фолликулярная фаза. AMH_LHR: день подъема LH. AMH_MLP: 8-й день после подъема ЛГ, середина лютеиновой фазы.AMH_02: 2/3 день последующего цикла.
Другие репродуктивные гормоны, связанные с изменчивостью АМГ.
Все значения гормонов для АМГ, ФСГ, ЛГ, эстрадиола и прогестерона показаны в таблице 3. Никакой корреляции между АМГ и ФСГ, эстрадиолом и прогестероном не наблюдалось ни в какой момент измерений. Однако была обнаружена значимая положительная корреляция между концентрациями LH_LHR и AMH ( t -значение: 5,962; p <0,0001).
Таблица 3 .Значения AMH, FSH, LH, E2 и P4, полученные каждый день измерения для всех 22 участников.
Обсуждение
Одним из преимуществ AMH по сравнению с другими показателями резерва яичников, такими как фолликулостимулирующий гормон (ФСГ), является то, что он, как считается, имеет минимальные вариации в течение менструального цикла, и, как результат, его можно тестировать в любой день цикл. Однако исследования, оценивающие стабильность уровней АМГ на протяжении менструального цикла, противоречивы и трудны для интерпретации из-за различий в используемых анализах.Текущее исследование четко продемонстрировало статистически значимое изменение уровней АМГ в сыворотке крови с использованием полностью автоматизированного анализа АМГ во время спонтанного менструального цикла в группе здоровых женщин репродуктивного возраста. Этот результат согласуется с другими предыдущими исследованиями (27–30), некоторые из которых выявили особую закономерность изменения с максимальным уровнем АМГ в среднефолликулярной фазе, снижающимся во время овуляции с повторным повышением лютеиновой кислоты. фаза (16, 28, 29, 31). Было высказано предположение, что этот паттерн отражает роль АМГ в росте фолликулов (32).Текущий анализ показал, что женщины, независимо от их яичникового резерва, демонстрировали статистически значимые внутри- и межцикловые вариации АМГ, однако четкую картину колебаний выявить не удалось. Примечательно, что во время повышения уровня ЛГ наблюдалась значительная положительная ко-вариация между уровнями АМГ и ЛГ в сыворотке. Эта связь между уровнями ЛГ и АМГ была также описана Bungum et al. (18), когда они исследовали циркадные вариации сывороточного АМГ. Эта корреляция между обоими гормонами указывает на совместный регуляторный механизм между AMH и секрецией LH, что подтверждается недавним обнаружением рецепторов AMH в значительной подгруппе центральных нейронов GnRH у мышей и людей (33), что должно стимулировать дальнейшие исследования.
Для включенных женщин значения АМГ варьировались на 20,7% на протяжении всего цикла от первого анализа сыворотки, полученного в начале цикла, до 2/3 дня последующих менструаций. Эти колебания AMH более чем в три раза превышают ожидаемые значения, связанные с неточностью анализа (<5% ожидаемая погрешность анализа для автоматизированного анализа Elecsys ® AMH) и, следовательно, могут отражать биологические колебания. Внутрииндивидуальные вариации также были продемонстрированы с использованием различных анализов сывороточного анализа (34).
На сегодняшний день данные о вариабельности АМГ в течение менструального цикла противоречивы (19). Некоторые из этих расхождений могут быть объяснены включением ановуляторных циклов, нечастого взятия проб крови, обработки образцов или вмешательства в анализ. В связи с этим настоящее исследование имеет несколько сильных сторон. Все образцы крови каждого испытуемого были проанализированы за один проход в один и тот же день на одной платформе Cobas Elecsys, что снизило аналитическую изменчивость и искажающие факторы. В будущих исследованиях можно рассмотреть возможность повторения анализа образцов на отдельной платформе Cobas Elecsys для проверки качества.Еще одним важным преимуществом является то, что в среднем 4,5 образца на участника были проанализированы в течение естественного цикла, и овуляция была подтверждена путем измерения сывороточных концентраций ЛГ и прогестерона в лютеиновой фазе во всех циклах, что позволило избежать низкой точности анализов мочи для выявления овуляции. Кроме того, в этом исследовании для анализа образцов использовался полностью автоматизированный анализ AMH, который, как ранее было показано, имеет низкую аналитическую вариабельность во всем диапазоне анализа (22, 35). Все образцы были получены утром или ранним днем, чтобы избежать возможных циркадных колебаний (18).Однако количество участников нашего исследования ограничено.
Выявленные внутрицикловые вариации у здоровых женщин аналогичны данным, опубликованным Hadlow et al., Которые выявили средние внутрииндивидуальные вариации концентрации АМГ в 20% (комбинированные аналитические и биологические) у бесплодных женщин с овуляторными циклами в течение учебный период 3 цикла (16). Напротив, участники настоящего исследования представляют собой репрезентативную выборку женщин репродуктивного возраста с овуляторными циклами.Кроме того, за более короткий период времени (один овуляторный цикл) были выявлены значительные внутрииндивидуальные вариации. Степень AMH-вариации в текущем анализе выше, чем ранее описанная Lambert-Messerlian, который пришел к выводу, что, несмотря на вариацию на 16% в течение всего цикла, сбор образцов может быть выполнен в любой день для оценки резерва яичников (15). Вариабельность более 20% при полностью автоматизированном анализе AMH в настоящем исследовании должна быть напоминанием клиницистам о том, что забор образцов AMH в любой день менструального цикла может не адекватно отражать истинный резерв яичников.
Очевидно, что уровни АМГ колеблются не только внутри циклов, но и между циклами. В настоящем исследовании была выявлена межцикловая вариабельность 28% ( p <0,0001) между 2 последовательными циклами. Кроме того, 4 участника с уровнем АМГ <1,2 нг / мл на 2/3 день первого цикла (AMH_01) были бы классифицированы как имеющие низкий АМГ на основании Болонских критериев (36). Двое из этих четырех добровольцев показали нормальные уровни АМГ после повторной оценки на 2/3 день последовательного цикла (AMH_02).Эти различия в последовательных циклах могут быть отражением различий в количестве антральных фолликулов (AFC). Это также может отражать различный ответ яичников, который можно увидеть в клинической практике, несмотря на назначение одного и того же протокола лечения той же пациентке, но в другом цикле (37, 38). Это очень важный вывод, который может изменить текущую клиническую практику с точки зрения тестирования AMH. Межцикловая оценка сывороточного АМГ на 2/3 день, безусловно, заслуживает дальнейшего изучения.
В то время как реальный запас яичников может не изменяться в течение естественного цикла или между последовательными циклами, уровни АМГ в сыворотке изменяются из-за биологических вариаций и, кроме того, необычных изоформ АМГ, которые также были описаны (39).Понятно, что молекулу АМГ нелегко определить количественно. Однако важные клинические решения часто основываются на одной случайной записи AMH, даже на дозе гонадотропинов, назначаемой в циклах ЭКО / ИКСИ (34).
Предыдущие публикации показали, что измерение АМГ, проводимое в течение первых нескольких дней цикла, хорошо коррелирует с ответом яичников на стимуляцию (базальный АМГ) (7, 8). Кроме того, перед консультированием женщин относительно их репродуктивного здоровья и результатов стимуляции яичников рекомендуется комбинированная оценка сывороточного АМГ и ультразвуковой оценки количества антральных фолликулов (AFC) в течение первых дней менструального цикла (8, 40).Комбинируя оба маркера яичников, AMH и AFC на 1-3 день цикла, врачи смогут с большей точностью определить развивающиеся фолликулы, которые, как ожидается, будут расти дальше после гормональной стимуляции. Это позволит клиницистам назначать наиболее подходящую дозу гонадотропинов для стимуляции яичников в любом заданном цикле, предлагая еще более индивидуализированное лечение.
Таким образом, это исследование ясно продемонстрировало значительные внутрицикловые и межцикловые вариации концентраций АМГ в сыворотке на протяжении естественных овуляторных циклов и между двумя последовательными менструациями с использованием полностью автоматизированного анализа АМГ.Основываясь на этих результатах, можно поставить под сомнение текущую клиническую практику использования одного случайного измерения АМГ для определения резерва яичников.
Авторские взносы
Авторы, перечисленные в этой рукописи, внесли значительный вклад в концепцию и дизайн исследования, сбор и интерпретацию данных, а также в составление / редактирование рукописи. Все окончательно одобрили версию для публикации.
Заявление о конфликте интересов
В настоящее время авторов работает в ИВИРМА.LM, BL, JS, EA, CC и HF в IVIRMA на Ближнем Востоке — ОАЭ и AN в фонде IVI — IVIRMA Валенсия (Испания).
Благодарности
Мы благодарим госпожу Елисавет Кампери за сбор данных.
Список литературы
1. Monniaux D, Clément F, Dalbiés Tran R, Estienne A, Fabre S, Mansanet C, et al. Яичниковый резерв примордиальных фолликулов и динамический резерв антральных фолликулов: какая связь? Biol Reprod. (2014) 90: 1–11. DOI: 10.1095 / биолрепрод.113.117077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Dewailly D, Andersen CY, Balen A, Broekmans F, Dilaver N, Fanchin R, et al. Физиология и клиническое применение антимюллерова гормона у женщин. Обновление репродукции человека (2014) 20: 370–85. DOI: 10.1093 / humupd / dmt062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Кевенаар М.Э., Меерасахиб М.Ф., Крамер П., ван де Ланг-Борн Б.М., де Йонг Ф.Х., Грум Н.П. и др. Уровни антимюллерова гормона в сыворотке крови отражают размер пула примордиальных фолликулов у мышей. Эндокринология (2006) 147: 3228–34. DOI: 10.1210 / en.2005-1588
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Ла Марка А., Минаси М.Г., Сигинолфи Дж., Греко П., Ардженто С., Гризенди В. и др. Женский возраст, сывороточный уровень анти-мюллерова гормона и количество ооцитов влияют на скорость и количество эуплоидных бластоцист в циклах оплодотворения in vitro / интрацитоплазматической инъекции сперматозоидов. Fertil Steril. (2017) 108: 777–83. DOI: 10.1016 / j.fertnstert.2017.08.029
CrossRef Полный текст | Google Scholar
5. Tarasconi B, Tadros T., Ayoudi JM, Belloc S, de Ziegler, Fanchin R. Сывороточные уровни антимюллерова гормона независимо связаны с частотой выкидышей после оплодотворения in vitro — переноса эмбриона. Fertil Steril. (2017) 108: 518–24. DOI: 10.1016 / j.fertnstert.2017.07.001
CrossRef Полный текст | Google Scholar
6. La Marca A, Grisendi V, Griesinger G. Насколько сильно АМГ действительно различается у нормальных женщин? Int J Endocrinol. (2013) 2013: 959487. DOI: 10.1155 / 2013/959487
CrossRef Полный текст | Google Scholar
7. Ли JR, Ким SH, Ким SM, Jee BC, Ku SY, Suh CS и др. Динамика антимюллерова гормона во время контролируемой гиперстимуляции яичников и оптимальное время измерения для прогнозирования исхода. Hum Reprod. (2010) 25: 2597–604. DOI: 10.1093 / humrep / deq204
CrossRef Полный текст | Google Scholar
8. Меладо Л., Фернандес-Нисталь А, Мартинес В., Верду В., Бруна I, Бахо Дж. М..Динамика антимюллеровских гормонов во время короткого протокола GNRH-антагонистов для ЭКО / ИКСИ у женщин с различным уровнем яичникового резерва. Минерва Гинекол. (2017) 69: 128–34. DOI: 10.23736 / S0026-4784.16.03951-4
CrossRef Полный текст | Google Scholar
9. Hehenkamp WJ, Looman CW, Themmen AP, de Jong FH, Te Velde ER, Broekmans FJ, et al. Уровни антимюллерова гормона в спонтанном менструальном цикле не подвержены значительным колебаниям. J Clin Endocrinol Metab. (2006) 91: 4057–63. DOI: 10.1210 / jc.2006-0331
CrossRef Полный текст | Google Scholar
10. Илиодромити С., Келси Т.В., Ву О., Андерсон Р.А., Нельсон С.М. Прогностическая точность антимюллерова гормона для живорождения после искусственного оплодотворения: систематический обзор и метаанализ литературы. Hum. Репродукция обновления (2014) 20: 560–70. DOI: 10.1093 / humupd / dmu003
CrossRef Полный текст | Google Scholar
11. Цепелидис С., Деврекер Ф., Демеэстер И., Флахаут А., Герви С., Энглерт Ю.Стабильные уровни антимюллерова гормона в сыворотке крови во время менструального цикла: проспективное исследование у женщин с нормоовуляцией. Hum Reprod. (2007) 22: 1837–40. DOI: 10.1093 / humrep / dem101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Ван Дисселдорп Дж., Ламбалк С.Б., Кви Дж., Луман К.В., Эйкеманс М.Дж., Фаузер Б.К. и др. Сравнение межцикловой и внутрицикловой вариабельности антимюллерова гормона и количества антральных фолликулов. Hum Reprod. (2010) 25: 221–7.DOI: 10,1093 / humrep / dep366
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Gorkem U, Kucukler FK, Togrul C, Gungor T. Антимюллеровы гормоны сильно различаются у бесплодных женщин с разными типами резерва яичников. Aust N Z J Obstet Gynaecol. (2017) 57: 464–8. DOI: 10.1111 / ajo.12625
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Ламберт-Мессерлиан Г., Планте Б., Эклунд Э., Рейкер С., Мур Р. Уровни антимюллерова гормона в сыворотке крови во время нормального менструального цикла. Fertil Steril. (2016) 105: 208–13. DOI: 10.1016 / j.fertnstert.2015.09.033
CrossRef Полный текст | Google Scholar
16. Хэдлоу Н., Браун С.Дж., Хабиб А., Уордроп Р., Джозеф Дж., Джиллетт М. и др. Количественная оценка индивидуальных вариаций антимюллерова гормона в яичниковом цикле. Fertil Steril. (2016) 106: 1230–7. DOI: 10.1016 / j.fertnstert.2016.06.009
CrossRef Полный текст | Google Scholar
17. Овербек А., Брукманс Ф. Дж., Хехенкамп В. Дж..Внутрицикловые колебания антимюллерова гормона у нормальных женщин с регулярным циклом: повторный анализ. Reprod Biomed Online (2012) 24: 664–9. DOI: 10.1016 / j.rbmo.2012.02.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Бунгум Л., Якобссон А. К., Розен Ф., Беккер С., Беккер С., Идинг Андерсен С., Гюнер Н. и др. Циркадные колебания концентрации антимюллерова гормона у регулярно менструирующих женщин: зависимость от возраста, уровня гонадотропинов и половых стероидов. Hum Reprod. (2011) 26: 678–84. DOI: 10.1093 / humrep / deq380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Рустамов О., Смит А., Робертс С.А., Йейтс А.П., Фицджеральд С., Кришнан М. и др. Измерение антимюллерова гормона: критическая оценка. J Clin Endocrinol Metab. (2014) 99: 723–32. DOI: 10.1210 / jc.2013-3476
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Deeks E. Elecsys® AMH Assay: обзор количественной оценки антимюллерова гормона и оценки овариального резерва. Mol Diagn Ther. (2015) 19: 245–9. DOI: 10.1007 / s40291-015-0156-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Анкаерт Э., Октем М., Тис А., Коэн-Бакри М., Даан Н., Шьеттекатт Дж. И др. Многоцентровая аналитическая оценка эффективности полностью автоматизированного анализа антимюллерова гормона и определение референтного интервала. Clin Biochem. (2016) 49: 260–7. DOI: 10.1016 / j.clinbiochem.2015.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Fatemi HM, Kyrou D, Bourgain C, Van den Abbeel E, Griesinger G, Devroey P. Перенос замороженных и размороженных человеческих эмбрионов: спонтанный естественный цикл превосходит естественный цикл, индуцированный хорионическим гонадотропином человека. Fertil Steril. (2010) 94: 2054–8. DOI: 10.1016 / j.fertnstert.2009.11.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Park SJ, Goldsmith L, Skurnick J, Wojtczuk A, Weiss G. Характеристики выброса лютеинизирующего гормона в моче у молодых овуляторных женщин. Fertil Steril. (2007) 88: 684–90. DOI: 10.1016 / j.fertnstert.2007.01.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Direito A1, Bailly S, Mariani A, Ecochard R. Взаимосвязь между выбросом лютеинизирующего гормона и другими характеристиками менструального цикла у нормально овулирующих женщин. Fertil Steril. (2013) 99: 279–85. DOI: 10.1016 / j.fertnstert.2012.08.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Ли HWR, Вонг BPC, Ip WK, Yeung WSB, Ho PC, Ng EHY. Сравнительная оценка трех новых коммерческих иммуноанализов для измерения антимюллерова гормона. Репродукция Человека. (2016) 31: 2796–802. DOI: 10.1093 / humrep / dew248
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Соуэрс М., МакКоннелл Д., Гаст К., Чжэн Х., Нан Б., Маккарти Д. Д. и др. Изменчивость антимюллерова гормона и ингибина B во время нормальных менструальных циклов. Fertil Steril. (2010) 94: 1482–6.DOI: 10.1016 / j.fertnstert.2009.07.1674
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Cook CL, Siow Y, Taylor S, Fallat M. Уровни вещества, ингибирующего мюллеров, в сыворотке во время нормальных менструальных циклов. Fertil Steril . (2000) 73: 859–61. DOI: 10.1016 / S0015-0282 (99) 00639-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Вундер Д.М., Берсингер Н.А., Яред М., Кречмер Р., Биркхойзер М.Х. Статистически значимые изменения уровней антимюллерова гормона и ингибина во время физиологического менструального цикла у женщин репродуктивного возраста. Fertil Steril. (2008) 89: 927–33. DOI: 10.1016 / j.fertnstert.2007.04.054
CrossRef Полный текст | Google Scholar
30. Кисселл К.А., Данахер М.Р., Шистерман Э.Ф., Вактавски-Венде Дж., Аренс К.А., Шлип К. и др. Биологическая вариабельность сывороточного антимюллерова гормона на протяжении менструального цикла в овуляторных и спорадических ановуляторных циклах у женщин с эуменореей. Hum Reprod. (2014) 29: 1764–72. DOI: 10.1093 / humrep / deu142
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Рэндольф Дж.Ф., Харлоу С.Д., Хельмут М.Э., Чжэн Х., МакКоннелл Д.С. Обновленные анализы на ингибин B и AMH предоставляют доказательства регулярной эпизодической секреции ингибина B, но не AMH в фолликулярной фазе нормального менструального цикла. Hum Reprod. (2014) 29: 592–600. DOI: 10.1093 / humrep / det447
CrossRef Полный текст | Google Scholar
32. Грасиа С., Шин С., Превитт М., Чемберлин Дж., Лофаро Л., Джонс К. и др. Многоцентровая клиническая оценка анализа Access AMH для определения уровней AMH у женщин репродуктивного возраста во время нормальных менструальных циклов. J Assist Reprod Genet. (2018) 35: 777–83. DOI: 10.1007 / s10815-018-1141-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Чимино И., Касони Ф., Лю X, Мессина А., Паркаш Дж., Джамин С.П. и др. Новая роль антимюллерова гормона в регуляции возбудимости нейронов ГнРГ и секреции гормонов. Нац Коммуна . (2016) 12: 10055. DOI: 10.1038 / ncomms10055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Bungum L, Tagevi J, Jokubkiene L., Bungum M, Giwercman A, Macklon N и др. Влияние биологической изменчивости или производительности анализа на измерения AMH: проспективное когортное исследование с AMH, протестированным на трех аналитических платформах. Фронт эндокринол. (2018) 9: 603. DOI: 10.3389 / fendo.2018.00603
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Андерсон Р.А., Анкаерт Э., Бош Э., Дьюайли Д., Данлоп С.Е., Фер Д. и др. Перспективное исследование ценности автоматизированного анализа антимюллерова гормона Elecsys для оценки пула растущих фолликулов яичников. Fertil Steril. (2015) 103: 1074–80. DOI: 10.1016 / j.fertnstert.2015.01.004
CrossRef Полный текст | Google Scholar
36. Ферраретти А.П., Ла Марка А., Фаузер BC, Тарлатзис Б., Наргунд Дж., Джанароли Л. Консенсус ESHRE по определению «плохого ответа» на стимуляцию яичников при оплодотворении in vitro : Болонские критерии. Hum Reprod. (2011) 26: 1616–24. DOI: 10.1093 / humrep / der092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Rombauts L, Onwude JL, Chew HW, Vollenhoven BJ. Прогностическая ценность количества антральных фолликулов остается неизменной на протяжении менструального цикла. Fertil Steril. (2011) 96: 1514–8. DOI: 10.1016 / j.fertnstert.2011.09.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Rombauts L, Lambalk CB, Schultze-Mosgau A, van Kuijk J, Verweij P, Gates D, et al. Межцикловая вариабельность ответа яичников у пациентов, подвергающихся повторной стимуляции корифоллитропином альфа в протоколе антагонистов гонадотропин-рилизинг-гормона. Fertil Steril. (2015) 104: 884–90. DOI: 10.1016 / j.fertnstert.2015.06.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Робертсон Д.М., Кумар А., Калра Б., Шах С., Пруйзерс Е., Ванден Бринк Х. и др. Обнаружение в сыворотке крови антимюллерова гормона у женщин, приближающихся к менопаузе, с помощью чувствительных иммуноферментных анализов, связанных с антимюллеровым гормоном. Менопауза (2014) 12: 1277–86. DOI: 10.1097 / GME.0000000000000244
CrossRef Полный текст | Google Scholar
40.Меладо Л., Лоуренс Б., Бунгум Л., Фатеми Х.М. Вариабельность антимюллерова гормона во время стимуляции яичников для ЭКО: новый подход к прогнозированию результатов лечения бесплодия. J Reprod Biol Endocrinol. (2018) 2: 33–4.
Google Scholar
Роль антимюллерова гормона и тестостерона в росте фолликулов: перекрестное исследование | BMC Endocrine Disorders
Описание образца исследования
Как показано на рис. 1, с апреля 2016 года по март 2019 года в исследование были включены 3487 женщин, обследованных на AMH и половые гормоны.Одна тысяча двести двадцать один случай был исключен, потому что тест на половые гормоны не проводился на ранней стадии фолликула. Позже 149 случаев были исключены из-за кисты яичников, гиперпролактинемии, злокачественных заболеваний, операций, гипофизомы и сахарного диабета. Наконец, 2117 женщин остались для дальнейшего анализа корреляции, включая 68 СПКЯ и 56 эндометриоз.
Характеристики исследуемой популяции представлены в таблице 1. В группе DOR были более высокие средний возраст, вес и ИМТ ( P <0.001). В группе СПКЯ средний возраст был значительно ниже в группе СПКЯ, чем в контрольной группе, а средний вес, ИМТ и АМГ были значительно выше (P <0,001). Не было разницы в росте, уровнях FPG и FPI ( P > 0,05).
Таблица 1 Характеристики включенных субъектовКорреляция между демографическими характеристиками, половыми гормонами и AMH
Тест Пирсона был проведен для исследования корреляции между демографическими характеристиками, гонадотропинами, стероидами яичников и AMH.Как показано на рис. 2a и d, в общей популяции возраст (R = -0,457, P <0,001) и ФСГ (R = -0,310, P <0,001) умеренно и умеренно отрицательно коррелировали с AMH. Между тем, ЛГ (R = 0,307, P <0,001) и T (R = 0,346, P <0,001) слабо коррелировали с AMH положительно (рис. 2e и i). Наблюдалась слабая отрицательная корреляция между весом (R = - 0,050, P = 0,021), ИМТ (R = — 0,058, P = 0,008), E 2 (R = — 0,052, P = 0.017) и AMH (рис. 2б, в, ж). Корреляции между PRL, P, ростом и AMH не было ( P > 0,01).
Рис. 2Корреляция между уровнем АМГ и демографическими характеристиками и половыми гормонами. АМГ: антимюллеров гормон. ИМТ: индекс массы тела. ФСГ: фолликулостимулирующий гормон. ЛГ: лютеинизирующий гормон. ПРЛ: пролактин. E 2 : эстрадиол. П: прогестерон. Т: тестостерон. * P <0,05
Поскольку корреляционный анализ Пирсона показал, что возраст, вес, ИМТ, ФСГ, ЛГ, E 2 и T коррелировали с AMH, для дальнейшего изучения взаимосвязи были выполнены множественные линейные регрессионные анализы с пошаговыми анализами. между этими показателями и AMH.Результаты показали, что в контрольной группе значительный вклад в прогнозирование сывороточного АМГ вносили возраст, ФСГ, ЛГ, E 2 и T, но не вес и ИМТ (таблица 2). Возраст, ФСГ и E 2 отрицательно коррелировали с АМГ, а ЛГ и Т положительно коррелировали с АМГ ( P <0,001).
Таблица 2 Корреляция демографических характеристик, половых гормонов и АМГ по множественной линейной регрессииДемографические характеристики и половые гормоны в группе DOR
Возраст был значительно старше в группе DOR по сравнению с контролем (рис.3а). Поскольку в этом исследовании DOR был диагностирован с отсечкой AMH, уровень AMH в группе DOR был намного ниже, чем в контрольной группе (рис. 3b). Вес и ИМТ показали небольшое увеличение в группе DOR ( P <0,05) (рис. 3c и d). Для гормонов гипофиза уровень ФСГ значительно увеличился в группе DOR, в то время как LH и PRL существенно не изменились между двумя группами ( P > 0,05) (рис. 3e, f и g). Для стероидов яичников значительное увеличение E 2 и значительное снижение T наблюдалось в группах DOR по сравнению с контролем (рис.3h, h и j).
Рис. 3Демографические характеристики и половые гормоны в группах NOR, DOR и PCOS. НОР: нормальный овариальный резерв. ДОР: снижение овариального резерва. СПКЯ: синдром поликистозных яичников. ИМТ: индекс массы тела. ФСГ: фолликулостимулирующий гормон. ЛГ: лютеинизирующий гормон. ПРЛ: пролактин. E 2 : эстрадиол. П: прогестерон. Т: тестостерон. * P <0,05
Демографические характеристики и половые гормоны в группе СПКЯ
Возраст был значительно ниже в группе СПКЯ по сравнению с контролем (рис.3а). Как показано на рис. 3b, средний уровень АМГ почти удвоился в группе с СПКЯ по сравнению с контрольной группой (6,93 ± 3,84 против 4,08 ± 3,00, P <0,05). Уровни веса и ИМТ показали значительное увеличение в группе с СПКЯ по сравнению с контролем (рис. 3c и d). Что касается гормонов гипофиза, уровень ЛГ значительно увеличился в группе с СПКЯ, а уровни ФСГ и ПРЛ были одинаковыми между двумя группами (рис. 3e, f и g). Для гормонов яичников уровень T показал значительное повышение в группе СПКЯ по сравнению с контролем, а вариации E 2 и P были незначительными (рис.3h, i и j).
Логистическая регрессия групп DOR и PCOS
Для анализа прогнозов DOR по возрасту, весу, ИМТ, ФСГ, E 2 и T. Возраст, вес, ФСГ, E 2 использовали бинарную логистическую регрессию с прямым методом. и T, но не BMI, были значимыми факторами, которые независимо предсказывали вероятность DOR. В модели логистической регрессии, скорректированной с учетом возраста, веса, ФСГ и E 2 , повышение уровня Т на один нмоль / л было связано со снижением в 0,60 раза (95% ДИ: 0.42–0,87, P = 0,007) риск DOR (таблица 3).
Таблица 3 Взаимосвязь AMH, демографических характеристик и половых гормонов у пациентов с DOR и PCOS с использованием логистической регрессииБинарная логистическая регрессия с прямым методом использовалась для анализа прогнозов на PCOS по возрасту, весу, ИМТ, AMH, FSH, LH и Т. Возраст, ИМТ, АМГ, ЛГ и Т, но не вес и ФСГ, были значимыми факторами, которые независимо предсказывали вероятность СПКЯ. В модели логистической регрессии с поправкой на возраст, ИМТ, АМГ и ЛГ повышение уровня тестостерона на один нмоль / л было связано с 1.В 54 раза увеличился (95% ДИ: 1,06–2,24, P = 0,025) риск СПКЯ (таблица 3).
500183: Антимюллеров гормон (AMH) (эндокринные науки)
Американский колледж акушеров и гинекологов. Комитет по гинекологической практике. Мнение Комитета № 618: Тестирование яичникового резерва. Акушерский гинекол. 2015 Янв; 125 (1): 268-273. 25560143
Broer SL, Broekmans FJ, Laven JS, Fauser BC. Антимюллеров гормон: тестирование яичникового резерва и его потенциальные клинические последствия. Обновление Hum Reprod. 2014 сентябрь-октябрь; 20 (5): 688-701. 24821925
Fleming R, Broekmans F, Calhaz-Jorge C, et. al. Можно ли использовать концентрации антимюллерова гормона для определения дозы гонадотропина и протокола лечения для стимуляции яичников? Reprod Biomed Online. 2013 Май; 26 (5): 431-439. 23507133
Gleicher N, Weghofer A, Barad DH. Антимюллеров гормон (АМГ) определяет, независимо от возраста, низкие или хорошие шансы на рождение живого ребенка у женщин с сильно уменьшенным овариальным резервом. Fertil Steril. 2010 Dec; 94 (7): 2824-2827. 20538269
Карканаки А., Воснакис С., Панидис Д. Клиническое значение оценки антимюллерова гормона в гинекологической эндокринологии. Гормоны (Афины). , апрель-июнь 2011 г .; 10 (2): 95-103. 21724534
La Marca A, Broekmans FJ, Volpe A, Fauser BC, Macklon NS; Специальная группа ESHRE по репродуктивной эндокринологии — круглый стол AMH. Антимюллеров гормон (АМГ): что нам еще нужно знать? Hum Reprod. сентябрь 2009 г .; 24 (9): 2264-2275. 19520713
La Marca A, Sighinolfi G, Radi D, et al. Антимюллеров гормон (АМГ) как прогностический маркер вспомогательных репродуктивных технологий (ВРТ). Обновление Hum Reprod. март-апрель 2010 г .; 16 (2): 113-130. 19793843
Ledger WL. Клиническая полезность измерения антимюллерова гормона в репродуктивной эндокринологии. J Clin Endocrinol Metab. 2010 Dec; 95 (12): 5144-5154. 21131535
van Disseldorp J, Faddy MJ, Themmen APN, et al.Связь концентрации антимюллерова гормона в сыворотке крови с возрастом в период менопаузы. J Clin Endocrinol Metab. 2008 июн; 93 (6): 2129-2134. 18334591
van Rooij IA, Broekmans FJ, Scheffer GJ, et al. Уровни антимуллеровых гормонов в сыворотке лучше всего отражают снижение репродуктивной функции с возрастом у здоровых женщин с доказанной фертильностью: продольное исследование. Fertil Steril. 2005; 83 (4): 979-987. 15820810
Тест на антимюллеровы гормоны — Fertility CARE
Широко распространено мнение, что уровни антимюллерова гормона (АМГ) являются хорошим определяющим фактором успеха или неудачи процедуры экстракорпорального оплодотворения (ЭКО) — но так ли это на самом деле? случай?
Марк П.Тролис, доктор медицины, директор отдела Fertility CARE: Центр ЭКО говорит, что фертильность у женщин имеет тенденцию к снижению с возрастом, а уровень АМГ значительно снижается после 35 лет. Это, в свою очередь, приводит к уменьшению объема яичников и количество антральных фолликулов значительно снижается.
«Предположение, что уровни AMH могут предсказать, способна ли женщина к зачатию или нет, не совсем точное, нет сомнений в том, что значения AMH часто используются для определения того, будет ли у женщины, проходящей лечение ЭКО, вероятность успеха выше», говорит докторТролис. «Некоторые женщины, кажется, думают, и некоторые клиники также поддерживают эту точку зрения, что тест AMH можно использовать для проверки потенциала фертильности женщины. Это совершенно неверно. На самом деле тест говорит нам о количестве оставшихся яиц ».
AMH — это вещество, вырабатываемое клетками гранулезы в фолликулах яичников. Гормон вырабатывается фолликулами размером от 5 до 7 мм. Уровень гормона может использоваться для прогнозирования реакции яичников на стимуляцию и полезен для настройки циклов ЭКО на основе результатов пациентов.
Рекомендации NICE по ЭКО предполагают, что уровень АМГ ниже или равный 5,4 пмоль / л (0,8 нг / мл) может предсказывать слабую реакцию на гиперстимуляцию яичников, но уровни выше или равные 25,0 пмоль / л (3,6 нг) / мл) с большей вероятностью дадут более успешные результаты. Чтобы определить уровни AMH, тест AMH все чаще используется при оценке фертильности. Тест AMH можно проводить в любой день месячного цикла женщины.Является ли тест AMH экраном для определения фертильности?
Многие считают, что уровень гормона AMH в крови может отражать объем яйцеклеток женщины.Однако уровни АМГ не дают никакой информации о качестве яиц и не могут дать четкого ответа о том, сможет ли женщина иметь ребенка или нет. Необязательно, что ЭКО у женщины с низким уровнем АМГ однозначно не удастся. Кроме того, результаты этого теста также не должны использоваться для исключения пар из попытки лечения ЭКО.
ТестAMH также часто сочетается с подсчетом антральных фолликулов (AFC), поскольку он сообщает медицинским работникам количество мелких фолликулов в обоих яичниках.Оба этих теста вместе могут помочь определить лучший стратегический маршрут для женщин, планирующих пройти лечение ЭКО.
Женщины старше 35 лет, желающие иметь ребенка, или те, кто еще не смог забеременеть и рассматривает возможность экстракорпорального оплодотворения, являются хорошими кандидатами для теста AMH, поскольку он является надежным предиктором резерва яичников. . Этот тест является частью стандартной оценки фертильности во многих клиниках и часто используется вместе с другими тестами, такими как определение уровня ФСГ, эстрадиола и антральных фолликулов.
Что означает уровень AMH для потенциальных родителей?
Хотя не существует 100-процентного предиктора способности женщины к зачатию, уровни АМГ можно интерпретировать следующим образом:
- Высокое (часто при СПКЯ) / Более 3,0 нг / мл
- Обычный классический учебник. / Более 1,0 нг / мл
- Низкий нормальный диапазон / 0,7 — 0,9 нг / мл
- Низкий / 0,3 — 0,6 нг / мл
- Очень низкий / менее 0,3 нг / мл
Что нужно помнить
- Уровни АМГ используются для оценки овариального резерва. Уровни АМГ
- полезны при определении протоколов стимуляции циклов ЭКО у женщин, подвергающихся лечению ЭКО. Уровень АМГ
- НЕ МОЖЕТ предсказать способность женщины к зачатию.
Тест AMH — это простой анализ крови, который можно использовать для определения вероятности того, что лечение ЭКО будет успешным у пар, пытающихся зачать ребенка.
«Тест на антимюллеровы гормоны существует уже, вероятно, пять или более лет, но сейчас он используется гораздо чаще, чем когда-либо прежде.Проблема в том, почему мы используем этот тест », — говорит д-р Тролис. «Мы используем тест, чтобы определить, как стимулировать женщину, которой будут вводить лекарство от бесплодия, и сколько яиц мы получим, если сделаем тест».
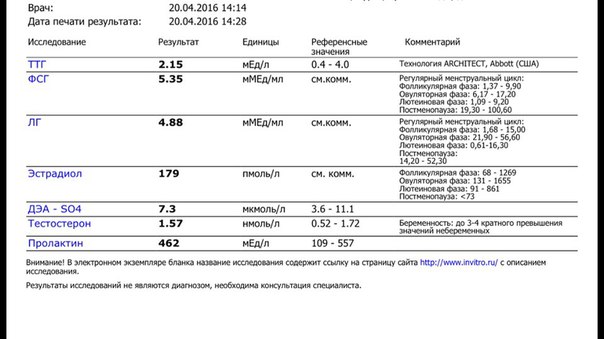
 [12]
[12] [19]
[19]