Для чего назначают электрофорез грудничкам: Физиотерпия на дому: электрофорез — Вирилис
зачем назначают, можно ли делать
Одной из составляющих комплексного лечения детских заболеваний является физиотерапия. Ее назначают при простудах, патологиях нервной и костной системы. Наиболее популярной процедурой считается электрофорез для грудничков.
Общие принципы
Этот неинвазивный способ (без повреждения тканей) введения лекарственных средств работает с помощью электрического тока малого заряда. Применяется для лечения и профилактики заболеваний нервной и костно-мышечной системы. Метод безболезненный и безопасный, лекарственное вещество действует в основном на определенную часть тела.
Электрофорез для грудничков назначается при лечении и реабилитации
Что это такое и как действует на организм малыша? Препарат наносят на прокладку, электрод или непосредственно на тело. Электроток приводит в движение ионы вещества. Они проникают вглубь кожи через потовые и сальные протоки, по лимфо- и кровотоку поступают к поврежденным органам и тканям.
- Активное вещество поступает непосредственно в пораженные ткани.
- Минимальное влияние химических соединений на организм.
- Снижение риска побочных явлений.
- Рефлекторное и иммуностимулирующее действие электротока.
Степень насыщения тканей лекарством зависит от концентрации действующего вещества, силы тока, продолжительности процедуры, особенностей кожи пациента.
Зачем назначают электрофорез
Метод наиболее востребован в педиатрии. Помогает излечить многие болезни даже у самых маленьких пациентов. Прием большинства лекарств им недоступен из-за малого возраста. Электрофорез оказывает обезболивающее и противовоспалительное действие, обладает успокаивающим и расслабляющим эффектом. В каких случаях назначают процедуру грудничкам и детям старшего возраста:
- патология шейного отдела позвоночника;
- повышенный или пониженный мышечный тонус;
- родовые травмы спины и головы;
- ДЦП;
- нарушения неврологического характера;
- при дисплазии ТБС;
- заболевания дыхательной системы;
- болезни ротовой полости и ЛОР органов;
- нарушение работы ЖКТ и мочевыводящей системы.

При пищевой аллергии у детей способ ввода незначительного количества лекарственных веществ с помощью электрофореза себя оправдывает и не приводит к возникновению побочных эффектов.
Физиотерапия оказывает расслабляющее действие, что улучшает состояние при заболеваниях верхних дыхательных путей — расслабляются мышцы бронхов, облегчается дыхание.
Техника проведения
Кожа младенцев отличается незрелостью, высокой всасывающей способностью и незначительным сопротивлением электротоку. Поэтому сила тока во время процедуры для детей до года составляет 0,01–0,04 мА/см2. Манипуляция длится 7–10 минут, для детей старше года 15–20. Процедуру проводят после назначения врача. Он подбирает необходимый препарат, определяет длительность сеанса и курса.
Электрофорез с эуфиллином улучшает кровоток
Важно понимать, как делают процедуру ребенку. На нужный участок тела накладывают салфетку, пропитанную лекарственным раствором. На ней закрепляют металлическую пластину, через которую проходит электрический ток. Раствор готовят непосредственно перед манипуляцией с использованием дистиллированной воды. Если действующее вещество не растворяется в воде, применяют спирт или димексид. Нужную концентрацию препарата определяет врач.
На ней закрепляют металлическую пластину, через которую проходит электрический ток. Раствор готовят непосредственно перед манипуляцией с использованием дистиллированной воды. Если действующее вещество не растворяется в воде, применяют спирт или димексид. Нужную концентрацию препарата определяет врач.
На тазобедренные суставы накладывают пластинку при их неполноценности и неправильном развитии. А если у малыша гипотонус плеча, салфетку с лекарством и электроды устанавливают на шею. Ребенок может беспокоиться и даже кричать во время процедуры. Неприятные ощущения связаны с прохладой пластинки, мокрой салфеткой или легким покалыванием. После манипуляции кожу следует вытереть насухо, при необходимости место воздействия смазать кремом и держать в тепле.
Какие лекарства используются
Электрофорез с эуфиллином улучшает кровоток в тканях, которые окружают больной сустав. По расширенным сосудам кровь усиленно доставляет питательные вещества и микроэлементы к пораженным тканям.
Для лечения ДЦП и нарушений кровообращения в верхнем отделе позвоночника применяют электрофорез по Ратнеру. Прокладку с эуфиллином устанавливают на область шейных позвонков. Процедура предусматривает использование двух лекарственных средств. Вторую, с папаверином, накладывают на ребра, справа от грудины. Препарат является спазмолитиком, с успехом снимает повышенный тонус.
Никотиновая кислота – это синтетический аналог витамина PP. Хорошо расширяет сосуды, улучшает углеводный обмен. Способствует заживлению тканей. Она используется вместе с раствором эуфиллина. Процедура показана при родовой травме у ребенка, гидроцефалии, нарушении тонуса мышц.
Как при любом лечении, после электрофореза возможны побочные явления. Это аллергическая реакция – зуд, сыпь, беспокойство. Возможно затрудненное дыхание, апноэ, отек Квинке.
Электрофорез с дибазолом используют при неврологической патологии, для лечения послеродовых травм, при высоком тонусе мышц верхних и нижних конечностей. Он положительно влияет на мышечные волокна, снимает спазмы кишечника. Стимулирует работу спинного мозга и иммунной системы.
Он положительно влияет на мышечные волокна, снимает спазмы кишечника. Стимулирует работу спинного мозга и иммунной системы.
Прокладки с магнезией помогают при болезнях дыхательной системы и почек. Лекарство нормализует кровоток, оказывает обезболивающее и противовоспалительное действие. Спазмолитические свойства стабилизируют эмоциональное состояние и успокаивают ребенка.
Электрофорез на тазобедренные суставы назначают при дисплазии
Процедуру с кальцием выполняют при бронхитах, патологии суставов, параличах, невралгии. Она оказывает противовоспалительный и противоаллергический эффект. Укрепляет сосуды, способствует остановке кровотечения.
Противопоказания
С помощью электрофореза для грудничков удается избежать инъекций, которые связаны с сильными болевыми ощущениями, а также снизить осложнения от перорального приема медикаментов. Чтобы достичь положительного эффекта, процедуру нужно проводить систематически и периодически повторять курс лечения. Но какой бы эффективной ни была манипуляция, она имеет противопоказания:
Но какой бы эффективной ни была манипуляция, она имеет противопоказания:
- заболевания кожи – покраснение, высыпание, пятна;
- травмы и повреждения кожи на месте необходимого воздействия током;
- острый воспалительно-инфекционный процесс, повышение температуры;
- обострение бронхиальной астмы;
- низкая свертываемость крови;
- предполагаемая аллергия на используемое лекарственное средство;
- болезни сердца и наличие кардиостимулятора.
Категорическим противопоказанием к проведению электрофореза являются опухоли, независимо от их размера и расположения.
Электрофорез – эффективная процедура. Но она не практикуется как самостоятельное лечение. Используется в комплексе с приемом медицинских препаратов, массажем и гимнастикой. Важно, чтобы ее назначал и контролировал физиотерапевт, он индивидуально решает, можно ли рекомендоватьв оздействие током в конкретном случае. В случае противопоказаний можно подобрать альтернативный метод физиотерапии.
Читайте далее: полипы в носу у детей
Зачем новорожденным и грудничкам нужен массаж?
Массаж для новорожденных и младенцев грудничков представляет собой тип физической терапии, при которой используются воздействие руками на тело малышей с целью расслабить напряженные мышцы, тонизировать расслабленные, улучшить кровоснабжение, лимфоотток, снять мышечные «блоки», увеличить подвижность суставов, нормализовать сон, улучшить общее самочувствие и ощущение благополучия, повысить общую сопротивляемость организма инфекциям. Этот вид дополнительного лечения практикуется во всем мире и все чаще используется для лечения малышей. Научные исследования показали, что у недоношенных младенцев массаж ускоряет прибавку в весе, увеличивает плотность костной ткани, уменьшает выработку гормона стресса — кортизола, позволяет сократить сроки пребывания на стационарном лечении, улучшает психическое и моторное развитие. Для здоровых младенцев массаж является отличным способом укрепить внутрисемейные связи ребенка с мамой и папой, стимулировать рост, увеличивать продолжительность сна, развивать двигательную активность, психомоторное развитие и коммуникативные навыки.
КАКОВЫ ОСНОВНЫЕ ПОЛОЖИТЕЛЬНЫЕ ЭФФЕКТЫ ОТ МАССАЖА?
Массаж для новорожденных и грудничков обладает множеством положительных эффектов, которые можно разделить на четыре основных группы: связь с родителями, стимуляция развития, устранение болезненных симптомов и релаксация.
Укрепление связи с родителями включает:
- Развитие вербальной и невербальной коммуникации.
- Развитие чувства доверия.
- Возникновение чувства любви, уважения и ценности.
Стимулирующие воздействие массажа:
- Стимуляция системы кровообращения и пищеварения.
- Стимуляция гормональной и иммунных систем.
- Развитие координации и чувства баланса.
- Улучшение концентрации внимания и обучаемости.
- Развитие мышц и укрепление костей.
- Стимуляция роста.
Облегчение неблагоприятных симптомов:
- Газообразование и колики, отрыжка.
- Запоры.
- Мышечное напряжение.
Массаж способствует расслаблению и релаксации:
- Улучшение глубины и продолжительности сна.
- Снижение гипертонуса мышц.
- Снижение уровня гормонов стресса.
- Повышение чувства безопасности и уверенности в себе.
ПРИ КАКИХ ЗАБОЛЕВАНИЯХ НОВОРОЖДЕННОМУ НУЖЕН ЛЕЧЕБНЫЙ МАССАЖ?
Лечение с помощью массажа назначает врач-физиотерапевт по направлению педиатра. К медицинским показаниям к детскому массажу относятся:
К медицинским показаниям к детскому массажу относятся:
- врожденная мышечная кривошея кривошея, деформация грудной клетки,
- сколиотическая болезнь,
- врожденный вывих бедра,
- дисплазия тазобедренного сустава,
- ювенильный ревматоидный артрит,
- вальгусная деформация стоп, косолапость, плоскостопие, деформация ног,
- гипо — гипертонус мышц,
- остаточные рефлексы и тремор (дрожание) частей тела,
- детский церебральный паралич,
- аутизм и заболевания центральной нервной системы,
- гипотрофия, рахит,
- анемия,
- пневмония новорожденных и бронхиальная астма,
- запоры, кишечные колики,
ОГРАНИЧЕНИЯ ПРИ МАССАЖЕ
В возрасте до 3-х месяцев у малышей не массируют область родничка, внутренние области сгибов крупных суставов, подмышки, внутреннюю часть бедер.
ПРОТИВОПОКАЗАНИЯ ДЛЯ МАССАЖА МЛАДЕНЦЕВ
Массаж не проводиться при наличии острых воспалительных процессов, инфекционных заболеваний, повреждениях кожи, при кожных болезнях, остеопении и остеопорозе, тяжелой степени недостаточности кровообращения, заболеваниях кроветворной системы, онкологических заболеваниях.
КАК ПРОВОДИТСЯ МЛАДЕНЧЕСКИЙ МАССАЖ?
Массаж для новорожденного или грудничка проводится не ранее, чем через 45 минут после кормления. Важным фактором для выбора времени массажа служит настроение ребенка. Если ребенок поддерживает зрительный контакт, выглядит спокойным и сытым, он сможет в полной мере наслаждаться массажем. Если же малыш отворачивается, вытягивается на руках – это не лучшее время для проведения массажа. Для малышей массаж может выполняться непосредственно перед занятиями по акватерапии и плаванию, подготавливая их к занятиям.
Малышам можно делать массаж ежедневно, например, перед сном, как часть ритуала успокоения. Младенческий массаж включает небольшую подготовку. Для начала необходимо создать спокойную атмосферу в помещении. Массаж необходимо проводить в теплом и тихом месте. Ребенок располагается перед массажистом или родителем на одеяле или пеленке. Ребенок кладется на спину, чтобы с ним можно было поддерживать зрительный контакт. Раздевая малыша, ему необходимо объяснять, что пришло время для массажа. Когда вы раздеваете своего ребенка, скажите ему, что это время массажа. Для массажа можно использовать нейтральное масло, например подсолнечное, или специальное детское масло.
Когда вы раздеваете своего ребенка, скажите ему, что это время массажа. Для массажа можно использовать нейтральное масло, например подсолнечное, или специальное детское масло.
Процедуру начинают с поглаживания и разминания каждой части тела ребенка, тратя примерно минуту на каждый участок, включая голову, шею, плечи, верхнюю часть спины, талию, бедра, ноги и руки. Затем ребенка укладывают на спину и одну минуту разгибают и сгибают каждую руку и ногу, а затем обе ноги одновременно. После чего повторяются разминание и поглаживание тела и конечностей в течение пяти минут.
Во время массажа массажист или родитель должен говорить с ребенком, можно петь или рассказывать сказку. Можно попробовать повторять имя ребенка и слово «массаж». Если ребенок смеется и кажется счастливым, он, вероятно, наслаждается массажем, и массаж можно продолжать. Если ребенок отворачивается или становится беспокойным, массаж необходимо прекратить.
Может потребоваться несколько попыток, прежде чем ребенок привыкнет к массажным процедурам.
КАК ЗАПИСАТЬСЯ НА МАССАЖ?
Для записи на массаж необходимо иметь направление на проведение процедуры от врача-физиотерапевта. Записаться на прием к врачу или вызвать его на дом можно круглосуточно по телефону +7 (812) 331-74-78.
Читайте также:
Для чего необходим электрофорез с использованием Зуфиллина на шейный отдел грудничку?
Электрофорез — это широко распространенный, физиотерапевтический метод ввода медикамента с помощью тока. Ток может быть импульсивным или гальваническим. Итак, рассмотрим немного подробнее о данной процедуре.
Лекарство проникает в кожу, концентрируясь неглубоко: в дермальном и эпидермальном слоях. Затем, оно попадает в и лимфу и достигает цели назначения с потоком крови вашего маленького чада.
Электрофорез – это процедура конкретно направленная. Возрастных противопоказаний у него нет, поэтому, при необходимости, электрофорез назначают и крохам — грудничкам, ничего страшного в этом нет.
Для чего грудничкам назначают электрофорез?
Чаще всего, медицинскими показаниями для медицинского назначения проведения курса процедур у грудничков первого года жизни являются неврологическая патология (гипертонус, гипотонус мышц).
Различные нарушения развития мыщечного или костного аппарата (тазобедренная дисплазия, кривошея у малыша).
Очень хорошо себя зарекомендовала процедура при диатезах. Также электрофорез могут назначить для снятия симптомов боли и для устранения последствий родовой травмы малыша.
Вредна ли процедура для малыша?
Любые родители боятся за здоровье своего маленького карапуза. И ссобенно, когда ребенок еще такой маленький. Обеспокоены они часто и назначением физиопроцедур, спрашивая врача так ли необходима эта процедура грудничку?
Да, необходима, если иак считает доктор, и ее совсем не нужно боятся, ведь она позволяет использовать лекарственный препарат с максимальным эффектом, избегая большинства побочных симптомов.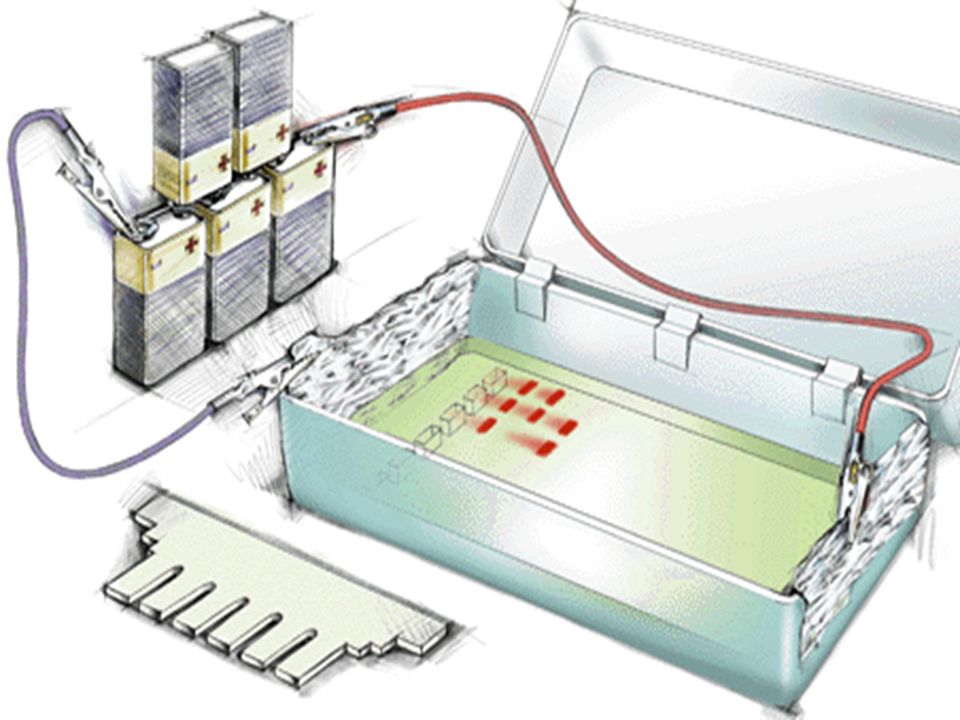
Клинический эффект достигается благодаря повышению чувствительности различного рода тканей к лекарству под электрическим воздействием. А благодаря локальному характеру воздействия, то и побочных эффектов удается избежать. Чего не скажешь о традиционном лечении медикаментами.
Электрофорез с Эуфилином
Эуфилин назначают при: повышенном или недостаточном тонусе мышц или для общего улучшения кровообращения в мозговой ткани и почках.
Под воздействием электрического тока, эуфилин повышает активность тканей, снимает болевой синдром в мышцах, улучшает процесс кровообращения, способствует питанию хрящевой ткани, ускоряет метаболизм, прогревает., стабилизирует состояние вегето-сосудистой системы.
Использование методики Ратнера
Своим названием этот метод обязан имени своего разработчика. А. Ю. Ратнер занимался исследованием последствий влияния родовых травм на последующее здоровье человека. Узнаем о процедуре подробнее чуть ниже.
А. Ю. Ратнер занимался исследованием последствий влияния родовых травм на последующее здоровье человека. Узнаем о процедуре подробнее чуть ниже.
Гипоксия, травматизм, нарушение функций кровообращения при родах влекут за собой многие заболевания, преследующие потом уже взрослого человека всю жизнь.
Разработанная автором методика предполагает проведение электрофореза с применением эуфиллина поперечным методом на шейный отдел позвоночника.
Связанно это стем, что он максимально подвержен родовому травматизму.
На уровне 2 — 7 шейного позвонка располагают анод, катод же располагают на верхнем краю грудной клетки. Проводят процедуру при силе воздействия не превышающей показателя в 0,5 мА.
Существует и второй вариант применения методики Ратнера. Он предполагает иную последовательность проведения электрофореза.
Марлевую прокладку пропитывают 0,5% раствором медикамента, и кладут на область шеи, а вторую марлевую прокладку пропитывают папаверином 1%, положив с права на ребра. Длительность процедуры 15 минут.
Длительность процедуры 15 минут.
Правильное применение Дибазола и раствора Магнезия
Дибазол положительно влияет на общемышечное состояние, хорошо убирает спазмы, расширяет совуды крови и сосуды внутренних органов, снижает артериальное давление, в общем очень помогает и детям и взрослым.
Широкое его использование в неврологии обусловлено его стимулирующим воздействием на межнейронное сообщение в синапсах спинного мозга. Так же Дибазол повышает иммунитет малыша.
Назначают проведение электрофореза с Дибазолом при симптомах остаточного полиомиелита у малышей и при болезнях неврологического характера, связанных с имеющимися родовыми травмами. Также процедура показывает хорошие клинические результаты при гипер или гипотонусе мышц.
Электрофорез с применением раствора магнезии оказывает успокаивающее воздействие и расширяет сосуды. Для проведения используется 20-25% раствор медикамента.
Для проведения используется 20-25% раствор медикамента.
Под воздействием тока раствор магнезии проникает в эпидермальный слой, а следом в кровь, нормализируя психоэмоциональный фон ребенка, улучшая кровообращение и состояние его мышечной ткани.
Электрофорез с Кальцием и Папаверином
Назначается процедура при мышечной дистрофии и параличе, а также для формирования костных ядр в тазобедренном суставе.
Особенно эффективен элекстрофрез с использование раствора кальия при совместном его применении с аскорбиновой кислотой и витамином РР при лечении катарального гингивита у малыша.
Физиотерапевтическое лечение позволяет добиться эффекта и снятия воспаления уже в первый раз.
Методика проведения электрофореза поперечная с использованием 1%-го раствора и силой электротока 3-5 мА. Папаверин снимает спазмы, способствует усилению кровяной циркуляции и развитию более свободных движений у маленьких грудничков.
Курс процедур улучшает мышечный тонус грудничка, снижает кишечные спазмы, успокаимвает нервную систему ребенка. Назначают обычно при гипертонусе рук и ног.
Противопоказания к проведению электрофореза.
Электрофорез, хоть и является процедурой безопасной и безболезненной, все же имеет ряд существенных противопоказаний.
Его нельзя применять при:- бронхиальной астме в острой ее форме;
- повышении температуры тела;
- почечной и сердечной недостаточности;
- гнойной кожной инфекции;
- при любых повреждениях кожи и дерматите.
Отзывы родителей о процедуре
Оксана, 26 лет. У моей малышки ПП ЦНС и гипертонус. Мы проходили комплексное лечение, малышке не было еще и года. Электрофорез был с эуфилином и папаверином. Ребенок не капризничал, лежал спокойно.
Первый сеанс был всего минуту, постепенно увеличили до 3 минуток (к концу первой недели). Результат я отметила сразу, ребенок стал лучше держать головку и (хоть и с опозданием) научился переворачиваться.
Может, это результат комплексного лечения, но и уже после проведения четырех курсов за год мы забыли о проблемах с неврологией у нашего малыша.
Марина, 30 лет. Нам тоже назначали электрофорез на шейно-воротниковую зону и поясницу. Я за проведение процедуры. Она очень полезна и, что крайне важно, безвредна. Я лечила сына от вчд и сниженного мышечного тонуса.
Ему было тогда полгода он не сидел, даже ни капли не пытался, да и голову держал очень слабо. Делали массаж и электрофорез. Улучшения налицо, малыш пытается присесть и более уверенно держит голову.
Поделитесь с друзьями
Детский физиотерапевт в Самаре. Физиотерапия в Самаре, физиопроцедуры. Цены. Отзывы. Запись на консультацию к врачу физиотерапевту.
Детская физиотерапия – это область медицины, изучающая воздействие на организм природных факторов.
Когда необходима физиотерапия?
Одним из наиболее эффективных методов профилактик и лечения является физиотерапия.
Если здоровые дети могут самостоятельно заниматься, например, гимнастикой и принимать солнечные ванны, то деткам, перенесшим ряд заболеваний или страдающим ими, просто необходимо посещение кабинета физиотерапевта.
Среди этих недугов можно выделить следующие:
- проблемы с позвоночником;
- простуда;
- ДЦП;
- нарушение работы кишечника;
- заболевания опорно-двигательного аппарата, например, рахит;
- нарушения кровообращения и другие.
Механизм действия большинства благотворных внешних факторов основан на том, что они налаживают в организме работу систем, отвечающих за приспособление к окружающей среде, и укрепляют иммунную систему. Вот почему эти средства в основном назначают малышам, когда они начинают выздоравливать.
Еще одно условие для направления на физиопроцедуры – возраст маленького пациента. Чем младше ребенок, тем выше вероятность, что действие лечебных факторов вызовет у него побочные эффекты, и тем меньше лечебные возможности разных методов.
Все эти ограничения приводят к тому, что в детской практике специалисты пользуются скорее портативными, а не мощными приборами, и преимущественно импульсными, то есть имеющими более щадящий режим действия, отдавая предпочтение малым дозам, чтобы сократить небезопасный для малышей тепловой эффект. Тем более что малые дозы вполне способны стимулировать защитные силы организма, регулировать его работу и лечить.
Лечебный эффект от физиопроцедур
Исследования показали, что воздействие на организм при помощи природных и искусственных факторов может существенно влиять не его функционирование и на самочувствие пациента. Именно поэтому физиотерапия для детей предусматривает использование света и тепла, УФ-излучения и тока, ультразвука и магнитных полей.
Лечебный эффект после процедур обусловлен тем, что в результате терапевтического воздействия в тканях и органах начинается генерация специфических процессов, способных улучшить состояние организма.
Важно и то, что физиопроцедуры для детей представляются наиболее щадящим методом лечения и практически не имеют противопоказаний.
Обращайтесь к специалистам медицинского центра «Здоровье детей», оснащенного всем необходимым для проведения физиопроцедур для детей.
Квалифицированные врачи клиники работают для того, чтобы ваши детки радовали вас хорошим здоровьем и счастливыми улыбками!
Физиотерапия в МЦ «Здоровье детей»
Жителям Самары и области мы рекомендуем воспользоваться услугами врачей, работающих в медицинском центре «Здоровье детей».
Наш медицинский центр оснащен современным оборудованием, обладает всеми необходимыми лицензиями и сертификатами, гарантирует высокое качество обследований и результативность лечения.
Доктора центра характеризуются профессионализмом и высокой квалификацией, индивидуальным подходом, чуткостью и любовью к детям.
Среди услуг медицинского центра присутствует выезд врача на дом, комплексные программы наблюдения и исследования, оформление медицинской документации, диспансеризация.
Также специалисты осуществляют вакцинацию, проводят лабораторные исследования и анализы, выполняют массаж.
Обращайтесь к администраторам МЦ «Здоровье детей», чтобы
записаться на физиопроцедуры
по тел.: +7(846) 200-20-44, +7(846) 972-46-44
Здоровье ваших детей – это первоочередная задача специалистов нашего медцентра!
Как проходит обследование
Электролечение
Самый распространенный метод физиотерапии – гальванизация и лекарственный электрофорез.
С его помощью в организм малыша вводят нужное лекарство – посредством постоянного тока. Обычно таким способом доставляются соли металлов и микроэлементов (цинк, кальций, магний, йод, бром), препараты, снимающие спазм и расширяющие сосуды (но-шпа, дибазол, эуфиллин и др.), противовоспалительные средства и многое другое.
Для маленьких пациентов физиотерапевты специально подбирают меньшую плотность тока.
Лазеротерапия
В последнее время этот метод лечения становится все более популярным.
Лазерное излучение разных оптических спектров помогает справиться с воспалениями и отеками, ускоряет заживление и восстановление тканей, стимулирует иммунную систему, снимает боль. Этот метод назначают малышам, перенесшим травмы, операции, а действие по точкам – во многих более распространенных ситуациях.
Лечение лазером во многих случаях становится важным дополнением к основному курсу терапии. Действенность метода повышается, если сочетать его со световым излучением и влиянием магнитного поля (магнитно-лазерная терапия с помощью аппаратов «Милта», «Узор», «Улей» и других).
Профилактика заболевания, как это давно известно, требует гораздо меньшего вложения сил, времени и средств, чем лечение недуга, который можно было бы предотвратить.
Медицинский центр «Здоровье детей» предлагает физиопроцедуры для юных пациентов, начиная с младенцев и заканчивая подростками.
В стенах клиники проводятся сеансы физиотерапии при помощи инфракрасного лазера, электрофореза, аппарата «Милта» (лазер), СМТ «Амплипульс».
Кроме того, квалифицированные специалисты делают массаж детям с различными заболеваниями и отклонениями в развитии.
Детский массаж и ЛФК, массаж ребенку на дому в СПб, запись на прием к детскому массажисту, цена в клинике ‘Скандинавия’
Нужен хороший детский массажист в Санкт-Петербурге? В нашей клинике работают высококвалифицированные специалисты, проводится лечебный и профилактический массаж, а также гимнастика для детей разных возрастов. Занятия ведутся в полностью оборудованных кабинетах и залах, возможен выезд на дом. Позвоните, чтобы узнать стоимость детского массажа, направления лечебной физкультуры и другую информацию.
Детский массаж – фундамент здоровья ребенка
Многие родители грудничков пугаются, когда на приеме у педиатра слышат предложение записать ребенка на массаж. Врач нашел какую-то патологию? Малышу грозит заболевание? Конечно, при наличии какого-либо заболевания врач может назначить массаж по медицинским показаниям. Но для правильного и гармоничного развития вашего малыша желательно провести массаж как общеукрепляющий курс процедур. На самом деле, массаж стимулирует развитие детского организма лучше витаминов и прогулок. Он помогает формировать костную структуру и мышечный корсет, готовит грудничка переворачиваться на животик, держать головку, сидеть и делать первые шаги. Взрослому человеку нужны занятия спортом для поддержания здоровья, а детям в первые годы жизни необходимы массаж и ЛФК.
Каким бывает детский массаж ЛФК
Комплекс процедур рекомендует педиатр, невролог, ортопед или хирург. Определить и уточнить объем и интенсивность воздействия, а при необходимости и сочетание различных методик сможет врач по лечебной физкультуре или физиотерапевт. Также врач, который выписал направление, оценивает результаты лечения и при необходимости продлевает курс. Есть три вида массажа для детей:
- лечебный массаж – назначается для комплексного лечения гипертонуса или слабости мышц, кривошеи, кривизны ног, дисплазии тазобедренных суставов, косолапости, рахита и других заболеваний;
- реабилитационный массаж – назначается для закрепления результата после лечения;
- профилактический (оздоравливающий) детский массаж – предназначен для укрепления мышц, стабилизации нервной системы, гармоничного развития организма.
Профилактический массаж можно делать без направления врача до трех раз в год. Необходимо только убедиться, что для него нет противопоказаний. Детский массажист проводит сеанс в течение 20-40 минут. Сеансы должны проходить ежедневно, длительность курса составляет 10-15 дней. Массаж можно делать с 3-х месяцев и обычно до 2-3 лет.
Почему нужен именно детский массажист
Делать массаж детям (особенно грудным) сложнее, чем взрослым. Специалист должен пройти обучение, прежде чем сможет работать с детьми. Одного курса недостаточно – методики массажа и ЛФК для грудничков постоянно обновляются, благодаря чему массаж становится все более эффективным. В нашей клинике специалисты по массажу постоянно совершенствуют свои навыки.
Детский массажист ребенку обязательно должен понравиться – если с малышом не установить контакт, он не позволит к себе прикасаться, будет беспокоиться и плакать. Вот почему, помимо навыков массажа и ЛФК, массажисту нужно знание детской психологии и талант к общению с маленькими пациентами.
Сколько стоит детский массаж
Стоимость курса определяется индивидуально, на основе диагноза ребенка и рекомендуемой врачом продолжительности сеанса. Массажист может приезжать к вам на дом, либо проводить сеанс в клинике – это также влияет на цену. Чтобы узнать более подробную информацию про цены на массаж детям, позвоните в любое из отделений нашей клиники.
Электрофорез для новорожденного и грудничка: что нужно знать
Нередко при различных заболеваниях новорожденным деткам и грудничкам назначают различные физиотерапевтические процедуры. К ним относится и электрофорез. Он заключается во введении всевозможных лекарственных препаратов в детский организм при помощи постоянного электрического тока. Процедура довольно простая, однако мамы и папы должны знать, в каких случаях она назначается ребенку, существуют ли противопоказания, и как она проводится.
Нередко при различных заболеваниях новорожденным деткам и грудничкам назначают различные физиотерапевтические процедуры. К ним относится и электрофорез. Он заключается во введении всевозможных лекарственных препаратов в детский организм при помощи постоянного электрического тока. Процедура довольно простая, однако мамы и папы должны знать, в каких случаях она назначается ребенку, существуют ли противопоказания, и как она проводится.
Показания к электрофорезу
Данная манипуляция расслабляет и успокаивает малыша, а также обладает противовоспалительным и обезболивающим свойствами. Поэтому детям раннего возраста электрофорез назначают в таких случаях:
- Патологии костно-мышечной системы (дисплазии суставов, мышечная и установочная кривошея).
- Диатезы.
- Мышечный гипер- или гипотонус.
- Различные неврологические расстройства.
- Артриты.
- Переломы, вывихи и подвывихи, контрактуры.
- Болезни пищеварительной системы (колит, гастрит).
- Стоматиты.
- Воспалительные заболевания мочевыделительной и дыхательной системы.
- Глазные заболевания (конъюнктивиты, кератиты, блефариты).
- ЛОР-патологии (отиты, тонзиллиты, риниты).
- Родовые травмы.
- Послеоперационная реабилитация.
Кроме того, электрофорез маленьким детям часто назначают для снятия болевого синдрома при различных заболеваниях.
В каких случаях процедуру проводить нельзя?
Электрофорез намного безопаснее для детского здоровья, чем лечение инъекциями. Однако есть ситуации, когда данная манипуляция противопоказана:
- Почечная или сердечная недостаточность различных степеней тяжести.
- Плохая свертываемость крови.
- Склонность к аллергическим реакциям.
- Приступ бронхиальной астмы.
- Наличие злокачественных или доброкачественных новообразований в организме.
В некоторых случаях, например, при гемангиоме, врач может разрешить проведение электрофореза, однако перед этим ребенка необходимо обследовать, а после первой процедуры наблюдать за состоянием малыша (не увеличивается ли гемангиома, меняет цвет или нет).
- Дерматиты.
- Гнойничковые высыпания на кожных покровах.
- Повышенная температура тела.
- Непереносимость электротока.
- Раны, ссадины, порезы в местах накладывания электрода.
Прежде чем назначить электрофорез крохе, врач должен обязательно назначить все необходимые обследования с целью выявления противопоказаний. Только после тщательного осмотра и оценки состояния здоровья доктор принимает решение. Также очень важно узнать у мамы, есть ли у малыша аллергия на какие-либо лекарственные препараты. В случае необходимости проводят аллергопробы.
Как проводится процедура?
Манипуляцию проводит специально обученный медицинский персонал в физиотерапевтическом кабинете. Детям раннего возраста обычно назначают курс из 10 процедур, продолжительность одного сеанса – от 5-8 до 20-25 минут. Электрофорез проводится довольно просто:
- Лекарственный препарат наносят на марлевую салфетку, которой обматывают электрод.
- Накладывают электроды на необходимые участки тела (шея, поясница, грудная клетка, суставы) в зависимости от показаний.
- Устанавливают необходимую силу тока, и подключают аппарат.
- После завершения процедуры кожу протирают сухой чистой салфеткой.
Повторный курс лечения в случае необходимости назначают не ранее чем через 1-2 месяца.
Выделяют и другие методики электрофореза:
- Ванночковая. Подготовленную емкость наполняют необходимым количеством лекарственного средства, и погружают туда пораженную часть тела (верхнюю или нижнюю конечность).
- Полостная. В полость (мочевой пузырь, кишечник) вводят лекарство, туда же вводят один электрод, а второй располагают на кожных покровах.
- Внутритканевая. Заключается во введении препарата инъекционным способом. Далее накладывают электроды на пораженные участки.
Во время проведения электрофореза ребенок ощущает легкое показывание в области соприкосновения электрода с кожными покровами. Это может напугать малыша, поэтому важно, чтобы мама находилась рядом и успокаивала его.
Какие лекарственные препараты чаще всего используют?
В зависимости от показаний во время проведения электрофореза чаще всего применяют такие лекарственные средства:
|
Наименование препарата |
При каких патологиях применяют |
|
Эуфиллин |
Дисплазии суставов, мышечный гипертонус, межпозвоночные грыжи, остеоартрозы. |
|
Кальций |
Переломы костей, частые кровотечения, заболевания полости рта (гингивиты), мышечная дистрофия, парезы и параличи. |
|
Магнезия |
Патологии дыхательной системы, болевые синдромы, желтухи. |
|
Папаверин |
Всевозможные спазмы (кишечные, мышечные, мочевыделительных путей). |
|
Никотиновая кислота |
Патологии пищеварительного тракта, сосудистые спазмы, длительно не заживающие раны. |
|
Дибазол |
Неврологические расстройства, мышечный гипертонус, кишечные спазмы, родовые травмы. |
|
Йод |
Склонность к кожным заболеваниям, некоторые неврологические расстройства, патологии щитовидной железы. |
|
Калий |
Заболевания сердца (тахикардия, мерцательная аритмия). |
|
Лидаза |
Патологии органа зрения и опорно-двигательной системы, наличие келоидных рубцов. |
|
Эуфиллин с папаверином (электрофорез по Ратнеру) |
Применяют для лечения кривошеи, ДЦП, короткой шеи, последствий родовых травм. При этом лекарственные препараты наносят отдельно на разные электроды. |
Стоит отметить, что препарат и его концентрацию определяет только врач. Во время проведения манипуляции, а также после нее за крохой необходимо наблюдать, обращая внимание на общее состояние, появление сыпи, одышки, кашля, или других симптомов.
Побочные эффекты процедуры
Электрофорез является одной из безопасных манипуляций, редко вызывающей осложнения. Однако у новорожденных деток и грудничков возможны так называемые побочные эффекты:
- Покраснения кожи в местах накладывания электродов.
- Появления раздражения на кожных покровах.
- Из-за покалывающих ощущений ребенок во время проведения процедуры может капризничать, пытаться сорвать электроды.
Обычно серьезных последствий после процедур не возникает, благодаря чему электрофорез получил широкое распространение в терапии многих заболеваний.
Возможны ли аллергические реакции?
Нередко у детей первого года жизни возникают аллергии на применяемые лекарственные препараты. Они могут проявляться сразу же, во время проведения электрофореза, или спустя некоторое время. Основными симптомами аллергии являются:
- Реакции кожных покровов (сыпь в виде волдырей по всему телу, шелушения, красные пятна).
- Учащение сердцебиения.
- Одышка, кашель, затрудненное дыхание.
- Нарушения общего состояния (вялость, сонливость, потеря аппетита).
- Повышение температуры тела.
При возникновении любых проявлений аллергической реакции процедуру прекращают. Если симптомы возникли спустя несколько часов после электрофореза, следует как можно скорее обратиться в больницу, где врач осмотрит кроху, назначит необходимые обследования для выявления причины возникновения ответной реакции и терапевтические процедуры.
Наталья Король, педиатр, специально для Mirmam.pro
Электрофорез с магнезией
АНМО «Ставропольский краевой клинический консультативно-диагностический центр»:
355017, г. Ставрополь, ул. Ленина 304(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное подразделение «Диагностический центр на Западном обходе»:
355029 г. Ставрополь, ул. Западный обход, 64(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-68-89 (факс)
Посмотреть подробнееКлиника семейного врача:
355017 г. Ставрополь, пр. К. Маркса, 110 (за ЦУМом)(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-50-60 (регистратура)
Посмотреть подробнееНевинномысский филиал:
357107, г. Невинномысск, ул. Низяева 1(86554) 95-777, 8-962-400-57-10 (регистратура)
Посмотреть подробнееОбособленное структурное подразделение в г. Черкесске :
369000, г. Черкесск, ул. Умара Алиева 318(8782) 26-48-02, +7-988-700-81-06 (контактные телефоны)
Посмотреть подробнееОбособленное структурное подразделение в г. Элисте :
358000, г. Элиста, ул. Республиканская, 478(989) 735-42-07 (контактные телефоны)
Посмотреть подробнееЗАО «Краевой клинический диагностический центр»:
355017 г. Ставрополь, ул. Ленина 304(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное структурное подразделение на ул. Савченко, 38 корп. 9:
355021, г. Ставрополь, ул. Савченко, 38, корп. 98 (8652) 316-847 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение на ул. Чехова, 77 :
355000, г. Ставрополь, ул. Чехова, 778(8652) 951-943 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение в г. Михайловске:
358000, г. Михайловск, ул. Ленина, 201 (в новом жилом районе «Акварель»).8(988) 099-15-55 (контактный телефон)
Посмотреть подробнееОценка повреждения ДНК в лимфоцитах курящих матерей новорожденных, вызванных курением, с помощью метода щелочного одноклеточного гель-электрофореза
https://doi.org/10.1016/0165-1161(95)00023-2Получить права и содержаниеРезюме
Метод одноклеточной гель-электрофоретики (SCGE) для определения наличия разрывов цепей ДНК и щелочно-лабильных повреждений в отдельных клетках был использован для изучения влияния на новорожденных детей воздействия сигаретного дыма на мать. Уровни повреждения ДНК в лимфоцитах 21 новорожденного от матери с разными привычками курения сравнивали с уровнями у 10 новорожденных, матери которых никогда не курили, и 8 новорожденных, матери которых подвергались пассивному воздействию в течение не менее 40 часов в неделю на рабочем месте и дома. .Повреждение ДНК не было обнаружено в лимфоцитах новорожденных от пассивно облученных матерей или новорожденных от матерей с низкой привычкой к курению в условиях, допускающих 40-минутное раскручивание ДНК и 40-минутный электрофорез. Предположительно более длительное время потребовалось для обнаружения SCGE более низких уровней повреждений. Средняя длина миграции ДНК в лимфоцитах между новорожденными от курящих матерей не показала какой-либо значимости, но процент поврежденных клеток увеличивался с увеличением частоты курения при оценке с помощью непараметрического теста Манна-Уитни U .Результаты SCGE сравнивали с нашими результатами, опубликованными у тех же людей с частотой обмена сестрин-хроматид (SCE). Результаты показывают аналогичные тенденции со средними показателями повреждения ДНК, увеличивающимися с увеличением частоты и продолжительности курения матери. Эти наблюдения поощряют применение SCGE как чувствительного и полезного метода для количественной оценки повреждений ДНК в отдельных клетках.
Ключевые слова
Одноклеточный гель-электрофорез
Повреждение ДНК
Анализ комет
Вызванные курением лимфоциты новорожденных
Обмен сестрин-хроматид
Рекомендуемые статьи Цитирующие статьи (0)
Полный текстse Copyright © 1995 Б.V.
Рекомендуемые статьи
Цитирующие статьи
Важность капиллярного электрофореза в скрининге гемоглобинопатий у новорожденных — Trivitron Blog
Технология капиллярного электрофореза:
Капиллярный электрофорез — одна из самых передовых медицинских технологий, используемых во всем мире. Технология электрофореза предлагает полную автоматизацию, полный обход и высокую производительность, что имеет жизненно важное значение для большинства клинических лабораторий.При электрофорезе сложные молекулы дифференцируются на основе электрического заряда, который они несут в капилляре кремнезема, и количественно определяются непосредственно на длине волны 415 нм.
Технология капиллярного электрофореза внедряется в большинстве клинических лабораторий и патологий по всему миру и находится на устойчивой траектории роста. Технология капиллярного электрофореза обеспечивает лучшую эффективность, большую клиническую ценность и пропускную способность для клинических лабораторий любого размера.
Гемоглобинопатии:
Гемоглобинопатии — это генетические состояния, которые влияют на количество или форму красных кровяных телец в организме.Эти условия могут отличаться друг от друга. Некоторые гемоглобинопатии могут вызывать серьезные симптомы, в то время как другие не вызывают проблем со здоровьем или даже симптомов заболевания. В легких случаях гемоглобинопатии лечение не требуется. Однако, когда тяжелые случаи остаются без лечения, они могут вызвать анемию, повреждение органов или даже смерть. К счастью, когда тяжелая гемоглобинопатия выявляется и начинается лечение в раннем возрасте, больные дети могут вести здоровый образ жизни.
Важность скрининга новорожденных на гемоглобинопатии:
Преимущества скрининга новорожденных на гемоглобинопатии можно разделить на пять категорий:
- Профилактика заболеваний новорожденных
- Ретроспективная первичная профилактика для родителей, находящихся в группе риска и имеющих пострадавшего ребенка
- Перспективная первичная профилактика для пар из группы риска, у которых был ребенок-носитель
- NBS для гемоглобинопатий может быть полезен при выявлении носителя анемии и помогает в предотвращении несчастных случаев, особенно во время анестезии для носителей HbS
- Долгосрочная информация для здоровых носителей для тестирования будущего партнера и выбора репродуктивной функции.
Скрининг гемоглобина с помощью капиллярной технологии:
Значительный процент младенцев страдает редкими генетическими заболеваниями, которые могут быть опасными для жизни, но поддаются лечению. Цель скрининга новорожденных — помочь выявить некоторые серьезные нарушения гемоглобина до того, как они могут отрицательно повлиять на ребенка. Скрининг новорожденных — это быстрый и простой способ дать вашему ребенку здоровое начало жизни.
Выявление вариантов структурного гемоглобина (Hb) и диагностика талассемии у новорожденных становятся все более важными.Раннее обнаружение вариантов гемоглобина, таких как HbS, имеет важные терапевтические последствия в раннем возрасте и может привести к надлежащему началу профилактических мероприятий. Количественная оценка HbA2 является сложной задачей, поскольку он происходит на очень низком уровне и лишь незначительно увеличивается у носителей b-талассемии, что требует высокой точности.
До недавнего времени разделение фракций Hb производилось по традиционным технологиям. В настоящее время капиллярный электрофорез широко применяется для разделения фракций гемоглобина и предполагаемой идентификации вариантов гемоглобина.В этой технологии гемоглобины разделяются и количественно определяются с высокой точностью. Предположительная идентификация варианта Hb производится путем сравнения его миграционного положения с конкретными зонами миграции известных вариантов Hb, обнаруженных в библиотеке.
Большинство вариантов гемоглобина разделяются по этой технологии без каких-либо помех. Прямое обнаружение обеспечивает точную относительную количественную оценку отдельных фракций гемоглобина, особенно гемоглобина HbA2, для диагностики бета-талассемии.Кроме того, высокая разрешающая способность этой технологии позволяет идентифицировать Hb S из Hb D и Hb E из Hb C. Количественное определение Hb A2 также может быть выполнено при наличии гемоглобина E.
Следовательно, капиллярная технология играет жизненно важную роль в скрининге вариантов гемоглобина у новорожденных и является всемирно признанной технологией для скрининга Hb.
Развитие кишечной микробиоты младенца
Abstract
Почти сразу после рождения человека возникает новая микробная экосистема, которая находится в желудочно-кишечном тракте этого человека.Хотя это универсальная и неотъемлемая часть биологии человека, временное развитие этого процесса, источники микробов, составляющих экосистему, как и почему они варьируются от одного младенца к другому, и как состав этой экосистемы влияет на человека. физиология, развитие и болезни все еще плохо изучены. В качестве шага к систематическому исследованию этих вопросов мы разработали микроматрицу для обнаружения и количественного определения последовательностей генов малых субъединиц рибосомной РНК (SSU рРНК) большинства известных в настоящее время видов и таксономических групп бактерий.Мы использовали этот микрочип вместе с секвенированием клонированных библиотек рДНК SSU, амплифицированных с помощью ПЦР, для профилирования микробных сообществ в среднем по 26 образцам стула от 14 здоровых доношенных новорожденных, включая пару дизиготных близнецов, начиная с первый стул после рождения и продолжающийся через определенные промежутки времени в течение первого года жизни. Чтобы исследовать возможное происхождение детской микробиоты, мы также составили профили вагинальных образцов и молока от большинства матерей, а также образцов кала от всех матерей, большинства отцов и двух братьев и сестер.Состав и временные паттерны микробных сообществ широко варьировались от ребенка к ребенку. Несмотря на значительные временные различия, отличительные черты микробного сообщества каждого ребенка можно было распознать с интервалом от нескольких недель до месяцев. Поразительно параллельные временные паттерны близнецов предполагают, что случайные воздействия окружающей среды играют важную роль в определении отличительных характеристик микробного сообщества каждого ребенка. К концу первого года жизни идиосинкразические микробные экосистемы у каждого ребенка, хотя и различны, сходились к профилю, характерному для желудочно-кишечного тракта взрослого.
Сведения об авторе
Уже почти столетие было признано, что люди населены удивительно плотной и разнообразной микробной экосистемой, но мы только начинаем понимать и ценить многие роли, которые эти микробы играют в здоровье и развитии человека. Знание состава этой экосистемы — решающий шаг к пониманию ее роли. В этом исследовании мы разработали и применили подход на основе микрочипов рибосомальной ДНК для отслеживания развития кишечной флоры у 14 здоровых доношенных детей в течение первого года жизни.Мы обнаружили, что состав и временные паттерны микробных сообществ широко варьировались от ребенка к ребенку, поддерживая более широкое определение здоровой колонизации, чем считалось ранее. К одному году младенцы сохранили свою уникальность, но приблизились к профилю, характерному для желудочно-кишечного тракта взрослого человека. Состав и временные паттерны развития кишечной микробиоты у пары разнояйцевых близнецов были поразительно похожи, что позволяет предположить, что генетические факторы и факторы окружающей среды формируют нашу кишечную микробиоту воспроизводимым образом.
Образец цитирования: Palmer C, Bik EM, DiGiulio DB, Relman DA, Brown PO (2007) Развитие кишечной микробиоты ребенка у человека. PLoS Biol 5 (7): e177. https://doi.org/10.1371/journal.pbio.0050177
Академический редактор: Иджун Руан, Институт генома Сингапура, Сингапур
Поступила: 22 января 2007 г .; Принята к печати: 4 мая 2007 г .; Опубликовано: 26 июня 2007 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями декларации Creative Commons Public Domain, которая предусматривает, что после размещения в общественном достоянии эта работа может свободно воспроизводиться, распространяться, передаваться, модифицированы, построены или иным образом использованы кем-либо в законных целях.
Финансирование: Эта работа финансировалась Фондом Хорна и Медицинским институтом Говарда Хьюза.
Конкурирующие интересы: ПОБ, исследователь Медицинского института Говарда Хьюза.
Сокращения: GI, желудочно-кишечный; nt, нуклеотид; ОТУ, оперативная таксономическая единица; prokMSA, выравнивание множественных прокариотических последовательностей; КПЦР, количественная ПЦР; рДНК, рибосомная ДНК; рРНК, рибосомальная РНК; СГУ, г. малая единица
Введение
Тело взрослого человека обычно содержит в десять раз больше микробных клеток, чем человеческих клеток, в основном из-за чрезвычайно высокой плотности микробов, обнаруженных в кишечном тракте человека (обычно 10 11 –10 12 микробов / мл просвета. содержание).Эта микробная экосистема выполняет множество важных функций для своего хозяина-человека, включая защиту от патогенов, обработку питательных веществ, стимуляцию ангиогенеза и регулирование накопления жира в организме хозяина [1–7]. Понятно, что этот список еще не полный; по мере расширения этой области исследований мы постоянно открываем для себя новые роли и отношения. Исследования на мышах-гнотобиотах были особенно полезными, демонстрируя важную роль микробиоты желудочно-кишечного тракта (ЖКТ) в нормальном развитии кишечника [2,5].Кроме того, многие заболевания как у взрослых, так и у младенцев имеют известную или предполагаемую связь с микробиотой желудочно-кишечного тракта, включая рак желудка [8], лимфому лимфоидной ткани, ассоциированную со слизистой оболочкой [9], воспалительное заболевание кишечника [10,11] и некротический энтероколит [ 12,13].
Состав микробиоты желудочно-кишечного тракта взрослого человека интенсивно изучался с использованием как культивирования, так и, в последнее время, методов на основе последовательности малых субъединиц (SSU) рибосомной ДНК (рДНК), не зависящих от культуры [14]. Одна только экосистема толстой кишки человека насчитывает более 400 видов бактерий, принадлежащих к ограниченному числу широких таксономических подразделений [15].Представители анаэробных родов Bacteroides, Eubacterium, Clostridium, Ruminococcus, и Faecalibacterium , как правило, составляют большую часть микробного сообщества кишечника взрослых людей. Тем не менее, кишечник каждого взрослого человека, по-видимому, имеет уникальное микробное сообщество со структурой, которая остается стабильной в течение нескольких месяцев [3,15,16].
Напротив, микробиота желудочно-кишечного тракта младенцев более изменчива по своему составу и менее стабильна с течением времени. На первом году жизни кишечный тракт младенца прогрессирует от бесплодия к чрезвычайно плотной колонизации, заканчиваясь смесью микробов, которая в целом очень похожа на микробы, обнаруженные в кишечнике взрослого человека [17].Хотя начальная и конечная точки этого временного отрезка хорошо определены, путь между этими точками плохо понят. В литературе имеются противоречивые сообщения о составе микробиоты ЖКТ новорожденных и факторах, которые ее формируют. В нескольких исследованиях сообщалось, что бифидобактерии почти всегда доминируют в микробиоте ЖКТ грудных детей к возрасту нескольких недель [17–20], в то время как другие обнаружили, что они встречаются только у небольшой части младенцев или численно не доминируют [21, 22].Влияние диеты на состав микробиоты желудочно-кишечного тракта младенцев также является спорным — многочисленные исследования показали более низкую численность Bifidobacteria и более высокую численность аэробных бактерий в микробиоте желудочно-кишечного тракта младенцев, вскармливаемых смесью, по сравнению с младенцами на грудном вскармливании [ 20,21,23–25], однако в других отчетах такой разницы не обнаружено [26,27]. Способ родов часто упоминается как один из ключевых факторов, формирующих микробиоту младенца [18,28,29]. Сообщалось, что микробиота желудочно-кишечного тракта младенцев, рожденных с помощью кесарева сечения, отличается от микробиоты младенцев, рожденных естественным путем, как по времени колонизации, так и по составу [18,30–32], а в некоторых случаях имеются явные следы материнского микробиота влагалища в микробиоте желудочно-кишечного тракта новорожденных [33], однако относительная важность способа доставки для микробиоты желудочно-кишечного тракта неясна.Из-за увеличения частоты проблем с желудочно-кишечным трактом у недоношенных детей, влияние гестационного возраста также широко изучалось. Эти исследования неизменно показывают, что микробиота госпитализированных недоношенных детей отличается от микробиоты здоровых доношенных детей [32,34–36]. Попытки связать определенные микробы с возникновением некротического энтероколита, состояния с подозрением на бактериальную этиологию, которое является важной причиной заболеваемости и смертности недоношенных детей, дали неоднозначные результаты [32,36].Очевидно, что еще многое предстоит узнать о происхождении и развитии микробиоты желудочно-кишечного тракта младенцев и ее влиянии на здоровье и болезни.
Мы сосредоточили наше исследование на описании ряда профилей, составляющих здоровую микробиоту желудочно-кишечного тракта младенцев, в надежде обнаружить темы, которые управляют ее развитием, а также предоставить подробные справочные материалы и прочную основу для последующих исследований, посвященных изучению факторов, влияющих на ее развитие. Микробиота ЖКТ. В нашем исследовании участвовали 14 здоровых доношенных детей, рожденных от 13 здоровых матерей (включая одну группу разнояйцевых близнецов) (Таблица 1).Образцы стула собирали в соответствии с установленным графиком, начиная с первого стула после рождения: образцы собирали сначала ежедневно, а затем с уменьшающейся частотой в течение 1 года, с дополнительным отбором образцов вокруг ключевых событий (например, введение твердой пищи и введение антибиотиков), что дает в среднем 26 образцов стула на каждого ребенка (Таблица 2). Кроме того, у родителей, братьев и сестер были взяты образцы стула, а у матерей — вагинальные мазки и грудное молоко.Мы проанализировали микробиоту каждого из этих образцов с использованием недавно разработанного микроматрицы рДНК SSU, предназначенной для почти полного охвата известных видов рДНК SSU. Подмножество этих образцов было также проанализировано секвенированием библиотеки клонов рДНК SSU с целью калибровки и проверки наших результатов на микрочипах.
Результаты
Сравнение профилей бактериальной популяции на основе микрочипов и последовательностей
Чтобы изучить состав нашего набора образцов и обеспечить основу для количественной калибровки результатов микроматрицы, мы создали контрольный пул, объединив равные количества амплифицированной рДНК SSU из каждого образца, способного амплифицироваться с помощью ПЦР (за исключением образцов, собранных, когда младенцы были ≥1 года).Мы получили 3 458 высококачественных последовательностей клонов из библиотеки, созданной из этого пула, и таксономически присвоили каждой последовательности с помощью классификатора проекта базы данных рибосом [37]. Таксономическое распределение этих последовательностей суммировано в Таблице 3.
Чтобы оценить эффективность нашего нового дизайна микроматрицы относительно секвенирования рДНК SSU, мы секвенировали рДНК SSU, амплифицированные из каждого из 12 индивидуальных биологических образцов, полученных в этом исследовании, выбранных по их разнообразным профилям с помощью анализа микроматрицы 16S рДНК.Этот набор исследований включал ДНК, выделенную из восьми детских стула, двух материнских стула, одного вагинального мазка и одного образца грудного молока. Для каждого из этих образцов мы амплифицировали последовательности рДНК SSU с использованием тех же праймеров ПЦР, которые использовались в анализе микрочипов, затем клонировали и секвенировали несколько сотен (среднее значение = 342) амплифицированных продуктов для всего 4100 последовательностей.
Мы сосредоточили наше сравнение на уровнях 2, 3 и 4 иерархии прокариотического множественного выравнивания последовательностей (prokMSA), которые очень приблизительно соответствуют уровням типа, класса и порядка в классической таксономической иерархии.На этих более широких уровнях ожидается, что большинство последовательностей будут иметь гомологию по крайней мере с одним зондом в нашем текущем дизайне микроматрицы, и последовательности рДНК, как правило, можно однозначно классифицировать. Оценки относительной численности на основе микрочипов были получены для 2149 видов и таксономических групп путем объединения данных от всех зондов, которые представляли любое подмножество рассматриваемого класса, как полностью описано в разделе «Материалы и методы». Оценки на основе последовательностей были получены путем таксономической классификации каждой последовательности путем присвоения кода операционной таксономической единицы (OTU) prokMSA наилучшего соответствия BLAST в базе данных prokMSA 2004 года из 86 453 последовательностей гена рибосомной РНК (рРНК) SSU [38] (наборы данных S1 и S2 ).Хотя относительную численность бактериального вида нельзя точно определить из его пропорционального представительства в пуле амплифицированных последовательностей рДНК, мы ожидаем, что такие оценки должны быть точными в пределах порядка величины и обычно в пределах нескольких раз [39–41], на основе предыдущих исследований, в которых сравнивались уровни численности, оцененные на основе секвенирования ампликонов рДНК SSU, с подсчетами, основанными на гибридизации in situ.
В целом результаты микроматрицы были очень похожи на результаты, полученные путем секвенирования, как качественно, так и количественно.На рисунке 1А показано сравнение профилей сообществ каждого из 12 образцов, полученных в результате нашего анализа микрочипов и путем секвенирования, для каждой таксономической группы на уровне 2 таксономического дерева prokMSA. Обратите внимание, что уровни (например, уровень 2) в таксономии prokMSA не имеют последовательного соответствия уровням (например, типу) в классической таксономической иерархии, и, таким образом, некоторые из традиционных имен, связанных с группами уровня 2 prokMSA, могут выглядеть несколько несочетаемый. Как анализ последовательностей, так и анализ микрочипов показали, что в образцах преобладает ограниченное число таксономических групп — 99% из 4100 последовательностей охватываются всего тремя из 22 подразделений prokMSA уровня 2: 2.15 (Flexibacter-Cytophaga-Bacteroides), 2,28 (Proteobacteria) и 2,30 (грамположительные бактерии [включая Firmicutes и Actinobacteria]), а оставшийся 1% принадлежал к группам 2,10 (Prosthecobacter), 2,29 (Fusobacteria) , или 2,21 (цианобактерии и хлоропласты). Как показано на рис. 1B и 1C, профили населения, полученные с помощью микроматрицы и анализа секвенирования, также были количественно схожи — корреляция Пирсона оценок относительной численности на основе микрочипов и секвенирования для 12 образцов была равна 0.97 на таксономическом уровне 2 prokMSA (рис. 1В), 0,89 на уровне 3 (рис. 1С) и 0,80 на уровне 4 (неопубликованные данные).
Рис. 1. Сравнение профилей сообществ на основе микрочипов и секвенирования
Полученные с помощью микроматрицы и полученные с помощью секвенирования оценки численности таксономических групп сравниваются для 12 биологических образцов.
(A) Сравниваются оценки численности для всех таксонов prokMSA уровня 2, измеренные на массиве. Каждый столбец представляет собой один биологический образец, а каждая строка соответствует одной таксономической группе, идентифицируемой (справа от каждой строки) своим числовым кодом prokMSA OTU вместе с примерно соответствующим условным названием группы.
(B) Сравнение оценок относительной численности на основе последовательностей и микрочипов для таксономических групп уровня 2 в 12 образцах (то же, что и в [A]). Ось x представляет относительную численность, оцененную по частоте клонов из данной таксономической группы, а ось y представляет относительную численность, оцененную с помощью профилирования микроматрицы.
(C) То же, что (B) для таксономических групп уровня 3.
https://doi.org/10.1371/journal.pbio.0050177.g001
Абсолютное количественное определение бактерий
Мы оценили общую плотность бактерий в каждом образце с помощью количественного ПЦР (кПЦР) в реальном времени, используя широкий набор бактериальных праймеров и зондов (см. «Материалы и методы»). Мы использовали общее количество копий гена рРНК (обычно около пяти на геном [42]) на грамм стула, рассчитанное с помощью этого анализа, чтобы приблизительно определить общую плотность бактерий. Как показано на рисунке 2, общее количество копий гена рРНК было относительно нестабильным в течение первой недели жизни, а затем сохранялось у большинства младенцев в диапазоне от 10 9 до 10 10 / г стула (сырой вес).Хотя явного влияния метода родоразрешения на время колонизации не наблюдалось, следует отметить, что младенцы 13 и 14 лет (близнецы с дизиготом), которые были единственными детьми, родившимися с помощью планового кесарева сечения и, следовательно, без разрыва околоплодных вод. мембрана и воздействие микробиоты родовых путей матери во время схваток или родоразрешения имели низкое количество бактерий (<10 8 копий гена рРНК / г) до седьмого дня жизни.
Рисунок 2. Изменение общей плотности фекальных бактерий в течение первого года жизни.
Для каждого образца ребенка численность бактерий оценивалась с помощью TaqMan ПЦР в реальном времени с универсальными бактериальными праймерами. Расчетные копии гена рРНК на грамм фекалий ( x -ось) нанесены на график как функция дней жизни ( x -ось). Обе оси имеют логарифмическую шкалу. Измерения обилия усечены по нижнему краю до значения, соответствующего 95-му процентилю экстракционных (отрицательных) контролей (количество копий, скорректированное на среднюю массу стула). Эпизоды антибактериального или противогрибкового (нистатин) лечения показаны на временной оси серыми или розовыми полосами соответственно (дополнительную информацию см. В Таблице 1).
https://doi.org/10.1371/journal.pbio.0050177.g002
Обзор профилей популяции бактерий на основе микрочипов
Мы проанализировали бактериальный состав 430 образцов — 363 образца детского стула, 43 образца стула взрослых, 2 образца стула братьев и сестер, 12 образцов грудного молока и 10 материнских вагинальных мазков — путем гибридизации с микрочипом ДНК, разработанным в этом исследовании. Объединив информацию по нескольким зондам (см. Материалы и методы), мы получили оценки относительной численности для 2149 вложенных таксономических групп и видов в каждой из этих выборок (все зонды перечислены в наборе данных S3; все таксоны перечислены в наборе данных S4).Как показано на рисунке 3, разнообразие на уровне филумов в образцах стула, проанализированных в этом исследовании, было чрезвычайно ограниченным. В подавляющем большинстве образцов преобладали всего три из 22 бактериальных групп уровня 2, представленных нашим микрочипом: 2,15 (Flexibacter-Cytophaga-Bacteroides), 2,28 (Proteobacteria) и 2,30 (грамположительные бактерии [Firmicutes и Actinobacteria] ). Вторым важным открытием стала замечательная степень индивидуальных различий в процессе колонизации. Хотя таксоны, населяющие желудочно-кишечный тракт младенца, были ограничены на самых широких уровнях, каждый ребенок отличался сочетанием видов микробов, которые он приобрел и поддерживал, а также точным временным паттерном, в котором эти виды появлялись и исчезали.Например, Bacteroides, доминировали в ранней микробиоте некоторых младенцев, но практически отсутствовали на этой стадии у других младенцев. Третьей поразительной особенностью этого набора данных была относительная стабильность микробных популяций во времени — даже на ранних этапах заселения желудочно-кишечного тракта младенца большинство таксономических групп сохранялось в течение интервалов от недель до месяцев.
Рисунок 3. Обзор профилей микробных сообществ всех образцов
Каждый столбец ( n = 430) представляет один биологический образец, а каждая строка ( n = 2149) представляет одну таксономическую группу или вид.Выборки организованы во временном порядке, начиная с рождения слева и любых образцов, полученных от матери или других семей, справа от каждого временного курса. Клинья над столбцами пронумерованы в соответствии с идентификатором ребенка. Строки (таксоны) сортируются по их числовым кодам, так что подгруппы данной группы лежат непосредственно под более общей группой (например, 2.15, затем 2.15.1, затем 2.15.1.1). Символы «>» и «>>» добавляются к названиям помеченных таксономических групп, которые являются подгруппами на уровне 3 или уровне 4, соответственно, помеченной таксономической группы уровня 2.Увеличение темноты шкалы серого соответствует более высокому расчетному относительному содержанию.
https://doi.org/10.1371/journal.pbio.0050177.g003
Основными измерениями различий между профилями колонизации различных таксономических групп были время колонизации и временная стабильность. В соответствии с предыдущими исследованиями [28,35,43,44], первыми колонизаторами часто были организмы, которые, как предполагалось, были аэробами (например, Staphylococcus, Streptococcus, и Enterobacteria), тогда как более поздние колонизаторы, как правило, были строгими анаэробами (Eubacteria и Clostridia) . Bacteroides сильно различались от ребенка к ребенку по времени их первого появления, но в некоторой степени постоянно присутствовали почти у всех младенцев к 1 году. Несколько других таксонов, в том числе Prevotella, Acinetobacter, Desulfovibrio, Veillonella, и Clostridium perfringens, , как правило, появлялись временно, иногда появлялись и исчезали повторно в течение первого года жизни ребенка.
Сходства и различия между профилями населения
Мы исследовали сходства и различия в составе всех наших выборок путем иерархической кластеризации 430 выборок на основе их сходства в отношении их профилей численности для набора из 53 таксономических групп prokMSA уровня 4, которые имели как минимум две выборки с относительной оценка численности более 1%.Схема кластеризации, отраженная в дендрограмме в верхней части рисунка 4, выделяет несколько важных особенностей программы колонизации и показывает, что микробиота стула детей в возрасте 1 года и старше заметно отличается от таковой в более раннем возрасте и намного больше. похож на взрослых. До 6 мес. Образцы стула имели тенденцию группироваться по каждому ребенку, что указывает на то, что различия от ребенка к ребенку намного больше, чем изменения в течение недель или месяцев в составе микробиоты любого отдельного ребенка.Было два заметных исключения из этой кластеризации, ориентированной на ребенка. Во-первых, образцы из первых нескольких дней жизни часто сгруппированы отдельно от остальных образцов данного ребенка, иногда сгруппировавшись с другими очень ранними образцами, а иногда с образцами из других мест (например, ребенок 8-го дня 1 с образцами из влагалища). Во-вторых, образцы от младенцев 13 и 14, которые являются разнояйцевыми близнецами, имели тенденцию смешиваться. На рисунке 4B показаны примеры нескольких описанных выше шаблонов кластеризации.
Рисунок 4.Кластеризация выборок на основе профилей популяций наиболее распространенных и многочисленных таксонов
(A) Каждый столбец ( n = 430) представляет один биологический образец, а каждая строка ( n = 52) представляет одну таксономическую группу или вид 4 уровня. для двух или более образцов оценки относительной численности превышали 1%. Представлены все образцы, включая образцы стула от младенцев, родителей и братьев и сестер, а также образцы молока и влагалища. Образцы были сгруппированы по центрированной корреляции Пирсона, так что столбцы, представляющие наиболее похожие образцы, сгруппированы вместе, тогда как таксономические группы (строки) сортируются численно, а не кластеризоваться.Увеличение темноты шкалы серого соответствует более высокому расчетному относительному содержанию. Значения log 2 относительной численности.
(B) Отобранные кластеры, иллюстрирующие, что (1) профили из образцов стула раннего ребенка группируются по ребенку, (2) образцы стула очень раннего ребенка объединяются с образцами матери и (3) образцы из пары разнояйцевых близнецов группируются вместе и смешиваются.
https://doi.org/10.1371/journal.pbio.0050177.g004
Большинство образцов грудного молока и материнского влагалища идеально сгруппированы по анатомическим участкам происхождения.Как и ожидалось, во всех вагинальных образцах, кроме одного, преобладали лактобациллы, включая Staphylococci , Bacteroides, Clostridia и Veillonella среди групп, которые в разной степени присутствовали как составляющие меньшинства. Влагалищный образец от одной из матерей (матери ребенка 11) имел отчетливо другой профиль популяции, в котором преобладали представители группы гамма-протеобактерий. Популяции микробов, обнаруженные в образцах молока, были разнообразными, часто включая смеси кишечных бактерий и видов Bacteroides, Pseudomonas, Haemophilus, Veillonella, и Streptococcus .
Для более систематического сравнения младенцев мы определили выборку ближайших соседей для каждой выборки, измеренную с помощью корреляции Пирсона оценок относительной численности четвертого уровня. Используя эту метрику, выборка ближайшего соседа любой данной выборки ребенка обычно была другой выборкой от того же ребенка — средний процент образцов от данного ребенка, для которых наиболее похожая выборка была от того же ребенка, составляла 82%. Рисунок 5 суммирует этот анализ и иллюстрирует интересный вывод о том, что по этому показателю наиболее похожей парой младенцев были младенцы 13 и 14 лет — разнояйцевые близнецы, воспитанные в одной и той же среде — 8 из 23 (35%) ближайших младенцев 13 лет. — образцы соседей были взяты от ребенка 14 (следующей наиболее похожей парой были дети 11 и 14 лет — 17%).
Рис. 5. Сходство микробиоты у младенцев
Для каждой пары образцов мы рассчитали образцы ближайших соседей в соответствии с корреляцией Пирсона профилей относительной численности уровня 4. Затем для каждого ребенка мы вычислили, какой процент выборок ближайшего соседа был получен от каждого ребенка. Оттенок серого указывает процент образцов из детского Y (столбец), которые были ближайшими соседями образцов из детского X (строка), так что суммы строк составляют 100%.
https: // doi.org / 10.1371 / journal.pbio.0050177.g005
Временные тенденции
Сходство профилей микробных сообществ в образцах стула младенцев 1 года и старше друг с другом и с образцами стула взрослых свидетельствует о том, что сообщества желудочно-кишечного тракта младенцев со временем сошлись к обобщенной «взрослой» микробиоте. Мы исследовали этот феномен, вычислив для каждого возрастного интервала среднюю попарную корреляцию Пирсона популяционных профилей всех выборок младенцев, собранных в этом возрасте.Как показано на рис. 6А, этот анализ показал, что с течением времени микробиота младенцев постоянно приближалась к общему профилю. Мы также рассчитали для каждой временной точки среднюю корреляцию выборок младенцев в этот момент времени с обобщенным профилем взрослого (центроид 18 выборок взрослых — девять отцов и девять матерей из этого исследования). Этот анализ, показанный на рисунке 6B, подтвердил, что профиль, к которому сходится микробиота младенцев, аналогичен профилю взрослых, и выявил очевидную тенденцию к перегруппировке популяции, которая происходит примерно через 5 дней после рождения.Примечательно, что микробиота желудочно-кишечного тракта младенцев не была значительно больше похожа на микробиоту их родителей, чем на микробиоту других взрослых, если судить по корреляциям Пирсона их таксономических профилей уровня 4 (средняя корреляция ребенок-родитель 0,55 для внутри семьи по сравнению с 0,62. между семьями для девяти «триад» одновременно полученных образцов от ребенка, матери и отца, полученных в возрасте 1–1,5 года).
Рис. 6. Временные паттерны среднего попарного сходства профилей микробиоты детского стула
(A) Сходство между младенцами во времени.Для каждой временной точки, для которой был составлен профиль не менее шести младенцев, мы вычисляли среднюю попарную корреляцию Пирсона между таксономическими профилями уровня 4 всех младенцев в этот момент времени. Также показана средняя парная корреляция Пирсона между этими профилями у 18 взрослых участников этого исследования (девять мужчин и девять женщин) (пустой кружок обозначен стрелкой).
(B) Переход к взрослой флоре с течением времени. Для каждой временной точки, для которой был составлен профиль по крайней мере четырех младенцев, мы рассчитали среднюю корреляцию Пирсона между таксономическими профилями уровня 4 всех младенцев в этот момент времени и «общим взрослым» профилем.Общий профиль взрослого — это центроид 18 (девять мужчин и девять женщин) взрослых (родителей в этом исследовании).
https://doi.org/10.1371/journal.pbio.0050177.g006
Чтобы визуализировать временные закономерности в определенных филогенетических группах, населяющих кишечник младенца, мы составили график относительной численности девяти таксономических групп уровня 4, которые имели средняя относительная численность 1% или более с течением времени у каждого младенца (рис. 7). Этот анализ позволил нам выявить общие темы и интересные различия между профилями колонизации этих младенцев.Во-первых, мы заметили, что «неравномерные» популяции (популяции, в которых преобладает одна таксономическая группа) были обычными в первые несколько недель, но редко в более поздние сроки. Другой примечательной особенностью временной программы многих младенцев было возникновение одного или нескольких резких сдвигов в структуре популяции — такие сдвиги часто стабилизировались в пределах одного интервала выборки. Нам не удалось идентифицировать какой-либо конкретный возраст или сигнальное событие, постоянно связанное с такими переходами, хотя переход к «взрослому» профилю часто сопровождал введение твердой пищи.
Рис. 7. Временные профили наиболее обильных таксономических групп уровня 3
Таксономические группы уровня 3 были выбраны для отображения, если их средняя (нормализованная) относительная численность по всем образцам детенышей превышала 1%. Ось x показывает дни с момента рождения и отображается в логарифмической шкале, а ось x показывает оценочную (нормализованную) относительную численность. Для некоторых младенцев значения для первых нескольких дней не отображаются, поскольку общее количество бактерий в образцах стула, собранных в эти дни, было недостаточным для анализа на основе микрочипов.
https://doi.org/10.1371/journal.pbio.0050177.g007
Несколько младенцев получали антибиотики либо в неонатальном периоде (дни 0–28), либо в более поздние месяцы (см. Таблицу 1 и Рисунок 2). Больше подробностей). В некоторых случаях лечение было связано с резким изменением плотности или состава микробиоты желудочно-кишечного тракта. Например, ребенок 8 получил два курса амоксициллина: один в 4 месяца и один в 6 месяцев. В обоих случаях как общая плотность бактерий (Рисунок 2), так и состав сообщества резко изменились (Рисунки 3 и 6).Действительно, у этого ребенка плотность бактерий в образцах кала снизилась настолько во время курсов антибиотиков, что мы не смогли амплифицировать достаточное количество рДНК SSU для анализа микрочипов, поэтому мы могли сравнивать популяции только до и после курса антибиотиков. Однако мы не выявили каких-либо устойчивых последствий лечения антибиотиками.
Эксперименты по валидации микрочипов
Результаты как анализа последовательности эталонного пула, так и анализа данных микроматрицы показали, что бифидобактерии были лишь второстепенными компонентами популяции — результат расходится с общепринятым мнением [20,21,26].Праймеры, которые мы использовали для широкой ПЦР-амплификации контрольного пула (источник последовательностей), и образцы для анализа микрочипов были потенциально неоптимальными для амплификации Bifidobacteria [21,26] из-за трех несовпадений в последовательности рДНК Bifidobacterium longum и прямой праймер 8F, использованный в этом исследовании. Обзор 5′-последовательностей полноразмерных генов рДНК SSU показал, что бифидобактерии резко отличаются от обычно консервативной последовательности праймера 8F. Поэтому мы провели два независимых анализа, чтобы определить, нужно ли и каким образом корректировать количественные оценки бифидобактерий по результатам гибридизации микрочипов.Во-первых, мы количественно оценили относительную эффективность, с которой пара праймеров 8F / 1391R амплифицировала рДНК SSU из двух видов Bifidobacterium — Bifidobacterium longum и Bifidobacterium infantis — по сравнению с набором из трех различных распространенных фекальных бактерий — Escherichia coli, Clostridium perfringens, Bacteroides fragilis — все они имеют последовательности рДНК SSU с одним или несколькими несовпадениями с последовательностями праймеров 8F / 1391R ПЦР. Используя ряд стехиометрических смесей хромосомной ДНК, выделенных из этих видов, мы обнаружили, что после 20 циклов (количество циклов, использованных для наших анализов микроматриц и для амплификации контрольного пула перед секвенированием) эффективность амплификации двух видов бифидобактерий ДНК была в 8 раз ниже, чем у трех других видов, все из которых амплифицировались с почти одинаковой эффективностью (неопубликованные данные).Этот результат предполагает, что как результаты секвенирования контрольного пула, так и количественный анализ на основе микрочипов занижали численность группы бифидобактерий в восемь раз. Во-вторых, мы использовали анализ кПЦР в реальном времени с парой праймеров и зондом, оптимизированными для обнаружения бифидобактерий, чтобы получить независимую оценку численности бифидобактерий в каждом образце. Результаты подтвердили вывод микроматричного анализа о том, что бифидобактерии почти всегда были лишь второстепенными составляющими фекальной микробиоты как младенцев, так и взрослых в нашей исследуемой популяции (набор данных S5 и рисунок S1).
Большинство видов бактерий, идентифицированных в нашем наборе образцов, ранее входили в состав микробиоты желудочно-кишечного тракта человека. Однако был ряд случаев, в которых результаты микроматрицы указывали на присутствие вида или группы бактерий, которые были неожиданными и не представлены в нашем пуле секвенированных эталонов. Мы исследовали несколько из этих случаев с помощью независимых анализов. Для 12 подозрительных видов / таксонов мы использовали родственные группоспецифичные праймеры в ПЦР-анализе, примененном к большинству или всем образцам, в которых подозреваемые виды / таксоны, по-видимому, присутствовали на основании результатов микроматрицы, а также небольшой набор образцов, в которых подозрительные виды не были обнаружены микрочипом.В одном случае, в случае Sutterella wadsworthia, секвенирование видоспецифичного продукта ПЦР подтвердило его присутствие. В семи из 12 случаев ни один из массивов положительных (или отрицательных) образцов не дал амплифицированного продукта при анализе ПЦР. В четырех оставшихся случаях анализ якобы видоспецифической ПЦР дал амплифицированный продукт ожидаемого размера, но клоны, секвенированные из этого продукта, не соответствовали ожидаемым видам. Мы дополнительно исследовали эти четыре случая путем секвенирования библиотеки клонов, полученной путем амплификации с теми же праймерами широкого диапазона, которые использовались при подготовке к анализу микроматрицы.Хотя секвенирование не подтвердило присутствие какого-либо из четырех сомнительных видов / таксонов, оно предоставило убедительные доказательства основного источника ложноположительных сигналов гибридизации. В частности, в трех из четырех случаев мы идентифицировали относительно многочисленные виды, чья последовательность рДНК была достаточно похожа на последовательность зонда, что, вероятно, объясняло наблюдаемый сигнал. В одном случае (Legionella pneumophila), , который, как предполагалось, присутствует примерно в 1%, мы не смогли идентифицировать какие-либо виды-кандидаты, которые могли бы объяснить сигнал гибридизации (т.е., ни один с лучшими совпадениями BLAST ≥30 баллов) среди нашего набора из 192 последовательностей. Поскольку наша способность обнаруживать виды, присутствующие с частичной численностью 1%, составляла только 85%, остается возможным, что этот вид или другой вид со сходной последовательностью рДНК SSU мог присутствовать в небольшом количестве в подозрительных образцах.
Обнаружение и количественная оценка грибов и архей
Наши методы экстракции ДНК и амплификации рДНК были оптимизированы для бактерий и неоптимальны для эукариот и архей, поэтому мы отдельно проверили наличие и численность грибов или архей с помощью анализов кПЦР с широкой специфичностью для соответствующих таксономических групп.На основании нашего анализа количественной ПЦР, грибки периодически обнаруживались в образцах стула при относительно низкой численности (10 4 –10 6 гена рРНК / г сырой массы фекалий), сохраняющихся в течение различной продолжительности у отдельных детей в течение первого года жизни. . У одного из детей, участвовавших в этом исследовании (ребенок 10), была отмечена сыпь от подгузников, а также молочница во рту, которые обычно вызываются грибком (Candida), и лечились противогрибковыми препаратами (нистатином). ). Анализ qPCR обнаружил особенно высокие уровни грибковой рДНК в образцах стула этого ребенка, особенно в тот период, когда были описаны эти результаты.У матери этого ребенка также были заметно высокие уровни грибковых последовательностей рДНК SSU в пренатальном образце вагинального мазка, но не в образце стула «нулевого дня».
Распространенность архей была значительно ниже и более вариабельна, чем распространенность грибов или бактерий; Анализ qPCR обнаружил гены рРНК архей (в диапазоне 10 3 –10 6 генов рРНК / г) только у семи младенцев в течение первого года жизни, а у четырех из этих младенцев они были обнаружены только у одного образец.У этих младенцев археи появлялись временно и почти исключительно в первые несколько недель жизни; они были обнаружены только у одного младенца после пятой недели жизни. Ограниченный анализ последовательностей архей, амплифицированных из трех образцов стула матери, которые дали положительный результат на археи (матери 4, 9 и 12), выявил преобладание Methanobrevibacter smithii (идентифицировано 7/8 архейных клонов, включая по крайней мере по одному клону от каждой матери), с одним дополнительным (некультурным) архейным филотипом.Результаты анализа количественной ПЦР грибов и архей включены в набор данных S5 и показаны графически вместе с результатами количественной ПЦР бактерий на Фигуре S2.
Обсуждение
Микробная колонизация желудочно-кишечного тракта младенца — примечательный эпизод в жизненном цикле человека. Каждый раз, когда рождается человеческий ребенок, из стерильной среды развивается богатая и динамичная экосистема. В считанные дни микробные иммигранты создают процветающее сообщество, население которого вскоре превосходит численность собственных клеток ребенка.Эволюционно древний симбиоз между желудочно-кишечным трактом человека и его резидентной микробиотой, несомненно, включает в себя разнообразные взаимные взаимодействия между микробиотой и хозяином, что имеет важные последствия для здоровья и физиологии человека. Эти взаимодействия могут иметь полезные пищевые, иммунологические эффекты и эффекты развития или патогенные эффекты для хозяина [2,5,7,18,45].
Это исследование началось с разработки микрочипа ДНК с почти полным охватом бактериальных таксонов, представленных в доступной базе данных последовательностей генов SSU рРНК.Наш дизайн микроматрицы и экспериментальные методы были основаны на уроках, извлеченных при валидации менее полной микроматрицы SSU рДНК [46]. Эти предыдущие эксперименты позволили нам оптимизировать наши методы для компьютерного прогнозирования поведения гибридизации SSU рДНК и разработать экспериментальный протокол, который максимизировал специфичность гибридизации. Превосходное согласование измерений отдельных таксонов, определенных с использованием нового дизайна микрочипов, по сравнению с результатами секвенирования из соответствующих библиотек клонов рДНК SSU (рисунок 1) предполагает, что эти принципы дизайна справедливы для этой платформы для множества таксонов и дают нам уверенность в том, что полнота и точность результатов, полученных с помощью нашего нового набора микрочипов.Однако важно отметить, что наши методы проектирования и анализа массивов несовершенны и все еще развиваются. Некоторые из неожиданных видов, которые, как предсказывает микроматрица, должны присутствовать в одном или нескольких образцах, не могут быть подтверждены секвенированием. В большинстве этих случаев анализ последовательности рассматриваемого образца (ов) показал, что перекрестная гибридизация на низком уровне высокоразвитых видов была ответственна за ложноположительный прогноз, результат, который будет приниматься во внимание в будущих раундах массива. дизайн и анализ.
Мы использовали этот микрочип в подробном, систематическом и количественном исследовании бактериальной колонизации желудочно-кишечного тракта новорожденного человека. Мы использовали только что собранные образцы стула в качестве заменителей образцов, взятых из просвета и слизистой оболочки толстой кишки. Хотя, несомненно, существуют различия в популяционных профилях образцов кала и соответствующих слизистых оболочек, в предыдущем исследовании мы обнаружили, что профили, тем не менее, удивительно согласованы — достаточно, чтобы отдельные образцы стула можно было легко сопоставить с образцами биопсии толстой кишки от одного и того же человека на основе на сходство их бактериальных профилей [15,46].Таким образом, мы полагаем, что результаты нашего временного анализа бактериальных популяций в образцах детского стула предоставляют полезное окно для анализа резидентной микробиоты толстой кишки.
Принимая во внимание важность симбиоза между человеческим хозяином и кишечными комменсалами как для человека-хозяина, так и для микробного колониста, было бы легко представить, что программа микробной колонизации желудочно-кишечного тракта новорожденных развивалась под сильным избирательным давлением, воздействуя на как кишечная ниша, так и ее микробные колонисты должны быть сильно детерминированными и стереотипными.Мы могли ожидать, что весьма ограниченная группа совместно эволюционирующих комменсалов будет исключительно хорошо адаптирована к этой среде и будет последовательно доминировать в процессе колонизации стереотипным образом. Действительно, бактерии, которые мы обнаружили в кале младенцев и взрослых, предположительно отражающие микробиоту толстой кишки, были в значительной степени ограничены лишь небольшой подгруппой бактериального мира — Proteobacteria, Bacteroides, Firmicutes, Actinobacteria и Verrucomicrobia. Тем не менее, к удивлению, мы обнаружили, что в первые дни или месяцы жизни микробиота кишечника младенца и временная структура, в которой она развивается, заметно варьируются от человека к человеку.Казалось бы, хаотичное развитие ранних событий колонизации и сходство бактериального состава некоторых ранних младенческих образцов с грудным молоком или вагинальными мазками позволяет предположить, что бактериальная популяция, которая развивается на начальных стадиях, в значительной степени определяется конкретными бактериями. которому случайно подвергается ребенок. Примечательно, что эти материнские «сигнатуры» не сохранялись бесконечно, о чем свидетельствует наша неспособность найти значительно более высокую корреляцию общих таксономических профилей пар ребенок / родитель из одного и того же домохозяйства по сравнению с разными домохозяйствами.
Важным исключением из рассказа об индивидуальности и уникальности ранних профилей было поразительное сходство временных профилей разнояйцевых близнецов (младенцев 13 и 14) (Рисунки 4 и 5). Эти близнецы имели как общую среду обитания, так и приблизительно 50% генетической идентичности, что делает невозможным определение из этого исследования, в какой степени каждая из этих общих черт ответственна за их сходные модели колонизации. Однако данные этого и других исследований показывают, что общая среда является основным фактором.Одним из аргументов в пользу этой точки зрения является отсутствие сопоставимого сходства в микробных сообществах других пар, которые также имеют 50% генетическую идентичность, включая мать: ребенок, отец: ребенок и родной брат: ребенок (неопубликованные данные), хотя это несходство может отчасти из-за разных стадий их развития. Еще один аргумент в пользу сильного влияния окружающей среды — это случайное временное появление определенных организмов у обоих близнецов — трудно представить, что появление определенного микроба в определенный день может быть генетически запрограммировано.Наш последний аргумент основан на доказательствах из предыдущего исследования, что микробиота генетически эквивалентных семей от скрещивания инбредных мышей была более сходной среди членов одного и того же «домашнего хозяйства» (мать и потомство, которые делят клетку), чем между домашними хозяйствами [1].
Определение «здоровой» кишечной микробиоты охватывает удивительное разнообразие профилей сообщества в первые 6 мес жизни. Хотя в первые месяцы эти микробные сообщества были разнообразными и своеобразными, они постепенно становились все более похожими друг на друга (рис. 6А), приближаясь к общему профилю, подобному взрослому (рис. 6В), характеризующемуся преобладанием Bacteroides и Firmicutes, обычным явлением Веррукомикробия и очень низкая численность протеобактерий и аэробных грамотрицательных бактерий в целом.Мы предполагаем, что самые ранние события колонизации в значительной степени определяются условно-патогенной колонизацией бактериями, которым ребенок подвергается в окружающей среде. Общие воздействия окружающей среды, вероятно, включают микробиоту влагалища, фекалий или кожи матери, о чем свидетельствует наблюдаемое сходство микробиоты раннего стула у некоторых младенцев с этими образцами, что согласуется с предыдущими доказательствами вертикальной передачи микробов [33,47 , 48]. Таким образом, разнообразие и вариативность отражают соответствующую индивидуальность этих случайных воздействий.Однако со временем преимущество пригодности таксонов, которые обычно доминируют в микробиоте толстой кишки взрослых особей, по-видимому, преодолевает первоначальное преимущество оппортунистов, колонизирующих на ранней стадии и менее приспособленных к кишечной среде. Кроме того, прогрессирующие изменения в кишечной среде, обусловленные внутренними изменениями слизистой оболочки кишечника, переходом на «взрослую» диету и влиянием самой микробиоты [44,49–51], могут требовать все более строгого отбора для наиболее адаптированные бактерии.Таким образом, несмотря на неожиданно хаотичный период первых месяцев жизни, становление экосистемы кишечника у младенцев, в конце концов, следует консервативной традиционной программе.
Трансформация кишечной микробиоты по образцу взрослого неявно включала замену видов, встречающихся у младенцев, но редко у взрослых, видами, характерными для толстой кишки взрослых. Одной из потенциальных движущих сил таких демографических изменений может быть то, что взрослые члены сообщества в конечном итоге будут доминировать в силу их большей способности устойчиво и необратимо утвердиться после колонизации хозяина.Мы искали доказательства этой дифференциальной «липкости», сравнивая автокорреляцию во времени численности каждого «вида» (см. Материалы и методы). Мы не нашли четких доказательств того, что виды, характерные для взрослой микробиоты, смогли установить более стабильную по своей природе колонизацию, чем виды, характерные для детской микробиоты.
Мы и другие обнаружили, что индивидуально-специфические характеристики бактериальной микробиоты взрослых стабильны в том смысле, что они остаются постоянно более похожими у одного человека с течением времени, чем между отдельными людьми, в течение периода в год или более, и одного из поразительными результатами этого исследования было выявление относительно стабильных, индивидуальных особенностей бактериальной колонизации даже в первые недели и месяцы жизни.Эти наблюдения открыли интересную возможность того, что события оппортунистической колонизации в раннем младенчестве могут играть значительную роль в определении отличительных характеристик микробиоты одного и того же человека во взрослой жизни. Мы искали доказательства этого, сравнивая внутрииндивидуальные и межиндивидуальные корреляции бактериальных профилей через 1 или 2 мес. И 1 год, и не обнаружили существенной разницы (неопубликованные данные). Таким образом, хотя эти результаты, безусловно, не исключают возможности того, что события ранней колонизации играют важную роль в определении взрослой микробиоты, не похоже, что между ними существует сильная прямая корреляция.
Наши результаты и выводы значительно отличаются от многих предыдущих отчетов по нескольким аспектам. Одним из заметных расхождений между нашими исследованиями и многими другими была относительно низкая частота и численность бифидобактерий в фекальной микробиоте в любом возрасте от рождения до взрослого возраста. Бифидобактериям уделялось непропорционально большое внимание, отчасти из-за их предполагаемых положительных эффектов, и во многих исследованиях сообщалось (и повторялись обзоры), что в микробиоте грудных детей преобладают бифидобактерии [17–19].Таким образом, мы были удивлены и поначалу скептически относились к очевидной малочисленности бифидобактерий почти во всех наших образцах и предприняли шаги для проверки точности наших результатов. Специфическая кПЦР для бифидобактерий подтвердила вывод, сделанный на основе результатов нашего микроматрицы, что бифидобактерии редко были основными составляющими микробиоты ЖКТ, по крайней мере, в этой исследуемой популяции, и что у большинства младенцев они появлялись только через несколько месяцев после рождения, а затем сохранялись как меньшинство населения.Хотя можно предположить, что существуют географические или демографические различия в распространенности бифидобактерий, мы подозреваем, что акцент на бифидобактерии в исследованиях и обзорах микробиоты желудочно-кишечного тракта младенцев может быть непропорциональным его распространенности, численности и значимости для здоровья.
Представленные здесь результаты указывают на многочисленные направления будущих исследований. Интересной особенностью динамики бактериальной популяции было появление резких сдвигов, перемежающих интервалы относительной стабильности.За исключением одного случая (лечение антибиотиками ребенка 8 лет), мы не смогли легко определить сильного кандидата в причину наблюдаемых нами сдвигов. Некоторые возможности включают вспышки бактериофагов, которые могут выборочно уничтожить доминирующую таксономическую группу [52]; случайное, условно-патологическое вторжение в метаболическую или анатомическую нишу более приспособленным видом; и тонкие изменения кишечной среды, вызванные развитием или диетой, нарушают физический баланс населения. Другими важными направлениями будущих исследований будут сравнение состава и эволюции микробных сообществ, встречающихся у этих здоровых детей, с сообществами недоношенных или других нездоровых детей, а также изучение влияния антибиотиков, диеты и способов родоразрешения на их развитие и эволюцию. сообщества.Несмотря на то, что здоровые дети в этом исследовании предполагали широкий диапазон профилей микробного сообщества, они были схожи в нескольких отношениях, в первую очередь в основных способствующих типах, в приобретении определенных ключевых типов с течением времени и в относительной стабильности их профилей. со временем. Возможно, что при других состояниях здоровья или болезни мы найдем либо виды или группы, которые являются новыми для этой среды, либо необычные комбинации этого недавно определенного набора «обычных» видов.
Важно отметить, что хотя мы показали, что микробиота кишечника становится все более стереотипной в течение первого года, четко установлено, что устойчивые межиндивидуальные различия сохраняются даже у взрослых [15,16].Когда и как развиваются эти стабильные «внутренние» характеристики микробиоты каждого человека? Как долго они сохраняются? Как различная стабильность колонизации разными бактериями связана с их микроанатомическими (например, крипта против ворсинок против слизистого слоя) или метаболическими нишами? Выявление экологических и генетических факторов, которые определяют отличительные характеристики микробиоты каждого человека, а также определение того, влияют ли эти индивидуальные особенности на физиологию и здоровье хозяина и каким образом, будет важной целью будущих исследований, в которых микроматрица, описанная в этом исследовании, будет быть полезным инструментом.
Материалы и методы
Разработка и производство микрочипов.
Микроматрица содержала 10 500 ДНК-зондов (10265 уникальных последовательностей). Зонды включали 1379 контрольных зондов (1144 уникальных последовательностей) и 9121 уникальных таксономически специфичных зонда (5938 зондов на групповом уровне и 3183 зондов на уровне видов), состоящих из 40-нуклеотидных (нуклеотидных) последовательностей, полученных из генов SSU рРНК, и выбранных для их специфичность к соответствующему виду или таксономической группе. Основные принципы проектирования подробно описаны в предыдущем отчете [46].Дизайн был основан на базе данных последовательностей рДНК prokMSA SSU 2004 года и филогенетическом дереве [38], содержащем 86 453 прокариотических последовательностей рДНК SSU (5 672 архей и 80 781 бактериальных), организованных в 672 архейных и 15 765 бактериальных ОТЕ. OTU были определены в prokMSA как группы последовательностей с оценками идентичности (как определено в [38]) выше 95% или 98% (в определенных родах, имеющих медицинское значение). Мы дистиллировали эту базу данных, выбрав одну высококачественную последовательность, репрезентативную для каждой OTU, и урезали последовательности до областей, амплифицированных универсальными бактериями (Bact-8F: 5′-AGAGTTTGATCCTGGCTCAG-3 ‘[53] + 1391R: 5’- GACGGGCGGTGTGTRCA-3 ‘[54]) или архейный (Arch444 [55] / 1391R) праймеры.OTU в нашей сокращенной базе данных prokMSA были организованы в 945 (53 архейных + 892 бактериальных) таксономических групп (узлов), содержащих несколько OTU, и 92 отдельных «узла» OTU.
Номенклатура базы данных была такова, что каждая OTU была обозначена числовым кодом, который указывал на ее таксономию prokMSA, например, вид «1.2.3.4.5.6.007» принадлежит к суперкоролевству 1, типу 1.2, классу 1.2.3, порядку 1.2. .3.4, семейство 1.2.3.4.5, род 1.2.3.4.5.6. В этой рукописи таксономические уровни упоминаются в соответствии с их глубиной в коде OTU, т.е.g., вид «1.2.3.4.5.6» принадлежит к группе с более широким охватом «1» на уровне 1 и к группе с меньшим охватом «1.2.3.4: на уровне 4».
Мы сгенерировали большой набор зондов-кандидатов, используя BLAST [56], чтобы предсказать возможность гибридизации перекрывающихся 40-нуклеотидных последовательностей из каждой OTU в нашей базе данных дистиллированных последовательностей с каждой из других OTU в базе данных (путем разбиения на каждую последовательность с окном на два). Последовательность считалась зондом-кандидатом для конкретной таксономической группы, если прогнозировалось, что она гибридизуется по крайней мере с 10% членов этой группы, а не с какими-либо членами, не входящими в группу, с использованием эмпирически определенного порога 28 из 40 совпадений BLAST — несовпадения (общее количество нуклеотидов за вычетом несовпадений соответствует лучшему совпадению BLAST для данной последовательности рДНК) в качестве предельного значения для потенциальной гибридизации [46].Из полученного набора зондов-кандидатов мы выбрали для каждого узла / таксономической группы два зонда, которые, по прогнозам, гибридизуются с наибольшей частью этой группы. Мы также выбрали зонды из нашего набора кандидатов таким образом, чтобы каждая OTU в нашей дистиллированной базе данных была представлена зондами на максимально возможном количестве таксономических уровней. Из-за нехватки места в массиве мы не смогли напечатать видоспецифические зонды для каждой OTU в нашей базе данных. Вместо этого мы дополнили набор зондов на уровне группы, разработанных, как описано выше, тремя дополнительными наборами зондов.Во-первых, мы составили список видов бактерий, которые были либо релевантными с медицинской точки зрения, либо известными человеческими комменсалами. Мы определили коды prokMSA для каждого из этих видов и протестировали выбранную последовательность из этой OTU для видоспецифичных 40-нуклеиновых последовательностей, как определено баллом совпадения-несоответствия BLAST не более 27 для любой другой последовательности. Мы также оценили видоспецифичные зонды из нашей предыдущей конструкции массива [46] в контексте базы данных prokMSA и включили 467 таких видоспецифичных зондов, представляющих 286 видов.Последней категорией таксономических зондов были зонды «новые OTU» — 316 зондов, разработанные для представления недавно открытых «видов» рДНК SSU, которые были идентифицированы в исследованиях толстой кишки [15] или желудка [57] взрослого человека (новые OTU были определены ограничение идентичности 99%, как описано в исходных исследованиях). Наконец, наш дизайн микроматрицы включал 1153 контрольных зонда — положительных и отрицательных — предназначенных для нормализации и систематического изучения гибридизационного поведения. Отрицательные контроли включали как последовательности, не относящиеся к рДНК, так и последовательности рДНК обратного комплемента, тогда как положительные контроли включали последовательности праймеров и несколько наборов перекрывающихся зондов, охватывающих полные гены SSU рРНК бактерий, архей и эукариот.Прикрепленные к поверхности олигонуклеотидные зонды были синтезированы in situ, как описано ранее [58], с 10-нуклеотидным поли-Т линкером, используемым для связывания специфического 40-нуклеотидного ДНК-зонда (Agilent Technologies, http://www.chem.agilent.com ). Все наборы также включали 307 стандартных контрольных зондов Agilent. Все последовательности зондов и аннотации доступны в наборе данных S6.
Покрытие массива.
Наш набор микроматричных зондов включает один или несколько группоспецифичных зондов для 649 из 950 таксономических групп в prokMSA и видоспецифических зондов для 1590 видов бактерий и 39 видов архей.Взятые вместе, эти зонды гарантировали, что 15 406 (94%) из 16 437 видов, представленных в базе данных prokMSA, имели по крайней мере один репрезентативный зонд на каком-то уровне дерева от типа к виду, а большинство видов prokMSA (74%) имели репрезентативные зонды на несколько таксономических уровней (в среднем 2,4 уровня на вид).
Объекты исследования и сбор образцов.
Тринадцать здоровых беременных женщин были набраны в Медицинском центре Стэнфордского университета. Все участники исследования, в том числе 14 младенцев (одна пара разнояйцевых близнецов), девять отцов, 13 матерей и двое братьев и сестер (в возрасте 1-2 лет) предоставили информированное согласие или согласие родителей.Дизайн исследования был одобрен административной комиссией Стэнфордского университета по медицинским исследованиям на людях. На 36–40 неделе беременности вагинальные мазки (Copan Diagnostics, http://www.copanusa.com) были получены от десяти из 13 матерей и немедленно заморожены при –20 ° C. После рождения образцы стула младенцев были взяты родителями с использованием пробирок для сбора стула (Sarstedt, http://www.sarstedt.com/php/main.php), которые содержали ложку для стандартизированного сбора примерно 300 мг материала.Образцы детского стула были собраны в соответствии с предписанным графиком (Таблица 1) и немедленно помещены в домашние морозильные камеры. Образец стула матери «нулевого дня» был взят в течение 0–5 дней после родов. Образцы стула были доставлены на льду в лабораторию для обработки через 2 недели, 3 месяца и 6 месяцев после рождения ребенка. Двенадцать матерей предоставили образцы грудного молока (~ 20 мл) через 3–9 месяцев после родов, а одна из них также предоставила грудное молоко через 6 дней после родов; эти образцы собирали в пробирки объемом 50 мл и немедленно замораживали.Девять из исследуемых семей также предоставили образцы стула одновременно от матери, отца и ребенка через 12–17 месяцев после рождения ребенка. По прибытии в лабораторию все образцы были немедленно перенесены в морозильную камеру -80 ° C и хранились там до обработки. Всего было собрано 548 образцов, в том числе 471 образец стула у младенцев, 39 образцов стула от матерей, 9 образцов стула от отцов, 2 образца стула от братьев и сестер, 16 образцов грудного молока и 11 вагинальных мазков. Родителям было поручено вести дневник, фиксируя ключевые события в категориях болезней, лекарств, изменения диеты и путешествий.Таблица 2 содержит выбранную информацию для каждого ребенка (например, пол и способ родов).
Экстракция ДНК и амплификация рДНК SSU.
ДНКэкстрагировали из образцов стула с помощью мини-набора QIAamp Stool DNA (Qiagen, http://www1.qiagen.com). Вагинальные мазки обрабатывали с использованием мини-набора QIAamp DNA (Qiagen). Образцы молока сначала концентрировали вращением 2 мл в микроцентрифуге в течение 10 мин при 5000 g, при этом удаляло 1800 мкл супернатанта. Осадок ресуспендировали в 200 мкл оставшегося супернатанта, и ДНК экстрагировали с помощью мини-набора QIAamp DNA.Образцы обрабатывали партиями примерно по 16, и в каждый цикл включали несколько контрольных экстрактов для мониторинга загрязнения. Отношение образцов к контролю экстракции составляло 6,8 для стула, 2,8 для вагинальных мазков и 5,3 для молока.
РДНКSSU была амплифицирована из экстрагированной ДНК с использованием бактериально-специфических праймеров широкого спектра действия Bact-8F (5′-AGAGTTTGATCCTGGCTCAG-3 ‘) [53] и T7-1391R (5’-AATTCTAATACGACTCACTATAGGGAGACGGGCGGTGTGTRCA-3) [46,5]. Эти праймеры амплифицируют приблизительно 90% или более полноразмерной бактериальной последовательности, кодирующей рРНК SSU, и обеспечивают промотор для РНК-полимеразы Т7.Смеси для ПЦР состояли из 1 × буфера II для ПЦР (Applied Biosystems, http://www.appliedbiosystems.com), 1,5 мМ MgCl 2 , 0,05% Triton X-100, 20 мМ хлорида тетраметиламмония, 2% диметилсульфоксида, 0,1 Концентрации мМ каждого дезоксирибонуклеозидтрифосфата, концентрации каждого праймера 0,4 мкМ, 2,5 ед. ДНК-полимеразы AmpliTaq (Applied Biosystems) и 5 мкл экстрагированной ДНК в конечном объеме 50 мкл. Используемые условия ПЦР: 5 минут при 95 ° C, 20 циклов по 30 секунд при 94 ° C, 30 секунд при 55 ° C и 90 секунд при 72 ° C, затем 8 минут при 72 ° C.Амплификацию проводили с использованием системы ПЦР GeneAmp 9700 (Applied Biosystems). В случаях чрезвычайно низкого выхода объединяли несколько 20-цикловых реакций. Реакции ПЦР очищали в 96-луночном формате с использованием системы на основе шариков для очистки ПЦР с переключателем заряда Invitrogen (Invitrogen, http://www.invitrogen.com) и хранили при -20 ° C.
Строительство эталонного бассейна.
Нашим общим эталоном была эквимолярная смесь ампликонов рДНК SSU из каждого образца (детский или материнский стул, вагинальное или грудное молоко), собранных до того, как ребенку исполнился 1 год.Для создания эквимолярной смеси очищенные продукты ПЦР с 20 циклами количественно определяли в 96-луночном формате с использованием набора дцДНК Quant-It PicoGreen (Molecular Probes, http://probes.invitrogen.com) и объединяли в равных количествах. Приблизительные доли рДНК SSU, полученной из стула, влагалища и молока, в полученном пуле составляли 90%, 5% и 5% соответственно. Этот пул ДНК использовали как в качестве матрицы для транскрипции in vitro (для гибридизации микроматриц), так и для конструирования библиотеки клонов SSU рДНК.
Анализ последовательности и таксономическая классификация клонированных продуктов ПЦР рДНК.
Контрольный пул (эквимолярная смесь ампликонов рДНК SSU из большинства образцов, описанных выше) клонировали и секвенировали, как описано ранее [15]. Мы получили 3458 высококачественных бактериальных последовательностей рДНК длиной более 800 нуклеотидов, включая 3163 двойных и 295 одиночных считываний. Эти последовательности были таксономически классифицированы с использованием классификатора Ribosomal Database Project (RDP) (обобщены в таблице 3).
Мы также клонировали и секвенировали несколько сотен ампликонов рДНК SSU (среднее значение = 342; диапазон = 125–557 адекватных последовательностей) из каждого из 12 различных индивидуальных образцов одним и тем же способом, получив в общей сложности 4100 высококачественных последовательностей длиной более 800 nt.12 секвенированных образцов состояли из десяти образцов стула (день 11 от ребенка 2; день 1 от матери ребенка 3; неделя 12 от ребенка 3; месяц 6+ от ребенка 8; день 1 и день 2B от ребенка 10; день 12 от ребенка. 12; 7 месяц от ребенка 13; 7 месяц от матери близнецов: младенцев 13 и 14; и 7 месяц от ребенка 14), один образец молока от матери близнецов 13 и 14 и один образец из влагалища от матери близнецов 13 и 14.
Каждая последовательность из этих 12 отдельных образцов была таксономически классифицирована в соответствии с таксономией prokMSA 2004 года [38] с использованием BLAST.В частности, мы использовали BLAST, чтобы найти последовательность с наибольшим количеством совпадений во всей базе данных prokMSA (также обрезанной до 8F и 1391R). Сообщалось и сравнивалось два самых популярных совпадения (совпадения с менее чем 600 совпадающими нуклеотидами не учитывались), и если эти два совпадения отображались на одну и ту же OTU, то последовательность классифицировалась по этой OTU. Если два самых популярных совпадения различались по таксономическому коду, то последовательность классифицируется только на самом конкретном уровне, разделяемом двумя лучшими совпадениями. В случаях, когда второй лучший результат был значительно хуже (соответствует 2-му / соответствует 1-му <0.9) учитывалось только лучшее попадание. Коды prokMSA OTU явно определяют таксономическую классификацию последовательности на всех филогенетических уровнях для всех 4100 высококачественных последовательностей «индивидуального образца».
Мечение и гибридизация.
Очищенные ампликоны рДНК SSU использовали в качестве матрицы для основанного на транскрипции синтеза аминоаллил-меченой одноцепочечной РНК с использованием набора для транскрипции MEGAScript T7 In Vitro (Ambion, http://www.ambion.com). Реакции транскрипции очищали в 96-луночном формате с использованием системы очистки РНК MagMax от Ambion и хранили при -20 ° C.Большие партии (5–10 мкг) эталонной РНК (эквимолярный пул всех образцов; см. Ниже) метили, используя сложный эфир Cy3 NHS, и хранили в течение нескольких недель для повторного использования. В день гибридизации 1 мкг каждого образца РНК метили, используя сложный эфир Cy5 NHS, как описано ранее [46]. Затем мы объединили 100 нг Cy5-меченного образца и 100 нг Cy3-меченного контрольного пула в объеме 48 мкл (в воде, свободной от нуклеаз). Затем мы добавили 2 мкл 25-кратного буфера для фрагментации Agilent и фрагментировали РНК путем нагревания при 70 ° C в течение 30 минут перед остановкой реакции, поместив ее на лед и добавив 50 мкл 2-кратного буфера для гибридизации Agilent.Непосредственно перед гибридизацией мы нагревали реакционную смесь до 95 ° C в течение 5 минут, затем охлаждали на льду перед добавлением 120 мкл 1 × гибридизационного буфера к 100 мкл фрагментированной меченой РНК и загружали 200 мкл этой смеси в камеру для гибридизации. (Agilent). Массивы гибридизовали при 60 ° C во вращающейся печи в течение 14–18 ч. Слайды промывали в 6 × SSC, 0,005% TritonX-102 в течение 5 минут при комнатной температуре, затем в 0,1 × SSC, 0,005% TritonX-102 в течение 5 минут и немедленно сканировали с использованием сканера Agilent DNA Microarray Scanner.Промывка и сканирование проводились в среде с низким содержанием озона [59].
Нормализация данных микрочипа.
Данные были извлечены из отсканированного изображения микрочипа с использованием самой последней версии программного обеспечения Agilent Feature Extraction (версии 7.1.1–8.1.1). Необработанные значения интенсивности флуоресценции Cy5 (или Cy3) за вычетом фона для каждого зонда были нормализованы путем деления значений Cy5 (или Cy3) на медианное значение Cy5 (или Cy3) универсального зонда «UNIV2» (расширенная версия 3 ‘ПЦР праймер 1391R: 5’-GTGGGGAGCGAACAGGATTAGATACCCTGGTAGTCCACGC-3 ‘) из соответствующего массива и умноженный на 100.На этом этапе значения варьировались от 0,01 до примерно 100; значения выше 100 были редкими и возникали только тогда, когда флуоресцентный сигнал для определенного зонда был ярче, чем у универсального зонда. Нормализованные значения Cy5 были «декомпрессированы» следующей коррекцией: декомпрессированный Cy5 равен 10 в степени log 5 нормализованной интенсивности Cy5. Эта декомпрессия корректирует нелинейную связь сигналов гибридизации с относительной численностью целевых видов, которую мы наблюдали в серии экспериментов по серийному разведению, описанных в предыдущем отчете [46].В этих экспериментах мы обнаружили, что 10-кратное изменение численности переводится примерно в 5-кратное изменение соответствующей интенсивности флуоресценции. После этого преобразования расширенный диапазон значений составлял от 0,001 до приблизительно 700. Мы использовали BLAST для прогнозирования гибридизации каждой из 3458 общих эталонных последовательностей рДНК, превышающих 800 пар оснований, используя схему взвешивания, описанную ранее [46], так что зонд с идеальным соответствием каждой последовательности будет иметь ожидание 100%, а зонды с меньшим количеством совпадений или несовершенные совпадения с последовательностями в контрольном пуле будут иметь соответственно более низкие ожидаемые значения гибридизации.Затем мы рассчитали логарифмическое (наблюдаемое / ожидаемое) отношение для каждого зонда в контексте нашей объединенной эталонной смеси образцов и применили эти поправочные коэффициенты для конкретных зондов к разуплотненным значениям Cy5.
Фильтрация микрочипов.
Микроматричный анализ синтетических пулов определенного состава позволил нам идентифицировать плохо работающие зонды, которые затем были исключены из дальнейших анализов. Мы оценили эффективность зонда с использованием пяти синтетических пулов (четыре пула из шести уникальных продуктов ПЦР рДНК, один пул из 230 уникальных продуктов ПЦР рДНК [из [46]]) и одного биологического пула (общий эталон, описанный выше), состав которых характеризовался следующим: глубокое секвенирование.Зонды со значениями интенсивности флуоресценции более 0,5% от интенсивности универсальных зондов, несмотря на отсутствие предсказанной гомологии последовательности (определяемой как значение совпадения-несовпадения BLAST менее 25 из возможных 40) с любым из видов в образце, были исключены. из последующих анализов. Мы также отбросили данные от зондов, которые имели наблюдаемую (декомпрессированную) интенсивность сигнала в 100 раз выше или ниже, чем ожидалось, в анализах биологического контрольного пула (как описано выше в разделе нормализации данных микрочипов).Оставшийся набор из 6381 зонда с хорошими характеристиками использовался во всех последующих анализах.
Оценка численности таксономических групп.
Для каждого образца мы получили оценку относительной численности каждой таксономической группы в нашем филогенетическом дереве с использованием алгоритма, который гарантирует, что ни один вид не вносит более одного вклада в оценку численности таксономической группы, и что нижележащие зонды (зонды, которые представляют отдельные подмножества видов, принадлежащих к этой филогенетической группе) включены в оценку совокупной численности группы.В частности, для каждой филогенетической группы в каждом образце мы отсортировали все находящиеся ниже по течению зонды в соответствии с их оценками относительной численности на основе микрочипов и рассчитали общую сумму оценок относительной численности всех неперекрывающихся зондов. В результате конкретные пробы, добавленные вместе для представления данной таксономической группы, варьировались в разных образцах, в зависимости от того, какие конкретные зонды имели наибольший сигнал гибридизации в этом образце.
Сравнение данных микрочипа и последовательности.
Оценки относительной численности каждой группы prokMSA на каждом уровне таксономической иерархии в контрольном пуле и в 12 отдельных образцах, проанализированных с помощью секвенирования, были получены путем расчета доли последовательностей в соответствующей библиотеке рДНК, которые были назначены пользователя BLAST в эту группу. Эти основанные на последовательностях оценки численности были напрямую сопоставлены с оценками, полученными на основе данных микрочипа, как описано в предыдущем разделе.
Автокорреляционный анализ.
Мы использовали автокорреляции как способ измерения тенденции таксономической группы к сохранению после установления («липкость»). Для данного временного ряда от времени a до времени b, мы вычислили корреляцию Пирсона для каждого дочернего вектора ( a + 1,…, b ) и вектора ( a, …, ). b — 1), представляющий логарифмические оценки (относительной численности). Автокорреляция каждой таксономической группы затем принималась как медианная автокорреляция для всех младенцев, для которых рассматриваемая таксономическая группа присутствовала хотя бы один раз (определяемая как численность> 0.1%) в рассматриваемом временном интервале. В нашем «липком» анализе мы выполнили этот анализ отдельно для двух разных наборов образцов, собранных с разными интервалами выборки, чтобы избежать смешивающего эффекта вариации в интервалах выборки: (1) образцы раз в неделю с 1 по 12 недель; и (2) ежемесячные пробы с 1 по 6 месяцев.
Обнаружение последовательностей архей и грибов.
Для скрининга последовательностей рДНК архей и грибов. мы сначала проверили пулы, включающие все извлеченные образцы ДНК от каждого ребенка (т.е., один пул на ребенка), все образцы стула родителей, все образцы из влагалища и все образцы молока, соответственно. Для каждого пула, дающего положительный результат, все образцы компонентов затем анализировались индивидуально. Для скрининга последовательностей рДНК архей мы использовали два набора специфичных для архей праймеров с широким спектром действия: A751F и U1406R [60]; и Arch433F (5′-TCCAGGCCCTACGGG-3 ‘[61]) и Arch958R (5′-YCCGGCGTTGAMTCCAATT-3′ [62,63]). Для скрининга грибов мы использовали специфические для грибов праймеры широкого спектра действия 817F [64] и 1536R-rev (5’-AATRCAATGCTCTATCCCCA-3 ‘, адаптировано из [64]).Смеси для ПЦР были аналогичны тем, которые использовались для ПЦР с широким спектром бактериальных бактерий, описанной выше, но со следующими изменениями: для ПЦР, специфичной для грибов, концентрация MgCl 2 была увеличена до 2 мМ, а BSA был добавлен в конечной концентрации. 1 мг / мл. В реакциях ПЦР, специфичных для грибов и архей, хлорид тетраметиламмония не добавляли, а добавляли 2 мкл объединенной ДНК с конечным объемом 50 мкл. Программа цикла состояла из 5 минут при 95 ° C, 35 циклов (30 секунд при 94 ° C, 30 секунд при 55 ° C и 30 секунд при 72 ° C), а затем 8 минут при 72 ° C.Реакции амплификации анализировали на агарозных гелях.
Анализ смещения амплификации.
Чтобы исследовать, могут ли несовпадения бактериальных праймеров влиять на амплификацию, была выделена ДНК из пяти контрольных штаммов бактерий: Escherichia coli (клетки TOP10, Invitrogen), Clostridium perfringens (ATCC 13124), Bacteroides fragilis (ATCC 25285), Bifidobacterium longum. (ATCC 15707) и Bifidobacterium infantis (ATCC 15697) с использованием мини-набора QIAamp DNA.Концентрации ДНК измеряли с помощью УФ-спектрофотометра и корректировали для корректировки выхода ДНК, размера генома и количества копий гена рРНК SSU на геном для получения «нормализованных» ДНК, каждая из которых содержит одинаковое количество копий гена рРНК SSU на мкл. Бактериальную ДНК из лизатов амплифицировали индивидуально или парами с использованием праймеров 8F и T7-1391R, как описано выше, с использованием 20 или 35 циклов. Для парных реакций нормализованную ДНК Bifidobacterium longum смешивали с неразбавленными или серийными разведениями нормализованной ДНК из Escherichia coli, Clostridium perfringens, или Bacteroides fragilis.После амплификации смеси ПЦР очищали с использованием набора для очистки ПЦР QIAquick (Qiagen) и расщепляли с использованием набора рестрикционных ферментов, выбранных для различения двух продуктов ПЦР, полученных с парными видами. Расщепления анализировали на агарозных гелях для количественной оценки относительного количества продуктов ПЦР, представляющих Bifidobacterium longum и виды в группе сравнения, соответственно.
Количественная ПЦР.
Отдельный анализ кПЦР в реальном времени использовался для амплификации и количественного определения рДНК каждой из четырех микробных групп: все бактерии, бифидобактерии, все грибы и все археи.Тотальный бактериальный КПЦР выполняли с использованием смеси 10: 1 универсального прямого праймера 8FM (5′-AGAGTTTGATCMTGGCTCAG-3 ‘, адаптировано из [53]) и соответствующего прямого праймера 8FB Bifidobacterium longum (5′-AGGGTTCGATTCTGGCTCAG-3′, это исследование ), с обратным праймером Bact515R (5’-TTACCGCGGCKGCTGGCAC-3 ‘, адаптированный из [54]) и зондом TaqMan Bact338K (5′-FAM / CCAKACTCCTACGGGAGGCAGCAG / TAMRA-3’, адаптированный из [65]). Мы дополнили универсальный бактериальный прямой праймер прямым праймером Bifidobacterium longum, потому что анализ последовательностей рДНК SSU показал, что эта группа была особой, поскольку она имела три несовпадения с нашим прямым праймером 8FM.Пилотные исследования показали, что эта смесь праймеров позволяет сравнимую амплификацию генов рРНК SSU из репрезентативных Bifidobacteria, Bacteroides, Enterobacteria и Clostridia. КПЦР рода Bifidobacterium выполняли с использованием праймеров Bif42F [26] и Bif164R (5′-CATCCGGCATTACCACCCGTT-3 ‘, адаптировано из [66]) и зонда Bif126_Taqman [26]. Тотальную количественную ПЦР грибов проводили с использованием праймеров ITS1F-F (5’-CTTGGTCATTTAGAGGAAGTAA-3 ‘[67]) и ITS4-R (5′-TCCTCCGCTTATTGATATGC-3′ [68] и зонда TaqMan 5.8S (5’-FAM / CATTTCGCTGCGTTCTTCATCGATG / TAMRA-3 ‘, адаптировано из [68]. КПЦР архей выполняли с использованием праймеров Arch433F (5′-TCCAGGCCCTACGGG-3′) [61] и Arch958R (5′-YCCGGCGTTCC) [63], и зонд 515F TaqMan (5’-FAM / GTGCCAGCMGCCGCGGTAA / TAMRA-3 ‘, адаптированный из [54]). Для всех анализов qPCR каждая 20-мкл реакционная смесь содержала 1 × мастер-микс TaqMan Universal PCR (Applied Biosystems) , 0,9 мкМ каждого праймера (0,09 мкМ праймера 8FB в общем бактериальном анализе), 0,2 мкМ зонда, 1 ед. ДНК-полимеразы AmpliTaq Gold (Applied Biosystems) и 2 мкл экстрагированной ДНК.Программа термоциклирования состояла из 95 ° C в течение 10 минут, за которыми следовали либо 40 циклов (анализы на бактерии и бифидобактерии), либо 45 циклов (анализы грибов и архей) при 95 ° C в течение 30 секунд, 55 ° C в течение 30 секунд, 60 ° C в течение 45 с, 65 ° C в течение 15 с и 72 ° C в течение 15 с [69]. Реакции проводили в системе обнаружения последовательностей Prism 7900HT (Applied Biosystems). Для построения стандартных кривых использовали десятикратные серийные разведения известных количеств рДНК из соответствующей микробной группы (например, бактерий, бифидобактерий, грибов или архей).Абсолютное содержание рДНК рассчитывали на основе стандартных кривых с использованием программного обеспечения SDS версии 2.1 (Applied Biosystems) с базовым уровнем, установленным на циклах 3–15 (бактериальные и бифидобактериальные анализы) или циклах 3–13 (анализы грибов и архей), а также пороге цикла. устанавливается в пределах геометрической фазы кривой усиления. Чувствительность каждого анализа составляла приблизительно 100 молекул рДНК на лунку для реакции ПЦР. Каждый реакционный планшет для количественной ПЦР включал два типа отрицательных контролей (контроль реагентов и контроль аликвот), каждый в трех экземплярах.Специфичность ПЦР-анализа на бифидобактерии в реальном времени была протестирована с использованием геномной ДНК, выделенной из 17 контрольных штаммов бактерий: Bacillus subtilis (ATCC 6633), Bacteroides fragilis (ATCC 25285), Bacteroides thetaiotaomicron (ATCC 29148), Bifidobacterium longum) (ATCC 15ifidobacterium longum) (ATCC 15ifidobacterium longum). Infantis (ATCC 15697), Clostridium perfringens (ATCC 13124), Clostridium putrefaciens (ATCC 25786), Enterococcus faecalis (ATCC 19433), Escherichia coli (клетки TOP10; Invitrogen), Haemophilus haemolyticus (ATCC 33390), Lactophilus haemolyticus (ATCC 33390), Lactophilus haemolyticus (ATCC 33390), Lactophilus haemolyticus (ATCC 33390), Lactobacillus Lactobacillus delbrueckii (ATCC 4797), Megasphaera elsdenii (ATCC 17752), Proteus vulgaris (ATCC 13315), Pseudomonas aeruginosa (ATCC 10145), Staphylococcus aureus (ATCC 25923) и Streptococcus salivarius (ATCC 13419).
Проверка подозрительных видов / таксонов.
Мы исследовали происхождение сигналов гибридизации массива, представляющих 12 видов / таксонов, присутствие которых в образцах было неожиданным и не подтвержденным последовательностями в контрольном пуле. Для каждого анализа мы использовали один или оба из двух независимых анализов. Во-первых, мы попытались амплифицировать последовательности, очевидно обнаруженные с помощью анализа массива, с использованием праймеров, специфичных для видов / таксонов; когда продукт был получен, его дополнительно анализировали путем секвенирования.Для амплификации последовательностей мы использовали праймер, идентичный 40-мерному зонду, который давал сигнал гибридизации на нашем микроматрице в качестве 5′-праймера и 40-мерную универсальную последовательность (обратный комплемент последовательности UNIV2, приведенный выше) в качестве 3′-фрагмента. грунтовка. В некоторых случаях мы также пытались амплифицировать подозрительную последовательность, используя усеченную (23-мерную) версию соответствующего олигонуклеотидного зонда из микроматрицы в паре с известным группоспецифическим праймером ПЦР от ProbeBase [55]. Все ПЦР были выполнены в условиях, идентичных тем, которые использовались при первоначальных амплификациях образцов для анализа микрочипов.Положительные полосы ожидаемого размера были клонированы и секвенированы. В качестве второго подхода четыре образца, которые, как было предсказано на основе результатов микроматрицы, содержали последовательности от неожиданных видов, были дополнительно проанализированы путем секвенирования библиотек клонов рДНК SSU (96–288 клонов), созданных путем амплификации с использованием бактериальных праймеров широкого диапазона 8F и 1391R (как указано выше. ), а также клонирование и секвенирование, как описано ранее [15]. Относительная численность, предсказанная анализом микроматрицы, и количество секвенированных клонов были следующими: Vibrio (13%): 96, Deinococcus (0.1%): 192, Spirochaetes (1%): 288 и Legionella pneumophila (1%): 192
Дополнительная информация
Набор данных S3. Нормализованные данные микрочипов для всех образцов и всех фильтрованных зондов
Необработанные интенсивности Cy5 преобразовывали, как описано в разделе «Материалы и методы». Обратите внимание, что для образцов с повторной гибридизацией ( n = 36) показаны усредненные значения, а названия образцов обозначены (Avg).
https://doi.org/10.1371/journal.pbio.0050177.sd003
(19,0 МБ TXT)
Рисунок S1. Численность бактерий и бифидобактерий в течение первого года жизни
Для каждого образца ребенка общее количество бактерий и бифидобактерий оценивалось с помощью ПЦР в реальном времени TaqMan, как подробно описано в разделе «Материалы и методы». Для каждой из этих таксономических групп оценочные копии гена рРНК на грамм фекалий (–-ось) нанесены на график как функция дней жизни (ось x-). Обе оси имеют логарифмическую шкалу.Для каждой таксономической группы измерения численности усекаются на нижнем конце диапазона до значения, соответствующего 95-му процентилю экстракционных (отрицательных) контролей для соответствующего набора праймеров ПЦР (10702 и 1183 копий рДНК на грамм эквивалента стула. для общих бактерий и бифидобактерий соответственно). Таким образом, значения, нанесенные на соответствующие нижние пределы обнаружения, обычно представляют собой численность ниже указанного значения (диапазон, включающий ноль).
https: // doi.org / 10.1371 / journal.pbio.0050177.sg001
(457 КБ PDF)
Рисунок S2. Обилие фекальных бактерий, грибов и архей в течение первого года жизни
Для каждого образца младенца обилие бактерий, грибов и архей оценивалось с помощью ПЦР в реальном времени TaqMan, как подробно описано в разделе «Материалы и методы». Для каждой из этих таксономических групп оценочные копии гена рРНК на грамм фекалий ( х по оси) нанесены как функция дней жизни ( х по оси). Обе оси имеют логарифмическую шкалу.Для каждой таксономической группы измерения численности усекаются на нижнем конце диапазона до значения, соответствующего 95-му процентилю экстракционных (отрицательных) контролей для соответствующего набора праймеров ПЦР (10702, 9831 и ноль копий рДНК на грамм). эквивалента стула для бактерий, грибов и архей соответственно). Таким образом, значения, нанесенные на соответствующие нижние пределы обнаружения, обычно представляют собой численность ниже указанного значения (диапазон, включающий ноль). Все значения, для которых оценка численности методом qPCR была равна нулю (только для архей), были опущены.Эпизоды антибактериального или противогрибкового (нистатин) лечения показаны на временной оси серыми или розовыми полосами соответственно (дополнительную информацию см. В Таблице 1).
https://doi.org/10.1371/journal.pbio.0050177.sg002
(773 КБ PDF)
Благодарности
Мы благодарим все семьи, принявшие участие в этом исследовании. Мы благодарны за помощь членов групп Брауна и Релмана, включая Стивена Поппера, Гарольда Амогана, Ле Детлефсена и Лину Веннстрём, а также за ценные советы Майкла Эйзена (Национальные лаборатории Лоуренса Беркли и Калифорнийский университет в Беркли), Роба Тибширани ( Стэнфорд) и Джерел Дэвис.Мы благодарим Карен Нельсон и Джоан Эмерсон (Институт геномных исследований) за техническую поддержку в создании и секвенировании библиотеки клонов рДНК SSU. Мы благодарим Horn Foundation за поддержку этой работы. ПОБ — исследователь Медицинского института Говарда Хьюза. DAR является лауреатом премии «Пионер» Национального института здравоохранения.
Вклад авторов
CP, EMB, DBD, DAR и POB разработали и разработали эксперименты и проанализировали данные. CP, EMB и DBD проводили эксперименты.Документ написали CP, EMB, DBD и POB.
Ссылки
- 1. Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD и др. (2005) Ожирение изменяет микробную экологию кишечника. Proc Natl Acad Sci U S A 102: 11070–11075.
- 2. Backhed F, Ding H, Wang T, Hooper LV, Koh GY и др. (2004) Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci U S A 101: 15718–15723.
- 3. Ley RE, Turnbaugh PJ, Klein S, Gordon JI (2006) Микробная экология: кишечные микробы человека, связанные с ожирением.Природа 444: 1022–1023.
- 4. Stappenbeck TS, Hooper LV, Gordon JI (2002) Регуляция развития кишечного ангиогенеза аборигенными микробами через клетки Панета. Proc Natl Acad Sci U S A 99: 15451–15455.
- 5. Сюй Дж., Гордон Дж. И. (2003) Вступительная статья: Почитай своих симбионтов. Proc Natl Acad Sci U S A 100: 10452–10459.
- 6. Hooper LV, Midtvedt T, Gordon JI (2002) Как взаимодействия между хозяином и микробом формируют питательную среду кишечника млекопитающих.Анну Рев Нутр 22: 283–307.
- 7. MacDonald TT, Gordon JN (2005) Бактериальная регуляция кишечных иммунных ответов. Гастроэнтерол Clin North Am 34: 401–412.
- 8. Парсоннет Дж., Фридман Г.Д., Вандерштин Д.П., Чанг Й., Фогельман Дж. Х. и др. (1991) Инфекция Helicobacter pylori и риск рака желудка. N Engl J Med 325: 1127–1131.
- 9. Лекит М., Абачин Э., Мартин А., Пойярт С., Почарт П. и др. (2004) Иммунопролиферативное заболевание тонкого кишечника, связанное с Campylobacter jejuni.N Engl J Med 350: 239–248.
- 10. Отт С.Дж., Мусфельдт М., Вендерот Д.Ф., Хампе Дж., Брант О. и др. (2004) Уменьшение разнообразия бактериальной микрофлоры слизистой оболочки толстой кишки у пациентов с активным воспалительным заболеванием кишечника. Кишечник 53: 685–693.
- 11. Сексик П., Риготтье-Гойс Л., Грамет Г., Сутрен М., Покхарт П. и др. (2003) Изменения доминирующих фекальных бактериальных групп у пациентов с болезнью Крона толстой кишки. Кишечник 52: 237–242.
- 12.Fell JM (2005) Воспалительные кишечные заболевания новорожденных: некротический энтероколит и аллергический колит. Early Hum Dev 81: 117–122.
- 13. de la Cochetiere MF, Piloquet H, des Robert C., Darmaun D, Galmiche JP, et al. (2004) Ранняя кишечная бактериальная колонизация и некротический энтероколит у недоношенных детей: предполагаемая роль Clostridium . Pediatr Res 56: 366–370.
- 14. Vaughan EE, Schut F, Heilig HG, Zoetendal EG, de Vos WM, et al.(2000) Молекулярный взгляд на экосистему кишечника. Curr Issues Intest Microbiol 1: 1–12.
- 15. Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, et al. (2005) Разнообразие кишечной микробной флоры человека. Наука 308: 1635–1638.
- 16. Zoetendal EG, Akkermans AD, De Vos WM (1998) Анализ гель-электрофореза в градиенте температуры 16S рРНК из образцов фекалий человека выявляет стабильные и специфичные для хозяина сообщества активных бактерий.Appl Environ Microbiol 64: 3854–3859.
- 17. Старк П.Л., Ли А. (1982) Микробная экология толстой кишки грудных детей и детей, вскармливаемых смесями, в течение первого года жизни. J Med Microbiol 15: 189–203.
- 18. Penders J, Thijs C, Vink C, Stelma FF, Snijders B, et al. (2006) Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве. Педиатрия 118: 511–521.
- 19. Бенно Ю., Савада К., Мицуока Т. (1984) Микрофлора кишечника младенцев: состав фекальной флоры у младенцев, находящихся на грудном и искусственном вскармливании.Microbiol Immunol 28: 975–986.
- 20. Favier CF, Vaughan EE, De Vos WM, Akkermans AD (2002) Молекулярный мониторинг последовательности бактериальных сообществ у новорожденных людей. Appl Environ Microbiol 68: 219–226.
- 21. Hopkins MJ, Macfarlane GT, Furrie E, Fite A, Macfarlane S (2005) Характеристика кишечных бактерий в детском стуле с использованием ПЦР в реальном времени и анализов северной гибридизации. FEMS Microbiol Ecol 54: 77–85.
- 22. Hall MA, Cole CB, Smith SL, Fuller R, Rolles CJ (1990) Факторы, влияющие на присутствие фекальных лактобацилл в раннем младенчестве.Arch Dis Child 65: 185–188.
- 23. Йошиока Х, Исэки К., Фудзита К. (1983) Развитие и различия кишечной флоры в неонатальном периоде у детей, находящихся на грудном и искусственном вскармливании. Педиатрия 72: 317–321.
- 24. Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, Wagendorp AA, Klijn N, et al. (2000) Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Pediatr Gastroenterol Nutr 30: 61–67.
- 25. Balmer SE, Wharton BA (1989) Диета и фекальная флора новорожденного: грудное молоко и детские смеси. Arch Dis Child 64: 1672–1677.
- 26. Пендерс Дж., Винк С., Дриссен С., Лондон Н., Тиджс С. и др. (2005) Количественная оценка Bifidobacterium spp., Escherichia coli и Clostridium difficile в образцах фекалий младенцев, находящихся на грудном вскармливании и вскармливаемых смесями, с помощью ПЦР в реальном времени. FEMS Microbiol Lett 243: 141–147.
- 27. Lundequist B, Nord CE, Winberg J (1985) Состав фекальной микрофлоры у детей, вскармливаемых грудью и из бутылочки, от рождения до восьми недель.Acta Paediatr Scand 74: 45–51.
- 28. Orrhage K, Nord CE (1999) Факторы, контролирующие бактериальную колонизацию кишечника у младенцев, находящихся на грудном вскармливании. Acta Paediatr Suppl 88: 47–57.
- 29. Fanaro S, Chierici R, Guerrini P, Vigi V (2003) Микрофлора кишечника в раннем младенчестве: состав и развитие. Acta Paediatr Suppl 91: 48–55.
- 30. Bennet R, Nord CE (1987) Развитие фекальной анаэробной микрофлоры после кесарева сечения и лечения антибиотиками у новорожденных.Инфекция 15: 332–336.
- 31. Neut C, Bezirtzoglou E, Romond C, Beerens H, Delcroix M и др. (1987) Бактериальная колонизация толстой кишки у новорожденных, рожденных путем кесарева сечения. Zentralbl Bakteriol Mikrobiol Hyg [A] 266: 330–337.
- 32. Hallstrom M, Eerola E, Vuento R, Janas M, Tammela O (2004) Влияние способа доставки и некротизирующего энтероколита на микрофлору кишечника у недоношенных детей. Eur J Clin Microbiol Infect Dis 23: 463–470.
- 33. Мандар Р., Микелсаар М. (1996) Передача микрофлоры матери новорожденному при рождении. Биол для новорожденных 69: 30–35.
- 34. Швирц А., Грюль Б., Лобниц М., Мишель П., Радке М. и др. (2003) Развитие бактериального состава кишечника у госпитализированных недоношенных детей по сравнению с доношенными детьми, находящимися на грудном вскармливании. Pediatr Res 54: 393–399.
- 35. Саката Х., Йошиока Х., Фудзита К. (1985) Развитие кишечной флоры у младенцев с очень низкой массой тела при рождении по сравнению с нормальными доношенными новорожденными.Eur J Pediatr 144: 186–190.
- 36. Миллар М.Р., Линтон К.Дж., Кейд А., Глэнси Д., Холл М. и др. (1996) Применение ПЦР гена 16S рРНК для изучения флоры кишечника недоношенных детей с некротическим энтероколитом и без него. J Clin Microbiol 34: 2506–2510.
- 37. Коул Дж. Р., Чай Б., Марш Т. Л., Фаррис Р. Дж., Ван К. и др. (2003) Проект базы данных рибосом (RDP-II): предварительный просмотр нового средства автоматического выравнивания, которое позволяет регулярно обновлять новую таксономию прокариот. Nucl Acids Res 31: 442–443.
- 38. ДеСантис Т.З., Дубосарский И., Мюррей С.Р., Андерсен Г.Л. (2003) Комплексное построение выровненных последовательностей для автоматизированного проектирования эффективных зондов (CASCADE-P) с использованием 16S рДНК. Биоинформатика 19: 1461–1468.
- 39. Дедыш С.Н., Панкратов Т.А., Белова С.Е., Куличевская И.С., Лизак В. (2006) Филогенетический анализ и определение состава бактериального сообщества на кислых сфагновых торфяниках in situ. Appl Environ Microbiol 72: 2110–2117.
- 40.Шмитт-Вагнер Д., Фридрих М.В., Вагнер Б., Брюн А. (2003) Филогенетическое разнообразие, численность и осевое распределение бактерий в кишечном тракте двух термитов, питающихся почвой (Cubitermes spp.). Appl Environ Microbiol 69: 6007–6017.
- 41. Salzman NH, de Jong H, Paterson Y, Harmsen HJ, Welling GW и др. (2002) Анализ библиотек 16S микрофлоры желудочно-кишечного тракта мышей выявил новую большую группу кишечных бактерий мышей. Микробиология 148: 3651–3660.
- 42. Acinas SG, Marcelino LA, Klepac-Ceraj V, Polz MF (2004) Дивергенция и избыточность последовательностей 16S рРНК в геномах с множественными оперонами rrn. J Bacteriol 186: 2629–2635.
- 43. Park HK, Shim SS, Kim SY, Park JH, Park SE и др. (2005) Молекулярный анализ колонизированных бактерий в кишечнике новорожденного человека. J Microbiol 43: 345–353.
- 44. Mackie RI, Sghir A, Gaskins HR (1999) Микробная экология развития желудочно-кишечного тракта новорожденных.Am J Clin Nutr 69: 1035S – 1045S.
- 45. Macdonald TT, Monteleone G (2005) Иммунитет, воспаление и аллергия в кишечнике. Наука 307: 1920–1925.
- 46. Палмер С., Бик Е.М., Эйзен М.Б., Экбург П.Б., Сана Т.Р. и др. (2006) Быстрое количественное определение сложных микробных популяций. Nucleic Acids Res. 34.
- 47. Линц Б., Баллу Ф., Мудли Й., Маника А., Лю Х. и др. (2007) Африканское происхождение тесной связи между человеком и Helicobacter pylori.Природа 445: 915–918.
- 48. Caufield PW, Saxena D, Fitch D, Li Y (2007) Популяционная структура плазмидсодержащих штаммов Streptococcus mutans, члена местной биоты человека. J Bacteriol 189: 1238–1243.
- 49. Беленгер А., Дункан С.Х., Колдер А.Г., Холтроп Дж., Луи П. и др. (2006) Два пути метаболического перекрестного питания между Bifidobacterium adolescentis и анаэробами, продуцирующими бутират, из кишечника человека. Appl Environ Microbiol 72: 3593–3599.
- 50. Самуэль Б.С., Гордон Дж. И. (2006) Гуманизированная модель мыши-гнотобиотической мыши мутуализма «хозяин-архей-бактерия». Proc Natl Acad Sci U S A 103: 10011–10016.
- 51. Зонненбург JL, Chen CT, Gordon JI (2006) Геномные и метаболические исследования воздействия пробиотиков на модельный симбионт кишечника и хозяина. PLoS Biol 4: e413 ..
- 52. Фарук С.М., Насер И.Б., Ислам М.Дж., Фарук А.С., Гош А.Н. и др. (2005) Сезонные эпидемии холеры обратно коррелируют с распространенностью фагов холеры в окружающей среде.Proc Natl Acad Sci U S A 102: 1702–1707.
- 53. Edwards U, Rogall T, Blocker H, Emde M, Bottger EC (1989) Выделение и прямое полное определение нуклеотидов целых генов. Характеристика гена, кодирующего рибосомную РНК 16S. Nucleic Acids Res 17: 7843–7853.
- 54. Lane DJ, Pace B, Olsen GJ, Stahl DA, Sogin ML, et al. (1985) Быстрое определение последовательностей 16S рибосомной РНК для филогенетических анализов. Proc Natl Acad Sci U S A 82: 6955–6959.
- 55. Loy A, Horn M, Wagner M (2003) probeBase: Интернет-ресурс для олигонуклеотидных зондов, нацеленных на рРНК. Nucleic Acids Res 31: 514–516.
- 56. Альтшул С.Ф., Гиш В., Миллер В., Майерс Е. В., Липман Д. Д. (1990) Базовый инструмент поиска локального выравнивания. J Mol Biol 215: 403–410.
- 57. Бик Э.М., Экбург П.Б., Гилл С.Р., Нельсон К.Э., Пурдом Э.А. и др. (2006) Молекулярный анализ бактериальной микробиоты в желудке человека. Proc Natl Acad Sci U S A 103: 732–737.
- 58. Blanchard AP, Kaiser RJ, Hood LE (1996) Матрицы олигонуклеотидов высокой плотности. Biosens Bioelectron 11: 687–690.
- 59. Фаре Т.Л., Коффи Э.М., Дай Х., Хе Ю.Д., Кесслер Д.А. и др. (2003) Влияние атмосферного озона на качество данных микрочипов. Anal Chem 75: 4672–4675.
- 60. Baker GC, Smith JJ, Cowan DA (2003) Обзор и повторный анализ доменно-специфичных праймеров 16S. J Microbiol Methods 55: 541–555.
- 61. Лепп П.У., Бриниг М.М., Оуверни С.К., Палм К., Армитаж Г.К. и др.(2004) Метаногенные археи и пародонтоз человека. Proc Natl Acad Sci U S A 101: 6176–6181.
- 62. DeLong EF, Wickham GS, Pace NR (1989) Филогенетические красители: зонды на основе рибосомной РНК для идентификации одиночных клеток. Наука 243: 1360–1363.
- 63. Делонг Е.Ф. (1992) Археи в прибрежных морских средах. Proc Natl Acad Sci U S A 89: 5685–5689.
- 64. Borneman J, Hartin RJ (2000) Праймеры для ПЦР, которые амплифицируют гены рРНК грибов из образцов окружающей среды.Appl Environ Microbiol 66: 4356–4360.
- 65. Аманн Р.И., Биндер Б.Дж., Олсон Р.Дж., Чисхолм С.В., Деверо Р. и др. (1990) Комбинация олигонуклеотидных зондов, нацеленных на 16S рРНК, с проточной цитометрией для анализа смешанных микробных популяций. Appl Environ Microbiol 56: 1919–1925.
- 66. Langendijk PS, Schut F, Jansen GJ, Raangs GC, Kamphuis GR, et al. (1995) Количественная флуоресцентная гибридизация in situ Bifidobacterium spp. с геноспецифическими зондами, нацеленными на 16S рРНК, и их применением в образцах фекалий.Appl Environ Microbiol 61: 3069–3075.
- 67. Гардес М., Брунс Т.Д. (1993) Праймеры ITS с повышенной специфичностью в отношении базидиомицетов — применение для идентификации микоризы и ржавчины. Мол Экол 2: 113–118.
- 68. White TJ, Burns T, Lee S, Taylor J (1990) Амплификация и секвенирование генов грибковой рибосомной РНК для филогенетики. В: Иннис М.А., Гельфанд Д.Х., Снинский Дж. Дж., Уайт Т. Дж., Редакторы. Протоколы ПЦР. Руководство по методам и приложениям. Сан-Диего (Калифорния): Academic Press.С. 315–322.
- 69. Brinig MM, Lepp PW, Ouverney CC, Armitage GC, Relman DA (2003) Распространенность бактерий подразделения TM7 в поддесневой бляшке человека и их связь с заболеванием. Appl Environ Microbiol 69: 1687–1694.
Гибридный гель-электрофорез с использованием фибробластов кожи для диагностики митохондриальных заболеваний.
Реферат
Цель. , названный BCN-PAGE, для выполнения окрашивания активности в геле комплексов митохондриальной электронно-транспортной цепи (ETC) в фибробластах кожи.
Методы Четыре пациента в возрасте 46–65 лет были осмотрены в Метаболической клинике Детской больницы Альберты и обследованы на предмет митохондриальных заболеваний, и у них был BN-PAGE или CN-PAGE на скелетных мышцах, который показал неполную сборку комплекса V (CV) в каждому пациенту. ПЦР с длинным диапазоном, выполненная на ДНК, экстрагированной из мышц, выявила 4 уникальные делеции митохондриальной ДНК (мтДНК), охватывающие ген ATP6 CV. Мы разработали метод BCN-PAGE для фибробластов кожи, взятых у пациентов одновременно, и сравнили результаты с результатами для скелетных мышц.
Результаты Во всех 4 случаях BCN-PAGE в фибробластах кожи подтвердил аномальную сердечно-сосудистую активность, обнаруженную при биопсии мышц, предполагая, что делеции мтДНК с участием ATP6 , скорее всего, были мутациями зародышевой линии, которые связаны с клиническим фенотипом митохондриального заболевания. .
Выводы Метод BCN-PAGE в фибробластах кожи потенциально может быть менее инвазивным инструментом по сравнению с биопсией мышц для скрининга пациентов на аномалии сердечно-сосудистых заболеваний и других митохондриальных комплексов ETC.
Глоссарий
- BBG =
- бриллиантовый синий G;
- ETC =
- цепь переноса электронов;
- BN-PAGE =
- электрофорез в полиакриламидном геле с природным синим;
- BCN-PAGE =
- электрофорез в синем и прозрачном полиакриламидном геле;
- CN-PAGE =
- электрофорез в прозрачном нативном полиакриламидном геле;
- CV =
- комплекс VC;
- DDM =
- н-додецил β-D-мальтозид;
- MNG =
- Медицинская нейрогенетика;
- мтДНК =
- митохондриальной ДНК;
- NBT =
- нитросиний тетразолий;
- яДНК =
- ядерная ДНК;
- NGS =
- секвенирование следующего поколения;
- OXPHOS =
- окислительное фосфорилирование
Митохондриальные заболевания могут иметь аномальную дисфункцию цепи транспорта электронов (ETC). 1 Электроны переносятся через 5 белковых комплексов (I, II, III, IV и V), которые взаимодействуют и образуют суперкомплексы (респирасомы) во внутренней митохондриальной мембране. Ткани с высокими потребностями в энергии могут быть более уязвимы для нарушения функции ETC, вызванного мутациями ядерной ДНК (яДНК) или митохондриальной ДНК (мтДНК). 2 Биопсия скелетных мышц является предпочтительным источником для измерения целостности и функции белка ETC из-за более высокой плотности митохондрий, но может быть инвазивной. 3
Хотя биопсия кожи менее инвазивна, 4,5 были некоторые опасения, могут ли существующие процедуры отражать функцию скелетных мышц из-за более низкой плотности митохондрий, активности и некоторых метаболических дефектов, не выраженных в фибробластах кожи. . 6 Большинство методов включают измерение активности ферментов и использование иммуноблоттинга белков ETC для определения содержания белка 7,8 , и их полезность в клинических условиях у пациентов с заболеваниями не ясна. 9,10
Наша цель состояла в том, чтобы определить, существуют ли делеции низкого уровня, обнаруженные в образцах мышц, также в культивируемых фибробластах кожи, используя один или комбинацию электрофореза в полиакриламидном геле с голубым или прозрачным нативным полиакриламидным гелем (BN-PAGE / CN-PAGE) белков ETC. Мы обнаружили, что гибридный метод, электрофорез в полиакриламидном геле с голубым и прозрачным нативным полиакриламидным гелем (BCN-PAGE), смог решить проблему аномального выявления сложных V (CV) паттернов у пациентов с этим заболеванием. 4,5
Методы
Утверждения стандартных протоколов, регистрации и согласия пациентов
Все экспериментальные процедуры этого исследования были выполнены в соответствии с правилами Объединенного совета по этике исследований в области здравоохранения Университета Калгари (REB13-0753) и Хельсинкской декларации и получено письменное информированное согласие пациента.
Пациенты и ткани
Митохондриальная клиника Детской больницы Альберты использует стандартный протокол для тестирования митохондриальных заболеваний, который включает биопсию мышечной иглы для световой и электронной микроскопии 11,12 , извлечение мтДНК при синдроме Кернса-Сейра Саузерн-блот, целевой анализ мутаций, ПЦР с длинным диапазоном для частных делеций и точечных мутаций, мышцы для BN-PAGE или CN-PAGE и биопсия кожи для культивирования фибробластов.Четыре пациента в возрасте 46–65 лет были осмотрены в Метаболической клинике Детской больницы Альберты (Калгари, AB) и обследованы на митохондриальные заболевания (таблица 1). Четыре контрольной группы в возрасте 46–62 лет были также отобраны из банка фибробластов кожи, которые ранее были исследованы и не имели диагноза врожденной ошибки метаболизма или митохондриального заболевания в Метаболической клинике Детской больницы Альберты.
ТаблицаХарактеристики пациента на момент подтверждения диагноза
Биопсия мышц и кожи была выполнена в рамках стандартных диагностических процедур с использованием игольной биопсии мышц. 13 Примерно 150 мг всего образца мышц были взяты для биопсии из латеральной широкой мышцы бедра перед быстрым замораживанием без консервантов и кратковременным хранением в жидком азоте. Часть мышцы была отправлена на анализ ферментов дыхательной цепи и либо BN-PAGE, либо CN-PAGE 14,15 либо в лабораторию биохимической генетики Университета Колорадо, Денвер (Аврора, Колорадо), либо в лаборатории медицинской нейрогенетики (Атланта, Джорджия) в соответствии с с провинциальным планом здравоохранения. Оставшуюся мышцу отправили на секвенирование и оценку мтДНК (секвенирование по Сэнгеру или секвенирование следующего поколения (NGS) и Саузерн-блоттинг) в Лабораторию молекулярной диагностики Университета Альберты (Эдмонтон, штат Алабама).BN-PAGE или CN-PAGE выявили неполную сборку CV у каждого пациента, характеризуемую дублетом CV (рис. 1). Комбинированное секвенирование и Саузерн-блот-анализ мышечной ткани успешно идентифицировали 4 уникальные делеции мтДНК, охватывающие ген CV ATP6 (таблица 1). 16 Образцы кожи были собраны с использованием либо круглой пункционной биопсии диаметром 4 мм, либо линейного кусочка размером 4 × 2 мм, удаленного из места разреза при биопсии мышцы и переданного в лабораторию биохимической генетики Детской больницы Альберты (Калгари, штат Алабама). для последующего культивирования фибробластов.
Рис. 1 Клиническая идентификация не полностью собранного митохондриального CV из скелетных мышц. Репрезентативное изображение, идентифицирующее неполную сборку митохондриального CV из скелетных мышцКлиническую диагностику сборок митохондриальных ферментов пациента проводили с использованием окрашивания активности в геле с помощью BN-PAGE или CN-PAGE. Диагностические оценки проводились на тканях скелетных мышц пациентов с помощью BN-PAGE 14,15 , проведенного в лаборатории биохимической генетики Университета Колорадо в Денвере (n = 3) (Аврора, Колорадо) и CN-PAGE в лабораториях MNG (n = 1) ( Атланта, Джорджия).Репрезентативное изображение относится к когорте BN-PAGE (пациент 1). BN-PAGE или CN-PAGE = электрофорез в полиакриламидном геле с нативным синим или прозрачным нативным полиакриламидом; CV = комплекс V; MNG = Медицинская нейрогенетика.
Культура фибробластов кожи
Ткани биопсии кожи пациента и контрольной группы были перенесены в P5 и помещены во флаконы T175 в соответствии с протоколом, используемым лабораторией биохимической генетики детской больницы Альберты. Клеточная среда, состоящая из минимально необходимой среды с 2 мМ глутамина (Life Technologies, Burlington, ON), 10% фетальной бычьей сыворотки (Life Technologies), 1 мМ пирувата натрия (Life Technologies), 20 мМ уридина (Life Technologies) и 100 Ед / мл пенициллин-стрептомицин удаляли и заменяли через 3 последовательных дня инкубации клеток. 17 Ранее было показано, что для снижения ложноотрицательных результатов по мтДНК в фибробластах кожи в среду добавляли уридин и пируват натрия для поддержания выживаемости аномальных митохондрий. 18 При достижении 80% слияния фибробласты кожи отделяли от соответствующих колб с использованием 3 мл 0,25% трипсина / 1 мМ ЭДТА (Life Technologies) и контролировали под световым микроскопом для установления успешного разделения. Отделенные фибробласты кожи из 8 колб T175 на линию клеток пациента / контрольной группы аспирировали пипеткой на 25 мл и объединяли в коническую пробирку на 50 мл.Объединенные клетки центрифугировали при 200 g в течение 5 минут при комнатной температуре (центрифуга Beckman Spinchron R; Beckman Coulter, Ramsey, MN). Супернатант отбрасывали, и осадок тщательно промывали 3 раза 2 мл сахарозного буфера — исходный раствор (250 мМ сахароза, 20 мМ Трис, 0,1 мМ ЭДТА, pH 7,4) (Sigma-Aldrich, Oakville, ON) перед ресуспендированием в 5 мл холодного сахарозного буфера (4 ° C). Затем клеточную суспензию переносили в гомогенизатор из стекла и тефлона и подвергали 20 проходам на льду.Затем гомогенизированную клеточную суспензию центрифугировали при 3000 об / мин в течение 7 минут при 4 ° C (микроцентрифуга Sorvall Legend Micro 21R; Thermo Fisher Scientific, Burlington, ON). Затем супернатант удаляли (осадок отбрасывали) и центрифугировали при 10000 об / мин в течение 10 минут при 4 ° C (микроцентрифуга Sorvall Legend Micro 21R). Затем супернатант отбрасывали, а осадок ресуспендировали в 2 мл холодного (4 ° C) сахарозного буфера перед другой стадией центрифугирования при 10000 об / мин в течение 10 минут при 4 ° C (микроцентрифуга Sorvall Legend Micro 21R).Затем супернатант отбрасывали, а осадок ресуспендировали в 250 мкл буфера C — исходный раствор (1,5 М аминокапроновая кислота, 50 мМ Bis-Tris, pH 7,0) (Sigma-Aldrich). На этом этапе отбирали аликвоту объемом 10 мкл для количественного определения белка митохондрий фибробластов кожи, используя бычий сывороточный альбумин в качестве стандарта, с использованием метода Брэдфорда (Bio-Rad, Hercules, CA). Затем солюбилизация митохондриальных мембран была достигнута путем инкубации 1,6 мг неионного детергента н-додецил-β-D-мальтозида (DDM — из исходного раствора) на 1 мг митохондриального белка в течение 20 минут на льду.После солюбилизации образцы центрифугировали при 14 800 об / мин в течение 30 минут при 4 ° C (микроцентрифуга Sorvall Legend Micro 21R). Супернатант отбрасывали, а осадок ресуспендировали в Brilliant Blue G (BBG) (Sigma-Aldrich) — 300 мкг BBG (из исходного раствора) на 100 мкг митохондриального белка. Продукт митохондриального белка, суспендированный в BBG, хранили при -80 ° C до анализа BCN-PAGE.
Электрофорез в полиакриламидном геле с природным синим и прозрачным природным слоем
BCN-PAGE выполняли с использованием системы электрофореза XCell SureLock Mini-Cell при 4 ° C (Thermo Fisher Scientific).В гели NativePAGE 4% –16% Bis-Tris (Thermo Fisher Scientific) непосредственно загружали 40 мкг митохондриального белка на лунку, используя хранящиеся растворы митохондриального белкового продукта и BBG. Гели работали при 160 В в течение первого часа, а затем напряженность электрического поля была изменена до 100 В на оставшиеся 4,5 часа, поскольку было обнаружено, что это оптимизирует разделение белков. В каждом эксперименте с электрофорезом использовали одну партию анода (50 мМ трицин, 15 мМ бис-трис, pH 7,0) и катода (50 мМ трицин, 15 мМ бис-трис, 0.01% мас. / Об. DDM, pH 7,0) (Sigma-Aldrich) без замены.
Окрашивание активности фермента в геле
После BCN-PAGE, адаптированного из ранее опубликованных протоколов, каждый индивидуальный белковый комплекс окислительного фосфорилирования (OXPHOS) исследовали на предмет его соответствующей ферментативной активности и сборки белкового комплекса. 19, -, 21 Индивидуальные гели запускали для каждого ферментного комплекса OXPHOS, причем каждый гель содержал все 4 контрольных образца и все 4 образца пациентов. Начиная с комплекса I, гели завершали в порядке возрастания номера комплекса ассоциированного фермента OXPHOS до CV.Каждое пятно активности готовили свежим до приблизительного объема 20 мл (см. Ниже), и перед сканированием или визуализацией каждый гель тщательно промывали водой и мягким встряхиванием (3 × 10 минут). Для комплекса III использовали окраску обилия белка, поскольку опубликованная окраска активности не считается эффективной для фибробластов кожи. 22
Активность комплекса I
Гель предварительно инкубировали в 2 мМ Трис-HCl pH 7,0 (Sigma-Aldrich) в течение 15 минут при комнатной температуре при мягком перемешивании.Затем его переносили в раствор 2 мМ Трис-HCl pH 7,4 (Sigma-Aldrich), содержащий 0,1 мг / мл никотинамидадениндинуклеотида (Sigma-Aldrich) и 0,25 мг / мл нитросинего тетразолия (NBT) (Sigma-Aldrich) при температуре окружающей среды. комнатная температура при легком перемешивании. Полосатость начала развиваться в течение 2 часов, при оптимальной визуализации полосы> 24 часов.
Активность комплекса II
Гель предварительно инкубировали в 200 мМ Трис-HCl pH 7,4 (Sigma-Aldrich) в течение 15 минут при комнатной температуре при легком перемешивании.Затем гель инкубировали в растворе 200 мМ трис-HCl pH 7,4 (Sigma-Aldrich), содержащем 30 мМ янтарной кислоты (Sigma-Aldrich), 0,2 мМ феназинметосульфат (Sigma-Aldrich), 2 мМ EDTA (Sigma-Aldrich). , 2 мМ цианида калия (Sigma-Aldrich) и 1,0 мг / мл NBT (Sigma-Aldrich) при комнатной температуре и легком перемешивании. Бандажирование развилось в течение 12 часов.
Обилие белка в комплексе III
Гель предварительно инкубировали в 5 мМ Трис-HCl pH 7,4 (Sigma-Aldrich) в течение 15 минут при комнатной температуре при легком перемешивании.Затем гель инкубировали приблизительно в 20 мл одностадийного раствора субстрата для тетраметилбензидин-блоттинга (Thermo Fisher Scientific) при комнатной температуре и легком перемешивании. Полосы развились в течение 6–12 часов, с оптимальной визуализацией полосы через 12 часов.
Активность комплекса IV
Гель предварительно инкубировали в 50 мМ фосфатном буфере, pH 7,4 (Sigma-Aldrich), в течение 15 минут при комнатной температуре при легком перемешивании. Затем его инкубировали в растворе 50 мМ фосфатного буфера pH 7.4 (Sigma-Aldrich), содержащий 10 мг тетрагидрохлорида диаминобензидина (Sigma-Aldrich), 20 мг цитохрома c (Sigma-Aldrich) и 1,5 г сахарозы (Sigma-Aldrich) при комнатной температуре и легком перемешивании. Бандажирование развивается в течение 4–12 часов.
Активность CV
Гель тщательно промывали водой и мягким встряхиванием (3 × 10 минут) перед предварительной инкубацией в 50 мМ Трис pH 8,6 (Sigma-Aldrich) в течение 1 часа при комнатной температуре с легким перемешиванием. За это время был приготовлен раствор, содержащий следующие химические вещества, добавленные в следующем порядке: 35 мМ Трис, 270 мМ глицин, 14 мМ MgSO 4 и 8 мМ АТФ (Sigma-Aldrich).Затем раствор доводили до pH 7,8 перед добавлением 0,2% Pb (NO 3 ) 2 (Sigma-Aldrich). Наконец, pH раствора доводили до 8,6, и гель инкубировали при 37 ° C при легком перемешивании. Полосы появляются в течение 1-2 часов, с оптимальным развитием полосы через 18 часов.
Иммуноблоттинг белков
После BCN-PAGE иммуноблоттинг белков, адаптированный из ранее опубликованной работы 21 , был выполнен с использованием отдельных гелей для образцов пациентов и контрольных образцов.После переноса на мембраны из поливинилидендифторида (Millipore, Billerica, MA) первичные антитела использовали для зондирования мембран в течение ночи при 4 ° C на платформе для встряхивания. Затем вторичные антитела инкубировали на мембране в течение 1,5 часов при комнатной температуре. Первичные антитела были следующими: Total OXPHOS (номер в каталоге ab110413; Abcam, Cambridge, MA) и β-актин (номер в каталоге ab8226; Abcam). Мембраны подвергали воздействию хемилюминесцентного субстрата максимальной чувствительности SuperSignal West Femto (Life Technologies) и отображали с помощью системы визуализации ChemiGenius (Syngene, Frederick, MD).Денситометрию выполняли с использованием GeneTools (Syngene) с β-актином в качестве контроля нагрузки.
Секвенирование всего экзома
Два пациента (1 и 4) также участвовали в нашем исследовании NGS, и им было выполнено секвенирование всего экзома. Экзомы секвенировали с использованием системы 5500XL SOLiD (Life Technologies), а обогащение экзомов выполняли с использованием Agilent SureSelect XT Human All Exon V5 (Agilent Technologies). Для вторичного анализа данные секвенирования были загружены в экземпляр Galaxy Университета Калгари (vpn.chgi.ucalgary.ca/), который использовал набор инструментов анализа генома и инструменты карты выравнивания последовательностей для создания файла вызова вариантов. Фильтрация и интерпретационный анализ полученных аннотированных вариантов проводились в формате .xlsx. Стратегия фильтрации состояла из параметров качества секвенирования (считывания вариантов), частоты варианта (≤MAF 0,01), зиготности, контекста вариантов и вычислительных данных, таких как PolyPhen, масштабно-инвариантное преобразование признаков и профилирование скорости геномной эволюции. Используемая сборка — ГРЧ47 / ХГ19.
Статистический анализ
Статистический анализ выполняли с использованием GraphPad Prism для Windows, версия 7.02 (GraphPad Software Inc., La Jolla, CA). Различия между группами определялись тестами Стьюдента t , где p <0,05 было значимым. Данные выражены как среднее ± SEM.
Доступность данных
Анонимные данные будут предоставлены по запросу любых квалифицированных исследователей.
Результаты
Окрашивание активности фермента в геле
Репрезентативное изображение, на котором сравниваются митохондриальные белковые комплексы OXPHOS с разрешением BCN-PAGE между пациентом 1 и контролем 1, представлено на рисунке 2.Результаты нашего модифицированного анализа BCN-PAGE демонстрируют способность как успешно идентифицировать каждый из 5 митохондриальных белковых комплексов OXPHOS, так и резюмировать клинические диагностические данные не полностью собранных CV, обнаруженных исключительно в образцах пациентов. Индивидуальные детали каждого белкового комплекса OXPHOS описаны в следующих разделах.
Рис. 2 Клиническая идентификация не полностью собранной сердечно-сосудистой системы митохондрий из фибробластов кожи. Репрезентативное изображение, идентифицирующее неполную сборку митохондриального CV из фибробластов кожиОценку сборок митохондриальных ферментов пациента проводили с использованием окрашивания активности в геле гибридного BCN-PAGE.Подтверждение предыдущих диагностических оценок проводилось на изолированных митохондриях фибробластов кожи пациентов и контрольной группы (n = 4 на группу). Репрезентативное изображение относится к данным от пациента 1 и контрольных образцов 1. BCN-PAGE = электрофорез в полиакриламидном геле с нативным голубым и прозрачным нативным полиакриламидом; CV = комплекс V.
Активность комплекса I
Клиническое окрашивание активности в геле выявило нормальную активность комплекса I у каждого пациента (n = 4) по сравнению с образцом внутреннего контроля.Анализ BCN-PAGE выявил явную разницу в сборке белкового комплекса между образцами пациента и контрольными образцами (рис. 2). Комбинация более низкой и более высокой сборки белка существовала для контрольных образцов, тогда как только более низкая сборка комплекса I присутствовала у пациентов (n = 4 на группу). Как было описано ранее, высшая сборка, скорее всего, является суперкомплексами. 23
Активность комплекса II и комплекса IV
Клиническое окрашивание активности в геле выявило нормальную активность как комплекса I, так и комплекса IV для каждого пациента (n = 4 на комплекс) по сравнению с образцом внутреннего контроля.Анализ BCN-PAGE подтвердил эти результаты, не обнаружив визуальных различий между образцами пациента и контрольной выборкой (n = 4 на группу) (рисунок 2).
Обилие белка в комплексе III
О клиническом окрашивании активности комплекса III в геле обычно не сообщается из-за воспроизводимости в фибробластах. Однако анализ BCN-PAGE может определить содержание белка в комплексе III с использованием одностадийного раствора субстрата для блоттинга тетраметилбензидина (рис. 2). Визуальных различий между количеством или сборкой белка между образцами пациентов и контрольными образцами (n = 4 на группу) выявлено не было.
Активность CV
Клиническое окрашивание активности в геле выявило нормальную активность CV, хотя каждый образец пациента также идентифицировал более сильную, чем обычно, одиночную полосу не полностью собранной CV (n = 4) по сравнению с внутренним контролем. Анализ BCN-PAGE подтвердил эти результаты, выявив аналогично неправильно собранный дублет CV в образцах пациентов, тогда как каждый контрольный образец был представлен в виде одной полосы (n = 4 на группу) (рисунок 2).
Иммуноблоттинг белков
Уровни белка отдельных митохондриальных белковых комплексов OXPHOS оценивали для количественной оценки содержания белка.Исследование блотов не выявило значительных различий в содержании белка для митохондриальных комплексов OXPHOS II, III, IV или V (n = 4 на группу) (рис. 3). Интересно, что даже в фибробластах кожи мы обнаружили большое количество комплекса I в контрольных образцах по сравнению с пациентами, потенциально подтверждая визуальный контраст между образцами пациента и контрольными образцами из экспериментов BCN-PAGE.
Рис. 3 Исследование белков OXPHOS, выделенных из фибробластов кожи пациента с неполностью собранными митохондриальными CVОценка митохондриальных белков OXPHOS в митохондриях, выделенных от пациентов с митохондриальными делециями CV и контрольных образцов, с использованием фибробластов кожи.Результаты сопровождаются репрезентативными изображениями иммуноблоттинга с n = 4 на группу. Данные представлены в виде среднего значения ± SEM, где * указывает на значительную разницу между образцами пациента и контрольной выборкой при p <0,05. CV = комплекс V; OXPHOS = окислительное фосфорилирование.
Секвенирование всего экзома
Секвенирование экзома у пациентов 1 и 4 не выявило никаких ядерных генов-кандидатов для объяснения фенотипа или митохондриального заболевания. Однако дальнодействующая ПЦР области, обычно удаляемой у пациентов с синдромом Кернса-Сейра, выявила низкий уровень делеций митохондриального генома.Секвенирование по Сэнгеру точки разрыва делеции показало, что все делеции связаны с образованием нового белка ATP6, который имеет 3′-концевую часть гена, слитую с последовательностью в гипервариабельной области. Предполагается, что это слияние, если оно будет стабильным, приведет к тому, что белок АТФ6 будет иметь более длинный карбокси-конец.
Обсуждение
Мы представляем 4 случая пациентов с низким уровнем делеций мтДНК в скелетных мышцах и аномальной сборкой CV-белков. Сердечно-сосудистые нарушения могут быть связаны со многими патогенными вариантами, влияющими как на яДНК, так и на мтДНК. 24,25 У 3 из этих пациентов уровень гетероплазмии в скелетных мышцах был ниже 10%, что вызвало опасения, что делеции мтДНК могут быть вызваны старением скелетных мышц, а не митохондриальным заболеванием зародышевой линии. Затем мы изменили устоявшиеся методы гель-электрофореза для создания гибридного метода BCN-PAGE, который успешно обнаружил аномальное сердечно-сосудистое заболевание в фибробластах кожи у всех 4 пациентов. Эти результаты согласуются с мутацией мтДНК, которая показала присутствие той же делеции как в мышцах, так и в коже и, таким образом, снизила вероятность соматически приобретенных делеций в скелетных мышцах.Многие митохондриальные заболевания, являющиеся частью наследственных метаболических нарушений, характеризуются недостаточностью функции OXPHOS, которая может быть результатом мутаций яДНК или мтДНК. 26 Диагностика отдельных митохондриальных заболеваний осложняется вариабельностью клинических фенотипов и тканеспецифической гетероплазмией митохондриального генома, и, таким образом, пациентам обычно требуется многогранный диагностический подход, исследующий ткани из многих систем органов. 27 Еще больше усложняя анализ митохондриального генома, в скелетных мышцах могут накапливаться спонтанные мутации мтДНК, которые сохраняются из-за постмитотической природы ткани. 28,29 По этой причине мы разработали анализ BCN-PAGE с использованием митогенных фибробластов кожи пациентов, у которых были потенциально патогенные мутации мтДНК в скелетных мышцах.
Обычно выполняется при клинических исследованиях митохондриальной болезни; BN-PAGE и CN-PAGE используют традиционный неденатурирующий (нативный) электрофорез для разделения белков на основе их электрофоретической подвижности. 30,31 Основное различие между вышеупомянутыми методами заключается в наличии анионных красителей или детергентов для усиления миграции белков за счет увеличения отрицательного заряда мигрирующих белков. 32 Это обычно достигается за счет добавления BBG, анионного красителя, который добавляют как в катодный буфер, так и в буфер для образцов в начале работы геля BN-PAGE, перед тем, как его удалить на оставшуюся часть анализа. Однако было показано, что добавление BBG препятствует окрашиванию активности в геле и последующему иммуноблоттингу белков. 32 С другой стороны, CN-PAGE лишен BBG, и поэтому только кислые белки мигрируют к аноду. 31 Также был разработан модифицированный анализ CN-PAGE (CN-PAGE высокого разрешения), в котором в катодный буфер добавляются как анионные, так и неионные детергенты.Это создает мицеллы, которые изменяют заряд нативных белков и облегчают миграцию к аноду. 33 Однако использование анионных детергентов может нарушить сборку митохондриальных белковых комплексов OXPHOS.
Разработка анализа BCN-PAGE была направлена на объединение полезных аспектов различных условий BN- и CN-PAGE при сохранении как активности белка, так и сборки белкового комплекса. В частности, сборка митохондриального белка поддерживалась во время экстракции с использованием мягкого неионного детергента (DDM) во время солюбилизации мембраны.Затем катодный буфер для анализа BCN-PAGE был приготовлен без добавления анионного красителя BBG, обычно используемого в BN-PAGE. Вместо этого BBG был заменен неионогенным детергентом (DDM), чтобы предотвратить вмешательство BBG в окрашивание активности в геле и иммуноблоттинг белков. 32 Таким образом, модифицированный катодный буфер BCN-PAGE сохраняет активность белка OXPHOS и сборку белкового комплекса. Буфер для образцов BCN-PAGE также содержит оптимизированную концентрацию BBG. Действуя как молекула со сдвигом заряда, анионный краситель BBG обеспечивает миграцию белкового комплекса к аноду. 31 В отличие от протоколов CN-PAGE, BCN-PAGE не использует анионные детергенты в катодном буфере или буфере для образцов, что обеспечивает миграцию нативного белка и образование комплексов. 34 Наконец, продолжительность электрофореза и напряженность электрического поля в BCN-PAGE были выбраны для оптимального разделения белков. В совокупности комбинация методов BN- и CN-PAGE обеспечивает более полное исследование митохондриальной активности белка OXPHOS и сборки белкового комплекса.
В настоящем исследовании использовался анализ BCN-PAGE с использованием фибробластов кожи в качестве дополнения для подтверждения клинических результатов биопсии скелетных мышц. После обычного обследования митохондриального заболевания каждому пациенту была проведена биопсия скелетных мышц для биохимического анализа (рисунок 1), гистологии (данные не показаны) и молекулярного анализа (таблица 1), а также биопсия кожи, которая была сохранена для будущего использования. Интересно, что характерный дублет не полностью собранной CV, как это было идентифицировано в клинических результатах BN- или CN-PAGE, был визуализирован в фибробластах кожи пациента с помощью BCN-PAGE (рис. 2).Эти находки предполагают, что мутации мтДНК CV, выявленные в мышцах, скорее всего, происходят из зародышевой линии, а не приобретаются соматически или в результате клональной экспансии. 35 Кроме того, систематическая идентификация суперкомплексов комплекса I может быть еще одним преимуществом нашей методики BCN-PAGE. Эти визуализированные различия в сборке белка комплекса I, идентифицированные с помощью BCN-PAGE (фиг. 2), также были увеличены после иммуноблоттинга белков (фиг. 3). Это согласуется с визуальным контрастом между образцами пациента и контрольными образцами из экспериментов BCN-PAGE.BCN-PAGE с использованием фибробластов кожи обеспечивает поддержку мутации митохондриального генома зародышевой линии, а визуализация полос белка BCN-PAGE после окрашивания активности в геле может предоставить ценную информацию относительно обилия митохондриального белка.
CV включает области F0 и F1, которые можно дополнительно разделить на 16 субъединиц, 2 из которых кодируются мтДНК. Как часть области F0, встроенной во внутреннюю митохондриальную мембрану, субъединицы A и A6L кодируются генами мтДНК ATP6 и ATP8 соответственно.Функционирующий белок ATP6 образует протонную пору, соединяющую некаталитическую область F0 с каталитически активным F136. Помимо облегчения движения протонов между каждой областью, белок ATP6 также физически соединяет области F0 и F1 через периферический стержень. Существующая гипотеза состоит в том, что повреждение субъединицы A может приводить к нарушению трансляции внутримитохондриального белка, нестабильности CV и, наконец, диссоциации областей F0 и F1, что приводит к визуализации CV как дублета. 36 Однако идентификация этих субкомплексов в культивируемых фибробластах кожи пациентов варьировала, с уровнями гетероплазмии> 95%. 36 Учитывая, что у 3 из наших пациентов была выявлена низкая гетероплазмия (<10%), а у четвертого - 25% гетероплазмии, мы предполагаем, что экспрессия белка ATP6 может действовать как доминантно-негативная мутация. 37 Другими словами, мутантный белок ATP6 связывается с окружающими белками CV, что приводит к эффективному секвестрации правильно функционирующих CV.
Часто используемая для дополнения существующих диагностических процедур различных наследственных метаболических нарушений, кожная пункционная биопсия является простой процедурой и может использоваться для изучения биохимических дефектов в фибробластах кожи пациента. 38 Однако золотым стандартом для оценки активности митохондриальных ферментов при подозрении на митохондриальное заболевание является биопсия скелетных мышц. 39 В частности, скелетная мышца считается превосходной тканью, потому что она содержит высокую концентрацию митохондрий, 40 , тем самым повышая чувствительность теста, 3 , и на ее функцию обычно влияет митохондриальное заболевание. 41 Однако ложноположительные результаты могут быть результатом неправильного хранения ткани 42 или спонтанного накопления мутаций мтДНК, 3 , тогда как ложноотрицательные результаты могут быть вызваны смещением выборки. 43 Хотя фибробласты кожи обладают низкой биоэнергетической способностью, они могут иметь различные уровни гетероплазмии мтДНК в зависимости от возраста пациента. Недавние исследования показали, что как мутации ДНК, так и уровни гетероплазмии мтДНК в фибробластах кожи остаются неизменными после продолжительного культивирования (пассажи 2–15), что указывает на то, что мутации мтДНК в фибробластах кожи, вероятно, наследуются. 44 Напротив, некоторые исследования выявили ограниченную полезность обнаружения истощения мтДНК с использованием фибробластов кожи. 45 Это демонстрирует важность комплексного подхода к митохондриальной диагностике, в котором следует применять несколько методов. Комбинирование этого подхода с другими неинвазивными подходами 46 может позволить использовать менее инвазивный подход во все большем числе случаев, особенно при заболеваниях, которые могут не обнаруживаться с использованием классических методов полногеномного или полногеномного секвенирования лейкоцитарной ДНК.
Вклад авторов
К. Ньюэлл, А. Хан, Д. Синасак, С. Хьюм, Дж. Ширер и И. Сосова разработали и разработали исследование. К. Ньюэлл, А. Хан, М. В. Фридрих и И. Сосова проводили эксперименты, собирали и анализировали данные. Рукопись написали К. Ньюэлл, А. Хан, Дж. Шоффнер, Дж. Л. Ван Хов и Дж. Ширер. Все авторы прочитали и одобрили окончательную рукопись.
Финансирование исследования
Это исследование было поддержано Исследовательским фондом детских больниц Альберты (ACHRF) и MitoCanada (A.Хан). Это исследование было поддержано докторантурой C. Newell из MitoCanada и Alberta Innovates — Health Solutions, MD / PhD. И.С. была стипендиатом исследовательского института детской больницы Альберты (ACHRI) в области клинических исследований.
Благодарность
Авторы благодарят Элизабет Ньюэлл за редактирование более раннего черновика этой рукописи.
Сноски
Для получения полной информации перейдите на Neurology.org/NG. Информация о финансировании представлена в конце статьи.
Конкурирующие интересы: авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Заявление об одобрении этических норм: Все экспериментальные процедуры данного исследования были выполнены в соответствии с рекомендациями Объединенного совета по этике исследований в области здравоохранения Университета Калгари, REB № 13-0753, MITO-FIND (функциональная и интегративная диагностика митохондрий нового поколения) Учиться.
Заявление о согласии пациента: Все пациенты дали письменное информированное согласие в соответствии с Этическим кодексом Всемирной медицинской ассоциации (Хельсинкская декларация).
Плата за обработку статьи была профинансирована авторами.
- Поступила 28 ноября 2018 г.
- Исправление получено 8 февраля 2019 г.
- Принято в окончательной форме 1 марта 2019 г.
- Copyright © 2019 Автор (ы). Опубликовано Wolters Kluwer Health, Inc.от имени Американской академии неврологии.
Электрофорез | Спросите у биолога
Электрофорез в агарозном геле
Электрофорез в агарозном геле позволяет разделять фрагменты ДНК по размеру. Обычно молекула ДНК переваривается рестрикционными ферментами, и электрофорез в агарозном геле используется в качестве диагностического инструмента для визуализации фрагментов. Электрический ток используется для перемещения молекул ДНК через агарозный гель, который представляет собой полисахаридную матрицу, которая функционирует как своего рода сито.Матрица помогает «поймать» молекулы по мере их перемещения электрическим током.
Эта техника имеет множество применений. Вообще говоря, вы можете анализировать фрагменты ДНК, полученные в результате ферментативного переваривания большего фрагмента ДНК, чтобы визуализировать фрагменты и определить их размеры.
Помимо полезности в исследовательских методах, электрофорез в агарозном геле является распространенным методом судебной медицины и используется для снятия отпечатков пальцев ДНК.
А нельзя было просто покрасить?
Бромид этидия представляет собой интеркалирующий краситель, что означает, что он внедряется между основаниями, расположенными в центре спирали ДНК.Одна молекула бромида этидия связывается с одним основанием. Когда каждая молекула красителя связывается с основаниями, спираль разматывается, чтобы принять напряжение от красителя.
Замкнутая кольцевая ДНК ограничена и не может противостоять такому напряжению скручивания, как линейная ДНК, поэтому кольцевая ДНК не может связывать столько красителя, сколько линейная ДНК.
Бромид этидия легко может попасть в ваши клетки. ДНК человека линейна и хорошо окрашивается. Это значит, что он может попасть в вашу ДНК и раскрутить ее. Это нехорошо, поэтому будьте осторожны и осторожны при использовании бромистого этидия.
Есть также более безопасные и менее токсичные альтернативы, которые вы можете использовать. GelRed и GelGreen — это пятна ДНК, которые не могут проходить через клеточные мембраны, что делает их более безопасными в использовании и утилизации.
Перемещение по матрице
Молекулы фосфата, составляющие основу молекул ДНК, имеют высокий отрицательный заряд. Когда ДНК помещают в поле с электрическим током, эти отрицательно заряженные молекулы ДНК мигрируют к положительному концу поля, которое в данном случае представляет собой гель агарозы, погруженный в буферную ванну.
Гель агарозы представляет собой сшитую матрицу, которая чем-то похожа на трехмерную сетку или экран. Молекулы ДНК притягиваются к положительному концу током, но они сталкиваются с сопротивлением этой агарозной сетки. Более мелкие молекулы могут перемещаться по сетке быстрее, чем более крупные, поэтому они продвигаются дальше по гелю, чем более крупные молекулы. Вот как электрофорез в агарозе разделяет разные молекулы ДНК в зависимости от их размера. Гель окрашивают бромидом этидия, чтобы вы могли визуализировать, как эти молекулы ДНК распадаются на полосы вдоль геля.
Саузерн-блоттинг также можно использовать в качестве метода визуализации агарозных гелей.
Неизвестные образцы ДНК обычно обрабатываются на одном геле с «лестницей». Лестница — это образец ДНК, размер полос которого известен. Итак, после того, как вы закончите свой образец, вы можете сравнить неизвестные фрагменты с фрагментами лестничной диаграммы и определить приблизительный размер неизвестных полос ДНК по тому, как они совпадают с известными полосами лестницы.
Дополнительные изображения из Викимедиа через Якопо Вертера (аппарат для электрофореза) и Мнольф (гель-электрофорез)
Правила 24-часового сбора образцов мочи
Вам понадобится
- Чистый контейнер для сбора мочи.Самки будут использовать унитаз для сбора или сбора мочи (Рисунок 1). Мужчины могут использовать пластиковый переносной (удобный для переноски) писсуар или большой контейнер для хранения мочи.
- Большой контейнер для хранения мочи (Фото 2)
- Полное официальное имя ребенка — полное имя и фамилия, правильно написанные
- Один из следующих уникальных идентификаторов:
- Дата рождения или
- ID пациента или
- Медицинская карта Национальной детской больницы №
Может быть полезно выполнить шаги 1 и 2 перед запуском сбора.
- Дата начала теста и дата окончания теста (ММ / ДД / ГГГГ)
- Время начала теста и время завершения теста (включая утро или вечер)
Национальные детские поликлиники могут предоставить вам регистрационный ярлык EPIC, который вы сможете прикрепить к большому контейнеру.
Как собрать суточный образец мочи- Выберите день для проведения теста, когда ваш ребенок будет весь день дома.
- В день обследования попросите ребенка опорожнить мочевой пузырь (помочиться или помочиться) в унитаз сразу после пробуждения.Смойте мочу в унитаз.
- Теперь тест начинается с пустым мочевым пузырем. Напишите эту дату и время начала на этикетке контейнера для хранения.
- В течение следующих 24 часов вашему ребенку нужно будет мочиться в сборный контейнер каждый раз, когда он идет в ванную. Самки могут пользоваться унитазом. Мужчины могут использовать пластиковый писсуар или писать прямо в большой контейнер для хранения. Если у вас дома нет унитаза или писсуара, вы можете использовать другой чистый пластиковый контейнер.
- Перед первым использованием пластикового контейнера вымойте его средством для посуды, а затем ополосните не менее 10 раз водопроводной водой. Дайте ему полностью высохнуть на воздухе.
- Не допускайте смешивания фекалий (фекалий) с мочой, иначе придется перезапустить анализ.
- Вылейте мочу в большой контейнер для хранения и плотно закройте крышку. Будьте очень осторожны, чтобы не пролить мочу.
- При использовании сборного контейнера промойте его только водой .Положите его обратно у унитаза, чтобы напомнить вам, что нужно использовать его в следующий раз. Дайте ему полностью высохнуть на воздухе.
- Поместите большой контейнер для хранения в холодильник. Мочу необходимо постоянно держать в прохладном месте. Если у вас нет места в холодильнике, вы можете хранить его в холодильнике поверх «Добавьте еще льда», чтобы моча оставалась холодной.
- Каждый раз, когда ваш ребенок писает днем и ночью, выполняйте шаги с 4 по 9.
- На следующий день (примерно в то же время, в которое вы начали в первый день) попросите ребенка в последний раз пописать в сборный контейнер.Добавьте его в большой контейнер для хранения. На этом 24-часовой сбор закончился.
- Напишите на этикетке дату и время последнего сбора мочи.
- Приложите список всех лекарств, включая лекарства, отпускаемые без рецепта, витамины и лечебные травы, которые ваш ребенок принимал во время 24-часового сбора мочи.
- Как можно скорее доставьте мочу в лабораторный (лабораторный) сервисный центр, в течение 24 часов после окончания сбора. Держите мочу в прохладе.
- Убедитесь, что моча не замерзает для следующих тестов: амилаза, арилсульфатаза, иммуноэлектрофорез, микроальбумин, прегнантриол, белок или мочевая кислота.
- Вам нужно будет начать тест заново, если какая-то моча вылилась, вы забыли ее сохранить или в ней есть какашки. Если необходимо перезапустить тест, можно использовать те же контейнеры для сбора и хранения. Вылейте мочу, тщательно очистите емкости и дайте им высохнуть на воздухе. Затем выполните шаги с 1 по 13.
Днем:
- Любой лабораторный сервисный центр или Общенациональный детский центр «Рядом с домом» в обычные рабочие часы. Чтобы узнать часы работы и местонахождение, позвоните в Лабораторную службу по телефону (800) 934-6575 или посетите сайт NationwideChildrens.org/Lab ..
- Национальная детская лаборатория апельсина, расположенная по адресу 555 S. 18th Street, Columbus, Ohio 43205. Часы работы: с понедельника по пятницу с 8:00 до 19:00.м. и суббота, с 8:30 до 15:30.
Вечером:
- Приемное отделение Национальной детской больницы в главном кампусе. Время возврата: с понедельника по пятницу, 19:00. до 23:30
Пожалуйста, не сдавайте образцы мочи в отделении неотложной помощи.
Если у вас есть какие-либо вопросы, обратитесь к своему врачу или позвоните в лабораторию по телефону (800) 934-6575.
Руководство по 24-часовому сбору образцов мочи (PDF), испанский (PDF), сомалийский (PDF)
HH-III-20 24 6/79 Пересмотрено 21 февраля Copyright 1979 Общенациональная детская больница
Технические и правовые аспекты немецкого пилотного исследования с 38 220 участниками
Серповидно-клеточная анемия (ВСС) не встречается у коренного населения Германии, но с увеличением числа иммигрантов из стран с высоким риском гемоглобинопатий возникает вопрос: или в любом случае не следует начинать в Германии программу скрининга новорожденных (NBS) на ВСС.Недавно мы показали, что в Берлине, городе с очень большим иммигрантским населением, частота ВСС высока, но наших результатов недостаточно для принятия решения для страны в целом. В этой статье мы покажем, что большой объем эпидемиологических данных может быть получен за относительно короткий период времени с очень высокой степенью точности и с относительно небольшими затратами — результат, который может побудить другие рабочие группы начать такой пилотный проект. проект локально. Мы исследовали ранее собранные карты высушенной крови возрастом до шести месяцев, используя высокоэффективную жидкостную хроматографию (ВЭЖХ) в качестве первого метода и капиллярный электрофорез (КЭ) в качестве второго метода.Один лаборант, работающий неполный рабочий день, обработал 38 220 проб за 162 рабочих дня. Общие затраты на образец, включая все непредвиденные расходы (а также затраты на рабочую силу), составили 1,44 евро.
1. Введение
1.1. Серповидно-клеточная анемия
ВСС — одно из наиболее распространенных моногенетических заболеваний во всем мире. Хотя это заболевание наиболее распространено в Африке, в некоторых частях Восточного Средиземноморья и Азии, в результате миграции распространенность также постоянно увеличивается в Центральной и Северной Европе.SCD включает группу аутосомно-рецессивных β -гемоглобинопатий, общей чертой которых является возникновение патогномоничного варианта гемоглобина S (HbS). Его генетическим коррелятом является мутация HBB: c20A> T, которая обнаруживается у всех пациентов и может возникать в гомозиготном или сложном гетерозиготном состоянии в сочетании с рядом других мутаций (например, HbC или β -талассемия). По сравнению с взрослым гемоглобином A (HbA) в молекуле HbS имеется аминокислотная замена на валин вместо глутаминовой кислоты в положении 6 полипептидной цепи β -глобин.Если содержание HbS в эритроците превышает критическую концентрацию, это приводит при определенных условиях к полимеризации деоксигенированных молекул HbS, центральному патофизиологическому событию SCD. В результате сложного процесса это приводит к острому и хроническому гемолизу, а также к повторяющимся вазокклюзионным явлениям, вызывающим боль, ишемию-реперфузионное повреждение и, наконец, хроническое повреждение органов [1].
1.2. Скрининг новорожденных на серповидноклеточную болезнь
Многочисленные исследования предоставляют четкие доказательства того, что опасные для жизни ранние осложнения ВСС (например,д., сепсис, криз секвестрации селезенки и т. д.) можно в значительной степени избежать, если диагноз поставлен на ранней стадии, то есть, если возможно, в первые три-шесть месяцев жизни. Простые, но очень эффективные профилактические меры (например, вакцинация, профилактика пенициллином и т. Д.) Могут быть начаты достаточно рано. Это может значительно снизить заболеваемость и смертность [2–10]. Таким образом, во многих странах ВСС является неотъемлемым компонентом национальных программ НБС. Во многих других странах, в которых нет национальных программ НБС, есть по крайней мере несколько региональных проектов и пилотных исследований [11–30].
Физико-химические свойства HbS отличаются от нормального HbA. Это явление используется для диагностики. Все физиологические гемоглобины, а также все варианты гемоглобина демонстрируют характерные, но не однозначные модели миграции во всех установленных методах разделения. Поскольку в каждом методе присутствуют гемоглобины с одинаковыми или сопоставимыми миграционными характеристиками, невозможно окончательно установить, какой гемоглобин присутствует в конкретном случае. Это означает, что результаты, по крайней мере, двух различных методов должны быть объединены, чтобы иметь возможность идентифицировать присутствующий гемоглобин с достаточной уверенностью [31–34].Это правило также применяется к NBS для SCD, чтобы избежать ложноположительных результатов. Методы, наиболее часто используемые в NBS для SCD для разделения гемоглобинов в высушенных образцах крови, — это ВЭЖХ, изоэлектрическое фокусирование (IEF) и CE [32, 35–37].
1.3. Немецкая программа скрининга новорожденных
В Германии все новорожденные по закону имеют право участвовать в национальной (так называемой расширенной) программе NBS [38]. Однако участие добровольное. Расширенная NBS включает 14 врожденных эндокринных нарушений и нарушений обмена веществ.Он не включает SCD. Кроме того, все новорожденные проходят скрининг на дефекты слуха. Список расстройств, на которые проводится скрининг в программе NBS Германии, устанавливается Объединенным федеральным комитетом (Gemeinsamer Bundesausschuss, G-BA). G-BA издает руководящие принципы для государственных фондов медицинского страхования (GKV), охватывающие более 70 миллионов застрахованных лиц в Германии. В нем указывается, какие услуги по оказанию медицинской помощи возмещает GKV. Если новое заболевание должно быть включено в расширенную программу NBS, оно должно соответствовать критериям Вильсона-Юнгнера, измененным Andermann et al.[39, 40], чтобы соответствовать особым условиям немецкой системы здравоохранения. В частности, должно быть достаточно эпидемиологических данных и должно быть продемонстрировано, что раннее выявление рассматриваемого заболевания связано с медицинской и / или экономической выгодой.
1,4. Серповидноклеточная болезнь в Германии
В Германии практически нет эпидемиологических данных о заболеваемости и распространенности ВСС. Таким образом, SCD до сих пор не воспринималась как серьезная проблема в системе здравоохранения Германии.В Берлине, городе с высоким уровнем заболеваемости, мы выполнили пилотный проект, ранее не имеющий аналогов в Германии, в котором все новорожденные, родившиеся в период с 1 сентября 2011 года по 30 ноября 2012 года, которые сдали образцы крови в рамках расширенной программы NBS, были дополнительно ретроспективно дополнительно ретроспективны. протестирован на SCD [41]. Возраст образцов представляет собой методологическую проблему. Однако две более ранние публикации показали, что возможно хранение не менее шести недель при комнатной температуре или 13 месяцев при –20 ° C [42, 43].В дополнение к сбору эпидемиологических данных, дальнейшая цель проекта заключалась в том, чтобы изучить, можно ли высушенные образцы крови хранить более шести недель при комнатной температуре и как их нужно обрабатывать после длительного хранения, чтобы получить надежные данные. измерения. Это важные параметры для планирования подобных экспериментальных эпидемиологических исследований.
В этом документе мы сообщаем о технических аспектах нашего исследования и более подробно обсуждаем особую правовую ситуацию в Германии.
2. Методы
2.1. Этика и согласие
Комитет по этике университетской больницы Шарите одобрил исследование 28 сентября 2011 г. (номер ссылки EA2 / 088/11). Родители всех обследованных новорожденных дали письменное информированное согласие на повторный анализ крови перед забором крови.
2.2. Дизайн исследования и популяция
Настоящее исследование представляет собой ретроспективное перекрестное исследование неотобранной когорты новорожденных. Все дети, родившиеся в Берлине в период с 1 сентября 2011 года по 30 ноября 2012 года, считались правомочными для участия в этом проекте при условии, что они принимали участие в расширенной программе NBS.Берлин — столица Германии и второй по численности населения город Европейского Союза после Лондона. На 31 декабря 2010 г. в Берлине проживало 3 460 725 человек, из которых 864 065 человек (24,97%) имели миграционный фон. Из них по крайней мере половина иммигрировала из стран с высокой распространенностью гемоглобинопатий [44].
Всего за исследуемый период родилось 39 249 детей. Из них 95 родителей или опекунов не дали согласия на участие в расширенной НБС. Еще 422 младенца не были включены в исследование, потому что родители или опекуны не дали согласия на хранение образцов их детей сверх времени, необходимого для регулярного скрининга.В 126 случаях не было дано согласие на использование образцов в научном проекте, а в 386 случаях было слишком мало материала для дополнительного тестирования на SCD после регулярного скрининга, так что в итоге можно было протестировать 38 220 образцов.
2.3. Целевые условия
Первичные целевые условия этого исследования включали SCD-S / S, SCD-S / C, SCD-S /, SCD-S / E, SCD-S / Lepore, SCD-S /, SCD-S / β -талассемия, SCD-S / δ β -талассемия и SCD-S / HPFH (наследственная персистенция гемоглобина плода).Вторичными целевыми условиями были гетерозиготность HbS, тяжелая талассемия и все варианты гемоглобина, кроме HbS, в гетеро- или гомозиготной форме.
2.4. Взятие образцов крови и логистика
Образцы для скрининга обычно собираются у новорожденных в родильном доме или дома между 36-м и 72-м часами жизни и отправляются в лабораторию NBS в Берлине в тот же день в виде карт сухих пятен крови (Ahlstrom 226, ID Biological Systems, Гринвилл, Южная Каролина, США). Берлинская лаборатория NBS (Лаборатория 1) — одна из 11 лабораторий NBS в Германии (http: // www.screening-dgns.de/screening-3.php), который анализирует образцы в контексте расширенной программы NBS, и является единственной лабораторией NBS в Берлине.
У новорожденных с гестационным возрастом менее 32 недель за первоначальным скринингом последовал второй скрининг при скорректированном возрасте гестации 32 недели. Дополнительными причинами для повторного скрининга были переливание крови или терапия кортикостероидами или дофамином перед сбором образцов для первого скрининга [45]. У пациентов, прошедших скрининг более одного раза, тест на ВСС проводился на последнем полученном образце.
После завершения регулярного скрининга в рамках расширенной программы NBS образцы хранились при комнатной температуре в лаборатории NBS. Они были отправлены через 42–171 день для изучения в рамках нашего проекта.
2,5. Методы измерения
Все образцы сначала исследовали с помощью ВЭЖХ. Образцы с профилями ВЭЖХ, соответствующими SCD, серповидно-клеточному признаку, β -талассемии или вариантам гемоглобина, отличным от HbS, впоследствии были проанализированы CE в качестве подтверждающего метода [41] (рис. 1).
2.6. Высокоэффективная жидкостная хроматография (ВЭЖХ)
ВЭЖХ выполняли на системе скрининга новорожденных VARIANT nbs (Bio-Rad Laboratories, Мюнхен, Германия) с использованием программы серповидных клеток VARIANT nbs. Если прямо не указано иное, мы следовали рекомендациям производителя. Колонки и все реагенты, такие как буферы, праймеры и маркеры времени удерживания, были приобретены у производителя.
Диск диаметром 1/8 » (3,2 мм) вытащили из карты высушенной крови и поместили в лунку 96-луночного планшета.240 мкл л дистиллированной воды добавляли на перфорированный диск, и образец инкубировали в течение 21 часа (в течение ночи) при 4–6 ° C. Затем элюат центрифугировали в течение 10 минут при 1200 g, чтобы удалить твердые элементы (диск, сгустки крови, остатки целлюлозы и т. Д.), Оставшиеся в образце. Осадок оставляли в образце, а супернатант измеряли с защитой от испарения.
Система скрининга новорожденных VARIANT nbs имеет детектор с двумя длинами волн, который измеряет оптическую плотность компонентов пробы на длине волны 415 нм.Фоновый шум снижается путем дополнительного измерения каждого образца на длине волны 690 нм. Затем данные оптической плотности передаются с детектора на подключенный ПК и преобразуются с помощью программного обеспечения GDM 3.0 (Bio-Rad Laboratories, Мюнхен, Германия) в хроматограмму в реальном времени, на которой измеренные напряжения (ось) наносятся на график в зависимости от времени ( -ось). Программа полностью автоматически анализирует хроматограммы, используя принцип интеграции от долины к долине.
Дополнительно все хроматограммы были проверены визуально.
Водные бланки служили отрицательными контролями и включались в каждый цикл. В качестве контроля преаналитического процесса и автоматизированного интегрирования и количественного определения пиков мы использовали элюаты с карт сухих пятен крови от носителей HbS и HbC и маркеры времени удерживания, предоставленные производителем. Были определены промежуточные коэффициенты вариации (CV).
2.7. Капиллярный электрофорез (КЭ)
Для КЭ диск диаметром 3,8 мм вытаскивали из карты высушенных пятен крови и помещали в лунку 8-луночной стрип-пробирки.После добавления 50 мкл л дистиллированной воды образец инкубировали в камере влажности CAPILLARYS при 4–6 ° C в течение не менее двух и не более 72 часов. Затем добавляли 0,6 мл гемолизирующего раствора. Затем измерение гемолизата проводили на системе CAPILLARYS 2 CE. В каждом цикле измеряли контроли с гемоглобинами A, F, S и C, предоставленные производителем. Сбор, обработка и анализ данных проводились с помощью программного обеспечения PHORESIS 6.51. Все материалы для СЕ были закуплены в Себии, Фульда, Германия.
2,8. Обработка результатов
Если и ВЭЖХ, и КЭ анализы крови ребенка указали на ВСС, с семьей связались и направили в наше отделение детской гематологии, где предполагаемый диагноз был подтвержден молекулярно-генетическим анализом образца свежей крови. Номера телефонов и адреса были извлечены из стандартной базы данных NBS. О государствах-перевозчиках не сообщалось, как того требует местный комитет по этике.
3. Результаты
Максимум четыре 96-луночных планшета измеряли в день, и 455 планшетов измеряли за 180 запусков.В течение всего исследования использовали шесть партий колонок. Всего с помощью ВЭЖХ было проанализировано 38 220 образцов, 34 084 из которых подлежали оценке. 4236 образцов пришлось исключить, поскольку соответствующие хроматограммы показали низкую общую AUC. Как и ожидалось, процент образцов с низкой AUC положительно коррелировал с возрастом образца (рис. 2). Более старые образцы показали большее разложение гемоглобина, что привело к большему фоновому шуму и меньшему количеству анализируемого материала. Более старые образцы также содержали больше ворса фильтровальной бумаги, что мешало анализу, вызывая технические проблемы, такие как повышение давления или ошибки детектора.В одном случае мы наблюдали сдвиг времени удерживания. С 74 нашими самыми старыми 84 образцами (88,1%) мы получили хроматограммы с AUC>
0
μ Vs, хотя они были взяты из карточек высушенных пятен крови 171 день назад. Таким образом, образцы соответствовали минимальным критериям тестирования, которые мы определили как «надлежащее качество». Тем не менее, доля непригодных для использования результатов значительно увеличилась, когда карты высушенной крови были старше трех месяцев (рис. 2).3.1. Новорожденные с положительным результатом скрининга
Из 34 084 включенных образцов 14 образцов показали картину ВЭЖХ, согласующуюся с диагнозом ВСС. 10 из которых были интерпретированы как FS; то есть предполагалось присутствие только гемоглобинов F и S. Паттерн FS указывает на гомозиготность по HbS, а также на гетерозиготность соединений по HbS и β -талассемию или δ β -талассемию или HPFH, соответственно. У четырех новорожденных мы обнаружили паттерн FSC; то есть у этих детей присутствовали только гемоглобины F, S и C.Это можно объяснить только гетерозиготностью соединений по HbS и HbC, клинически приводящей к SCD-S / C (рис. 3).
CE использовали для подтверждения результатов ВЭЖХ. Во всех 14 случаях картины КЭ соответствовали соответствующим результатам ВЭЖХ. Следовательно, эти новорожденные были сочтены «положительными по результатам скрининга» и помещены в нашу поликлинику детской гематологии для окончательного подтверждения диагноза (Таблица 1). Мы не наблюдали ложноположительных результатов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Новорожденные с отрицательным результатом скрининга
У остальных 34 070 новорожденных был обнаружен гемоглобин без каких-либо признаков фенотипа ВСС, и поэтому они были классифицированы как «отрицательные при скрининге». Среди них мы идентифицировали в общей сложности 236 новорожденных, которые были гетерозиготными по варианту гемоглобина. Это был HbS в 165 случаях, HbE в 27, HbC в 23 и HbD в 11. Еще в десяти случаях был вариант, отличный от HbS, E, C или D. В случаях, интерпретируемых как гетерозиготность по HbS, HbS: Соотношение HbA было <2.0.
До настоящего времени мы не обращали внимания на то, что ни у одного из этих детей с отрицательным результатом скрининга диагноз ВСС ставился впоследствии. Однако этим детям сейчас от 14 до 28 месяцев, и последующее наблюдение систематически не организовано. Таким образом, возможно, что скрининг ложноотрицательных субъектов, например, детей, страдающих более легкими подтипами ВСС, такими как SCD-S / β + талассемия, будет пропущен.
3.3. Точность ВЭЖХ
Маркеры времени удерживания (RTM) были предоставлены производителем.RTM представляют собой лиофилизированные контроли, содержащие гемоглобины F, A, E и S и гемоглобины F, A, D и C, соответственно, для контроля точного разделения вышеупомянутых гемоглобинов с помощью прибора ВЭЖХ [46]. RTM помогает обнаруживать нестабильности в давлении насоса или градиентном составе, что является обязательным требованием для правильной аналитической работы, потому что необработанные данные обрабатываются электронным способом, а правильная интерпретация и интеграция пиков, появляющихся в определенных временных окнах, требуют полной функциональности оборудования.
Если RTM указывал на функциональное нарушение аппарата ВЭЖХ, мы повторяли прогоны, которые, вероятно, были затронуты. В таблице 2 показаны наши результаты нескольких измерений () маркеров времени удерживания в сравнении со спецификациями производителя. Наши данные показывают высокую точность времени удерживания (CV ≤ 1,5%). Максимальное отклонение от среднего времени удерживания для HbS составило ± 0,042 мин.
| |||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
Поскольку многие факторы в течение всей аналитической процедуры могут повлиять на результаты теста, образцы высушенной крови пяти новорожденных, которые оказались гетерозиготными по HbS или HbC, соответственно, были установлены в качестве дополнительного контроля качества .Эти образцы были случайным образом интегрированы в несколько прогонов, включая все этапы от пре- до постаналитического анализа, чтобы включить все влияющие факторы. В таблице 4 показаны результаты повторных анализов этих образцов контроля качества, которые, как известно, являются гетерозиготными по HbS (A) или HbC (B), в разные рабочие дни.
| (a) | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| (б) | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Точность снижалась, если в порядке обнаружения присутствовали определенные фракции гемоглобина % от общей AUC. | |||||||||||||||||||||||||||||||||||||||||
3.4. Точность CE
В качестве контроля качества жидких контрольных образцов CE, содержащих гемоглобины F, A, S и C, использовали каждый цикл в разные рабочие дни (таблица 5).
| |||||||||||||||||||||||||||||||||||||||||||
