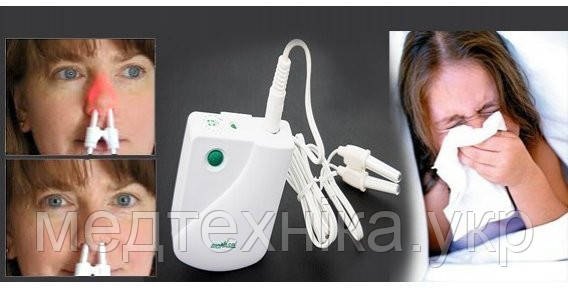
Электрофорез на нос: Эндоназальный электрофорез для носа: с хлористым кальцием, гидрокортизоном
Эндоназальный электрофорез для носа: с хлористым кальцием, гидрокортизоном
При заболеваниях у взрослых и детей иногда назначается такая физиотерапевтическая процедура, как электрофорез. Она подразумевает воздействие на организм электрическими импульсами, которые генерируются специальным прибором. Под воздействием постоянного тока достигается терапевтический эффект за счет одновременного введения лекарств через кожу или слизистую оболочку (в зависимости от места воздействия).
Суть процедуры
Физиологическая процедура выполняется с использованием аппарата. В нем имеется отверстие для электрода с маркировкой «+» и «-», кнопки, которыми регулируется сила подаваемого тока и время проведения процедуры.Это могут быть следующие приборы: Победа, Элфор, Элфор Проф. На более современных моделях имеется дисплей и цифровой индикатор. За счет физиопроцедуры на организм оказывается положительное воздействие:
- Снижается выраженность воспаления
- Устраняются отеки
- Уменьшается болевой синдром
- Стимулируется выработка веществ с биологической активностью
- Расслабляются мышцы, находящиеся в тонусе
- Успокаивается нервная система
- Улучшается кровообращение
- Ускоряется процесс регенерации тканей
- Активируются защитные силы
За счет электрического тока, излучаемого аппаратом, медикаменты превращаются в ионы, получающие заряд и проникающие в кожу. Так в организм доставляется основная часть лекарства. Оставшаяся доля попадает в лимфу и кровь. Положительно заряженные ионы снимают воспаление, обезболивают и успокаивают. Отрицательно заряженные – расслабляют мышечную ткань, улучшают обменные процессы, расширяют сосуды и оказывают секреторное действие.
Так в организм доставляется основная часть лекарства. Оставшаяся доля попадает в лимфу и кровь. Положительно заряженные ионы снимают воспаление, обезболивают и успокаивают. Отрицательно заряженные – расслабляют мышечную ткань, улучшают обменные процессы, расширяют сосуды и оказывают секреторное действие.
Эффективность проводимой процедуры зависит не только от используемого лекарства, но и от таких факторов, как:
- Возраст больного
- Сила тока
- Свойства препарата, в котором разводят медикаменты
- Дозировка лекарства и его концентрация
- Размер получаемого на выходе заряда
- Место установки электрода
- Продолжительность воздействия
- Индивидуальная восприимчивость в проводимой процедуре
Электрофорез проводится только медицинским работником, имеющим опыт установки и настройки оборудования. Есть аппараты, устроенные немного проще, и ими допускается пользоваться в домашних условиях. К ним прилагается инструкция, которую следует строго соблюдать при проведении процедуры.
Как проводится эндоназальный электрофорез в нос:
Методика проведения процедуры
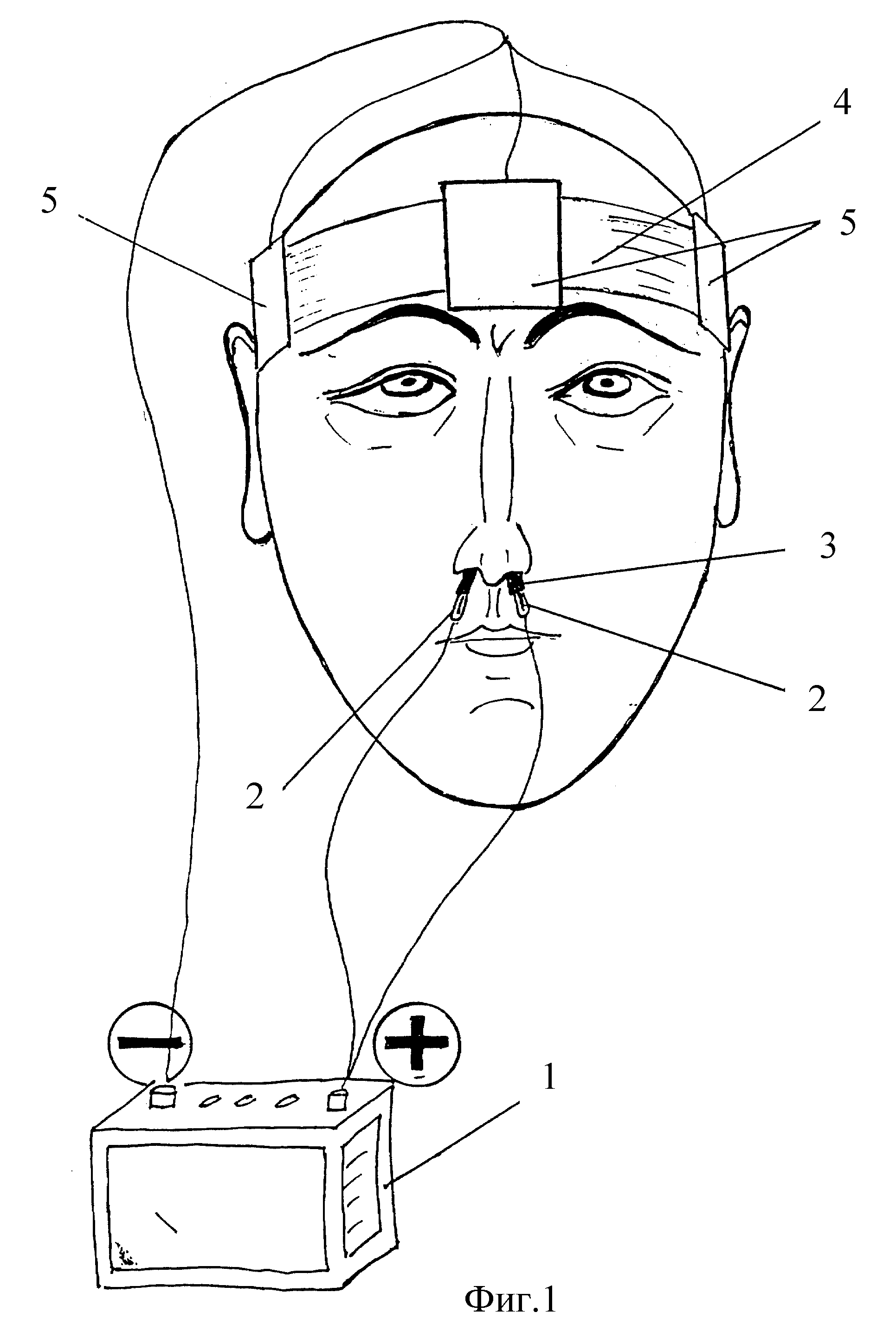
Классический способ проведения электрофореза – через кожу. Участки тела, на которые предполагается установка электродов, должны быть здоровыми, не иметь на поверхности родинки, повреждения или воспалительные очаги. На 2 стерильные марли наносят лекарства, одна из них подсоединяется к плюсу, другая – к минусу. Затем эти прокладки прикладываются к коже, фиксируются грузами или бинтами. К ткани крепятся электроды, после чего запускается аппарат.
Сила тока для каждого пациента настраивается индивидуально. На протяжении процедуры она понемногу регулируется в сторону увеличения. Больной при этом ощущает легкие покалывания в местах подключения. При возникновении зуда, боли или жжения процедуру следует прекратить.
Продолжительность воздействия электрофорезом составляет от 10 до 15 минут.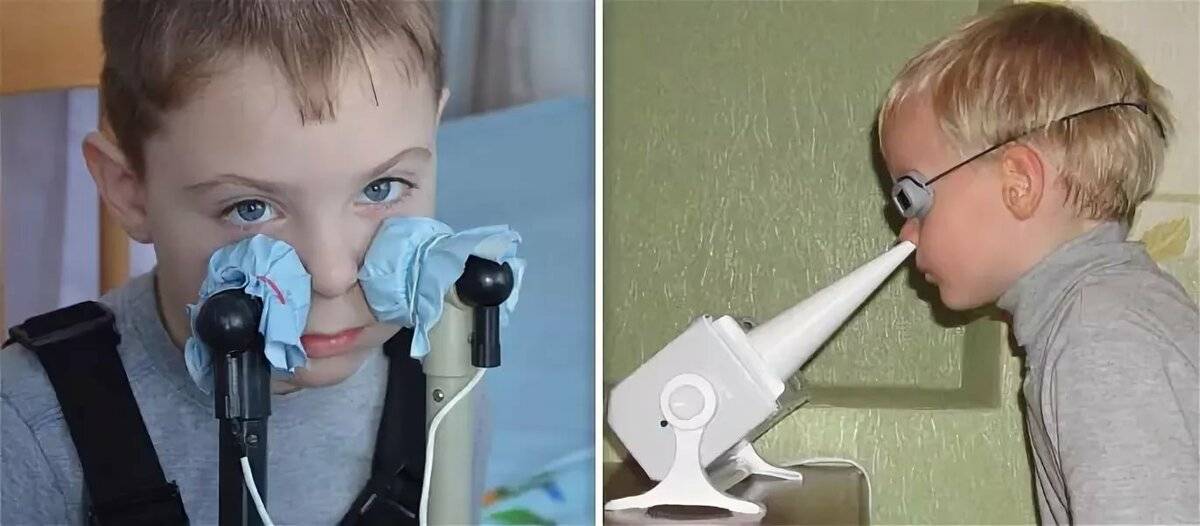 Для детей это время сокращается вдвое. Средний курс лечения физиопроцедурой занимает 2 недели ежедневных посещений или сеансов через день (в зависимости от врачебных назначений).
Для детей это время сокращается вдвое. Средний курс лечения физиопроцедурой занимает 2 недели ежедневных посещений или сеансов через день (в зависимости от врачебных назначений).
Показания к проведению электрофореза на нос
Временных ограничений по повторению курса электрофореза нет. Его назначают при следующих ЛОР-заболеваниях:Электрофорез могут назначить в период послеоперационный реабилитации. Эта процедура назначается также при лечении стоматологических, глазных, кожных, сердечно-сосудистых заболеваниях и при расстройствах опорно-двигательного аппарата.
Использование физиотерапии при лечении ЛОР-заболеваний:
Используемые лекарства
Для физиотерапевтической процедуры используются различные препараты. Каждый из них обладает своим терапевтическим действием на организм пациента. Это могут быть:
Это могут быть:
- Кальций Хлорид. Имеет противоаллергическое и противовоспалительное действие, восполняет недостаток кальция и оказывает кровеостанавливающий эффект.
- Димедрол. Оказывает обезболивающее седативное действие. Успокаивает и расслабляет гладкую мускулатуру. Используется при аллергическом рините.
- Лидаза. Расщепляет гиалуроновую кислоту, которая принимает участие в формировании рубца. Уменьшает отек.
- Гидрокортизон. Глюкокортикостероид – применяется при леении заболеваний аллергической природы.
- Новокаин. Оказывает обезболивающее местное действие.
- Ампициллин. Используется при отитах и синуситах. Оказывает бактерицидное воздействие на большое количество возбудителей инфекции.
- Никотиновая или аминокапроновая кислота. Обладает сосудорасширяющим действием улучшает процессы кровообращения.
- Стрептоцид. Назначается при инфекционных болезнях ЛОР-органов, способствует подавлению роста патогенной среды.
- Гумизоль.
 Имеет выраженный адаптогенный эффект. Снимает воспаление и обезболивает.
Имеет выраженный адаптогенный эффект. Снимает воспаление и обезболивает.
О том, какие препараты подключать к минусу, какие к плюсы знает работник клиники, которые отвечает за проведение процедуры. Некоторые лекарства можно подключать к любому из полюсов (Лидаза, Гумизоль). Назначение медикаментов производит врач с учетом клинической картины больного.
Преимущества проводимой физиопроцедуры
Введение лекарств таким способом сводит вероятность появления побочных реакций от них к нулю. Электрофорез – безболезненная процедура.Небольшого количества медикаментов, доставленных в организм таким способом, оказывает эффективное терапевтическое действие и значительно ускоряет процесс выздоровления.
Препарат доставляется непосредственно к очагу воспаления, что невозможно при медикаментозном методе лечения.
 Даже при аллергии на некоторые средства введение их таким способом снижает риск проявления ответной реакции.
Даже при аллергии на некоторые средства введение их таким способом снижает риск проявления ответной реакции.Рекомендации
При назначении процедуры оценивается физическое и психическое состояние больного. Не рекомендуется проводить ее при беременности, но если в этом есть острая необходимость и все риски оцениваются ниже достигаемого эффекта, то проводится назначение. Не рекомендуется проводить процедуру ребенку не достигшего 2-хлетнего возраста.
Не проводится назначение электрофореза пациентам, имеющим повышенную температуру тела. Если соблюдены все правила проведения процедуры, то никаких побочных реакций при отсутствии прямых противопоказаний не будет. Стоит быть готовым к тому, что в месте прилегания электродов остаются красные пятна (гиперемия), которые быстро проходят без постороннего вмешательства.
Противопоказания и ограничения
К проведению электрофореза есть относительные и абсолютные противопоказания.В первом случае врач оценивает лечебную ценность назначаемого лечения над общим состоянием больного.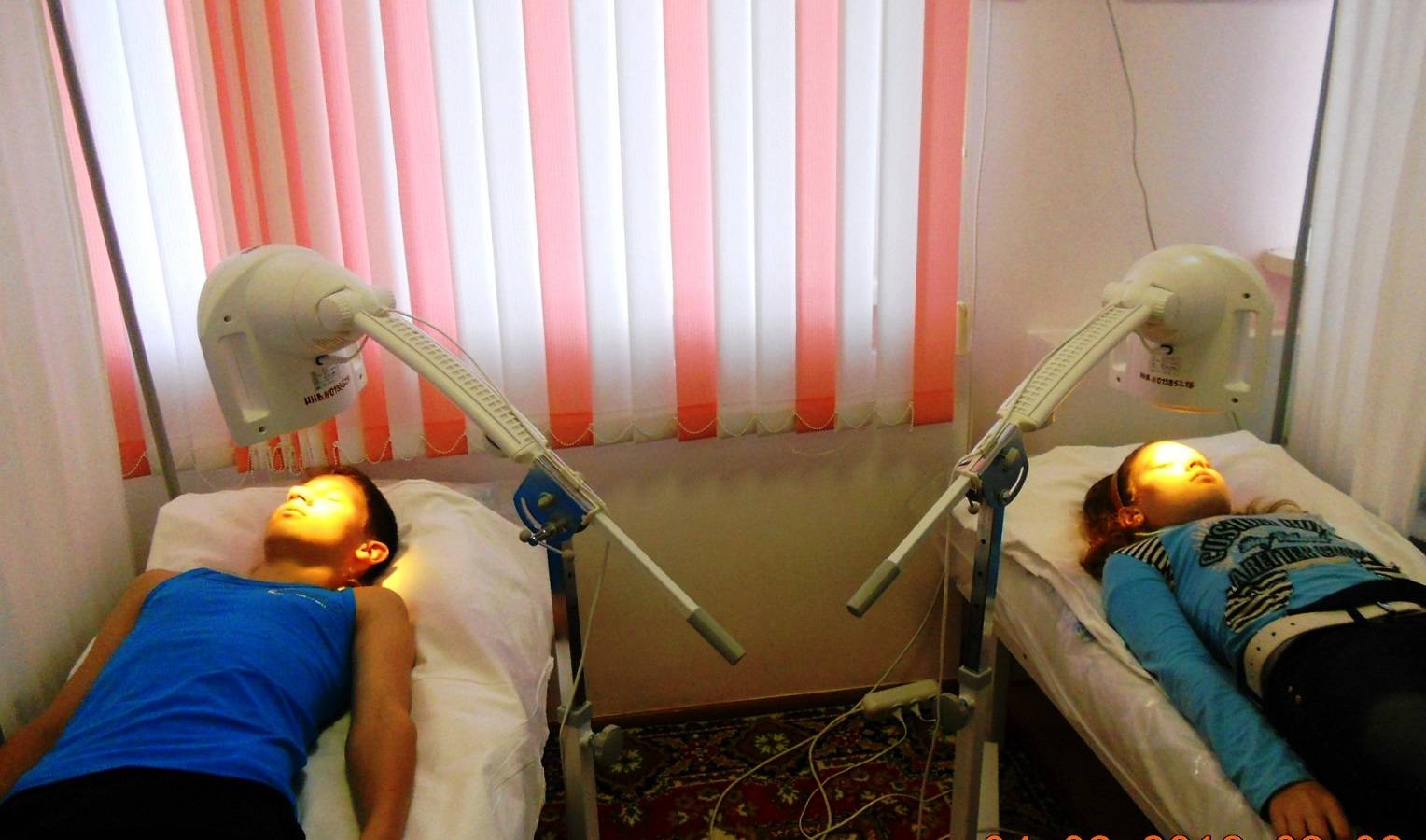
- Плохая свертываемость крови
- Температура выше 38 градусов
- Непереносимость электрического тока
- Активная форма туберкулеза
- Психические расстройства
- Печеночная и почечная недостаточность
- Встроенный кардиостимулятор
- Тяжелая степень сердечной недостаточности
- Онкология
Нельзя устанавливать электроды при нарушенной целостности кожных покровов. Женщинам, у которых критические дни, придется повременить с проведением процедуры до полного их окончания.
Электрофорез не назначается пациентам, которые переносят любое заболевание в острой форме, а также при обострении хронического течения болезни.
Не проводится процедура при частых носовых кровотечениях. При наличии противопоказаний любой группы врач взвешивает все «за» и «против» индивидуально для каждого пациента.
Ценность воздействия током
Ценность электрофореза заключается в том, что он позволяет значительно ускорить выздоровление. При этом больной получает максимум лечебного эффекта от лекарств при минимальном контакте с ним. Это один из наиболее безопасных методов транспортировки лекарственных средств непосредственно к очагу воспаления.
При этом больной получает максимум лечебного эффекта от лекарств при минимальном контакте с ним. Это один из наиболее безопасных методов транспортировки лекарственных средств непосредственно к очагу воспаления.
Отзывы о самостоятельном применении электрофореза:
Отоларинголог в Санкт-Петербурге. Запись на платный приём отоларинголога
В нашей клинике вы получите квалифицированную диагностику и лечение ЛОР — заболеваний у взрослых и детей.
Наши специалисты имеют большой опыт по эффективному и безболезненному решению ЛОР проблем: проводятся консультации, диагностика, лабораторные исследования, лечение заболеваний уха, горла, носа.
Из-за особенностей климата жители Санкт-Петербурга наиболее подвержены заболеваниям ЛОР органов, многим из них эта предрасположенность передалась по наследству.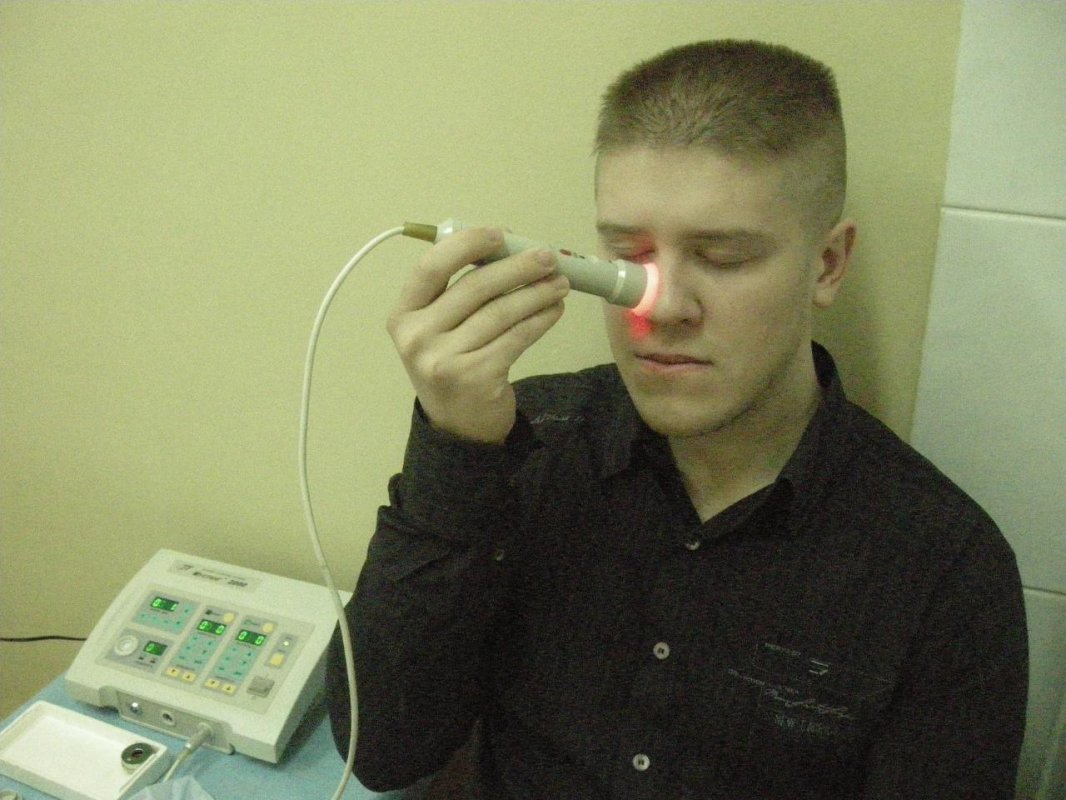 Поэтому им как никому другому необходимы экстренные и плановые консультации отоларинголога.
Поэтому им как никому другому необходимы экстренные и плановые консультации отоларинголога.
Срочная консультация отоларинголога необходима в следующих случаях:
- постоянная головная боль, «шум» в голове;
- «заложенность» носа, затруднение дыхания;
- отсутствие обоняния;
- повышенная температура;
- увеличение лимфатических узлов;
- отек век и щек;
- боль в гортани, осиплость голоса;
- носовые кровотечения;
- заложенность уха, снижение слуха, боли в ухе;
- случаи тугоухости у ближайших родственников;
- травмы уха, горла и носа;
- насморк и кашель, чихание.
- головокружения, нарушения в вестибулярном аппарате;
- состояние после операций ЛОР-органов.
На консультации врач – отоларинголог соберет информацию о жалобах и проведет осмотр полостей уха, горла и носа.
Если произошло снижение слуха, либо существуют проблемы с вестибулярным аппаратом, в ходе приема врач проведет проверку функции данных органов, обнаружит нарушение и найдет способ его устранения.
При необходимости врач — отоларинголог уже во время консультации произведет промывание миндалин, ушных проходов и полостей носа, сделает пункцию внутричелюстных пазух, проведет вскрытие абсцессов, сделает внутриносовые, ушные и фарингеальные блокады, продувание слуховых труб и другие манипуляции.
Почему мы?
Комплексный подход специалистов клиники ЕвроМедика экономит пациенту время, а также позволяет незамедлительно решить свою проблему за один прием врача. В ходе каждой консультации врач обязательно даст рекомендации по профилактике заболеваний.
Если обычного осмотра специалиста недостаточно, врач может назначить такие исследования как клинический и биохимический анализ крови, риноцитограмма, мазки (нос, зев, ухо) на микрофлору (бактерии, грибы, тип клеток) и другие лабораторные тесты, выдать направление на проведение рентгеновского обследования.
Лечение недугов уха, горла, носа как правило, заключается в назначении медикаментозного лечения и/или физиотерапии (электрофорез, фонофорез, магнит, озонотерапия, ультразвуковая терапия «Тонзиллор»)
Заболевания
Какие болезни лечит ЛОР:
- ринит (насморк) – воспаление слизистой оболочки носа
- гайморит — воспаление слизистой оболочки верхнечелюстной пазухи)
- острый тонзиллит – воспаление лимфоидных образований (небные миндалины)
- фарингит — воспаление слизистой оболочки лимфоидной ткани глотки
- отит – воспалительный процесс в ухе
- полипы полости носа — доброкачественные образования в носовой полости
- серные пробки – большое скопление серы в слуховом проходе.

Нужно помнить, что наличие хронического воспаления в ЛОР-органах может привести к осложнениям в области головного мозга, желудочно – кишечного тракта и сердца. Поэтому так важно вовремя проконсультироваться у врача – отоларинголога.
Электрофорез с кальцием хлоридом
Электрофорез, иначе ионофорез — физиотерапевтический метод лечения заболеваний различного происхождения и локализаций. Принцип процедуры заключается в местном, а также системном воздействии на организм человека электрического импульса. Рассмотрим особенности проведения электрофореза с кальцием.
Электрофорез с кальцием
Данная процедура универсальна и достаточно эффективна, применяется при многих заболеваниях в педиатрической практике, в частности, при лечении бронхитов, невритов, дисплазии и судорог в конечностях, при стоматологических заболеваниях.
Электрофорез проводится с помощью специальной аппаратуры, которая осуществляет введение лекарственных препаратов. Перечень используемых аппаратов достаточно объемный, новейшие из них оснащены дисплеем и цифровым индикатором.
Перечень используемых аппаратов достаточно объемный, новейшие из них оснащены дисплеем и цифровым индикатором.
Для лечения детей широко используется методика электрофореза при ЛОР-патологии, что обусловлено способностью данной процедуры:
- Снижать активность воспалительного процесса.
- Уменьшать отечность и болезненность в зоне поражения.
- Ускорять восстановительный процесс и активировать защитные механизмы.
Длительность процедуры электрофореза для детей до одного года не должна превышать 8 минут, старше года — 15 или 20 минут. Продолжительность курса в среднем составляет 10–20 процедур.
Принцип метода
Перед проведением процедуры необходимо подготовить лекарственный препарат. Раствор с кальция хлоридом должен быть без примесей, приготовлен он лишь на дистиллированной воде или очищенном спирте, но не на физиологическом растворе.
Самый распространенный вариант электрофореза хлоридом кальция — чрезкожный. Он заключается в наложении на здоровые участки тела марлевых прокладок, одна из которых пропитана лекарственным веществом. К ней присоединяют электрод со знаком «+», к другой прокладке — электрод со знаком «–». Перед запуском аппарата, при помощи груза необходимо зафиксировать прокладки.
К ней присоединяют электрод со знаком «+», к другой прокладке — электрод со знаком «–». Перед запуском аппарата, при помощи груза необходимо зафиксировать прокладки.
Силу тока следует увеличивать медленно, до появления легкого покалывания в месте наложения электродов. Проявление любых других ощущений служит сигналом к незамедлительному завершению процедуры.
Преимущества электрофореза
В сравнении со многими видами терапии, электрофоретическая методика лечения является предпочтительнее в силу основных своих достоинств:
- Минимальный риск развития нежелательных реакций.
- Высокая продолжительность терапевтического действия.
- Возможность одновременного введения нескольких препаратов. Примером может служить электрофорез с кальцием и фосфором, который часто назначают при патологии суставов.
- Свойственна длительная задержка препарата в организме.
- Воздействие тока повышает чувствительность тканей организма даже к малым дозам лекарственного средства.

- Основное действие электрофореза – местное, противовоспалительное. Препарат вводится непосредственно в воспалительный очаг.
Недостатком данного вида лечения служит лишь большой перечень ограничений к его применению как у взрослых, так и у детей.
Назначение
Показания для назначения ионофореза охватывают большое количество заболеваний различных органов и систем детского организма. Кальций для электрофореза наиболее часто применяется:
- Воспалительные процессы в полости носа и носовых пазухах (гаймориты, различные риниты).
- Заболевание ушей (отиты, болезнь Миньера).
- При нарушениях со стороны опорно-двигательного аппарата (дисплазии суставов, переломы костей, кривошея у ребенка).
- Стоматологические болезни (пульпит, кисты и гранулемы).
- Неврологической патологии (нарушения тонуса мускулатуры, невралгии, невриты и миозиты).

- При заболеваниях органов дыхания (бронхитах, пневмониях).
Важно перед назначением соблюдать индивидуальный подход к каждому ребенку и правильно оценить риск данного вида вмешательства.
Противопоказания для лечения электрофорезом
Выделяют относительные и абсолютные противопоказания к назначению электрофореза. К относительным у детей относят лишь возраст ребенка до 2 лет. Перечень абсолютных ограничений довольно обширный:
- Повышенная чувствительность к хлориду кальция.
- Непереносимость электротока.
- Поврежденные кожные покровы в месте наложения электрода.
- При гнойных и воспалительных очагах.
- Признаки интоксикации организма.
- Дерматит.
- Наличие злокачественных образований любой локализации.
- Наличие в анамнезе бронхиальной астмы.
- Повышенная кровоточивость.
- Тяжелые нарушения со стороны сердечно-сосудистой системы.
- Значительное снижение функции почек.

- Тяжелые нарушения со стороны психики.
Учитывая то, что возраст до 2 лет не является абсолютным противопоказанием, для грудничков часто применяется электрофорез при серьезных нарушениях со стороны нервной системы.
Эндоназальный электрофорез
Эндоназально электрофорез применяют с целью укрепить сосудистые стенки, уменьшить воспалительный процесс. Данный способ терапии назначается лечащим врачом при многих заболеваниях носа, наиболее часто при рините и гайморите. Для начала нужно промыть носовые ходы с помощью воды.
Электрофорез с хлористым кальцием получил название метод по Гращенкову-Кассилю. Во время процедуры, тампоны, пропитанные кальция хлоридом, вставляют в полость носа на глубину в один или два сантиметра. Один электрод, содержащий две пластинки, вставляют в оба носовых прохода, другой помещают в область расположения нижних шейных позвонков. Под действием тока препарат хорошо всасывается в слизистую оболочку носа, глубоко проникает в носовые пазухи.
Электрофорез эндоназально назначают только после достижения ребенком 3 лет.
Электрофорез при ЛОР-заболеваниях
Заболеваемость ЛОР-патологиями широко распространена среди всех слоев населения, в частности и среди детей. Большой процент среди всех видов заболеваний приходится на отиты. При этой болезни электрофорез назначается эндоназально, но есть и другие варианты.
Методика одного из них заключается в установке в ушной проход (со стороны поражения) эбонитовой воронки, в которую вливается раствор кальция хлорида, подогретый до 37 градусов. Затем один из электродов располагают в воронке, а другой – в области шеи со здоровой стороны. Подачу тока необходимо осуществлять медленно.
Исходя из всего вышеизложенного, применение электрофореза при ЛОР-заболеваниях — весьма эффективный метод терапии, который широко используется во врачебной практике. С помощью такого лечения можно добиться быстрого и продолжительного терапевтического эффекта.
Вконтакте
Google+
Вазомоторный ренит у детей
Если это не аллергия, то почему у ребенка постоянно заложен нос?
Если только мама ребенка сама не сталкивалась с гормональным ринитом во время беременности, для нее может стать сюрпризом, что насморк у ребенка может быть вызван ни аллергическими, ни инфекционными причинами. Вазомоторный ринит – самая частая разновидность неаллергического ринита, его также называют «идиопатическим» (невыясненной природы). Не до конца ясно, какой спектр причин вызывает это заболевание, но предположительно оно связано с нарушением работы нервов и сосудов слизистой носа.
Это не специфически детская болезнь. Намного чаще она поражает взрослых старше 30 лет (и женщин – чаще, чем мужчин). Однако существует мнение, что доля НАР (неаллергического ринита) среди детей выше, чем это фиксируется в медицинской статистике, то есть диагноз является недооцененным. Существует предположение, что классические «сопли на фоне прорезывания зубов» у младенца могут быть ранним проявлением вазомоторного ринита.
Заболевание носит хронический характер, то есть обычно длится более 10 дней и может рецидивировать.
Почему у ребенка возникает вазомоторный ринит?
Триггерами могут выступать самые разные факторы, от холодного воздуха до горячей или слишком острой еды. Существует и медикаментозно спровоцированный ринит, то самое «привыкание» к сосудосуживающим препаратам, закапываемым в нос.
Чаще идиопатический ринит встречается в крупных городах из-за большего количества провоцирующих факторов (выхлопов, резких запахов, пыли). Поэтому в среднем детский ЛОР-врач в Москве встречает такой насморк в клинической практике чаще, чем его коллега в сельской местности.
Как отличить вазомоторный ринит от инфекционного или аллергического?
Заложенность носа, зуд, чихание, отделяемое слизистой – это симптомы ринита любого происхождения, поэтому только по ним определить причину не удастся. Однако, когда насморк вызван вирусом или бактериальной инфекцией, он чаще всего сопровождается другими симптомами: острым фарингитом, назофарингитом, повышением температуры, головной болью, слабостью. Наличие инфекции подтверждается общим анализом крови.
Наличие инфекции подтверждается общим анализом крови.
Аллергический ринит чаще сопровождается слезотечением, зудом в глазах или в ушах. Важное значение имеет также изменение условий жизни ребенка – переезд, появление домашних животных, введение в рацион новых продуктов. Эта информация позволяет грамотному оториноларингологу определить, что наиболее вероятна именно аллергия, и направить маленького пациента на консультацию к специалисту – детскому аллергологу-иммунологу. Для подтверждения реакции на специфичные аллергены используют анализы крови.
Диагноз «вазомоторный ринит» может быть поставлен методом исключения, когда отметены все явные причины, которые могли бы вызвать проблему. Помимо анализов, обследование у детского ЛОРа может включать в себя переднюю риноскопию и эндоскопию.
Как лечат идиопатический ринит у детей?
Неаллергический неинфекционный ринит у детей может быть сопряжен с эозонофилией (повышенным числом эозонофилов в крови) или нет, и лечение в зависимости от этого будет разным. Вазомоторным ринитом в практике называют именно ту разновидность, которая не сопровождается эозонофильным синдромом.
Вазомоторным ринитом в практике называют именно ту разновидность, которая не сопровождается эозонофильным синдромом.
Важной ее особенностью является то, что таким пациентом редко помогают антигистаминные препараты (зодак, зиртек, супрастин и т. п.). Более эффективно себя показывают местные глюкокортикостероиды, которые закапывают в нос. Обычно это флутиказон и беклометазон, но надо учитывать, что оба этих препарата не предназначены для детей младше 4 лет. Для более младших пациентов это, как правило, Пульмикорт (будесонид). Однако точные назначения зависят от клинической картины и тяжести протекания заболевания и могут делаться только квалифицированным врачом. При необходимости детский ЛОР может дать ребенку направление на физиотерапию – хорошие результаты показывают электрофорез и фонофорез.
Чем помочь ребенку?
При любом виде насморка, что бы его ни вызывало, хорошую помощь окажет промывание носа изотоническим солевым раствором или морской водой. Вторая важная вещь, которую могут сделать родители, — попробовать выявить провоцирующий фактор и исключить его. Иногда одного этого бывает достаточно, чтобы существенно облегчить состояние ребенка и быстрее избавиться от такой неприятности, как насморк.
Иногда одного этого бывает достаточно, чтобы существенно облегчить состояние ребенка и быстрее избавиться от такой неприятности, как насморк.
Псориазин, один из нескольких новых белков, идентифицированных в жидкости для промывания носа у лиц, страдающих аллергией и не страдающих аллергией, с помощью 2-мерного гель-электрофореза и масс-спектрометрии | Респираторные исследования
Кожный укол-тест
Кожный укол-тест (SPT) проводился со стандартной панелью из 10 распространенных переносимых по воздуху аллергенов (ALK, Копенгаген, Дания), включая пыльцу (березы, тимофеевки и полыни), клещей домашней пыли ( D. Pteronyssimus и D. Farinae ), плесени ( Cladosporium и Alternaria ) и аллергены животных (кошки, собаки и лошади).SPT выполняли на ладонной стороне предплечья с физиологическим буфером в качестве отрицательного и хлорид гистамина (10 мг / мл) в качестве положительного контроля. Диаметр волдырей измеряли через 20 минут с помощью линейки.
Субъекты
В исследование были включены 11 пациентов (6 женщин) с симптомами перемежающегося аллергического ринита, вызванного пыльцой березы и / или трав, и 11 здоровых добровольцев (7 женщин), которые служили контролем. Средний возраст пациентов и контрольной группы составил 43 (26–55) и 41 (24–55) год соответственно.Диагноз аллергического ринита, вызванного пыльцой березы и / или травы, был основан на положительном анамнезе перемежающегося аллергического ринита в течение не менее 2 лет и положительном SPT на березу и / или траву. Все пациенты были классифицированы как имеющие тяжелые симптомы (зуд в носу и глазах, чихание, выделения из носа и заложенность носа) во время сезона пыльцы, и все они получали антигистаминные препараты и назальные стероиды во время сезонов пыльцы в предыдущие годы. У пациентов не было постоянных симптомов астмы, и они не принимали никаких лекарств от астмы.У всех пациентов наблюдалась реакция волдыря на березу или тимофеевку диаметром> 3 мм при SPT (примерно соответствует реакции 3+ или 4+ по сравнению с гистамином [7])..jpg) Критерии исключения включали наличие в анамнезе хронических симптомов, инфекцию верхних дыхательных путей за последние 2 недели до посещения и лечение местными или системными кортикостероидами в течение последних 2 месяцев. Все контрольные группы не имели симптомов, не имели в анамнезе аллергического ринита и имели отрицательный SPT к стандартной панели аллергенов, как описано выше.У них не было в анамнезе инфекции верхних дыхательных путей в течение 2 недель до посещения, и все они не принимали лекарства. Исследование было одобрено этическим комитетом медицинского факультета Лундского университета.
Критерии исключения включали наличие в анамнезе хронических симптомов, инфекцию верхних дыхательных путей за последние 2 недели до посещения и лечение местными или системными кортикостероидами в течение последних 2 месяцев. Все контрольные группы не имели симптомов, не имели в анамнезе аллергического ринита и имели отрицательный SPT к стандартной панели аллергенов, как описано выше.У них не было в анамнезе инфекции верхних дыхательных путей в течение 2 недель до посещения, и все они не принимали лекарства. Исследование было одобрено этическим комитетом медицинского факультета Лундского университета.
Сбор и подготовка проб
Жидкость для промывания носа была собрана во время сезона пыльцы березы (9 пациентов) или травы (2 пациента). Пациенты включались в исследование, когда у них наблюдались существенные симптомы риноконъюнктивита (зуд в носу и глазах, чихание, выделения из носа и заложенность носа) в течение как минимум 3 дней подряд.Большинство пациентов были осмотрены в течение 5–10 дней после появления первых симптомов и локального подсчета пыльцы.
Жидкость для промывания носа была собрана по ранее описанной методике [8]. После очистки носа от избыточной слизи в обе ноздри распыляли стерильный физиологический раствор комнатной температуры. Жидкости позволяли пассивно возвращаться и собирали в калиброванную пробирку до тех пор, пока не было извлечено 7 мл. NLF центрифугировали при 1750 об / мин при 4 ° C в течение 10 минут для удаления содержимого клеток, а супернатанты хранили при -70 ° C до приготовления образца.
Перед концентрированием образцов NLF оттаивали и центрифугировали при 12300 об / мин при 4 ° C в течение 20 минут для удаления мусора. С помощью концентраторов Vivaspin 6 и Vivaspin 500 (Vivascience, Ганновер, Германия) супернатанты концентрировали и обессоливали. Концентрацию белка определяли с помощью набора для анализа белков BCA (Pierce Biotechnology, Рокфорд, США), и в результате была получена концентрация белка 1572–5625 мкг / мл для здоровых людей и 1833–7867 мкг / мл для аллергиков. NLF хранили при -70 ° C до анализа.
2-DE анализ
Образцы смешивали с раствором для регидратации, содержащим 8 M мочевину, 2% CHAPS, 2,8 мг / мл DTT (Sigma-Aldrich, Steinheim, Германия), 0,5% буфер IPG (pH 3–10) (Amersham Biosciences, Uppsala Sweden) и небольшое количество бромфенолового синего. Для аналитических гелей добавляли 150 мкг белка до конечного объема 450 мкл для каждого образца. Для препаративных гелей, один для здоровых и один для аллергических образцов, использовали 600 мкг из пула образцов. Чтобы иметь возможность загрузить до 600 мкг на препаративные гели, объединенные образцы дополнительно концентрировали с использованием Microcon YM-3 (Millipore, Billerica, USA) перед добавлением в раствор для регидратации.Образцы инкубировали в течение приблизительно 15 минут при комнатной температуре, чтобы полностью растворить и денатурировать белки. Образцы центрифугировали при 13000 об / мин в течение 10 мин, а затем загружали на 24 см 3–10 нелинейные полоски IPG (Amersham Biosciences, Упсала, Швеция). Регидратация в геле и изоэлектрическое фокусирование (IEF) выполняли в течение ночи (~ 60000 Vh) с использованием системы изоэлектрической фокусировки Ettan IPGphor (Amersham Biosciences, Уппсала, Швеция). После того, как полоски IEF хранились при -70 ° C до анализа.Полоски IPG уравновешивали в буфере для уравновешивания SDS (75 мМ Трис, 6 М мочевина, 30% глицерина, 2% SDS и 0,002% бромфенолового синего (Sigma-Aldrich, Steinheim, Германия)) в течение 2 × 15 мин. ДТТ (10 мг / мл) (Sigma-Aldrich, Steinheim, Германия) добавляли к первому, а йодацетамид (25 мг / мл) (Sigma-Aldrich, Steinheim, Germany) — ко второму этапу уравновешивания. После уравновешивания полоски загружали в изготовленные в лаборатории гели второго размера с 12,5% акриламида. SDS-PAGE выполняли при постоянном воздействии (10 Вт / гель) в течение примерно 4 часов и 30 минут с использованием системы Ettan DALT II (Amersham Biosciences).
Регидратация в геле и изоэлектрическое фокусирование (IEF) выполняли в течение ночи (~ 60000 Vh) с использованием системы изоэлектрической фокусировки Ettan IPGphor (Amersham Biosciences, Уппсала, Швеция). После того, как полоски IEF хранились при -70 ° C до анализа.Полоски IPG уравновешивали в буфере для уравновешивания SDS (75 мМ Трис, 6 М мочевина, 30% глицерина, 2% SDS и 0,002% бромфенолового синего (Sigma-Aldrich, Steinheim, Германия)) в течение 2 × 15 мин. ДТТ (10 мг / мл) (Sigma-Aldrich, Steinheim, Германия) добавляли к первому, а йодацетамид (25 мг / мл) (Sigma-Aldrich, Steinheim, Germany) — ко второму этапу уравновешивания. После уравновешивания полоски загружали в изготовленные в лаборатории гели второго размера с 12,5% акриламида. SDS-PAGE выполняли при постоянном воздействии (10 Вт / гель) в течение примерно 4 часов и 30 минут с использованием системы Ettan DALT II (Amersham Biosciences).
Окрашивание гелей и анализ изображения гелей
Гели второго измерения фиксировали 30% этанолом и 10% уксусной кислотой в течение ночи, промывали 4 раза по 30 мин в 20% этаноле и окрашивали флуоресцентным красителем трис-батофенантролин дисульфонатом рутения II ( 1 мкМ) примерно на 6 часов. После этого гели обесцвечивали в 40% этаноле и 10% уксусной кислоте в течение ночи и промывали бидистиллированной водой в течение примерно 4 × 30–60 мин [9]. Все этапы инкубации и промывки выполнялись при осторожном перемешивании.Гели хранили в темноте в бидистиллированной воде при 4 ° C до сканирования. Гели автоматически сканировали с помощью роботизированной системы вместе со сканером 9410 Typhoon (488 нм лазер) от Amersham Biosciences [10], а изображения гелей анализировали с помощью компьютерного программного обеспечения Image master 2D Platinum (Amersham Biosciences) и Ludesi 2D Interpreter (Ludesi AB, Лунд, Швеция). Объем в каждом пятне рассчитывали как интегральную оптическую плотность по площади пятна. Количество белка в каждом пятне выражалось в% VOL (ppm), то есть объем пятна, деленный на общий объем всех пятен в геле.
После этого гели обесцвечивали в 40% этаноле и 10% уксусной кислоте в течение ночи и промывали бидистиллированной водой в течение примерно 4 × 30–60 мин [9]. Все этапы инкубации и промывки выполнялись при осторожном перемешивании.Гели хранили в темноте в бидистиллированной воде при 4 ° C до сканирования. Гели автоматически сканировали с помощью роботизированной системы вместе со сканером 9410 Typhoon (488 нм лазер) от Amersham Biosciences [10], а изображения гелей анализировали с помощью компьютерного программного обеспечения Image master 2D Platinum (Amersham Biosciences) и Ludesi 2D Interpreter (Ludesi AB, Лунд, Швеция). Объем в каждом пятне рассчитывали как интегральную оптическую плотность по площади пятна. Количество белка в каждом пятне выражалось в% VOL (ppm), то есть объем пятна, деленный на общий объем всех пятен в геле.
Сбор пятен, расщепление белков и анализ MALDI-TOF (матричная лазерная десорбционная ионизация — время полета)
Используя рабочую станцию для обработки пятен Ettan (Amersham Biosciences), выбранные пятна были автоматически вырезаны из препаративных гелей, обесцвечены и ферментативно расщеплены с помощью трипсин (трипсин, модифицированный для секвенирования свиней, Promega, Мэдисон, США). Затем триптические пептиды наносили на планшет-мишень MALDI [11]. Планшеты-мишени MALDI загружали в масс-спектрометр Micromass MALDI-TOF (Waters, Milford, USA) для анализа пептидных масс.
Затем триптические пептиды наносили на планшет-мишень MALDI [11]. Планшеты-мишени MALDI загружали в масс-спектрометр Micromass MALDI-TOF (Waters, Milford, USA) для анализа пептидных масс.
Поиск в базе данных
Пептидные массы, полученные из спектров анализа MALDI-TOF, были отправлены в базу данных (IPI human 1.38) [12] с помощью поисковой машины PIUMS [13]. Были использованы следующие параметры сопоставления: постоянная модификация цистеина карбамидометилированием, переменная модификация метионина путем окисления и максимум 1 пропущенное расщепление для трипсина. Попадание белка считалось значимым, если показатель качества PIUMS составлял ≥ 4,7, что соответствует значению ожидания 0.01. Поиск в IPI human 1.38 также был выполнен с использованием поисковой системы Mascot, и результаты этого поиска сравнивались с результатами PIUMS.
Вестерн-блот
NLF смешивали с буфером для образцов SDS, нагревали при 95–100 ° C в течение 5 минут и центрифугировали при 10 000 об / мин в течение 10 минут.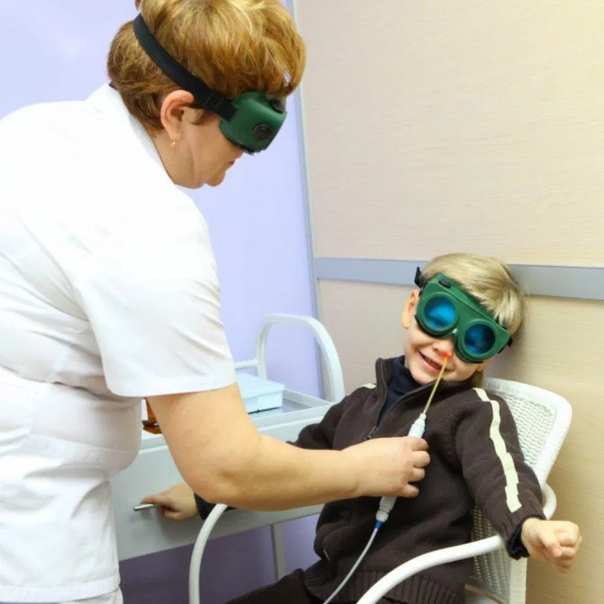 Равные количества образцов наносили на 4–12% гель NuPAGE Bis-Tris (Invitrogen, Carlsbad, USA), разделяли электрофорезом (Mini vertical gel system, Thermo EC, Waltham, USA) и наносили на мембраны Immobilon-P PVDF. (Миллипор, Биллерика, США).Мембраны блокировали в буфере 1 (трис-HCl 10 мМ, pH 7,4, NaCl 0,9% и сухое молоко 5%), а затем инкубировали в течение ночи с первичным антителом (1 мкг / мл) против псориазина, галектина-3 (Abcam, Кембридж, Великобритания). , Wnt-2B (Zymed, Южный Сан-Франциско, США) и альфа-энолаза (Санта-Крус, Санта-Крус, США) соответственно. Мембраны промывали 2 раза буфером 1 с последующей инкубацией в течение приблизительно 2 ч с вторичным антителом, конъюгированным с HRP (50 нг / мл). После 2 промывок буфером 2 (10 мМ трис-HCl, pH 7,4, NaCl 0.9% и Tween 20 0,05%) инкубировали в течение 5 мин в растворе SuperSignal West Pico (Pierce Biotechnology, Rockford, США). Хемилюминесценцию регистрировали с помощью рентгеновской системы MAN-X (Fujifilm Science Imaging systems, США).
Равные количества образцов наносили на 4–12% гель NuPAGE Bis-Tris (Invitrogen, Carlsbad, USA), разделяли электрофорезом (Mini vertical gel system, Thermo EC, Waltham, USA) и наносили на мембраны Immobilon-P PVDF. (Миллипор, Биллерика, США).Мембраны блокировали в буфере 1 (трис-HCl 10 мМ, pH 7,4, NaCl 0,9% и сухое молоко 5%), а затем инкубировали в течение ночи с первичным антителом (1 мкг / мл) против псориазина, галектина-3 (Abcam, Кембридж, Великобритания). , Wnt-2B (Zymed, Южный Сан-Франциско, США) и альфа-энолаза (Санта-Крус, Санта-Крус, США) соответственно. Мембраны промывали 2 раза буфером 1 с последующей инкубацией в течение приблизительно 2 ч с вторичным антителом, конъюгированным с HRP (50 нг / мл). После 2 промывок буфером 2 (10 мМ трис-HCl, pH 7,4, NaCl 0.9% и Tween 20 0,05%) инкубировали в течение 5 мин в растворе SuperSignal West Pico (Pierce Biotechnology, Rockford, США). Хемилюминесценцию регистрировали с помощью рентгеновской системы MAN-X (Fujifilm Science Imaging systems, США). Проявленные пленки для количественного анализа сканировали и анализировали в программе ImageQuant (Molecular Dynamics, Саннивейл, США). Не было доступных антител против гипотетического белка MGC33648 и соответствующего фрагмента интерсектина-2. Следовательно, эти белки нельзя было оценить с помощью вестерн-блоттинга.
Проявленные пленки для количественного анализа сканировали и анализировали в программе ImageQuant (Molecular Dynamics, Саннивейл, США). Не было доступных антител против гипотетического белка MGC33648 и соответствующего фрагмента интерсектина-2. Следовательно, эти белки нельзя было оценить с помощью вестерн-блоттинга.
Статистический анализ
Все значения выражены как средние значения ± SEM. Статистический анализ экспрессии белка проводили в интерпретаторе Ludesi 2D (Ludesi AB) с использованием однофакторного дисперсионного анализа.
Электрофоретические частицы значительно улучшают доставку обонятельных лекарств: технико-экономическое обоснование
Абстрактные
Фон
Интраназальная обонятельная доставка лекарств представляет собой неинвазивный метод, который обходит гематоэнцефалический барьер и доставляет лекарство напрямую в головной и спинной мозг.Однако устройства, разработанного специально для обонятельной доставки, до сих пор не найдено.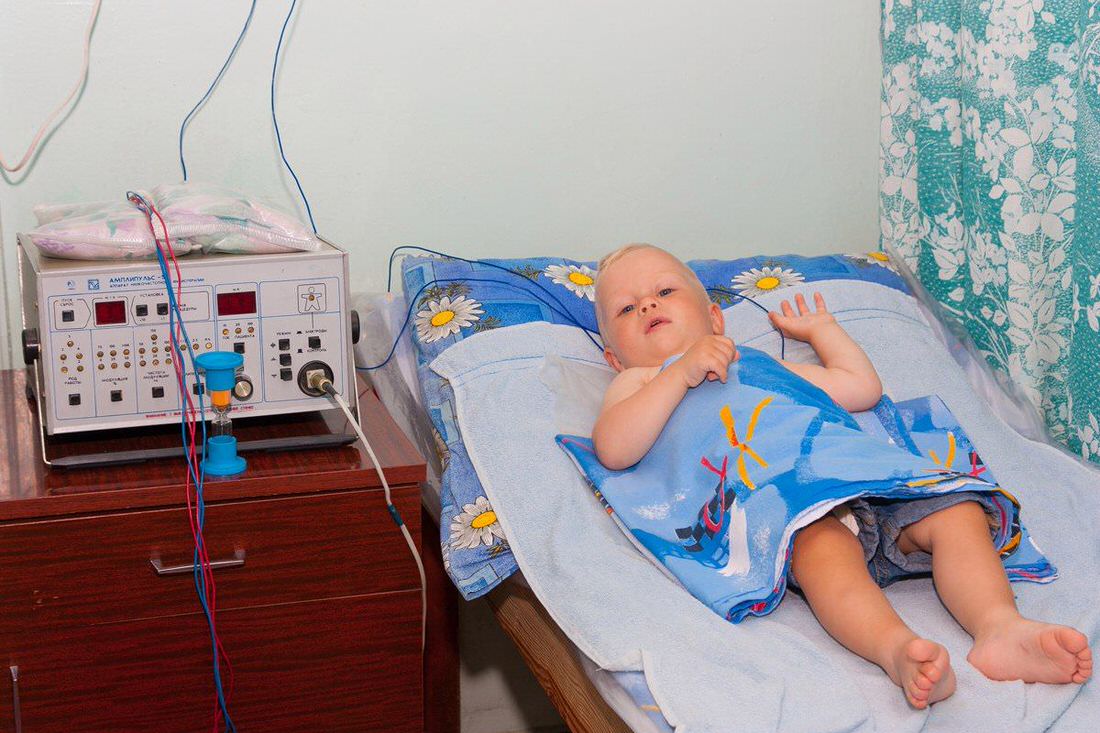
Методы
В этом исследовании был предложен новый метод доставки, в котором используются электрофоретические силы для направления частиц лекарства в обонятельную область. Возможность использования этого метода была численно оценена как на идеализированных 2-D, так и на анатомически точных 3-D моделях носа. Также изучали влияние носового воздушного потока, силы электродов и положения высвобождения лекарственного средства на эффективность обонятельной доставки.
Выводы
Результаты показали, что за счет применения электрофоретических сил дозировка в обонятельной области была значительно увеличена. Как в 2-мерном, так и в 3-мерном случаях доставка под контролем электрофоретики обеспечивала обонятельные дозировки почти на два порядка выше, чем без электрофоретических сил. Кроме того, высвобождение лекарств в верхнюю половину ноздри (т.е. частичное высвобождение) привело к обонятельным дозам в два раза выше, чем высвобождение лекарств по всей области ноздри.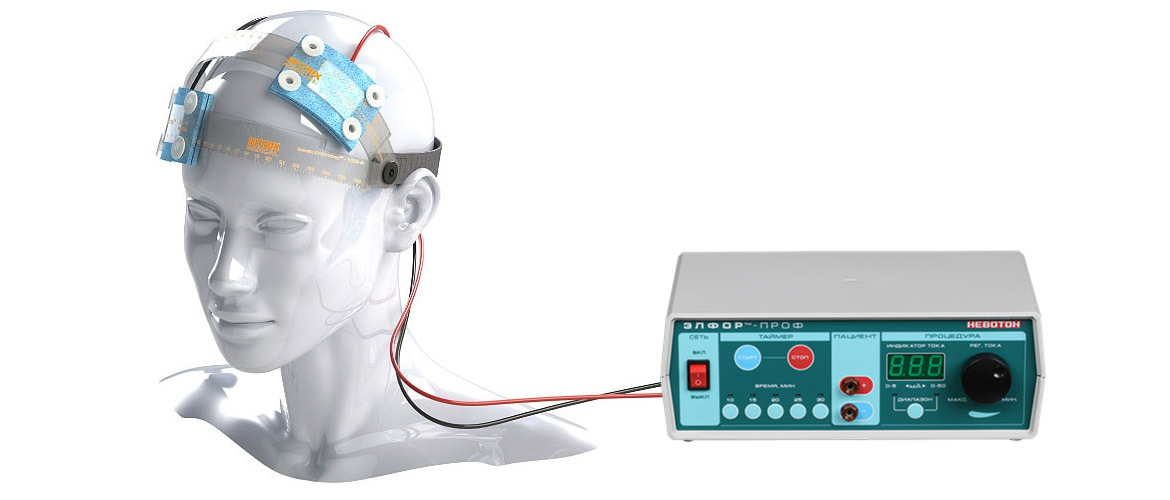 Благодаря сочетанию преимуществ точного высвобождения лекарственного средства и соответствующего электрофоретического контроля наблюдались обонятельные дозы более 90% по сравнению с чрезвычайно низкой обонятельной дозировкой (<1%) при использовании обычных ингаляторов.
Благодаря сочетанию преимуществ точного высвобождения лекарственного средства и соответствующего электрофоретического контроля наблюдались обонятельные дозы более 90% по сравнению с чрезвычайно низкой обонятельной дозировкой (<1%) при использовании обычных ингаляторов.
Заключение
Результаты этого исследования имеют важное значение для разработки протоколов персонализированной обонятельной доставки для лечения неврологических расстройств. Более того, наблюдалась высокая чувствительность обонятельной дозировки по отношению к различным точкам высвобождения, что указывает на важность точного управления частицами для эффективной обонятельной доставки.
Образец цитирования: Xi J, Si XA, Gaide R (2014) Рекомендации по электрофоретическим частицам значительно улучшают доставку обонятельных лекарств: технико-экономическое обоснование. PLoS ONE 9 (1): e86593. https://doi.org/10.1371/journal.pone.0086593
Редактор: Надин Равель, Лионский университет, Франция
Поступила: 10 сентября 2013 г . ; Принята к печати: 17 декабря 2013 г .; Опубликован: 31 января 2014 г.
; Принята к печати: 17 декабря 2013 г .; Опубликован: 31 января 2014 г.
Авторские права: © 2014 Xi et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа финансировалась грантом Центрального Мичиганского университета на инновационные исследования P421071 и грантом Центрального Мичиганского университета на начало карьеры P622911. RG была поддержана Calvin Summer Research Grant. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Гематоэнцефалический барьер (BBB) предотвратил использование многих новых генно-инженерных препаратов для лечения заболеваний центральной нервной системы (ЦНС), таких как болезнь Альцгеймера [1], параплегия [2] и мигренозная головная боль [3] ]. Необходимость в разработке простого, безопасного и эффективного способа доставки лекарств для лечения расстройств ЦНС является насущной.Обонятельная область — единственное место в организме человека, где ЦНС находится в прямом контакте с внешней средой. Если бы лекарства можно было направлять непосредственно в эту область через нос, они могли бы диффундировать через обонятельную слизистую оболочку и достигать ЦНС через внеклеточный эпителиальный путь [4]. Прямая доставка лекарств из носа в мозг позволяет обойти ГЭБ и имеет множество преимуществ по сравнению с традиционными методами внутривенной доставки. Эти преимущества включают простоту введения, быстрое начало действия и предотвращение метаболизма первого прохождения [5], [6].Однако демонстрация его клинической осуществимости все еще находится в подростковом возрасте из-за отсутствия устройств, которые эффективно доставляют лекарство в обонятельную область. Хотя на рынке доступно множество устройств для назальной доставки, таких как небулайзер, порошковый ингалятор или дозирующий ингалятор под давлением (pMDI), устройства, предназначенные для обонятельного осаждения, еще не найдены [7].
Необходимость в разработке простого, безопасного и эффективного способа доставки лекарств для лечения расстройств ЦНС является насущной.Обонятельная область — единственное место в организме человека, где ЦНС находится в прямом контакте с внешней средой. Если бы лекарства можно было направлять непосредственно в эту область через нос, они могли бы диффундировать через обонятельную слизистую оболочку и достигать ЦНС через внеклеточный эпителиальный путь [4]. Прямая доставка лекарств из носа в мозг позволяет обойти ГЭБ и имеет множество преимуществ по сравнению с традиционными методами внутривенной доставки. Эти преимущества включают простоту введения, быстрое начало действия и предотвращение метаболизма первого прохождения [5], [6].Однако демонстрация его клинической осуществимости все еще находится в подростковом возрасте из-за отсутствия устройств, которые эффективно доставляют лекарство в обонятельную область. Хотя на рынке доступно множество устройств для назальной доставки, таких как небулайзер, порошковый ингалятор или дозирующий ингалятор под давлением (pMDI), устройства, предназначенные для обонятельного осаждения, еще не найдены [7]. Ограничения обычных носовых устройств очевидны; только очень небольшая часть терапевтических агентов откладывается в обонятельной области и попадает в мозг.Предыдущие исследования [8], [9] показали, что менее 1% частиц, вдыхаемых через нос, может достигать обонятельных нервов, которые находятся в самой верхней части носовой полости (рис. 1а). Поэтому очень важно искать более эффективные методы доставки лекарств в обонятельную область.
Ограничения обычных носовых устройств очевидны; только очень небольшая часть терапевтических агентов откладывается в обонятельной области и попадает в мозг.Предыдущие исследования [8], [9] показали, что менее 1% частиц, вдыхаемых через нос, может достигать обонятельных нервов, которые находятся в самой верхней части носовой полости (рис. 1а). Поэтому очень важно искать более эффективные методы доставки лекарств в обонятельную область.
Рисунок 1. Анатомия носовых дыхательных путей с обонятельной областью (OR).
Геометрическая сложность и узость носовых дыхательных путей препятствуют эффективной интраназальной доставке лекарств. Чтобы избежать потери контакта со стенкой, частицы должны точно следовать за средней плоскостью (а) носового прохода, которая имеет трехмерные пространственные особенности.На рисунке (b) показана простая система доставки, которая состоит из компонентов со следующими четырьмя функциями: (1) генерация аэрозоля (ингалятор), (2) зарядка частиц, (3) фокусировка частиц и (4) управление перемещением частиц. Более сложная система может иметь опоры для стабилизации устройства относительно головы человека.
Более сложная система может иметь опоры для стабилизации устройства относительно головы человека.
https://doi.org/10.1371/journal.pone.0086593.g001
Низкая эффективность обонятельной доставки в основном объясняется уникальной структурой носовой полости человека, которая состоит из двух относительно симметричных носовых ходов, разделенных носовой перегородкой. .Каждый носовой ход имеет три изогнутых плавниковых выступа дыхательных путей, известных как верхний, средний и нижний проходы. Костные ткани над каждым проходом называются верхними, средними и нижними носовыми раковинами соответственно и образуют боковую стенку основного прохода. Обонятельный эпителий, или обонятельная слизистая оболочка, расположен в самом верху носовой полости между верхней носовой раковиной и решетчатой пластинкой решетчатой кости (рис. 1а) и покрывает 10 ~ 12 см 2 , или приблизительно 8% площади. общая площадь носовой поверхности [10].Если лекарства могут быть доставлены глубоко и достаточно высоко в полость носа, они достигнут обонятельной слизистой оболочки и попадут в мозг. Однако сложная форма носа препятствует эффективной интраназальной доставке лекарств. Движения частиц очень сложны и далеки от плоских, как показано на рис. 1а. Большинство вдыхаемых частиц попадают на стенки носа и отфильтровываются. Обычные ингаляционные устройства для доставки лекарств зависят исключительно от аэродинамики ингаляции для направления частиц лекарства к месту назначения [11].На эти частицы действуют три основные силы: инерция, сила сопротивления и гравитация. Дальнейшего контроля за траекториями этих частиц после того, как они были выпущены из ингаляционного устройства, нет. Соответственно, то, как далеко перемещается частица или где она оседает, в первую очередь зависит от ее начальной скорости, а также от структуры носовых дыхательных путей. Из-за этого отсутствия контроля значительное количество лекарства расходуется в верхних дыхательных путях и не может достичь целевого обонятельного рецептора.
Однако сложная форма носа препятствует эффективной интраназальной доставке лекарств. Движения частиц очень сложны и далеки от плоских, как показано на рис. 1а. Большинство вдыхаемых частиц попадают на стенки носа и отфильтровываются. Обычные ингаляционные устройства для доставки лекарств зависят исключительно от аэродинамики ингаляции для направления частиц лекарства к месту назначения [11].На эти частицы действуют три основные силы: инерция, сила сопротивления и гравитация. Дальнейшего контроля за траекториями этих частиц после того, как они были выпущены из ингаляционного устройства, нет. Соответственно, то, как далеко перемещается частица или где она оседает, в первую очередь зависит от ее начальной скорости, а также от структуры носовых дыхательных путей. Из-за этого отсутствия контроля значительное количество лекарства расходуется в верхних дыхательных путях и не может достичь целевого обонятельного рецептора.
Обоснование электрофоретической доставки лекарств можно сравнить с основанием для управляемых баллистических ракет. Ракеты могут точно поражать свои цели, поскольку они находятся под постоянным контролем по заданным траекториям. Точно так же было бы очень желательно, если бы мы могли контролировать фармацевтические частицы, чтобы они вели себя так же, как управляемые ракеты. Это кажется сложной задачей, учитывая крошечный размер этих аэрозолей (0,2–5 микрон) и сложную структуру носа, которая требует предельной точности для перемещения частиц через извитые раковины и к скрытой обонятельной области. Интересно, что решение этой проблемы заключается в самой проблеме или в крошечном размере частиц.Электрофоретическая сила на наночастицах может быть доминирующей, что позволяет дистанционно контролировать вдыхаемые аэрозоли. Чем меньше размер частиц, тем сильнее на них действует электромагнитная сила [12]. Предполагается, что при соответствующем внешнем электрическом поле заряженные наночастицы можно точно направлять с помощью электрофоретических сил и перемещать через носовые ходы без ущерба для стенок дыхательных путей.
Ракеты могут точно поражать свои цели, поскольку они находятся под постоянным контролем по заданным траекториям. Точно так же было бы очень желательно, если бы мы могли контролировать фармацевтические частицы, чтобы они вели себя так же, как управляемые ракеты. Это кажется сложной задачей, учитывая крошечный размер этих аэрозолей (0,2–5 микрон) и сложную структуру носа, которая требует предельной точности для перемещения частиц через извитые раковины и к скрытой обонятельной области. Интересно, что решение этой проблемы заключается в самой проблеме или в крошечном размере частиц.Электрофоретическая сила на наночастицах может быть доминирующей, что позволяет дистанционно контролировать вдыхаемые аэрозоли. Чем меньше размер частиц, тем сильнее на них действует электромагнитная сила [12]. Предполагается, что при соответствующем внешнем электрическом поле заряженные наночастицы можно точно направлять с помощью электрофоретических сил и перемещать через носовые ходы без ущерба для стенок дыхательных путей. Требуемое электрическое поле может быть достигнуто путем аккуратного размещения нескольких электродов с разными электрическими потенциалами вокруг носа.
Требуемое электрическое поле может быть достигнуто путем аккуратного размещения нескольких электродов с разными электрическими потенциалами вокруг носа.
Заряженные частицы нашли свое применение во многих промышленных и медицинских приложениях, таких как струйная печать, электростатическое осаждение и масс-спектрометрия. Размер, классификация и сбор наночастиц в первую очередь зависят от их электрических свойств [13]. В свете вдыхаемых заряженных частиц в ряде теоретических и экспериментальных исследований рассматривался перенос и отложение заряженных частиц в дыхательных путях человека [14], [15], [16], [17], [18], [19] , [20], [21].Постепенно уменьшая заряды частиц в модели носовой модели, Фрай [19] сообщил, что частично нейтрализованные частицы и заряженные частицы Больцмана имели схожие характеристики осаждения в носовой полости. Однако уровни заряда в этом исследовании намного ниже тех, которые типичны для дозированных ингаляторов, которые достаточно высоки, чтобы изменить отложение вдыхаемых частиц в дыхательных путях [17]. Больцмановский заряд субмикронных аэрозолей может быть значительным [13] и может вызывать некоторый уровень вариаций осаждения, которые не были идентифицированы Фраем [19].Сообщалось о значительном усилении осаждения в гортани и трахеобронхиальном слепке как для микрометровых [14], так и для субмикронных [15] заряженных частиц, даже в отсутствие внешнего электрического поля. Yu и соавторы [18], [22] теоретически изучили электростатические осадки в потоках труб с заданными электрическими потенциалами и предложили эмпирические корреляции для отложений заряженных аэрозолей в таких идеализированных геометриях. Однако эти корреляции, основанные на полностью развитых потоках, не могут быть легко распространены на сложные геометрии, такие как дыхательные пути, где преобладает развивающийся поток.
Больцмановский заряд субмикронных аэрозолей может быть значительным [13] и может вызывать некоторый уровень вариаций осаждения, которые не были идентифицированы Фраем [19].Сообщалось о значительном усилении осаждения в гортани и трахеобронхиальном слепке как для микрометровых [14], так и для субмикронных [15] заряженных частиц, даже в отсутствие внешнего электрического поля. Yu и соавторы [18], [22] теоретически изучили электростатические осадки в потоках труб с заданными электрическими потенциалами и предложили эмпирические корреляции для отложений заряженных аэрозолей в таких идеализированных геометриях. Однако эти корреляции, основанные на полностью развитых потоках, не могут быть легко распространены на сложные геометрии, такие как дыхательные пути, где преобладает развивающийся поток.
Цели этого исследования: (1) разработать модель вычислительной гидродинамики (CFD) для доставки лекарств под контролем электрофоретики; (2) численно оценить возможность электрофоретической фокусировки в трех квадрупольных конструкциях; (3) численно оценить эффективность управляемой электрофоретикой доставки лекарственного средства как в идеализированных двухмерных, так и в физиологически реалистичных трехмерных моделях носа; и (4) определить оптимальную компоновку и рабочие параметры электродов. Потенциальные выгоды от этого исследования включают (1) понимание динамики транспорта, лежащей в основе доставки интраназальных неврологических препаратов, и (2) рекомендации по разработке эффективных устройств для доставки лекарств, нацеленных на обонятельный эпителий.
Потенциальные выгоды от этого исследования включают (1) понимание динамики транспорта, лежащей в основе доставки интраназальных неврологических препаратов, и (2) рекомендации по разработке эффективных устройств для доставки лекарств, нацеленных на обонятельный эпителий.
Методы
Модель носовых дыхательных путей
Физиологически точная модель дыхательных путей необходима для надежного анализа ингаляционной доставки лекарственного средства. Моделирование на основе изображений представляет собой заметное улучшение по сравнению с обычными отливками для трупов, которые подвержены большим искажениям из-за усадки слизистых оболочек или введения литейных материалов. МРТ здорового некурящих 53-летнего мужчины (вес 73 кг и рост 173 см) использовались в этом исследовании для построения модели носовых дыхательных путей (рис.1а). Снимки МРТ были предоставлены Институтом медицинских наук Хамнера (Research Triangle Park, Северная Каролина), использование которого было одобрено Наблюдательным советом Университета Содружества Вирджинии. Этот набор данных МРТ был первоначально опубликован Guilmette et al. [23] в 1989 г. и был реализован в ряде экспериментов по осаждению частиц через нос [24], [25] и моделирования [26], [27]. Многосрезовые изображения МРТ сначала были сегментированы с использованием MIMICS (Materialize, Ann Arbor, MI) в трехмерную модель, которая затем была преобразована в набор контуров, определяющих интересующие дыхательные пути.На основе этих контуров в Gambit 2.4 была построена геометрия внутренней поверхности. Полученная модель предназначена для точного представления анатомии носовых дыхательных путей с незначительным сглаживанием поверхности. Эта модель может быть изготовлена в виде сплошного литья с помощью методов прототипирования для исследований in vitro , или может быть скомпонована с помощью высококачественных вычислительных элементов для численного анализа.
Этот набор данных МРТ был первоначально опубликован Guilmette et al. [23] в 1989 г. и был реализован в ряде экспериментов по осаждению частиц через нос [24], [25] и моделирования [26], [27]. Многосрезовые изображения МРТ сначала были сегментированы с использованием MIMICS (Materialize, Ann Arbor, MI) в трехмерную модель, которая затем была преобразована в набор контуров, определяющих интересующие дыхательные пути.На основе этих контуров в Gambit 2.4 была построена геометрия внутренней поверхности. Полученная модель предназначена для точного представления анатомии носовых дыхательных путей с незначительным сглаживанием поверхности. Эта модель может быть изготовлена в виде сплошного литья с помощью методов прототипирования для исследований in vitro , или может быть скомпонована с помощью высококачественных вычислительных элементов для численного анализа.
Протокол электрофоретической обонятельной доставки
Простое устройство такого протокола доставки будет состоять из компонентов со следующими четырьмя функциями: (а) генерация аэрозоля (ингалятор), (б) зарядка частиц, (в) фокусировка частиц и (г) управление перемещением частиц (рис.1б). Более сложные устройства могут добавлять опоры для стабилизации устройства относительно головы человека. Частицы должны генерироваться с помощью доступных ингаляторов, таких как небулайзер, pMDI и ингалятор для сухого порошка [28]. Затем частицы проходят через зарядную камеру и приобретают заданное количество зарядов (обычно положительно заряженных) [29]. Затем положительно заряженные частицы попадают в камеру фокусировки, имеющую несколько щелей [30]. Первая щель имеет высокое положительное напряжение, а последняя — нулевое напряжение.Когда частицы проходят через щели, внутренняя сила отталкивания превращает аэрозоль в точно сфокусированный луч; тем временем прямая сила отталкивания ускоряет пучок частиц до определенной скорости выхода (или скорости входа в ноздри). Преимущество знания скорости носового впускного отверстия заключается в том, что траектория частицы может быть заранее определена для данной точки выброса. Еще одно преимущество состоит в том, что скорость аэрозоля может быть намного выше, чем скорость вдыхаемого воздуха, так что он не зависит от ингаляционных маневров, что делает его подходящим для пожилых людей или пациентов с затрудненным дыханием.Попадая в носовую полость, частицы подвергаются электрофоретической силе и начинают контролируемым образом отклоняться от своих первоначальных траекторий (то есть направлять частицы). Точный контроль отклонений пути будет направлять частицы к намеченному обонятельному рецептору с минимальными потерями для носовых клапанов и носовых раковин. В этом исследовании мы ограничим наше внимание осуществимостью электрофоретического управления неврологическими частицами лекарств с электрическими потенциалами и уровнями заряда, безопасными для человеческого тела.
Модели транспортировки жидких частиц
В данном исследовании предполагается, что потоки изотермические и несжимаемые. Для всех симуляций предполагались устойчивый вдох и нормальные условия дыхания. Среднее число Рейнольдса на входе в ноздри было около 1413 [31]. Условия потока в носовых дыхательных путях человека преимущественно ламинарные. Поэтому в данном исследовании была принята модель ламинарного потока.
Траектории монодисперсных частиц с диаметрами ( d p ) были рассчитаны на основе лагранжа путем прямого интегрирования соответствующей формы уравнения переноса частиц.Меньшая частица имеет меньшую инерцию, большую диффузию и большее влияние электрофоретической силы. Частицы, рассматриваемые в этом исследовании, имели диаметр 0,5 мкм из-за их относительно небольших инерционных и диффузионных свойств при сохранении относительно большой электрофоретической силы. Аэрозоли этого диапазона размеров имеют очень низкие числа Стокса ( St k = ρ p d p 2 UC c /18 µD h << 1), где ρ p — плотность частиц (1.0 г / см 3 ), C c коэффициент коррекции скольжения Каннингема, μ вязкость жидкости, U средняя скорость жидкости и D h гидравлический диаметр ноздри. Основное уравнение для движения сферической частицы в этих условиях может быть выражено как [32], (1) где v i — скорость частицы, u i — локальная скорость жидкости, а τ p (т.е., ρ p d p 2 /18 μ) — характерное время, необходимое частице для реакции на изменения в поле потока. Фактор сопротивления f , который представляет собой отношение коэффициента сопротивления C D к сопротивлению Стокса, основан на выражении Морси и Александера [33] для аэрозолей размером более 1 мкм. Эффекты неконтинуального скольжения на сопротивление наночастиц учитываются с использованием поправочного коэффициента Каннингема ( C c) [13].Сила тяжести была включена с вектором гравитации, ориентированным в вертикальном направлении. Подъемная сила Саффмана была рассчитана для частиц размером более 1 мкм [34]. Эффект броуновского движения рассматривался для частиц размером менее 1 мкм [35]. Односторонняя связь потока и частиц была реализована в этом исследовании из-за разбавленной концентрации аэрозолей лекарств. Вычислительная модель динамики жидких частиц, используемая в этом исследовании, была проверена в сравнении с существующими экспериментальными данными в сопоставимых моделях дыхательных путей [36], [37].Численно определенные результаты осаждения согласуются с экспериментальными данными в пределах 5% как для сидячих (15 л / мин), так и для световой активности (30 л / мин) условий ингаляции, что указывает на то, что представленная здесь модель была адекватной для отражения интересующего физического реализма.
Электрическое поле и электрофоретическая сила
Для поля постоянного тока электрический потенциал U DC получается путем решения уравнения Пуассона, (2) где ε 0 — диэлектрическая проницаемость свободного пространства (Ф / м), а ε r — относительная диэлектрическая проницаемость свободного пространства.Ноль в правой части приведенного выше уравнения указывает на то, что плотностью пространственного заряда можно пренебречь. Для поля переменного тока сохранение электрических токов решается для вычисления потенциала переменного тока, V [38] 🙁 3) где σ — электрическая проводимость, а ω — угловая частота (Гц). Полное электрическое поле получается из суперпозиции полей постоянного и переменного тока с учетом того, что уравнения для полей постоянного и переменного тока являются линейными.
Электрофоретическая сила рассчитывается по формуле (4)
Где n — безразмерное число заряда, а e — элементарный заряд ( e = 1.6 × 10 −19 C), E DC и E AC — напряженность электрического поля, которая рассчитывается следующим образом. (5)
Символ означает, что электрический потенциал переменного тока является комплексной величиной. В этом исследовании тестировались только напряжения менее 12 В, что вполне соответствовало диапазону безопасности для человека (<50 В) [39]. Соответствующие рабочие параметры, такие как оптимальный размер частиц, заряд частиц, скорость / положение высвобождения лекарственного средства и расположение / прочность электродов, будут систематически изучаться, как описано ниже.
Связь между параметрами приложенного напряжения и траекторией частиц будет сначала исследована в квадрупольной геометрии. Для заданных путей частиц будут рассчитаны требуемые параметры напряжения. Затем эти параметры будут реализованы в двухмерной (2-D) и трехмерной моделях носа для расчета траекторий частиц. Учитывая задействованную мультифизику и длительные вычислительные затраты, использование двухмерной модели значительно сокращает время вычислений по сравнению с трехмерным моделированием.Это также позволяет нам снизить сложность модели без ущерба для ее целостности, получить понимание фундаментальной физики, лежащей в основе процесса переноса, и точно настроить рабочие параметры для использования в более сложных трехмерных моделях. В этом исследовании будет изучено влияние носового воздушного потока, силы электродов и положения высвобождения лекарства на обонятельное отложение. Эффективность предлагаемого протокола доставки будет оцениваться путем сравнения переноса и осаждения частиц между случаями с электрофоретическим контролем и без него, а также случаями с фокусировкой частиц и без (точечное высвобождение).
Численный метод и анализ чувствительности сетки
Чтобы решить метафизику, включенную в это исследование, Comsol (Берлингтон, Массачусетс) был использован для моделирования соответствующей мультифизики, которая включает воздушный поток, электрическую силу и отслеживание частиц. Сходимость решения поля потока предполагалась, когда глобальная невязка массы была уменьшена на четыре порядка величины, а остаточные скорости уменьшения как массы, так и количества движения были достаточно малы. Расчетная сетка была сгенерирована в Comsol в многодоменных областях с физическим контролем.Носовые дыхательные пути были дискретизированы на основе физики жидкости, а остальные области (электроды и открытое пространство) были основаны на общей физике. Чтобы разрешить возможные крутые градиенты переменных потока в пристенной области, также использовалась сетка, подогнанная к телу. Ввиду высокой сложности морфологии носа, уточнение угловой сетки было реализовано по всей геометрии модели. Анализ чувствительности сетки был проведен путем тестирования эффектов различной плотности сетки с приблизительно 0,4 миллиона, 0.790 миллионов, 1,1 миллиона и 2,0 миллиона элементов (степени свободы). Прогнозируемая скорость осаждения составила менее 1% при увеличении размера ячеек с 1,1 миллиона до 2,0 миллиона. В результате окончательная сетка для отчетности по полю потока и условиям отложений состояла примерно из 1,1 миллиона ячеек.
Результаты
Фокусировка и наведение частиц в квадрупольной модели
Возможность электрофоретической фокусировки и наведения была впервые протестирована в квадрупольной геометрии (рис.2), в котором траекторией заряженных частиц можно управлять, изменяя расположение электродов. В этом приложении приложенное напряжение составляло 12 В, а размер частиц составлял 0,5 мкм с 200 элементарными зарядами. Скорость на входе воздушного потока и заряженных частиц составляла 0,1 м / с. Электрическое поле и траектории частиц в квадрупольной геометрии показаны на рис. 2 для трех тестовых случаев с разным расположением электродов. В первом испытании мы проверили чувствительность заряженных наночастиц к электрофоретическому наведению путем изменения электрических полей как по направлению, так и по силе.При этом восемь групп электродов были расположены вдоль кривой, чтобы можно было указать различные комбинации напряжений. На рис. 2а два противоположных электрода имели одинаковое напряжение (12 В или -12 В). Точно так же нулевое электрическое поле было достигнуто вдоль изогнутой центральной линии. Частицы концентрировались в этом поле и в то же время направлялись к выходу, маневрируя через кривизны, преодолевая силу инерции.
Во втором испытании (рис. 2b) мы сняли напряжение с двух последних электродных групп, чтобы убедиться в незаменимости электрофоретических сил при фокусировке и навигации частиц.Как и ожидалось, без электрофоретических сил траектории частиц отклонялись от центральной линии, указывая на нарушение баланса сил между электрофоретическими и инерционными силами. Тщательный осмотр рис. 3a и b дополнительно выявили этот тонкий баланс сил, который проявлялся в вейвлетах или флуктуациях траекторий частиц вдоль изогнутой центральной линии.
Рис. 3. Динамика двумерной интраназальной доставки: (а) воздушный поток, (б) электрическое потенциальное поле, (в) траектории частиц с электрофоретическими силами и (г) траектории частиц без электрофоретических сил.
В электрическом поле красный цвет представляет нулевое напряжение, а синий цвет представляет отрицательное напряжение.
https://doi.org/10.1371/journal.pone.0086593.g003
В третьем испытании проверялась способность электрофоретических сил изменять траектории частиц путем изменения расположения и / или прочности электродов (рис. 2c). В этом испытании два противоположных электрода в одной группе имели разное напряжение (12 В, 6 В), при этом две соседние группы чередовали расположение напряжений, как показано на рис.2c. Было замечено, что траектории частиц действительно были изменены, что в значительной степени соответствовало результирующему полю нулевого E. Это желательно, потому что это является многообещающим инструментом для направления частиц лекарства через извитые носовые ходы и отвода их от носовых раковин. Возможный недостаток этого метода состоит в том, что фокусировка частиц на уровне может быть нарушена, как показано более беспорядочными и дисперсными следами частиц на рис. 2c.
Двумерная модель носа
Выполнимость нового протокола доставки была дополнительно оценена на двухмерной модели носа на основе МРТ.На рис. 3а показано поле носового воздушного потока, которое разделено на три потока нижней и средней раковинами (или носовыми раковинами). Верхний поток далее разделяется верхними раковинами, при этом только небольшая часть потока распределяется в обонятельную область (самое верхнее место носовой полости). В целом, верхняя полость носа принимает небольшую часть вдыхаемого воздуха, что указывает на низкую вероятность проникновения частиц в эту область. На рис. 3а линии тока, которые начинаются от передней ноздри, движутся к верхнему проходу, тогда как линии тока от задней ноздри движутся к дну носа (т.е.е. нижний проход). Следовательно, возможно, что частицы, вводимые в кончик ноздри, имеют более высокую вероятность достичь обонятельной области.
Для проверки протокола электрофоретической интраназальной доставки четыре электрода были расположены вокруг носа. Электрические потенциалы были установлены равными -3 В, -8 В, -12 В и 0 В соответственно (рис. 3а). Небольшой перепад напряжения (3 В) в преддверии носа должен был обеспечить небольшую движущую силу в направлении верхней носовой полости, в то же время пытаясь избежать столкновения частиц с преддверием носа.Дифференциал напряжения увеличился до 8 В за областью носового клапана, чтобы направить частицы в обонятельную область. Дифференциал напряжения увеличился до 12 В непосредственно над обонятельной областью, чтобы привлечь аэрозоли лекарства. На рисунке 3b показано результирующее электрическое потенциальное поле. Наблюдается изменение электрического поля от почти 0 В в ноздрях до почти -12 В в обонятельной области.
На рисунках 3c и 3d сравниваются положения частиц с электрофоретическими силами и без них в различные моменты времени с момента их высвобождения в ноздрях.Рассматриваемые частицы имеют диаметр 0,5 мкм, плотность 1 г / см 3 и число заряда 200. И поток воздуха, и частицы входят в ноздрю со скоростью 0,1 м / с. Профили частиц без и с электрофоретическими силами изначально кажутся похожими. После этого отклонение становится очевидным (0,75 с) и продолжает увеличиваться до 1,5 с. Из-за возрастающей направленной вверх электрофоретической силы большинство частиц сталкиваются с тремя носовыми раковинами (или носовыми раковинами), и лишь небольшая часть частиц (~ 14%) достигает обонятельной области (рис.3d). Напротив, в обонятельной области почти не бывает отложений без электрофоретического контроля (рис. 3c).
Основываясь на наблюдении, что отложения в раковинах преимущественно образуются из частиц, которые выделяются в нижней половине ноздри, естественно предположить, что, избегая высвобождения лекарства из этой области, нежелательные отложения в носовых раковинах уменьшатся. На рисунке 4а показаны сценарии введения лекарств только из верхней половины ноздри (т.е. частичное высвобождение лекарства), что значительно снижает отложение в средней раковине и почти устраняет отложение в нижней раковине.В случае с электрофоретическим контролем частичное высвобождение доставляет около 45% лекарств в обонятельную область, а оставшаяся часть (~ 55%) откладывается в верхней раковине (рис. 4a). Чтобы еще больше сократить отходы лекарств, мы улучшили зону высвобождения лекарства, чтобы все частицы из этой зоны могли проходить через носовые ходы и достигать обонятельной области. На рис. 4b показана динамика частиц через одну секунду после их выхода из заостренной области на кончике ноздри. Почти все электрофоретические частицы из этой области (~ 95%) откладываются в обонятельной области.Напротив, только 0,77% частиц, выпущенных из этой области, попадают в обонятельную область в отсутствие электрофоретических сил.
Скорость осаждения частиц лекарства в обонятельной области (т. Е. Обонятельная доза) показана на рис. 5 в логарифмической шкале. Как видно из рис. 5, применение электрофоретических сил заметно увеличивает обонятельную дозу. В этом пилотном двухмерном исследовании доставка под контролем электрофореза приводит к обонятельным дозам, которые на два порядка выше по сравнению с доставкой лекарств без электрофоретических сил.Кроме того, высвобождение лекарств в верхнюю половину ноздри (т.е. частичное высвобождение) приводит к обонятельной дозировке, в два раза большей, чем при высвобождении лекарств по всей области ноздри (т.е. обычное высвобождение). Оптимальное положение высвобождения с электрофоретическим контролем находится в верхней части ноздрей, откуда 95% лекарств доставляется в обонятельную область. Учитывая чрезвычайно низкую эффективность обонятельной доставки (0,11–0,77%) при использовании традиционных подходов, этот новый протокол имеет большое преимущество при разработке новых устройств, специально предназначенных для доставки лекарств из носа в мозг.
Рис. 5. Сравнение обонятельных дозировок с применением электрических сил и без них в двухмерной модели в логарифмической шкале.
Обонятельные дозы могут быть на два порядка выше с приложенными E-силами, чем без них.
https://doi.org/10.1371/journal.pone.0086593.g005
Трехмерная модель носа
Обоснование, лежащее в основе двумерных исследований, состоит в том, что движение частицы можно в значительной степени предположить как плоское, а боковые движения незначительны.Это разумно, когда цель состоит в том, чтобы определить соответствующие рабочие параметры (электрический потенциал и соотношение масса / заряд), которые будут использоваться в трехмерных сценариях. Однако носовые воздушные потоки в основном трехмерны, со значительными вторичными движениями, распределяющими вдыхаемый воздух / частицы внутри носа весьма неоднородным образом. Более того, двухмерные исследования неадекватны, когда требуется расположение электродов для создания трехмерного электрического поля для точного наведения частиц.
На рис. 6 показана схема расположения электродов для электрофоретической обонятельной доставки.Электроды состоят из четырех рядов, два из которых расположены вдоль гребней двух носовых ходов, а два других — по бокам носа (рис. 6). Соответствующие электрические потенциалы определены для того, чтобы терапевтические агенты, вводимые в ноздри, могли (а) избежать захвата носового клапана / носовых раковин и (б) отложиться в обонятельной области. Соответственно, требуются две компоненты внешней силы: восходящая сила, которая толкает частицы к обонятельной области, преодолевая силу тяжести и нисходящую силу сопротивления, и боковая (в направлении оси x) сила, которая не дает частицам осаждаться на боковых стенках раковин. .Два верхних ряда, которые заряжены отрицательно, создают восходящую силу, а два боковых ряда обеспечивают боковые силы. В этом исследовании лекарства вводятся только в левую ноздрю, поэтому используются только электроды в верхних левых рядах и в двух боковых рядах (Таблица 1). Кроме того, чтобы оценить влияние различных положений высвобождения на обонятельное дозирование, будет протестирован катетер диаметром 1,5 мм, расположенный в четырех местах (на расстоянии 1 мм друг от друга) в левой ноздре (рис. 6).Считается, что рассматриваемые частицы являются монодисперсными, имеют диаметр 0,5 мкм, плотность 1 г / см 3 и несут 200 электрических зарядов [13].
Рис. 6. Схема конфигурации электродов и четыре положения высвобождения частиц с заостренным концом.
Есть четыре группы электродов в тандеме, по одной группе с каждой стороны носа и по одной группе накладок над каждым из двух носовых выступов. L: слева; R: вправо; LS: левая сторона; RS: правая сторона.
https: // doi.org / 10.1371 / journal.pone.0086593.g006
Детальное знание аэродинамики имеет решающее значение для прогнозирования поведения и судьбы вдыхаемых агентов. Поля воздушного потока и динамика частиц в трехмерных носовых дыхательных путях показаны на рис. 7 для скорости вдоха 0,1 м / с. Подобно двумерному случаю, потоки с высокой величиной скорости возникают в средней части медиального прохода, в то время как узкие плавниковые области прохода принимают небольшую часть воздушного потока. Основной поток резко меняет свое направление от ноздрей к носоглотке, образуя искривление почти на 180 °.Зона рециркуляции наблюдается в верхней дорсальной части носоглотки в результате внезапного расширения площади как в поперечном сечении, так и в области эффективного потока (рис. 7a). Также наблюдается, что только линии тока от передней ноздри перемещаются в обонятельную область, которая движется вверх до обоняния и вниз после него.
Для условий дыхания, рассматриваемых в данном исследовании (0,1 м / с), требуется 0,6–1 секунды после введения, чтобы частицы достигли обонятельной области (рис.7б). Из-за резкого изгиба дыхательных путей от ноздрей к носоглотке высокая концентрация частиц постоянно корректирует свое направление в соответствии со средней кривизной обтекаемых потоков вдыхаемого воздуха. В медиальных проходах наблюдается более быстрый перенос и более глубокое проникновение аэрозолей, в то время как медленно движущиеся частицы обнаруживаются возле стенок дыхательных путей. Наблюдается, что только небольшая часть откладывается в верхнем проходе, а еще меньше частиц достигает самой верхней обонятельной области. Соответственно, поверхностное осаждение вдыхаемых аэрозолей очень неоднородно, как показано на поверхностном осаждении (рис.8а).
Сравнение схем осаждения с электрофоретическими силами и без них показано на рис. 8 для частиц диаметром 0,5 мкм и 200 электрических зарядов. В обоих случаях 10000 частиц выпускаются равномерно по всей площади левой ноздри. При правильном расположении электрического потенциала (таблица 1) заметный процент (3,7%) вводимых лекарств достигает целевой обонятельной области (рис. 8а, левая панель). Напротив, возможность обонятельного отложения ничтожно мала (0.06%) в отсутствие электрофоретических сил (рис. 8а, правая панель).
Для дальнейшего повышения эффективности обонятельной доставки лекарства вводятся в одну небольшую точку (точка B на рис. 8b) в передней части ноздри, чтобы помочь избежать захвата носового клапана / носовых раковин. В обоих случаях потери лекарства через носовой клапан и носовые раковины заметно уменьшаются. Что еще более важно, при электрофоретическом контроле большинство (92%) терапевтических агентов попали в обонятельные органы (красный эллипс), которые в противном случае откладывались бы в верхней носовой раковине и носоглотке (рис.8b, левая панель против правой панели). Тщательный осмотр отложения в верхней носовой раковине (зеленый квадрат) на правой панели рис. 8b показывает, что частицы откладываются на внешней стороне (поверхности носовой раковины) в отличие от внутренней стенки перегородки. Чтобы уменьшить осаждение здесь, необходима составляющая поперечной силы, чтобы отталкивать эти частицы от приближения к внешней стенке.
Механизм, лежащий в основе электрофоретической обонятельной доставки, проиллюстрирован на рис. 9, на котором показано отклонение заряженных частиц от линий тока воздушного потока, электрическое потенциальное поле и компонент результирующей электрической силы в направлении x (латеральный).Первоначально отклонение становится очевидным в области ниже обоняния. Как обсуждалось ранее, частицы перемещаются от ноздри в эту область за 0,6–1,0 с, в основном за счет аэродинамических сил. После этого направленная вверх электрофоретическая сила становится доминирующей, которая изменяет траекторию частиц и ориентирует их в направлении обоняния. Этот процесс медленный и может занять 1-2 секунды, на что указывает миграция цвета от зеленого к красному на рис. 9a.
Внешнее электрическое потенциальное поле и электрофоретическая сила, испытываемая частицами лекарства, показаны на рис.9b и c. Чтобы успешно перемещать частицы через извитый носовой проход, электрический потенциал должен изменяться как по величине, так и по направлению вдоль пути частицы, в зависимости от отклонений пути, необходимых для выхода из носового клапана или носовых раковин. В этом случае движение частиц можно разделить на три стадии: стадия с аэродинамическим управлением (0–0,5 с), которая переносит частицы из ноздри в верхний проход, вторая стадия, на которой важны как сопротивление, так и электрические силы (0.5–1 с) и третья стадия (1–2 с), на которой частицы отводятся в обонятельные органы за счет электрофоретического притяжения. На втором этапе на частицы заряда действует боковая электрическая сила, которая указывает на перегородку (отрицательное направление x на рис. 9c) и помогает отвести частицы от осаждения на носовой раковине.
На рис. 10 сравнивается прогнозируемая эффективность обонятельной доставки с электрофоретическими силами и без них с использованием логарифмической шкалы. В целом, численные прогнозы в трехмерной модели подтверждают двухмерные результаты, согласно которым электрофоретические силы могут значительно улучшить обонятельную доставку.При соответствующих E-силах скорость обонятельного отложения может быть на два порядка выше, чем без электрофоретического контроля. Кроме того, введение терапевтических агентов в определенное место (то есть с точным высвобождением лекарства) дополнительно усиливает обонятельную доставку по сравнению с традиционной практикой введения лекарств по всей области ноздри (обычное высвобождение). Также отмечается, что эффективность обонятельной доставки очень чувствительна к точке высвобождения. Для данного электрического поля и его оптимальной точки высвобождения (точка B в этом исследовании) обонятельная доза уменьшается с 92% в точке B до 75% за счет смещения положения высвобождения всего на 1 мм вперед к точке A, уменьшается до 67% на 1 мм назад к точке C и на 41% на 2 мм назад к точке D.Перенос заряженных частиц через воздушный поток и электрическое поле — это динамический процесс. Траектория такой частицы является результатом взаимодействия аэродинамических и электрических сил. Более того, взаимосвязь между электрофоретическим отклонением и электрическим потенциалом является нелинейной (производная второго порядка по своей природе) и пространственно-зависимой (локальная скорость и электрическое поле). Принимая во внимание эти взаимодействующие факторы, неудивительно, что обонятельное дозирование будет проявлять высокую чувствительность к различным местам высвобождения.
Рис. 10. Сравнение обонятельных дозировок с применением электрических сил и без них в трехмерной модели в логарифмической шкале.
Обонятельные дозы могут быть на два порядка выше с приложенными E-силами, чем без них.
https://doi.org/10.1371/journal.pone.0086593.g010
Обсуждение и резюме
В этом пилотном исследовании мы продемонстрировали возможность интраназальной доставки лекарств в обонятельную область с электрофоретическим контролем на модели человеческого носа на основе изображений.Эффективное обонятельное дозирование — решающий первый шаг в прямой доставке из носа в мозг, возможность которой зависит от двух факторов: эффективной дозировки для центральной нервной системы (ЦНС) и отсутствия очевидных системных побочных эффектов. В этом отношении оптимальная обонятельная доза (92%), предсказанная в этом исследовании, кажется очень многообещающей. Максимальное напряжение, приложенное к носу, составляет всего 12 В, что безопасно для человеческого тела и может быть легко достигнуто с помощью батареи на 12 В.
Сложность носовой полости препятствует эффективной интраназальной доставке лекарств.Большинство вдыхаемых частиц попадают на интраназальные стенки и отфильтровываются из дыхательных путей. Это объясняет, как человеческий нос действует как эффективный фильтр и считается нашей первой линией защиты. Однако эта же защита на протяжении десятилетий сбивала с толку усилия по поиску эффективных методов доставки лекарств через нос в легкие, обонятельный эпителий или придаточные пазухи носа. Результаты этого исследования показали, что при соответствующем электрическом поле траекторию частицы можно точно контролировать, чтобы не пересекать поверхность дыхательных путей до достижения обонятельной области.Успех такого контроля зависит от точного знания двух факторов: (1) исходный курс / траектория вдыхаемых частиц и (2) отклонение курса, необходимое для выхода из носовых клапанов / фильтраций носовых раковин. Первый фактор может быть легко идентифицирован с помощью моделирования CFD изображения для конкретного пациента, чтобы определить необходимые отклонения (второй фактор). Величина отклонения для данной частицы зависит от одновременного действия электрических и аэродинамических сил, которые дополнительно определяются полем электрического потенциала и мгновенной скоростью частицы (временем пребывания).Соответственно, если отношение массы частиц к заряду и скорость ингаляции известны, электрическое поле, необходимое для отклонения траектории, может быть вычислено, что может быть использовано для расчета расположения и прочности электродов. Следует отметить, что для обеспечения эффективных обонятельных доз должны быть отклонения более чем в одном направлении, как показано на рис. 1.
Новым аспектом этого исследования является то, что заряженными наночастицами можно точно управлять с помощью соответствующих электрофоретических сил. Этот протокол обеспечивает множество преимуществ, которых нет в современных ингаляторных устройствах.Например, частицы лекарства под контролем электрофореза могут бесконтактно соприкасаться со стенкой дыхательных путей, что значительно снижает отходы лекарства в носовом клапане / раковинах и увеличивает обонятельную дозу. В результате у него есть потенциал преодолеть узкое место между носом и мозгом, вызванное чрезвычайно низким уровнем обонятельных отложений [9]. Частицы лекарства могут не содержать трехвалентных магнитных материалов, что сводит к минимуму побочные эффекты от металлических скоплений [40], [41]. Кроме того, доставка под контролем электрофореза не зависит от условий ингаляции, что делает ее подходящей для пожилых людей или пациентов с респираторным дистресс-синдромом, которым трудно выполнять необходимые дыхательные маневры [42], [43], [44].Предлагаемая платформа также может быть легко адаптирована для целевой доставки лекарств в респираторные органы, отличные от обонятельной, путем изменения расположения электродов и градиентов напряжения.
Клинически предполагается, что система электрофоретического наведения будет состоять из одного электрода нулевого напряжения, расположенного во рту, и четырех рядов отрицательных электродов, расположенных снаружи носа. Каждый ряд будет включать в себя несколько электродов, к которым прикладываются разные напряжения для создания желаемого электрического поля в носу.Подголовник можно использовать для стабилизации электродов относительно головы, чтобы не было прямого контакта между электродами и телом человека. В этом предложенном протоколе моделирование CFD изображения для конкретного пациента необходимо для определения требуемых отклонений. Стоимость сканирования МРТ и моделирования CFD может стать потенциальным препятствием для его применения в человеческой популяции.
Воспаление слизистой оболочки носа вследствие аллергического ринита или риносинусита приводит к сужению и закупорке и без того узких носовых ходов.Вероятно, будет сложнее направлять частицы лекарственного средства через эти каналы без потери контакта с поверхностью, что требует более точного контроля траекторий частиц для достижения удовлетворительной эффективности доставки. Модификации градиентов электрического потенциала необходимы для исправления измененных отклонений траектории частиц. Для сценариев с серьезными препятствиями ожидается снижение эффективности обонятельной доставки. Чтобы исправить эту неудачу, сначала следует назначать вазоконстрикторы, такие как ксилометазолин, пациентам с ринитом и риносинуситом, чтобы облегчить воспаление носа, прежде чем вводить лекарства.Как правило, носовая слизь несет отрицательный заряд из-за движения натрия и хлоридов через мембрану (т.е. от -5 до -30 мВ для нормальных субъектов и от -40 до -80 мВ для пациентов с муковисцидозом) [45]. Однако ожидается, что потенциальное влияние этого заряда на траектории частиц будет незначительным, учитывая, что он имеет гораздо меньшую величину по сравнению с приложенным электрическим напряжением.
Ограничения этого исследования включают предположение о постоянном потоке, жестких стенках дыхательных путей, ограниченном расположении электродов / рабочих параметрах и пренебрежении топологией лица.В этом исследовании были приняты особые меры для минимизации эффектов потока. Во-первых, была принята очень низкая скорость ингаляции (0,1 л / мин), чтобы уменьшить инерционный эффект частиц и увеличить время реакции частицы на электрофоретический контроль. Во-вторых, этот предлагаемый протокол доставки в основном зависит от электрофоретических сил и, следовательно, меньше зависит от условий дыхания. Практически, влияние кратковременных вдохов можно дополнительно минимизировать, дав пациенту инструкцию делать устойчивый вдох и активируя высвобождение лекарства только во время этой квазистационарной фазы вдоха.Учитывая нелинейную взаимосвязь между траекторией частицы и электрофоретической силой, определение оптимальных значений электрического напряжения — это в основном искусство, смешанное с наукой, требующее многочисленных испытаний, чтобы найти лучшую комбинацию. Эта сложность еще больше усугубляется необходимостью точного управления траекторией, при котором частицы перемещаются через извитые носовые ходы без потерь для стенки. Топология лица также может повлиять на расположение электродов. Каждое ограничение влияет на реалистичность прогнозов модели и должно быть рассмотрено в будущих исследованиях.Кроме того, это исследование ограничено моделями носа, основанными на одном субъекте, и поэтому не учитывает межпредметную изменчивость. Будущие численные исследования с большим количеством моделей носа на основе изображений, а также дополнительные экспериментальные исследования необходимы для расширения наших знаний о осуществимости и эффективности этой новой стратегии доставки лекарств.
В заключение, в этом исследовании систематически оценивалась возможность и эффективность адресной доставки лекарств с помощью электрофоретических сил как на идеализированных, так и на реалистичных моделях носа.В частности, влияние электрических полей и положений высвобождения лекарственного средства исследовали при управлении движением частиц в направлении обонятельной области. Результаты этого пилотного исследования имеют значение для разработки эффективных устройств для интраназальной доставки лекарств, нацеленных на обонятельный эпителий. Конкретные результаты этого исследования:
- Возможно фокусировать и направлять наночастицы с помощью электрического напряжения, безопасного для человеческого тела (<12 В).
- Применение электрофоретических сил может значительно увеличить обонятельное осаждение наночастиц диаметром 0.5 мкм и ниже.
- Электрофоретическая обонятельная доставка демонстрирует высокую чувствительность к положениям высвобождения лекарства.
- При соответствующем электрофоретическом руководстве и селективном высвобождении лекарственного средства может быть достигнута эффективность обонятельной доставки более 90%.
Благодарности
Д-р Цинь Ху, Джордан Ролингер, Грег Олдхэм и Кирстен Бринк выражают благодарность за полезные обсуждения и рецензирование рукописи.
Вклад авторов
Задумал и спроектировал эксперименты: JX XAS.Проведены эксперименты: JX XAS RG. Проанализированы данные: JX XAS RG. Предоставленные реагенты / материалы / инструменты анализа: JX XAS. Написал бумагу: JX XAS.
Ссылки
- 1. Bagger M, Bechgaard E (2004) Модель микродиализа для изучения назальной доставки лекарств и обонятельной абсорбции у крыс с использованием лидокаина гидрохлорида в качестве модельного лекарственного средства. Int J Pharm 269: 311–322.
- 2. Mancuso G, Barth E, Crivello P, Rugarli EI (2012) Альтернативный сплайсинг Spg7, гена, участвующего в наследственной спастической параплегии, кодирует вариант параплегина, нацеленный на эндоплазматический ретикулум.PLoS ONE 7: e36337.
- 3. Далем М.А., Хаджихани Н. (2009) Аура мигрени: втягивание частиц, подобных волнам, в слабо восприимчивой коре головного мозга. PLoS ONE 4: e5007.
- 4. Мисра А., Кхер Г. (2012) Системы доставки лекарств от носа до мозга. Curr Pharm Biotechnol 13: 2355–2379.
- 5. Mistry A, Stolnik S, Illum L (2009) Наночастицы для прямой доставки лекарств из носа в мозг. Int J Pharm 379: 146–157.
- 6. Алам С., Хан З.И., Мустафа Г., Кумар М., Ислам Ф. и др.(2012) Разработка и оценка инкапсулированных в тимохинон наночастиц хитозана для нацеливания от носа к мозгу: фармакосинтиграфическое исследование. Int J Nanomedicine 7: 5705–5718.
- 7. Hanson L, Frey W (2007) Стратегии интраназальной доставки терапевтических средств для профилактики и лечения NeuroAIDS. J Neuroimmune Pharmacol 2: 81–86.
- 8. Shi H, Kleinstreuer C, Zhang Z (2006) Ламинарный воздушный поток и осаждение наночастиц или паров в модели носовой полости человека.J Biomech Eng 128: 697–706.
- 9. Si X, Xi J, Kim J, Zhou Y, Zhong H (2013) Моделирование положения выпуска и эффектов вентиляции на доставку обонятельного аэрозоля. Respir Physiol Neurobiol 186: 22–32.
- 10. Turker S, Onur E, Ozer Y (2004) Назальный путь и системы доставки лекарств. Pharm World Sci 26: 137–142.
- 11. Illum L (2002) Назальная доставка лекарств: новые разработки и стратегии. Drug Discov Today 7: 1184–1189.
- 12.Xi J, Longest PW, Anderson PJ (2010) Динамика респираторного аэрозоля с приложениями к доставке фармацевтических лекарств. В: Фанун М., редактор. Коллоиды в доставке лекарств: CRC Press. 501–526.
- 13. Hinds WC (1999) Технология аэрозолей: свойства, поведение и измерение частиц в воздухе. Нью-Йорк: Джон Уайли и сыновья.
- 14. Чан Т.Л., Липпманн М., Коэн В., Шлезингер Р.Б. (1978) Влияние электростатических зарядов на осаждение частиц в полой слепке гортани-трахеобронхиального дерева человека.J Aerosol Sci 9: 463–468.
- 15. Коэн BS, Xiong JQ, Asgharian B, Ayres L (1995) Отложение вдыхаемых заряженных сверхмелкозернистых частиц в простой модели трахеи. J Aerosol Sci 26: 1149–1160.
- 16. Kwok PCL, Noakes T, Chan H-K (2008) Влияние влаги на свойства электростатического заряда аэрозолей дозированных ингаляторов. J Aerosol Sci 39: 211–226.
- 17. Kwok PCL, Glover W, Chan HK (2005) Характеристики электростатического заряда аэрозолей, производимых из дозирующих ингаляторов.J Pharm Sci 94: 2789–2799.
- 18. Ю. П., Чандра К. (1977) Осаждение субмикронных заряженных частиц в дыхательных путях легких человека. Bull Math Biol 39: 471–478.
- 19. Фрай Ф.А. (1970) Распределение заряда на аэрозолях полистирола и отложение в носу человека. J Aerosol Sci 1: 135–146.
- 20. Карнер С., Урбанец Н.А. (2011) Влияние электростатического заряда на фармацевтические порошки с особым вниманием к ингаляционным порошкам. J Aerosol Sci 42: 428–445.
- 21. Тао Х, Чжан Ц., Линг К., Чен Й, Ян В. и др. (2012) Влияние поверхностных зарядов наночастиц пуллулана на комплексообразование с HSA и поведение связанных с HSA наночастиц с высвобождением лекарственного средства. PLoS ONE 7: e49304.
- 22. Чен Ю.К., Ю.П. (1993) Осаждение частиц из потоков в воздуховоде с помощью комбинированных механизмов. Аэрозоль Sci Technol 19: 389–395.
- 23. Guilmette RA, Wicks JD, Wolff RK (1989) Морфометрия носовых дыхательных путей человека in vivo с использованием магнитно-резонансной томографии.J Aerosol Med 2: 365–377.
- 24. Cheng KH, Cheng YS, Yeh HC, Swift DL (1995) Отложение ультратонких аэрозолей в дыхательных путях головы во время естественного дыхания и во время имитации задержки дыхания с использованием дубликатов слепков верхних дыхательных путей человека. Аэрозоль Sci Technol 23: 465–474.
- 25. Kelly JT, Asgharian B, Kimbell JS, Wong B (2004) Депозиты частиц в аналогах носовых дыхательных путей человека, изготовленных различными методами. Часть I: Частицы инерционного режима. Аэрозоль Sci Technol 38: 1063–1071.
- 26. Schroeter JD, Kimbell JS, Asgharian B (2006) Анализ осаждения частиц в носовых раковинах и областях обоняния с использованием модели динамики жидкости носа человека. J Aerosol Med 19: 301–313.
- 27. Xi J, Berlinski A, Zhou Y, Greenberg B, Ou X (2012) Сопротивление дыханию и отложение ультратонких частиц в носовых и гортанных дыхательных путях новорожденного, младенца, ребенка и взрослого. Энн Биомед Энг 40: 2579–2595.
- 28. Geller DE (2005) Сравнение клинических характеристик небулайзера, дозированного ингалятора и ингалятора сухого порошка.Respir Care 50: 1313–1321 обсуждение 1321–1312.
- 29. Covert D, Wiedensohler A, Russell L (1997) Эффективность зарядки и передачи частиц аэрозольных нейтрализаторов заряда. Аэрозоль Sci Technol 27: 206–214.
- 30. Zeng Y, von Klitzing R (2012) Масштабирование расстояния между слоями заряженных частиц при ограничении поровой щелью: влияние концентрации или эффективного диаметра частиц? Журнал физики конденсированных сред 24.
- 31. Xi J, Longest PW (2008) Численные прогнозы осаждения субмикрометровых аэрозолей в носовой полости с использованием нового подхода к дрейфующему потоку.Int J Heat Mass Transfer 51: 5562–5577.
- 32. Xi J, Longest PW (2007) Транспорт и осаждение микроаэрозолей в реалистичных и упрощенных моделях дыхательных путей полости рта. Энн Биомед Энг 35: 560–581.
- 33. Морси С.А., Александр А.Дж. (1972) Исследование траекторий частиц в системах с двухфазными потоками. Журнал «Механика жидкости» 55 (2): 193–208.
- 34. Xi J, Longest PW (2009) Характеристика осаждения субмикронных аэрозолей во внегрудных дыхательных путях во время носового выдоха.Аэрозоль Sci Technol 43: 808–827.
- 35. Xi J, Longest PW (2007) Влияние характеристик геометрии дыхательных путей на диффузное осаждение вдыхаемых наночастиц. Журнал ASME по биомеханической инженерии 130: 011008–011001-011016.
- 36. Cheng KH, Cheng YS, Yeh HC, Swift DL (1995) Отложение ультратонких аэрозолей в дыхательных путях головы при естественном дыхании и во время имитации задержки дыхания с использованием дубликатов слепков верхних дыхательных путей человека. Наука и технология аэрозолей 23: 465–474.
- 37. Cheng YS, Su YF, Yeh HC, Swift DL (1993) Отложение потомства Thoron в дыхательных путях головы человека. Аэрозоль Sci Technol 18: 359–375.
- 38. Рибейро П., Si X (2012) Раздел 2: Электрическая и магнитная цепь. В: Beaty HW, Fink DG, редакторы. Стандартный справочник по электротехнике. 16 изд: МакГроу Хилл. 2.1–2.58.
- 39. Zhang L, Rabussay DP (2002) Клиническая оценка безопасности и переносимости человеком электрических ощущений, индуцированных электрическими полями с неинвазивными электродами.Биоэлектрохимия 56: 233–236.
- 40. Петито Ф., Лестевель П., Турлониас Э., Маццукко С., Жакино С. и др. (2013) Вдыхание наночастиц урана: отложение в дыхательных путях и перемещение к вторичным органам-мишеням у крыс. Toxicol Lett 217: 217–225.
- 41. Уильямс М., Вильярреал А., Божилов К., Лин С., Талбот П. (2013) Металлические и силикатные частицы, включая наночастицы, присутствуют в жидкости и аэрозоле для картомайзера электронных сигарет. PLoS ONE 8: e57987.
- 42. Dhand R (2012) Аэрозольная терапия у пациентов, получающих неинвазивную вентиляцию с положительным давлением. Журнал аэрозольной медицины и легочной доставки лекарств 25: 63–78.
- 43. Уиллис Л.Д., Берлински А. (2012) Исследование методов доставки аэрозолей для детей с трахеостомией со спонтанным дыханием. Respir Care 57: 1234–1241.
- 44. Nava S, Karakurt S, Rampulla C, Braschi A, Fanfulla F (2001) Доставка сальбутамола во время неинвазивной механической вентиляции легких у пациентов с хронической обструктивной болезнью легких: рандомизированное контролируемое исследование.Intensive Care Med 27: 1627–1635.
- 45. Яаков Ю., Керем Е., Яхав Ю., Ривлин Дж., Блау Х. и др. (2007) Воспроизводимость измерений назальной разности потенциалов при муковисцидозе. Сундук 132: 1219–1226.
Двумерный гель-электрофорез назальных и бронхоальвеолярных жидкостей лаважа после профессионального воздействия
Ссылки
7 мая 1976 г. · Аналитическая биохимия · М. М. Брэдфорд
1 декабря 1992 г. · Грудная клетка · CG PerssonI Erjefält
1 мая 1990 г. · Клиническая и экспериментальная аллергия: журнал Британского общества аллергии и клинической иммунологии · L GreiffC G Persson
1 декабря 1989 г. · Американский журнал респираторной клеточной и молекулярной биологии · MW Frampton M. J Utell
1 февраля 1989 г. · British Journal промышленной медицины · RG Barbers, JL Abraham
1 апреля 1989 · Британский журнал промышленной медицины · KM Venables
1 сентября 1988 · Электрофорез · A GörgS Günther
17 июля 1987 · Journal of Chromatography · MJ Dunn
1 августа 1994 г. · Электрофорез · JM CorbettA Görg
1 ноября 1994 г. · Медицина интенсивной терапии · J SörensenM Lindahl
1 марта 1994 г. · Электрофорез · B BjellqvistJ E Celis 9001 3
1 ноября 1993 г. · Электрофорез · O GolazC Walzer
1 января 1993 г. · Грудная клетка · DS RobinsonS R Durham
1 февраля 1993 г. · Аллергия · G Rasp, K Hochstrasser
1 января 1993 г. и гигиена окружающей среды · K PazdrakU Ruta
1 марта 1993 г. · Электрофорез · AG LenzK Maier
1 мая 1993 г. · Американский журнал промышленной медицины · U JohardA Eklund
Цитаты
27 мая 1999 г. · Электрофорез · M LindahlC Tagesson
28 декабря 1999 г. · Электрофорез · M LindahlC Tagesson
27 июня 2001 г. · Электрофорез · M LindahlC Tagesson
27 июня 2001 г. · Электрофорез · F Sabounchi-SchüttB Bjellqvist 12
· 2002Манфред Нойманн Маттиас Гризе
5 февраля 1999 г. · Электрофорез · М. ЛиндальК Тагессон
26 сентября 2009 г. · Медицина интенсивной терапии · Джованни ВентоРозанна Инзитари
9 ноября 2000 г. · Архив медицинских исследований · J Mochca-Morales
9 0004 23 мая 2002 г. · Журнал хроматографии.Б. Аналитические технологии в биомедицине и науках о жизни · Изабель Ноэль-Георис, Радди Ваттис,, 12 декабря 2012 г. · Журнал протеомных исследований, · Харриет Мертстед, Кристиан Х. Линд,
,, 1 октября 1996 г. · Торакс, М. Линдал, К. Тэгессон,
, 2002 г., 5 февраля · Ежегодный обзор физиологии · Брайан Шутте, Пол Б. МакКрей18 декабря 2010 г. · Экспертный обзор клинической иммунологии · Бегона КасадоПаоло Иадарола
22 октября 2008 г. · Экспертный обзор протеомики · Бегона Касадо Мартин Куссманн
18 января 2002 г. · Грудь · Василики Галани · Йотанна Далаванга
19 октября 2010 · Журнал протеомики · Нуно Чарро Дебора Пенке
6 апреля 2007 · Журнал торакальной онкологии: официальная публикация Международной ассоциации по изучению рака легких · Пьер П Массион, Ричард М. Каприоли
5 июля 2005 г. · Протеомика · Бегонья Касадо Джеймс Н. Баранюк
22 октября 2005 г. · Протеомика · Юронг Гуоджо Дж. Н. Гарсия
1 сентября 2009 г. · Протеомика.Клиническое применение · Praveen GovenderSeamas C Donnelly
7 марта 2006 г. · Протеомика · Yung-Shan LeePao-Chi Liao
30 ноября 2006 г. · Протеомика · Barbara MagiPaola Rottoli
31 октября 2008 г. · Протеомика · Декабрь MillerElisabetta Gianazza
4, 2008 · Journal of Separation Science · Линда М. Бенсон, Дуглас Плагер17 декабря 2014 г. · Протеомика. Клинические применения · Роза Терраччано, Рокко Савино,
, 1 ноября 2011 г. · Протеомический журнал · Серена Э. О’Нил, Ян Летвалл,
,, 19 августа 2000 г. 19, 2004 г. · Биомаркеры: биохимические индикаторы воздействия, реакции и восприимчивости к химическим веществам · Матс ЛиндальБенгт Столбом
10 июня 2004 г. · Американский журнал физиологии.Клеточная и молекулярная физиология легких · Ян Хирш, Майкл А. Маттей,
, 28 мая 2013 г. · Американский журнал физиологии. Клеточная и молекулярная физиология легких · Дженнифер А. Бартлетт · Кэтрин Э Уильямс
1 декабря 2014 · Клиническая и трансляционная медицина · Маниш БхаргаваДэвид Х. Ингбар
22 июня 1999 · Инфекция и иммунитет · AM ColeT Ganz
11 ноября 2014 · Журнал Исследования протеома · Луис М. Теран Томас Франц
7 февраля 2006 г. · Журнал исследований протеома · Б. ГафуриМ Линдал
Иммунофиксация с помощью электрофореза (моча) | Spectrum Health Lakeland
Есть ли у этого теста другие названия?
Электрофорез иммунофиксации, IFE
Что это за тест?
Этот тест отделяет и измеряет белки в моче.Он ищет аномальный белок, называемый моноклональным белком, также называемый М-белком.
M-белок — это тип аномального иммуноглобулина, вырабатываемого плазматическими клетками. Плазматические клетки — это разновидность белых кровяных телец. Ваше тело использует иммуноглобулины для выработки антител, которые помогают атаковать захватчиков, таких как бактерии и вирусы. Если ваше тело вырабатывает М-белок, это может означать, что у вас один из нескольких типов рака, например множественная миелома, или другая серьезная проблема со здоровьем.
В этом тесте используется электрический ток, чтобы протолкнуть белки в образце мочи через специальный гель.Это электрофорез. В лаборатории обрабатывают гель, чтобы сохранить только определенные белки. Это иммунофиксация. При окрашивании различные белки проявляются в виде полос или пиков.
Зачем мне нужен этот тест?
Вам может понадобиться этот тест, если ваш лечащий врач считает, что у вас есть такое состояние здоровья, как:
Множественная миелома — это тип рака, при котором в костном мозге накапливаются аномальные плазматические клетки. В результате на многих костях вырастают опухоли. Когда это происходит, костный мозг не может выполнять свою обычную работу по производству различных клеток крови.Симптомы множественной миеломы включают:
Первичный амилоидоз вызывает скопление в ваших органах вещества, называемого амилоидом. Амилоид состоит из фрагментов белка антитела. Когда амилоид собирается в органах, таких как почки, легкие, сердце или мозг, он может их повредить. У некоторых людей может быть как множественная миелома, так и первичный амилоидоз.
Макроглобулинемия Вальденстрема — это редкий тип неходжкинской лимфомы, который является разновидностью рака. Это вызвано высоким уровнем моноклонального иммуноглобулина M (IgM).Симптомы могут включать:
Какие еще тесты я мог бы пройти вместе с этим тестом?
Вам могут потребоваться другие тесты, чтобы определить, есть ли у вас проблемы со здоровьем. Эти тесты могут включать:
Анализ образца костного мозга
Биопсия ткани вашего тела для проверки признаков амилоидоза
Рентген для проверки костей
Анализ мочи на необычный уровень протеина
Полный анализ крови (CBC), который включает измерение количества различных клеток в вашей крови
Измерение уровня иммуноглобулинов в крови
КТ для исследования лимфатических узлов, селезенки и печени
Что означают мои результаты теста?
Результаты теста могут отличаться в зависимости от вашего возраста, пола, истории болезни, метода, использованного для теста, и других факторов.Результаты вашего теста могут не означать, что у вас есть проблема. Спросите своего лечащего врача, что для вас значат результаты анализов.
Как проводится этот тест?
Для этого теста требуется 24-часовой образец мочи. Для этого образца вы должны собрать всю мочу в течение 24 часов. Утром сначала полностью опорожните мочевой пузырь, не собирая его. Обратите внимание на время. Затем собирайте мочу каждый раз, когда вы идете в туалет в течение следующих 24 часов.
Представляет ли этот тест какие-либо риски?
Этот тест не представляет известных рисков.
Что может повлиять на результаты моих тестов?
Никакие другие факторы не могут повлиять на ваши результаты.
Как мне подготовиться к этому тесту?
Вам не нужно готовиться к этому тесту. Но убедитесь, что ваш лечащий врач знает обо всех лекарствах, травах, витаминах и добавках, которые вы принимаете. Сюда входят лекарства, рецепт на которые не требуется, и любые запрещенные препараты, которые вы можете употреблять.
(PDF) Разделение ?? 2-трансферрина с помощью денатурирующего гель-электрофореза для обнаружения спинномозговой жидкости в ушной и назальной жидкости
диагностическая информация при анализе с помощью нашего метода.
Наши результаты можно отнести к денатурации белка в процессе SDS-PAGE, что затрудняет дифференциацию между
специфической мономерной формой CSF и тетрамерной формой
, присутствующей в крови (38). Это различие потребует более
сложных методик (39), которые вряд ли станут рутинными процедурами
, но могут быть полезны в сложных ситуациях, например, в случае заражения крови.
Таким образом, мы обнаружили, что утечку спинномозговой жидкости при оторее или ринорею
всегда можно обнаружить путем идентификации изоформы трансферрина

2
.Хотя слюна, слезы и выделения
уха также проявляют микрогетерогенность трансферрина, профиль концентрации изоформ белка
отличается от
, обнаруженного в спинномозговой жидкости. Следовательно, CSF также может быть обнаружен в
смеси, содержащей эти жидкости и выделения. Представленный здесь метод
прост в применении и поэтому хорошо подходит для рутинных приложений. Хотя это на
больше времени, чем нефелометрический

-следовой тест,
наш анализ может быть особенно полезен для обнаружения
небольших количеств спинномозговой жидкости в выделениях из носа и уха, которые
могут выпасть. в диагностическую серую зону с помощью доступа nephelomet-
ric (35, 36).Тем не менее, наш метод разделяет
со всеми другими, основанными на иммунологических реакциях, и позволяет идентифицировать изоформу

2
в образцах
СМЖ, загрязненных кровью. В настоящее время все анализы для выявления отореи или ринореи CSF
проводятся с использованием поликлональной антисыворотки
, которая распознает все существующие генетические варианты трансферрина
. Следовательно, невозможно предсказать эффективность
, с которой данная поликлональная антисыворотка
будет обнаруживать различные антигенные эпитопы иммобилизованного, денатурированного
белка-мишени.С целью повышения специфичности нашего метода
, в настоящее время мы разрабатываем иммунологический анализ, основанный на реактивности моноклонального антитела
, направленного исключительно против

2
iso-
форма.
Мы благодарим профессора Дойшля (Отделение неврологии, Университетский университет
, Киль, Германия) за предоставление некоторых образцов CSF
. Мы также хотим поблагодарить А. Рёен и К. Клозе
за отличную техническую помощь.
Ссылки
1. Rouah E, Rogers BB, Buffone GJ. Анализ трансферрина методом иммуно-
фиксации как средство диагностики отореи спинномозговой жидкости.
Arch Pathol Lab Med 1987; 111: 756–7.
2. Reisinger PWM, Hochstrasser K. Диагностика спинномозговой фистулы по
на основе обнаружения трансферрина

2 с помощью полиакриламидного геля
электрофорез и иммуноблоттинг. Clin Chem Clin Biochem
1989; 27: 169–72.
3. Бленноу К., Фредман П. Обнаружение утечки спинномозговой жидкости с помощью изоэлектрического фокусирования
на полиакриламидных гелях с окрашиванием серебром
с использованием PhastSystem. Acta Neurochir (Wien) 1995; 136: 135–9.
4. Райалл Р.Г., Павлин М.К., Симпсон Д.А. Применение анализа

2-трансферрина
при обнаружении утечки спинномозговой жидкости после травмы головы
. J. Neurosurg 1992; 77: 737–9.
5. Оберашер Г., Аррер Э.Новый метод использования флуоресцеина
демонстрирует ото- и риноликворею. Арка Оториноларингол
1986; 243: 117–20.
6. Аррер Э., Оберашер Г., Гибиц Х. Дж. Распределение белков в перилимфе
. Acta Otolaryngol 1988; 106: 117–23.
7. Миддельверд М.Дж., де Вирес Н., Каллиоау Дж., Ван Кэмп Г.Дж. Новый биохимический анализ
в диагностике утечки мозгового вещества носа.
утечка броспинальной жидкости. Eur Arch Otorhinolaryngol 1995; 252:
336–9.
8. Зарет Д.Л., Моррисон Н., Гулбрансон Р., Керен Д.Ф. Иммунофиксация к
позволяет количественно определить

2 трансферрина в спинномозговой жидкости для обнаружения утечки
спинномозговой жидкости в результате травмы черепа. Clin Chem 1992; 38: 1908 —
12.
9. Huobore I, Huobore E, Pinoh CA. Открытие трансферрина у
беспозвоночных. Protides Biol Fluids 1984; 32: 59 — 61.
10. Aisen P, Leibman A, Reich HA. Исследования связывания железа с трансферрином
и кональбумином.J Biol Chem 1966; 24: 1666–71.
11. Fletcher J, Huehns ER. Значение связывания железа трансферрином
. Nature 1967; 215: 584 — 6.
12. Kallee E, Lohss F, Debiasi S. Иммунологическая демонстрация обратимого связывания
Fe
59
с трансферрином. Nucl Med 1963; 1: 111–8.
13. Ян Ф., Ламм Дж. Б., МакГилл Дж. Р., Мур С. М., Нейлор С. Л., ван Брагт PH,
и др. Трансферрин человека: характеристика кДНК и хромосомная локализация
.Proc Natl Acad Sci U S. A. 1984; 8: 2752–6.
14. McGillivray RTA, Mendez E, Shewal JG, Sinha SK, Lineback-Zins J,
Брю К. Первичная структура трансферрина сыворотки человека. Структуры
семи цианогенбромидных фрагментов и совокупность
полной структуры. Журнал биологии химии, 1983; 258: 3543–53.
15. Де Йонг Дж., Ван Дейк Дж. П., ван Эйк Г. Г.. Биология трансферрина. Clin
Chim Acta 1990; 190: 1–46.
16. Саиз А., Граус Ф., Далмау Дж., Пифарре А., Марин С., Толоса Е. и др.
Обнаружение белка головного мозга 14-3-3 в спинномозговой жидкости
пациентов с паранеопластическими неврологическими расстройствами. Энн Нейрол
1999; 46: 774-7.
17. Contini C, Fainardi E, Cultrera R, Seraceni S, Castellazzi M, Peyron
F, et al. Доказательства наличия свободных каппа-легких цепей в спинномозговой жидкости у
больных СПИДом с энцефалитом Toxoplasma gondii. J Neuroimmu-
номер 2000; 108: 221–6.
18. Нагамицу С., Мацуиси Т., Ямасита Ю., Ямада С., Като Х.
Экстрапонтинный миелинолиз с паркинсонизмом после быстрой коррекции
гипонатриемии: высокий уровень гомованилиновой кислоты в спинномозговой жидкости
и успешное дофаминергическое лечение. Нейронная передача
1999; 106: 949–53.
19. Меурман О.Н., Ирьяла К., Суонпаа Дж., Лоран Б. Новый метод
идентификации утечки спинномозговой жидкости. Acta Otolaryngol
1979; 87: 366–9.
20. Laemmli UK. Расщепление структурных белков при сборке
головки бактериофага Т4.Nature 1970; 227: 680–6.
21. Grunewald S, Huyben K, de Jong JG, Smeitink JA, Rubio E, Boers
GH, et al. Бета-следовые белки в спинномозговой жидкости человека: диагностический маркер
дефектов N-гликозилирования в головном мозге. Biochim
Biophys Acta 1999; 1455: 54 — 60.
22. Tumani H, Nau R, Felgenhauer K. Бета-следовые белки в спинномозговой жидкости
: оценка, связанная с барьером гемато-спинномозговой жидкости в неврологии
болезни. Энн Нейрол 1998; 44: 882–9.
23. Ямашима Т., Сакуда К., Тохма Й., Ямасита Дж., Ода Х., Ирикура Д.,
и др. Простагландин D-синтаза (

-следы) в человеческих паутинных клетках и
менингиомных клетках: роль клеточного маркера или в спинномозговой жидкости
абсорбция, канцерогенез и процесс кальцификации. J Neurosci
1997; 17: 2376–82.
24. Оберашер Г. Современная концепция диагностики спинномозговой жидкости
при ото- и ринорее. Ринология 1988; 26: 89–103.
25. Thalmann I, Kohut RI, Ryu JH, Thalmann R. Двумерный электрофорез с высоким разрешением
: методика и возможность применения
для изучения заболеваний внутреннего уха. Am J Otol 1995; 16:
153–7.
Clinical Chemistry 51, No. 9, 2005 1709
Модуль электрофореза
Модуль электрофорезаКэрол Беннетт и Брайан Хардкасл
Лето 1995 г.
Введение
Обоснование модуля
учителя по всей стране выразили готовность участвовать в реструктуризации естественнонаучного образования.Уже много лет научное сообщество попросило нацию задуматься о потребность в ученых и научно-грамотных гражданах в нашем мир, управляемый технологиями. Сочетание меняющихся требований в нашем обществе и новые взгляды на преподавание и обучение привлек широкий круг заинтересованных сторон в сфере образования (педагогов, родители, общественные и бизнес-лидеры) к реализации что мы должны реформировать нашу систему образования.
Образование должно воспитывать у студентов врожденное любопытство, желание учиться и позволять им исследовать и понимать сложный взаимодействия в окружающем мире.Знание концепций и методы науки необходимы для подготовки студентов к полному участие в нашем разнообразном современном обществе. Научный грамотность является национальной целью, как указано в Project 2061, Наука для всех американцев и Америка 2000 .
Как указано в 1992 году Национальными учителями естественных наук. Текст ассоциации, The Content Core , типичный для США. научная программа препятствует настоящему обучению не только чрезмерный акцент на фактах, но по самой своей структуре, которая препятствует студентов от установления ценных связей между фактами.Самый научные программы в средних школах США организованы в то, что обычно называют «слоеным пирогом». Ясно, что как Как передает НГТА, настало время образовательного здания факты и слоеный пирог нужно разобрать. Акцент на фактах механического заучивания и трудностей, с которыми студенты сталкиваются в схватив теоретические соображения без знания опыт удерживает многих от продолжения в науке.
Вашингтонский государственный университет (WSU) при поддержке Национальный научный фонд разработал Институт Естественнонаучное и математическое образование через инженерное дело Опыт.Цель которого — пригласить к сотрудничеству учителя средней школы в области инженерии. Работая с профессора и аспиранты преподавателей WSU получат понимание и оценка области инженерии, в то время как формулировка занятий для класса, иллюстрирующих связь между разработкой и реальным применением. Этот проект согласовывается с текущими усилиями по увеличению естественнонаучная и математическая грамотность по всей территории Соединенных Штатов.
Представленный модуль является результатом работы, проделанной в области химии. инженер в Университете штата Вашингтон с доктором Корнелиусом Айвори и доктор Кван Хи Ким. Проект ориентирован на биохимические разделения с использованием электрофореза в агарозном и полиакриламидном геле. Основные области применения — биологические и биохимические. исследования, химия белков, фармакология, судебная медицина, клинические исследования, ветеринария, а также контроль пищевых продуктов как молекулярная биология.
Биотехнология
Биотехнология — это применение данных и методов техника и технологии для исследования и решения проблем относительно живых организмов. Одна область, которая приобретает много признание — идентификация неизвестных белков с помощью различных молекулярные свойства. В большинстве случаев молекулы различаются относительно размера, веса, конфигурации или чистого электрического заряда. Электрофорез, гель-фильтрационная хроматография и тонкослойная хроматография (ТСХ) — это методы, которые работают, используя преимущества тонких различий в этих свойствах.
Электрофорез
Электрофорез — это процесс измерения миграции ионы в электрическом поле. Это достигается путем размещения пары электродов в водном растворе белка или аминокислоты. Один из типов электрофоретического разделения называется изоэлектрическим. фокусировка или ИЭФ. Изоэлектрическая фокусировка происходит в pH градиент и может использоваться только для амфотерных веществ, таких как пептиды и белки. PH, при котором аминокислота имеет чистую заряд нуля называется изоэлектрической точкой .Этот pH равен учитывая символ pI. В этой ячейке анионы мигрируют в сторону анод, а катионы мигрируют к катоду. На его изоэлектрической точка, аминокислота не перемещается ни к одному из электродов в ячейка для электрофореза. Изоэлектрическая точка данной аминокислоты кислота — физическая константа.
Тип электрофоретического разделения, продемонстрированный в модуль называется зонным электрофорезом. В этом процессе гомогенная буферная система используется в течение всего времени разделения и диапазон, обеспечивающий постоянное значение pH.Расстояние покрыты в течение определенного срока, являются мерой электрофоретическая подвижность различных веществ.
Понимание кислотно-основного поведения аминокислот и также белков, важен по двум причинам. Во-первых, это помогает нам, чтобы понять растворимость этих молекул как функцию pH. Хотя аминокислоты обычно хорошо растворяются в воде, растворимость минимальна в изоэлектрической точке. Кристаллизовать аминокислота или белок, pH водного раствора составляет доводится до pI, и вещество осаждается, фильтруется, и собрал.Этот процесс известен как изоэлектрический. осадки. Во-вторых, знание изоэлектрических точек позволяет нам прогнозировать, каким образом компоненты смесей аминокислот или белки мигрируют в электрическом поле.
Электрофоретическое разделение можно проводить с использованием различных сред. При бумажном электрофорезе бумажная полоска, пропитанная с водным буфером заданного pH служит мостиком между двумя электродными камерами. Образец аминокислоты или белок наносится как пятно.Когда электрический потенциал наносится на электродные камеры, аминокислота или белок молекулы мигрируют к электроду, несущему противоположный плата. Молекулы с высокой плотностью заряда движутся быстрее чем с низкой плотностью заряда. Любая молекула уже в изоэлектрическая точка остается в начале координат. После расставания готово, полоска просушена. В случае бумаги электрофорез, бумага опрыскивается красителем, чтобы отдельные компоненты видны.Краситель, который чаще всего используется для аминокислоты — нингидрин.
Электрофоретическое разделение можно также проводить с использованием крахмала, агар, некоторые пластмассы и ацетат целлюлозы в качестве твердых носителей. Этот метод чрезвычайно важен в биохимических исследованиях, а также бесценный инструмент в клинической химии. лаборатория. В 1949 году Линус Полинг сделал открытие, открывшее путь к пониманию серповидноклеточной анемии в молекулярный уровень. Он заметил, что существует значительный разница между нормальным взрослым гемоглобином (Hb A) и серповидно-клеточным гемоглобин (Hb S).При pH 6,9 Hb A имеет чистый отрицательный заряд и Hb S имеет чистый положительный заряд и при электрофорезе при этом pH Hb A движется к положительному электроду, а Hb S — к положительному электроду. отрицательный электрод.
Секвенирование ДНК или считывание последовательности оснований ДНК вдоль его длина, теперь может быть достигнута. При секвенировании ДНК радиоактивная метка добавляется к одноцепочечной ДНК. ДНК разделены на четыре группы, которые подвергаются разным химическим воздействиям. лечения.Химическая обработка разбивает ДНК на части что при разделении показывает положение баз на оригинальная прядь. Кусочки ДНК разделяются утилизацией электрофоретической техники.
ДНК-дактилоскопия набирает популярность во время последнего три года. Снятие отпечатков пальцев ДНК использует тот факт, что большие части человеческого генома состоят из повторяющихся последовательности различной длины, не кодирующие белки.
ДНК-дактилоскопия работает путем взятия небольшого образца ДНК человека который был разрезан рестрикционным ферментом. Результирующий фрагменты разделяются по размеру в процессе электрофорез. Полосы, полученные при использовании электрофореза затем сравниваются и измеряются с любым другим человеком в мир.
Голы
Общие цели
Первая цель этого модуля — предоставить студентам серия развивающих занятий, которые дадут им опыт при разделении различных растворов с помощью электрофореза.Вторая цель модуля — предоставить студентам практика в применении информации в реальном мире настройка, генерация и анализ данных, синтез и разработка альтернативного протокола, а также группового и самостоятельного оценка исследовательского опыта.
Цели обучения учащихся
К концу этого модуля студенты должны уметь:
- Используйте микропипетку и измеряйте объемы в микролитры.
- Установите аппарат, который будет разделять раствор на электрофорез.
- График и прогноз молекулярной массы неизвестного белки / аминокислоты или наоборот, используя график программа.
- Анализировать образцы белков / аминокислот в зависимости от заряда и миграция, пройденное расстояние и молекулярный вес с использованием гель-электрофорез.
- Сравните и сопоставьте использование хроматографии и электрофорез как метод разделения вещества.
Брайан Хардкасл
Средняя школа Ривер-Ридж,
8929 Martin Way E.
Лэйси, Вашингтон 98516
(360) 493-9604
Кэрол Беннет
Средняя школа Gaither,
16200 N. Dale Mabry Hwy
Тампа, Флорида 33618
(813) 975-7340
Гель-электрофорез
Аннотация
Электрофорез применяется в биологии, биохимии. исследования, химия белков, фармакология, судебная медицина, клинические исследования, ветеринария и качество пищевых продуктов контроль.Арне Тизелиус получил Нобелевскую премию в 1948 году за разработка этой техники подвижных граничных систем для разделение электрофорезом в 1939 г.
Под действием электрического поля заряженные частицы мигрируют к противоположно заряженному электроду. Из-за различных заряд и масса разных молекул движутся с разной скоростью и разделены на фракции. Подвижность — характеристика параметра каждой заряженной молекулы и зависит от pK стоимость заряженной группы и ее размер.На него влияет тип молекулы, концентрация, pH раствора, температура и напряженность поля, а также характер материала подложки. во время электрофореза. Буферы используются для обеспечения постоянного pH. Буферные ионы переносятся так же, как и другие ионы, поэтому буферные концентрации относительно велики по сравнению с материалы разделены. т.е. буферы могут быть 0,1 М, тогда как только 10 мкг белок используется. Поскольку относительная подвижность каждого вещества зависит от многих переменных, расстояние миграции равно по сравнению со стандартом, который используется в том же экспериментальном бег.
В настоящее время в качестве поддерживающей среды чаще всего используются гели. для электрофореза, хотя целлюлозные волокна или тонкие слои кремнезем. Их можно использовать в тонких капиллярных трубках. или в виде пленки на стеклянных или пластиковых пластинах. Есть три основных виды гель-электрофореза:
- Зональный электрофорез с использованием гомогенного буфера. Пройденное расстояние полностью зависит от молекулярной мобильность.Этот модуль демонстрирует этот медицинский сканер, который может отдельные красители, белки или пептиды, ДНК.
- Изотахофорез (ITP) с использованием прерывистого буфера система. Ионизированный образец перемещается между «быстрый» лидирующий электролит и «медленный» завершающий. Этот метод используется в количественный анализ и не будет рассматриваться в данном модуль.
- Изоэлектрическая фокусировка с использованием градиента pH.Этот метод используется только для амфотерных веществ, таких как пептиды и белки. Молекулы движутся навстречу электроды, пока они не достигнут части градиента pH где их чистый заряд равен нулю. Это изоэлектрический точки, и электрическое поле больше не влияет на молекула. Этот метод чаще всего используется в качественный анализ для разделения смесей веществ.
Этот модуль включает несколько экспериментов с использованием зонного геля. электрофорез.
- Используется 1% агарозный гель из-за его простоты препарата и нетоксичных характеристик. Гели агарозы может разделять молекулы размером более 10 нм. размер пор в эти гели имеют диапазон от 150 нм при 1% до 500 нм при 0,16%. Изменение размера пор позволяет разделить больший диапазон молекулярного размера. Поскольку агароза мутнеет в растворы> 1% обычно используется только при разделении белков с высоким молекулярным весом в исследованиях или коммерческие приложения.Этот модуль знакомит с гелем сначала электрофорез с агарозными гелями и красителями, потому что его большей простоты приготовления, а затем приводит к большему количеству сложный материал с использованием полиакриламидных гелей.
- Разделители полиакриламидного геля, разработанные Raymond & Вайнтрауб в 1959 г. разрешил больший контроль размера пор за счет варьируя как сшивающий агент между акриламидные цепи и варьируя соотношение катализатора.Акриламид в больших количествах: сшивающий агент производит меньшие размеры пор и лучшее разделение более мелкие молекулы. Меньший размер пор также дает более резкие полосы молекул внутри геля. Полиакриламид гели имеют преимущество использования тонких гелей, которые позволяют более быстрое разделение, более четкие полосы, более быстрое окрашивание после отделения и лучшая эффективность окрашивания. Тем не мение, одно из возможных соображений, используемых в школах, заключается в том, что акриламид указан как нейтотоксин и, следовательно, должен быть бережно обрабатывается инструктором, который делает инвентарь препараты.
СПРАВОЧНАЯ ИНФОРМАЦИЯ:
Hames, B. D., & Rickwood, D. Editors. лари Электрофорез белка; Практический подход . 2-е изд., IRL Press, NY, 1990.
Westermeier, Reimer, Электрофорез в практике , VCH Publishers, Inc., Нью-Йорк, 1993.
Schultz, B. & Hutchinson, N. Фред Хатчинсон Рак Исследовательский центр, SEP Dye Tchr WN, сентябрь 1994 г.
Классная среда: химия средней школы, обычная или продвинутый
Размер группы зависит от активности, как указано в каждом разделе.
Обучающая стратегия
Представляем установку с использованием электролиза хлорида меди (II). Студенты должны работать в парах или поодиночке, так как это оборудование очень недорого. Ион меди + перемещается к катодному электроду и видно. Ионы хлорида перемещаются к аноду и хлору. можно почувствовать запах. Предложите учащимся решить задачу о том, как ионы могут быть замедлилось (с гелем). Перейти к концепции электрофорез с использованием гелей.Выявить студенческие прогнозы, о которых типы молекул будут перемещаться быстрее.
Перейти к приготовлению геля и электрофорезу с использованием красителей. Студенты достаточно хорошо владеют этой техникой, чтобы работать с ней. полиакриламидные гели. Деятельность с использованием микропипетки может быть вводили перед активностью геля с красителями или с белками. Студентам не обязательно использовать микропипетки с красителем.
Временной интервал:
Четыре 50-минутных урока с учетом предшествующей практики с микропипец, если деятельность прекращается электрофорезом красителя
День 1 — Знакомство с концепцией электрофореза через электролиз.
День 2 — Продемонстрируйте технику наливания геля. Студенты приготовьте агарозные растворы и разлейте гель на помеченные чашки. (Если время ограничено, приготовьте агарозу и согрейте в горячем водяная баня на плите.)
День 3 — Студенты устанавливают коробки с гелем, добавляют буфер, загружают лунки, проведите электрофорез и запишите результаты.
День 4 — Учащиеся сравнивают результаты и оценивают информацию.Обсудите вопросы анализа, возникшие в ходе эксперимента.
День 5 — (Необязательно) Симуляция класса для использования данных для определения молекулярной массы белков
Школы, продолжающие занятия с использованием полиакриламида гели и белки или ДНК относятся к временным рамкам в этом модуле раздел.
Введение в движение ионов в растворе, Электролиз
Аннотация
Когда через раствор пропускают электрический ток содержащих ионы (заряженные атомы), происходит электролиз.Эти ионы перемещаются к электродам и либо теряют электроны, либо получают электроны становятся нейтральными.
Материалы
0,2 M CuCl 2 , лист ацетата, аппарат для электролиза, 2 карандаша, аккумулятор на 9 вольт, зажим для аккумулятора и провод с изображением аллигатора зажимы на концах.
Протокол
- Добыть материалы и собрать электролизный аппарат.
- Присоедините зажим к аккумулятору.
- Подсоедините зажимы типа «крокодил» к одному концу каждого карандаш так, чтобы зажим соприкасался с графитовая точка, а не дерево.
- Налейте небольшую лужицу (около 1-1 1/2 дюйма) меди (II) хлорид на ацетатном листе.
- Вставьте электроды-карандаши в раствор, как показано на рисунке. как можно дальше друг от друга. Убедитесь, что графитовые точки в растворе. (Если острие карандаша сломалось, высушите и заточите.)
- Обратите внимание на любые изменения, происходящие на катоде. (- заряжен, черный провод) Ищите красноватые, коричневые отложения на один электрод.
- Обратите внимание на любые изменения, происходящие рядом с анодом. (+ заряжено, красный провод) ВНИМАТЕЛЬНО почувствуйте запах газа, выделяемого направляя пары к носу, и осторожно вдохните.
- Как только вы сделаете наблюдения, остановите электролиз вынув электроды из жидкости.
- Промойте электроды и вытрите их, прежде чем возвращаться к складской площади.
- Промойте раствор хлорида меди в канализацию и просушите ацетат.
Аналитический вопрос
- Какое вещество представляет собой красновато-коричневый налет на
катод?
- Почему ион Cu 2+ попал на этот электрод?
- Какое вещество вышло на аноде? Какой ион
ездил на этом электроде?
Добавочный номер
- Молекулы белка заряжаются в кислой или основной решения.Если белок становится + заряженным, что электрод будет ли он двигаться? Что, если это станет — вместо этого взимает плату?
- Ионы, такие как Cu 2+ и Cl 1- путешествуют очень быстро к электродам. Как бы скорость белки с молекулярной массой в тысячи сравнивают с ионом меди (II) и ионом хлорида?
- Ученые могут разделять белки аналогичным методом называется электрофорезом, потому что более тяжелые молекулы движутся медленнее и преодолевайте меньшее расстояние в заданном время.Метод, называемый «гель-электрофорезом». использует гелевую матрицу из длинных запутанных молекул. Это делает более крупным молекулам еще труднее путешествовать и помогает разделению. Следующим вашим занятием будет гель электрофорез. Посмотрите ссылку и посмотрите, как ДНК молекулы разделены.
ДЕЯТЕЛЬНОСТЬ ПО ПРАКТИКЕ MICROPIPET
Аннотация
Большинство разделений белков происходит в очень мелком масштабе и используют микроколичество жидкостей.Это требует от вас манипулирования портативный инструмент, называемый микропипеткой. Эта деятельность будет ознакомит вас с их использованием и даст быстрый способ проиллюстрируйте, правильно ли вы их используете.
Материалы:
Комплект с пеноблоком для пластиковых микроцентрифужных пробирок красного цвета, зеленый, синий и желтый пищевые красители, 4 пустые микроцентрифужные пробирки, пипетка наконечники, фильтровальная бумага, микропипетка
Протокол:
- Использование микропипетки
- Установка объема
- Посмотрите на микропипетку, чтобы определить диапазон громкости, 0.5 мкл — 10 мкл или 2 мкл — 20 uL
- Узнайте у своего инструктора, пипетка имеет настройку блокировки громкости. Если так, отпустите фиксатор, как показано.
- Поверните ручку управления, чтобы выбрать необходимый объем. ДВОЙНАЯ ПРОВЕРКА.
- Присоедините наконечник пипетки.
- Держите пипетку большим пальцем на кнопке разблокировки. и в вертикальном положении. НИКОГДА НЕ НАЛИВАЙТЕ ЖИДКОСТЬ БЕЗ НАКОНЕЧНИКА НА ПИПЕТКУ. НИКОГДА НЕ ЛАЙТ НАКОНЕЧНИК ДОБАВИТЬ ЖИДКОСТЬ.
- Заполнение:
- Нажмите кнопку управления до первая останавливаться.
- Погрузите наконечник дозатора на 2 мм в жидкость.
- Дайте кнопке управления скользить назад медленно .
- Выдвиньте наконечник по внутренней стороне контейнер.
- Вытрите все внешние капли с наконечника. тканью без ворса.
- Выдача
- Большой наконечник в жидкость.
- Медленно нажмите кнопку управления полностью для активации функции продувки.
- Извлечь наконечник.
- Установка объема
- Попрактикуйтесь в использовании пипетки с пробами воды, чтобы комфортно с ощущением остановки кнопки управления.
- Формирование четырех новых цветов:
- Поместите 3 мкл образца основных цветов красителя (красный, зеленый, синий и желтый) на фильтровальной бумаге и отметьте пятна карандашом.
- Используйте приведенную ниже таблицу, чтобы смешать требуемый мл
основные цвета в правильной чистой пустой микропробирке.
Красный Зеленый Синий Желтый бирюзовый 5 мкл 15 мкл Роза 15 мкл 5 мкл Оранжевый 6 мкл 14 мкл Шартрез 2 мкл 18 мкл - Смешайте все красители в одну каплю внизу каждой микропробирки.(Используйте вихревой миксер или очистите, пластиковая зубочистка)
- Поместите образец смешанных цветов объемом 3 мкл на тот же кусок фильтровальной бумаги, на который вы положили основные цвета.
- Очистить.
- Промойте микроцентрифужную пробирку смесью . цвета (бирюзовый, розовый, оранжевый и шартрез) дистиллированной водой.
- Заменить чистые пробирки в комплекте для следующей группы.
- Очистить территорию.
- Замените микропипетку, как показано. По вашему инструктор.
- Прикрепите фильтровальную бумагу к листу бумаги с помощью имя и дата выставления оценок.
Вопросы для анализа:
- Сравните размеры пятен на фильтровальной бумаге.В размеры пятен должны быть одинаковыми, если ваша техника верно.
- Сравните цвета, производимые для бирюзового, розового, оранжевого и шартрез со стандартом. Это также указывает на вашу способность следовать указаниям и обращаться с микропипеткой правильно.
Как сделать гелевую пластину
Аннотация
Электрофорез включает заряженные молекулы, движущиеся в геле. матрица запутанных молекул.В этом случае гель представляет собой агарозный гель. производное от водорослей. Подготовьте гель, отмерив количество твердого вещества и добавление его в буферный раствор. После нагрева до растворить твердое вещество, необходимое для наливания горячей жидкости в стакан планшет, а затем сформируйте в геле небольшие прорези, называемые лунками. Гель затвердеет и может быть использован завтра.
Материалы
Весысантиграммов, весы для лодок или бумаги, порошок агарозы, 1X Буфер TAE, градуировка, микроволновая печь или электрическая плита, горячие перчатки, стакан стержень для перемешивания, стакан или колба 125 мл, защитные очки, 5 «x 5» стеклянный планшет, гребешок для формирования лунок, небольшое количество буфера
Протокол
- Добавить 0.50 г твердого порошка агарозы на 50 мл буфера в химическом стакане или колбу.
- Нагрейте до растворения всех частиц — около 30 сек. до 1 минуты после закипания раствора удалить все газ. (Используйте плиту или микроволновую печь.) При использовании микроволновой печи нагревайте сначала 45 секунд, затем нагревайте с шагом 10 секунд во избежание закипания жидкости.
- Держите колбу на водяной бане 60 o C до готовности. для использования.
- Этикетка на нижней стороне стеклянной пластины для идентификации. Место стеклянная пластина на ровной поверхности этикеткой вниз.
- Используя стеклянную палочку для перемешивания в качестве направляющей, осторожно налейте горячий раствор агарозы вниз стержнем так, чтобы гель располагался сначала по внешним краям. Заполните центр в последнюю очередь. В гель на краю остывает первым, а поверхностное натяжение позволяет больше геля в середине. Если вы не будете осторожны, гель будет стекать стекло.Если вы попали в аварию, позвольте слегка остудить и соскоблить. Поместите гель обратно в стакан. и повторно нагреть.
- Немедленно поместите гребешок в гель примерно на полпути от один конец. Используйте диаграмму на листе отделения красителя в качестве руководство.
- Дайте гелю застыть 10 мин. Добавьте несколько мл буфера на поверхность затвердевшего геля и аккуратно снимите гребешок с одного стороной вперед и держите гребень под наклоном.
- Хранить в контейнере или сумке Ziploc для использования завтра в качестве направлен.
Разделение молекул красителя с помощью геля Электрофорез
Аннотация:
В этом мероприятии несколько биологических красителей будут помещены в гель. лунки и разделены с помощью гель-электрофореза. Красители заряжен и будет двигаться либо к катоду, либо к аноду на разные скорости. Таким образом, смесь красителей можно идентифицировать, если по сравнению с образцами окраски отдельных красителей.
Материалы: на группу из 4 человек
| бокс для электрофореза | блок питания (делится на 2 группы) |
| Планшет с 1% агарозным гелем, приготовленный вчера | 200 мл 1X TAE-буфера |
| маркер и лист ацетата | промокательная бумага |
| pH-бумага | мм линейка |
| образец красителя | пластиковая пленка |
| наконечники для микропипеток и микропипетки или микропипетки Beral пипетка |
| А.Образцы красителя для прогона | ИЛИ | B. Образцы красителей для испытаний |
| 1. бромфеноловый синий | 1. бромкрезоловый зеленый | |
| 2. метиленовый синий | 2. кристально-фиолетовый | |
| 3. Оранжевый G | 3.флуороцен | |
| 4. красный пищевой краситель | 4. красный пищевой краситель | |
| 5. синий пищевой краситель | 5. синий пищевой краситель | |
| 6. зеленый пищевой краситель | 6. зеленый пищевой краситель | |
| 7. желтый пищевой краситель | 7.желтый пищевой краситель | |
| 8. смесь красителей или натуральный краситель | 8. смесь красителей или натуральных красителей |
Протокол
- Установите прибор для электрофореза рядом с источником питания, как
показывает инструктор.
- Измерьте pH буфера TAE
- Добавить 1X TAE буфер в лунки с буфером
- Получите приготовленный гель.Осторожно выдвиньте его из Сумку Ziploc и поместите на место в аппарат для электрофореза, предложенный вашим инструктор.
- Получите образцы красителей
- Получите образцы красителей для вашей группы с помощью пипетки 20 мкл каждого красителя из класса поставляются в маркированная соответствующим образом микропробирка. Это от 15 мкл до нагрузка в колодец плюс немного доп.
- Использование микропипетки со специальным наконечником для загрузки или микропипеткой Beral добавьте небольшие образцы (около 15 мкл) в каждую прорезь геля.
- В таблице данных внимательно запишите, какой краситель в каком слоте.
- Если у вас есть коммерческий электрофорез
аппарата, переходите к шагу 5.
Если у вас некоммерческий аппарат, сделайте следующее:- Положите два бумажных полотенца толщиной так, чтобы один конец задрапирован на краю гель, а другой погружается в буфер хорошо.Это сделает электрический связь между ними. Повторите на обратная сторона геля. См. Диаграмму ниже
- Дважды проверьте буферный раствор, чтобы уверен, что расстояние очень мало (менее 2 дюймов) между верхом поверхность раствора и пластина геля. При необходимости добавьте еще раствора.
- Когда все образцы загружены, закройте крышку на коробку с гелем или используйте пластину из оргстекла, поставляемую в качестве крышка.
- Студенческие группы поделятся источниками питания. Соединять электроды к гелевой коробке и силовой питание, соединяющее красный к + и черный к -. Перемена на блоке питания и выставил его на 100 вольт.Проверять выход в миллиамперах. Электрофорез 10 мин. общий.
- Наблюдать и записывать изменения положения красителя в гель через 5 минут в вашем техническом паспорте.
- Примерно через 10 минут выключит питание. Отключите
электроды и откройте коробку с гелем.
- Измерьте pH буфера на каждом конце коробки.
- Извлеките гелевую деку и гель.Поместите их на лабораторном столе на полиэтиленовой пленке, стирание лишнего буфера.
- Запишите свои наблюдения на основе ваших данных стол.
- Сделайте постоянный учет своего геля, выполнив ONE из следующих.
- Положите кусок ацетатного листа поверх гель.Используя перманентный маркер, отметьте лунки и каждое пятно краски. Примечание + и — заканчиваются.
- Положите лист промокательной бумаги поверх гель и нажмите прямо вниз примерно на 5 сек. Краситель перейдет из геля в промокательная бумага.
- Поместите гель в пластиковый пакет Ziploc, чтобы сушка.
- Измерьте расстояние, на котором каждый образец красителя ездил на геле. Вы можете использовать ацетат лист или гель для этого. Измерьте в мм от нижний край лунки до центра красителя пятно, место. Запишите данные.
- Замените оборудование, как указано. Не выбрасывайте буфер. Поместите в контейнер с надписью «Б / У буфер »для повторного использования в следующем периоде.
Отчет лаборатории красителей для гель-электрофореза
Имя ________________________
Аккуратно запишите все данные чернилами.
| Образец № | Краситель | Расстояние Поехали (мм) | Кому полюс (+ или -) | Наблюдения |
| 1 | ||||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 | ||||
| 7 | ||||
| 8 |
| Данные pH | Черный конец (-) | Красный конец (+) |
| pH перед прогоном геля | ||
| pH после прогона геля |
Аналитические вопросы
- Запишите наблюдения геля через 5 минут после электрофорез.
- Нарисуйте точную иллюстрацию результатов геля на назад.
- К какому электроду было сделано большее количество образцов запустить?
- Сравните результаты окрашивания пищевых продуктов с результатами другой группы. Был расстояние одинаковое для разных марок красного пищевой краситель? Предложите причину.
- Какие красители состояли из более чем одного пигмент?
- Если ваша группа работала со смесью, какие красители были в образец? Приведите доказательства, подтверждающие ваш ответ.
- Какие молекулярные свойства использовал гель электрофорез для разделения молекул?
- Если вас попросили улучшить разделение этих красители, какие переменные вы можете изменить в ваш эксперимент?
| Группа А После электрофореза Отрицательный полюс | Группа B После электрофореза Отрицательный полюс |
Определение молекулярной массы Неизвестный белок
Аннотация
Белки перемещаются через гели во время электрофореза при различных скорости, потому что они имеют разную молекулярную массу.Это было установлено, что по мере прохождения белков через гели расстояние проходимость данного белка пропорциональна логарифму 10 молекулярной массы. Это линейная зависимость, но более тяжелые белки проходят гораздо меньшее расстояние.
Каждый раз, когда ученый проводит гель-электрофорез на белков он / она использует стандартную смесь, которая называется «маркер». Молекулярный вес белков в этом смеси известны и могут использоваться для определения веса для неизвестные образцы.Когда даны данные для белков известного веса в стандарте вы сможете определить молекулярную массу неизвестного после того, как вы построите график данных и используете их для создания интерполяции.
Материалы:
миллиметровая бумага, прямая кромка, калькулятор
| Белок | Мол. Вес, г Дальтон | Лог 10 Мол. Вес | Пройденное расстояние, см |
| Миозин | 201 000 | 0.58 | |
| бета-галактозидаза | 134 000 | 0,82 | |
| Бычий сывороточный альбумин | 81 000 | 1,14 | |
| Карбоангидраза | 41 500 | 1,53 | |
| Ингибитор трипсина сои | 31 800 | 1.70 | |
| лизоцим | 17 900 912 32 | 2,05 | |
| Апротинин | 7,700 | 2,55 | |
| Цитохром C | 2,32 | ||
| Гемоглобин | 4.36 |
Протокол
- Определите log 10 молекулярной массы белки, входящие в стандартную смесь.
- Изобразите данные аккуратно на миллиметровой бумаге.
- Логарифм 10 молекулярной массы равен традиционно наносится на ось Y и пройденное расстояние по оси X.
- Планируйте приращения по каждой оси для распределения переменных на графике как можно больше.
- Когда точки расставлены правильно, соедините их с прямой « best fit » строку, которую вы можете предоставить с этими данными. Линия должен пройти через происхождение.
- Используя эту строку, определите журнал 10 молекулярная масса белка с учетом расстояния путешествовал.
- Рассчитайте молекулярную массу каждого белка, найдя антилог этих значений.
- Найдите правильный молекулярный вес и определите свой процентная ошибка.
Разделение белков
Использование полиакриламидного геля
Электрофорез
Аннотация:
Полиакриламидные гели впервые были использованы для электрофореза в 1959. Они химически инертны и механически стабильны. К химическая сополимеризация мономеров акриламида с сшивающий реагент прозрачный прозрачный гель, проявляющий очень получается небольшой электроосмос.Размер пор может быть точно и воспроизводимо контролируется общей концентрацией акриламида и степень сшивки.
Пробы белка пропускают через гель для укладки перед переход в бегущую гелевую фазу. В геле для укладки протеин концентрируется, потому что растворитель прерывается. Этот ступень концентрирования увеличивает полученное окончательное разрешение.
Студентам будет поручено сделать гель из определенной поры размер в зависимости от процентного содержания используемого полиакриламида (5% -15%).Калейдоскоп белка-маркера будет использоваться в качестве сравнение известных неизвестных белков. Студенты будут строить журнал молекулярной массы белков в зависимости от расстояния путешествовал (см.) в геле. На основе этой информации студенты будут определить на основе их графической информации молекулярную веса белков образцов.
После получения известных значений этих белков студенты будут вычислить их процентную ошибку и определить жизнеспособные источники ошибка.
В качестве расширения к этой лабораторной работе студентов попросят разработать градиентный гель, 5% -15%, для получения более полного разделение.
Стратегия обучения:
В этом упражнении учащиеся произведут разделения белков. с использованием пор разного размера. Эти гели будут размещены так, чтобы каждый студент может увидеть процентное содержание полиакриламида в сравнении с качеством и количество разделения. Затем студентам будет предложено сделать выводы из этих данных.Этот формат поддается управляемый индуктивный процесс расследования. Используя индуктивное исследование, процессы наблюдения, вывода, классификации, формулирования гипотезы и прогнозы все отточены или подкреплены опыты.
После завершения первой части лабораторной работы студенты будут вас попросят разработать систему, которая приведет к градиенту геля. Целью этого является постепенное уменьшение размера пор. для «улавливания» большего количества белков на протяжении всего разделения.В процесс, разработанный студентами, будет проанализирован для эффективность основана на разделении низкомолекулярных и высокомолекулярных весовые белки. Этот метод решения проблем подразумевает определенное степень свободы исследовать проблему и прийти к возможное решение.
Стандартные решения:
SOLUTION A — Акриламид-BIS, 30: 0,8; 300 грамм
акриламид + 8 граммов N’-N’-бисметиленакриламида.Макияж до
1000 мл с водой; Акриламид от Biorad.
РЕШЕНИЕ B —181,5 г Трис (Биорад) + 500
мл воды. Довести pH до 8,8 с помощью HCl. Составить до 1 литра с
вода (1,5М).
РЕШЕНИЕ C —10% SDS в воде. SDS от
Biorad.
РАСТВОР D —60 грамм Триса + 400 мл воды.
Довести pH примерно до 6,8 с помощью HCl. Довести до 1 литра водой
(0.5М).
РЕШЕНИЕ E —10% Персульфат аммония (AP)
сделано ежедневно.
Внимание !!! АКРИЛАМИД ЯВЛЯЕТСЯ МОЩНЫМ НЕЙРОТОКСИН. Избегайте вдыхания акриламидной пыли. Контакт с кожей с акриламидные растворы и пипетирование раствора акриламида должно быть
строго избегать !Электрофорез включает применение потенциально опасное напряжение в резервуарах с гелем и гелем.Никогда при прикосновении к какой-либо части установки для электрофореза после подачи тока на устройство.
Протокол:
Шаг 1: Определение времени гелеобразования
- Время гелеобразования для рабочего буфера и укладывающегося геля должно быть от 15 до 30 минут. Для этого возникает соотношение между полиакриламидным гелем и инициатор (TEMED) и сшивающий линкер (AP) должны быть определенный.Рекомендуется, чтобы инструктор предварительно определите подходящие соотношения. (ПОДСКАЗКА: в 40 мл гель мы добавили 50 мкл AP и 10 мкл TEMED)
Шаг 2: Запас геля для бега
- Ниже приводится общая формула приготовления 15% геля.
Все расчеты основаны на этих процентах с
Результирующий объем 40 мл.
Гель для бега 15%
Раствор A — 20 мл
Раствор B — 10 мл
Решение C—.4 мл
добавить воды в 40 мл
Шаг 3: Герметизация коробки с гелем (следующие инструкции
для вертикального контейнера с гелем) (см. «Электрофорез
Красители », представляющий пример горизонтального пробега)
- Соберите коробку с гелем с помощью распорок и зажимов.
- Количество геля, необходимое для герметизации коробки, зависит от габариты агрегата. В качестве общего руководства следующие применяется.Экстракт 10 мл. запаса геля для бега и разлить в колбу на 50 мл.
- Добавьте перекрестный линкер и инициатор в соответствующих соотношениях. (Для ускорения процесса запечатывания увеличение на 20% инициатор можно использовать)
- Лучший способ запечатать коробку — наклонить коробку с гелем. и налейте жидкий герметизирующий гель в основу. Можно также заклейте основу коробки, а затем заполните пространство между пластинами.Осторожность!! Есть возможность вытягивание геля при снятии ленты. Ты вероятно мог бы оставить это и все будет хорошо.
- После затвердевания дна коробки небольшой слой додецилсульфата натрия (SDS) может оставаться в верхней части гель-уплотнение. Просто слейте лишний SDS.
- Положите коробку на бок и закройте, следуя той же процедуре. в b и c. На этот раз введите гель-уплотнение между стеклянные тарелки.Примерно на 0,2 см выше распорки должно быть достаточно.
Шаг 4: Гель для бега
- Извлеките оставшиеся 10 мл рабочего геля и поместить в колбу на 50 мл.
- Добавить заранее определенные количества инициатора и катализатора, перемешать и обойтись. Заполните до точки, чтобы белки перемещаться через 1 см укладывающегося геля после того, как расческа вставлен. Дайте застыть.
Шаг 5: Укладочный гель
- Ниже приводится формула подготовки штабелирования. гель. Залейте гель для укладки только перед использованием (чтобы поддерживать градиент pH между штабелированием и работой гели): не забудьте перед заливка геля для укладки!
Укладочный гель
Решение A— 1.3 мл
Раствор D — 2,5 мл
Раствор C — 0,1 мл
Вода — 6,0 мл
AP — 0,1 мл
ТЕМЕД — 10 мкл
- Извлеките и распределите вышеуказанный рецепт для штабелирования гель в колбе на 50 мл. Смешайте и нанесите пипеткой гель для укладки. заполняя общий объем пространства между стеклянные тарелки.
- Вставьте гребешок, чтобы он затвердел.
Шаг 6: Подготовка образцов белка (См. Учителей руководство для образцов рекомендаций)
- Поместите 5 мг каждого белка в небольшую микропробирку.
- Добавьте 3,3 мл воды. Это будет ваше стандартное решение для каждый белок!
- Для каждого белка поместите 10 мкл исходного раствора + 10 мкл вода + 20 мкл (2x) GSB + 5 мкл B-меркаптоэтанола в микропробирка.
- Поместите микропробирки из «3» в кипящую воду на 2 минуты.
2x Буфер для образцов GSB-Gel
Раствор D ———————— 2,5 мл
Решение C ———————— 2.0 мл
Глицерин ————————- 2,0 мл
0,1% бромфенолового синего ——— 1,0 мл
Вода ————————— 2,3 мл
Развести образец, предпочтительно в воде, 1: 1 с 2x GSB. Добавьте бета-меркаптоэтанол до конечной концентрации 10%.
Шаг 7: Загрузка образцов и запуск геля
- Снимите гребешок.
- Заполните лунки бегущим буфером.При этом заполняем верхний и нижний резервуары с рабочим буфером.
- Внесите 15 мкл каждого образца в лунку. Убедись в
заменяйте наконечник дозатора после каждой загрузки. Заполните колодец
снизу вверх! * Не забудьте использовать маркер, который будет использоваться
метод сравнения. Калейдоскоп (Биорад) — хороший
маркер. (См. Диаграмму с указанием цвета полосы в зависимости от молекулярной массы.) Калейдоскоп
Protein Band Цвет ремешка Молекулярный вес Миозин Синий 201 000 B-галактозидаза пурпурный 134 000 Бычий сывороточный альбумин Зеленый 81 000 Карбоангидраза Фиолетовый 41 500 Ингибитор трипсина сои Оранжевый 31 800 лизоцим Красный 17 900 912 32 Апротинин Синий 7,700 - Подключите охлаждающие линии, если они есть.
- Присоедините электроды и запустите гель при 60 В (прибл. 40 миллиампер) через гель для укладки.
- Как только образцы начнут течь в текучий гель увеличиваем напряжение до 150 Вольт.
- Запускайте гель до тех пор, пока образцы не окажутся в пределах 2 мм от уплотнения. внизу коробки. Отключите питание. Отключить электроды. (Также отключите линии охлаждения, если в наличии)
Следующие шаги включают приготовление геля для
анализ данных.Рекомендуется вообще носить перчатки.
раз.
Шаг 8: Крепление геля
- Ниже приводится рецепт приготовления фиксирующего раствора.
Крепление Решение
200 мл этанола
40 мл уксусной кислоты
200 мл воды - Поместите гель в чашку из пирекса.
- Нанесите фиксирующий раствор на гель.
- Гель должен находиться в фиксирующем растворе 30 минут.
Шаг 9: Метод окрашивания гелем (с использованием кумасси синего)
- Ниже приводится рецепт окрашивания.
решение.
Окрашивающий раствор
1,1 г Кумасси Синий (Биорад)
200 мл метанола
40 мл HOAc
200 мл воды
(Вакуумный фильтр перед использованием)
Это решение можно использовать 5 раз, прежде чем выбросить - Поместите гель в пластину из пирекса.Добавьте красящий раствор пока гель не покроется.
- Время от времени волнуйтесь. Время окрашивания 30 минут.
Шаг 10: Удаление геля
- Ниже приводится рецепт обесцвечивания.
решение.
Раствор для обезвоживания
7,5% уксусная кислота
10% этанол - Удалите пятно с посуды, стараясь не сломать гель.
- Промойте гель один раз в деионизированной воде.
- Дестейн, добавив в блюдо 300 мл Дестейнинга Решение.
- При добавлении обесцвечивающего раствора белок полосы должны быть сразу видны. Это должно улучшить со временем.
- Destain 2x 30 минут.
Шаг 11: Гель для фотографирования
- Нанесите гель на кусок обертки Saran.Используйте белый фон, чтобы помочь в просмотре полос белка.
- Поместите линейку (шкала в сантиметрах) рядом с образцом и фотография.
- Если камера недоступна, попросите учащихся использовать график бумагу для описания результатов. (Убедитесь, что они следить за масштабом)
- Выбросьте обернутые гели Saran в корзину для мусора, когда завершенный.
Студенты должны построить график относительной мобильности по сравнению с бромфеноловый синий (RBPB) для каждого из меченых белков.Данные генерируются с самого начала работы геля. Студенты будут построить график зависимости RBPB от логарифма молекулярной массы для каждого белковый маркер. Молекулярная масса неизвестных полос белка затем можно определить. После определения студенты будут рассчитать процентную ошибку для известных значений белка группы. Затем студенты будут выполнять стандартную Процедура лабораторной презентации определяется следующим: ( учащиеся должны иметь 10% -15% известных значений их расчетные молекулярные массы)
Вопросы
- В чем преимущество полиакриламидного геля электрофорез с использованием агарозных гелей? Список два факторы.
- Как определяется процентное содержание полиакриламида в вашем геле? сравнить с другими, использующими те же самые и разные проценты (с точки зрения качества и количества протеина разделение)?
- Какой процент полиакриламида оказался лучшим? использовались при разделении?
- Разработайте эксперимент, который покажет больший диапазон разделения. Будьте готовы изложить свою гипотезу.
Выводы
- Резюме лабораторного опыта: выделите электрофоретическое средство техника использованная
- Объяснение наблюдений: на основе ваших исследований и общие научные знания объясните, что указано в вашем качественное резюме.
- Источники ошибок: перечислите три возможных источника ошибок в вашу лабораторию и как они повлияют на результат.
Анализ данных и расширение
После обсуждения результатов в классе концепция использования линейный градиент будет генерироваться динамически или воронкообразным учителем.Студентам будут выданы два шприца объемом 10 см3, различные трубки, зажимы и т. д., необходимые для создания линейного градиента гель. Студентам также будет предоставлен отрывок из статьи Electrophoresis. in Practice Райнера Вестермайера (1993), обобщающего эффект от использования линейного градиента.
После тестирования своей системы группы будут вывешивать свои результаты. Затем последует групповая презентация, где каждая группа объяснит их система и результаты. Каждый член группы будет назначен конкретный раздел презентации: (1) Обсуждение дизайна; (2) Представление данных; (3) Сравнение данных с априорные нелинейные градиенты; и (4) Источники ошибок, а также выделение областей улучшения дизайна.
Руководство для учителя
для
Разделение белков
Использование полиакриламидного геля
Электрофорез
Ответов на текстовые вопросы:
- (a) Легче последовательно регулировать размер пор с полакриламидными гелями, (б) Лучшее применение градиентные гели с полиакриламидными гелями. * Студенты могут иметь множество ответов, касающихся их лаборатории последовательность тоже.
- Студенты заметят, что оптимальный процент полиакриламидный гель зависит от молекулярной веса использованных белков.
- Зависит от данных
- Сгенерировано студентом
В применяемой здесь электрофоретической технике используются полиакриламидные гели. Этот метод использует различия в размер молекулы и заряд для целей разделения.Гель компоненты не заряжаются и могут изменяться известным способом для производят гели с различными размерами пор. Эффективная пора радиус 0,5-3,0 нм можно получить, регулируя общий концентрация акриламида и концентрация сшивки реагент в смеси для полимеризации. Сшивающие агенты прочие чем BIS / акриламид, которые имеют преимущество что они могут быть включены в гель, а затем сшивающие связи легко разрушаются.Таким образом, можно повторно растворить часть геля, содержащую макромолекулу интерес.
Гелеобразование происходит медленнее при более низких значениях pH, поскольку свободная форма основания требуется, чтобы катализировать реакцию. Скорость полимеризации сильно зависит от температуры, поэтому температура должна поддерживаться постоянной.
Электрофорез белков
Поскольку белки амфотерные, pH электрофореза
систему следует выбирать с учетом изоэлектрических точек
белки, которые необходимо разделить.
В системе электрофореза в этом эксперименте используется детергент, додецилсульфат натрия (SDS). Система SDS включает концентрирование образцов белка в очень тонкие слои с помощью прерывистый градиент напряжения, а затем электрофорез на колонка из полиакриламидного геля. Шаг концентрации увеличивает получено окончательное разрешение.
Принципы электрофореза
Белок концентрируется, потому что растворитель
прерывистый.Растворы хлорида и глицина
электрофоретически последовательно. Движение ионов (ток)
должны быть одинаковыми во всей системе. При подаче напряжения
глицин и хлорид будут двигаться к положительному электроду.
Эта стадия концентрирования называется «укладкой» и происходит
в верхнем геле.
Трекинговый краситель добавлен к белку или верхнему буферу. перед электрофорезом. Обладает подвижностью, зависящей от pH в этой области и является промежуточным между хлором и глицин.Принято указывать на относительную подвижность вещества на геле как отношение расстояния, пройденного вещество, которое перемещается следящим красителем.
Ссылки: Freidfelder, pp 211-234
Оригинальная литература: Шапиро, Виннела и Майзель
Ссылки: Comm. 28 , 815 (1967)
Электрофорез ДНК с использованием агарозного геля
(Понимание роли рестрикционных ферментов)
Аннотация:
Электрофорез в агарозе — стандартный метод разделения, идентификация и очистка фрагментов ДНК и РНК.Для разделения нуклеиновых кислот используются горизонтальные гели: агарозный гель лежит прямо в буфере. Это предотвращает гель от высыхания. Гели окрашиваются бромистым этидием и полосы видны в УФ-свете.
Используя белки, называемые рестрикционными ферментами, гены можно разрезать на специфические последовательности ДНК. Более 75 различных видов рестрикционные ферменты известны, и каждый из них «распознает» и разрезает ДНК по определенной последовательности.В точность этих ферментов поразительна. Они не будут резать последовательность, отличная от той, которую они распознают, даже если пять из шесть пар оснований идентичны их сайту узнавания. Рестрикционные ферменты позволяют разрезать ДНК на фрагменты. которые можно изолировать, разделить и проанализировать.
Стратегия обучения:
Совместное обучение увеличивает достижения, стимулирует когнитивное развитие, способствует активному обучению, увеличивает чувство собственного достоинства и способствует положительному отношению к школе.Бизнес и промышленность все чаще требуют, чтобы люди работали вместе в производственных командах или в группах по решению проблем. Поэтому важно научиться эффективно работать в группе; совместные группы по решению проблем в химической лаборатории помогают студенты развивают и оттачивают свои навыки.
Студенты будут работать в лабораторных группах по два человека. После завершения они будут координировать представление данных, как описано в выводы, с другой командой.Презентации студентов будут оценивается на основе балльной оценки выпускного проекта по рубрике используется в средней школе Ривер-Ридж, Лейси, Вашингтон.
* Компании продают предварительно вырезанную ДНК из ассортимента рестрикционные ферменты. Их можно купить, чтобы сэкономить на подготовке. время!
Протокол:
Шаг 1: Тарелок LB и бульон
- Смешать в колбе на 1000 мл (растворять не нужно) следующие вещества; 5 г триптона, 2.5 г дрожжей Экстракт, 5 г NaCl, 7,5 г агара, 500 мл воды.
- Автоклав с медленным выхлопом на 30 минут.
- Охладите 15 минут.
- Добавьте 500 мкл ампициллина.
- Залейте тарелки.
- Подожгите пузыри.
- После застывания пластин просушите крышки салфеткой. комната для культивирования с вентилятором и бактерицидной лампой.
- Для приготовления бульона LB без агара и автоклава все 30 минут на медленном выхлопе.
- Разлить по 100 мл виалам и снова автоклавировать.
Шаг 2: Выращивание культур
- Добавьте 100 мкл ампициллина к 100 мл LB.
- Внесите пипеткой по 5 мл LB в каждую культуральную пробирку и засевайте.
- Вырастите ночью в теплой комнате на шейкере.
- Храните оставшиеся LB в холодильнике.
Шаг 3: Мини-подготовка образцов
- Вращение вниз 1.5 мл культуры в течение 30 секунд при прибл. 32000 об. / Мин. Удалите и слейте жидкость.
- суспендировать бактериальный осадок в 150 микролитрах STET (2x) и 150 мкл стерильной воды путем нанесения жидкость вверх и вниз по пипетке. Тритон — это моющее средство, разрушающее липидный слой, составляющий внешняя мембрана. Помещая клетки в сахарозу с высоким содержанием окружающей среды поток жидкости в ячейке идет из внутренней к внешнему созданию механического напряжения.В конце концов, из-за при увеличении напряжения внутренняя стенка клетки разрывается.
- Добавьте десять микролитров лизоцима (20 мг / мл) и кипятите 45 минут. секунд. Лизоцим переваривает углеводную мембрану (пептидогликан).
- Центрифуга пять минут (32 000 об / мин) при комнатной температуре. ДНК и РНК образуют осадок.
- Пометьте новый набор пробирок и пипетку 300 мкл изопропанол в каждую пробирку.
- Удалите жидкость из ‘4’ и внесите пипеткой в пробирки. содержащий изопропанол. Переверните пробирку, чтобы перемешать. В изопропанол вызывает осаждение ДНК и РНК из раствора.
- Центрифуга десять минут (достаточно комнатной температуры, но более холодные вращения имеют тенденцию давать лучшие результаты) при 32000 об / мин. Слить жидкость.
- Добавьте 750 мкл холодного 70% этанола. Обратить на полоскание гранулы.Центрифуга в течение пяти минут (32000 об / мин).
- Сушите гранулы в быстросъемном пылесосе в течение 10-15 минут. Если не доступен оставьте образец в вытяжном шкафу на ночь.
- Развести осадок в 50 микролитрах стерильной воды. Перемешайте, набрав раствор в пипетку и дозирование. (Слишком большое перемешивание пипеткой приведет к срезанию ДНК) Этот раствор представляет собой непереваренный ДНК.
Шаг 4: Расщепление ДНК с использованием рестрикционного фермента
- Возьмите микропробирку и нанесите десять микролитров непереваренная ДНК.Добавьте два микролитра универсального буфера, два микролитра HindIII, EcoRI или другого ограничения фермент в микропробирку. На короткое время центрифугировать, чтобы смешать содержимое. Этот раствор представляет собой переваренный ДНК. (См. «Рекомендуемую таблицу дозирования. Образцы »в качестве ориентира)
Шаг 5: Подготовка агарозного геля
- Приготовьте 1% раствор агарозы.Для небольшой гелевой смеси 0,5 г агароза в 49,5 мл буфера ТАЕ. Для большего двойного геля количества.
- Разогреть в микроволновой печи буферный раствор агарозы / TAE в колбе. покрытые сарановой пленкой до полного растворения (начать с 1,5 минут на максимуме).
- Перелейте раствор в лоток для геля. (Вы можете записать края лотка для геля, чтобы гель стал гуще). вставьте расческу.
- Дать застыть (прибл.30 минут), затем снимите гребешок.
- Поместите в буферный ящик. Убедитесь, что гель слегка покрыт буфером.
- Извлечь десять микролитров раствора, содержащего ДНК, воду и буфер для образцов геля из образца (см. справочную таблицу для данных). Загрузите образцы в лунки.
- Присоедините катод (отрицательный электрод) к боковой стороне ящик, ближайший к колодцам.
- Запустите гель при 100 вольт в течение одного часа или пока краситель не станет примерно 2/3 геля.
Предлагаемый стол для дозирования образцов
| ПУТЬ на геле | Трубка с маркировкой | Образец | Образец (объем) | Вода | GSB (5X) | 10 микролитров |
| 1 | 1 | неразрезанная ДНК | 5 мкл | 3 мкл | 2 мкл | 10 мкл |
| 2 | 2 | разрезанная ДНК + EcoR1 | 5 мкл | 3 мкл | 2 мкл | 10 мкл |
| 3 | 3 | разрезанная ДНК + HindIII | 5 мкл | 3 мкл | 2 мкл | 10 мкл |
| 4 | 4 | разрезанная ДНК + неизвестно r.е. | 5 мкл | 3 мкл | 2 мкл | 10 мкл |
| 5 | 5 | разрезанная ДНК + смесь 2 ферментов | 5 мкл 2,5×2 | 3 мкл | 2 мкл | 10 мкл |
| 6 | 6 | 1 Кб ДНК-лестница | 5 мкл | 3 мкл | 2 мкл | 10 мкл |
Шаг 6: Протокол окрашивания / обесцвечивания
- Окрашивайте гель в бромистом этидии примерно на пять минут.
- Дестин в воде (или TAE, если гель будет использоваться повторно).
- Фотогель в УФ-свете рядом с линейкой (5.6, второй).
Концентрации раствора:
Буфер TBE (10x) 1 л
108 г Трис
55 г борной кислоты
50 мл 0,5 М ЭДТА
Смешайте все в колбе Эрленмейера с мешалкой. Автоклав.
DEPC h3O 2L
2 л наночистой воды
100 мкл DEPC
Перемешать и автоклавировать.
STET (2x) 100 мл
16% глюкозы или сахарозы (32 мл 50%)
100 мМ Tris-Cl pH8 (10 мл 1M)
100 мМ ЭДТА pH8 (20 мл 0,5 М)
1% Тритон х-100 (1 мл 100%)
наночистая вода (33 мл)
Перемешайте и стерилизуйте, затем профильтруйте.
TAE (50x) Буфер 1 л
242г Трис
57,1 мл уксусной кислоты
100 мл 0,5 М ЭДТА
Смешайте все в колбе Эрленмейера с мешалкой.Автоклав.
ЭДТА (0,5 М) 1 л
186,1 г NaEDTA. 2ч30
ок. 20 г NaOH
Растворите NaOH прибл. 800 мл воды и pH до 8. Медленно добавьте
ЭДТА при перемешивании мешалкой на слабом огне. Отрегулируйте pH до
8 и автоклав.
1% агарозный гель
25 мл 1x TAE
2,5 г агарозы
растворить и дегазировать раствор, поместив смесь в
микроволновая печь для коротких серий прибл.20с
Бромид этидия раствор. 200 мл
(Считается мутагеном)
Разбавляйте раствор до появления светло-оранжевого оттенка.
Студенты должны назначить размеры полосам ДНК, которые они см. использование рестрикционной карты фаговой лямбда-ДНК в качестве руководства. Студенты должны записывать свои результаты в свои дневники до построение графиков выборок на основе журнала размера маркера по сравнению с пройденное расстояние (см). По этим данным студенты должны определить размеры маркеров для лент производства Bamh2.
Вопросы
- Как повлияет на ваш гелевый узор использование двух рестрикционные ферменты.
- Некоторые группы были более насыщенными (ясность), чем другие. Какие как вы думаете, значение этого есть?
- Рестрикционные ферменты производятся различными видами бактерии. Как бактерии используют ферменты?
Выводы
- Резюме лабораторного опыта: выделите электрофоретическое средство техника использованная
- Объяснение наблюдений: на основе ваших исследований и общенаучные знания объяснят ваши качественные данные.
- Источники ошибок: перечислите три возможных источника ошибок в вашу лабораторию и как они повлияют на результат.
Анализ данных и расширение:
Каждая группа из четырех студентов будет разделена на две лабораторные работы. станции (две группы по две). Группе будет предоставлен образец ДНК, которая была расщеплена с использованием HindIII, EcoRI и БамХИ (хотя можно использовать и другие). Небольшие группы из двух человек будут запустить гель, используя тот же набор условий, чтобы сравнить их результаты, когда они будут завершены.Каждая большая группа из четырех человек будет учитывая образец, который содержит один аналог (EcoR1) или (HindIII) и один непохожий рестрикционный фермент. Группы опубликуют свои результаты во время групповой презентации, объясняющей сходства и различия в данных, сгенерированных с использованием плакатной техники. Каждому члену группы будет назначен определенный раздел презентация: (1) Краткое изложение лабораторного опыта, (2) Презентация данных, (3) Сравнение данных и (4) Источники ошибок с практическое применение.
Руководство для учителя
для
Электрофорез ДНК
,00 Использование геля агарозы
(Понимание роли рестрикционных ферментов)
Ответов на текстовые вопросы:
- Студенты должны видеть больше полос, связанных с микшированием двух рестрикционных ферментов.
- Брайан проверь свои фотографии
- Бактерии используют рестрикционные ферменты как средство защиты против вирусов!
* Примечание: Чтобы упростить подготовку, компании продавать предварительно разрезанную ДНК с помощью различных рестрикционных ферментов.Это немного дороже, но можно сэкономить время!
Размеры маркеров
EcoRI —
- 21266 * (слабые полосы при нагревании)
- 7421
- 5804
- 5643
- 4878
- 3540 *
HindIII —
- 27,500 присутствует в неотапливаемом состоянии
- 23,130 левый рычаг
- 9416
- 6682
- 4361 рычаг правый
- 2322
- 2027
- 564 слабый
- 125 «
Соответствующие концентрации агарозы для разделения ДНК Фрагменты разного размера
% агарозы —- эффективный диапазон разрешения линейной ДНК
Фрагменты (кб)
0.5% ____________________________________ от 30 до 1
0,7% ____________________________________ от 12 до 0,8
1,0% ____________________________________ от 10 до 0,5
1,2% _____________________________________ от 7 до 0,4
1,5% _____________________________________ от 3 до 0,2
* 1 Kb ДНК-лестница подходит для линейной проклейки фрагменты двухцепочечной ДНК размером от 500 до 12 т.п.н. Группы каждая лестница содержит от 1 до 12 повторов ДНК длиной 1,018 п.н. фрагмент.Помимо этих 12 лент, лестница содержит векторные фрагменты ДНК размером от 75 до 1636 п.н.
** Существует также продукт под названием DNA Mass Ladder (патент ожидает рассмотрения) подходит для оценки массы неизвестной ДНК образцы окрашиванием бромистым этидием. Лестница состоит из эквимолярная смесь шести тупых фрагментов от 100 до 2000 п.н. Электрофорез 4 мкл лестницы масс ДНК дает полосы содержащие 200, 120, 80, 40, 20 и 10 нг (всего 470 нг) ДНК.
Приложение А
Изготовление гелевых коробок недорого
Материалы
Для каждой установки гелевого бокса у вас должно быть:
две маленькие емкости для буферов (пластик предпочтительно, стаканов будет достаточно)
Стеклянная пластина 5 дюймов на 5 дюймов (предпочтительно пластиковая пластина)
пластиковый квадрат для поднятия стеклянной гелевой пластины на высоту буферные емкости
два электрода (карандаши с мягким графитом доступны в художественный магазин, изделия из нержавеющей стали или платины)
мягкие белые бумажные полотенца или хроматографическая бумага, служащая солевым мостиком между лунками и гель
Покрытие из оргстекла для предотвращения высыхания геля и сохранить пальцы ученика в сторону
Все гелевые боксы состоят из двух лунок для буферного раствора, приподнятая площадка для размещения гелевых пластин и двух электродов.Немного геля коробки содержат гелевую пластину или лоток, погруженные в буферный раствор, но мы не сочли это удовлетворительным. Абсорбирующие белые бумажные полоски может быть помещен одним концом в буферный отсек, а другой накинуть на край гелевой пластины так, чтобы подключение сделано.
Автор обнаружил, что небольшой контейнер Rubbermaid емкостью 1-1 / 2 кварты был удовлетворительным. Два небольших пластиковых контейнера (по 225 мл каждый) размещены на противоположных концах, чтобы служить буферными лунками.Любой маленький пластиковые детали могут быть помещены между этими двумя лунками в качестве опоры для стеклянной пластинки с гелем. Автор использовал перевернутый пластиковая корзина. Необязательно размещать все эти более мелкие компоненты в большем контейнере, но это приводит к стабильности и безопасность.
Автор попробовал графитовые карандаши в качестве электродов и обнаружил их удовлетворительно на короткий срок. Если вы хотите повторить это много лет экспериментируйте, получайте полосы или стержни из нержавеющей стали из хозяйственного магазина для использования в качестве катода.Платиновая проволока лучший выбор для анода, но не нужен для красителя разделение Если вы используете платиновую проволоку, достаточно диаметра 0,25 мм. и стоит около 25 долларов за 25 см. Выбранные электроды могут быть приклеены к противоположным сторонам большего контейнера. Если у вас есть платиновые электроды от аппарата Хоффмана, они также должны хватит. Следует выбрать любой способ закрепления электродов.
Наконец, вам нужна абсорбирующая бумага, которая будет служить солевым мостиком. между буферными лотками и гелем.Удвойте бумажные полотенца для больший поток ионов. Накройте полотенцем противоположные концы геля. пластина. Заполните буферные лунки достаточным количеством раствора, чтобы свести к минимуму расстояние между буферным раствором и гелевой пластиной. Это предотвращает сушка полотенца. Автор нашел недорогие белые бумажные полотенца. вполне удовлетворительно и намного дешевле, чем хроматография бумага. Промокательная бумага, купленная в магазинах канцелярских товаров, кажется, быть слишком устойчивым к току и не рекомендуется.
Чтобы помочь студентам загружать лунки в планшет с гелем, с узким наконечником Насадки Eppendorf очень удобны, но вы можете использовать микронасадки. пластиковые пипетки Бераля или пипетки Пастера с вытянутыми стеклянными наконечниками до более тонкого диаметра.
ПРИЛОЖЕНИЕ B
Рекомендации учителей по электролизу
Классная среда:
Студенты должны работать в парах.
Материалы
На каждую пару учеников нужно:
одна батарея 9 В
один зажим для аккумулятора (можно недорого приобрести в Radio Shack в упаковки по 6 шт.)
одна пара зажимов типа «крокодил» для подключения от зажима аккумулятора к карандаши
один ацетатный лист
два карандаша, каждый заостренный с обоих концов, чтобы служить электроды
примерно 5 мл 0.2M CuCl 2
бумажное полотенце для очистки электродов
Батарея крепче, если можно разрезать аллигатора. зажимные соединители, доступные в Radio Shack, пополам и припаять отрежьте концы зажима аккумулятора, как показано на лабораторной схеме. Один раз подготовленные, комплекты для занятий служат годами. (Автор использовал так же установил за 8 лет без проблем. Батареи хватает на 5-6 лет.)
Ответов на вопросы анализа:
- Медь наплавленная.
- Ионы меди заряжены положительно и притягиваются к отрицательный электрод, потому что противоположные заряды притягиваются.
- Вещество, выделяющееся на аноде, представляет собой газообразный хлор. В Ион хлорида попал на электрод, потому что у него противоположный заряд.
Ответы на добавочные номера
- Положительно заряженные белки будут двигаться к катод. Отрицательно заряженные белки будут двигаться в сторону анод.
- Ионы можно замедлить с помощью вещества, которое их улавливает такие как гель или спутанные полимеры. Белки с большим молекулярная масса будет двигаться медленнее. (Воспользуйтесь аналогией попытки достать камешек из миски с прозрачным супом или снизу тарелки с приготовленными спагетти.) ДНК
- также разделяют с помощью гель-электрофореза. ДНК цепь заряжена отрицательно из-за фосфатной группы и движется к аноду.
Приложение C
Инструкции для учителя по практическому занятию Micropipet
Аннотация
Студенты осваивают технику использования микропипеток при приготовлении четыре цвета из четырех основных пищевых красителей.
Обучающая стратегия
Большинство разделений белков происходит в очень мелком масштабе и используют микроколичество жидкостей. Это требует умения манипулировать ручные инструменты, называемые микропипетками.Эта деятельность будет знакомит студентов с их использованием и предлагает быстрый метод определение, правильно ли они их используют.
Материалы:
микропипетки, пластиковые микроцентрифуги или вихревой миксер (Eppendorf) микропробирки, наконечники для пипеток, глицерин, дистиллированная или деионизированная вода, фильтровальная бумага, пищевые красители (красный, зеленый, синий и желтый), Листы пенополистирола 6 футов на 6 дюймов для использования в качестве держателей микроцентрифуг, вортекс миксер или пластмассовые зубочистки для перемешивания
Подготовка учителей
- Приготовление базового раствора красителя для 8 наборов
- Смесь 4.0 мл желаемого пищевого красителя и 4,0 мл вода дистиллированная
- Добавьте к смеси 16 мкл глицерина и перемешайте тщательно. (Предпочтительно вихревой смеситель)
- Разделите каждый цветной раствор на 8 помеченных микропробирки.
- Для каждой группы учеников подготовьте комплект, состоящий из:
- Лист пенополистирола или кусок пенопласта, который будет действовать как
держатель микропробирок, содержащий:
- 4 пустые микроцентрифужные пробирки;
- 4 промаркированных микроцентрифужных пробирки, каждая с одной из четырех основных цветов
- 1 микропипетка
- фильтровальная бумага
- Лист пенополистирола или кусок пенопласта, который будет действовать как
держатель микропробирок, содержащий:
Особые примечания:
- Наконечники Micropipet можно промывать и использовать повторно.
- Будут подготовлены цвета бирюзового, розово-оранжевого и зеленовато-желтого цветов.
- Сравнение пятен на фильтровальной бумаге указывает на способности ученика правильно дозировать 3 мкл.
- Приготовьте эталон, чтобы вы могли сравнить их чирок, розу, оранжевый и шартрез цвета. Это также указывает на их умение пользоваться микропипетками.
Приложение D
Рекомендации учителей по приготовлению геля
Сокращения:
- Приготовьте раствор агарозы раньше и согрейте (70 o C для агарозы, 60 o C для желатина Knox) в воде ванна на плите.Если гель остынет слишком сильно, он затвердеть. Если он слишком горячий, гель слишком долго остудить и затвердеть.
- Желатин Knox можно заменить агарозой , используя красители только . Если вы заменяете, 3% — 5% будет необходимо для гелеобразования (одна упаковка на 1 стакан воды представляет собой 2,9% раствор. Этот гель превратится в золь (жидкое) состояние быстрее, если используется слишком большое напряжение во время электрофореза, если у вас нет метода охлаждение геля.Если вы используете этот гель НЕ ПРЕВЫШАЙТЕ 100 В ПО ЛЮБОЙ ПРИЧИНЕ . Если гель тает, В системе может произойти короткое замыкание. (Этот автор использовались 3% -ные растворы, но 5% -ный раствор имеет меньшую вероятность плавления.)
- Гребни могут быть изготовлены из оргстекла. Каждый зуб 6,25 мм широкий. Толщина оргстекла на коммерческих гребнях 0,75 мм. Расческу можно вырезать из высокой плотности бутылки для молока из полиэтиленовых галлонов, если нет оргстекла доступный.Они действительно делают очень узкие прорези, но будут хватит. Помните, что зубы не должны уходить полностью. через гель. Схема приводится ниже.
Приложение E
Инструкции по лаборатории красителей для учителей
Обучающая стратегия
Классная среда: Химия средней школы
Этот вид деятельности олицетворяет открытое обучение, поэтому сопротивляйтесь желание сказать слишком много в начале.Убедитесь, что студенты понять технику. Студенты могут приготовить смесь красок для другая группа для идентификации.
Предварительная подготовка учителя к гель-электрофорезу с красители
- Необходимое оборудование для класса 32 (8 групп по 4)
DC Источники питания для электрофореза (100 В или выше) Некоторые могут использоваться 2 или более группами
остатки
плита или микроволновая печь для нагрева геля
8 стеклянных пластин размером около 5 дюймов на 5 дюймов, 8 листов ацетата и маркеры или 8 листов промокательной бумаги
8 термостойких перчаток (по желанию)
8 коробок с гелем для электрофореза (коммерческие или сконструированные как в Приложении А)
Ассортимент красителей (Приложение F)
Преподаватель Время на подготовку — примерно 2-3 часа
Приготовьте красители, как указано в Приложении D, или купите в коммерческих
источники, перечисленные в Приложении E
Рабочий буфер, 1X TAE (0.4М трис-ацетат; с 0,001 млн
ЭДТА)
Это более удобно приготовить, используя раствор 50X TAE.
и разбавление 40 мл раствора 50X водой до конечного объема.
2 литра. Во многих гелевых коробках используется примерно 125-200 мл 1X буфера. г.
буфер можно повторно использовать несколько раз, если он полностью перемешан между
работает .
Рецепт концентрата 50X TAE
242 г Трис-основания, доступного от Sigma Chemical Co., Флинн или Фрей
57,1 мл ледяной уксусной кислоты
100 мл 0,5 М ЭДТА, pH 8
(Эта масса изготовлена из динатриевой соли EDTA и pH сбалансирована с использованием pH-метр или pH-бумага и HCl.) Сделайте 1 литр деионизированным или дистиллированная вода. Этот раствор реагента также можно купить.
Вы можете заранее приготовить несколько практических гелей и использовать один урок для студентов, чтобы попрактиковаться в дозировании и загрузочные лунки в этих гелях.
Если учащиеся используют микропипетки и подсказки, они нуждаются в предварительном инструкция и практика, как указано в стратегии. При использовании вытащили пипетки Пастера или пипетки Берала с микронаконечником, найдите время, чтобы проинструктируйте их, как ими пользоваться, чтобы получить очень небольшой размер выборки.
Ответы на вопросы анализа
- Ответы будут разными. Направления окраски указаны в Приложении. F.
- Ответы будут разными. Направления окраски указаны в Приложении. Ф.
- На + электрод отправляется больше образцов. Они часто анионы солей.
- Красные красители должны быть разными, поэтому расстояние ездил должно меняться.
- Студенты могут быть удивлены тем, что желтый краситель имеет желтый и красный и синий — это синий с небольшим количеством красного. Зеленый желтый и синий.
- Если электрофорез проводится достаточно долго, они могут различать смеси.В противном случае нет.
- Свойства заряда и молекулярной массы используются для разделите их.
- Гели с меньшими отверстиями обеспечивают лучшее разделение. Более концентрированные гели имеют отверстия меньшего размера. Бег электрофорез в течение более длительного времени помогает разделению геля тарелка достаточно длинная, чтобы ее можно было использовать. (Гели агарозы дадут результаты лучше, чем у желатина Knox.)
Приложение F Красители для электрофореза красителей
Предлагаются следующие красители.Некоторые из них обычно используются как кислотно-основные индикаторы и др. являются биологическими пятнами. Попробуй использовать некоторые из них являются катионными, а некоторые — анионными.
| Краситель | Путешествие на какой полюс |
| бромкрезоловый зеленый | + (анод) |
| пурпурный бромкрезол | + |
| бромфеноловый синий | + |
| кристаллический фиолетовый (генциановый фиолетовый) | — (катод) |
| эозин Y | + |
| флуороцен | + |
| м-крезол пурпурный | + |
| метиловый зеленый | _ |
| метиленовый синий | _ |
| 0-крезол красный | + |
| оранжевый G | + |
| фенол красный | + |
| сафранин O | _ |
| ксилолцианол | + |
Другие предложения: меркурохром, пищевые красители, чернила, пасха яичные красители, связующие красители, экстракты цветов, сок капусты, сок свеклы, ягодный сок, йод.Этому автору не удалось промышленный краситель, краситель Рит. Консервированный свекольный сок работал очень хорошо и ученики должны увидеть две цветные полосы: ярко-розовую и бледную. апельсин. Чтобы использовать любой из первых, попробуйте подготовить относительно темный экстракт путем измельчения растительного материала в ступке и пестике или в блендере с минимальным количеством воды. Процедить перед употреблением.
Студенческие группы могут делать простую смесь красителей, но смеси + & — красители легко выпадают в осадок.Все миксы должны быть отрицательно или все положительно заряжены.
Приготовьте красители в 0,25% растворе (25 мг / 10 мл). Добавьте 1 мл глицерин, чтобы сделать смесь более густой, чтобы облегчить загрузку геля колодцы. При приготовлении смесей красителей необходимо соблюдать осторожность, чтобы избежать появления красителя. беспорядок и избегайте вдыхания порошков. Используйте фартук и перчатки и работайте в хорошо проветриваемом помещении. Растворы красителей можно приобрести в коммерческие источники, перечисленные в Приложении H.
Приложение G
Стратегия учителя
Определение молекулярной массы неизвестного белка
Обучающая стратегия
В этом упражнении по решению проблем предлагаются классы различных способность определять молекулярную массу.Для студентов с несколько предварительных навыков, выполните задание, как указано на стр. 19 который дает данные о расстоянии. Должны быть предоставлены расширенные классы. только с диаграммой ниже, которая имитирует полученные данные на гель-электрофорез этих белков. Студенты должны измерить сами расстояния, как это сделал бы химик-исследователь. Они получат большую погрешность. Световые линии добавлен для облегчения измерения, но не будет ни на одном геле. В полоса миоглогина изогнута в виде «улыбки», чтобы имитировать то, что иногда возникает по краям геля.Также второй свет полоса предназначена для гемоглобина, который может фрагментироваться на половинки.
Приложение H
Источники материалов
Bio-Rad
Источник белков, микропипетки и наконечники
Наконечники для пипеток с тонким наконечником для инъекций в лунки, кат. # 223-9915 \
Предварительно окрашенные стандарты калейдоскопа, № по каталогу 161-0324; 90 долларов за 500 м L
Flinn Scientific
П.О. Box 219
Батавия, Иллинойс 60510-9958
Телефон 800-451-1261
Источник комплектов
- Молекулярная масса белков с 3 белками, SDS и агароза, № по каталогу FB0308; 96,25 долл. США
- Набор геля агарозы с красителями; Кот. # FB 0300; $ 56
Источник красителей: приобретается отдельно
- оранжевый G, бромкрезоловый зеленый, бромкрезоловый пурпурный, фенол красный, метоловый красный, метиленовый синий, кристаллический фиолетовый
Источник концентрированного буфера для электрофореза 50X TAE
- раствор агарозы, растопить и залить
- красителей для электрофореза
Frey Scientific , 905 Hickory Lane, P.О. Box 8101, Мэнсфилд, Огайо 44901-8101,
- PH 800-225-FREY
- Набор «Электрофоретические свойства нативных белков», # F18888, 85 долларов США
- Набор для вводного электрофореза, # F18879, 50 долларов США (включает 6 красителей, гель, агароза и буфер)
- Набор для определения молекулярной массы белков, № F18887, $ 85
Источник трис-глицина, буфер SDS, полиакриламид, гели реагент, краситель кумасси для белков, белковая агароза,
Видео по электрофорезу
Sigma Chemical
П.О. Box 14508
Сент-Луис, Миссури 63178-9916
Источник агарозы, белков и красителей х.ч., платина провод
Поперечное и продольное исследование
% PDF-1.7 % 1 0 объект > / Метаданные 2 0 R / Имена 3 0 R / OpenAction [4 0 R / FitH 910] / Контуры 5 0 R / PageLabels 6 0 руб. / PageLayout / SinglePage / PageMode / UseOutlines / Страницы 7 0 R / StructTreeRoot 8 0 R / Темы [9 0 R] / Тип / Каталог >> эндобдж 10 0 obj > эндобдж 2 0 obj > транслировать приложение / pdf10.1016 / j.vetmic.2012.06.012
 Имеет выраженный адаптогенный эффект. Снимает воспаление и обезболивает.
Имеет выраженный адаптогенный эффект. Снимает воспаление и обезболивает.