Формирование иммунитета после прививки от гриппа: Памятка по гриппу. Вакцинопрофилактика гриппа
Вакцинация против гриппа. Справка — РИА Новости, 04.09.2009
Основным принципом вакцинации является то, что пациенту дается ослабленный или убитый болезнетворный агент (или искусственно синтезированный белок, который идентичен белку агента) для того, чтобы стимулировать продукцию антител для борьбы с возбудителем заболевания.
Среди микроорганизмов, против которых успешно борются при помощи прививок, могут быть вирусы (например, возбудители кори, краснухи, свинки, полиомиелита, гепатита В) или бактерии (возбудители туберкулеза, дифтерии, коклюша, столбняка, гемофильной инфекции).
Вакцинация бывает как однократной (корь, паротит, туберкулез), так и многократной (полиомиелит). Кратность говорит о том, сколько раз необходимо получить вакцину для образования иммунитета.
Перспективность борьбы с гриппом с помощью вакцинации признается специалистами всего мира, что отражено в решениях многих совещаний, проведенных Всемирной организацией здравоохранения (ВОЗ), рекомендациях Комитета США по практике иммунизации и официальных документах Министерства здравоохранения России.
Вирус гриппа состоит из белковой оболочки, внутри которой находится генетическая информация – молекулы рибонуклеиновой кислоты, которые кодируют семь структурных белков. Из них наиболее специфичны два – нейраминидаза и гамагглютинин. Именно они обеспечивают болезнетворное действие вируса на организм человека, и по ним же вирус опознается иммунной системой.
Как известно, вирусы гриппа подвержены высокой изменчивости. Считается, что время перебора всех возможных вариантов вируса гриппа – около 70 лет.
В теплом воздухе вирус гриппа живет всего несколько часов. А в холодном воздухе (даже при – 70º С) вирус держится гораздо дольше, да и в охлажденных слизистых оболочках размножается быстрее. Именно поэтому эпидемии гриппа возникают, как правило, в холодное время года.
Типы вакцин против вируса гриппа
Для вакцинации против вируса гриппа производятся и применяются на практике живые, инактивированные цельновирионные, субвирионные или расщепленные (сплит), а также субъединичные поливалентные гриппозные вакцины.
Живые гриппозные вакцины
Реактогенность (свойство вакцины вызывать при введении в организм какие-либо побочные эффекты) таких вакцин значительно выше, чем у инактивированных, однако они более экономичны. Могут использоваться у детей старше 3-х лет и взрослых. Однако живые вакцины имеют довольно много противопоказаний.
Противопоказания: острые заболевания; обострения хронических заболеваний; хронические заболевания легких и верхних дыхательных путей; хронический отит; сердечнососудистая недостаточность и гипертоническая болезнь II и III стадий; злокачественные новообразования, болезни крови; иммунодефицитные состояния; аллергические заболевания; болезни центральной нервной системы, почек, эндокринной системы; эпилепсия с частыми припадками; гидроцефалия в стадии декомпенсации и субкомпенсации; беременность.
Побочные реакции: повышение температуры, недомогание, головная боль, катаральные явления (воспаление слизистой оболочки верхних дыхательных путей).
Инактивированные вакцины представляют собой вирусы гриппа типов А и В, полученные из вируссодержащей аллантоисной жидкости куриных эмбрионов, инактивированных формалином или ультрафиолетовым излучением. При введении инактивированных вакцин формируется и местный (на слизистых), и общий иммунитет, обеспечивающий надежную защиту от гриппа. Такие вакцины имеют меньше противопоказаний и поэтому широко рекомендуются для иммунизации детей от 7 лет (в том числе с различными хроническими заболеваниями), а также лиц преклонного возраста. Ввиду их плохой переносимости не могут применяться у маленьких детей.
Противопоказания:
1. При парентеральном введении (инъекция): острые заболевания, обострение хронических заболеваний, аллергические заболевания, аллергия к куриному белку, бронхиальная астма, диффузные заболевания соединительной ткани, заболевания надпочечников, заболевания нервной системы.
2. При интраназальном введении (через нос): аллергия на белок куриного яйца, хронический ринит, острые заболевания, обострение хронических заболеваний.
Побочные реакции: недомогание, головная боль, повышение температуры, местные реакции в месте укола (покраснение, отек), у части привитых могут образовываться инфильтраты (скопление в тканях организма клеточных элементов с примесью крови и лимфы.)
Расщепленные (Сплит-вакцины) – вакцины второго поколения – содержат поверхностные и внутренние антигены вируса гриппа. По данным зарубежных исследователей, благодаря высокой степени очистки можно применять во всех возрастных группах, в том числе для прививки против гриппа детей, начиная с 6-месячного возраста.
Противопоказания: острое заболевание с температурой; обострение хронического заболевания; аллергия на белок куриного яйца; аллергия к другим компонентам вакцины.
Побочные реакции: местные реакции в виде отека, болезненности и покраснения –встречаются у не более 3% привитых; общие реакции (крайне редко) в виде общего недомогания, головной боли, повышения температуры; крайне редко – аллергические реакции
Субъединичные вакцины (вакцины третьего поколения) готовятся только из поверхностных белков вируса – гемагглютинина и нейраминидазы. Внутренние белки отсутствуют.
Внутренние белки отсутствуют.
Противопоказания: острое заболевание с температурой; обострение хронического заболевания; аллергия на белок куриного яйца; аллергия к другим компонентам вакцины.
Побочные реакции: местные реакции в виде отека, болезненности и покраснения встречаются у не более 3% привитых; общие реакции (крайне редко) в виде общего недомогания, головной боли, повышения температуры; крайне редко – аллергические реакции.
Эксперт оценила формирование длительного иммунитета после прививки от COVID-19
Считается, что инактивированные и пептидные вакцины хуже или вообще не способны гарантировать Т-клеточный (долговременный) иммунитет, в отличие от векторных вакцин. Так ли это, «Российской газете» прокомментировала Светлана Закирова, заместитель гендиректора «Нанолек» по исследованиям и разработкам. Эта компания начинает в конце июля выпускать вакцину «КовиВак» Научного центра имени Чумакова.
— Сначала поясню, что представляют собой инактивированные, векторные и пептидные вакцины, а также принцип формирования Т-клеточного ответа. Инактивированные вакцины — это вакцины, которые представляют из себя «убитый» патоген, в случае вакцины против COVID-19 — это коронавирус SARS-Cov-2, — рассказала Светлана Закирова. — Убить его можно либо температурой, либо химическими веществами (например, формалином). «КовиВак» относится именно к этому типу вакцин.
Инактивированные вакцины — это вакцины, которые представляют из себя «убитый» патоген, в случае вакцины против COVID-19 — это коронавирус SARS-Cov-2, — рассказала Светлана Закирова. — Убить его можно либо температурой, либо химическими веществами (например, формалином). «КовиВак» относится именно к этому типу вакцин.
Векторные вакцины представляют из себя генетически модифицированный патоген. У него изменен генетический аппарат таким образом, что данный патоген становится не вирулентным, то есть он не способен размножаться и убивать клетку, как его дикий представитель. То есть используется живой вирус (например, аденовирус), который доставляет ген интереса в клетку. Из российских вакцин к этому типу относится «Спутник V». И, наконец, пептидная вакцина — «ЭпиВакКорона». Это синтетический препарат, который состоит из маленьких фрагментов белка-шипа, которые прикреплены к белку-носителю — тот в свою очередь включает в себя фрагменты нуклеокапсидного белка, которые окружают РНК вируса.
«Что такое Т-клеточный ответ? Это ответ Т-лимфоцитов. Т-лимфоциты «реагируют» на эпитопы (части белковой молекулы антигена длиной 9-20 аминокислот). Такие эпитопы есть как в векторной, так и в инактивированной или пептидной вакцине. То есть стимулировать Т-клеточный иммунитет будет прививка любой из этих типов вакцин, — пояснила Светлана Закирова. — Однако, если инактивированная вакцина получена путем химической инактивации — то в таком случае эпитопы могут быть также химически изменены и это снизит Т-клеточный ответ. Но незначительно.
Грипп. Важность коллективного иммунитета
Грипп – чрезвычайно заразная вирусная инфекция с воздушно-капельным и контактно-бытовым механизмами передачи. Основной путь распространения инфекции – воздушно-капельный (от зараженного человека здоровому) – при чихании, кашле, во время разговора.
Всем известно, что вакцинация против гриппа – основной действенный способ профилактики заболевания.
Вакцинация против гриппа проводится в соответствии с приказом Министерства здравоохранения РФ от 21 марта 2014 г. № 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям».
№ 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям».
Вакцинация проводится ежегодно. С учетом рекомендаций Всемирной организации здравоохранения охват прививками против гриппа в группах риска должен быть не менее 75%, охват прививками против гриппа населения в целом по стране и по субъектам Российской Федерации в отдельности – не менее 40%.
Оптимальным временем проведения прививок против гриппа является период с сентября по ноябрь, т.к. иммунитет формируется примерно в течении 2 недель. Иммунитет после проведенной прививки от гриппа должен успеть сформироваться до начала эпидемического подъема заболеваемости.
Вакцинация против гриппа снижает риск заболеваемости у детей и взрослых на 70-90%. В случае, если привитый человек инфицируется, грипп протекает в легкой форме, риск развития осложнений минимален.
Вакцинация снижает распространение инфекции среди контактных лиц, а также снижает риск формирования нового варианта вируса гриппа.
Чем больше людей привились против гриппа, тем больше невосприимчивых к вирусу гриппа лиц среди населения. Чем выше коллективный иммунитет, соответственно, тем меньше вероятность заболеть у человека, встретившегося с вирусом. При условии, что 90% людей привиты – остальные 10% не заболею.
Итак, коллективный иммунитет защищает не только привитых людей, но и остальное население, например тех, кто имеет противопоказания или медотвод от вакцинации (лица, с аллергической реакцией на куриный белок или иные компоненты вакцины, а также те, у кого отмечались сильная температурная или аллергическая реакция на предыдущую вакцинацию против гриппа).
Коллективный иммунитет снижает риск распространения вирусов гриппа.
Вакцинация — единственный надежный способ защиты от гриппа!
Мифы о прививках
Миф: В состав вакцин входят опасные для здоровья ребенка вещества, такие как ртуть. Они вызывают необратимые последствия, вплоть до развития аутизма у привитого.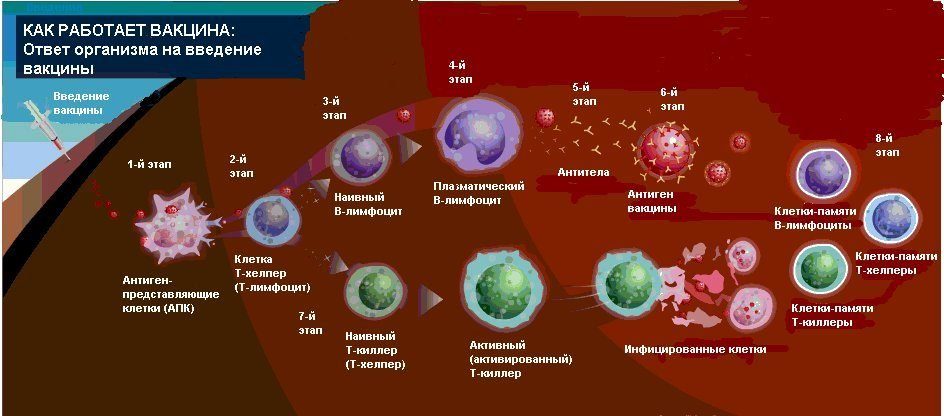
Факт: Непонимание вопроса приводит к ложным выводам и необоснованным страхам. В некоторых вакцинах для взрослого населения в качестве консерванта содержится органическое соединение ртути, которое имеет период полувыведения до 3,5–4 дней. Важно понимать, что консервант в небольшом количестве совершенно безопасен для здоровья человека. Его объем в одной дозе вакцины меньше того, что мы потребляем в течение дня с пищей, или вдыхая городской воздух. Многочисленные исследования нейрохимического развития подтверждают, что зависимости между вакцинацией содержащими мертиолят препаратами и нарушениями в развитии, в том числе в нейропсихическом, не существует. Слухи о том, что консервант или компоненты вакцин могут провоцировать аутизм, были инициированы работой английского доктора Эндрю Уэйкфилда. Выводы врача были официально опровергнуты ВОЗ и местным Минздравом, поскольку в докладе выявились грубейшие нарушения в методике исследований. Мировые эксперты в области нейропсихологии подчеркивают, что расстройства аутического спектра имеют доказанную наследственную природу.
Миф: Вакцинация сопровождается реакцией организма, которая сравнима с симптомами самой болезни или ее осложнениями.
Факт: Как мы ранее выяснили, в отличие от «естественной» инфекции, которая наносит мощный удар по организму и характеризуется попаданием в него живых патогенных микроорганизмов и их активным размножением, вакцина содержит ослабленные или «убитые» штаммы вирусов, то есть так называемую «пустышку», которая не может вызвать болезнь. Только «естественная» инфекция, в отличие от вакцинации, часто приводит к осложнениям.
Миф: У детей есть природный иммунитет, который может пострадать, если его «нагружать» многочисленными прививками.
Факт: Иммунную систему невозможно «перегрузить» вакцинами, а пренебрежение ими может, напротив, причинить серьезный вред здоровью, поскольку у ребенка нет природного «врожденного» иммунитета от опасных инфекций. Вакцинация – это достижение науки, которое в контролируемой и безопасной форме помогает ребенку приобретать защитные механизмы с первых дней. Современные вакцины содержат минимальное количество антигенов, этого достаточно для того, чтобы организм выработал клетки памяти и при встрече с настоящим «врагом» ответил в полную силу. Что касается «перегрузки», то это просто миф, наша иммунная система работает постоянно, оберегая не только от кори, паротита и других известных инфекций, но и от тысяч других, с которыми она борется так успешно, что мы этого просто не замечаем.
Современные вакцины содержат минимальное количество антигенов, этого достаточно для того, чтобы организм выработал клетки памяти и при встрече с настоящим «врагом» ответил в полную силу. Что касается «перегрузки», то это просто миф, наша иммунная система работает постоянно, оберегая не только от кори, паротита и других известных инфекций, но и от тысяч других, с которыми она борется так успешно, что мы этого просто не замечаем.
Миф: Организму легче справляться с вирусной нагрузкой, если вводить вакцины по одной, а не несколько одновременно.
Факт: У иммунитета не существует определенного предела, дальше которого защита начинает ослабевать из-за слишком большой нагрузки. Он постоянно реагирует на многочисленные бактерии, которыми наполнена окружающая нас среда. Давно доказано, что введение многокомпонентных (пяти- и шестикомпонентных) вакцин воспринимается организмом так же, как и профилактика моновакцинами, и иммунная реакция проявляется в равной степени – накопительного эффекта, который рисует наше сознание, нет – иммунитет работает совершенно иначе. При этом ребенку гораздо легче переносить один укол, а родителям не приходится испытывать стресс из-за частых походов в поликлинику.
При этом ребенку гораздо легче переносить один укол, а родителям не приходится испытывать стресс из-за частых походов в поликлинику.
Миф: Многие люди не прививают своих детей и не делают вакцинацию сами и при этом не болеют.
Факт: Официальная статистика однозначна – среди привитых людей случаев заболеваний намного меньше, чем среди невакцинированного населения. Чтобы сделать корректное заключение о пользе вакцинации, необходимо сравнивать сопоставимые случаи – пол, возраст, социальные обстоятельства, что недоступно обычному человеку. Кроме того, необходимо принимать во внимание такой феномен, как коллективный иммунитет – в обществе с широким охватом уровня вакцинации населения болезнь распространяется не столь активно и без вспышек, такая массовая защита помогает сохранять здоровье и отдельному индивиду. Случается и так, что привитый человек заболевает, например, гриппом. В таком случае можно говорить об изменчивости некоторых вирусов, быстрые мутации которого могут быть незнакомы организму. Но в любом случае, даже если после прививки человек заболел, он будет переносить инфекцию намного легче и без осложнений. А ведь именно в этом цель прививки — защитить от тяжелых болезней и их последствий.
Но в любом случае, даже если после прививки человек заболел, он будет переносить инфекцию намного легче и без осложнений. А ведь именно в этом цель прививки — защитить от тяжелых болезней и их последствий.
Миф: Поствакцинальная реакция на АКДС опаснее, чем болезни, от которых она защищает.
Факт: Действительно, более 70% поствакцинальных реакций приходится на вакцину, содержащую коклюшный компонент, именно поэтому она вызывает больше всего опасений у родителей. У детей после прививки повышается температура, они могут проявлять беспокойство или впадать в сонливое состояние, становиться плаксивыми, плохо спать, нередки и аллергические реакции. Все эти проявления ожидаемы и проходят в течение суток. При заболевании же коклюшем в одном из десяти случаев ребенок получает осложнения в виде воспаления легких, в двадцати случаях из тысячи – судороги, в четырёх случаях из тысячи – поражение головного мозга. Риски таких заболеваний не сопоставимы с неприятными, но быстро проходящими поствакцинальными реакциями.
Миф: Люди с аллергией, хроническими заболеваниями не должны прививаться, так как у них ослабленный иммунитет.
Факт: Именно ослабленный иммунитет – виновник того, что инфекционные заболевания протекают намного тяжелее, чем у здоровых людей. Как мы уже выяснили, в основе механизма действия вакцины лежит способность организма создавать иммунную память, для выработки которой ему нужно минимальное количество антигенов. Без предварительной подготовки, не имея специфического иммунитета, при встрече с настоящей инфекцией ослабленные основным заболеванием защитные механизмы человека могут не сработать. Так, коклюш или ветряная оспа могут сильно отягощать течение хронических недугов, иногда они становятся причиной смерти. При правильном подходе, под контролем врача прививки безопасны и эффективны, а кратковременные обострения основного заболевания проходят в течение нескольких дней.
Миф: Вакцинироваться от гриппа не имеет смысла, так как все равно заболеешь.
Факт: Грипп ошибочно воспринимают как легкое недомогание, которое излечивается народными средствами. Он тяжело переносится организмом, ежегодно в мире из-за заболевания и его осложнений умирают сотни тысяч людей. Вакцинация обеспечивает иммунитет против трех наиболее распространенных штаммов, циркулирующих в любой сезон, поэтому шансы заразиться после прививки снижаются, но не исчезают полностью. Действительно, во время эпидемии может заболеть и привитый человек, но при этом он будет защищен от тяжелейших осложнений, таких как отит, астма, пневмония. Прививки на треть уменьшают количество осложнений с госпитализацией и вдвое – количество смертельных исходов. Исследования показывают, что вакцинация детей более чем на 50% сокращает количество случаев ухода на больничный работающих матерей для ухода за ребенком. Вместе с расходами на лекарства грипп дорого обходится семье. Можно с уверенностью сказать, что прививка – это реальная защита от гриппа и ОРВИ.
Миф: Вакцинация намного опаснее, чем признает официальная медицина. Количество осложнений после прививок замалчивается.
Количество осложнений после прививок замалчивается.
Факт: Все случаи серьезных осложнений тщательно расследуются и фиксируются Росздравнадзором. Каждое заявление подлежит статистическому учету, на основании которого принимается решение об изъятии партии той или иной вакцины. Практически все реакции на иммунобиологические препараты известны медицине, поэтому врачи могут оказать адекватную и оперативную помощь в случае появления поствакцинальных или нежелательных реакций.
Польза прививки против гриппа
Угроза гриппа: как противостоять вирусной инфекции
Грипп, как коварное и довольно опасное заболевание, каждый год угрожает населению планеты появлением массовых эпидемий. Календарным сроком начала периода заболеваемости принято считать последнюю декаду октября с переходом на первую декаду ноября. Каждый взрослый человек, уделяющий максимум внимания своему здоровью, в конце осени оказывается перед выбором – поможет ли прививка от гриппа избежать инфицирования, а главное тяжелых осложнений после болезни. Тем более, что вакцинопрофилактика и ее методы вызывают много вопросов и противоречивых мнений.
Тем более, что вакцинопрофилактика и ее методы вызывают много вопросов и противоречивых мнений.
Важная информация о противогриппозной вакцинации
Основная задача антигриппозных профилактических мер – сформировать основу специфического иммунитета к определенному виду возбудителя гриппа, что способствует предупреждению инфицирования. С веществом вакцины в организм попадает особый набор антигенного материала, включающий в себя фрагменты возбудителя, следы его жизнедеятельности, а также микроорганизмы, убитые или инактивированные.
Эффективность прививки, которая действует лишь год, оценивают по следующим факторам:
- степень невосприимчивости к грозной инфекции;
- тяжесть характерных симптомов заболевания;
- длительность развития патологии;
- количество осложнений, возникших после острой стадии заболевания.
Совет: следует учесть, что из-за постоянной мутации микроорганизма, каждые несколько месяцев появляются новые штаммы гриппозных вирусов, поэтому иммунизация подразумевает прививание только актуальными в текущем году вакцинами, а не препаратами прошлых лет.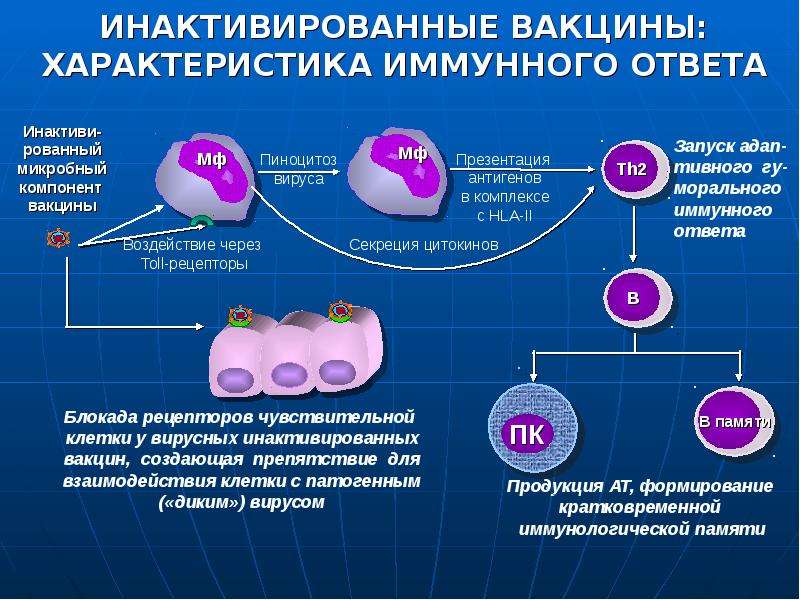
Что следует знать о процессе противогриппозной вакцинации
- Стойкий иммунитет после прививки появляется не сразу, должно пройти 10-14 дней после нее. Поэтому вакцину вводят в преддверие эпидемии, а не во время нее, введенный в разгар эпидемии раствор антигенного комплекса способен провоцировать само заболевание.
- Известно, что современные эпидемии развиваются волнами, чтобы предупредить заболевания в течение всего периода эпидемии, вакцина против гриппа в своем составе содержит набор из трех возбудителей.
- Чтобы иммунитет обрел достаточную напряженность после прививания, необходимо учесть:
- качество препарата – его чистоту, жизнеспособность, дозировку;
- состояние прививаемого – его возраст, генетическую предрасположенность, оценить уровень иммунного ответа;
- внешние факторы, связанные с питанием, условиями жизни и труда человека, климатом.
- Четкое соблюдение правил и условий процесса станет залогом того, что иммунизация даст ожидаемый положительный результат – до 90% защиты.

- Из-за ежегодных мутаций вируса гриппа перед очередной эпидемией согласно прогнозу ВОЗ о типичных свойствах вирусов производители вакцинальных препаратов своевременно изменяют состав, который будет использован для вакцинации.
Важно: прививка против гриппа способствует снижению порога заболеваемости, ослабляет тяжесть развития недуга, становится надежным заслоном против осложнений вследствие инфекции, минимизирует число летальных случаев. От инъекции не стоит отказываться, особенно входящим в группы риска людям.
Противогриппозная сыворотка показана следующим лицам:
- · часто и длительно болеющим людям, особенно страдающим хроническими заболеваниями органов дыхания;
- · людям с заболеваниями сердечно- сосудистой, нервной и эндокринной систем;
- · лицам, страдающим хроническими заболеваниями почек;
- · работникам больших коллективов;
- · при заболеваниях крови и иммунодефицитных состояниях;
- · детям, посещающим детские учреждения, а также получающим иммуномодуляторы.

Совет: эффективность и польза иммунизации для беременных обусловлена тем, что вакцинироваться против гриппа данной категории рекомендовано в период планирования беременности. Если условие не выполнено, то после первого триместра беременности, чтобы не навредить плоду. Решение о целесообразности принимает врач.
Какие вакцины от гриппа применяют в настоящее время:
|
Название вакцинирующего препарата |
Страна, выпускающая вакцину |
Важная информация |
|
Живая противогриппозная вакцина ЖГВ |
Россия |
Интраназальная, стойкий иммунитет формируется за счет инфицирования и течения заболевания в облегченной форме. Имеет множество противопоказаний, вызывает побочные эффекты |
|
Грипповак |
Россия |
Инактивированную жидкую центрифужную вакцину выпускают в дозах для интраназального введения и в виде суспензии для введения подкожно детям с 7-ми лет и взрослому населению |
|
Ваксигрип |
Франция |
Самая эффективная вакцина среди отечественных и зарубежных препаратов, минимум осложнений на фоне формирования полноценного иммунитета, вводят подкожно и внутримышечно |
|
Бегривак |
Германия |
Инактивированный препарат содержит минимальную дозу штаммов вируса, актуальных в грядущий эпидемический сезон |
|
Флюарикс |
Англия |
Сплит-вакцину вводят детям старше года и взрослым, обремененным серьезными хроническими заболеваниями |
|
Инфлювак |
Нидерланды |
Высокоочищенный препарат с низким процентом побочных эффектов, содержит части антигенов вирусов групп А и В |
|
Агриппал S1 |
Италия |
Вакцина субъединичная очищенная, рассчитана на людей (детей и взрослых) с хроническими недугами особой тяжести |
|
Гриппол и Гриппол плюс |
Россия |
Инактивированный препарат и усовершенствованный его аналог не содержит живых вирусов. |
|
Инфлексал |
Швейцария |
Виросомальная вакцина, изготовленная по новым технологиям. Она рассчитана на детей старше полугода и взрослых, которым другие вакцины противопоказаны |
Важно: согласно стандарту противогриппозную вакцинацию проводят ежегодно в октябре-ноябре, чтобы в оставшееся до начала эпидемического периода время успела сформироваться иммунная защита от инфекции. Проводить процедуру в более ранние сроки нецелесообразно, т.к. к завершению эпидемии произойдет уменьшение количества антител, что чревато высоким риском заражения.
Станет ли спасением прививка от гриппа
Заболевание вызывают возбудители трех разновидностей – А, В, С, к ним довольно высокая восприимчивость людей всех возрастов, причем в любое время года, хотя превышение порога заболеваемости происходит именно зимой. В этот период из-за недостатка витаминов и свежего воздуха, а также переохлаждений люди становятся наиболее беззащитными против инфекции.
В этот период из-за недостатка витаминов и свежего воздуха, а также переохлаждений люди становятся наиболее беззащитными против инфекции.
С учетом этих факторов, а также индивидуального подхода вакцинация должна стать надежным барьером против инфекционного заболевания, угрожающего опасными осложнениями. Гриппозный вирус, снижая сопротивляемость другим инфекционным заболеваниям, становится причиной бактериальных инфекций, обострения хронических недугов, способен вызвать пневмонию и отит, угрожающий развитием менингита.
Важно: если эффективность прививки высокая, заболевших людей будет меньше, что сократит масштабы эпидемии, не давая ей перерасти в пандемию, когда в процесс инфицирования вовлекаются большие популяции не только населения стран, но и континентов.
Не всем и не всегда прививка от гриппа разрешена, существуют некоторые ограничения на сезонную инъекцию:
- заболевания простудного характера с повышенной температурой;
- аллергическая реакция на куриный белок в составе препарата;
- наличие некоторых хронических заболеваний сердца, почек, нервной и эндокринной системы, дыхательных путей в период их декомпенсации
Важно: детям до полугода противогриппозную инъекцию не делают, т. к. они под защитой материнского иммунитета. Также не рекомендуют прививать детей до трех лет из-за широкого спектра осложнений и противопоказаний к процедуре.
к. они под защитой материнского иммунитета. Также не рекомендуют прививать детей до трех лет из-за широкого спектра осложнений и противопоказаний к процедуре.
Попав в организм человека, белковые структуры противогриппозного препарата способны распознать и уничтожить вирус, пресекая его размножение. Эффект иммунной реакции организма сохраняется от полугода до года, становясь залогом высокой сопротивляемости человека вирусу на период сезонной эпидемии, даже определенной защитой против ОРЗ.
Как и чем проводят профилактику сезонного заболевания
В настоящее время вакцинация общества считается основным средством массовых профилактических мер против разворачивания масштабных эпидемий. Эффективность процесса защиты зависит от правильного выбора типа вакцины, которая содержит живые (ослабленные) или убитые вирусы или их фрагменты. Попадая в человеческий организм, они заставляют его бороться с инфицированием, тем самым формируя специфический ответ на заражение (иммунитет).
Цель и задача вакцинации – помочь человеческому организму вырабатывать защитные антитела в ответ на поступившие с препаратом специфические антигены, что повышает сопротивляемость организма инфекции. Иммунизацию обычно проводят в поликлиниках по месту жительства населения и специализированных вакцинальных центрах, а также в частных клиниках (имеющих лицензию), которые в качестве платной услуги могут сделать инъекцию на дому.
Совет: следует помнить, чтобы обеспечить высокую эффективность, противогриппозную прививку делают ежегодно минимум за две недели до официального начала эпидемии, поскольку на формирование иммунитета потребуется 14 дней. Вакцина действует весь эпидемический сезон, а 80%-й охват населения способствует коллективному иммунитету.
Процедура иммунизации выполняется следующими типами препаратов:
- Вакцинами живыми, способными вызвать заболевание гриппом легкой формы. Прививка обеспечивает довольно стойкий иммунитет хорошей силы.

- Инактивированными вакцинами, которые могут быть:
- цельновирионными, для них характерна стабильная устойчивость к заболеванию, но процент побочных действий высокий;
- расщепленными, способными обеспечить максимум иммунитета без токсического воздействия;
- субъединичными, их эффективность уступает расщепленным сплит-вакцинам;
- виросомальными комплексными, обеспечивающими усиление иммунного ответа на вакцинацию, переносятся хорошо.
Какие вакцины против гриппа предусмотрены во время иммунизации
|
Тип |
Информация о препарате |
Как вводят |
|
Живая вакцина (аттенуированная) |
Препарат содержит ослабленные штаммы вируса, культивируемые на куриных эмбрионах, может вызвать заболевание гриппом. Прививка запрещена к использованию во время эпидемии, противопоказана людям с хроническими заболеваниями, детям и беременным |
Для стимуляции местного ответа вводят интраназально, взрослым однократно, детям — дважды |
|
Цельновирионная вакцина |
Инактивированная очищенная, содержит концентрацию вирусов, убитых специальной обработкой. |
Внутримышечный и подкожный способ введения с 16-ти лет, с 7-ми лет — интраназально |
|
Расщепленные сплит-вакцины |
В их составе разрушенные компоненты вируса, но способные сформировать иммунный ответ. Содержат комбинацию наружных и внутренних антигенов оболочки вируса, что обеспечивает защиту от новых и старых модификаций вируса |
Внутримышечный однократный метод введения (мышца плеча) с 6-месячного возраста |
|
Субъединичные вакцины |
Состав препарата обогащен фрагментами поверхностных антигенов оболочки вируса, что несколько снижает эффект от вакцинации. Средство может содержать дополнительное усиливающее вещество (полиоксидоний), может выпускаться в индивидуальной шприц-дозе |
Внутримышечный и подкожный способ введения, особой категории людей положено вводить дважды |
|
Виросомальная вакцина |
Разработана по новым технологиям, инактивированная, с виросомальным комплексом поверхностных антигенов вируса. |
Внутримышечный и подкожный метод введения, малышам с недостаточным весом прививку ставят в бедро |
Совет: следует учесть, что противогриппозная сыворотка это защита только от заболевания гриппом, а не от других простудных болезней, хотя после вакцинации их течение ослаблено. Кроме того, инъекция не снижает иммунитет, а прививаемый не становится источником инфицирования для окружающих.
Какими осложнениями может обернуться заболевание гриппом
Медики считают, что само заболевание не так опасно, как множество тяжелых его осложнений, которые призвана остановить прививка. Правда, что сама вакцинация против гриппа может стать причиной некоторых побочных реакций на введение противогриппозной сыворотки. Реакции, как правило, местного характера и обычно быстро проходят, проявляются через сутки после инъекции, а исчезают бесследно максимум через три дня.
Среди побочных реакций на прививку появление красноты, слабого отека и тяжести в зоне укола. Иногда снижается аппетит, может повыситься температура, сопровождаемая легким недомоганием. Эти симптомы свидетельствуют о том, что действие прививки началось.
Совет: если температура превысила 38-градусный барьер на фоне общей слабости и разбитого состояния, а место инъекции сильно припухло с появлением признаков нагноения, такие признаки считаются отклонением от нормы. Необходимо срочно поставить в известность врача.
Страх перед побочными явлениями введения противогриппозной сыворотки не должен стать причиной отказа от прививки, поскольку осложнения после гриппа затрагивают ряд важных систем жизнеобеспечения человеческого организма.
Как заболевание, грипп непредсказуем, а осложнения после него подразделяют на следующие группы:
- Осложнения после болезни, связанные с непосредственным ее течением, вызывают развитие:
- геморрагического отека легких;
- менингитов, а также менингоэнцефалитов серозных;
- инфекционно-токсического шока.

- Осложнения после гриппа, причиной которых становится присоединение бактериальных инфекций (вторичных), вызывают заболевание:
- пневмонией;
- отитами и синуситами;
- гломерулонефритом;
- гнойными менингоэнцефалитами.
Совет: именно для предотвращения и профилактики смертельно опасных осложнений так важна вакцинация против гриппа, тем более что тяжелые побочные явления после нее довольно редкое явление.
Кроме прививок перед началом эпидемии, в качестве профилактических мер, медики советуют поддержать организм витаминами и растительными препаратами, закаливанием. Экстренную профилактику и лечение стремительно распространяющегося гриппа рекомендуют осуществлять методами пассивной профилактики, применяя препараты из ряда иммуноглобулинов строго по индивидуальному назначению врача.
Врачи посоветовали, как быть с прививками от COVID и гриппа :: Общество :: РБК
Осенью стартует ежегодная вакцинация от гриппа. Между прививками от коронавируса и гриппа должен пройти месяц, указывают врачи. Они рекомендуют воздержаться от инъекций в одно время и сначала закончить вакцинацию от COVID-19
Между прививками от коронавируса и гриппа должен пройти месяц, указывают врачи. Они рекомендуют воздержаться от инъекций в одно время и сначала закончить вакцинацию от COVID-19
Фото: Сергей Киселев / АГН «Москва»
Прививки от гриппа и коронавирусной инфекции лучше разделять и не делать в одно время, сообщили РБК опрошенные эксперты. Они рекомендуют сначала завершить вакцинацию от COVID-19, а затем сделать инъекцию от гриппа.
Они рекомендуют сначала завершить вакцинацию от COVID-19, а затем сделать инъекцию от гриппа.
Между прививками должен пройти месяц, рассказала руководитель Центра формирования здорового образа жизни Ирина Добрецова. По ее словам, спланировать личный календарь прививок нужно таким образом, чтобы к сезонному всплеску гриппа в декабре—январе уже выработался устойчивый иммунитет. «Необходимо сначала выработать иммунитет к коронавирусной инфекции, а потом спокойно, осенью, заблаговременно поставить себе прививку от гриппа и пневмококка», — добавила эксперт.
Добрецова отметила, что вакцинация от коронавируса не отменяет прививку от гриппа. «Когда сейчас идет время коронавирусной инфекции, любая другая инфекция может усугубить течение этой болезни, могут быть тяжелые осложнения. Если это микс коронавирусной инфекции и гриппа, то, получается, это в разы может усилить неблагоприятное течение», — сказала она.
Терапевт, клинический фармаколог Андрей Кондрахин отметил, что в пандемию прививка от гриппа по-прежнему необходима. «Это другой вирус, и он тоже несет за собой последствия», — сказал Кондрахин.
«Это другой вирус, и он тоже несет за собой последствия», — сказал Кондрахин.
Доктор биологических наук, профессор вирусологии Александр Шестопалов рассказал РБК, что между инъекциями от вакцин против гриппа и COVID-19 должно пройти минимум две-три недели, чтобы организм «воспринял обе вакцины». Перерыв необходим, чтобы не нагружать организм и лучше отследить побочные эффекты от вакцин, отметила Добрецова. Кондрахин сказал, что пауза нужна еще и для того, чтобы четче определить действие вакцин. «Человек может списать действие, проявление одной вакцины на другую, это может исказить информацию», — заключил он.
Ослабляет ли прививка от COVID-19 врожденный иммунитет? Фактчекинг DW | События в мире — оценки и прогнозы из Германии и Европы | DW
«Вакцина BioNTech ослабляет иммунитет?» — именно так звучит заголовок сообщения телеканалов DMAX и Hamburg 1, которое сейчас активно обсуждают в немецком сегменте соцсетей Twitter и Facebook. Сама новость посвящена исследованию Университета Неймегена в Нидерландах о влиянии данной мРНК-вакцины на иммунную систему человека. Его выводы были обнародованы в мае 2021 года на платформе medRxiv, предназначенной для публикации предварительных результатов научных исследований, которые еще не были отрецензированы научным сообществом и не имеют статуса проверенных данных.
Его выводы были обнародованы в мае 2021 года на платформе medRxiv, предназначенной для публикации предварительных результатов научных исследований, которые еще не были отрецензированы научным сообществом и не имеют статуса проверенных данных.
Ссылаясь на эту научную работу, некоторые пользователи Сети заявляют, что в ней содержатся доказательства негативного влияния мРНК-вакцины BioNTech/Pfizer на иммунную систему. DW разобралась, что именно изучалось в этом исследовании и насколько обоснованы его выводы.
В Нидерландах выяснили, что прививка от ковида ослабляет врожденный иммунитет?
Нет. Исследование было проведено с целью определить эффективность вакцины BioNTech/Pfizer против нового коронавируса SARS-CoV-2, и в результате действенность препарата подтвердилась, рассказал в беседе с DW один из авторов исследования Михаи Нетеа. Утверждение о том, что исследование доказывает, что прививка вакциной от коронавируса BioNTech/Pfizer ослабляет врожденный иммунитет организма, не соответствует действительности, подчеркивает ученый.
«Мы хотели изучить влияние новых мРНК-вакцин на иммунитет. Это важно, поскольку они еще долго будут сопровождать нас, — говорит Нетеа. — Печально, что некоторые интерпретируют результаты этой работы в направлении, которое вовсе не имелось в виду».
Суть нидерландского исследования мРНК-вакцины BioNTech/Pfizer
Авторы исследования проанализировали ответную реакцию иммунной системы 16 добровольцев на различные стимуляторы. При этом подтвердилось, что прививка вакциной BioNTech влияет как на приобретенный, так и на врожденный иммунитет.
Глава Немецкого общества иммунологии Кристине Фальк
Клетки иммунной системы участников исследования стимулировали не только при помощи вируса SARS-CoV-2, но и посредством других возбудителей (частиц вирусов, грибков и бактерий). Оказалось, что ответ иммунной системы был или сильнее, или слабее обычного — в зависимости от рода стимулятора и времени анализа.
По словам главы Немецкого общества иммунологии Кристине Фальк (Christine Falk), результаты этой работы показывают, насколько тонко работает иммунная система на молекулярном уровне, и говорят о том, что и врожденный иммунитет можно «тренировать».
Вероятность заболеть после прививки выше обычного?
Нет, это неверно. Иммунная система человека настолько универсальна, что может бороться с вирусами одновременно на нескольких фронтах, указывает Кристине Фальк. «Представьте себе: в нашем организме существует целая армия T-клеток и B-клеток и всего десять из них борются в данный момент со спайковыми белками, а оставшаяся часть армии стоит наготове, — поясняет ученая. — Так что нет повода волноваться, что иммунная система после прививки становится более уязвимой».
Опасны ли изменения, вызываемые в иммунной системе мРНК-вакцинами?
Формулировка «перепрограммирование врожденного иммунитета», которой воспользовались журналисты телеканалов DMAX и Hamburg 1, особенно взволновала пользователей соцсетей. На первый взгляд кажется, что речь идет о необратимых изменениях, вызванных манипуляциями над иммунной системой человека. Однако на самом деле эта фраза — синоним выражений «натренированный иммунитет» и «врожденная иммунологическая резистентность».
На первый взгляд кажется, что речь идет о необратимых изменениях, вызванных манипуляциями над иммунной системой человека. Однако на самом деле эта фраза — синоним выражений «натренированный иммунитет» и «врожденная иммунологическая резистентность».
По словам Фальк, на врожденный иммунитет влияют все вакцины, а не только препараты против SARS-CoV-2. «Перепрограммирование врожденного иммунного ответа нельзя приравнивать к ослаблению всей иммунной системы», — указывает, со своей стороны, автор нидерландского исследования Михаи Нетеа.
Усиленная защита от грибков и ослабленная — от вирусов
Один из пользователей соцсети Twitter при обсуждении нидерландского исследования ссылается на известного немецкого иммунолога и публициста, главу Института медицинской микробиологии при университетской клинике в Галле Александера Кекуле (Alexander Kekule).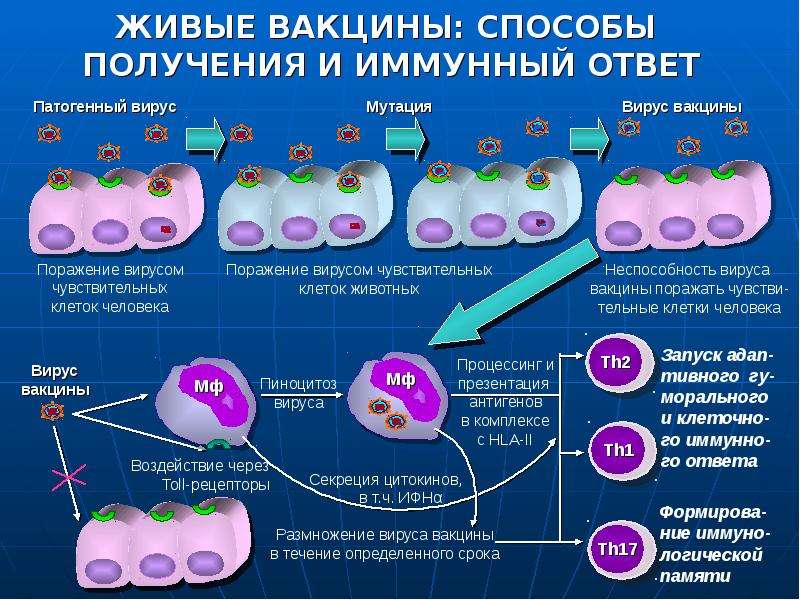 По словам пользователя, тот утверждает, что нидерландские ученые пришли к выводу, что прививка вакциной от COVID-19 BioNTech/Pfizer ослабляет иммунитет к другим вирусам. Так ли это и что именно сказал немецкий иммунолог?
По словам пользователя, тот утверждает, что нидерландские ученые пришли к выводу, что прививка вакциной от COVID-19 BioNTech/Pfizer ослабляет иммунитет к другим вирусам. Так ли это и что именно сказал немецкий иммунолог?
Иммунолог Александер Кекуле
25 мая 2021 года Кекуле в своем подкасте Kekules Corona-Kompass в эфире немецкой общественно-правовой медиакомпании MDR действительно рассказал о новом исследовании нидерландских ученых о влиянии прививки мРНК-вакциной BioNTech/Pfizer на иммунитет.
Кекуле напомнил, что для иммунной системы важны не только антитела и так называемые цитотоксические T-клетки, появляющиеся после прививки как часть приобретенного иммунитета, но и врожденный иммунитет, который начинает работу еще до того формирования «памяти» о возбудителе. «И именно этот иммунитет, который никак не связан с прививкой, модулируется (в результате прививки. — Ред.)», — объясняет эксперт.
«Поразительно, что это модулирование, как показывают голландцы, заключается в том, что некоторые защитные механизмы, работающие против определенных вирусов и бактерий, замедляются посредством прививки. Это означает, что, когда я делаю прививку против SARS-CoV-2, естественным образом активируется иммунный ответ организма на заражение этим новым вирусом. Однако параллельно замедляется иммунный ответ на заражения другими вирусами. Таким образом, это своего рода переключение работы (иммунной системы. — Ред.) на SARS-CoV-2, а против других вирусов организм, так сказать, имеет менее эффективную иммунную защиту», — говорит буквально Александер Кекуле.
Это означает, что, когда я делаю прививку против SARS-CoV-2, естественным образом активируется иммунный ответ организма на заражение этим новым вирусом. Однако параллельно замедляется иммунный ответ на заражения другими вирусами. Таким образом, это своего рода переключение работы (иммунной системы. — Ред.) на SARS-CoV-2, а против других вирусов организм, так сказать, имеет менее эффективную иммунную защиту», — говорит буквально Александер Кекуле.
При этом он указывает, что иммунологам известны и другие случаи — когда человек, привитый против вируса А, оказывается лучше защищен и от вируса B. «Но в данном случае врожденный иммунитет понижается. В то же время — внимание! — в отношении грибковых заболеваний все происходит с точностью до наоборот. То есть, если вас привили вакциной BioNTech, у вас возникает усиленный иммунный ответ на грибки, однако ослабленный иммунный ответ на другие вирусы и бактерии», — объясняет Кекуле.
К моменту публикации материала DW Александер Кекуле не ответил на запрос редакции с просьбой прокомментировать свои слова о нидерландском исследовании.
Меняет ли прививка нашу иммунную систему надолго?
Нет. По словам Михаи Нетеа, изменения в реакции врожденного иммунитета организма на неспецифические стимуляторы после прививки вакциной BioNTech/Pfizer носят краткосрочный характер. Это подтверждает и опыт Кристине Фальк. Уже по прошествии двух недель после второй прививки против COVID-19 иммунная система возвращалась к работе в нормальном режиме, имея в запасе нужные антитела.
Предположительно, вакцина BioNTech/Pfizer усиливает защиту от грибковых заболеваний
С точки зрения иммунолога Фальк, опасность представляет собой, скорее, изменение иммунной системы, происходящее вследствие перенесенной болезни. «Мы осмотрели 100 пациентов. У всех них наблюдалось смещение иммунных клеток в крови. Это означает, что даже при отсутствии осложнений вирус устраивает «беспорядок» в иммунной системе.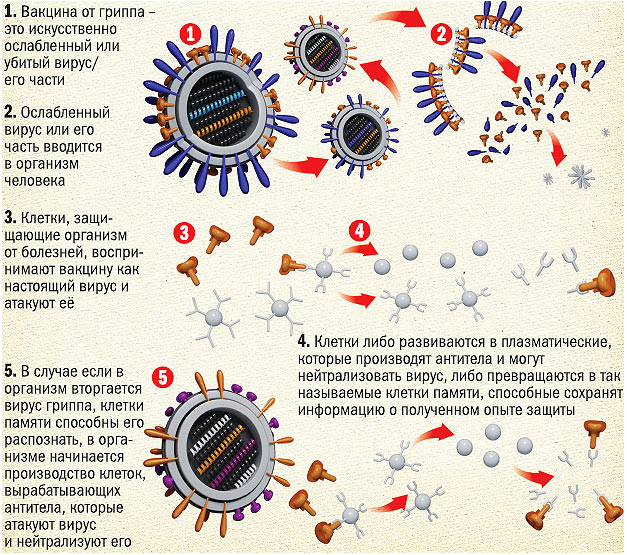 Даже при легком течении болезни иммунная система борется изо всех сил. Возникающие в результате этого изменения заметны и по прошествии месяцев. И это вызывает у меня большую тревогу», — резюмирует Фальк.
Даже при легком течении болезни иммунная система борется изо всех сил. Возникающие в результате этого изменения заметны и по прошествии месяцев. И это вызывает у меня большую тревогу», — резюмирует Фальк.
Смотрите также:
Вакцина BioNTech и Pfizer: германо-американская история успеха
Вакцина Made in Germany
В Германии, США, Израиле и ряде других стран подавляющая часть населения будет привита от коронавируса мРНК-вакциной BioNTech/Pfizer. Для простоты ее часто называют «пфайзеровской», хотя точнее было бы сказать «байонтековской». В основе ее успеха — стратегический альянс инновационной немецкой биотехнологической фирмы-разработчика и опытного американского гиганта классической фармацевтики.
Вакцина BioNTech и Pfizer: германо-американская история успеха
Успех детей мигрантов
Фирму BioNTech основали в 2008 году в Майнце при участии финансовых инвесторов профессор медицины Угур Шахин, сын турецкого гастарбайтера на автозаводе Ford в Кёльне, и его жена Озлем Тюречи, дочь приехавшего в ФРГ турецкого врача.
 Она стала директором по медицинским исследованиям новой компании, которая сосредоточилась на индивидуализированных иммунотерапиях рака и других тяжелых заболеваний.
Она стала директором по медицинским исследованиям новой компании, которая сосредоточилась на индивидуализированных иммунотерапиях рака и других тяжелых заболеваний.Вакцина BioNTech и Pfizer: германо-американская история успеха
Офис на улице «У золотого кладезя»
Головной офис BioNTech находится в Майнце на улице с историческим названием «У золотого кладезя», что теперь, естественно, всячески обыгрывают журналисты. 12 января 2020 года Угур Шахин, прочитав в медицинском журнале The Lancet статью про новый вирус в китайском Ухане и осознав, что дело идет к пандемии, тут же приступил к созданию вакцины на основе наработанных за десятилетие РНК-технологий.
Вакцина BioNTech и Pfizer: германо-американская история успеха
Pfizer: испытания и производство
17 марта 2020 года BioNTech заключила стратегический альянс с Pfizer. Два года до этого они уже начали разрабатывать мРНК-вакцину против гриппа. Корпорация из Нью-Йорка, основанная в 1849 году двумя выходцами из Германии и входящая ныне в тройку лидеров мировой фармацевтики, организовала в шести странах клинические испытания немецкого препарата и предоставила свои производственные мощности.

Вакцина BioNTech и Pfizer: германо-американская история успеха
Первая вакцина от COVID-19 в США и ЕС
В декабре 2020 после завершения третьей фазы клинических испытаний разработка BioNTech и Pfizer стала первой вакциной от COVID-19, которую разрешили к применению как в США, так и в Евросоюзе. К тому моменту ЕС уже имел договор о покупке 200 млн доз и опцию на дополнительные 100 млн доз. В Германии самые первые прививки получили 27 декабря пенсионеры в возрастной группе 80+ в домах престарелых.
Вакцина BioNTech и Pfizer: германо-американская история успеха
Завод Pfizer в Бельгии снабжает весь мир
Амбициозная цель двух компаний — выпустить в 2021 году 2 млрд доз. Три предприятия Pfizer в США обеспечивают североамериканский рынок, а снабжать Европу и остальной мир поручено заводу корпорации в бельгийском Пуурсе. Уже в январе стало ясно, что его мощностей не хватит для удовлетворения глобального спроса, и началось их срочное расширение, из-за чего примерно на месяц упали объемы производства.

Вакцина BioNTech и Pfizer: германо-американская история успеха
Марбург обеспечит 750 млн доз в год
До создания вакцины BioNTech имела в Германии сравнительно небольшие производственные мощности. Теперь потребовалось крупное предприятие. 17 сентября 2020 года компания купила у швейцарского фармацевтического концерна Novartis завод в Марбурге. После срочной реконструкции и переоснащения он заработал 10 февраля. План на первое полугодие 2021 — 250 млн доз, проектная мощность — 750 млн доз в год.
Вакцина BioNTech и Pfizer: германо-американская история успеха
Логистика требует холодного расчета
Особенность вакцины BioNTech/Pfizer — ей требуются сверхнизкие температуры до минус 80 градусов. Поэтому при транспортировке используются специальные термобоксы. Каждая содержит 23 килограмма сухого льда, проложенного тремя слоями: это обеспечивает холод в течение десяти дней. И каждая оснащена термосенсорами, подключенными к спутниковой системе GPS.
 На снимке: прибытие партии вакцин в Италию.
На снимке: прибытие партии вакцин в Италию.Вакцина BioNTech и Pfizer: германо-американская история успеха
Израиль подтвердил эффективность вакцины
Ни одна страна не прививала свое население в декабре-феврале такими высокими темпами, как Израиль, и ни одна другая не изучала при этом столь пристально эффективность вакцины BioNTech/Pfizer. 21 февраля министерство здравоохранения Израиля сообщило: через две недели после второй прививки риск заболеть снижается на 95,8%, а угроза попасть в больницу или умереть — на 98,9%.
Вакцина BioNTech и Pfizer: германо-американская история успеха
Орден в знак благодарности
Германия отблагодарила своих ученых высшей наградой страны — орденом Крест за заслуги. 19 марта 2021 его вручил Озлем Тюречи и Угуру Шахину президент ФРГ Франк-Вальтер Штайнмайер. «Вы приняли решение быть учеными и предпринимателями, потому что хотели, чтобы результаты ваших научных исследований дошли до пациентов, — подчеркнул он.
 — Вы создали вакцину для всего человечества».
— Вы создали вакцину для всего человечества».Автор: Андрей Гурков
Иммунобиология вакцин против гриппа
Реферат
Вакцинация — это основная стратегия профилактики и контроля гриппа. Белок поверхностного гемагглютинина (НА) вируса гриппа содержит два структурных элемента (голова и стебель), которые различаются по своей потенциальной полезности в качестве мишеней для вакцины. Головка белка НА является основной мишенью для антител, которые придают защитный иммунитет к вирусам гриппа. Основное состояние здоровья, возраст и полиморфизм генов реципиентов вакцины и, что не менее важно, степень антигенного соответствия между вирусами в вакцине и вирусами, которые циркулируют, модулируют защиту вакцины от гриппа.Адъюванты вакцины и живая аттенуированная вакцина против гриппа улучшают широту иммунитета к сезонным и пандемическим штаммам вирусов. Выявление антител против консервативной области ствола НА, которые перекрестно реагируют с НА в типах или подтипах вируса гриппа, позволило бы разработать универсальную вакцину против гриппа. Очень сложная сеть взаимодействий, возникающая после заражения гриппом и вакцинации, может быть изучена с использованием инструментов системной биологии, таких как микрочипы ДНК. Использование системной вакцинологии позволило создать сигнатуры экспрессии генов, которые представляют ключевые транскрипционные различия между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа.Кроме того, использование инструментов системной вакцинологии привело к идентификации новых маркеров суррогатных генов, которые являются предикторами силы реакции хозяина на вакцины, что имеет решающее значение как для разработки вакцины, так и для общественного здравоохранения. Выявление связи между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин.
Очень сложная сеть взаимодействий, возникающая после заражения гриппом и вакцинации, может быть изучена с использованием инструментов системной биологии, таких как микрочипы ДНК. Использование системной вакцинологии позволило создать сигнатуры экспрессии генов, которые представляют ключевые транскрипционные различия между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа.Кроме того, использование инструментов системной вакцинологии привело к идентификации новых маркеров суррогатных генов, которые являются предикторами силы реакции хозяина на вакцины, что имеет решающее значение как для разработки вакцины, так и для общественного здравоохранения. Выявление связи между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин.
Критические успехи в понимании иммунобиологических механизмов, ведущих к защите, обеспечиваемой противогриппозными вакцинами, были достигнуты за последнее десятилетие. В этом обзоре мы обсуждаем наиболее актуальные из этих достижений с особым акцентом на использование инструментов вакцинологии для улучшения производства вакцин и повышения иммуногенности, а также на системную вакцинологию для раннего выявления лиц, отвечающих на вакцинацию. Мы также уделяем внимание гетеротипическому иммунитету к гриппу и иммунологической основе для разработки универсальной вакцины против гриппа. Эти проблемы в разработке вакцины против гриппа и соответствующие возможности кратко описаны в.
В этом обзоре мы обсуждаем наиболее актуальные из этих достижений с особым акцентом на использование инструментов вакцинологии для улучшения производства вакцин и повышения иммуногенности, а также на системную вакцинологию для раннего выявления лиц, отвечающих на вакцинацию. Мы также уделяем внимание гетеротипическому иммунитету к гриппу и иммунологической основе для разработки универсальной вакцины против гриппа. Эти проблемы в разработке вакцины против гриппа и соответствующие возможности кратко описаны в.
Таблица 1
— Проблемы и стратегии в разработке вакцины против гриппа
| Проблемы | Стратегии |
| Антигенный дрейф / сдвиг вируса гриппа | Повышение антигенного соответствия за счет разработки универсальной вакцины против гриппа (защищает от большинство разновидностей штаммов и подтипов гриппа): |
1. Вакцина-кандидат будет вырабатывать антитела против консервативной области ствола HA, которые перекрестно реагируют с HA h2 и h4 1 Вакцина-кандидат будет вырабатывать антитела против консервативной области ствола HA, которые перекрестно реагируют с HA h2 и h4 1 | |
| 2. Вакцина-кандидат будет использовать внеклеточные домены M2 и NP в качестве защитных антигенов 2 | |
| 3. Разработка кандидатных универсальных вакцин против гриппа на основе сигнатур генов, связанных с разработкой широкопротекторных антител 3 | |
| Усиление клеточно-опосредованных ответов с помощью LAIV 4 | |
| Индивидуальные вариации иммунного ответа на грипп | Использование индивидуального подхода, ориентированного на пациента: |
1. Увеличить текущие знания о генетических полиморфизмах хозяина в иммунном ответе на вакцину против гриппа 5 Увеличить текущие знания о генетических полиморфизмах хозяина в иммунном ответе на вакцину против гриппа 5 | |
| 2. Использование инструментов системной вакцинологии для дальнейшего понимания влияния индивидуальных генетических вариаций на развитие защитного иммунитета 3 | |
| Субоптимальная иммуногенность в группах риска: пожилые люди (старение иммунитета), люди с сопутствующими заболеваниями (тяжелая астма) | Разработка адъювантных противогриппозных вакцин 6 |
| Надежное праймирование клеточной ветви иммунная система с виросомами 7 | |
| Производство высокодозных вакцин против гриппа 8 | |
| Раннее выявление лиц, не ответивших на вопросы, с помощью вакцинных чипов 3 | |
| Потребность в вакцинах которые вызывают быстрое повышение защитных антител в условиях пандемии гриппа | Препандемическое праймирование противогриппозной вакциной с адъювантом MF59 с последующим усилением долгоживущих В-клеток памяти человека в условиях пандемии 9 |
| Потребность в вакцинах, которые можно было бы быстро производить в ответ на начинающуюся пандемию | Надзор, направленный на выявление пандемических вирусов-предшественников с новыми NA 10 |
| Ограниченная доступность субъединичных белков НА и NA для производства вакцины | Антиген -сохраняющие режимы вакцинации путем разработки вакцин на основе адъювантов 11 — 15 |
| Продленный график производства вакцины | Сокращение сроков производства вакцины на: |
1. Использование технологии обратной генетики на основе плазмид для создания референсных штаммов вакцин 16 , 17 Использование технологии обратной генетики на основе плазмид для создания референсных штаммов вакцин 16 , 17 | |
| 2. Разработка нерепликативной вакцины против гриппа с вектором аденовируса, которая может быть произведена без предварительных условий роста гриппа вирус в яйцах или клетках 18 | |
| Несбалансированный ответ на HA и NA в существующих противогриппозных вакцинах | Разработка противогриппозных вакцин с более высоким содержанием антигена NA 19 |
| Низкая иммуногенность пандемического гриппа штаммов у иммунологически наивных людей | Разработка новых адъювантных вакцин 9 |
| Длительное время, необходимое для оценки новых противогриппозных вакцин в клинических испытаниях, особенно в контексте пандемии | Идентификация ранних молекулярных сигнатур, которые могут быть используется для предсказания последующие иммунные ответы 20 , 21 |
| Применение знаний, полученных из ранних иммунных сигнатур субоптимальных вакцин, для разработки более эффективных 3 |
Вирус гриппа и иммунные медиаторы защиты
Выделение вируса гриппа А в 1933 г. 22 привело к первому использованию противогриппозных вакцин в 1930-х и 1940-х годах. 23 — 25 Вирусы гриппа содержат восемь одноцепочечных сегментов РНК, кодирующих 11 белков, и классифицируются на три различных типа на основе основных антигенных различий: грипп A, грипп B и грипп C, с типами A и B вызывает ежегодные эпидемии среди людей. 26 Тримерный гликопротеин гемагглютинина (НА) является главной детерминантой вирулентности и отвечает за прикрепление вируса к специфическим белкам, содержащим сиаловую кислоту, на поверхности клетки-хозяина и, в конечном итоге, за слияние вирусной и эндосомной мембран и выброс вирусных нуклеиновых кислот в цитоплазму.Белок НА содержит два структурных элемента: головку (основная мишень антител, обеспечивающих защитный иммунитет к вирусам гриппа 27 ) и стебель. Оба элемента различаются по своей потенциальной полезности в качестве мишеней для вакцины (обсуждаются в разделе «Шаги к разработке универсальной вакцины против гриппа»).
22 привело к первому использованию противогриппозных вакцин в 1930-х и 1940-х годах. 23 — 25 Вирусы гриппа содержат восемь одноцепочечных сегментов РНК, кодирующих 11 белков, и классифицируются на три различных типа на основе основных антигенных различий: грипп A, грипп B и грипп C, с типами A и B вызывает ежегодные эпидемии среди людей. 26 Тримерный гликопротеин гемагглютинина (НА) является главной детерминантой вирулентности и отвечает за прикрепление вируса к специфическим белкам, содержащим сиаловую кислоту, на поверхности клетки-хозяина и, в конечном итоге, за слияние вирусной и эндосомной мембран и выброс вирусных нуклеиновых кислот в цитоплазму.Белок НА содержит два структурных элемента: головку (основная мишень антител, обеспечивающих защитный иммунитет к вирусам гриппа 27 ) и стебель. Оба элемента различаются по своей потенциальной полезности в качестве мишеней для вакцины (обсуждаются в разделе «Шаги к разработке универсальной вакцины против гриппа»). Протеолитическое расщепление НА необходимо для образования инфекционного вируса, но роль расщепления НА в патогенезе у людей в настоящее время неизвестна. Однако известно, что вирусы гриппа используют неструктурный белок 1 в качестве механизма обхода интерфероновой реакции хозяина I типа (обсуждается в разделе «Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин»).Нейраминидаза (NA) представляет собой гликопротеин, который удаляет сиаловую кислоту из вирусных белков и предотвращает агрегацию вируса за счет связывания белка HA с другими белками. Антитела к вирусам NA накапливают на поверхности клетки, эффективно уменьшая количество вируса, высвобождаемого из инфицированных клеток. 19 Хотя иммунный ответ на поверхностные гликопротеины гриппа в основном гуморальный, Т-клетки CD4 + и CD8 + также играют важную роль в иммунитете к гриппу.
Протеолитическое расщепление НА необходимо для образования инфекционного вируса, но роль расщепления НА в патогенезе у людей в настоящее время неизвестна. Однако известно, что вирусы гриппа используют неструктурный белок 1 в качестве механизма обхода интерфероновой реакции хозяина I типа (обсуждается в разделе «Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин»).Нейраминидаза (NA) представляет собой гликопротеин, который удаляет сиаловую кислоту из вирусных белков и предотвращает агрегацию вируса за счет связывания белка HA с другими белками. Антитела к вирусам NA накапливают на поверхности клетки, эффективно уменьшая количество вируса, высвобождаемого из инфицированных клеток. 19 Хотя иммунный ответ на поверхностные гликопротеины гриппа в основном гуморальный, Т-клетки CD4 + и CD8 + также играют важную роль в иммунитете к гриппу.
В отличие от штаммоспецифического ответа антител, клеточный иммунитет имеет тенденцию быть более перекрестным между вирусными подтипами, распознавая более консервативные эпитопы на поверхностных белках и внутренних вирусных белках. 28 Открытие эпитопов на относительно хорошо консервативных белках гриппа, таких как нуклеопротеин (NP) M, и основа тримеров HA служит основой для разработки универсальной вакцины против гриппа, способной вызывать ответные реакции. перекрестная реактивность между подтипами (обсуждается в разделе «Шаги к разработке универсальной вакцины против гриппа»).
Из-за своих полимераз, подверженных ошибкам, вирусы гриппа претерпевают генетические изменения, которые приводят к постепенным антигенным изменениям как в НА, так и в NA, процесс, известный как антигенный дрейф, который приводит к появлению новых вариантных штаммов. 29 Антигенный сдвиг происходит, когда циркулирующий в настоящее время вирус гриппа A исчезает и заменяется новым подтипом с новыми гликопротеинами, с которыми антитела против ранее циркулирующего подтипа не реагируют перекрестно. 30 Однако воздействие 1918-подобного вируса h2N1 (от предыдущей инфекции или вакцинации) способствовало индукции перекрестно-реактивного ответа антител на вирус гриппа A (h2N1) 2009 года. 31
30 Однако воздействие 1918-подобного вируса h2N1 (от предыдущей инфекции или вакцинации) способствовало индукции перекрестно-реактивного ответа антител на вирус гриппа A (h2N1) 2009 года. 31
Филогенетический анализ последовательностей генов гриппа показал, что штаммы пандемий 20-го века возникли в результате многократного перераспределения вирусных генов между вирусами человека и животных. Хотя новый подтип всегда был новым HA, эти анализы показали, что новые NA и внутренние гены были введены в преобладающие штаммы вируса человека до приобретения нового пандемического HA. Меры надзора, направленные на выявление этих вирусов-предшественников, могут заранее предупредить должностных лиц здравоохранения о возникновении будущих пандемий. 10
Вакцинация является основной стратегией профилактики и борьбы с гриппом, 32 , 33 , но вакцина против гриппа должна пересматриваться почти каждый год, чтобы учесть постоянно возникающие проблемы. изменение вируса. Защита после естественной инфекции в первую очередь обеспечивается HA-специфическими антителами в сыворотке и слизистой оболочке, тогда как антитела, направленные против NA, консервативных белков гриппа и Т-клеточных ответов, снижают тяжесть заболевания за счет увеличения клиренса вируса. 26 , 30 , 34 Основываясь на серологических исследованиях гриппа с использованием сыворотки крови человека, титр ингибирования гемагглютинации (HAI) от 1:32 до 1:40 представляет собой диапазон титров. при котором примерно 50% людей будут защищены от заражения. 35 Не существует титра HAI, который мог бы гарантировать защиту от инфекции, 36 — 39 , хотя повышенные уровни сывороточных антител к HA обычно коррелируют с устойчивостью к инфекции гриппа, а более низкие уровни антител связаны с с повышенным риском заболевания среди лиц, инфицированных гриппом. 40 — 43 Идентификация дополнительных медиаторов раннего адаптивного и врожденного иммунитета имеет особое значение при разработке вакцин против пандемического гриппа (обсуждается в разделе «Врожденные иммунные сигнатуры, предсказывающие иммуногенность вакцины против гриппа»).
Разработка перекрестных защитных вакцин против гриппа
Помимо возраста и состояния здоровья реципиента, защита, обеспечиваемая вакцинами, зависит от степени антигенного соответствия между вирусами в вакцине и вирусами, циркулирующими в течение данного сезона гриппа. 44
Традиционные антигены в производстве противогриппозной вакцины
Каждая доза вакцины против сезонного гриппа содержит вирусы (или их белки НА), представляющие штаммы гриппа A (h4N2), A (h2N1) и гриппа B. считается наиболее вероятным распространением в предстоящем сезоне гриппа. Производство вакцины в Соединенных Штатах начинается с создания контрольных штаммов вакцин, то есть гибридных вирусов с генами HA и NA из дрейфующего варианта в сочетании с другими генами из лабораторного штамма, адаптированного для хорошего роста в яйцах. 26 Технология обратной генетики на основе плазмид теперь используется для надежного создания эталонных штаммов в более короткие сроки. 16 , 17 Вирионы, собранные из яиц, химически инактивируют, вирусную оболочку разрушают детергентами, а затем очищают белки HA и NA. HA является основным иммуногеном в инактивированных вакцинах против гриппа, и уровни HA используются для стандартизации доз вакцины. Количество NA не стандартизировано и может сильно различаться для разных производителей и производственных партий.Уровни антител NA также имеют решающее значение для защиты, и есть опасения, что вакцины против гриппа человека не содержат достаточного количества белка NA, чтобы вызвать сильный защитный ответ антител. 19
Мастер-штаммы вируса (MVS) для каждого из трех компонентов вируса гриппа в живой аттенуированной противогриппозной вакцине (LAIV) создаются посредством генетической реассортации. В этом процессе стабильный, аттенуированный, адаптированный к холоду главный донорский вирус скрещивается в культуре ткани с ожидаемым эпидемическим штаммом дикого типа, в результате чего получается MVS, который содержит два генетических сегмента, кодирующих HA и NA, полученные из антигенно релевантных вирусов гриппа. рекомендовано для включения в состав годовой вакцины Центрами по контролю и профилактике заболеваний и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Оставшаяся генетическая основа MVS происходит от основного вируса-донора, содержащего мутации, которые придают адаптированный к холоду, чувствительный к температуре и ослабленный фенотип. 45 LAIV стимулирует сильный перекрестно-реактивный ответ антител у детей и обеспечивает высокий уровень защиты от антигенных дрейфующих штаммов в сезон гриппа, когда существует неоптимальное соответствие между вакцинным штаммом и эпидемическим штаммом. Кроме того, LAIV индуцирует назальные антитела IgA, которые коррелируют с защитой. 4
Альтернативные антигены в производстве вакцины против гриппа
Кандидаты в вакцины могут быть разработаны быстро после секвенирования гена HA, что устраняет необходимость использования патогенных вирусов или адаптации вирусов для роста в яйцах или клеточной культуре. 26 Гены НА были клонированы в векторные вирусы, что привело к получению рекомбинантных вакцин, экспрессирующих белок НА, который индуцирует защитные клеточные ответы и ответы антител против вакцинного вируса и штаммов с антигенным дрейфом в исследованиях на животных. 46 — 50 Было показано, что интраназальное и подкожное введение вакцины против гриппа с вектором аденовируса является эффективным средством получения защитных антител против НА в ранних клинических испытаниях безопасности и иммуногенности. 18
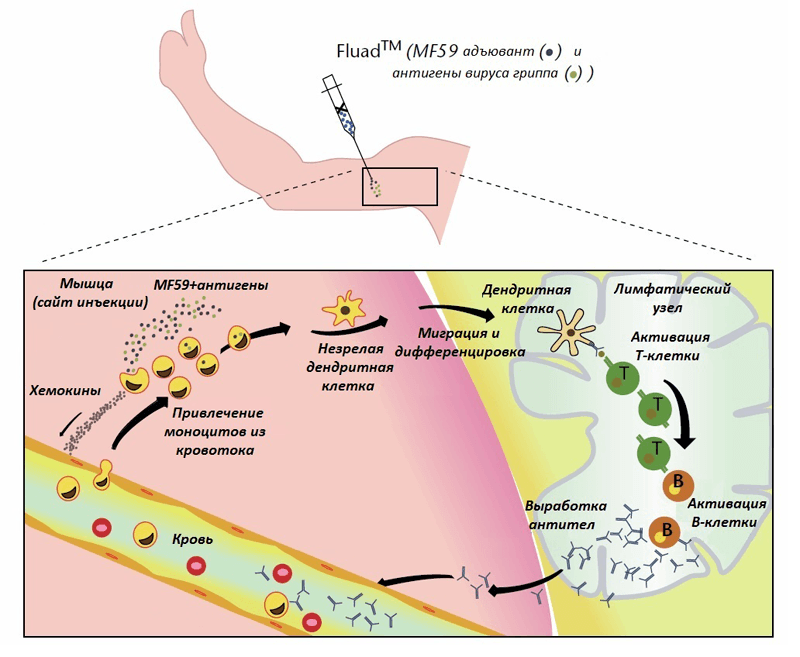
Адъюванты используются для усиления иммунного ответа на вакцинные антигены с 1920-х годов. Как их преимущества, так и побочные эффекты связаны с активацией определенных компонентов врожденной иммунной системы. 51 Адъюванты позволяют использовать антиген-сберегающие режимы, обеспечивают гибкость временного интервала между вакцинациями, улучшают авидность антител и широту иммунитета к дрейфующим штаммам вируса, а также повышают ответ на вакцину у пожилых людей. 6 , 11 — 15
Эмульсии масла в воде, содержащие сквален, в настоящее время используемые в качестве адъювантов для лицензированных инактивированных вакцин против гриппа за пределами США, включают MF59 и AS03. 52 В AS03 сквален объединен с α-токоферолом, увеличивая общее содержание масла в AS03 по сравнению с MF59. MF59 работает независимо от Nalp3. 53 , 54 Его эффекты проявляются в месте инъекции, где он вызывает сильный приток гранулоцитов (нейтрофилов, эозинофилов) и нескольких типов антигенпрезентирующих клеток (APC) (моноциты, макрофаги и др.) дендритные клетки), которые захватывают антиген и адъювант и транспортируют их к дренирующим лимфатическим узлам. 55 Дистанционное праймирование противогриппозными вакцинами с адъювантом MF59 приводит к образованию пула перекрестно-реактивных В-клеток памяти, который может быть быстро усилен спустя годы с помощью несоответствующей вакцины с адъювантом MF59 для получения высоких титров перекрестно-реактивных нейтрализующих антител. 9 AS03 усиливает антиген-специфический адаптивный иммунный ответ за счет стимулирования моноцитов, а не дендритных клеток в качестве основных APC, а также за счет своего воздействия на функцию гранулоцитов и продукцию цитокинов. 56
Виросомы состоят из фосфолипидов, которые спонтанно образуют вирусоподобные пузырьки, к которым прикреплены поверхностные гликопротеины HA и NA вируса гриппа. 57 Виросомы взаимодействуют с В-лимфоцитами и захватываются APC, вызывая более сильный Т-хелперный (Th) 1-ответ, чем тот, который индуцируется неадъювантными противогриппозными вакцинами. 7
Шаги к разработке универсальной вакцины против гриппа
Универсальная вакцина против гриппа обладает способностью защищать от большинства разновидностей штаммов и подтипов гриппа.Многие стратегии разработки универсальной вакцины против гриппа основаны на повышении иммунного ответа против белков гриппа, которые являются высококонсервативными для всех штаммов. 58 , 59 Гетеротипический иммунитет (перекрестная защита) относится к защите некоторых людей от подтипов вируса гриппа, которым они ранее не подвергались в результате естественной инфекции или иммунизации. Возможное объяснение перекрестного защитного иммунитета возникло из понимания молекулярных мишеней широко нейтрализующих моноклональных антител, направленных против различных частей белка НА.
Специфическая область стебля НА является высококонсервативной среди многих вирусных штаммов, и стало возможным стимулировать выработку нацеленных на стебель антител с перекрестными нейтрализующими свойствами у нескольких видов хозяев, включая нечеловеческих приматов. 60 Иммунные ответы на пандемическую инфекцию гриппа h2N1 2009 года включают широко перекрестно-реактивные антитела против эпитопов стебля HA и головного домена множества штаммов гриппа. 61 Большинство HA-специфических антител от здоровых реципиентов вакцины против пандемического гриппа h2N1 также показали широкую перекрестную реактивность с головкой HA, и было показано, что три широких перекрестно-реактивных антитела связываются со стеблем HA. 62
Гетеротипические (перекрестно-защитные) антитела человека генерировались после проведения вакцинации против сезонного гриппа, что приводило к продукции сывороточного IgG, который перекрестно реагировал с H5 HA. Увековечивая В-клетки памяти этих людей, исследователи выделили панель из 20 гетеротипических нейтрализующих моноклональных антител, которые нейтрализовали вирусы, принадлежащие к нескольким подтипам НА (h2, h3, H5, H6 и H9), включая пандемический A / California / 07 / 09 Изолят h2N1. 63 Путем опроса> 100000 плазматических клеток от восьми доноров-людей, инфицированных несколькими штаммами гриппа A или иммунизированных против них, ученые выделили нейтрализующее моноклональное антитело (F16), которое распознало белки HA, присутствующие во всех 16 подтипах гриппа, и нейтрализовало оба h2 и вирусы гриппа А h4 путем связывания с консервативным эпитопом в субдомене слияния (основа тримеров НА). Пассивный перенос этого антитела обеспечивает защиту от инфекции и смерти у животных, предполагая, что выработка антител против области ствола HA, которые перекрестно реагируют с HA h2 и h4 (или между подтипами), является реалистичным подходом к разработке универсальных противогриппозных вакцин. 1
Другие подходы сосредоточены на использовании консервативных эпитопов вирусных белков, включая внеклеточный домен белка ионного канала матрикса 2 (M2) и NP в качестве защитных антигенов. Основываясь на заражении H5N1 у хорьков, иммунизация ДНК-вакцинами, кодирующими HA, индуцирует более высокий титр нейтрализующих антител, чем иммунизация ДНК NP и M2, предполагая, что NP и M2 могут потребовать комбинаторной вакцинации с HA, чтобы быть подходящими кандидатами для универсальных вакцин против гриппа. 2
Тщательное понимание широко защитных ответов антител на консервативные эпитопы имеет решающее значение для разработки универсальной вакцины, но и ответы хозяина также очень важны. Выявлены множественные ассоциации между вариациями гуморального иммунитета к вакцинам против сезонного гриппа и полиморфизмами генов лейкоцитарных антигенов, цитокинов и рецепторов цитокинов человека. Выявление ассоциаций между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин, способных генерировать длительные защитные иммунные ответы против высококонсервативных белков гриппа, поскольку эти гены являются важными мишенями для транскрипции во время иммунных ответов вакцины. 5 Тем не менее, текущая оценка иммуногенности противогриппозных вакцин, основанная исключительно на конечном результате развития адаптивных иммунных ответов, по крайней мере, неполна и не учитывает потенциал врожденных ответов, которые развиваются вскоре после вакцинации. в качестве иммунологических маркеров ответа (обсуждается в разделе «Врожденные иммунные сигнатуры, прогнозирующие иммуногенность вакцины против гриппа»)
Системная вакцинология
Наше понимание врожденных и адаптивных иммунных ответов in vivo значительно улучшилось благодаря использованию системной биологии.Этот развивающийся междисциплинарный подход систематически описывает взаимодействия между всеми частями биологической системы с целью прогнозирования поведения этой системы. 64 Системная биология или системная вакцинология в контексте разработки вакцин требует использования сложных и мощных математических и вычислительных методов моделирования для выявления, измерения и прогнозирования явлений иммунитета, вызванного вакциной, включая, помимо прочего, , различия в экспрессии генов через сотни и тысячи наборов зондов (набор зондов), предназначенных для исследования данной последовательности.
Генерическое и специфичное для гриппа транскрипционное профилирование
Микроматричный чип ДНК — это инструмент системной биологии, содержащий большой упорядоченный массив ДНК-зондов с известной последовательностью, напечатанных на твердой подложке и изготовленных в очень маленьком масштабе. Зонды используются для исследования состава сложных смесей ДНК (включая кДНК, полученную из транскриптов РНК) посредством гибридизации. 65 Такие микромассивы ДНК используются для создания профиля транскрипции (сигнатуры экспрессии генов), который представляет собой снимок генов, экспрессируемых в определенный момент времени конкретным типом клеток или тканью.
Комбинированный анализ опубликованных данных транскрипционного профилирования, полученных из 32 исследований и 77 различных взаимодействий между хозяином и патогеном, привел к идентификации кластера из 511 генов, которые составляют общий ответ хозяина, индуцированный во многих различных типах клеток на разные патогены. 65 Группа генов с наиболее сильной и устойчивой активацией состоит из генов, кодирующих цитокины (так называемый кластер воспалительных / хемотаксических цитокинов). Следует отметить, что повышающая регуляция кластера воспалительных / хемотаксических цитокинов является относительно слабой после заражения вирусом гриппа, который активирует клетки млекопитающих через врожденный иммунный рецептор для одноцепочечного Toll-подобного рецептора (TLR) 7 66 и, возможно, через TLR3.Напротив, вирус гриппа вызывает большую активацию интерферона и индуцированных интерфероном генов, включая несколько генов хемокинов, способствуя развитию иммунного ответа Th2-типа.
Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин
Транскрипционное профилирование успешно использовалось для сравнения влияния вирусных белков из разных штаммов и подтипов на иммунный ответ.Этот подход показал, что подавление экспрессии генов-хозяев может быть локализовано в вирусных белках, которые, как известно, вызывают тяжелое заболевание. Например, ген NS1 вируса гриппа A играет центральную роль в ингибировании зависимых от интерферона, цитокина и ядерного фактора κB сигнальных путей. Вирусы, содержащие NS1 пандемии 1918 года, блокировали экспрессию регулируемых интерфероном генов более эффективно, чем вирусы, содержащие NS1 из более современных штаммов. 67 Анализ транскриптомов также показал, что MF59 является мощным индуктором генов, участвующих в миграции лейкоцитов, в частности JunB и Ptx3 . 68
Транскрипционные профили, лежащие в основе клинических симптомов инфекции гриппа
В исследованиях анализировались in vivo изменения экспрессии генов в лейкоцитах периферической крови субъектов с инфекцией гриппа А. 69 — 71 Наблюдались ключевые различия в транскрипции между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа А.В частности, кластер генов, включая те, которые кодируют несколько рецепторов распознавания образов, которые регулируют иммунные ответы, действуя как сенсоры вирусной РНК (TLR7, РНК-геликазы и интерферон, индуцированный геликазой C-доменом 1), сильно активируется только у субъектов с симптомами. Эта уникальная сигнатура транскрипции проявляется за 36 часов до пиковых симптомов и позволяет прогнозировать тяжесть заболевания. 71
Врожденные иммунные сигнатуры, позволяющие прогнозировать иммуногенность вакцины против гриппа
Подходы к системной биологии (с использованием мультиплексного цитокинового анализа, проточной цитометрии и микроматричного транскрипционного профилирования) использовались для определения ранних молекулярных сигнатур, которые можно использовать для прогнозирования более позднего иммунитета. ответы и получить лучшее представление о механизмах, лежащих в основе иммуногенности. 20 , 21 Гены, продукты которых участвуют в вирусном зондировании посредством TLR7 и TLR8, представлении антигена класса 1, опосредованном главным комплексом гистосовместимости, передаче сигналов интерферона, воспалении и ядерном факторе κB и киназе Януса / все сигнальные преобразователи и активаторы сигнальных путей транскрипции играют центральную роль в ответе вакцины на трехвалентную вакцину против гриппа (TIV) у взрослых в течение 24 часов после иммунизации. 20 Анализ этих ранних паттернов экспрессии генов выявил транскрипционную сигнатуру 494 гена, которая коррелировала с величиной ответа антител.Экспрессия CD74 , HLA-E , E2F2 и PTEN наиболее сильно коррелировала с величиной ответа антител. Экспрессия STAT1 (связанная с путями передачи сигналов интерферона) увеличивается после вакцинации, наиболее заметно в день 1 и в группе с высоким ответом. Экспрессия E2F2 (транскрипция репрессирует гены клеточного цикла для поддержания состояния покоя) снижается после вакцинации, наиболее заметно на 3-й день и в группе с высоким уровнем ответа.Различия между экспрессией STAT1 и E2F2 было достаточно, чтобы предсказать рано после вакцинации, будет ли человек в конечном итоге иметь высокий или низкий ответ, о чем судили по ответам антител. 20
Nakaya et al. 21 использовали инструменты системной биологии для сравнения врожденного и адаптивного иммунных ответов на вакцинацию TIV и LAIV. Среди генов, индуцированных вакцинацией TIV, эти исследователи обнаружили, что гены, которые преимущественно экспрессировались секретирующими антитела клетками, были обогащены.Этот результат мог отражать быстрое разрастание плазмобластов после вакцинации; однако микроматричный анализ В-клеток, отсортированных от вакцинированных субъектов, позволил сделать вывод о том, что наблюдаемые изменения экспрессии представляют собой реальные изменения транскрипции в В-клетках. Следует отметить, что экспрессия XBP-1 , фактора транскрипции, необходимого для дифференцировки В-клеток (а также его генов-мишеней), сильно повышалась на 7 день после вакцинации. Это усиление коррелировало с ответами на HAI.В отличие от результатов, полученных для TIV, анализ транскрипционной сигнатуры, индуцированной LAIV, показал значительное обогащение генов, высоко экспрессируемых в Т-клетках и моноцитах. В частности, экспрессия генов, связанных с интерфероном, в моноцитах на 3-й день после вакцинации коррелировала с ответом на HAI, предполагая связь между ответом на интерферон и ответом антител.
С использованием биоинформатического моделирования, такого как дискриминантный анализ с помощью смешанного целочисленного программирования, было идентифицировано 42 набора генов, которые можно было использовать для прогнозирования четырехкратной или большей амплитуды ответа антител через 4 недели после вакцинации против TIV.Ключевыми генами в прогностических сигнатурах генов были TNFRSF17, (член суперсемейства рецепторов фактора некроза опухолей 17, фактор созревания В-клеток), ген, ранее использовавшийся для прогнозирования величины ответа антител на вакцинацию вакциной против желтой лихорадки YF-17D, 72 и CD38 , который кодирует поверхностный белок, важный для развития лимфоцитов. Еще неизвестно, является ли TNFRSF17 частью большой сети генов, чья транскрипционная сигнатура представляет собой общий предиктор ответов антител на другие вакцины.Другой ген, CAMK4 (кодирующий кальций / кальмодулин-зависимую протеинкиназу типа IV [CaMK-IV]), также был идентифицирован в дискриминантном анализе TIV с помощью модели смешанного целочисленного программирования. 21 Экспрессия CAMK4 на 3-й день после вакцинации обратно коррелировала с титрами HAI-антител в плазме на 28-й день. CaMK-IV в регуляции ответов антител.Эти данные предполагают, что новые суррогатные генные маркеры могут быть полезны для прогнозирования величины ответа хозяина на вакцины против гриппа и для сокращения времени, необходимого для оценки защитных ответов вакцины в клинических испытаниях, сосредоточив внимание на прогнозировании врожденных ответов в стратегически ранние моменты времени (например, дни 0, 3, 7), а не гуморальные реакции, развивающиеся через несколько недель после вакцинации. Насколько нам известно, на сегодняшний день нет опубликованных данных о сигнатурах транскрипционного профилирования, генерируемых IgA-секретирующими В-клетками в слизистой оболочке носа реципиентов TIV или LAIV.
Системная вакцинология и разработка вакцины против гриппа
Индивидуальная изменчивость иммунных ответов на грипп в популяции зависит от возраста. До 50% пожилых реципиентов противогриппозных вакцин не реагируют на TIV с четырехкратным увеличением титров HAI, 35 , а наличие сопутствующих заболеваний, таких как астма, приводит к более низким показателям серопротекции у пожилых людей, чем у более молодых людей. к той же дозе вакцины, особенно при тяжелой астме. 8 У пожилых людей наблюдается субоптимальная секреция цитокинов, хроническое воспалительное состояние («воспаление»), а также сниженная функция Т-клеток, В-клеток и APC (обычно называемая иммуносенесценцией). Более конкретно, частота TIV-специфических секретирующих антитела клеток, циркулирующих после вакцинации, значительно ниже у пожилых субъектов, чем у более молодых субъектов, что приводит к дисфункциональному иммунитету и нарушению формирования памяти. 73 , 74
Идентификация прогностических сигнатур вакцин позволила бы разработать чип вакцины с несколькими сотнями генов, которые могли бы исследовать конкретный тип врожденного или адаптивного иммунного ответа (например, , величина эффекторного ответа Т-клеток CD8 + ; частота Th-клеток; баланс клеток Th2, Th3 и Th27; титры высокоаффинных антител).Такой чип позволит быстро идентифицировать (или предсказывать) неоптимальные реакции у пожилых людей и других групп, таких как младенцы и люди с ослабленным иммунитетом. 3 Более того, эти чипы могут быть полезны для идентификации безопасных и эффективных адъювантов, которые могут быть использованы для усиления ответа антител у таких слаборазвитых людей.
Раннее выявление лиц с низким уровнем ответа имеет решающее значение в контексте пандемий или при проведении клинических испытаний вакцин в рамках адаптивного дизайна.В обеих ситуациях системная вакцинология позволит быстро оценить силу, тип, продолжительность и качество защитных иммунных ответов, стимулированных вакциной, и направить совершенствование вакцинных рецептур, систем доставки и общую разработку вакцин с улучшенной иммуногенностью. 3 , 75
Выводы
Анализ ранних изменений транскриптома после вакцинации против гриппа и того, как эти изменения коррелируют или могут использоваться для прогнозирования местных ответов антител, имеет решающее значение для разработки вакцины против гриппа и общественности. здоровье.Дальнейшие исследования должны быть сосредоточены на анализе изменений транскриптома слизистой оболочки носа после вакцинации LAIV.
Системная вакцинология продолжит играть важную роль в обнаружении коррелятов (наиболее важно, ранних сигнатур) защиты и предикторов ответа антител на другие вакцины и общих генных сетей, критически участвующих в регулировании ответов антител на разные вакцины. Системные подходы должны обеспечить лучшее понимание того, как конкретные генетические вариации способствуют защитному иммунитету как на индивидуальном, так и на популяционном уровне.Эти методы также должны определять процесс иммунного старения, который препятствует защите, обеспечиваемой нынешними вакцинами против сезонного гриппа на уровне населения, и может аналогичным образом препятствовать защите, обеспечиваемой универсальной вакциной против гриппа. Системная вакцинология могла бы дополнительно поддержать разработку универсальной вакцины против гриппа за счет выявления генетических сигнатур плазмобластов и плазматических клеток, которые продуцировали широко защитные антитела у субъектов, инфицированных или вакцинированных сезонными и пандемическими вакцинами против гриппа.
Использование высокопроизводительных методов скрининга привело к недавней идентификации нейтрализующего моноклонального антитела человека, которое распознает гликопротеин HA всех 16 подтипов и нейтрализует HA h2 и h4 вирусов гриппа А. Такие исследования могут послужить дополнительной информацией для разработки универсальных вакцин за счет идентификации редких эпитопов вирусных белков, таких как HA, M2, NP и других, распознаваемых широко защищающими антителами. Наконец, адъюванты позволяют применять антиген-сберегающие режимы, которые имеют решающее значение для производства вакцин в контексте пандемии.Более того, адъюванты быстро стимулируют выработку долгоживущих ответов В-клеток памяти, что приводит к длительной защите.
Иммунобиология вакцин против гриппа
Реферат
Вакцинация — это основная стратегия профилактики гриппа и борьбы с ним. Белок поверхностного гемагглютинина (НА) вируса гриппа содержит два структурных элемента (голова и стебель), которые различаются по своей потенциальной полезности в качестве мишеней для вакцины. Головка белка НА является основной мишенью для антител, которые придают защитный иммунитет к вирусам гриппа.Основное состояние здоровья, возраст и полиморфизм генов реципиентов вакцины и, что не менее важно, степень антигенного соответствия между вирусами в вакцине и вирусами, которые циркулируют, модулируют защиту вакцины от гриппа. Адъюванты вакцины и живая аттенуированная вакцина против гриппа улучшают широту иммунитета к сезонным и пандемическим штаммам вирусов. Выявление антител против консервативной области ствола НА, которые перекрестно реагируют с НА в типах или подтипах вируса гриппа, позволило бы разработать универсальную вакцину против гриппа.Очень сложная сеть взаимодействий, возникающая после заражения гриппом и вакцинации, может быть изучена с использованием инструментов системной биологии, таких как микрочипы ДНК. Использование системной вакцинологии позволило создать сигнатуры экспрессии генов, которые представляют ключевые транскрипционные различия между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа. Кроме того, использование инструментов системной вакцинологии привело к идентификации новых маркеров суррогатных генов, которые являются предикторами силы реакции хозяина на вакцины, что имеет решающее значение как для разработки вакцины, так и для общественного здравоохранения.Выявление связи между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин.
Критические успехи в понимании иммунобиологических механизмов, ведущих к защите, обеспечиваемой противогриппозными вакцинами, были достигнуты за последнее десятилетие. В этом обзоре мы обсуждаем наиболее актуальные из этих достижений с особым акцентом на использование инструментов вакцинологии для улучшения производства вакцин и повышения иммуногенности, а также на системную вакцинологию для раннего выявления лиц, отвечающих на вакцинацию.Мы также уделяем внимание гетеротипическому иммунитету к гриппу и иммунологической основе для разработки универсальной вакцины против гриппа. Эти проблемы в разработке вакцины против гриппа и соответствующие возможности кратко описаны в.
Таблица 1
— Проблемы и стратегии в разработке вакцины против гриппа
| Проблемы | Стратегии |
| Антигенный дрейф / сдвиг вируса гриппа | Повышение антигенного соответствия за счет разработки универсальной вакцины против гриппа (защищает от большинство разновидностей штаммов и подтипов гриппа): |
| 1.Вакцина-кандидат будет вырабатывать антитела против консервативной области ствола HA, которые перекрестно реагируют с HA h2 и h4 1 | |
| 2. Вакцина-кандидат будет использовать внеклеточные домены M2 и NP в качестве защитных антигенов 2 | |
| 3. Разработка кандидатных универсальных вакцин против гриппа на основе сигнатур генов, связанных с разработкой широкопротекторных антител 3 | |
| Усиление клеточно-опосредованных ответов с помощью LAIV 4 | |
| Индивидуальные вариации иммунного ответа на грипп | Использование индивидуального подхода, ориентированного на пациента: |
| 1.Увеличить текущие знания о генетических полиморфизмах хозяина в иммунном ответе на вакцину против гриппа 5 | |
| 2. Использование инструментов системной вакцинологии для дальнейшего понимания влияния индивидуальных генетических вариаций на развитие защитного иммунитета 3 | |
| Субоптимальная иммуногенность в группах риска: пожилые люди (старение иммунитета), люди с сопутствующими заболеваниями (тяжелая астма) | Разработка адъювантных противогриппозных вакцин 6 |
| Надежное праймирование клеточной ветви иммунная система с виросомами 7 | |
| Производство высокодозных вакцин против гриппа 8 | |
| Раннее выявление лиц, не ответивших на вопросы, с помощью вакцинных чипов 3 | |
| Потребность в вакцинах которые вызывают быстрое повышение защитных антител в условиях пандемии гриппа | Препандемическое праймирование противогриппозной вакциной с адъювантом MF59 с последующим усилением долгоживущих В-клеток памяти человека в условиях пандемии 9 |
| Потребность в вакцинах, которые можно было бы быстро производить в ответ на начинающуюся пандемию | Надзор, направленный на выявление пандемических вирусов-предшественников с новыми NA 10 |
| Ограниченная доступность субъединичных белков НА и NA для производства вакцины | Антиген -сохраняющие режимы вакцинации путем разработки вакцин на основе адъювантов 11 — 15 |
| Продленный график производства вакцины | Сокращение сроков производства вакцины на: |
| 1.Использование технологии обратной генетики на основе плазмид для создания референсных штаммов вакцин 16 , 17 | |
| 2. Разработка нерепликативной вакцины против гриппа с вектором аденовируса, которая может быть произведена без предварительных условий роста гриппа вирус в яйцах или клетках 18 | |
| Несбалансированный ответ на HA и NA в существующих противогриппозных вакцинах | Разработка противогриппозных вакцин с более высоким содержанием антигена NA 19 |
| Низкая иммуногенность пандемического гриппа штаммов у иммунологически наивных людей | Разработка новых адъювантных вакцин 9 |
| Длительное время, необходимое для оценки новых противогриппозных вакцин в клинических испытаниях, особенно в контексте пандемии | Идентификация ранних молекулярных сигнатур, которые могут быть используется для предсказания последующие иммунные ответы 20 , 21 |
| Применение знаний, полученных из ранних иммунных сигнатур субоптимальных вакцин, для разработки более эффективных 3 |
Вирус гриппа и иммунные медиаторы защиты
Выделение вируса гриппа А в 1933 г. 22 привело к первому использованию противогриппозных вакцин в 1930-х и 1940-х годах. 23 — 25 Вирусы гриппа содержат восемь одноцепочечных сегментов РНК, кодирующих 11 белков, и классифицируются на три различных типа на основе основных антигенных различий: грипп A, грипп B и грипп C, с типами A и B вызывает ежегодные эпидемии среди людей. 26 Тримерный гликопротеин гемагглютинина (НА) является главной детерминантой вирулентности и отвечает за прикрепление вируса к специфическим белкам, содержащим сиаловую кислоту, на поверхности клетки-хозяина и, в конечном итоге, за слияние вирусной и эндосомной мембран и выброс вирусных нуклеиновых кислот в цитоплазму.Белок НА содержит два структурных элемента: головку (основная мишень антител, обеспечивающих защитный иммунитет к вирусам гриппа 27 ) и стебель. Оба элемента различаются по своей потенциальной полезности в качестве мишеней для вакцины (обсуждаются в разделе «Шаги к разработке универсальной вакцины против гриппа»). Протеолитическое расщепление НА необходимо для образования инфекционного вируса, но роль расщепления НА в патогенезе у людей в настоящее время неизвестна. Однако известно, что вирусы гриппа используют неструктурный белок 1 в качестве механизма обхода интерфероновой реакции хозяина I типа (обсуждается в разделе «Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин»).Нейраминидаза (NA) представляет собой гликопротеин, который удаляет сиаловую кислоту из вирусных белков и предотвращает агрегацию вируса за счет связывания белка HA с другими белками. Антитела к вирусам NA накапливают на поверхности клетки, эффективно уменьшая количество вируса, высвобождаемого из инфицированных клеток. 19 Хотя иммунный ответ на поверхностные гликопротеины гриппа в основном гуморальный, Т-клетки CD4 + и CD8 + также играют важную роль в иммунитете к гриппу.
В отличие от штаммоспецифического ответа антител, клеточный иммунитет имеет тенденцию быть более перекрестным между вирусными подтипами, распознавая более консервативные эпитопы на поверхностных белках и внутренних вирусных белках. 28 Открытие эпитопов на относительно хорошо консервативных белках гриппа, таких как нуклеопротеин (NP) M, и основа тримеров HA служит основой для разработки универсальной вакцины против гриппа, способной вызывать ответные реакции. перекрестная реактивность между подтипами (обсуждается в разделе «Шаги к разработке универсальной вакцины против гриппа»).
Из-за своих полимераз, подверженных ошибкам, вирусы гриппа претерпевают генетические изменения, которые приводят к постепенным антигенным изменениям как в НА, так и в NA, процесс, известный как антигенный дрейф, который приводит к появлению новых вариантных штаммов. 29 Антигенный сдвиг происходит, когда циркулирующий в настоящее время вирус гриппа A исчезает и заменяется новым подтипом с новыми гликопротеинами, с которыми антитела против ранее циркулирующего подтипа не реагируют перекрестно. 30 Однако воздействие 1918-подобного вируса h2N1 (от предыдущей инфекции или вакцинации) способствовало индукции перекрестно-реактивного ответа антител на вирус гриппа A (h2N1) 2009 года. 31
Филогенетический анализ последовательностей генов гриппа показал, что штаммы пандемий 20-го века возникли в результате многократного перераспределения вирусных генов между вирусами человека и животных. Хотя новый подтип всегда был новым HA, эти анализы показали, что новые NA и внутренние гены были введены в преобладающие штаммы вируса человека до приобретения нового пандемического HA. Меры надзора, направленные на выявление этих вирусов-предшественников, могут заранее предупредить должностных лиц здравоохранения о возникновении будущих пандемий. 10
Вакцинация является основной стратегией профилактики и борьбы с гриппом, 32 , 33 , но вакцина против гриппа должна пересматриваться почти каждый год, чтобы учесть постоянно возникающие проблемы. изменение вируса. Защита после естественной инфекции в первую очередь обеспечивается HA-специфическими антителами в сыворотке и слизистой оболочке, тогда как антитела, направленные против NA, консервативных белков гриппа и Т-клеточных ответов, снижают тяжесть заболевания за счет увеличения клиренса вируса. 26 , 30 , 34 Основываясь на серологических исследованиях гриппа с использованием сыворотки крови человека, титр ингибирования гемагглютинации (HAI) от 1:32 до 1:40 представляет собой диапазон титров. при котором примерно 50% людей будут защищены от заражения. 35 Не существует титра HAI, который мог бы гарантировать защиту от инфекции, 36 — 39 , хотя повышенные уровни сывороточных антител к HA обычно коррелируют с устойчивостью к инфекции гриппа, а более низкие уровни антител связаны с с повышенным риском заболевания среди лиц, инфицированных гриппом. 40 — 43 Идентификация дополнительных медиаторов раннего адаптивного и врожденного иммунитета имеет особое значение при разработке вакцин против пандемического гриппа (обсуждается в разделе «Врожденные иммунные сигнатуры, предсказывающие иммуногенность вакцины против гриппа»).
Разработка перекрестных защитных вакцин против гриппа
Помимо возраста и состояния здоровья реципиента, защита, обеспечиваемая вакцинами, зависит от степени антигенного соответствия между вирусами в вакцине и вирусами, циркулирующими в течение данного сезона гриппа. 44
Традиционные антигены в производстве противогриппозной вакцины
Каждая доза вакцины против сезонного гриппа содержит вирусы (или их белки НА), представляющие штаммы гриппа A (h4N2), A (h2N1) и гриппа B. считается наиболее вероятным распространением в предстоящем сезоне гриппа. Производство вакцины в Соединенных Штатах начинается с создания контрольных штаммов вакцин, то есть гибридных вирусов с генами HA и NA из дрейфующего варианта в сочетании с другими генами из лабораторного штамма, адаптированного для хорошего роста в яйцах. 26 Технология обратной генетики на основе плазмид теперь используется для надежного создания эталонных штаммов в более короткие сроки. 16 , 17 Вирионы, собранные из яиц, химически инактивируют, вирусную оболочку разрушают детергентами, а затем очищают белки HA и NA. HA является основным иммуногеном в инактивированных вакцинах против гриппа, и уровни HA используются для стандартизации доз вакцины. Количество NA не стандартизировано и может сильно различаться для разных производителей и производственных партий.Уровни антител NA также имеют решающее значение для защиты, и есть опасения, что вакцины против гриппа человека не содержат достаточного количества белка NA, чтобы вызвать сильный защитный ответ антител. 19
Мастер-штаммы вируса (MVS) для каждого из трех компонентов вируса гриппа в живой аттенуированной противогриппозной вакцине (LAIV) создаются посредством генетической реассортации. В этом процессе стабильный, аттенуированный, адаптированный к холоду главный донорский вирус скрещивается в культуре ткани с ожидаемым эпидемическим штаммом дикого типа, в результате чего получается MVS, который содержит два генетических сегмента, кодирующих HA и NA, полученные из антигенно релевантных вирусов гриппа. рекомендовано для включения в состав годовой вакцины Центрами по контролю и профилактике заболеваний и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Оставшаяся генетическая основа MVS происходит от основного вируса-донора, содержащего мутации, которые придают адаптированный к холоду, чувствительный к температуре и ослабленный фенотип. 45 LAIV стимулирует сильный перекрестно-реактивный ответ антител у детей и обеспечивает высокий уровень защиты от антигенных дрейфующих штаммов в сезон гриппа, когда существует неоптимальное соответствие между вакцинным штаммом и эпидемическим штаммом. Кроме того, LAIV индуцирует назальные антитела IgA, которые коррелируют с защитой. 4
Альтернативные антигены в производстве вакцины против гриппа
Кандидаты в вакцины могут быть разработаны быстро после секвенирования гена HA, что устраняет необходимость использования патогенных вирусов или адаптации вирусов для роста в яйцах или клеточной культуре. 26 Гены НА были клонированы в векторные вирусы, что привело к получению рекомбинантных вакцин, экспрессирующих белок НА, который индуцирует защитные клеточные ответы и ответы антител против вакцинного вируса и штаммов с антигенным дрейфом в исследованиях на животных. 46 — 50 Было показано, что интраназальное и подкожное введение вакцины против гриппа с вектором аденовируса является эффективным средством получения защитных антител против НА в ранних клинических испытаниях безопасности и иммуногенности. 18
Адъюванты используются для усиления иммунного ответа на вакцинные антигены с 1920-х годов. Как их преимущества, так и побочные эффекты связаны с активацией определенных компонентов врожденной иммунной системы. 51 Адъюванты позволяют использовать антиген-сберегающие режимы, обеспечивают гибкость временного интервала между вакцинациями, улучшают авидность антител и широту иммунитета к дрейфующим штаммам вируса, а также повышают ответ на вакцину у пожилых людей. 6 , 11 — 15
Эмульсии масла в воде, содержащие сквален, в настоящее время используемые в качестве адъювантов для лицензированных инактивированных вакцин против гриппа за пределами США, включают MF59 и AS03. 52 В AS03 сквален объединен с α-токоферолом, увеличивая общее содержание масла в AS03 по сравнению с MF59. MF59 работает независимо от Nalp3. 53 , 54 Его эффекты проявляются в месте инъекции, где он вызывает сильный приток гранулоцитов (нейтрофилов, эозинофилов) и нескольких типов антигенпрезентирующих клеток (APC) (моноциты, макрофаги и др.) дендритные клетки), которые захватывают антиген и адъювант и транспортируют их к дренирующим лимфатическим узлам. 55 Дистанционное праймирование противогриппозными вакцинами с адъювантом MF59 приводит к образованию пула перекрестно-реактивных В-клеток памяти, который может быть быстро усилен спустя годы с помощью несоответствующей вакцины с адъювантом MF59 для получения высоких титров перекрестно-реактивных нейтрализующих антител. 9 AS03 усиливает антиген-специфический адаптивный иммунный ответ за счет стимулирования моноцитов, а не дендритных клеток в качестве основных APC, а также за счет своего воздействия на функцию гранулоцитов и продукцию цитокинов. 56
Виросомы состоят из фосфолипидов, которые спонтанно образуют вирусоподобные пузырьки, к которым прикреплены поверхностные гликопротеины HA и NA вируса гриппа. 57 Виросомы взаимодействуют с В-лимфоцитами и захватываются APC, вызывая более сильный Т-хелперный (Th) 1-ответ, чем тот, который индуцируется неадъювантными противогриппозными вакцинами. 7
Шаги к разработке универсальной вакцины против гриппа
Универсальная вакцина против гриппа обладает способностью защищать от большинства разновидностей штаммов и подтипов гриппа.Многие стратегии разработки универсальной вакцины против гриппа основаны на повышении иммунного ответа против белков гриппа, которые являются высококонсервативными для всех штаммов. 58 , 59 Гетеротипический иммунитет (перекрестная защита) относится к защите некоторых людей от подтипов вируса гриппа, которым они ранее не подвергались в результате естественной инфекции или иммунизации. Возможное объяснение перекрестного защитного иммунитета возникло из понимания молекулярных мишеней широко нейтрализующих моноклональных антител, направленных против различных частей белка НА.
Специфическая область стебля НА является высококонсервативной среди многих вирусных штаммов, и стало возможным стимулировать выработку нацеленных на стебель антител с перекрестными нейтрализующими свойствами у нескольких видов хозяев, включая нечеловеческих приматов. 60 Иммунные ответы на пандемическую инфекцию гриппа h2N1 2009 года включают широко перекрестно-реактивные антитела против эпитопов стебля HA и головного домена множества штаммов гриппа. 61 Большинство HA-специфических антител от здоровых реципиентов вакцины против пандемического гриппа h2N1 также показали широкую перекрестную реактивность с головкой HA, и было показано, что три широких перекрестно-реактивных антитела связываются со стеблем HA. 62
Гетеротипические (перекрестно-защитные) антитела человека генерировались после проведения вакцинации против сезонного гриппа, что приводило к продукции сывороточного IgG, который перекрестно реагировал с H5 HA. Увековечивая В-клетки памяти этих людей, исследователи выделили панель из 20 гетеротипических нейтрализующих моноклональных антител, которые нейтрализовали вирусы, принадлежащие к нескольким подтипам НА (h2, h3, H5, H6 и H9), включая пандемический A / California / 07 / 09 Изолят h2N1. 63 Путем опроса> 100000 плазматических клеток от восьми доноров-людей, инфицированных несколькими штаммами гриппа A или иммунизированных против них, ученые выделили нейтрализующее моноклональное антитело (F16), которое распознало белки HA, присутствующие во всех 16 подтипах гриппа, и нейтрализовало оба h2 и вирусы гриппа А h4 путем связывания с консервативным эпитопом в субдомене слияния (основа тримеров НА). Пассивный перенос этого антитела обеспечивает защиту от инфекции и смерти у животных, предполагая, что выработка антител против области ствола HA, которые перекрестно реагируют с HA h2 и h4 (или между подтипами), является реалистичным подходом к разработке универсальных противогриппозных вакцин. 1
Другие подходы сосредоточены на использовании консервативных эпитопов вирусных белков, включая внеклеточный домен белка ионного канала матрикса 2 (M2) и NP в качестве защитных антигенов. Основываясь на заражении H5N1 у хорьков, иммунизация ДНК-вакцинами, кодирующими HA, индуцирует более высокий титр нейтрализующих антител, чем иммунизация ДНК NP и M2, предполагая, что NP и M2 могут потребовать комбинаторной вакцинации с HA, чтобы быть подходящими кандидатами для универсальных вакцин против гриппа. 2
Тщательное понимание широко защитных ответов антител на консервативные эпитопы имеет решающее значение для разработки универсальной вакцины, но и ответы хозяина также очень важны. Выявлены множественные ассоциации между вариациями гуморального иммунитета к вакцинам против сезонного гриппа и полиморфизмами генов лейкоцитарных антигенов, цитокинов и рецепторов цитокинов человека. Выявление ассоциаций между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин, способных генерировать длительные защитные иммунные ответы против высококонсервативных белков гриппа, поскольку эти гены являются важными мишенями для транскрипции во время иммунных ответов вакцины. 5 Тем не менее, текущая оценка иммуногенности противогриппозных вакцин, основанная исключительно на конечном результате развития адаптивных иммунных ответов, по крайней мере, неполна и не учитывает потенциал врожденных ответов, которые развиваются вскоре после вакцинации. в качестве иммунологических маркеров ответа (обсуждается в разделе «Врожденные иммунные сигнатуры, прогнозирующие иммуногенность вакцины против гриппа»)
Системная вакцинология
Наше понимание врожденных и адаптивных иммунных ответов in vivo значительно улучшилось благодаря использованию системной биологии.Этот развивающийся междисциплинарный подход систематически описывает взаимодействия между всеми частями биологической системы с целью прогнозирования поведения этой системы. 64 Системная биология или системная вакцинология в контексте разработки вакцин требует использования сложных и мощных математических и вычислительных методов моделирования для выявления, измерения и прогнозирования явлений иммунитета, вызванного вакциной, включая, помимо прочего, , различия в экспрессии генов через сотни и тысячи наборов зондов (набор зондов), предназначенных для исследования данной последовательности.
Генерическое и специфичное для гриппа транскрипционное профилирование
Микроматричный чип ДНК — это инструмент системной биологии, содержащий большой упорядоченный массив ДНК-зондов с известной последовательностью, напечатанных на твердой подложке и изготовленных в очень маленьком масштабе. Зонды используются для исследования состава сложных смесей ДНК (включая кДНК, полученную из транскриптов РНК) посредством гибридизации. 65 Такие микромассивы ДНК используются для создания профиля транскрипции (сигнатуры экспрессии генов), который представляет собой снимок генов, экспрессируемых в определенный момент времени конкретным типом клеток или тканью.
Комбинированный анализ опубликованных данных транскрипционного профилирования, полученных из 32 исследований и 77 различных взаимодействий между хозяином и патогеном, привел к идентификации кластера из 511 генов, которые составляют общий ответ хозяина, индуцированный во многих различных типах клеток на разные патогены. 65 Группа генов с наиболее сильной и устойчивой активацией состоит из генов, кодирующих цитокины (так называемый кластер воспалительных / хемотаксических цитокинов). Следует отметить, что повышающая регуляция кластера воспалительных / хемотаксических цитокинов является относительно слабой после заражения вирусом гриппа, который активирует клетки млекопитающих через врожденный иммунный рецептор для одноцепочечного Toll-подобного рецептора (TLR) 7 66 и, возможно, через TLR3.Напротив, вирус гриппа вызывает большую активацию интерферона и индуцированных интерфероном генов, включая несколько генов хемокинов, способствуя развитию иммунного ответа Th2-типа.
Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин
Транскрипционное профилирование успешно использовалось для сравнения влияния вирусных белков из разных штаммов и подтипов на иммунный ответ.Этот подход показал, что подавление экспрессии генов-хозяев может быть локализовано в вирусных белках, которые, как известно, вызывают тяжелое заболевание. Например, ген NS1 вируса гриппа A играет центральную роль в ингибировании зависимых от интерферона, цитокина и ядерного фактора κB сигнальных путей. Вирусы, содержащие NS1 пандемии 1918 года, блокировали экспрессию регулируемых интерфероном генов более эффективно, чем вирусы, содержащие NS1 из более современных штаммов. 67 Анализ транскриптомов также показал, что MF59 является мощным индуктором генов, участвующих в миграции лейкоцитов, в частности JunB и Ptx3 . 68
Транскрипционные профили, лежащие в основе клинических симптомов инфекции гриппа
В исследованиях анализировались in vivo изменения экспрессии генов в лейкоцитах периферической крови субъектов с инфекцией гриппа А. 69 — 71 Наблюдались ключевые различия в транскрипции между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа А.В частности, кластер генов, включая те, которые кодируют несколько рецепторов распознавания образов, которые регулируют иммунные ответы, действуя как сенсоры вирусной РНК (TLR7, РНК-геликазы и интерферон, индуцированный геликазой C-доменом 1), сильно активируется только у субъектов с симптомами. Эта уникальная сигнатура транскрипции проявляется за 36 часов до пиковых симптомов и позволяет прогнозировать тяжесть заболевания. 71
Врожденные иммунные сигнатуры, позволяющие прогнозировать иммуногенность вакцины против гриппа
Подходы к системной биологии (с использованием мультиплексного цитокинового анализа, проточной цитометрии и микроматричного транскрипционного профилирования) использовались для определения ранних молекулярных сигнатур, которые можно использовать для прогнозирования более позднего иммунитета. ответы и получить лучшее представление о механизмах, лежащих в основе иммуногенности. 20 , 21 Гены, продукты которых участвуют в вирусном зондировании посредством TLR7 и TLR8, представлении антигена класса 1, опосредованном главным комплексом гистосовместимости, передаче сигналов интерферона, воспалении и ядерном факторе κB и киназе Януса / все сигнальные преобразователи и активаторы сигнальных путей транскрипции играют центральную роль в ответе вакцины на трехвалентную вакцину против гриппа (TIV) у взрослых в течение 24 часов после иммунизации. 20 Анализ этих ранних паттернов экспрессии генов выявил транскрипционную сигнатуру 494 гена, которая коррелировала с величиной ответа антител.Экспрессия CD74 , HLA-E , E2F2 и PTEN наиболее сильно коррелировала с величиной ответа антител. Экспрессия STAT1 (связанная с путями передачи сигналов интерферона) увеличивается после вакцинации, наиболее заметно в день 1 и в группе с высоким ответом. Экспрессия E2F2 (транскрипция репрессирует гены клеточного цикла для поддержания состояния покоя) снижается после вакцинации, наиболее заметно на 3-й день и в группе с высоким уровнем ответа.Различия между экспрессией STAT1 и E2F2 было достаточно, чтобы предсказать рано после вакцинации, будет ли человек в конечном итоге иметь высокий или низкий ответ, о чем судили по ответам антител. 20
Nakaya et al. 21 использовали инструменты системной биологии для сравнения врожденного и адаптивного иммунных ответов на вакцинацию TIV и LAIV. Среди генов, индуцированных вакцинацией TIV, эти исследователи обнаружили, что гены, которые преимущественно экспрессировались секретирующими антитела клетками, были обогащены.Этот результат мог отражать быстрое разрастание плазмобластов после вакцинации; однако микроматричный анализ В-клеток, отсортированных от вакцинированных субъектов, позволил сделать вывод о том, что наблюдаемые изменения экспрессии представляют собой реальные изменения транскрипции в В-клетках. Следует отметить, что экспрессия XBP-1 , фактора транскрипции, необходимого для дифференцировки В-клеток (а также его генов-мишеней), сильно повышалась на 7 день после вакцинации. Это усиление коррелировало с ответами на HAI.В отличие от результатов, полученных для TIV, анализ транскрипционной сигнатуры, индуцированной LAIV, показал значительное обогащение генов, высоко экспрессируемых в Т-клетках и моноцитах. В частности, экспрессия генов, связанных с интерфероном, в моноцитах на 3-й день после вакцинации коррелировала с ответом на HAI, предполагая связь между ответом на интерферон и ответом антител.
С использованием биоинформатического моделирования, такого как дискриминантный анализ с помощью смешанного целочисленного программирования, было идентифицировано 42 набора генов, которые можно было использовать для прогнозирования четырехкратной или большей амплитуды ответа антител через 4 недели после вакцинации против TIV.Ключевыми генами в прогностических сигнатурах генов были TNFRSF17, (член суперсемейства рецепторов фактора некроза опухолей 17, фактор созревания В-клеток), ген, ранее использовавшийся для прогнозирования величины ответа антител на вакцинацию вакциной против желтой лихорадки YF-17D, 72 и CD38 , который кодирует поверхностный белок, важный для развития лимфоцитов. Еще неизвестно, является ли TNFRSF17 частью большой сети генов, чья транскрипционная сигнатура представляет собой общий предиктор ответов антител на другие вакцины.Другой ген, CAMK4 (кодирующий кальций / кальмодулин-зависимую протеинкиназу типа IV [CaMK-IV]), также был идентифицирован в дискриминантном анализе TIV с помощью модели смешанного целочисленного программирования. 21 Экспрессия CAMK4 на 3-й день после вакцинации обратно коррелировала с титрами HAI-антител в плазме на 28-й день. CaMK-IV в регуляции ответов антител.Эти данные предполагают, что новые суррогатные генные маркеры могут быть полезны для прогнозирования величины ответа хозяина на вакцины против гриппа и для сокращения времени, необходимого для оценки защитных ответов вакцины в клинических испытаниях, сосредоточив внимание на прогнозировании врожденных ответов в стратегически ранние моменты времени (например, дни 0, 3, 7), а не гуморальные реакции, развивающиеся через несколько недель после вакцинации. Насколько нам известно, на сегодняшний день нет опубликованных данных о сигнатурах транскрипционного профилирования, генерируемых IgA-секретирующими В-клетками в слизистой оболочке носа реципиентов TIV или LAIV.
Системная вакцинология и разработка вакцины против гриппа
Индивидуальная изменчивость иммунных ответов на грипп в популяции зависит от возраста. До 50% пожилых реципиентов противогриппозных вакцин не реагируют на TIV с четырехкратным увеличением титров HAI, 35 , а наличие сопутствующих заболеваний, таких как астма, приводит к более низким показателям серопротекции у пожилых людей, чем у более молодых людей. к той же дозе вакцины, особенно при тяжелой астме. 8 У пожилых людей наблюдается субоптимальная секреция цитокинов, хроническое воспалительное состояние («воспаление»), а также сниженная функция Т-клеток, В-клеток и APC (обычно называемая иммуносенесценцией). Более конкретно, частота TIV-специфических секретирующих антитела клеток, циркулирующих после вакцинации, значительно ниже у пожилых субъектов, чем у более молодых субъектов, что приводит к дисфункциональному иммунитету и нарушению формирования памяти. 73 , 74
Идентификация прогностических сигнатур вакцин позволила бы разработать чип вакцины с несколькими сотнями генов, которые могли бы исследовать конкретный тип врожденного или адаптивного иммунного ответа (например, , величина эффекторного ответа Т-клеток CD8 + ; частота Th-клеток; баланс клеток Th2, Th3 и Th27; титры высокоаффинных антител).Такой чип позволит быстро идентифицировать (или предсказывать) неоптимальные реакции у пожилых людей и других групп, таких как младенцы и люди с ослабленным иммунитетом. 3 Более того, эти чипы могут быть полезны для идентификации безопасных и эффективных адъювантов, которые могут быть использованы для усиления ответа антител у таких слаборазвитых людей.
Раннее выявление лиц с низким уровнем ответа имеет решающее значение в контексте пандемий или при проведении клинических испытаний вакцин в рамках адаптивного дизайна.В обеих ситуациях системная вакцинология позволит быстро оценить силу, тип, продолжительность и качество защитных иммунных ответов, стимулированных вакциной, и направить совершенствование вакцинных рецептур, систем доставки и общую разработку вакцин с улучшенной иммуногенностью. 3 , 75
Выводы
Анализ ранних изменений транскриптома после вакцинации против гриппа и того, как эти изменения коррелируют или могут использоваться для прогнозирования местных ответов антител, имеет решающее значение для разработки вакцины против гриппа и общественности. здоровье.Дальнейшие исследования должны быть сосредоточены на анализе изменений транскриптома слизистой оболочки носа после вакцинации LAIV.
Системная вакцинология продолжит играть важную роль в обнаружении коррелятов (наиболее важно, ранних сигнатур) защиты и предикторов ответа антител на другие вакцины и общих генных сетей, критически участвующих в регулировании ответов антител на разные вакцины. Системные подходы должны обеспечить лучшее понимание того, как конкретные генетические вариации способствуют защитному иммунитету как на индивидуальном, так и на популяционном уровне.Эти методы также должны определять процесс иммунного старения, который препятствует защите, обеспечиваемой нынешними вакцинами против сезонного гриппа на уровне населения, и может аналогичным образом препятствовать защите, обеспечиваемой универсальной вакциной против гриппа. Системная вакцинология могла бы дополнительно поддержать разработку универсальной вакцины против гриппа за счет выявления генетических сигнатур плазмобластов и плазматических клеток, которые продуцировали широко защитные антитела у субъектов, инфицированных или вакцинированных сезонными и пандемическими вакцинами против гриппа.
Использование высокопроизводительных методов скрининга привело к недавней идентификации нейтрализующего моноклонального антитела человека, которое распознает гликопротеин HA всех 16 подтипов и нейтрализует HA h2 и h4 вирусов гриппа А. Такие исследования могут послужить дополнительной информацией для разработки универсальных вакцин за счет идентификации редких эпитопов вирусных белков, таких как HA, M2, NP и других, распознаваемых широко защищающими антителами. Наконец, адъюванты позволяют применять антиген-сберегающие режимы, которые имеют решающее значение для производства вакцин в контексте пандемии.Более того, адъюванты быстро стимулируют выработку долгоживущих ответов В-клеток памяти, что приводит к длительной защите.
Иммунобиология вакцин против гриппа
Реферат
Вакцинация — это основная стратегия профилактики гриппа и борьбы с ним. Белок поверхностного гемагглютинина (НА) вируса гриппа содержит два структурных элемента (голова и стебель), которые различаются по своей потенциальной полезности в качестве мишеней для вакцины. Головка белка НА является основной мишенью для антител, которые придают защитный иммунитет к вирусам гриппа.Основное состояние здоровья, возраст и полиморфизм генов реципиентов вакцины и, что не менее важно, степень антигенного соответствия между вирусами в вакцине и вирусами, которые циркулируют, модулируют защиту вакцины от гриппа. Адъюванты вакцины и живая аттенуированная вакцина против гриппа улучшают широту иммунитета к сезонным и пандемическим штаммам вирусов. Выявление антител против консервативной области ствола НА, которые перекрестно реагируют с НА в типах или подтипах вируса гриппа, позволило бы разработать универсальную вакцину против гриппа.Очень сложная сеть взаимодействий, возникающая после заражения гриппом и вакцинации, может быть изучена с использованием инструментов системной биологии, таких как микрочипы ДНК. Использование системной вакцинологии позволило создать сигнатуры экспрессии генов, которые представляют ключевые транскрипционные различия между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа. Кроме того, использование инструментов системной вакцинологии привело к идентификации новых маркеров суррогатных генов, которые являются предикторами силы реакции хозяина на вакцины, что имеет решающее значение как для разработки вакцины, так и для общественного здравоохранения.Выявление связи между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин.
Критические успехи в понимании иммунобиологических механизмов, ведущих к защите, обеспечиваемой противогриппозными вакцинами, были достигнуты за последнее десятилетие. В этом обзоре мы обсуждаем наиболее актуальные из этих достижений с особым акцентом на использование инструментов вакцинологии для улучшения производства вакцин и повышения иммуногенности, а также на системную вакцинологию для раннего выявления лиц, отвечающих на вакцинацию.Мы также уделяем внимание гетеротипическому иммунитету к гриппу и иммунологической основе для разработки универсальной вакцины против гриппа. Эти проблемы в разработке вакцины против гриппа и соответствующие возможности кратко описаны в.
Таблица 1
— Проблемы и стратегии в разработке вакцины против гриппа
| Проблемы | Стратегии |
| Антигенный дрейф / сдвиг вируса гриппа | Повышение антигенного соответствия за счет разработки универсальной вакцины против гриппа (защищает от большинство разновидностей штаммов и подтипов гриппа): |
| 1.Вакцина-кандидат будет вырабатывать антитела против консервативной области ствола HA, которые перекрестно реагируют с HA h2 и h4 1 | |
| 2. Вакцина-кандидат будет использовать внеклеточные домены M2 и NP в качестве защитных антигенов 2 | |
| 3. Разработка кандидатных универсальных вакцин против гриппа на основе сигнатур генов, связанных с разработкой широкопротекторных антител 3 | |
| Усиление клеточно-опосредованных ответов с помощью LAIV 4 | |
| Индивидуальные вариации иммунного ответа на грипп | Использование индивидуального подхода, ориентированного на пациента: |
| 1.Увеличить текущие знания о генетических полиморфизмах хозяина в иммунном ответе на вакцину против гриппа 5 | |
| 2. Использование инструментов системной вакцинологии для дальнейшего понимания влияния индивидуальных генетических вариаций на развитие защитного иммунитета 3 | |
| Субоптимальная иммуногенность в группах риска: пожилые люди (старение иммунитета), люди с сопутствующими заболеваниями (тяжелая астма) | Разработка адъювантных противогриппозных вакцин 6 |
| Надежное праймирование клеточной ветви иммунная система с виросомами 7 | |
| Производство высокодозных вакцин против гриппа 8 | |
| Раннее выявление лиц, не ответивших на вопросы, с помощью вакцинных чипов 3 | |
| Потребность в вакцинах которые вызывают быстрое повышение защитных антител в условиях пандемии гриппа | Препандемическое праймирование противогриппозной вакциной с адъювантом MF59 с последующим усилением долгоживущих В-клеток памяти человека в условиях пандемии 9 |
| Потребность в вакцинах, которые можно было бы быстро производить в ответ на начинающуюся пандемию | Надзор, направленный на выявление пандемических вирусов-предшественников с новыми NA 10 |
| Ограниченная доступность субъединичных белков НА и NA для производства вакцины | Антиген -сохраняющие режимы вакцинации путем разработки вакцин на основе адъювантов 11 — 15 |
| Продленный график производства вакцины | Сокращение сроков производства вакцины на: |
| 1.Использование технологии обратной генетики на основе плазмид для создания референсных штаммов вакцин 16 , 17 | |
| 2. Разработка нерепликативной вакцины против гриппа с вектором аденовируса, которая может быть произведена без предварительных условий роста гриппа вирус в яйцах или клетках 18 | |
| Несбалансированный ответ на HA и NA в существующих противогриппозных вакцинах | Разработка противогриппозных вакцин с более высоким содержанием антигена NA 19 |
| Низкая иммуногенность пандемического гриппа штаммов у иммунологически наивных людей | Разработка новых адъювантных вакцин 9 |
| Длительное время, необходимое для оценки новых противогриппозных вакцин в клинических испытаниях, особенно в контексте пандемии | Идентификация ранних молекулярных сигнатур, которые могут быть используется для предсказания последующие иммунные ответы 20 , 21 |
| Применение знаний, полученных из ранних иммунных сигнатур субоптимальных вакцин, для разработки более эффективных 3 |
Вирус гриппа и иммунные медиаторы защиты
Выделение вируса гриппа А в 1933 г. 22 привело к первому использованию противогриппозных вакцин в 1930-х и 1940-х годах. 23 — 25 Вирусы гриппа содержат восемь одноцепочечных сегментов РНК, кодирующих 11 белков, и классифицируются на три различных типа на основе основных антигенных различий: грипп A, грипп B и грипп C, с типами A и B вызывает ежегодные эпидемии среди людей. 26 Тримерный гликопротеин гемагглютинина (НА) является главной детерминантой вирулентности и отвечает за прикрепление вируса к специфическим белкам, содержащим сиаловую кислоту, на поверхности клетки-хозяина и, в конечном итоге, за слияние вирусной и эндосомной мембран и выброс вирусных нуклеиновых кислот в цитоплазму.Белок НА содержит два структурных элемента: головку (основная мишень антител, обеспечивающих защитный иммунитет к вирусам гриппа 27 ) и стебель. Оба элемента различаются по своей потенциальной полезности в качестве мишеней для вакцины (обсуждаются в разделе «Шаги к разработке универсальной вакцины против гриппа»). Протеолитическое расщепление НА необходимо для образования инфекционного вируса, но роль расщепления НА в патогенезе у людей в настоящее время неизвестна. Однако известно, что вирусы гриппа используют неструктурный белок 1 в качестве механизма обхода интерфероновой реакции хозяина I типа (обсуждается в разделе «Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин»).Нейраминидаза (NA) представляет собой гликопротеин, который удаляет сиаловую кислоту из вирусных белков и предотвращает агрегацию вируса за счет связывания белка HA с другими белками. Антитела к вирусам NA накапливают на поверхности клетки, эффективно уменьшая количество вируса, высвобождаемого из инфицированных клеток. 19 Хотя иммунный ответ на поверхностные гликопротеины гриппа в основном гуморальный, Т-клетки CD4 + и CD8 + также играют важную роль в иммунитете к гриппу.
В отличие от штаммоспецифического ответа антител, клеточный иммунитет имеет тенденцию быть более перекрестным между вирусными подтипами, распознавая более консервативные эпитопы на поверхностных белках и внутренних вирусных белках. 28 Открытие эпитопов на относительно хорошо консервативных белках гриппа, таких как нуклеопротеин (NP) M, и основа тримеров HA служит основой для разработки универсальной вакцины против гриппа, способной вызывать ответные реакции. перекрестная реактивность между подтипами (обсуждается в разделе «Шаги к разработке универсальной вакцины против гриппа»).
Из-за своих полимераз, подверженных ошибкам, вирусы гриппа претерпевают генетические изменения, которые приводят к постепенным антигенным изменениям как в НА, так и в NA, процесс, известный как антигенный дрейф, который приводит к появлению новых вариантных штаммов. 29 Антигенный сдвиг происходит, когда циркулирующий в настоящее время вирус гриппа A исчезает и заменяется новым подтипом с новыми гликопротеинами, с которыми антитела против ранее циркулирующего подтипа не реагируют перекрестно. 30 Однако воздействие 1918-подобного вируса h2N1 (от предыдущей инфекции или вакцинации) способствовало индукции перекрестно-реактивного ответа антител на вирус гриппа A (h2N1) 2009 года. 31
Филогенетический анализ последовательностей генов гриппа показал, что штаммы пандемий 20-го века возникли в результате многократного перераспределения вирусных генов между вирусами человека и животных. Хотя новый подтип всегда был новым HA, эти анализы показали, что новые NA и внутренние гены были введены в преобладающие штаммы вируса человека до приобретения нового пандемического HA. Меры надзора, направленные на выявление этих вирусов-предшественников, могут заранее предупредить должностных лиц здравоохранения о возникновении будущих пандемий. 10
Вакцинация является основной стратегией профилактики и борьбы с гриппом, 32 , 33 , но вакцина против гриппа должна пересматриваться почти каждый год, чтобы учесть постоянно возникающие проблемы. изменение вируса. Защита после естественной инфекции в первую очередь обеспечивается HA-специфическими антителами в сыворотке и слизистой оболочке, тогда как антитела, направленные против NA, консервативных белков гриппа и Т-клеточных ответов, снижают тяжесть заболевания за счет увеличения клиренса вируса. 26 , 30 , 34 Основываясь на серологических исследованиях гриппа с использованием сыворотки крови человека, титр ингибирования гемагглютинации (HAI) от 1:32 до 1:40 представляет собой диапазон титров. при котором примерно 50% людей будут защищены от заражения. 35 Не существует титра HAI, который мог бы гарантировать защиту от инфекции, 36 — 39 , хотя повышенные уровни сывороточных антител к HA обычно коррелируют с устойчивостью к инфекции гриппа, а более низкие уровни антител связаны с с повышенным риском заболевания среди лиц, инфицированных гриппом. 40 — 43 Идентификация дополнительных медиаторов раннего адаптивного и врожденного иммунитета имеет особое значение при разработке вакцин против пандемического гриппа (обсуждается в разделе «Врожденные иммунные сигнатуры, предсказывающие иммуногенность вакцины против гриппа»).
Разработка перекрестных защитных вакцин против гриппа
Помимо возраста и состояния здоровья реципиента, защита, обеспечиваемая вакцинами, зависит от степени антигенного соответствия между вирусами в вакцине и вирусами, циркулирующими в течение данного сезона гриппа. 44
Традиционные антигены в производстве противогриппозной вакцины
Каждая доза вакцины против сезонного гриппа содержит вирусы (или их белки НА), представляющие штаммы гриппа A (h4N2), A (h2N1) и гриппа B. считается наиболее вероятным распространением в предстоящем сезоне гриппа. Производство вакцины в Соединенных Штатах начинается с создания контрольных штаммов вакцин, то есть гибридных вирусов с генами HA и NA из дрейфующего варианта в сочетании с другими генами из лабораторного штамма, адаптированного для хорошего роста в яйцах. 26 Технология обратной генетики на основе плазмид теперь используется для надежного создания эталонных штаммов в более короткие сроки. 16 , 17 Вирионы, собранные из яиц, химически инактивируют, вирусную оболочку разрушают детергентами, а затем очищают белки HA и NA. HA является основным иммуногеном в инактивированных вакцинах против гриппа, и уровни HA используются для стандартизации доз вакцины. Количество NA не стандартизировано и может сильно различаться для разных производителей и производственных партий.Уровни антител NA также имеют решающее значение для защиты, и есть опасения, что вакцины против гриппа человека не содержат достаточного количества белка NA, чтобы вызвать сильный защитный ответ антител. 19
Мастер-штаммы вируса (MVS) для каждого из трех компонентов вируса гриппа в живой аттенуированной противогриппозной вакцине (LAIV) создаются посредством генетической реассортации. В этом процессе стабильный, аттенуированный, адаптированный к холоду главный донорский вирус скрещивается в культуре ткани с ожидаемым эпидемическим штаммом дикого типа, в результате чего получается MVS, который содержит два генетических сегмента, кодирующих HA и NA, полученные из антигенно релевантных вирусов гриппа. рекомендовано для включения в состав годовой вакцины Центрами по контролю и профилактике заболеваний и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Оставшаяся генетическая основа MVS происходит от основного вируса-донора, содержащего мутации, которые придают адаптированный к холоду, чувствительный к температуре и ослабленный фенотип. 45 LAIV стимулирует сильный перекрестно-реактивный ответ антител у детей и обеспечивает высокий уровень защиты от антигенных дрейфующих штаммов в сезон гриппа, когда существует неоптимальное соответствие между вакцинным штаммом и эпидемическим штаммом. Кроме того, LAIV индуцирует назальные антитела IgA, которые коррелируют с защитой. 4
Альтернативные антигены в производстве вакцины против гриппа
Кандидаты в вакцины могут быть разработаны быстро после секвенирования гена HA, что устраняет необходимость использования патогенных вирусов или адаптации вирусов для роста в яйцах или клеточной культуре. 26 Гены НА были клонированы в векторные вирусы, что привело к получению рекомбинантных вакцин, экспрессирующих белок НА, который индуцирует защитные клеточные ответы и ответы антител против вакцинного вируса и штаммов с антигенным дрейфом в исследованиях на животных. 46 — 50 Было показано, что интраназальное и подкожное введение вакцины против гриппа с вектором аденовируса является эффективным средством получения защитных антител против НА в ранних клинических испытаниях безопасности и иммуногенности. 18
Адъюванты используются для усиления иммунного ответа на вакцинные антигены с 1920-х годов. Как их преимущества, так и побочные эффекты связаны с активацией определенных компонентов врожденной иммунной системы. 51 Адъюванты позволяют использовать антиген-сберегающие режимы, обеспечивают гибкость временного интервала между вакцинациями, улучшают авидность антител и широту иммунитета к дрейфующим штаммам вируса, а также повышают ответ на вакцину у пожилых людей. 6 , 11 — 15
Эмульсии масла в воде, содержащие сквален, в настоящее время используемые в качестве адъювантов для лицензированных инактивированных вакцин против гриппа за пределами США, включают MF59 и AS03. 52 В AS03 сквален объединен с α-токоферолом, увеличивая общее содержание масла в AS03 по сравнению с MF59. MF59 работает независимо от Nalp3. 53 , 54 Его эффекты проявляются в месте инъекции, где он вызывает сильный приток гранулоцитов (нейтрофилов, эозинофилов) и нескольких типов антигенпрезентирующих клеток (APC) (моноциты, макрофаги и др.) дендритные клетки), которые захватывают антиген и адъювант и транспортируют их к дренирующим лимфатическим узлам. 55 Дистанционное праймирование противогриппозными вакцинами с адъювантом MF59 приводит к образованию пула перекрестно-реактивных В-клеток памяти, который может быть быстро усилен спустя годы с помощью несоответствующей вакцины с адъювантом MF59 для получения высоких титров перекрестно-реактивных нейтрализующих антител. 9 AS03 усиливает антиген-специфический адаптивный иммунный ответ за счет стимулирования моноцитов, а не дендритных клеток в качестве основных APC, а также за счет своего воздействия на функцию гранулоцитов и продукцию цитокинов. 56
Виросомы состоят из фосфолипидов, которые спонтанно образуют вирусоподобные пузырьки, к которым прикреплены поверхностные гликопротеины HA и NA вируса гриппа. 57 Виросомы взаимодействуют с В-лимфоцитами и захватываются APC, вызывая более сильный Т-хелперный (Th) 1-ответ, чем тот, который индуцируется неадъювантными противогриппозными вакцинами. 7
Шаги к разработке универсальной вакцины против гриппа
Универсальная вакцина против гриппа обладает способностью защищать от большинства разновидностей штаммов и подтипов гриппа.Многие стратегии разработки универсальной вакцины против гриппа основаны на повышении иммунного ответа против белков гриппа, которые являются высококонсервативными для всех штаммов. 58 , 59 Гетеротипический иммунитет (перекрестная защита) относится к защите некоторых людей от подтипов вируса гриппа, которым они ранее не подвергались в результате естественной инфекции или иммунизации. Возможное объяснение перекрестного защитного иммунитета возникло из понимания молекулярных мишеней широко нейтрализующих моноклональных антител, направленных против различных частей белка НА.
Специфическая область стебля НА является высококонсервативной среди многих вирусных штаммов, и стало возможным стимулировать выработку нацеленных на стебель антител с перекрестными нейтрализующими свойствами у нескольких видов хозяев, включая нечеловеческих приматов. 60 Иммунные ответы на пандемическую инфекцию гриппа h2N1 2009 года включают широко перекрестно-реактивные антитела против эпитопов стебля HA и головного домена множества штаммов гриппа. 61 Большинство HA-специфических антител от здоровых реципиентов вакцины против пандемического гриппа h2N1 также показали широкую перекрестную реактивность с головкой HA, и было показано, что три широких перекрестно-реактивных антитела связываются со стеблем HA. 62
Гетеротипические (перекрестно-защитные) антитела человека генерировались после проведения вакцинации против сезонного гриппа, что приводило к продукции сывороточного IgG, который перекрестно реагировал с H5 HA. Увековечивая В-клетки памяти этих людей, исследователи выделили панель из 20 гетеротипических нейтрализующих моноклональных антител, которые нейтрализовали вирусы, принадлежащие к нескольким подтипам НА (h2, h3, H5, H6 и H9), включая пандемический A / California / 07 / 09 Изолят h2N1. 63 Путем опроса> 100000 плазматических клеток от восьми доноров-людей, инфицированных несколькими штаммами гриппа A или иммунизированных против них, ученые выделили нейтрализующее моноклональное антитело (F16), которое распознало белки HA, присутствующие во всех 16 подтипах гриппа, и нейтрализовало оба h2 и вирусы гриппа А h4 путем связывания с консервативным эпитопом в субдомене слияния (основа тримеров НА). Пассивный перенос этого антитела обеспечивает защиту от инфекции и смерти у животных, предполагая, что выработка антител против области ствола HA, которые перекрестно реагируют с HA h2 и h4 (или между подтипами), является реалистичным подходом к разработке универсальных противогриппозных вакцин. 1
Другие подходы сосредоточены на использовании консервативных эпитопов вирусных белков, включая внеклеточный домен белка ионного канала матрикса 2 (M2) и NP в качестве защитных антигенов. Основываясь на заражении H5N1 у хорьков, иммунизация ДНК-вакцинами, кодирующими HA, индуцирует более высокий титр нейтрализующих антител, чем иммунизация ДНК NP и M2, предполагая, что NP и M2 могут потребовать комбинаторной вакцинации с HA, чтобы быть подходящими кандидатами для универсальных вакцин против гриппа. 2
Тщательное понимание широко защитных ответов антител на консервативные эпитопы имеет решающее значение для разработки универсальной вакцины, но и ответы хозяина также очень важны. Выявлены множественные ассоциации между вариациями гуморального иммунитета к вакцинам против сезонного гриппа и полиморфизмами генов лейкоцитарных антигенов, цитокинов и рецепторов цитокинов человека. Выявление ассоциаций между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин, способных генерировать длительные защитные иммунные ответы против высококонсервативных белков гриппа, поскольку эти гены являются важными мишенями для транскрипции во время иммунных ответов вакцины. 5 Тем не менее, текущая оценка иммуногенности противогриппозных вакцин, основанная исключительно на конечном результате развития адаптивных иммунных ответов, по крайней мере, неполна и не учитывает потенциал врожденных ответов, которые развиваются вскоре после вакцинации. в качестве иммунологических маркеров ответа (обсуждается в разделе «Врожденные иммунные сигнатуры, прогнозирующие иммуногенность вакцины против гриппа»)
Системная вакцинология
Наше понимание врожденных и адаптивных иммунных ответов in vivo значительно улучшилось благодаря использованию системной биологии.Этот развивающийся междисциплинарный подход систематически описывает взаимодействия между всеми частями биологической системы с целью прогнозирования поведения этой системы. 64 Системная биология или системная вакцинология в контексте разработки вакцин требует использования сложных и мощных математических и вычислительных методов моделирования для выявления, измерения и прогнозирования явлений иммунитета, вызванного вакциной, включая, помимо прочего, , различия в экспрессии генов через сотни и тысячи наборов зондов (набор зондов), предназначенных для исследования данной последовательности.
Генерическое и специфичное для гриппа транскрипционное профилирование
Микроматричный чип ДНК — это инструмент системной биологии, содержащий большой упорядоченный массив ДНК-зондов с известной последовательностью, напечатанных на твердой подложке и изготовленных в очень маленьком масштабе. Зонды используются для исследования состава сложных смесей ДНК (включая кДНК, полученную из транскриптов РНК) посредством гибридизации. 65 Такие микромассивы ДНК используются для создания профиля транскрипции (сигнатуры экспрессии генов), который представляет собой снимок генов, экспрессируемых в определенный момент времени конкретным типом клеток или тканью.
Комбинированный анализ опубликованных данных транскрипционного профилирования, полученных из 32 исследований и 77 различных взаимодействий между хозяином и патогеном, привел к идентификации кластера из 511 генов, которые составляют общий ответ хозяина, индуцированный во многих различных типах клеток на разные патогены. 65 Группа генов с наиболее сильной и устойчивой активацией состоит из генов, кодирующих цитокины (так называемый кластер воспалительных / хемотаксических цитокинов). Следует отметить, что повышающая регуляция кластера воспалительных / хемотаксических цитокинов является относительно слабой после заражения вирусом гриппа, который активирует клетки млекопитающих через врожденный иммунный рецептор для одноцепочечного Toll-подобного рецептора (TLR) 7 66 и, возможно, через TLR3.Напротив, вирус гриппа вызывает большую активацию интерферона и индуцированных интерфероном генов, включая несколько генов хемокинов, способствуя развитию иммунного ответа Th2-типа.
Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин
Транскрипционное профилирование успешно использовалось для сравнения влияния вирусных белков из разных штаммов и подтипов на иммунный ответ.Этот подход показал, что подавление экспрессии генов-хозяев может быть локализовано в вирусных белках, которые, как известно, вызывают тяжелое заболевание. Например, ген NS1 вируса гриппа A играет центральную роль в ингибировании зависимых от интерферона, цитокина и ядерного фактора κB сигнальных путей. Вирусы, содержащие NS1 пандемии 1918 года, блокировали экспрессию регулируемых интерфероном генов более эффективно, чем вирусы, содержащие NS1 из более современных штаммов. 67 Анализ транскриптомов также показал, что MF59 является мощным индуктором генов, участвующих в миграции лейкоцитов, в частности JunB и Ptx3 . 68
Транскрипционные профили, лежащие в основе клинических симптомов инфекции гриппа
В исследованиях анализировались in vivo изменения экспрессии генов в лейкоцитах периферической крови субъектов с инфекцией гриппа А. 69 — 71 Наблюдались ключевые различия в транскрипции между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа А.В частности, кластер генов, включая те, которые кодируют несколько рецепторов распознавания образов, которые регулируют иммунные ответы, действуя как сенсоры вирусной РНК (TLR7, РНК-геликазы и интерферон, индуцированный геликазой C-доменом 1), сильно активируется только у субъектов с симптомами. Эта уникальная сигнатура транскрипции проявляется за 36 часов до пиковых симптомов и позволяет прогнозировать тяжесть заболевания. 71
Врожденные иммунные сигнатуры, позволяющие прогнозировать иммуногенность вакцины против гриппа
Подходы к системной биологии (с использованием мультиплексного цитокинового анализа, проточной цитометрии и микроматричного транскрипционного профилирования) использовались для определения ранних молекулярных сигнатур, которые можно использовать для прогнозирования более позднего иммунитета. ответы и получить лучшее представление о механизмах, лежащих в основе иммуногенности. 20 , 21 Гены, продукты которых участвуют в вирусном зондировании посредством TLR7 и TLR8, представлении антигена класса 1, опосредованном главным комплексом гистосовместимости, передаче сигналов интерферона, воспалении и ядерном факторе κB и киназе Януса / все сигнальные преобразователи и активаторы сигнальных путей транскрипции играют центральную роль в ответе вакцины на трехвалентную вакцину против гриппа (TIV) у взрослых в течение 24 часов после иммунизации. 20 Анализ этих ранних паттернов экспрессии генов выявил транскрипционную сигнатуру 494 гена, которая коррелировала с величиной ответа антител.Экспрессия CD74 , HLA-E , E2F2 и PTEN наиболее сильно коррелировала с величиной ответа антител. Экспрессия STAT1 (связанная с путями передачи сигналов интерферона) увеличивается после вакцинации, наиболее заметно в день 1 и в группе с высоким ответом. Экспрессия E2F2 (транскрипция репрессирует гены клеточного цикла для поддержания состояния покоя) снижается после вакцинации, наиболее заметно на 3-й день и в группе с высоким уровнем ответа.Различия между экспрессией STAT1 и E2F2 было достаточно, чтобы предсказать рано после вакцинации, будет ли человек в конечном итоге иметь высокий или низкий ответ, о чем судили по ответам антител. 20
Nakaya et al. 21 использовали инструменты системной биологии для сравнения врожденного и адаптивного иммунных ответов на вакцинацию TIV и LAIV. Среди генов, индуцированных вакцинацией TIV, эти исследователи обнаружили, что гены, которые преимущественно экспрессировались секретирующими антитела клетками, были обогащены.Этот результат мог отражать быстрое разрастание плазмобластов после вакцинации; однако микроматричный анализ В-клеток, отсортированных от вакцинированных субъектов, позволил сделать вывод о том, что наблюдаемые изменения экспрессии представляют собой реальные изменения транскрипции в В-клетках. Следует отметить, что экспрессия XBP-1 , фактора транскрипции, необходимого для дифференцировки В-клеток (а также его генов-мишеней), сильно повышалась на 7 день после вакцинации. Это усиление коррелировало с ответами на HAI.В отличие от результатов, полученных для TIV, анализ транскрипционной сигнатуры, индуцированной LAIV, показал значительное обогащение генов, высоко экспрессируемых в Т-клетках и моноцитах. В частности, экспрессия генов, связанных с интерфероном, в моноцитах на 3-й день после вакцинации коррелировала с ответом на HAI, предполагая связь между ответом на интерферон и ответом антител.
С использованием биоинформатического моделирования, такого как дискриминантный анализ с помощью смешанного целочисленного программирования, было идентифицировано 42 набора генов, которые можно было использовать для прогнозирования четырехкратной или большей амплитуды ответа антител через 4 недели после вакцинации против TIV.Ключевыми генами в прогностических сигнатурах генов были TNFRSF17, (член суперсемейства рецепторов фактора некроза опухолей 17, фактор созревания В-клеток), ген, ранее использовавшийся для прогнозирования величины ответа антител на вакцинацию вакциной против желтой лихорадки YF-17D, 72 и CD38 , который кодирует поверхностный белок, важный для развития лимфоцитов. Еще неизвестно, является ли TNFRSF17 частью большой сети генов, чья транскрипционная сигнатура представляет собой общий предиктор ответов антител на другие вакцины.Другой ген, CAMK4 (кодирующий кальций / кальмодулин-зависимую протеинкиназу типа IV [CaMK-IV]), также был идентифицирован в дискриминантном анализе TIV с помощью модели смешанного целочисленного программирования. 21 Экспрессия CAMK4 на 3-й день после вакцинации обратно коррелировала с титрами HAI-антител в плазме на 28-й день. CaMK-IV в регуляции ответов антител.Эти данные предполагают, что новые суррогатные генные маркеры могут быть полезны для прогнозирования величины ответа хозяина на вакцины против гриппа и для сокращения времени, необходимого для оценки защитных ответов вакцины в клинических испытаниях, сосредоточив внимание на прогнозировании врожденных ответов в стратегически ранние моменты времени (например, дни 0, 3, 7), а не гуморальные реакции, развивающиеся через несколько недель после вакцинации. Насколько нам известно, на сегодняшний день нет опубликованных данных о сигнатурах транскрипционного профилирования, генерируемых IgA-секретирующими В-клетками в слизистой оболочке носа реципиентов TIV или LAIV.
Системная вакцинология и разработка вакцины против гриппа
Индивидуальная изменчивость иммунных ответов на грипп в популяции зависит от возраста. До 50% пожилых реципиентов противогриппозных вакцин не реагируют на TIV с четырехкратным увеличением титров HAI, 35 , а наличие сопутствующих заболеваний, таких как астма, приводит к более низким показателям серопротекции у пожилых людей, чем у более молодых людей. к той же дозе вакцины, особенно при тяжелой астме. 8 У пожилых людей наблюдается субоптимальная секреция цитокинов, хроническое воспалительное состояние («воспаление»), а также сниженная функция Т-клеток, В-клеток и APC (обычно называемая иммуносенесценцией). Более конкретно, частота TIV-специфических секретирующих антитела клеток, циркулирующих после вакцинации, значительно ниже у пожилых субъектов, чем у более молодых субъектов, что приводит к дисфункциональному иммунитету и нарушению формирования памяти. 73 , 74
Идентификация прогностических сигнатур вакцин позволила бы разработать чип вакцины с несколькими сотнями генов, которые могли бы исследовать конкретный тип врожденного или адаптивного иммунного ответа (например, , величина эффекторного ответа Т-клеток CD8 + ; частота Th-клеток; баланс клеток Th2, Th3 и Th27; титры высокоаффинных антител).Такой чип позволит быстро идентифицировать (или предсказывать) неоптимальные реакции у пожилых людей и других групп, таких как младенцы и люди с ослабленным иммунитетом. 3 Более того, эти чипы могут быть полезны для идентификации безопасных и эффективных адъювантов, которые могут быть использованы для усиления ответа антител у таких слаборазвитых людей.
Раннее выявление лиц с низким уровнем ответа имеет решающее значение в контексте пандемий или при проведении клинических испытаний вакцин в рамках адаптивного дизайна.В обеих ситуациях системная вакцинология позволит быстро оценить силу, тип, продолжительность и качество защитных иммунных ответов, стимулированных вакциной, и направить совершенствование вакцинных рецептур, систем доставки и общую разработку вакцин с улучшенной иммуногенностью. 3 , 75
Выводы
Анализ ранних изменений транскриптома после вакцинации против гриппа и того, как эти изменения коррелируют или могут использоваться для прогнозирования местных ответов антител, имеет решающее значение для разработки вакцины против гриппа и общественности. здоровье.Дальнейшие исследования должны быть сосредоточены на анализе изменений транскриптома слизистой оболочки носа после вакцинации LAIV.
Системная вакцинология продолжит играть важную роль в обнаружении коррелятов (наиболее важно, ранних сигнатур) защиты и предикторов ответа антител на другие вакцины и общих генных сетей, критически участвующих в регулировании ответов антител на разные вакцины. Системные подходы должны обеспечить лучшее понимание того, как конкретные генетические вариации способствуют защитному иммунитету как на индивидуальном, так и на популяционном уровне.Эти методы также должны определять процесс иммунного старения, который препятствует защите, обеспечиваемой нынешними вакцинами против сезонного гриппа на уровне населения, и может аналогичным образом препятствовать защите, обеспечиваемой универсальной вакциной против гриппа. Системная вакцинология могла бы дополнительно поддержать разработку универсальной вакцины против гриппа за счет выявления генетических сигнатур плазмобластов и плазматических клеток, которые продуцировали широко защитные антитела у субъектов, инфицированных или вакцинированных сезонными и пандемическими вакцинами против гриппа.
Использование высокопроизводительных методов скрининга привело к недавней идентификации нейтрализующего моноклонального антитела человека, которое распознает гликопротеин HA всех 16 подтипов и нейтрализует HA h2 и h4 вирусов гриппа А. Такие исследования могут послужить дополнительной информацией для разработки универсальных вакцин за счет идентификации редких эпитопов вирусных белков, таких как HA, M2, NP и других, распознаваемых широко защищающими антителами. Наконец, адъюванты позволяют применять антиген-сберегающие режимы, которые имеют решающее значение для производства вакцин в контексте пандемии.Более того, адъюванты быстро стимулируют выработку долгоживущих ответов В-клеток памяти, что приводит к длительной защите.
Иммунобиология вакцин против гриппа
Реферат
Вакцинация — это основная стратегия профилактики гриппа и борьбы с ним. Белок поверхностного гемагглютинина (НА) вируса гриппа содержит два структурных элемента (голова и стебель), которые различаются по своей потенциальной полезности в качестве мишеней для вакцины. Головка белка НА является основной мишенью для антител, которые придают защитный иммунитет к вирусам гриппа.Основное состояние здоровья, возраст и полиморфизм генов реципиентов вакцины и, что не менее важно, степень антигенного соответствия между вирусами в вакцине и вирусами, которые циркулируют, модулируют защиту вакцины от гриппа. Адъюванты вакцины и живая аттенуированная вакцина против гриппа улучшают широту иммунитета к сезонным и пандемическим штаммам вирусов. Выявление антител против консервативной области ствола НА, которые перекрестно реагируют с НА в типах или подтипах вируса гриппа, позволило бы разработать универсальную вакцину против гриппа.Очень сложная сеть взаимодействий, возникающая после заражения гриппом и вакцинации, может быть изучена с использованием инструментов системной биологии, таких как микрочипы ДНК. Использование системной вакцинологии позволило создать сигнатуры экспрессии генов, которые представляют ключевые транскрипционные различия между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа. Кроме того, использование инструментов системной вакцинологии привело к идентификации новых маркеров суррогатных генов, которые являются предикторами силы реакции хозяина на вакцины, что имеет решающее значение как для разработки вакцины, так и для общественного здравоохранения.Выявление связи между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин.
Критические успехи в понимании иммунобиологических механизмов, ведущих к защите, обеспечиваемой противогриппозными вакцинами, были достигнуты за последнее десятилетие. В этом обзоре мы обсуждаем наиболее актуальные из этих достижений с особым акцентом на использование инструментов вакцинологии для улучшения производства вакцин и повышения иммуногенности, а также на системную вакцинологию для раннего выявления лиц, отвечающих на вакцинацию.Мы также уделяем внимание гетеротипическому иммунитету к гриппу и иммунологической основе для разработки универсальной вакцины против гриппа. Эти проблемы в разработке вакцины против гриппа и соответствующие возможности кратко описаны в.
Таблица 1
— Проблемы и стратегии в разработке вакцины против гриппа
| Проблемы | Стратегии |
| Антигенный дрейф / сдвиг вируса гриппа | Повышение антигенного соответствия за счет разработки универсальной вакцины против гриппа (защищает от большинство разновидностей штаммов и подтипов гриппа): |
| 1.Вакцина-кандидат будет вырабатывать антитела против консервативной области ствола HA, которые перекрестно реагируют с HA h2 и h4 1 | |
| 2. Вакцина-кандидат будет использовать внеклеточные домены M2 и NP в качестве защитных антигенов 2 | |
| 3. Разработка кандидатных универсальных вакцин против гриппа на основе сигнатур генов, связанных с разработкой широкопротекторных антител 3 | |
| Усиление клеточно-опосредованных ответов с помощью LAIV 4 | |
| Индивидуальные вариации иммунного ответа на грипп | Использование индивидуального подхода, ориентированного на пациента: |
| 1.Увеличить текущие знания о генетических полиморфизмах хозяина в иммунном ответе на вакцину против гриппа 5 | |
| 2. Использование инструментов системной вакцинологии для дальнейшего понимания влияния индивидуальных генетических вариаций на развитие защитного иммунитета 3 | |
| Субоптимальная иммуногенность в группах риска: пожилые люди (старение иммунитета), люди с сопутствующими заболеваниями (тяжелая астма) | Разработка адъювантных противогриппозных вакцин 6 |
| Надежное праймирование клеточной ветви иммунная система с виросомами 7 | |
| Производство высокодозных вакцин против гриппа 8 | |
| Раннее выявление лиц, не ответивших на вопросы, с помощью вакцинных чипов 3 | |
| Потребность в вакцинах которые вызывают быстрое повышение защитных антител в условиях пандемии гриппа | Препандемическое праймирование противогриппозной вакциной с адъювантом MF59 с последующим усилением долгоживущих В-клеток памяти человека в условиях пандемии 9 |
| Потребность в вакцинах, которые можно было бы быстро производить в ответ на начинающуюся пандемию | Надзор, направленный на выявление пандемических вирусов-предшественников с новыми NA 10 |
| Ограниченная доступность субъединичных белков НА и NA для производства вакцины | Антиген -сохраняющие режимы вакцинации путем разработки вакцин на основе адъювантов 11 — 15 |
| Продленный график производства вакцины | Сокращение сроков производства вакцины на: |
| 1.Использование технологии обратной генетики на основе плазмид для создания референсных штаммов вакцин 16 , 17 | |
| 2. Разработка нерепликативной вакцины против гриппа с вектором аденовируса, которая может быть произведена без предварительных условий роста гриппа вирус в яйцах или клетках 18 | |
| Несбалансированный ответ на HA и NA в существующих противогриппозных вакцинах | Разработка противогриппозных вакцин с более высоким содержанием антигена NA 19 |
| Низкая иммуногенность пандемического гриппа штаммов у иммунологически наивных людей | Разработка новых адъювантных вакцин 9 |
| Длительное время, необходимое для оценки новых противогриппозных вакцин в клинических испытаниях, особенно в контексте пандемии | Идентификация ранних молекулярных сигнатур, которые могут быть используется для предсказания последующие иммунные ответы 20 , 21 |
| Применение знаний, полученных из ранних иммунных сигнатур субоптимальных вакцин, для разработки более эффективных 3 |
Вирус гриппа и иммунные медиаторы защиты
Выделение вируса гриппа А в 1933 г. 22 привело к первому использованию противогриппозных вакцин в 1930-х и 1940-х годах. 23 — 25 Вирусы гриппа содержат восемь одноцепочечных сегментов РНК, кодирующих 11 белков, и классифицируются на три различных типа на основе основных антигенных различий: грипп A, грипп B и грипп C, с типами A и B вызывает ежегодные эпидемии среди людей. 26 Тримерный гликопротеин гемагглютинина (НА) является главной детерминантой вирулентности и отвечает за прикрепление вируса к специфическим белкам, содержащим сиаловую кислоту, на поверхности клетки-хозяина и, в конечном итоге, за слияние вирусной и эндосомной мембран и выброс вирусных нуклеиновых кислот в цитоплазму.Белок НА содержит два структурных элемента: головку (основная мишень антител, обеспечивающих защитный иммунитет к вирусам гриппа 27 ) и стебель. Оба элемента различаются по своей потенциальной полезности в качестве мишеней для вакцины (обсуждаются в разделе «Шаги к разработке универсальной вакцины против гриппа»). Протеолитическое расщепление НА необходимо для образования инфекционного вируса, но роль расщепления НА в патогенезе у людей в настоящее время неизвестна. Однако известно, что вирусы гриппа используют неструктурный белок 1 в качестве механизма обхода интерфероновой реакции хозяина I типа (обсуждается в разделе «Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин»).Нейраминидаза (NA) представляет собой гликопротеин, который удаляет сиаловую кислоту из вирусных белков и предотвращает агрегацию вируса за счет связывания белка HA с другими белками. Антитела к вирусам NA накапливают на поверхности клетки, эффективно уменьшая количество вируса, высвобождаемого из инфицированных клеток. 19 Хотя иммунный ответ на поверхностные гликопротеины гриппа в основном гуморальный, Т-клетки CD4 + и CD8 + также играют важную роль в иммунитете к гриппу.
В отличие от штаммоспецифического ответа антител, клеточный иммунитет имеет тенденцию быть более перекрестным между вирусными подтипами, распознавая более консервативные эпитопы на поверхностных белках и внутренних вирусных белках. 28 Открытие эпитопов на относительно хорошо консервативных белках гриппа, таких как нуклеопротеин (NP) M, и основа тримеров HA служит основой для разработки универсальной вакцины против гриппа, способной вызывать ответные реакции. перекрестная реактивность между подтипами (обсуждается в разделе «Шаги к разработке универсальной вакцины против гриппа»).
Из-за своих полимераз, подверженных ошибкам, вирусы гриппа претерпевают генетические изменения, которые приводят к постепенным антигенным изменениям как в НА, так и в NA, процесс, известный как антигенный дрейф, который приводит к появлению новых вариантных штаммов. 29 Антигенный сдвиг происходит, когда циркулирующий в настоящее время вирус гриппа A исчезает и заменяется новым подтипом с новыми гликопротеинами, с которыми антитела против ранее циркулирующего подтипа не реагируют перекрестно. 30 Однако воздействие 1918-подобного вируса h2N1 (от предыдущей инфекции или вакцинации) способствовало индукции перекрестно-реактивного ответа антител на вирус гриппа A (h2N1) 2009 года. 31
Филогенетический анализ последовательностей генов гриппа показал, что штаммы пандемий 20-го века возникли в результате многократного перераспределения вирусных генов между вирусами человека и животных. Хотя новый подтип всегда был новым HA, эти анализы показали, что новые NA и внутренние гены были введены в преобладающие штаммы вируса человека до приобретения нового пандемического HA. Меры надзора, направленные на выявление этих вирусов-предшественников, могут заранее предупредить должностных лиц здравоохранения о возникновении будущих пандемий. 10
Вакцинация является основной стратегией профилактики и борьбы с гриппом, 32 , 33 , но вакцина против гриппа должна пересматриваться почти каждый год, чтобы учесть постоянно возникающие проблемы. изменение вируса. Защита после естественной инфекции в первую очередь обеспечивается HA-специфическими антителами в сыворотке и слизистой оболочке, тогда как антитела, направленные против NA, консервативных белков гриппа и Т-клеточных ответов, снижают тяжесть заболевания за счет увеличения клиренса вируса. 26 , 30 , 34 Основываясь на серологических исследованиях гриппа с использованием сыворотки крови человека, титр ингибирования гемагглютинации (HAI) от 1:32 до 1:40 представляет собой диапазон титров. при котором примерно 50% людей будут защищены от заражения. 35 Не существует титра HAI, который мог бы гарантировать защиту от инфекции, 36 — 39 , хотя повышенные уровни сывороточных антител к HA обычно коррелируют с устойчивостью к инфекции гриппа, а более низкие уровни антител связаны с с повышенным риском заболевания среди лиц, инфицированных гриппом. 40 — 43 Идентификация дополнительных медиаторов раннего адаптивного и врожденного иммунитета имеет особое значение при разработке вакцин против пандемического гриппа (обсуждается в разделе «Врожденные иммунные сигнатуры, предсказывающие иммуногенность вакцины против гриппа»).
Разработка перекрестных защитных вакцин против гриппа
Помимо возраста и состояния здоровья реципиента, защита, обеспечиваемая вакцинами, зависит от степени антигенного соответствия между вирусами в вакцине и вирусами, циркулирующими в течение данного сезона гриппа. 44
Традиционные антигены в производстве противогриппозной вакцины
Каждая доза вакцины против сезонного гриппа содержит вирусы (или их белки НА), представляющие штаммы гриппа A (h4N2), A (h2N1) и гриппа B. считается наиболее вероятным распространением в предстоящем сезоне гриппа. Производство вакцины в Соединенных Штатах начинается с создания контрольных штаммов вакцин, то есть гибридных вирусов с генами HA и NA из дрейфующего варианта в сочетании с другими генами из лабораторного штамма, адаптированного для хорошего роста в яйцах. 26 Технология обратной генетики на основе плазмид теперь используется для надежного создания эталонных штаммов в более короткие сроки. 16 , 17 Вирионы, собранные из яиц, химически инактивируют, вирусную оболочку разрушают детергентами, а затем очищают белки HA и NA. HA является основным иммуногеном в инактивированных вакцинах против гриппа, и уровни HA используются для стандартизации доз вакцины. Количество NA не стандартизировано и может сильно различаться для разных производителей и производственных партий.Уровни антител NA также имеют решающее значение для защиты, и есть опасения, что вакцины против гриппа человека не содержат достаточного количества белка NA, чтобы вызвать сильный защитный ответ антител. 19
Мастер-штаммы вируса (MVS) для каждого из трех компонентов вируса гриппа в живой аттенуированной противогриппозной вакцине (LAIV) создаются посредством генетической реассортации. В этом процессе стабильный, аттенуированный, адаптированный к холоду главный донорский вирус скрещивается в культуре ткани с ожидаемым эпидемическим штаммом дикого типа, в результате чего получается MVS, который содержит два генетических сегмента, кодирующих HA и NA, полученные из антигенно релевантных вирусов гриппа. рекомендовано для включения в состав годовой вакцины Центрами по контролю и профилактике заболеваний и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Оставшаяся генетическая основа MVS происходит от основного вируса-донора, содержащего мутации, которые придают адаптированный к холоду, чувствительный к температуре и ослабленный фенотип. 45 LAIV стимулирует сильный перекрестно-реактивный ответ антител у детей и обеспечивает высокий уровень защиты от антигенных дрейфующих штаммов в сезон гриппа, когда существует неоптимальное соответствие между вакцинным штаммом и эпидемическим штаммом. Кроме того, LAIV индуцирует назальные антитела IgA, которые коррелируют с защитой. 4
Альтернативные антигены в производстве вакцины против гриппа
Кандидаты в вакцины могут быть разработаны быстро после секвенирования гена HA, что устраняет необходимость использования патогенных вирусов или адаптации вирусов для роста в яйцах или клеточной культуре. 26 Гены НА были клонированы в векторные вирусы, что привело к получению рекомбинантных вакцин, экспрессирующих белок НА, который индуцирует защитные клеточные ответы и ответы антител против вакцинного вируса и штаммов с антигенным дрейфом в исследованиях на животных. 46 — 50 Было показано, что интраназальное и подкожное введение вакцины против гриппа с вектором аденовируса является эффективным средством получения защитных антител против НА в ранних клинических испытаниях безопасности и иммуногенности. 18
Адъюванты используются для усиления иммунного ответа на вакцинные антигены с 1920-х годов. Как их преимущества, так и побочные эффекты связаны с активацией определенных компонентов врожденной иммунной системы. 51 Адъюванты позволяют использовать антиген-сберегающие режимы, обеспечивают гибкость временного интервала между вакцинациями, улучшают авидность антител и широту иммунитета к дрейфующим штаммам вируса, а также повышают ответ на вакцину у пожилых людей. 6 , 11 — 15
Эмульсии масла в воде, содержащие сквален, в настоящее время используемые в качестве адъювантов для лицензированных инактивированных вакцин против гриппа за пределами США, включают MF59 и AS03. 52 В AS03 сквален объединен с α-токоферолом, увеличивая общее содержание масла в AS03 по сравнению с MF59. MF59 работает независимо от Nalp3. 53 , 54 Его эффекты проявляются в месте инъекции, где он вызывает сильный приток гранулоцитов (нейтрофилов, эозинофилов) и нескольких типов антигенпрезентирующих клеток (APC) (моноциты, макрофаги и др.) дендритные клетки), которые захватывают антиген и адъювант и транспортируют их к дренирующим лимфатическим узлам. 55 Дистанционное праймирование противогриппозными вакцинами с адъювантом MF59 приводит к образованию пула перекрестно-реактивных В-клеток памяти, который может быть быстро усилен спустя годы с помощью несоответствующей вакцины с адъювантом MF59 для получения высоких титров перекрестно-реактивных нейтрализующих антител. 9 AS03 усиливает антиген-специфический адаптивный иммунный ответ за счет стимулирования моноцитов, а не дендритных клеток в качестве основных APC, а также за счет своего воздействия на функцию гранулоцитов и продукцию цитокинов. 56
Виросомы состоят из фосфолипидов, которые спонтанно образуют вирусоподобные пузырьки, к которым прикреплены поверхностные гликопротеины HA и NA вируса гриппа. 57 Виросомы взаимодействуют с В-лимфоцитами и захватываются APC, вызывая более сильный Т-хелперный (Th) 1-ответ, чем тот, который индуцируется неадъювантными противогриппозными вакцинами. 7
Шаги к разработке универсальной вакцины против гриппа
Универсальная вакцина против гриппа обладает способностью защищать от большинства разновидностей штаммов и подтипов гриппа.Многие стратегии разработки универсальной вакцины против гриппа основаны на повышении иммунного ответа против белков гриппа, которые являются высококонсервативными для всех штаммов. 58 , 59 Гетеротипический иммунитет (перекрестная защита) относится к защите некоторых людей от подтипов вируса гриппа, которым они ранее не подвергались в результате естественной инфекции или иммунизации. Возможное объяснение перекрестного защитного иммунитета возникло из понимания молекулярных мишеней широко нейтрализующих моноклональных антител, направленных против различных частей белка НА.
Специфическая область стебля НА является высококонсервативной среди многих вирусных штаммов, и стало возможным стимулировать выработку нацеленных на стебель антител с перекрестными нейтрализующими свойствами у нескольких видов хозяев, включая нечеловеческих приматов. 60 Иммунные ответы на пандемическую инфекцию гриппа h2N1 2009 года включают широко перекрестно-реактивные антитела против эпитопов стебля HA и головного домена множества штаммов гриппа. 61 Большинство HA-специфических антител от здоровых реципиентов вакцины против пандемического гриппа h2N1 также показали широкую перекрестную реактивность с головкой HA, и было показано, что три широких перекрестно-реактивных антитела связываются со стеблем HA. 62
Гетеротипические (перекрестно-защитные) антитела человека генерировались после проведения вакцинации против сезонного гриппа, что приводило к продукции сывороточного IgG, который перекрестно реагировал с H5 HA. Увековечивая В-клетки памяти этих людей, исследователи выделили панель из 20 гетеротипических нейтрализующих моноклональных антител, которые нейтрализовали вирусы, принадлежащие к нескольким подтипам НА (h2, h3, H5, H6 и H9), включая пандемический A / California / 07 / 09 Изолят h2N1. 63 Путем опроса> 100000 плазматических клеток от восьми доноров-людей, инфицированных несколькими штаммами гриппа A или иммунизированных против них, ученые выделили нейтрализующее моноклональное антитело (F16), которое распознало белки HA, присутствующие во всех 16 подтипах гриппа, и нейтрализовало оба h2 и вирусы гриппа А h4 путем связывания с консервативным эпитопом в субдомене слияния (основа тримеров НА). Пассивный перенос этого антитела обеспечивает защиту от инфекции и смерти у животных, предполагая, что выработка антител против области ствола HA, которые перекрестно реагируют с HA h2 и h4 (или между подтипами), является реалистичным подходом к разработке универсальных противогриппозных вакцин. 1
Другие подходы сосредоточены на использовании консервативных эпитопов вирусных белков, включая внеклеточный домен белка ионного канала матрикса 2 (M2) и NP в качестве защитных антигенов. Основываясь на заражении H5N1 у хорьков, иммунизация ДНК-вакцинами, кодирующими HA, индуцирует более высокий титр нейтрализующих антител, чем иммунизация ДНК NP и M2, предполагая, что NP и M2 могут потребовать комбинаторной вакцинации с HA, чтобы быть подходящими кандидатами для универсальных вакцин против гриппа. 2
Тщательное понимание широко защитных ответов антител на консервативные эпитопы имеет решающее значение для разработки универсальной вакцины, но и ответы хозяина также очень важны. Выявлены множественные ассоциации между вариациями гуморального иммунитета к вакцинам против сезонного гриппа и полиморфизмами генов лейкоцитарных антигенов, цитокинов и рецепторов цитокинов человека. Выявление ассоциаций между вариациями иммунных ответов вакцины и полиморфизмами генов имеет решающее значение при разработке универсальных противогриппозных вакцин, способных генерировать длительные защитные иммунные ответы против высококонсервативных белков гриппа, поскольку эти гены являются важными мишенями для транскрипции во время иммунных ответов вакцины. 5 Тем не менее, текущая оценка иммуногенности противогриппозных вакцин, основанная исключительно на конечном результате развития адаптивных иммунных ответов, по крайней мере, неполна и не учитывает потенциал врожденных ответов, которые развиваются вскоре после вакцинации. в качестве иммунологических маркеров ответа (обсуждается в разделе «Врожденные иммунные сигнатуры, прогнозирующие иммуногенность вакцины против гриппа»)
Системная вакцинология
Наше понимание врожденных и адаптивных иммунных ответов in vivo значительно улучшилось благодаря использованию системной биологии.Этот развивающийся междисциплинарный подход систематически описывает взаимодействия между всеми частями биологической системы с целью прогнозирования поведения этой системы. 64 Системная биология или системная вакцинология в контексте разработки вакцин требует использования сложных и мощных математических и вычислительных методов моделирования для выявления, измерения и прогнозирования явлений иммунитета, вызванного вакциной, включая, помимо прочего, , различия в экспрессии генов через сотни и тысячи наборов зондов (набор зондов), предназначенных для исследования данной последовательности.
Генерическое и специфичное для гриппа транскрипционное профилирование
Микроматричный чип ДНК — это инструмент системной биологии, содержащий большой упорядоченный массив ДНК-зондов с известной последовательностью, напечатанных на твердой подложке и изготовленных в очень маленьком масштабе. Зонды используются для исследования состава сложных смесей ДНК (включая кДНК, полученную из транскриптов РНК) посредством гибридизации. 65 Такие микромассивы ДНК используются для создания профиля транскрипции (сигнатуры экспрессии генов), который представляет собой снимок генов, экспрессируемых в определенный момент времени конкретным типом клеток или тканью.
Комбинированный анализ опубликованных данных транскрипционного профилирования, полученных из 32 исследований и 77 различных взаимодействий между хозяином и патогеном, привел к идентификации кластера из 511 генов, которые составляют общий ответ хозяина, индуцированный во многих различных типах клеток на разные патогены. 65 Группа генов с наиболее сильной и устойчивой активацией состоит из генов, кодирующих цитокины (так называемый кластер воспалительных / хемотаксических цитокинов). Следует отметить, что повышающая регуляция кластера воспалительных / хемотаксических цитокинов является относительно слабой после заражения вирусом гриппа, который активирует клетки млекопитающих через врожденный иммунный рецептор для одноцепочечного Toll-подобного рецептора (TLR) 7 66 и, возможно, через TLR3.Напротив, вирус гриппа вызывает большую активацию интерферона и индуцированных интерфероном генов, включая несколько генов хемокинов, способствуя развитию иммунного ответа Th2-типа.
Использование транскрипционного профилирования для идентификации факторов вирулентности, специфичных для гриппа, и ответов на адъюванты человеческих вакцин
Транскрипционное профилирование успешно использовалось для сравнения влияния вирусных белков из разных штаммов и подтипов на иммунный ответ.Этот подход показал, что подавление экспрессии генов-хозяев может быть локализовано в вирусных белках, которые, как известно, вызывают тяжелое заболевание. Например, ген NS1 вируса гриппа A играет центральную роль в ингибировании зависимых от интерферона, цитокина и ядерного фактора κB сигнальных путей. Вирусы, содержащие NS1 пандемии 1918 года, блокировали экспрессию регулируемых интерфероном генов более эффективно, чем вирусы, содержащие NS1 из более современных штаммов. 67 Анализ транскриптомов также показал, что MF59 является мощным индуктором генов, участвующих в миграции лейкоцитов, в частности JunB и Ptx3 . 68
Транскрипционные профили, лежащие в основе клинических симптомов инфекции гриппа
В исследованиях анализировались in vivo изменения экспрессии генов в лейкоцитах периферической крови субъектов с инфекцией гриппа А. 69 — 71 Наблюдались ключевые различия в транскрипции между бессимптомными и симптоматическими ответами хозяина на инфекцию гриппа А.В частности, кластер генов, включая те, которые кодируют несколько рецепторов распознавания образов, которые регулируют иммунные ответы, действуя как сенсоры вирусной РНК (TLR7, РНК-геликазы и интерферон, индуцированный геликазой C-доменом 1), сильно активируется только у субъектов с симптомами. Эта уникальная сигнатура транскрипции проявляется за 36 часов до пиковых симптомов и позволяет прогнозировать тяжесть заболевания. 71
Врожденные иммунные сигнатуры, позволяющие прогнозировать иммуногенность вакцины против гриппа
Подходы к системной биологии (с использованием мультиплексного цитокинового анализа, проточной цитометрии и микроматричного транскрипционного профилирования) использовались для определения ранних молекулярных сигнатур, которые можно использовать для прогнозирования более позднего иммунитета. ответы и получить лучшее представление о механизмах, лежащих в основе иммуногенности. 20 , 21 Гены, продукты которых участвуют в вирусном зондировании посредством TLR7 и TLR8, представлении антигена класса 1, опосредованном главным комплексом гистосовместимости, передаче сигналов интерферона, воспалении и ядерном факторе κB и киназе Януса / все сигнальные преобразователи и активаторы сигнальных путей транскрипции играют центральную роль в ответе вакцины на трехвалентную вакцину против гриппа (TIV) у взрослых в течение 24 часов после иммунизации. 20 Анализ этих ранних паттернов экспрессии генов выявил транскрипционную сигнатуру 494 гена, которая коррелировала с величиной ответа антител.Экспрессия CD74 , HLA-E , E2F2 и PTEN наиболее сильно коррелировала с величиной ответа антител. Экспрессия STAT1 (связанная с путями передачи сигналов интерферона) увеличивается после вакцинации, наиболее заметно в день 1 и в группе с высоким ответом. Экспрессия E2F2 (транскрипция репрессирует гены клеточного цикла для поддержания состояния покоя) снижается после вакцинации, наиболее заметно на 3-й день и в группе с высоким уровнем ответа.Различия между экспрессией STAT1 и E2F2 было достаточно, чтобы предсказать рано после вакцинации, будет ли человек в конечном итоге иметь высокий или низкий ответ, о чем судили по ответам антител. 20
Nakaya et al. 21 использовали инструменты системной биологии для сравнения врожденного и адаптивного иммунных ответов на вакцинацию TIV и LAIV. Среди генов, индуцированных вакцинацией TIV, эти исследователи обнаружили, что гены, которые преимущественно экспрессировались секретирующими антитела клетками, были обогащены.Этот результат мог отражать быстрое разрастание плазмобластов после вакцинации; однако микроматричный анализ В-клеток, отсортированных от вакцинированных субъектов, позволил сделать вывод о том, что наблюдаемые изменения экспрессии представляют собой реальные изменения транскрипции в В-клетках. Следует отметить, что экспрессия XBP-1 , фактора транскрипции, необходимого для дифференцировки В-клеток (а также его генов-мишеней), сильно повышалась на 7 день после вакцинации. Это усиление коррелировало с ответами на HAI.В отличие от результатов, полученных для TIV, анализ транскрипционной сигнатуры, индуцированной LAIV, показал значительное обогащение генов, высоко экспрессируемых в Т-клетках и моноцитах. В частности, экспрессия генов, связанных с интерфероном, в моноцитах на 3-й день после вакцинации коррелировала с ответом на HAI, предполагая связь между ответом на интерферон и ответом антител.
С использованием биоинформатического моделирования, такого как дискриминантный анализ с помощью смешанного целочисленного программирования, было идентифицировано 42 набора генов, которые можно было использовать для прогнозирования четырехкратной или большей амплитуды ответа антител через 4 недели после вакцинации против TIV.Ключевыми генами в прогностических сигнатурах генов были TNFRSF17, (член суперсемейства рецепторов фактора некроза опухолей 17, фактор созревания В-клеток), ген, ранее использовавшийся для прогнозирования величины ответа антител на вакцинацию вакциной против желтой лихорадки YF-17D, 72 и CD38 , который кодирует поверхностный белок, важный для развития лимфоцитов. Еще неизвестно, является ли TNFRSF17 частью большой сети генов, чья транскрипционная сигнатура представляет собой общий предиктор ответов антител на другие вакцины.Другой ген, CAMK4 (кодирующий кальций / кальмодулин-зависимую протеинкиназу типа IV [CaMK-IV]), также был идентифицирован в дискриминантном анализе TIV с помощью модели смешанного целочисленного программирования. 21 Экспрессия CAMK4 на 3-й день после вакцинации обратно коррелировала с титрами HAI-антител в плазме на 28-й день. CaMK-IV в регуляции ответов антител.Эти данные предполагают, что новые суррогатные генные маркеры могут быть полезны для прогнозирования величины ответа хозяина на вакцины против гриппа и для сокращения времени, необходимого для оценки защитных ответов вакцины в клинических испытаниях, сосредоточив внимание на прогнозировании врожденных ответов в стратегически ранние моменты времени (например, дни 0, 3, 7), а не гуморальные реакции, развивающиеся через несколько недель после вакцинации. Насколько нам известно, на сегодняшний день нет опубликованных данных о сигнатурах транскрипционного профилирования, генерируемых IgA-секретирующими В-клетками в слизистой оболочке носа реципиентов TIV или LAIV.
Системная вакцинология и разработка вакцины против гриппа
Индивидуальная изменчивость иммунных ответов на грипп в популяции зависит от возраста. До 50% пожилых реципиентов противогриппозных вакцин не реагируют на TIV с четырехкратным увеличением титров HAI, 35 , а наличие сопутствующих заболеваний, таких как астма, приводит к более низким показателям серопротекции у пожилых людей, чем у более молодых людей. к той же дозе вакцины, особенно при тяжелой астме. 8 У пожилых людей наблюдается субоптимальная секреция цитокинов, хроническое воспалительное состояние («воспаление»), а также сниженная функция Т-клеток, В-клеток и APC (обычно называемая иммуносенесценцией). Более конкретно, частота TIV-специфических секретирующих антитела клеток, циркулирующих после вакцинации, значительно ниже у пожилых субъектов, чем у более молодых субъектов, что приводит к дисфункциональному иммунитету и нарушению формирования памяти. 73 , 74
Идентификация прогностических сигнатур вакцин позволила бы разработать чип вакцины с несколькими сотнями генов, которые могли бы исследовать конкретный тип врожденного или адаптивного иммунного ответа (например, , величина эффекторного ответа Т-клеток CD8 + ; частота Th-клеток; баланс клеток Th2, Th3 и Th27; титры высокоаффинных антител).Такой чип позволит быстро идентифицировать (или предсказывать) неоптимальные реакции у пожилых людей и других групп, таких как младенцы и люди с ослабленным иммунитетом. 3 Более того, эти чипы могут быть полезны для идентификации безопасных и эффективных адъювантов, которые могут быть использованы для усиления ответа антител у таких слаборазвитых людей.
Раннее выявление лиц с низким уровнем ответа имеет решающее значение в контексте пандемий или при проведении клинических испытаний вакцин в рамках адаптивного дизайна.В обеих ситуациях системная вакцинология позволит быстро оценить силу, тип, продолжительность и качество защитных иммунных ответов, стимулированных вакциной, и направить совершенствование вакцинных рецептур, систем доставки и общую разработку вакцин с улучшенной иммуногенностью. 3 , 75
Выводы
Анализ ранних изменений транскриптома после вакцинации против гриппа и того, как эти изменения коррелируют или могут использоваться для прогнозирования местных ответов антител, имеет решающее значение для разработки вакцины против гриппа и общественности. здоровье.Дальнейшие исследования должны быть сосредоточены на анализе изменений транскриптома слизистой оболочки носа после вакцинации LAIV.
Системная вакцинология продолжит играть важную роль в обнаружении коррелятов (наиболее важно, ранних сигнатур) защиты и предикторов ответа антител на другие вакцины и общих генных сетей, критически участвующих в регулировании ответов антител на разные вакцины. Системные подходы должны обеспечить лучшее понимание того, как конкретные генетические вариации способствуют защитному иммунитету как на индивидуальном, так и на популяционном уровне.Эти методы также должны определять процесс иммунного старения, который препятствует защите, обеспечиваемой нынешними вакцинами против сезонного гриппа на уровне населения, и может аналогичным образом препятствовать защите, обеспечиваемой универсальной вакциной против гриппа. Системная вакцинология могла бы дополнительно поддержать разработку универсальной вакцины против гриппа за счет выявления генетических сигнатур плазмобластов и плазматических клеток, которые продуцировали широко защитные антитела у субъектов, инфицированных или вакцинированных сезонными и пандемическими вакцинами против гриппа.
Использование высокопроизводительных методов скрининга привело к недавней идентификации нейтрализующего моноклонального антитела человека, которое распознает гликопротеин HA всех 16 подтипов и нейтрализует HA h2 и h4 вирусов гриппа А. Такие исследования могут послужить дополнительной информацией для разработки универсальных вакцин за счет идентификации редких эпитопов вирусных белков, таких как HA, M2, NP и других, распознаваемых широко защищающими антителами. Наконец, адъюванты позволяют применять антиген-сберегающие режимы, которые имеют решающее значение для производства вакцин в контексте пандемии.Более того, адъюванты быстро стимулируют выработку долгоживущих ответов В-клеток памяти, что приводит к длительной защите.
Антигенная характеристика | CDC
«Антигены» — это молекулярные структуры на поверхности вирусов, которые распознаются иммунной системой и способны вызывать один вид иммунного ответа, известный как выработка антител. Два белка (гемагглютинин и нейраминидаза) на поверхности вирусов гриппа содержат основные антигены, нацеленные на антитела (см. Рисунок 1).
Когда кто-то подвергается воздействию вируса гриппа (через инфекцию или вакцинацию), его иммунная система вырабатывает специфические антитела против антигенов (поверхностных белков) этого конкретного вируса гриппа. Термин «антигенные свойства» используется для описания антител или иммунного ответа, вызванного антигенами конкретного вируса. «Антигенная характеристика» относится к анализу антигенных свойств вируса, чтобы помочь оценить, насколько он связан с другим вирусом.
CDC дает антигенные характеристики около 2 000 вирусов гриппа в течение типичного сезона гриппа, чтобы отслеживать изменения в циркулирующих вирусах и сравнивать, насколько эти вирусы похожи на те, которые включены в вакцины.Антигенная характеристика может указывать на способность вакцины против гриппа вызывать иммунный ответ против вирусов гриппа, циркулирующих среди людей. Эта информация также помогает экспертам решить, какие вирусы следует включить в вакцину против гриппа в предстоящем сезоне.
Серологические тесты с использованием сыворотки человека и генетического секвенирования предоставляют дополнительную информацию о том, насколько циркулирующие вирусы гриппа похожи на вакцины или другие вирусы гриппа.
значок изображенияНа приведенном выше изображении показаны различные особенности вируса гриппа, включая основные поверхностные белки, гемагглютинин (НА) и нейраминидазу (NA).После инфицирования гриппом или получения вакцины против гриппа иммунная система организма вырабатывает антитела, которые распознают и связываются с «антигенными сайтами», то есть участками, обнаруженными на поверхностных белках вируса гриппа. Связываясь с антигенными сайтами HA, антитела могут нейтрализовать вирусы гриппа, что предотвращает их дальнейшее заражение. (Антитела, которые связываются с антигенными сайтами NA, также могут уменьшить дальнейшее распространение.)
Анализ ингибирования гемагглютинации (HI-тест)
Ученые используют тест, называемый анализом ингибирования гемагглютинации (тест HI), для антигенной характеристики вирусов гриппа.Белки НА на поверхности вирусов гриппа могут связываться с эритроцитами и «склеивать» их вместе, образуя решетчатую структуру (это известно как «гемагглютинация»). На рисунке ниже представлен пример гемагглютинации. В самой правой части изображения показано, как выглядит гемагглютинация в лунке микротитровального планшета (более подробно это объясняется ниже).
Тест HI работает, измеряя, насколько хорошо антитела связываются с белками HA и не позволяют им «склеивать» эритроциты вместе (т.е.е. ингибирование гемагглютинации). На рисунке ниже показан пример ингибирования гемагглютинации. В самой правой части изображения показано, как ингибирование гемагглютинации выглядит в лунке микротитрационного планшета (более подробно это объясняется ниже).
Ученые используют тест HI для оценки антигенного сходства между вирусами гриппа. Этот тест помогает выбрать вирусы-кандидаты вакцины (CVV), включенные в вакцины против сезонного гриппа. Результаты теста HI могут сказать нам, распознают ли антитела, выработанные после вакцинации одним вирусом, связываются ли они с другими циркулирующими вирусами гриппа и, следовательно, являются ли они похожими на них.Ученые также используют тест HI для сравнения антигенных свойств (т.е. способности вируса распознаваться антителами) циркулирующих в настоящее время вирусов гриппа с вирусами гриппа, которые циркулировали в прошлом.
Тест HI включает три основных компонента: антитела, вирус гриппа и эритроциты, которые смешиваются вместе в лунках (т. Е. Чашках) микротитровального планшета. (См. Изображение 1.)
Планшет для микротитрования используется для проведения теста HI.Планшет содержит лунки (т. Е. Чашеобразные углубления, в которых может находиться небольшое количество жидкости), куда вводят раствор антител, вируса гриппа и эритроцитов и позволяют им взаимодействовать. Эти лунки расположены в ряды и столбцы (которые обозначены на микротитровальном планшете буквами и цифрами соответственно). Ряды планшета можно использовать для тестирования разных вирусов гриппа против одного и того же набора антител. Столбцы можно использовать для различения больших разведений антител, например шкалу от низкого до высокого слева направо (см. Примеры на рисунках 3 и 4).
Антитела, используемые в HI-тесте, получают путем заражения животного (обычно хорька), которое является иммунологически наивным (т. Е. Оно не подвергалось воздействию какого-либо вируса гриппа или вакцины ранее в течение своей жизни). Иммунная система животного вырабатывает антитела в ответ на антигены на поверхности конкретного вируса гриппа, который использовался для заражения этого животного. Для изучения этих антител у животного берут образец крови, от которого получают сыворотку. Тест HI измеряет, насколько хорошо эти антитела распознают и связываются с другими вирусами гриппа (такими как вирусы гриппа, выделенные от больных гриппом).Если антитела хорька, возникшие в результате воздействия вакцинного вируса, распознают и хорошо связываются с вирусом гриппа от больного пациента, это указывает на то, что вакцинный вирус антигенно подобен вирусу гриппа, полученному от больного пациента. Это открытие имеет значение для того, насколько хорошо вакцина может действовать на людей. См. Дополнительную информацию в разделе «Эффективность вакцины против гриппа: вопросы и ответы для медицинских работников».
Как упоминалось ранее, вирусы гриппа, используемые в тесте HI, получены от больных людей.CDC и другие сотрудничающие центры ВОЗ собирают образцы у людей со всего мира, чтобы отслеживать, какие вирусы гриппа инфицируют людей, и следить за тем, как эти вирусы меняются.
Для теста HI берут эритроциты (эритроциты) животных (обычно индейки или морские свинки). Они используются в тесте HI, потому что с ними связываются вирусы гриппа. Обычно эритроциты в растворе опускаются на дно лунки для анализа и образуют красную точку внизу (рис. 2А). Однако, когда вирус гриппа добавляется к раствору эритроцитов, поверхностные белки гемагглютинина (НА) вируса связываются с множеством эритроцитов.Когда вирусы гриппа связываются с эритроцитами, красные клетки образуют решетчатую структуру (рис. 2В). Это удерживает эритроциты во взвешенном состоянии в растворе вместо того, чтобы опускаться на дно и образовывать красную точку. Процесс связывания вируса гриппа с эритроцитами с образованием решетчатой структуры называется «гемагглютинацией».
Тест HI включает взаимодействие эритроцитов (эритроцитов), антител и вируса гриппа. В строке A показано, что в отсутствие вируса эритроциты в растворе опускаются на дно лунки микротитратора и выглядят как красная точка.В строке B показано, что вирусы гриппа будут связываться с эритроцитами при помещении в тот же раствор. Это называется гемагглютинацией и выражается в формировании решетчатой структуры, изображенной в крайнем правом столбце под заголовком «Результаты микротитрования». Строка C показывает, что антитело хорошо связывается с вирусом и не позволяет вирусу склеивать эритроциты вместе и формировать решетчатую структуру, поэтому гемагглютинация не происходит (т.е. вместо этого происходит ингибирование гемагглютинации).
Когда антитела предварительно смешаны с вирусом гриппа, за которым следуют эритроциты, антитела будут связываться с антигенами вируса гриппа, которые они распознают, покрывая вирус, так что его поверхностные белки НА больше не могут связываться с эритроцитами (рис. 2С).Реакция между антителом и вирусом подавляет (т.е. предотвращает) возникновение гемагглютинации, что приводит к ингибированию гемагглютинации (как показано на рисунке 2C). Вот почему этот анализ называется «тестом на ингибирование гемагглютинации (HI)». Гемагглютинация (как показано на рисунке 2B) происходит, когда антитела не распознают и не связываются с вирусами гриппа в растворе, и в результате вирусы гриппа связываются с эритроцитами, образуя решетчатую структуру. Когда антитела распознают вирус гриппа в растворе и связываются с ним, это показывает, что вирус вакцины (например, тот, которым был заражен хорек) похож на вирус гриппа, полученный от больного пациента.Когда это происходит, говорят, что тестируемый вирус гриппа «антигенно подобен» вирусу гриппа, который создал антитела (от хорька).
Когда циркулирующий вирус гриппа по своим антигенам отличается от вакцины, антитела, выработанные в ответ на вакцинный вирус, могут не распознавать и не связывать этот вирус. В тесте HI это вызовет гемагглютинацию (см. Рисунок 2B). Циркулирующие вирусы гриппа, проверенные с помощью теста HI, обычно получают из респираторных проб, взятых у больных.
Оценка антигенного сходства с помощью теста HI
Тест HI оценивает степень антигенного сходства между двумя вирусами с использованием шкалы, основанной на разведении антител. Как упоминалось ранее, тест HI выполняется с использованием микротитровального планшета. Планшет для микротитрования содержит ряды и столбцы лунок (то есть чашек), в которых смешиваются эритроциты, вирус гриппа и антитела (разработанные против вируса сравнения, такого как вирус вакцины). Разведения отмечены наверху микротитровального планшета.Эти разведения функционируют как шкала для оценки антигенного сходства и иммунного ответа. Проверяя способность больших разведений антител предотвращать гемагглютинацию, ученые измеряют, насколько хорошо эти антитела распознают вирус гриппа и связываются с ним. Чем выше разведение, тем меньше антител необходимо для блокирования гемагглютинации и тем более антигенно схожи два сравниваемых вируса друг с другом. Наибольшее разведение антитела, которое приводит к ингибированию гемагглютинации тестируемого вируса, считается титром HI (рис. 3).
Этот вирус имеет титр HI 1280, что означает, что наибольшее разведение антитела, которое все еще блокировало возникновение гемагглютинации, было при разведении 1280. В этом разведении антитела все еще были способны распознавать антигены вируса и связываться с ними.
Когда CDC антигенно характеризует вирусы гриппа, чтобы принять решение о составлении вакцины против сезонного гриппа, тест HI используется для сравнения циркулирующих в настоящее время вирусов (строки B и C) с вирусами вакцины (строка A).Это позволяет ученым быстро определить, является ли вирус, используемый в вакцине против сезонного гриппа, антигенно схожим с циркулирующими вирусами гриппа и, следовательно, способен ли вызывать иммунный ответ против них.
границ | Вирусы гриппа: врожденный иммунитет и вакцины с мРНК
Введение
Врожденная иммунная система служит первой линией иммунного ответа хозяина против патогенов, а также вакцинами на основе вирусов, содержащими ослабленные или инактивированные вирусы, для предотвращения инфекционных заболеваний.После вакцинации врожденная иммунная система идентифицирует и удаляет вакцинированные клетки, одновременно координируя адаптивные иммунные ответы в форме антиген-специфических реакций, тем самым поддерживая долгосрочную защиту от вирусной инфекции. Чтобы быстро обнаруживать различные вирусы и защищаться от них, иммунные клетки эволюционировали и приобрели множество рецепторов распознавания образов (PRR), таких как Toll-подобные рецепторы (TLR), рецепторы, индуцируемые ретиноевой кислотой, подобные гену I (RIG-I) ( RLR), а также белков семейства рецепторов, подобных домену нуклеотид-связывающей олигомеризации (NOD) (NLR) (1, 2).Через такие рецепторы врожденная иммунная система активируется строго регулируемым образом, сохраняя при этом адаптивный иммунный ответ, но без чрезмерных врожденных иммунных ответов, которые могут вызвать повреждение тканей и системное воспаление, которые вредны для хозяина. В настоящем обзоре мы обсуждаем распознавание врожденного иммунитета, активацию инфламмасом и секрецию цитокинов в ответ на инфекцию вируса гриппа и его мРНК-вакцины. Мы также подчеркиваем, что вакцины с мРНК являются многообещающими инструментами для профилактики и борьбы с вирусными заболеваниями гриппа.
Краткая история вакцин против гриппа на сегодняшний день
Вирусы гриппа вызывают одни из самых опасных инфекций дыхательных путей у людей. По оценкам, сезонные эпидемии вируса гриппа в глобальном масштабе приводят к 290 000–650 000 смертей в год (3). Вирусы гриппа представляют собой оболочечные вирусы с одноцепочечной РНК отрицательного смысла (оцРНК) с сегментированным геномом. Например, вирус гриппа A (IAV) содержит восемь сегментов РНК, кодирующих субъединицы РНК-полимеразы [кислотный белок полимеразы (PA), основной белок полимеразы 1 (PB1), основной белок полимеразы 2 (PB2)], вирусные гликопротеины [гемагглютинин (HA ), что облегчает проникновение вирусов; и нейраминидаза (NA), которая способствует высвобождению вируса], вирусный нуклеопротеин (NP), матричный белок (M1), мембранный белок (M2) и неструктурный белок 1 (NS1) (рис. 1A).IAV инфицирует клетку посредством эндосомного захвата и высвобождения, и вирусные рибонуклеопротеины (vRNP) входят в ядро для транскрипции и репликации мРНК через промежуточный комплементарный рибонуклеопротеин (cRNP) с положительным смыслом. Затем вирусная мРНК превращается в вирусные белки в цитоплазме, которые образуют комплекс в новые вирионы и высвобождаются из клетки (рис. 1B).
Рисунок 1 Структура и репликация вируса гриппа А. (A) Геном вируса гриппа A (IAV) состоит из восьми сегментированных одноцепочечных и отрицательных РНК (вРНК).Каждый сегмент инкапсулирован нуклеопротеином (NP) и, опосредованный РНК-полимеразой, они образуют комплекс вирусного рибонуклеопротеина (vRNP) (PB1, PB2, PA и NP), который является важной единицей как для транскрипции, так и для репликации. (B) Инфекционный vRNP транспортируется в ядро, где происходит вирусная транскрипция и репликация с последующим продуцированием vRNP потомством. После того, как потомство vRNP экспортируется в цитоплазму, происходит сборка вируса. HA, гемагглютинин; M1, матричный белок; М2, мембранный белок; NA, нейраминидаза; NS1, неструктурный белок 1; PA, кислотный белок полимеразы; PB1, основной белок 1 полимеразы; PB2, основной белок полимеразы 2.
Существует четыре различных типа сезонных вирусов гриппа: типы A, B, C и D. Вирусы гриппа типов A и B в настоящее время совместно циркулируют в человеческой популяции и вызывают сезонные эпидемии: подтипы h2N1 и h4N2 IAV. и две расходящиеся линии (линия Yamagata и линия Vitoria) вирусов гриппа B (IBV) (4). При координации Глобальной сети эпиднадзора за гриппом Всемирной организации здравоохранения вакцины против сезонного вируса гриппа разрабатываются ежегодно, а составы содержат два штамма IAV и два штамма IBV; однако эффективность вакцин против сезонного вируса гриппа сильно варьируется в зависимости от сезона гриппа (5).При инъекции вакцины против сезонного гриппа клетки врожденного иммунитета, включая макрофаги и дендритные клетки (ДК), присутствующие в мышцах, вызывают увеличение высвобождения хемокинов, что приводит к привлечению большего количества иммунных клеток из крови в место заражения. вакцинация. Дифференцированные DC действуют как антигенпрезентирующие клетки и мигрируют в лимфатические узлы, что приводит к активации Т- и В-клеток для выработки антител (6) (рис. 2). Однако вакцины вызывают узкий и штаммоспецифический иммунитет, который требует постоянного обновления (почти каждый год) из-за высокой частоты точечных мутаций, что в конечном итоге представляет собой сложный, дорогостоящий и трудоемкий процесс.Кроме того, различные штаммы вирусов гриппа, в том числе вирусы птичьего и свиного, приобрели способность эффективно расти у людей, преодолевая видовые барьеры, исходящие от животных-резервуаров, и распространяться между популяциями, создавая серьезную угрозу для человека. Помимо сезонных эпидемий, пандемии гриппа происходят раз в несколько десятилетий и вызываются ВГА свиного происхождения, которые никогда не циркулировали и могут быстро распространяться среди населения. Пандемия вируса гриппа h2N1 в 1918 году унесла жизни около 40 миллионов человек во всем мире (7).С тех пор пандемии были вызваны h3N2 в 1957 г., h4N2 в 1968 г. и снова h2N1pdm09 в 2009 г. (8). Учитывая, что вакцины против сезонного вируса гриппа вызывают штамм-специфический иммунитет, который может не обеспечивать надежной защиты от заражения вирусом гриппа, вызывающим пандемию, существует необходимость в разработке новых противогриппозных вакцин, которые индуцируют широкий иммунитет, не ориентированный на соответствующий штамм вакцины ( 9).
Рисунок 2 Иммунный ответ хозяина против мРНК вакцин. Вакцина с самоусиливающейся РНК (саРНК) может быть доставлена в форме вирусоподобных частиц РНК, транскрибированной РНК in vitro и плазмидной ДНК.Дендритные клетки (ДК) распознают саРНК в мышцах, и клетки дифференцируются. Дифференцированные DC функционируют как антигенпрезентирующие клетки и мигрируют в лимфатические узлы, что приводит к активации Т- и В-клеток для продукции антител.
До 1980-х годов были созданы инактивированные и живые аттенуированные вакцины для защиты людей от патогенных микроорганизмов. Инактивированные вакцины производились путем химической или термической обработки, а живые аттенуированные вакцины обычно разрабатывались на животных или в клеточных линиях.Использование убитых вакцин на основе цельного организма или живых аттенуированных вакцин имело огромный успех в сокращении вирусных инфекций, включая корь, эпидемический паротит, краснуху и полиомиелит, а также в искоренении инфекции оспы (1). Несмотря на успех, серьезные опасения по поводу традиционных стратегий вакцинации сохраняются. Инфекционные патогены, такие как вирус гриппа, способны уклоняться от адаптивного иммунного ответа, и часто бывает трудно разработать живые ослабленные или убитые вакцины на основе целого организма (10).В случае современной вакцины против вируса гриппа основной проблемой является ее низкая эффективность у пожилых людей (≥ 65 лет), которые более восприимчивы к инфекции вируса гриппа, чем дети и взрослые (11). Такие недостатки вакцин с инактивированным вирусом гриппа часто связывают с мутациями поверхностных антигенов вируса гриппа. Другие опасения относительно живых аттенуированных вакцин против вируса гриппа включают возможность вызвать системное воспаление и смерть, возможно, из-за обратных мутаций, приобретения компенсаторных мутаций или рекомбинации с циркулирующими трансмиссивными штаммами дикого типа (12–14).
Обычно вирус гриппа заражает хозяина через носовую или ротовую полости, где он впервые контактирует с респираторным эпителием, подобно живым ослабленным вакцинам против гриппа, вводимым интраназально (15, 16). После заражения респираторных эпителиальных клеток вирус или интраназальная вакцина против гриппа может вызывать как системные иммунные реакции, так и иммунные реакции слизистых оболочек. Защитные механизмы клеток врожденного иммунитета, особенно DC, представляют собой серьезный барьер для вируса гриппа.Особые иммунные системы существуют на различных поверхностях слизистых оболочек для борьбы с инвазией вируса гриппа. Вирусная РНК, которая присутствует в инфицированных клетках, распознается как чужеродная различными рецепторами распознавания образов (PRR), что приводит к высвобождению провоспалительных цитокинов, хемокинов и интерферонов I типа (IFN). Макрофаги, пневмоциты, DC и плазмацитоидные DC продуцируют IFN типа I, которые, в свою очередь, стимулируют экспрессию IFN-стимулированных генов (ISG) в соседних клетках, которые вызывают антивирусные состояния (17-19).
В отличие от вирусной инфекции гриппа или интраназальной вакцины против гриппа, вакцины на основе мРНК содержат мРНК, которые кодируют как вирусный белок, так и иммуномодулирующие белки в качестве адъювантов, которые усиливают иммуностимулирующие свойства. При попадании мРНК в клетки-хозяева эндосомные (например, TLR3, TLR7 и TLR8) и цитозольные сенсоры врожденного иммунитета (например, RIG-I, PKR, NOD2, OAS и MDA5) распознают мРНК, включая одноцепочечную РНК (оцРНК). и двухцепочечная РНК (дцРНК). Впоследствии иммунные клетки активируются и продуцируют IFN типа I и множественные воспалительные цитокины (20).Однако одноцепочечные мРНК в вакцине очищаются надлежащим образом с помощью процесса транскрипции in vitro для устранения взаимодействия с сенсорами врожденного иммунитета, которые вызывают чрезмерную секрецию интерферона I типа и его клеточную дисфункцию (20).
Кроме того, адъювант стимулирует врожденный иммунный ответ и вызывает антиген-специфические Т-клеточные ответы, не вызывая системного воспаления, которое может вызвать серьезные побочные эффекты. Кроме того, место инъекции (например, подкожное, внутримышечное, внутрикожное и внутривенное) и составы для доставки вакцины мРНК (например,грамм. липидные наночастицы) влияют на силу иммунного ответа (21). Например, системы-носители липидных наночастиц дополнительно защищают мРНК от нуклеаз и могут нацеливать доставку в лимфатические узлы и способствовать трансляции белка в лимфатических узлах путем внутримышечной инъекции (20). В отличие от интраназального мРНК-опосредованного врожденного иммунного ответа, внутримышечная мРНК будет в первую очередь поглощаться неиммунными клетками, включая местные миоциты. Попадая в лимфатические узлы, липидная наночастица в конечном итоге фагоцитируется DC, которые, следовательно, продуцируют и представляют антиген Т-клеткам, чтобы способствовать адаптивным иммунным ответам (22, 23).Способность мРНК-вакцин индуцировать внутриклеточную продукцию антигенных белков наряду с врожденными иммунными ответами должна примировать как Т-клетки CD8 + , так и CD4 + , чтобы дифференцироваться на эффекторные подмножества и подмножества памяти для защиты от инфекции (24).
Об эффективном использовании мРНК in vitro, транскрибируемой , у млекопитающих впервые было сообщено в 1990 году, когда мРНК репортерного гена вводились мышам, что индуцировало продукцию целевых белков (25).Последующее исследование показало, что введение в гипоталамус мРНК, кодирующей вазопрессин, может вызвать физиологический ответ у крыс (26). Однако такие ранние многообещающие результаты не привели к значительным инвестициям в разработку мРНК-вакцин из-за опасений, связанных с нестабильностью мРНК, тяжелыми врожденными иммунными ответами и неэффективной доставкой in vivo . Однако за последнее десятилетие крупные технологические инновации и инвестиции в исследования сделали мРНК многообещающим инструментом вакцинации.Использование мРНК-вакцин имеет несколько преимуществ по сравнению с субъединичными, убитыми и живыми аттенуированными вирусами. Поскольку мРНК представляет собой неинфекционную и неинтегрирующую платформу, нет потенциального риска инфицирования или инсерционного мутагенеза. Кроме того, мРНК разрушается нормальными клеточными процессами, и различные модификации и способы доставки могут модулировать ее период полужизни in vivo (27–29). Формулирование мРНК в молекулы-носители способствует быстрому захвату и экспрессии в цитоплазме, где она является стабильной и легко переводимой (28, 30).Кроме того, мРНК-вакцины обладают быстрым, недорогим и легко монтируемым производственным потенциалом благодаря высокому выходу ответов транскрипции in vitro . Кроме того, было проведено несколько элегантных исследований с моделями вакцины мРНК гриппа на нечеловеческих приматах. После иммунизации обезьян модифицированной нереплицирующейся мРНК, кодирующей вирус гриппа h20, инкапсулированной в липидные наночастицы, защитные уровни антител против гемагглютинина резко повысились, аналогично наблюдениям после сезонной вакцинации против гриппа у людей (31).Используя новую технологию визуализации (позитронно-эмиссионная томография – компьютерная томография, ПЭТ – КТ), мРНК-вакцина, меченная зондом, используется для оценки биораспределения у обезьян, обеспечивая понимание механизмов врожденных и адаптивных иммунных ответов после введения вакцины. на месте и в дренирующем лимфатическом узле, что приводит к защитному иммунитету (32).
Врожденный иммунитет к вирусам гриппа
IAV распознается PRR, включая TLR, RLR и NLR, как чужеродный, что приводит к запрограммированной гибели клеток, секреции IFN типа I и провоспалительным цитокинам, вызывающим чрезмерное воспаление.
TLR- и RLR-ассоциированное распознавание вируса гриппа
TLR- и RLR-опосредованные сигналы для вирусов гриппа индуцируют высвобождение интерферонов типа I и стимулируют экспрессию ISG инфицированными и близлежащими клетками, вызывая антивирусное состояние (33– 36). Более того, сигналы TLR и RLR также вызывают высвобождение провоспалительных цитокинов, таких как интерлейкин (IL) -6 и IL-8 (37, 38).
TLR3 распознает дцРНК в эндосомах. Хотя клетки, инфицированные вирусом гриппа, не продуцируют дцРНК, Tlr3 — / — мышей имеют более длительную продолжительность жизни по сравнению с мышами дикого типа после заражения смертельным вирусом гриппа (38), что позволяет предположить, что TLR3 распознает неидентифицированную структуру РНК после вирусной инфекционное заболевание.Кроме того, Tlr3 — / — мышей вырабатывают нормальные антитела, а Т-клеточные ответы CD4 + и CD8 + после заражения вирусом гриппа (33) предполагают, что TLR3 незаменим для создания Т-клеточного иммунитета. В плазмацитоидных ДК TLR7 распознает геномы оцРНК вируса гриппа (34, 35). Передача сигналов TLR7 через адаптер , первичный ответ миелоидной дифференцировки 88 (MYD88) приводит к активации факторов транскрипции, включая ядерный фактор-κB (NF-κB) и IFN-регуляторный фактор 7 (IRF7), которые индуцируют продукцию IFN типа I и провоспалительные цитокины (39–41).
RIG-I представляет собой цитозольную PRR, которая обычно распознает 5’ppp-двухцепочечную РНК (дцРНК). RIG-I также распознает 5’ppp-вирусную оцРНК, которая продуцируется после репликации вируса гриппа (42–44). После обнаружения РНК вируса гриппа геликазный домен RIG-I взаимодействует с АТФ, что способствует конформационным изменениям доменов рекрутирования каспаз (CARD) для взаимодействия с сигнальным адаптером митохондриального антивирусного сигнального белка (MAVS) для продукции IFN типа I (45). , 46).
Инфламмасома-опосредованный ответ на вирус гриппа
NLR играют важную роль в противовирусном иммунном ответе, воспалительном ответе и индукции цитокинов.Провоспалительная передача сигналов вызывает рекрутирование иммунных клеток, таких как макрофаги и нейтрофилы, для устранения патогенов и молекул, производных от патогенов. IL-1β и IL-18 являются ключевыми провоспалительными цитокинами и важны для защиты от инфекции IAV (16, 47–49). Секреция IL-1β и IL-18 требует протеолитического созревания про-IL-1β и про-IL-18, соответственно, которое опосредуется инфламмасомами. Инфламмасомы представляют собой мультибелковые комплексы, состоящие из каспазы-1, ASC и PRR, таких как белок 3 семейства NOD-подобных рецепторов (NLRP3) (16, 47–49).При зондировании вирусного лиганда PRR индуцируют самоолигомеризацию и связываются с адаптерным белком инфламмасомы ASC, который состоит из N-концевого пиринового домена (PYD) и C-концевого CARD. ASC олигомеризует посредством гомотипических взаимодействий домена PYD, а затем связывается с каспазой-1 через CARD для образования инфламмасом, что в конечном итоге вызывает гибель воспалительных клеток.
В макрофагах индуцированная вирусом гриппа активация инфламмасомы NLRP3 требует, чтобы Z-ДНК связывающий белок 1 (ZBP1) формировал инфламмасому ZBP1 – NLRP3 (50, 51).При репликации IAV генерирует Z-РНК, которые представляют собой трансформированные версии двойной спирали РНК, которые воспринимаются ZBP1 и связываются с рецептором, взаимодействующим с серин / треонинкиназой 3 (RIPK3) и каспазой-8, чтобы активировать инфламмасому ZBP1 – NLRP3 ( 50–52). Недавно было показано, что каспаза-6 способствует RHIM-зависимому связыванию RIPK3 с ZBP1, способствуя ZBP1-опосредованной активации инфламмасом NLRP3 (53). В клетках респираторного эпителия MxA функционирует как сенсор инфламмасомы, который распознает вирусный белок гриппа NP и индуцирует высвобождение IL-1β и IL-18 независимым от NLRP3 образом (15, 16).
Было показано, что активация инфламмасом NLRP3 и MxA является важной врожденной иммунной защитой от вируса гриппа. После заражения штаммом вируса гриппа A / Puerto Rico / 8/34 (PR8) было обнаружено, что NLRP3 важен для миграции лейкоцитов в легкие и для защиты хозяина от инфекции (47, 49). Во время инфицирования вирусом гриппа у трансгенных мышей человека MxA быстрая активация инфламмасомы MxA в респираторном эпителии подавляла распространение вируса от бронхиол к дистальным альвеолярным областям (16).Результаты таких исследований показывают, что оптимальная активация инфламмасом благоприятна для хозяина; однако аномальная активация может привести к пагубным последствиям.
Адаптивный иммунитет к вирусу гриппа
Врожденные и адаптивные иммунные ответы значительно защищают хозяина от вирусов гриппа и важны для выработки сильных антител. После инфицирования вирусом гриппа врожденная иммунная система имеет решающее значение для распознавания и удаления вакцинированных клеток, а также для координации адаптивного иммунитета посредством реакции антиген-специфических антител и обеспечения долгосрочной защиты от вирусной инфекции.
При распознавании вирусных антигенов и взаимодействии с родственными CD4 + Т-лимфоцитами активируются наивные В-клетки (54). Некоторые из активированных В-клеток быстро дифференцируются в короткоживущие плазмобласты. Хотя другие активированные В-клетки мигрируют к фолликулам вторичных лимфоидных тканей и подвергаются реакции зародышевого центра, плазмобласты продуцируют первую волну вирус-специфических антител у людей. Если плазмобласты происходят из B-клеток памяти, количество плазмобластов достигает пика на периферии примерно через 7 дней после заражения (55).Однако небольшое количество активированных B-клеток будет дифференцироваться только в долгоживущие плазматические клетки, которые мигрируют и находятся в костном мозге для выработки антител, которые обеспечивают долгосрочный уровень антител в сыворотке и связаны с защитой от патогенов. инфекция и болезнь. Другая часть первично активированных B-клеток дифференцируется в B-клетки памяти (56, 57), которые не выделяют антитела и остаются на периферии для иммунного надзора, но они долгоживущие и могут реактивироваться, чтобы стать плазмобластами во время инфекции. для производства новых антител и дальнейших В-клеток памяти (55).В целом ответ антител на инфекцию вируса гриппа, обусловленный адаптивным иммунитетом, является относительно широким и долгоживущим; однако вирусы гриппа могут со временем отклоняться от адаптивных иммунных ответов из-за их высокой скорости мутаций и антигенной гибкости. Для разработки вакцин против вируса гриппа следующего поколения необходимы дальнейшие исследования того, как естественная вирусная инфекция вызывает долгоживущие иммунные ответы.
Обычные вакцины против сезонного вируса гриппа
Вакцины против сезонного вируса гриппа производятся с использованием технологий на основе яиц, клеток и белков, и весь процесс обычно занимает 6-8 месяцев.Вакцины против гриппа против IAV и IBV были изобретены в 1940-х годах, и такие вакцины, инактивированные цельным вирусом, были созданы в куриных яйцах с эмбрионами, которые состояли из грубо очищенного цельного вируса, инактивированного формалином и нитратом фенилртути (58, 59). В 2012 г. вакциносодержащий клеточный вирус появился в качестве альтернативного метода производства инактивированных и живых аттенуированных вакцин (60). Эффективность трехвалентной инактивированной и живой аттенуированной противогриппозных вакцин составляет примерно 65% и 83% у взрослых и детей соответственно (61).Используемые живые аттенуированные вакцины против вируса гриппа обычно адаптированы к холоду и чувствительны к температуре и эффективно реплицируются в верхних, но не нижних дыхательных путях (62–64). В совокупности такие исследования показывают, что вакцины против сезонного вируса гриппа представляют собой хорошую защиту от заражения вирусом гриппа.
Однако есть и отрицательные сообщения о таких вакцинах. Эффективность вакцины 75% у взрослых внезапно снижается у пожилых людей, которые более восприимчивы к инфекции вируса гриппа (65, 66).Кроме того, иногда возникают несоответствия между вакциной и циркулирующими штаммами, которые обычно связаны с более низкой эффективностью вакцины (67). Основываясь на данных вирусологического надзора в США и данных Сети по эффективности вакцины против гриппа (ВЭ против гриппа), расчетная эффективность вакцины (ЭВ) против ВБК или ИБК снизилась до 29% для всех возрастов в течение сезона гриппа 2019–2020 гг. (Средний показатель ЭВ в 2010–2018 гг. 44,1%) из-за распространения антигенно дрейфующего IAV (h4N2), что вызвало опасения по поводу выбора вакцинного штамма (68) (https: // www.cdc.gov/flu/vaccines-work/past-seasons-estimates.html). Кроме того, время защиты иногда бывает коротким (69, 70). Чтобы вызвать более сильные и устойчивые иммунные ответы у пожилых людей, были протестированы вакцины с высокими дозами или усовершенствованные адъювантные вакцины, включая MF59 и AS03. Дозы в высокодозовых вакцинах в 4 раза превышают дозы в трехвалентных инактивированных вакцинах, которые могут индуцировать более высокие количества антител, чем стандартные дозы вакцин (71). Сезонная вакцина с адъювантом MF59 была лицензирована и продается более чем в 25 странах для пожилого населения (72, 73).Вакцины против вируса гриппа с адъювантом AS03 также рассматриваются для использования у пожилых людей (74).
Обычные вакцины против пандемического вируса гриппа
ИАВ обычно передаются в пределах одного вида животных, но иногда они могут передаваться и вызывать заболевание у другого вида. В последней ситуации проявляются более значительные генетические изменения, чем в циркулирующем сезонном IAV человека. Если новый IAV заразен и легко распространяется среди людей, это считается пандемией вируса гриппа.Поскольку большая часть населения не имеет естественного иммунитета к новым штаммам вируса гриппа или имеет лишь ограниченный естественный иммунитет, вакцины-кандидаты против пандемического вируса против вируса гриппа были разработаны с использованием ряда производственных платформ. Платформа вакцины на основе инактивированного сплит-вируса гриппа с адъювантом продвинулась дальше всех, а другие платформы, включая нуклеиновую кислоту (ДНК и мРНК), вектор, рекомбинантный белок (VLP; вирусоподобная частица) и живой вирус, все еще находятся в стадии разработки (75 ). Вакцина против вируса птичьего гриппа H5N1 была первой вакциной U.Вакцина для населения, одобренная Управлением по контролю за продуктами и лекарствами США, поскольку высказывались опасения относительно возможности высокопатогенного вируса H5N1 вызывать пандемию гриппа (76, 77).
Одной из проблем в борьбе с пандемией гриппа является глобальный потенциал производства вакцины в течение нескольких месяцев после возникновения вспышки. В случае вакцин против штаммов H5N1 семенные штаммы были созданы с использованием обратной генетики для удаления многоосновного сайта расщепления HA и изменения скелета на таковой у высокоразвитого штамма PR8 h2N1, который проявляет относительно меньшую патогенность ( 77).Такие модификации облегчают производство более безопасных вакцинных штаммов и в больших количествах, поскольку высокопатогенные IAV часто убивают зародышевые яйца, что приводит к низкому производству (77). Ряд вакцин H5N1 и H7N9 был протестирован на людях, и для индукции надежного титра ингибирования гемагглютинации необходима высокая доза антигена или использование адъюванта (77, 78). Клиническое испытание вакцины H7N9 показало эффективность примерно 60%, несмотря на использование адъюванта (79), что указывает на то, что адъюванты и множественные вакцинации необходимы для достижения достаточной эффективности вакцины.
Стратегии вакцин с матричной РНК против вируса гриппа
Вакцины на основе мРНКшироко характеризуются экспериментальными подходами, которые улучшают стабильность и доставку мРНК, а также продукцию белка. Такие подходы включают разработку методов транспорта наночастиц, которые стабилизируют мРНК, увеличивают клеточное поглощение и улучшают биологическую доступность, когда мРНК проникает в клетку. Явным преимуществом вакцин с мРНК является то, что ей не нужно проникать в ядро, чтобы способствовать экспрессии антигена.
Вакцины с самоусиливающейся мРНК против вируса гриппа
Вакцина с самоамплифицирующейся РНК (саРНК) может быть представлена в виде плазмидной ДНК, вирусоподобных частиц РНК и in vitro, транскрибированных РНК (80) (рис. ). Вакцины saRNA на основе ДНК-плазмиды сочетают в себе преимущества более стабильного продукта нуклеиновой кислоты ДНК с более высокими уровнями экспрессии антигена. Вакцины saRNA вызвали сильный иммунный ответ на доклинических моделях (81). Вакцины saRNA происходят из основы генома альфавируса, в котором гены, кодирующие аппарат репликации вирусной РНК, не повреждены (82).
Фиг. 3 Получение экспрессии антигена путем самоамплификации РНК-вакцинации. Показаны три пути доставки самоусиливающейся РНК (саРНК). К ним относятся: 1) вирусоподобные частицы РНК, которые доставляют саРНК в цитоплазму посредством рецептор-опосредованного эндоцитоза, 2) прямую доставку in vitro репликона , транскрибированного саРНК репликона, в клетки либо в физиологическом растворе, либо в синтетических препаратах, и 3) несущие плазмидную ДНК гены репликазы и трансген в ядро, где он транскрибируется, генерируя репликон saRNA, который затем транспортируется в цитоплазму.Три пути вакцинации saRNA, наконец, генерируют информационную РНК (мРНК), которая транслируется через рибосом для получения вакцинного антигена.
Имеется несколько отчетов об использовании saRNA вакцины против вируса гриппа. Иммунизация 10 мг saRNA вакцины, кодирующей PR8 h2N1 IAV HA, вызвала антительный ответ и защиту от летального заражения гомологичным вирусом у мышей (83). Другое исследование показало разработку саРНК-вакцин, в которых саРНК, кодирующая HA A / California / 07/2009 (h2N1) или A / Shanghai / 2/2013 (H7N9) IAV, была сформулирована в липидных наночастицах, а малые дозы индуцировали защитные уровни ингибирования гемагглютинации. титры после двух внутримышечных инъекций мышам (84).В соответствии с этим открытием другая группа показала, что внутримышечное введение 0,1 или 0,2 мг PR8 h2N1 IAV NP, M1 или комбинированных вакцин NP + M1 самоусиливающихся РНК-липидных наночастиц приводит к сильным антиген-специфическим Т-клеточным ответам и защите от гомологичная вирусная инфекция (85). IAV HA и репликон NP РНК в комплексе с хитозан-содержащими липидными наночастицами или полиэтиленимином (PEI) вызвали Т- и В-клеточные иммунные ответы у мышей после подкожной доставки (86, 87). Недавнее исследование выявило платформу доставки, состоящую из химически модифицированного ионизируемого дендримера, образованного липидными наночастицами.Используя эту платформу, внутримышечная доставка репликонов РНК, кодирующих A / WSN / 33 (h2N1) IAV HA, успешно защищала мышей от заражения летальным гомологичным вирусом (88). Более недавнее исследование показало прямое сравнение иммунного ответа и защитной эффективности после иммунизации самореплицирующейся мРНК и нереплицирующейся мРНК у мышей (80). Животных внутримышечно иммунизировали два раза возрастающими дозами PR8 h2N1 IAV HA-кодирующей несформулированной самореплицирующейся мРНК или немодифицированной нереплицирующейся мРНК и заражали через восемь недель после первой вакцинации.Обе платформы индуцировали защиту от заражения гомологичным вирусом гриппа (80).
Вакцины с нереплицирующейся мРНК вируса гриппа
Вакцины с нереплицирующейся мРНК могут быть получены с включением различных модифицированных нуклеозидов, и много усилий было вложено в разработку нереплицирующихся мРНК вакцин для прямого введения. Существует несколько исследований нереплицирующихся мРНК-вакцин против вируса гриппа. Введение мРНК, кодирующей NP IAV, в липосомах, вызывало цитотоксические Т-клеточные ответы у мышей (89).Внутрикожно иммунизированные мыши, хорьки и свиньи различными РНК-активными вакцинами, кодирующими IAV, HA, NP и NA, вызвали защитный иммунный ответ после однократной иммунизации (90). Внутривенная иммунизация мышей с использованием HA-кодирующих PR8 h2N1 IAV немодифицированных комплексов мРНК-липид показала усиление активации Т-клеток после введения однократной дозы (91). Вместе будет важно определить, применимы ли эти результаты к клиническим испытаниям и вакцинации, и каким образом.
Врожденный иммунитет к мРНК-вакцинам
Врожденная иммунная система действует как первая линия иммунного ответа хозяина против вакцинации мРНК.Во время вакцинации мРНК мРНК может распознаваться различными PRR, включая TLR, RLR и NLR, для продукции IFN и провоспалительных цитокинов. Прототипически IFN и провоспалительные цитокины в значительной степени полезны для хозяина и запускают индукцию IFN-индуцируемых генов и инфильтрацию иммунных клеток для удаления вакцинированных клеток. Однако дисрегулируемые IFN и провоспалительные цитокины приводят к подавлению эффективности вакцин с мРНК, пагубному системному гипервоспалению и повреждению тканей.Следовательно, соответствующая очистка транскрибированной мРНК in vitro имеет решающее значение для максимизации продукции иммуногена и предотвращения нежелательной активации врожденного иммунитета.
TLR3 распознает дцРНК длиной более 45 пар оснований и те, которые получены из оцРНК, образующей вторичные структуры, или из промежуточных продуктов репликации вируса. TLR7 может распознавать как дцРНК, так и оцРНК, тогда как TLR8 воспринимает только оцРНК (92). Активация TLR7 может стимулировать презентацию антигена, высвобождение цитокинов и индуцировать B-клеточные ответы (93).В частности, RIG-I воспринимает оцРНК и дцРНК, несущие 5′-трифосфат, и стимулирует продукцию IFN (44, 94).
мРНК, полученный из вакцины. Производство IFN с помощью датчиков РНК зависит от качества транскрибированной мРНК in vitro , носителя для доставки и пути введения. Распознавание in vitro транскрибированной мРНК , загрязненной дцРНК, вызывает быструю индукцию IFN типа I, которая усиливает экспрессию и активацию протеинкиназы R (PKR) и 2′-5′-олигоаденилатсинтетазы (OAS).Это приводит к ингибированию трансляции и деградации клеточной мРНК, рибосомной РНК и in vitro транскрибированной мРНК (95–97) (рис. 4). Загрязняющая дцРНК может быть эффективно удалена из in vitro транскрибированной мРНК хроматографическими методами, включая обращенно-фазовую жидкостную хроматографию на быстрых белках или высокоэффективную жидкостную хроматографию. Было показано, что очистка этими методами увеличивает продукцию антигенного белка из in vitro транскрибированной мРНК примерно до 1000 раз в человеческих DC (97).Помимо примесей дцРНК, одноцепочечные молекулы мРНК распознаются как PAMP и обнаруживаются TLR7 и TLR8, что приводит к продукции IFN типа I и снижению продукции антигенного белка из in vitro транскрибированной мРНК (98–100).
Рисунок 4 Нарушение регуляции врожденного иммунитета препятствует эффективности мРНК-вакцины После вакцинации мРНК поступающая самоамплифицирующаяся РНК (саРНК) распознается Toll-подобным рецептором (TLR) 3, TLR7 и геном I, индуцируемым ретиноевой кислотой (RIG- I), что способствует их последующей передаче сигналов и последующей продукции интерферона I типа (IFN).Распознавание in vitro транскрибированной мРНК , загрязненной дцРНК, вызывает быстрое производство IFN типа I, которое индуцирует экспрессию и активацию протеинкиназы R (PKR) и 2′-5′-олигоаденилатсинтетазы (OAS). Это будет подавлять трансляцию и вызывать деградацию клеточной мРНК, рибосомной РНК и in vitro транскрибируемой мРНК . EIF2a, фактор инициации эукариот 2a; IFNAR, рецептор интерферона-альфа.
Учитывая, что снижение передачи сигналов IFN типа I имеет решающее значение для стратегии вакцинации мРНК, несколько исследований выявили развитие модифицированной мРНК, которая снижает передачу сигналов IFN I типа.Включение природных химически модифицированных нуклеозидов, включая псевдоуридин и 1-метилпсевдоуридин, предотвращает активацию TLR7, TLR8 и других сенсоров врожденного иммунитета, тем самым снижая передачу сигналов IFN типа I (27, 101–104). Другое исследование также показало, что модифицированная нуклеозидами мРНК транслируется лучше, чем немодифицированная мРНК in vitro , особенно в первичных DC, и in vivo у мышей (27, 103). В совокупности баланс между мРНК-вакцинами и врожденным иммунным ответом имеет решающее значение для потенциальных подходов к вакцинам; этот баланс необходимо точно контролировать, чтобы уменьшить чрезмерные врожденные иммунные ответы при сохранении максимальной продукции иммуногена в DC.
Обратите внимание, что хотя зависимое от инфламмасомы высвобождение IL-1b и IL-18 запускает дальнейшую продукцию в DC для индукции специфического для вируса гриппа прайминга CD8 + Т-клеток (49, 105), независимо от того, in vitro транскрибированных мРНК могут быть распознаны сенсорами инфламмасом, остается в значительной степени неизвестным. Необходимы дальнейшие исследования, чтобы полностью изучить факторы, необходимые для адаптивного иммунного ответа, управляемого инфламмасомами.
Разработка вакцины против вируса гриппа на основе мРНК
Вакцины на основе мРНКв последнее время привлекли к себе значительное внимание, потребовали огромных академических и промышленных инвестиций, а биотехнологические компании преуспели в привлечении капитала для разработки инновационных РНК-вакцин.Первая инъекционная РНК-вакцина гриппа против h20N8 и H7N9 была разработана учеными Moderna Therapeutics (США), которые продемонстрировали возможность индукции защитной иммуногенности с приемлемыми профилями переносимости (106, 107). Для первого испытания РНК-вакцины против вируса сезонного гриппа человека компания CureVac AG (Германия) разработала стратегию последовательной инженерии мРНК-липидных наночастиц, которая обеспечивает экстраординарный уровень трансляции белка in vivo без использования модифицированных нуклеозидов (29).Используя эту стратегию, недавнее исследование продемонстрировало, что однократная внутримышечная иммунизация 10 мкг HA-кодирующих мРНК-липидных наночастиц A / Netherlands / 602/2009 (h2N1) индуцирует титры ингибирования гемагглютинации в защитном диапазоне (≥1: 40) при отсутствии -человеческие приматы. Более того, введение второй дозы эффективно усиливало иммунные ответы и приводило к титрам ингибирования гемагглютинации ≥1: 160 в течение более 1 года у всех вакцинированных животных (108). Ученые CureVac AG представили доказательства того, что две иммунизации мРНК-липидными наночастицами, кодирующими HA из A / Hong Kong / 4801/2014 (h4N2), вызывали более сильные Т- и В-клеточные иммунные ответы, чем лицензированная трехвалентная инактивированная вакцина IAV с адъювантом MF59.
Ограничения мРНК Вакцина
Реакции гиперчувствительности, связанные с мРНК вакцины, наблюдаются нечасто. Точно так же тяжелые острые, предположительно опосредованные иммуноглобулином-E (IgE) или иммуноглобулином-G (IgG) и опосредованные комплементом анафилактические или тяжелые системные ответы с отсроченным началом, опосредованные Т-клетками, также считаются очень редкими. Также может развиться гиперчувствительность к активному антигену вакцины. Острые реакции гиперчувствительности после вакцинации включают в себя ограниченные местные побочные эффекты, а системные реакции могут варьироваться от крапивницы / ангионевротического отека до полномасштабной анафилаксии с мультисистемным вовлечением (109).
Анафилаксия — это редкая опасная для жизни аллергическая реакция, которая обычно возникает в течение нескольких минут или часов после вакцинации (109). Анафилаксия, вызванная вакцинами, обычно бывает редко. Пандемия коронавирусного заболевания 2019 года (COVID-19) подчеркнула необходимость в надежном производстве вакцины с использованием мРНК-вакцин, полученных в липидных наночастицах. Неожиданно стало меньше серьезных аллергических реакций из-за общедоступных вакцин, и, как следствие, существует значительная общественная озабоченность, связанная с атопическими людьми.Предыдущие исследования иммунного механизма анафилаксии, связанной с вакцинами, были сосредоточены на присутствии желатина, латекса и яичных белков, а в последнее время — на полисорбате 80, широко используемом сурфактанте, присутствующем во многих вакцинах (110). Однако все вышеупомянутые вспомогательные вещества не были включены в вакцину мРНК Pfizer-BioNTech COVID-19, и в крупномасштабных клинических испытаниях фазы 2/3 не наблюдалось случаев анафилаксии; таким образом, эти события являются неожиданными (111, 112). Следовательно, возникновение анафилаксии при первоначальном воздействии вакцины COVID-19 относится к ранее существовавшему опосредованному антителами иммунитету (аллергии) или псевдоаллергической реакции, не связанной с предыдущим воздействием.
Анафилаксия, связанная с известными аллергенами, лучше всего понимается с помощью классической парадигмы сшитого IgE, связанного с фрагментарно-кристаллизуемой областью (Fc) ϵ рецепторами тучных клеток и базофилов, но неклассическими путями, включая антителозависимую активацию комплемента или IgG-ассоциированных тучных клеток / Опосредованная гранулоцитами / тромбоцитами / базофилами активация тучных клеток / гранулоцитов / тромбоцитов / базофилов через рецепторов Fcγ была описана на животных моделях и в аллергических ответах человека на лекарства (113–117).К сожалению, информация о потенциальном использовании вакцин для тестирования с целью подтверждения патологической этиологии или прогнозирования риска реактивности остается скудной.
Для решения этих проблем во время кризиса общественного здравоохранения требуется быстрая и тщательная оценка пациентов, у которых наблюдались анафилактические реакции на вакцины, и проспективные клинические испытания у лиц из групп риска.
Выводы и направления будущих исследований
Мы выделили реакцию врожденной иммунной системы во время вакцинации мРНК IAV.Оптимальное врожденное иммунное восприятие и высвобождение воспалительных цитокинов необходимы для Т- и В-клеточного иммунного ответа. Однако чрезмерные врожденные иммунные ответы хозяина могут приводить к цитокиновым бурям и / или повреждению тканей (118, 119), подавляя эффективность вакцин мРНК вируса гриппа. Следовательно, необходимо контролировать врожденный иммунитет, индуцированный мРНК, чтобы уменьшить чрезмерное воспаление при сохранении продукции антител.
За последнее десятилетие произошел явный прорыв в области мРНК-вакцин против вируса гриппа, продемонстрировав доказательство концепции как в доклинических, так и в клинических условиях (20).Однако снижение чувствительности к мРНК врожденным иммунитетом и максимальная переводимость многообещающих данных о животных людям остается сложной задачей. Для оценки воздействия РНК-вакцин на вакцины против вируса гриппа необходимы дальнейшие клинические испытания, изучающие долгосрочную безопасность и иммуногенность.
В настоящее время пандемия COVID-19 продолжает распространяться по всему миру, и для борьбы с ней срочно требуются эффективные вакцины. Одобренные FDA мРНК-вакцины очень эффективны для профилактики инфекции SARS-CoV-2 у взрослых трудоспособного возраста, поскольку вакцины ослабляют вирусную РНК-нагрузку, снижают риск лихорадочных симптомов и продолжительность заболевания среди тех, у кого прорывная инфекция наблюдается, несмотря на вакцинацию (120). ).Будущее области вакцины на основе мРНК является потенциальным, и клинические данные и ресурсы, предоставляемые ассоциированными компаниями и другими академическими учреждениями, вероятно, будут в значительной степени опираться на фундаментальные исследования вакцин на основе мРНК и способствовать их укреплению.
Вклад авторов
SL и J-HR разработали план рукописи. SL и J-HR. написал рукопись. SL и J-HR критически отредактировали и одобрили окончательную версию рукописи. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование было частично поддержано грантами Министерства образования, культуры, спорта, науки и технологий Японии (19K16665 — SL).
Автор Заявление об отказе от ответственности
Ответственность за содержание полностью лежит на авторах и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Конфликт интересов
Автор J-HR работал в компании Biorchestra Co.
Остальные авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все претензии, выраженные в этой статье, принадлежат исключительно авторам и не обязательно относятся к их аффилированным организациям или заявлению издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или заявление, которое может быть сделано его производителем, не подлежат гарантии или одобрению со стороны издателя.
Благодарности
Мы приносим свои извинения нашим коллегам в этой области, чьи работы не могут быть процитированы из-за нехватки места.Благодарим всех членов корпорации Biorchestra за их комментарии и предложения.
Ссылки
3. Иулиано А.Д., Рогуски К.М., Чанг Х.Х., Мускателло Д.Д., Палекар Р., Темпиа С. и др. Оценки глобальной респираторной смертности, связанной с сезонным гриппом: модельное исследование. Ланцет (2018) 391 (10127): 1285–300. DOI: 10.1016 / S0140-6736 (17) 33293-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Сегалофф Х., Мелиду А., Адлхох С., Переяслов Д., Робесин Э., Пенттинен П. и др.Совместная циркуляция вирусов гриппа A (h2N1) pdm09 и гриппа A (h4N2), Европейский регион Всемирной организации здравоохранения (ВОЗ), октябрь 2018 г. — февраль 2019 г. евро Surveill (2019) 24 (9): 1
| -6 PubMed Аннотация | CrossRef Полный текст | Google Scholar 65. Бейер В.Е., Макэлхейни Дж., Смит Д.Д., Монто А.С., Нгуен-Ван-Там Дж.С., Остерхаус А.Д. Cochrane Re-Arranged: Поддержка политики вакцинации пожилых людей от гриппа. Вакцина (2013) 31 (50): 6030–3. doi: 10.1016 / j.vaccine.2013.09.063 PubMed Аннотация | CrossRef Полный текст | Google Scholar 66. Ohmit SE, Petrie JG, Malosh RE, Cowling BJ, Thompson MG, Shay DK, et al.Эффективность вакцины против гриппа в сообществе и домашнем хозяйстве. Clin Infect Dis (2013) 56 (10): 1363–9. doi: 10.1093 / cid / cit060 PubMed Аннотация | CrossRef Полный текст | Google Scholar 67. de Jong JC, Beyer WE, Palache AM, Rimmelzwaan GF, Osterhaus AD. Несоответствие между вакциной против гриппа 1997/1998 гг. И штаммом основного эпидемического вируса A (h4N2) как причина неадекватной реакции антител на этот штамм у пожилых людей, вызванной вакциной. J Med Virol (2000) 61 (1): 94–9.doi: 10.1002 / (SICI) 1096-9071 (200005) 61: 1 <94 :: AID-JMV15> 3.0.CO; 2-C PubMed Реферат | CrossRef Полный текст | Google Scholar 68. Flannery B, Kondor RJG, Chung JR, Gaglani M, Reis M, Zimmerman RK, et al. Распространение вирусов гриппа A (h4N2) с антигенным дрейфом и эффективность вакцины в США в сезоне 2018-2019 гг. J Infect Dis (2020) 221 (1): 8–15. doi: 10.1093 / infdis / jiz543 PubMed Аннотация | CrossRef Полный текст | Google Scholar 69.Кисслинг Э., Валенсиано М., Ларраури А., Ороси Б., Коэн Дж. М., Нуньес Б. и др. Низкая и снижающаяся эффективность вакцины против гриппа A (h4) в 2011/12 г. среди целевых групп вакцинации в Европе: результаты многоцентрового исследования «случай-контроль» I-MOVE. Euro Surveill (2013) 18 (5): 20390. doi: 10.2807 / ese.18.05.20390-en CrossRef Полный текст | Google Scholar 70. Кларк А., Поттер К. В., Дженнингс Р., Николл Дж. П., Лангрик А. Ф., Шилд Г. К. и др. Сравнение живых и инактивированных вакцин против вируса гриппа A (h2N1).2. Долгосрочный иммунитет. Дж. Хиг (Лондон) (1983) 90 (3): 361–70. doi: 10.1017 / s0022172400028990 PubMed Аннотация | CrossRef Полный текст | Google Scholar 71. DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al. Эффективность вакцины против гриппа в высокой дозе по сравнению со стандартной дозой у пожилых людей. N Engl J Med (2014) 371 (7): 635–45. doi: 10.1056 / NEJMoa1315727 PubMed Аннотация | CrossRef Полный текст | Google Scholar 72.О’Хаган Д.Т., Отт Г.С., Нест Г.В., Раппуоли Р., Джудис Г.Д. История адъюванта MF59 ( ® ): феникс, восставший из пепла. Expert Rev Vaccines (2013) 12 (1): 13–30. doi: 10.1586 / erv.12.140 PubMed Аннотация | CrossRef Полный текст | Google Scholar 75. Wei CJ, Crank MC, Shiver J, Graham BS, Mascola JR, Nabel GJ. Вакцины против гриппа нового поколения: возможности и проблемы. Nat Rev Drug Discovery (2020) 19 (4): 239–52. doi: 10.1038 / s41573-019-0056-x CrossRef Полный текст | Google Scholar 76.Кистнер О., Ховард М.К., Спрут М., Водал В., Брюль П., Геренсер М. и др. Клеточная культура (Vero), полученная из цельного вируса (H5N1), вакцина на основе штамма вируса дикого типа индуцирует перекрестные защитные иммунные ответы. Vaccine (2007) 25 (32): 6028–36. doi: 10.1016 / j.vaccine.2007.05.013 PubMed Реферат | CrossRef Полный текст | Google Scholar 78. Belshe RB, Frey SE, Graham IL, Anderson EL, Jackson LA, Spearman P, et al. Иммуногенность вакцины против птичьего гриппа A / Anhui / 01/2005 (H5N1) с адъювантом MF59: рандомизированное клиническое испытание. Джама (2014) 312 (14): 1420–8. doi: 10.1001 / jama.2014.12609 PubMed Аннотация | CrossRef Полный текст | Google Scholar 79. Маллиган М.Дж., Бернштейн Д.И., Винокур П., Рупп Р., Андерсон Е., Руфаэль Н. и др. Серологические ответы на вакцину против птичьего гриппа A / H7N9, смешанную в месте использования с адъювантом MF59: рандомизированное клиническое испытание. Джама (2014) 312 (14): 1409–19. doi: 10.1001 / jama.2014.12854 PubMed Аннотация | CrossRef Полный текст | Google Scholar 80.Фогель А.Б., Ламберт Л., Киннер Э., Буссе Д., Эрбар С., Рейтер К.С. и др. Самоусиливающиеся РНК-вакцины обеспечивают защиту от гриппа, эквивалентную мРНК-вакцинам, но в гораздо более низких дозах. Mol Ther (2018) 26 (2): 446–55. doi: 10.1016 / j.ymthe.2017.11.017 PubMed Аннотация | CrossRef Полный текст | Google Scholar 81. Берглунд П., Смерду С., Флитон М.Н., Тубулекас И., Лильестрем П. Повышение иммунного ответа с помощью суицидных ДНК-вакцин. Nat Biotechnol (1998) 16 (6): 562–5.doi: 10.1038 / nbt0698-562 PubMed Аннотация | CrossRef Полный текст | Google Scholar 82. Чжоу X, Берглунд П., Чжао Х., Лильестрем П., Йондал М. Генерация цитотоксических и гуморальных иммунных ответов нерепликативным рекомбинантным вирусом леса Семлики. Proc Natl Acad Sci USA (1995) 92 (7): 3009–13. doi: 10.1073 / pnas.92.7.3009 PubMed Аннотация | CrossRef Полный текст | Google Scholar 83. Fleeton MN, Chen M, Berglund P, Rhodes G, Parker SE, Murphy M, et al.Саморепликативные РНК-вакцины обеспечивают защиту от вируса гриппа А, респираторно-синцитиального вируса и вируса клещевого энцефалита. J Infect Dis (2001) 183 (9): 1395–8. doi: 10.1086 / 319857 PubMed Аннотация | CrossRef Полный текст | Google Scholar 84. Хекеле А., Бертолет С., Арчер Дж., Гибсон Д.Г., Палладино Дж., Брито Л.А. и др. Быстро производимая вакцина SAM ( ® ) против гриппа H7N9 является иммуногенной для мышей. Emerg Microbes Infect (2013) 2 (8): e52.doi: 10.1038 / emi.2013.54 PubMed Аннотация | CrossRef Полный текст | Google Scholar 85. Magini D, Giovani C, Mangiavacchi S, Maccari S, Cecchi R, Ulmer JB, et al. Самоусиливающиеся вакцины Mrna, экспрессирующие несколько консервативных антигенов гриппа, обеспечивают защиту от гомологичного и гетероподтипического вирусного заражения. PloS One (2016) 11 (8): e0161193. doi: 10.1371 / journal.pone.0161193 PubMed Аннотация | CrossRef Полный текст | Google Scholar 86.McCullough KC, Bassi I, Milona P, Suter R, Thomann-Harwood L, Englezou P, et al. Самореплицирующаяся доставка РНК репликона в дендритные клетки с помощью наночастиц хитозана для трансляции in vitro и in vivo. Мол тер нуклеиновых кислот (2014) 3 (7): e173. doi: 10.1038 / mtna.2014.24 PubMed Аннотация | CrossRef Полный текст | Google Scholar 87. Демулен Т., Милона П., Энглезу П.С., Эбенсен Т., Шульце К., Сутер Р. и др. Полиплексная доставка самореплицирующихся РНК-вакцин на основе полиэтиленимина. Наномедицина (2016) 12 (3): 711–22. doi: 10.1016 / j.nano.2015.11.001 PubMed Аннотация | CrossRef Полный текст | Google Scholar 88. Чахал Дж. С., Хан О. Ф., Купер С. Л., МакПартлан Дж. С., Цози Дж. К., Тилли Л. Д. и др. Наночастицы дендример-РНК создают защитный иммунитет против смертельной болезни Эбола, гриппа h2N1 и токсоплазмы Gondii с помощью одной дозы. Proc Natl Acad Sci USA (2016) 113 (35): E5250. doi: 10.1073 / pnas.16127 PubMed Аннотация | CrossRef Полный текст | Google Scholar 89.Мартинон Ф., Кришнан С., Лензен Дж., Магне Р., Гомар Э., Гийе Дж. Г. и др. Индукция вирус-специфических цитотоксических Т-лимфоцитов in vivo с помощью захваченной липосомами мРНК. Eur J Immunol (1993) 23 (7): 1719–22. doi: 10.1002 / eji.1830230749 PubMed Аннотация | CrossRef Полный текст | Google Scholar 90. Kallen KJ, Heidenreich R, Schnee M, Petsch B, Schlake T, Thess A, et al. Новая подрывная технология вакцинации: саморегулирующиеся R-активные ( ® ) вакцины. Hum Vaccin Immunother (2013) 9 (10): 2263–76.doi: 10.4161 / hv.25181 PubMed Аннотация | CrossRef Полный текст | Google Scholar 91. Kranz LM, Diken M, Haas H, Kreiter S, Loquai C, Reuter KC, et al. Системная доставка РНК к дендритным клеткам использует противовирусную защиту для иммунотерапии рака. Nature (2016) 534 (7607): 396–401. doi: 10.1038 / nature18300 PubMed Аннотация | CrossRef Полный текст | Google Scholar 92. Ablasser A, Poeck H, Anz D, Berger M, Schlee M, Kim S и др. Выбор молекулярной структуры и доставки олигонуклеотидов РНК для активации TLR7 по сравнению с TLR8 и для индукции высоких количеств IL-12p70 в первичных моноцитах человека. J Immunol (2009) 182 (11): 6824–33. doi: 10.4049 / jimmunol.0803001 PubMed Аннотация | CrossRef Полный текст | Google Scholar 94. Goubau D, Schlee M, Deddouche S, Pruijssers AJ, Zillinger T, Goldeck M, et al. Противовирусный иммунитет через опосредованное RIG-I распознавание РНК, несущей 5’-дифосфаты. Nature (2014) 514 (7522): 372–5. DOI: 10.1038 / nature13590 PubMed Аннотация | CrossRef Полный текст | Google Scholar 95. Карико К., Мурамацу Х., Людвиг Дж., Вайсман Д.Создание оптимальной мРНК для терапии: очистка с помощью ВЭЖХ устраняет активацию иммунной системы и улучшает трансляцию модифицированной нуклеозидами мРНК, кодирующей белок. Nucleic Acids Res (2011) 39 (21): e142. DOI: 10.1093 / nar / gkr695 PubMed Аннотация | CrossRef Полный текст | Google Scholar 98. Zhang Z, Ohto U, Shibata T., Krayukhina E, Taoka M, Yamauchi Y, et al. Структурный анализ показывает, что толл-подобный рецептор 7 является двойным рецептором для гуанозина и одноцепочечной РНК. Иммунитет (2016) 45 (4): 737–48. doi: 10.1016 / j.immuni.2016.09.011 PubMed Аннотация | CrossRef Полный текст | Google Scholar 99. Танджи Х., Ото У., Шибата Т., Таока М., Ямаути Й., Исобе Т. и др. Толл-подобный рецептор 8 воспринимает продукты деградации одноцепочечной РНК. Nat Struct Mol Biol (2015) 22 (2): 109–15. doi: 10.1038 / nsmb.2943 PubMed Аннотация | CrossRef Полный текст | Google Scholar 101. Шварц С., Бернштейн Д.А., Мумбах М.Р., Йованович М., Хербст Р.Х., Леон-Рикардо Б.Х. и др.Полнотранскриптомное картирование выявляет широко распространенное динамически регулируемое псевдоуридилирование нкРНК и мРНК. Ячейка (2014) 159 (1): 148–62. doi: 10.1016 / j.cell.2014.08.028 PubMed Аннотация | CrossRef Полный текст | Google Scholar 102. Карлайл Т.М., Рохас-Дюран М.Ф., Зинштейн Б., Шин Х., Бартоли К.М., Гилберт В.В. Профилирование псевдоуридина показывает регулируемое псевдоуридилирование Mrna в клетках дрожжей и человека. Nature (2014) 515 (7525): 143–6. DOI: 10.1038 / nature13802 PubMed Аннотация | CrossRef Полный текст | Google Scholar 103.Андрис О., Мак Кафферти С., Де Смедт С. К., Вайс Р., Сандерс Н. Н., Китада Т. Н. (1) мРНК, содержащая метилпсевдоуридин, превосходит мРНК, содержащую псевдоуридин, за счет обеспечения повышенной экспрессии белка и снижения иммуногенности в клеточных линиях млекопитающих и мышей. J Control Release (2015) 217: 337–44. doi: 10.1016 / j.jconrel.2015.08.051 PubMed Аннотация | CrossRef Полный текст | Google Scholar 104. Карико К., Бакштейн М., Ни Х, Вайсман Д. Подавление распознавания РНК толл-подобными рецепторами: влияние модификации нуклеозидов и эволюционное происхождение РНК. Иммунитет (2005) 23 (2): 165–75. doi: 10.1016 / j.immuni.2005.06.008 PubMed Аннотация | CrossRef Полный текст | Google Scholar 105. Панг И.К., Ичинохе Т., Ивасаки А. Передача сигналов IL-1r в дендритных клетках заменяет рецепторы распознавания образов в стимулировании Т-клеточного ответа CD8 + на вирус гриппа А. Nat Immunol (2013) 14 (3): 246–53. doi: 10.1038 / ni.2514 PubMed Аннотация | CrossRef Полный текст | Google Scholar 106. Бахл К., Сенн Дж. Дж., Южаков О., Булычев А., Брито Л. А., Хассет К. Дж. И др.Доклиническая и клиническая демонстрация иммуногенности мРНК вакцин против вирусов гриппа h20N8 и H7N9. Mol Ther (2017) 25 (6): 1316–27. doi: 10.1016 / j.ymthe.2017.03.035 PubMed Аннотация | CrossRef Полный текст | Google Scholar 107. Фельдман Р.А., Фур Р., Смоленов И., Мик Рибейро А., Пантера Л., Уотсон М. и др. Вакцины с мРНК против вирусов гриппа h20N8 и H7N9 с пандемическим потенциалом являются иммуногенными и хорошо переносятся здоровыми взрослыми в фазе 1 рандомизированных клинических испытаний. Vaccine (2019) 37 (25): 3326–34. doi: 10.1016 / j.vaccine.2019.04.074 PubMed Аннотация | CrossRef Полный текст | Google Scholar 108. Lutz J, Lazzaro S, Habbeddine M, Schmidt KE, Baumhof P, Mui BL, et al. Немодифицированная мРНК в LNP представляет собой конкурентную технологию для профилактических вакцин. Вакцины NPJ (2017) 2:29. DOI: 10.1038 / s41541-017-0032-6 PubMed Аннотация | CrossRef Полный текст | Google Scholar 111. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al.Безопасность и эффективность вакцины мРНК Covid-19 BNT162b2. N Engl J Med (2020) 383 (27): 2603–15. doi: 10.1056 / NEJMoa2034577 PubMed Аннотация | CrossRef Полный текст | Google Scholar 112. Баден Л. Р., Эль Сахли Х. М., Эссинк Б., Котлофф К., Фрей С., Новак Р. и др. Эффективность и безопасность вакцины mRNA-1273 SARS-CoV-2. N Engl J Med (2021) 384 (5): 403–16. doi: 10.1056 / NEJMoa2035389 PubMed Аннотация | CrossRef Полный текст | Google Scholar 114.Хименес-Родригес Т.В., Гарсия-Нойер М., Аленази Л.А., Кастельс М. Анафилаксия в 21 веке: фенотипы, эндотипы и биомаркеры. J Asthma Allergy (2018) 11: 121–42. doi: 10.2147 / JAA.S159411 PubMed Аннотация | CrossRef Полный текст | Google Scholar 115. Jönsson F, de Chaisemartin L, Granger V, Gouel-Chéron A, Gillis CM, Zhu Q, et al. Индуцированный IgG путь активации нейтрофилов способствует анафилаксии, индуцированной лекарствами. Sci Transl Med (2019) 11 (500): eaat1479.doi: 10.1126 / scitranslmed.aat1479 PubMed Аннотация | CrossRef Полный текст | Google Scholar 116. Бальбино Б., Эрвиу П., Годон О., Стакович Дж., Гофф О.Р., Ианнасколи Б. и др. Омализумаб mAb против IgE вызывает побочные реакции за счет взаимодействия с рецепторами Fcγ. J Clin Invest (2020) 130 (3): 1330–5. doi: 10.1172 / JCI129697 PubMed Аннотация | CrossRef Полный текст | Google Scholar 117. Beutier H, Hechler B, Godon O, Wang Y, Gillis CM, de Chaisemartin L, et al.Тромбоциты, экспрессирующие рецептор IgG Fcγriia / CD32A, определяют тяжесть экспериментальной анафилаксии. Sci Immunol (2018) 3 (22): eaan5997. doi: 10.1126 / sciimmunol.aan5997 PubMed Аннотация | CrossRef Полный текст | Google Scholar 118. Карки Р., Шарма Б. Р., Туладхар С., Уильямс Е. П., Залдуондо Л., Самир П. и др. Синергизм TNF-α и IFN-γ вызывает гибель воспалительных клеток, повреждение тканей и смертность при синдроме SARS-CoV-2 и цитокинового шока. Ячейка (2021) 184 (1): 149–68.e17. doi: 10.1016 / j.cell.2020.11.025 PubMed Аннотация | CrossRef Полный текст | Google Scholar 119. Lee S, Channappanavar R, Kanneganti TD. Коронавирусы: врожденный иммунитет, активация инфламмасом, гибель воспалительных клеток и цитокины. Trends Immunol (2020) 41 (12): 1083–99. doi: 10.1016 / j.it.2020.10.005 PubMed Аннотация | CrossRef Полный текст | Google Scholar 120. Томпсон М.Г., Берджесс Дж.Л., Нейлевэй А.Л., Тайнер Х., Юн С.К., Мис Дж. И др. Профилактика и ослабление Covid-19 с помощью вакцин BNT162b2 и мРНК-1273. N Engl J Med (2021) 385: 320–9. doi: 10.1056 / NEJMoa2107058 PubMed Аннотация | CrossRef Полный текст | Google Scholar Почему недолговечный иммунитет к вакцине против гриппаМногие детские вакцины действуют годами, если не десятилетиями. Несмотря на надежды на универсальную вакцину против гриппа, вакцина против вируса гриппа (гриппа) остается сезонной, и в начале каждого сезона гриппа требуется делать новую прививку. Есть несколько причин для необходимости прививки от сезонного гриппа.Один из них заключается в структуре генома вируса из восьми сегментов РНК. Части РНК склонны к обмену, когда в клетку проникает более одного вируса. При этом антигенные сдвиги создают, казалось бы, постоянно меняющиеся штаммы, которым требуются новые вакцины, адаптированные для борьбы с ними. Другая проблема заключается в недолговечном иммунитете, создаваемом вакциной. Новое исследование, проведенное командой из Центра вакцин Эмори, дает представление о том, почему иммунитет вакцины против гриппа короче, чем у других вакцин.Результаты опубликованы в статье «Вызванное вакциной против гриппа плазматические клетки костного мозга человека уменьшаются в течение года после вакцинации» в журнале Science . Базой иммунных клеток, вырабатывающих антитела, является костный мозг. Поскольку долгосрочные уровни антител в сыворотке поддерживаются плазматическими клетками костного мозга (BMPC), исследователи исследовали производство и поддержание этих клеток после вакцинации против гриппа. Сезонная вакцинация против гриппа действительно увеличивает количество продуцирующих антитела клеток, специфичных для гриппа, в костном мозге.Однако, как выяснили исследователи, большая часть вновь сгенерированных клеток теряется в течение одного года. В большинстве исследований вакцин берутся образцы крови участников, в которых в течение нескольких недель после вакцинации можно обнаружить продуцирующие антитела клетки. Исследователи во главе с директором Центра вакцин Эмори Рафи Ахмедом, доктором философии, предприняли дополнительный шаг, взяв образцы костного мозга (проводившиеся в 2009–2018 годах), что является более инвазивной процедурой. В этом исследовании 53 здоровых добровольца согласились предоставить костный мозг до вакцинации от сезонного гриппа, а затем через месяц после вакцинации, с последующим наблюдением за некоторыми примерно через год.Вакцинация увеличила долю гриппоспецифических клеток (в среднем с 0,8% до 1,9%) через месяц. Однако контрольный визит несколько месяцев спустя показал, что число снизилось до исходного уровня. Это снижение, как писали авторы, «было вызвано потерей BMPC, вызванной вакциной, в то время как ранее существовавшие BMPC сохранялись». У большинства людей уже есть плазматические клетки, специфичные для гриппа: тип иммунных клеток, которые секретируют большое количество антител. Таким образом, исследователям Эмори нужно было различать антитела, вырабатываемые уже существующими клетками, и антителами, выработка которых стимулировалась штаммами, присутствующими в сезонной вакцине. Поиск новых вакцин-специфических секретирующих антитела клеток требовал анализа как ДНК клеток, так и исследования вырабатываемых ими антител, а затем отслеживания численности этих клеток как в крови, так и в костном мозге. Для большинства вновь образованных клонов плазматических клеток от 70 до 99% клеток были потеряны через год. «Мы смогли проследить конкретные клетки, продуцируемые вакциной, потому что они продуцировали уникальные антитела, которые можно идентифицировать с помощью методов секвенирования», — сказал Карл Дэвис, доктор философии, первый автор статьи и научный сотрудник лаборатории Ахмеда. «Мы могли видеть, что эти новые антитела увеличивались в костном мозге через месяц после вакцинации, а затем сокращались через год. С другой стороны, антитела против гриппа, которые были в костном мозге до введения вакцины, оставались на постоянном уровне в течение одного года ». «Это показывает, что просто добраться до костного мозга недостаточно», — сказал Ахмед. «Плазматическая клетка должна найти нишу в костном мозге, закрепиться и претерпеть изменения экспрессии генов и метаболизма, способствующие долголетию.” Хорошая новость, особенно для людей, участвующих в исследованиях вакцин, заключается в том, что уровни секретирующих антитела клеток в крови коррелируют с долгосрочным ответом в костном мозге. Таким образом, исследователи вакцин могут продолжать отслеживать иммунные реакции, ища секретирующие антитела клетки в крови. Кроме того, можно ожидать, что добавки к вакцинам, называемые адъювантами, увеличат долгосрочное возвращение в костный мозг клеток, секретирующих антитела, сказал Ахмед. Стандартные инактивированные вакцины против гриппа не содержат адъювантов. Адъюванты также способствуют образованию зародышевых центров, структур в лимфатических узлах, где образуются плазматические клетки, продуцирующие высокоаффинные антитела. |


 Вакцинируют детей с трех лет, подростков и взрослых
Вакцинируют детей с трех лет, подростков и взрослых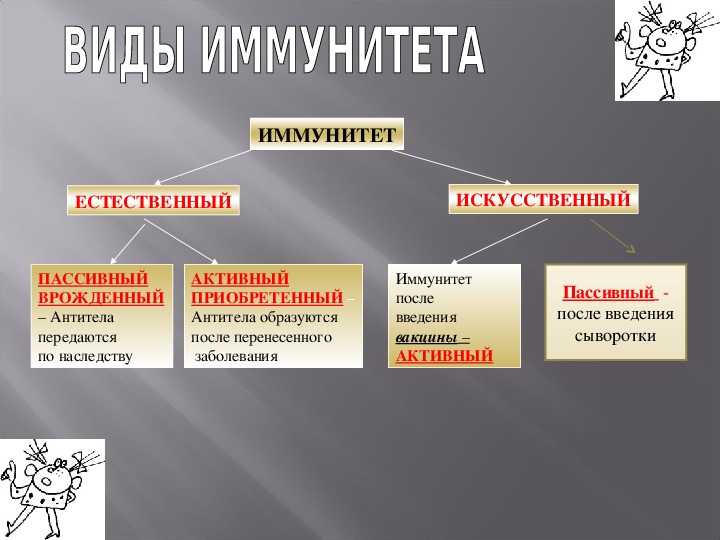
 Беременным вакцину не рекомендуют из-за высокого процента осложнений
Беременным вакцину не рекомендуют из-за высокого процента осложнений Отличительная особенность – хорошая переносимость, свободна от консервантов, обеспечивает стойкий иммунитет
Отличительная особенность – хорошая переносимость, свободна от консервантов, обеспечивает стойкий иммунитет
 Она стала директором по медицинским исследованиям новой компании, которая сосредоточилась на индивидуализированных иммунотерапиях рака и других тяжелых заболеваний.
Она стала директором по медицинским исследованиям новой компании, которая сосредоточилась на индивидуализированных иммунотерапиях рака и других тяжелых заболеваний.

 На снимке: прибытие партии вакцин в Италию.
На снимке: прибытие партии вакцин в Италию. — Вы создали вакцину для всего человечества».
— Вы создали вакцину для всего человечества».