Гормон амг за что отвечает у женщин: Антимюллеров гормон (АМГ) | Сдача анализов. Диагностика
НОВИНКА!!! Антимюллеров гормон (или ингибирующее вещество Мюллера) – один из основных показателей репродуктивной функции у мужчин и женщин!
Антимюллеров гормон (АМГ), другие названия — антимюллеровская субстанция, антимюллеровый фактор или ингибирующее вещество Мюллера — один из последних и наиболее важных маркеров репродуктивной системы женщины и мужчины.
Какова роль данной субстанции в организме женщины?
Немецким анатомом Йохан Мюллером описан эмбриональный проток, предшественник матки, маточных труб и верхней трети влагалища – Мюллеров проток. Первые признаки продукции АМГ в яичниках девочки появляются в пренатальный период (32 – 36 недель беременности), и уровень его в крови медленно повышается с возрастом. Максимальный уровень АМГ достигается к расцвету репродуктивной функции женщины в 20 – 30 лет, в дальнейшем постепенно снижается, и к менопаузе равняется нулю. АМГ является важнейшим показателем старения женской репродуктивной системы.
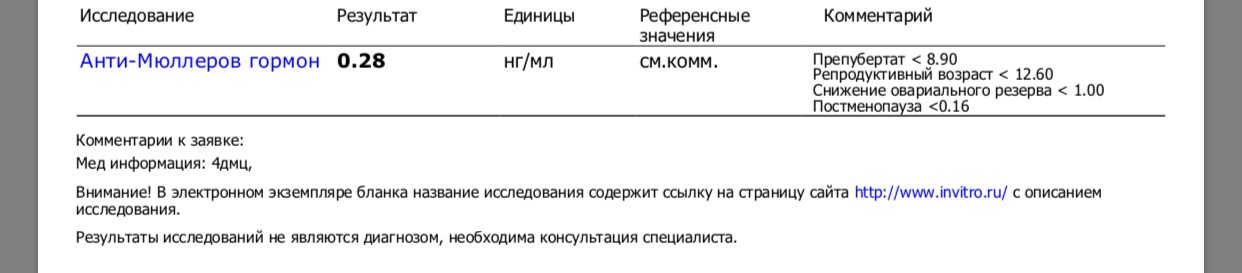
АМГ – маркер: Овариального резерва. Овариального старения. Овариальной дисфункции. Овариального ответа
Овариального старения. Овариальной дисфункции. Овариального ответа
В протоколах IVF(ЭКО) у женщин старшего репродуктивного возраста успех наступления беременности тем выше, чем выше уровень AMГ. При синдроме поликистозных яичников (СПКЯ) уровень AMГ выше, чем у нормально овулирующих женщин.
В онкологической практике определение АМГ имеет значение при диагностике гранулёзоклеточных опухолей яичников, поскольку при этом происходит значительное повышение его концентрации.
Какова роль данной субстанции в организме мужчины?
В процессе эмбрионального развития он секретируется клетками Cертоли и отвечает за регрессию Мюллеровых протоков у мужчин. До наступления половой зрелости АМН продуцируется яичками, а затем его уровень постепенно снижается до остаточных постпубертатных значений. Нарушение функции антимюллерова гормона вызывает у мужчин сохранение дериватов мюллеровых протоков. Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП).
В каких случаях рекомендуется определять уровень Антимюллеров гормона или ингибирующего вещества Мюллера?
• Бесплодие неясного генеза.
• Оценка мужской половой функции в любом возрасте.
• Исследование овариального резерва и пременопаузальных изменений у женщин.
• Выявление преждевременного или замедленного полового созревания.
• Постановка диагноза крипторхизма и анорхизма.
• Диагностика и контроль гранулёзоклеточного рака яичника.
• Неудачные попытки ЭКО, недостаточный ответ на стимуляцию.
• Установление пола в сомнительных случаях.
• Пограничные или повышенные значения ФСГ.
• При аутотрансплантации ткани яичника.
• При химиотерапии как маркер овариальной функции.
• При оценке эффективности антиандрогенной терапии.
Используя самые современные методы лабораторной и инструментальной диагностики, коллектив «Медицинского Центра Здоровья» готов прийти на помощь каждому, кто оказался в сложной ситуации.
С заботой о Вашем здоровье,
врач-терапевт, кардиолог Бичева Анна Юрьевна.
Анти-Мюллеров гормон (АМГ) — Общество. Здравоохранение. НИА Самара, 18.07.2018
Анти-Мюллеров гормон синтезируется как в женском, так и в мужском организме. Он принимает участие в формировании и росте тканей. Особенно велика его роль в созревании и функционировании репродуктивной системы организма. Данный тест направлен на определение уровня АМГ в венозной крови
Показания к исследованию:
- необходимость установления причин бесплодия;
- высокий уровень ФСГ;
- неудачное ЭКО;
- симптомы новообразований яичников;
- мониторинг эффективности лечения;
- преждевременное половое созревание или его задержка.

Общие сведения
У мужчин MIS отвечает за формирование половых органов. Он продуцируется в значительных количествах до начала полового созревания, а в дальнейшем уровень снижается. Как правило, при нарушениях выработки АМГ женщина не может забеременеть. Уровень гормона позволяет оценить функциональный резерв яичников. Поэтому данный тест назначается при диагностике бесплодия, его лечении, в процессе подготовки к ЭКО. Недостаточное количество гормона указывает на проблемы с наступлением беременности. Также снижение его концентрации характерно для менопаузы. Низкие показатели могут наблюдаться при ожирении, дисфункции яичников, слишком раннем половом созревании. Независимо от причин такое состояние нуждается в коррекции, так как в противном случае репродуктивная функция может быть утрачена. Повышение уровня гормона позволяет врачу заподозрить новообразования яичников, поликистоз, бесплодие, задержку полового созревания и другие патологии.
Для получения точных результатов в ходе данного теста важно в точности соблюдать рекомендации по подготовке к сдаче биоматериала. Как правило, женщины сдают кровь на третий день менструального цикла, но лечащий врач может дать и другие рекомендации. За 3 дня до сдачи биоматериала рекомендуется исключить эмоциональное перенапряжение, снизить физические нагрузки. В остром периоде заболеваний, в том числе и респираторных, сдавать биоматериал для этого исследования нельзя. За час до сдачи крови необходимо отказаться от курения.
Как правило, женщины сдают кровь на третий день менструального цикла, но лечащий врач может дать и другие рекомендации. За 3 дня до сдачи биоматериала рекомендуется исключить эмоциональное перенапряжение, снизить физические нагрузки. В остром периоде заболеваний, в том числе и респираторных, сдавать биоматериал для этого исследования нельзя. За час до сдачи крови необходимо отказаться от курения.
Правильно оценить результаты теста на ингибирующее вещество Мюллера может только врач. В ряде случаев для установления диагноза требуется дополнительное обследование. Современная медицина в большинстве случаев успешно корректирует гормональные проблемы. Главное, пройти необходимо обследование для установления точного диагноза и следовать всем рекомендациям врача.
Определить паратиреоидный гормон повышен или нет можно в медицинском офисе Лабквест.
норма гормона АМГ, расшифровка результатов
Что такое антимюллеров гормон?
Антимюллеров гормон (АМГ, AMH, MIS, ингибирующее вещество Мюллера) — это биологически активное вещество, которое регулирует репродуктивную функцию, а также играет важную роль в эмбриональном периоде и во время полового созревания человека.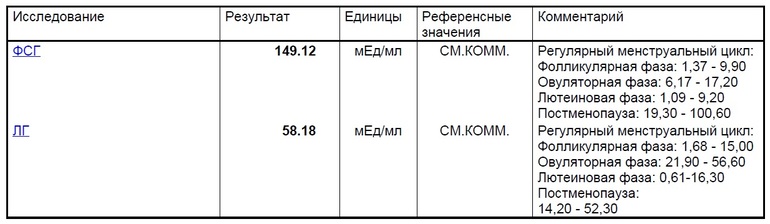
АМГ вырабатывается клетками Сертоли яичка у мужчин и зернистыми клетками яичников у женщин в третьем триместре беременности.
У мужчин наивысшая концентрация АМГ наблюдается во время внутриутробного развития, поскольку он регулирует формирование мужских половых органов. Далее концентрация постепенно падает. У женщин гормон сохраняется в крови от момента рождения вплоть до наступления менопаузы. Максимальный уровень АМГ наблюдается в 20-30 лет, затем его количество начинает снижаться, а после менопаузы выработка этого гормона прекращается.
Что такое Мюллеров проток?
Изначально Мюллеров проток образуется у зародышей обоих полов. Однако у эмбрионов мужского пола он угнетается под действием определенного активного вещества, который и получил название антимюллерова гормона или ингибирующего вещества Мюллера¹.
Однако у эмбрионов мужского пола он угнетается под действием определенного активного вещества, который и получил название антимюллерова гормона или ингибирующего вещества Мюллера¹.
Роль антимюллерова гормона у взрослых
В женском организме антимюллеров гормон отвечает за созревание фолликулов, их отбор для овуляции и чувствительность к фолликулостимулирующему гормону (ФСГ). Таким образом его активность обеспечивает созревание и овуляцию одного из фолликулов яичника во время каждого менструального цикла. А поскольку уровень АМГ в крови напрямую зависит от количества дозревающих фолликулов, он является отличным маркером функционального резерва яичника и возможности зачатия ребенка.
В организме взрослого мужчины АМГ регулирует выработку мужских половых гормонов – андрогенов. При этом он считается более точным методом дифференциации между вариантами азооспермии (отсутствия сперматозоидов в эякуляте), чем ФСГ.
Рисунок 1. Овариальный резерв яичников. График: Wikipedia (Public Domain)Показания к проведению теста на антимюллеров гормон
Измерение уровня антимюллерова гормона проводится во время планирования беременности, а также при патологиях полового развития. Чаще всего этот анализ назначается педиатрами, эндокринологами, урологами, гинекологами и генетиками.
Чаще всего этот анализ назначается педиатрами, эндокринологами, урологами, гинекологами и генетиками.
Основными показаниями к тесту являются²:
- Оценка функционального резерва яичников, что дает возможность определить фертильность женщины и прогнозировать сроки перехода в менопаузу.
- Определение реакции организма на стимуляцию овуляции при экстракорпоральном оплодотворении (ЭКО) и во время лечения женского бесплодия. Также анализ используется при неудачных попытках ЭКО в анамнезе.
- Подозрение на развитие опухолей яичников и яичек, злокачественных новообразований клеток Сертоли, контроль эффективности проводимой терапии.
- Диагностика синдрома персистирующего Мюллерова протока, а также дифференциация крипторхизма и анорхии.
- Поиск причин нарушений половой дифференциации (гермафродитизма) и мужского бесплодия.
- Наличие признаков высокого уровня эстрогенов у женщин (проявляется маточными кровотечениями) и у мужчин (сопровождается гинекомастией).

Подготовка к сдаче анализа
Измерение уровня АМГ проводиться путем иммунохемилюминесцентного анализа. В качестве биологического материала для исследования используется венозная кровь пациента.
Сдать анализ на АМГ можно в любой день менструального цикла. Фото: kukuruzaphoto / freepik.comКак правило, специфической подготовки к анализу не требуется – она предусматривает базовые правила и требования, которые используются для большинства методов лабораторной диагностики. К ним относятся:
- Исключение приема пищи как минимум за 8 часов до забора крови.
- Избежание переедания, употребления алкоголя накануне сдачи теста. Также рекомендуется воздержаться от употребления жирной, жареной пищи.
- Отказ от курения как минимум за 60 минут до анализа.
- Ограничение интенсивной физической активности, стрессов и эмоциональных нагрузок за день до исследования.
- Прекращение приема гормональных препаратов за 48 часов до проведения теста.

Нормы у мужчин и женщин
Уровень антимюллерова гормона венозной крови измеряется в нанограммах на миллилитр (Нг/мл). Нормальные значения зависят от целого ряда параметров – возраста для взрослого человека или стадии полового созревания по Таннеру для детей (рис. 2), аппаратуры и реактивов, которые применяются в конкретной лаборатории.
Рисунок 2. Шкала полового созревания Таннера. Изображение: M.Komorniczak, polish wikipedist / Wikipedia (CC BY-SA 3.0)Усредненные значения нормальной концентрации гормона в крови для женщин – 1,0-2,5 нг/мл, для мужчин – 0,49-5,98 нг/мл³. Более точные данные приведены в таблице 1. В большинстве случаев значение нормы указывается на бланке, рядом с полученным результатом.
| Пол | Возраст (лет) / стадия по Таннеру | Референсные значения, нг/мл |
| Мужской | ≤ 60 дней | 15,11 — 266,59 |
| 1 стадия | 4,95 — 144,48 | |
| 2 стадия | 5,02 — 140,06 | |
| 3 стадия | 2,61 — 75,9 | |
| 4 стадия | 0,43 — 20,14 | |
| 5 стадия | 1,95 — 21,2 | |
| > 18 | 0,73 — 16,05 | |
| Женский | ≤ 60 дней | < 3,39 |
| 18-26 | 0,96 — 13,34 | |
| 26-31 | 0,17 — 7,37 | |
| 31-36 | 0,07 — 7,35 | |
| 36-41 | 0,03 — 7,15 | |
| 41-46 | 0 — 3,27 | |
| > 46 | 0 — 1,15 |
Что может повлиять на результат?
Фаза менструального цикла не искажает значение анализа, поэтому проходить это исследование можно в любой период. Однако повлиять на полученные данные может прием гормональных контрацептивов. Поэтому важно проконсультироваться с врачом по этому поводу и, при возможности, предварительно прервать терапию.
Однако повлиять на полученные данные может прием гормональных контрацептивов. Поэтому важно проконсультироваться с врачом по этому поводу и, при возможности, предварительно прервать терапию.
Также повлиять на показатели АМГ в крови могут следующие факторы:
- Избыточный вес и ожирение.
- Нарушение толерантности к глюкозе и сахарный диабет.
- Дефицит или повышенный уровень витамина D в крови.
- Расовая принадлежность.
- Сильные физические и психоэмоциональные нагрузки
Причины повышенного АМГ
К основным причинам повышенного уровня антимюллерового гормона в крови у мужчин относятся:
- Задержка полового развития.
- Гормональная терапия антиандрогенными препаратами.
- Дефекты синтеза андрогенов.
- Резистентность (невосприимчивость) к андрогенам.
- Рак яичек.
- Крипторхизм.
У женщин высокий уровень АМГ может свидетельствовать о следующих патологиях:
- Гормональное бесплодие.

- Злокачественные, гормонально-активные опухоли яичников.
- Синдром поликистозных яичников (СПКЯ).
Причины пониженного АМГ
Снижение уровня АМГ в крови у мужчин может быть обусловлено следующими патологическими изменениями:
- В подростковом возрасте – преждевременное половое созревание.
- Чрезмерный уровень мужских половых гормонов.
- Анорхизм – аномалия развития, проявляющаяся полным отсутствием яичек.
- Необструктивная азооспермия – заболевание, приводящее к отсутствию сперматозоидов из-за нарушения их синтеза в яичках.
- Синдром персистирующего Мюллерова протока – генетическое заболевание, при котором у мужчины могут формироваться матка, маточные трубы и влагалищный отросток урогенитального синуса.
У женщин дефицит антимюллерова гормона зачастую связан со следующими изменения в организме:
- Избыточный вес и ожирение.
- Низкий функциональный резерв яичников, скорое наступление менопаузы.

- Яичниковая недостаточность, в том числе – после химиотерапии или лучевой терапии рака женских половых органов, оперативных вмешательств на них.
- Менопауза. При этом уровень АМГ может достигать нуля¹.
Влияние на беременность
АМГ часто используется для определения фертильности женщины – ее возможности забеременеть. При этом низкие показатели свидетельствуют о снижении функционального резерва яичников и невысокой вероятности наступления беременности.
При уровне антимюллерова гормона ниже 1 нг/мл возможность забеременеть еще сохраняется. Критическим значением считается 0,2 нг/мл, при котором вероятность забеременеть самостоятельно практически отсутствует. Но даже при низких показателях АМГ возможно успешное зачатие ребенка при помощи ЭКО.
В промежутке 0,2-1 нг/мл дополнительно проводится измерение уровня фолликулостимулирующего гормона, поскольку при его низких значениях вероятность беременности сохраняется.
Низкий уровень АМГ говорит о невысоких шансах наступления естественной беременности. Фото: psodaz / freepik.com
Фото: psodaz / freepik.comМетоды коррекции уровня антимюллерова гормона
При выявлении отклонений от нормы проводится обследование человека с целью поиска наиболее вероятных заболеваний и нарушений, которые могут повлиять на уровень АМГ в крови.
Если колебания его уровня связаны с сопутствующими заболеваниями, их лечение может нормализовать уровень гормона в крови. Например, повышение уровня АМГ, обусловленное гормон-продуцирующими опухолями яичников или яичек, корригируется путем удаления новообразования. Однако при проведении химиотерапии возможно поражение желез, которое приведет к смещению показателей в другую сторону.
При низком уровне антимюллерова гормона и бесплодии его коррекция также малоэффективна, поскольку эти изменения означают истощение яичников. Однако в некоторых случаях при снижении АМГ может использоваться заместительная гормональная терапия для отсрочки начала менопаузы и сохранения репродуктивной функции.
На данный момент известно только несколько веществ, которые могут повысить уровень АМГ.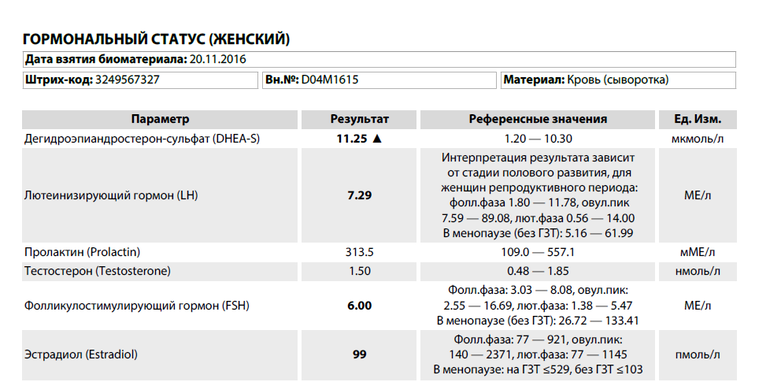 К ним относятся¹:
К ним относятся¹:
- Витамин D3. Стимулирует выработку ингибирующего вещества Мюллера гранулезными клетками.
- Дегидроэпиандростерон (ДГЭА). Повышает уровень АМГ путем увеличения количества фолликулов, а также стимуляции выработки непосредственно самого гормона.
Заключение
Антимюллеров гормон является важным лабораторным показателем в разных областях медицины, в первую очередь – в репродуктологии и онкологии. Его отклонения от нормы зачастую свидетельствуют о серьезных нарушениях организма – от истощения яичников и невозможности самостоятельно зачать ребенка до развития рака. Таким образом измерение уровня АМГ позволяет провести своевременную диагностику заболеваний репродуктивной системы, вовремя начать необходимое лечение и избежать развития осложнений.
Источники
- Скриганюк, Анна Андреевна, and Алла Николаевна Харламова. «Антимюллеров гормон.» Universum: медицина и фармакология 1 (56) (2019).
- Булавенко, O.
 В. «Антимюллеров гормон как маркер репродуктивной системы женщины.» Reproductive Endocrinology 1 (2011): 27-29.
В. «Антимюллеров гормон как маркер репродуктивной системы женщины.» Reproductive Endocrinology 1 (2011): 27-29. - Довбнюк, А. В. «Антимюллеров гормон.» (2019).
Бесплодие – Диагностика женщины | INVICTA
Фертильность и возраст женщиныСамым существенным отдельным фактором, влияющим на фертильность женщины, является возраст. В организме женщины на протяжении жизни происходят изменения, которые сокращают ее шансы на оплодотворение. Постепенно снижается количество фолликулов, оставшиеся стареют, увеличивается процент анеуплоидий (нарушений числа хромосом), что приводит к снижению шанса на оплодотворение и ростом риска потери беременности.
ОЦЕНКА ЯИЧНИКОВОГО ЗАПАСА– ключевой элемент диагностики бесплодия
Генеративный потенциал женщины определяется на основании оценки ее яичникового запаса. Каждая женщина обладает определенным числом первичных фолликулов, часть которых расходуется в каждом цикле. Овариальный резерв зависит от числа оставшихся в яичнике первичных фолликулов. Это они могут превратиться в зрелую яйцеклетку.
Каждая женщина обладает определенным числом первичных фолликулов, часть которых расходуется в каждом цикле. Овариальный резерв зависит от числа оставшихся в яичнике первичных фолликулов. Это они могут превратиться в зрелую яйцеклетку.
Цель оценки овариального (яичникового) резерва:
- выявление молодых пациенток с пониженным яичниковым резервом – ускоренное лечение
- выявление пациенток среднего возраста, у которых все еще есть полноценные яйцеклетки – определение дальнейшего клинического ведения
- исключение пациенток, которые не имеют шансов на получение беременности (стоимость лечения, обременительность терапии)
AMH (антимюллеров гормон, АМГ, англ. Anti-Müllerian Hormone)
AMH (англ. Anti-Müllerian Hormone) является гормоном, вырабатываемым как у женщин, так и у мужчин. У женщин AMH вырабатывается в фолликулах в яичнике клетками, окружающими яйцеклетки, готовые к росту. Уровень AMH не обусловлен менструальным циклом женщины, поэтому его можно определять в произвольный день цикла. Его уровень уменьшается с возрастом женщины, в связи с чем он является очень хорошим маркером снижения фертильности, в том числе преждевременного угасания функции яичников. У пациенток с СПЯ (PCO, синдром поликистозных яичников) уровень AMH значительно повышен.
Уровень AMH не обусловлен менструальным циклом женщины, поэтому его можно определять в произвольный день цикла. Его уровень уменьшается с возрастом женщины, в связи с чем он является очень хорошим маркером снижения фертильности, в том числе преждевременного угасания функции яичников. У пациенток с СПЯ (PCO, синдром поликистозных яичников) уровень AMH значительно повышен.
ИНГИБИН B (INHIBIN B)
ИНГИБИН B используется для оценки овариального резерва. Ингибин B вырабатывается зернистыми клетками ранних антральных фолликулов. Это вещество выделяется главным образом во время фолликулярной фазы менструального цикла. Его концентрация в ранней фолликулярной фазе отражает число и качество фолликулов. Существует положительное соотношение между концентрациями ингибина B и количеством антральных фолликулов, оцениваемых в ультразвуковом обследовании в первых днях менструального цикла.
AFC
Другим важным анализом являтся AFC (оценка количества антральных фолликулов). В этом случае дополнительную информацию о яичниковом резерве дает ультразвуковое обследование. При помощи УЗИ можно оценить эндометрий и структуру яичника, число антральных фолликулов (пузырьков с размерами 2-6 мм) и рост пузырька у пациенток с нарушениями овуляции или прошедших отбор для лечения методами вспомогательной репродукции.
В этом случае дополнительную информацию о яичниковом резерве дает ультразвуковое обследование. При помощи УЗИ можно оценить эндометрий и структуру яичника, число антральных фолликулов (пузырьков с размерами 2-6 мм) и рост пузырька у пациенток с нарушениями овуляции или прошедших отбор для лечения методами вспомогательной репродукции.
Лабораторные анализы, если выполнены и интерпретированы правильно, представляют собой значимый диагностический инструмент. Основная диагностическая панель INVICTA включает у женщин набор 12 лабораторных анализов.
АМГ: контроль за беременностью и яичками
Анализ крови на АМГ помогает оценить способность женщины в репродуктивном возрасте забеременеть. Его уровень отражает резерв яичников женщины — количество яйцеклеток, которые потенциально могут быть оплодотворены. Чем больше яйцеклеток, тем выше АМГ. С возрастом резерв сокращается, уровень АМГ падает и зачать ребенка становится сложнее.
С возрастом резерв сокращается, уровень АМГ падает и зачать ребенка становится сложнее.
Женщинам старшего возраста анализ на АМГ могут назначить для фиксации наступления менопаузы — его уровень резко снижается, а после почти не обнаруживается. Хотя Американский колледж акушерства и гинекологии советует не злоупотреблять этим тестом и не использовать его для предсказания ее наступления в будущем.
Тем, кто проходит ЭКО, анализ на АМГ помогает оценить шансы на успех процедуры. Но за зачатие отвечает не только он, так что низкий уровень АМГ не повод опускать руки. Международного стандарта измерения его уровня нет, как и точных пороговых значений. Uptodate предлагает ориентироваться на такие цифры:
- АМГ больше 1,5 нг/мл, но меньше 3,5 нг/мл свидетельствует о хорошем ответе на стимуляцию яичников при ЭКО.
- Больше 3,5 нг/мл — есть риск гиперстимуляции, поэтому процедуру нужно проводить с осторожностью.

- Меньше 1,5 нг/мл — число яйцеклеток при стимуляции будет ограничено.
- Меньше 0,5 нг/мл — получится меньше трех яйцеклеток для цикла ЭКО.
Высокий уровень АМГ может указывать на синдром поликистозных яичников (СПКЯ). Среди его симптомов нерегулярные месячные, избыток волос на теле и потеря их на голове, набор веса, жирная кожа, трудности с зачатием. Однако по-прежнему одного анализа недостаточно для диагноза.
АМГ повышается при некоторых доброкачественных и раковых опухолях. Если новообразование вырабатывает этот гормон, то тест на его уровень используют в качестве маркера эффективного лечения или рецидива.
Низкий АМГ у новорожденного мальчика может сигнализировать о генетическом заболевании, при котором у ребенка не формируются или не работают яички.
Антимюллеров гормон в репродуктологии | IPF
Антимюллеров гормон (antiMullerian hormone)один из ключевых гормонов в сфере репродуктологии.
Этот белок может присутствовать в организме женщины и мужчины и играет решающую роль при половой дифференциации во время внутриутробного развития.
Если семейная пара столкнулась с проблемой зачатия ребенка, то врач — репродуктолог рекомендует гормональное обследование. Одним из основных гормонов является АМГ (антимюллеров гормон)
Каково значение Антимюллерового гормона?
Материалом для образования фаллопиевых труб, матки и влагалища служат мюллеровы протоки, которые закладываются на четвертой неделе эмбрионального развития. У мужчин под влиянием АМГ происходит регресс мюллеровых ходов. За секрецию АМГ отвечают клетки Сертоли, начиная с 7 недели эмбрионального развития. Именно поэтому этот гормон активно вырабатывается до момента полового созревания, а после наступления половой зрелости уровень АМГ постепенно падает.
У женщин содержание этого гормона значительно меньше в крови. Антимюллеров гормон вырабатывается тканью яичников, и значительное его снижение наблюдается в период менопаузы.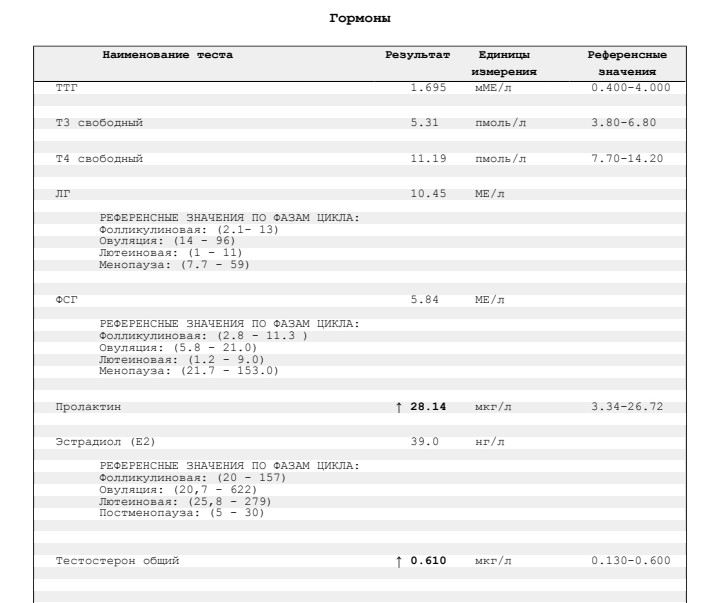 Снижение антилюллерова гормона можно наблюдать при снижении овариального (яичникового) резерва. АМГ является своего рода маркером, по которому можно предположить о количестве яйцеклеток способных к зачатию или даже ориентировочное время предполагаемой менопаузы.
Снижение антилюллерова гормона можно наблюдать при снижении овариального (яичникового) резерва. АМГ является своего рода маркером, по которому можно предположить о количестве яйцеклеток способных к зачатию или даже ориентировочное время предполагаемой менопаузы.
Какие условия необходимы для определения АМГ?
Уровень АМГ определяют в венозной крови. Анализ сдают утром натощак, желательно через час – два после сна, на 2-5 день менструального цикла. Если менструальный цикл отсутствует (аменорея), в любой день. Накануне, необходимо исключить стрессовые ситуации, тяжелые физические нагрузки, нежелательно сдавать анализ в период обострения хронических или острых заболеваний (Грипп, ОРВИ, ангина и т.п.)
Уровень АМГ у мужчин: 0,49 – 5,98нг/мл
Уровень АМГ у женщин:
• низкий 0,01 – 0,9 нг/мл
• средний 1,0 – 2,5нг/мл
• высокий более 2,5нг/мл
Показания для анализа АМГ у мужчин:
-Частичная или полная дисгенезия гонад
— Крипторхизм или анорхизм
— нечувствительность к андрогенам
— установление пола в сомнительных случаях
— оценка эффективности лечения
— оценка мужской половой функции
Показания для определения АМГ у женщин:
— Преждевременная менопауза
— Снижение овариального резерва
— Бесплодие
— Преждевременное половое развитие
— Поликистоз яичников
— Ожирение в позднем репродуктивном возрасте
— Гранулезные опухоли яичников
Низкие показатели АМГ свидетельствуют о снижении количества антральных фолликулов.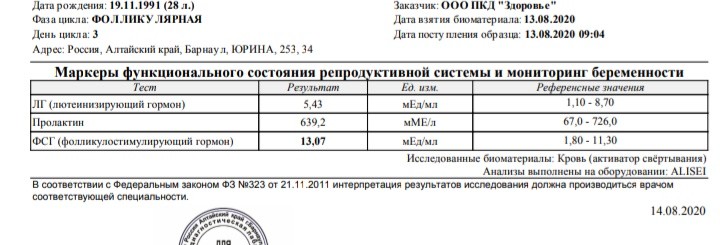 В такой ситуации нет смысла в повышении АМГ, так как он является следствием, а не причиной.
В такой ситуации нет смысла в повышении АМГ, так как он является следствием, а не причиной.
Помните, бесплодие не приговор!
Всегда на страже Вашего здоровья, IPF!
—
Определение репродуктивного потенциала для женщин
Способность женщины к рождению детей почти полностью зависит от состояния яичников. Сегодня появилась возможность достоверно оценить резерв работоспособности яичников, а значит, определить свой репродуктивный потенциал. И не упустить время.
Подробнее о программе:
Современная индустриализация оказывает своё влияние на планы женщин по рождению детей. Многие активно работают, занимаются карьерой, а деторождение переносится на более поздний период. Этот тренд носит название «отсроченное или позднее материнство» и характерен для многих стран с развитой экономикой. Но в этом переносе на более старший возраст кроются риски по снижению фертильности (способности зачать) вплоть до бесплодия.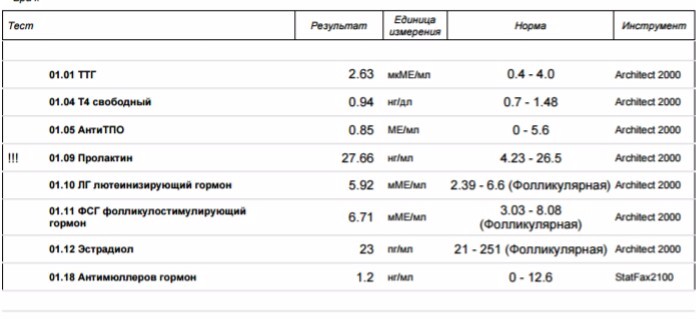
Комплексная программа включает в себя несколько видов исследований: Исследование крови на Антимюллеров гормон (АМГ) – тест применяется для оценки овариального резерва у женщин, что актуально в диагностике и мониторинге лечения бесплодия, при подготовке к ЭКО. Результат выдаётся в виде числового значения с указанными рефренными интервалами. Так же будет сделано УЗИ органов малого таза с оценкой фолликулярного аппарата яичников. Ультразвуковая диагностика проводится трансвагинально и при необходимости трансабдоминально. При УЗИ подсчитывается количество фолликулов, определяется наличие доминантного фолликула, оценивается состояние эндометрия. По показаниям будет использована технология цветного допплера без дополнительной оплаты. В конце программы пациент получит консультацию гинеколога-эндокринолога, которое включает опрос пациентки, осмотр на гинекологическом кресле. По итогам консультации врач выдаёт заключение и расписывает рекомендации относительно профилактики и дальнейшего лечения выявленных при осмотре заболеваний, а также даётся предварительная оценка репродуктивного резерва.
Кому рекомендуется комплексная программа по оценке репродуктивного потенциала:
- женщинам старше 30 лет
- при планировании карьеры
- при подготовке к процедурам ВРТ: ЭКО, ЭКО-ИКСИ, стимуляция овуляции
- при бесплодии
- после операций на яичниках
- при эндометриозе
- при хронических воспалительных заболеваниях органов малого таза (ВЗОМТ)
Подготовка к обследованию
Перед забором крови рекомендуется воздержаться от приёма пищи в течении 4 часов, возможно употребление сладких напитков, исключая газированные. Не рекомендуется курить за 30 минут до обследования. Накануне избегать пищевых продуктов, усиливающих газообразование в кишечнике и переедания.
Советы и новости по фертильности | CREATE Fertility
Что такое СПКЯ?
Синдром поликистозных яичников (СПКЯ) — распространенное заболевание у женщин, при котором в яичниках обнаруживаются множественные кисты.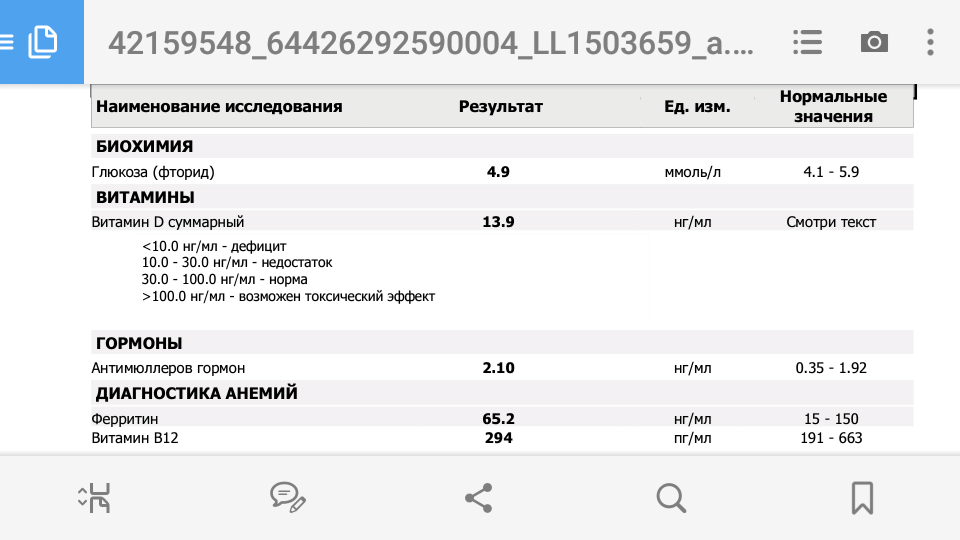 По оценкам экспертов, до 20% женщин страдают поликистозом яичников (СПКЯ), не страдая полным синдромом (СПКЯ), которым страдают от 5 до 10% женщин и включают гормональный дисбаланс и ряд сопутствующих симптомов.
По оценкам экспертов, до 20% женщин страдают поликистозом яичников (СПКЯ), не страдая полным синдромом (СПКЯ), которым страдают от 5 до 10% женщин и включают гормональный дисбаланс и ряд сопутствующих симптомов.
Кисты, обнаруживаемые в яичниках, на самом деле представляют собой фолликулы, содержащие яйцеклетки, которые еще не полностью созрели.Это означает, что яйца, которые начали развиваться в яичниках, останавливаются на незрелой стадии, когда они еще слишком малы для выпуска, и остаются в яичниках. Женщины, страдающие полным СПКЯ, также имеют дисбаланс гормонов и ряд других симптомов, которые могут включать: нежелательный рост волос, увеличение веса, прыщи, нерегулярный менструальный цикл и депрессию. Симптомы могут быть легкими или тяжелыми, и во многих случаях они, как правило, начинаются в подростковом возрасте.
Что означает СПКЯ для фертильности?
Женщины, страдающие СПКЯ, могут быть инсулинорезистентными и иметь более высокое, чем обычно, производство тестостерона яичниками. Состояние также характеризуется дисбалансом других гормонов, включая глобулин, связывающий половые гормоны (SHBG), лютеинизирующий гормон (LH) и антимюллеров гормон (AMH). В совокупности этот дисбаланс может привести к трудностям для женщин при попытке зачать ребенка.
Состояние также характеризуется дисбалансом других гормонов, включая глобулин, связывающий половые гормоны (SHBG), лютеинизирующий гормон (LH) и антимюллеров гормон (AMH). В совокупности этот дисбаланс может привести к трудностям для женщин при попытке зачать ребенка.
Как я могу проверить, не болею ли я СПКЯ? Почему важен мой показатель AMH?
АМГ — это гормон, выделяемый развивающимися фолликулами, которые представляют собой яйцеклетки, содержащие незрелые яйца. АМГ естественным образом снижается с возрастом по мере уменьшения количества фолликулов.Мы знаем, что женщины с СПКЯ часто имеют повышенный уровень АМГ, вероятно, из-за высокого уровня фолликулов, которые у них есть на ранней стадии развития. Вооружившись информацией о средних уровнях АМГ, которые мы ожидаем увидеть у женщин в разных возрастных диапазонах, мы можем идентифицировать пациентов с более высокими, чем обычно, баллами по АМГ, используя простой анализ крови в качестве одного из возможных индикаторов того, что они могут страдать от СПКЯ.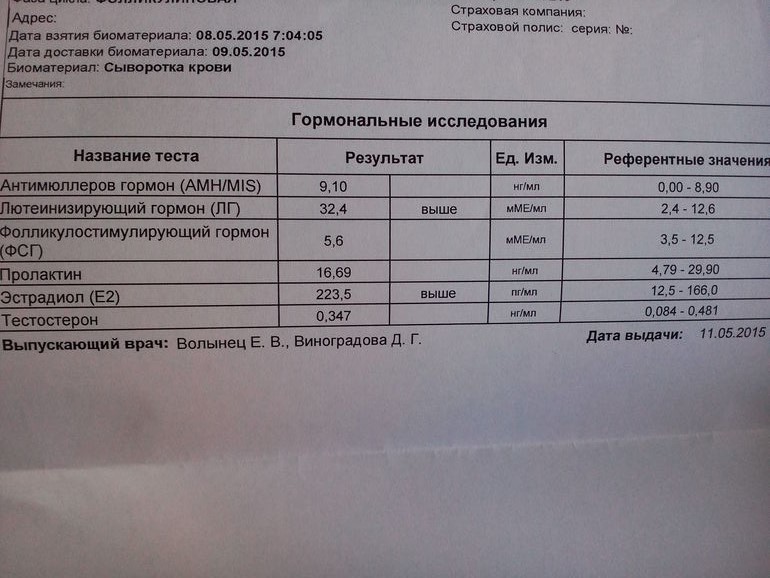 Вы можете сдать анализ крови на AMH в любой день менструального цикла и получить результаты в тот же день.Если результаты показывают, что ваша фертильность может потребовать дальнейшего исследования, врач посоветует вам пройти полное внутреннее ультразвуковое сканирование. Это комплексное сканирование, позволяющее определить количество антральных фолликулов (AFC) и наличие кист в яичнике. Важно обсудить ваш показатель AMH со своим врачом, поскольку его следует рассматривать в контексте ряда факторов, в первую очередь вашего возраста.
Вы можете сдать анализ крови на AMH в любой день менструального цикла и получить результаты в тот же день.Если результаты показывают, что ваша фертильность может потребовать дальнейшего исследования, врач посоветует вам пройти полное внутреннее ультразвуковое сканирование. Это комплексное сканирование, позволяющее определить количество антральных фолликулов (AFC) и наличие кист в яичнике. Важно обсудить ваш показатель AMH со своим врачом, поскольку его следует рассматривать в контексте ряда факторов, в первую очередь вашего возраста.
Однако мы точно знаем, что в любом возрасте показатель выше 48 пмоль / л (что означает пикомоль на литр) считается высоким и может быть признаком СПКЯ.Исследования фактически показали, что около 97% женщин с АМГ более 71 пмоль / л имеют СПКЯ.
Могу ли я пройти курс лечения бесплодия, если у меня высокий показатель AMH?
Построение полной картины вашего репродуктивного здоровья, включая ваш показатель AMH, важно, если вы подумываете о лечении бесплодия. Хорошая новость заключается в том, что женщины с СПКЯ обычно хорошо реагируют на лечение ЭКО, но они могут подвергаться риску чрезмерной реакции на лекарства, предназначенные для стимуляции яичников, что может подвергнуть их риску синдрома гиперстимуляции яичников (СГЯ).СГЯ — распространенное и потенциально серьезное осложнение лечения бесплодия, которое вызывает набухание яичников. Более безопасным вариантом для пациентов, страдающих СПКЯ, является лечение мягкой стимуляцией. Мы первыми разработали безопасные и успешные протоколы естественного и мягкого ЭКО, которые подходят женщинам и их индивидуальным обстоятельствам.
Хорошая новость заключается в том, что женщины с СПКЯ обычно хорошо реагируют на лечение ЭКО, но они могут подвергаться риску чрезмерной реакции на лекарства, предназначенные для стимуляции яичников, что может подвергнуть их риску синдрома гиперстимуляции яичников (СГЯ).СГЯ — распространенное и потенциально серьезное осложнение лечения бесплодия, которое вызывает набухание яичников. Более безопасным вариантом для пациентов, страдающих СПКЯ, является лечение мягкой стимуляцией. Мы первыми разработали безопасные и успешные протоколы естественного и мягкого ЭКО, которые подходят женщинам и их индивидуальным обстоятельствам.
Есть ли лекарство от СПКЯ?
Хотя лекарств от СПКЯ нет, вы можете управлять симптомами, выбирая образ жизни, например, теряя вес.Также может помочь активный образ жизни в сочетании со сбалансированной диетой с низким содержанием обработанных сахаров и высоким содержанием свежих фруктов и овощей. Врачи могут назначить инсулиновые препараты для нормализации гормонального дисбаланса и улучшения инсулинорезистентности.
Если вы обеспокоены тем, что у вас могут быть некоторые из симптомов, связанных с СПКЯ, или у вас есть СПКЯ, и вы заинтересованы в более безопасных и мягких методах ЭКО, более благоприятных для организма, позвоните нам по телефону 0333 240 7300.
Почему AMG (антимулерианский гормон) важен для успешного ЭКО?
У каждой женщины естественный запас яйцеклеток находится в яичниках.По мере взросления качество и количество яиц снижается. Антимюллеров гормон (АМГ) вырабатывается яйцеклетками по мере развития яичных мешочков или фолликулов. Уровень АМГ в крови женщины — один из лучших индикаторов текущего качества ее яичникового резерва.
Уровни АМГ в крови доноров яйцеклеток, если они не были затронуты во время менструации или из-за менструального цикла. Следовательно, этот тест можно проводить в любое время в течение всего месяца. Даже если женщина принимает оральные контрацептивы, она может пройти такой тест, чтобы определить качество и потенциал ее яичникового резерва.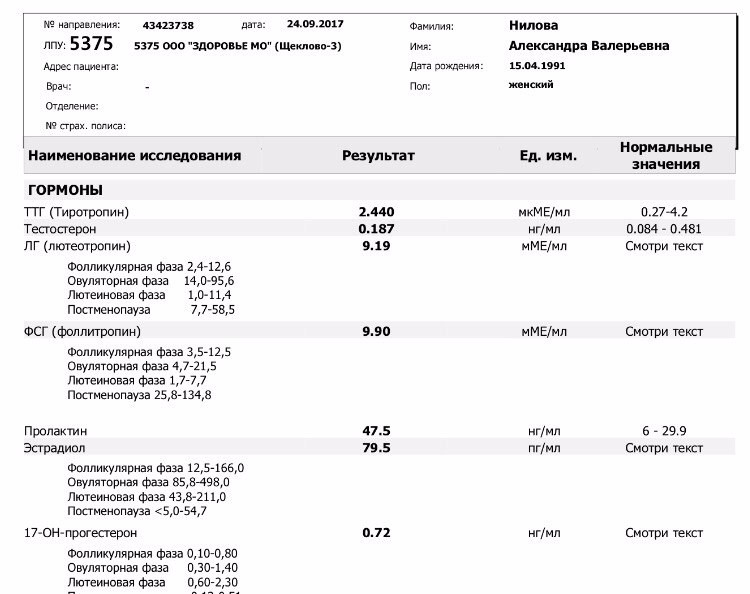
Этот тест в первую очередь проводится на предполагаемых матерях перед оплодотворением. Это позволяет им получить отчет о качестве своих яйцеклеток, прежде чем вкладывать средства в оплодотворение яйцеклетки спермой. Женщины с плохими результатами анализов обычно обращаются к донору яйцеклеток, чтобы получить наиболее плодовитую яйцеклетку для цикла ЭКО.
Фертильность — одна из самых серьезных проблем, с которыми сегодня сталкиваются начинающие родители. Тысячи пар сегодня сталкиваются с проблемами бесплодия и проходят лечение ЭКО.Основная цель всех циклов лечения ЭКО — установить причину бесплодия и устранить ее с помощью лекарств. Женское бесплодие — один из основных аспектов для пар, сталкивающихся с проблемами естественного зачатия. Тест AMH проводится для подтверждения отклонений, связанных с фертильностью яиц, вырабатываемых женщиной естественным путем. Если он подтверждает наличие у женщины некачественных яйцеклеток, ее обычно отправляют на лечение. Если она не готова тратить много времени на это лечение, обычно рекомендуется обратиться к донору яйцеклеток для завершения цикла ЭКО.
Если она не готова тратить много времени на это лечение, обычно рекомендуется обратиться к донору яйцеклеток для завершения цикла ЭКО.
Поскольку предполагаемые родители вкладывают много своих денег и энергии в цикл ЭКО, они обеспокоены качеством яйцеклетки, которую они получают от донора яйцеклеток. Честно говоря, предполагаемые родители должны вкладывать дополнительные средства, чтобы получить яйцеклетки от донора. Из-за этого они хотят получать самые лучшие яйца с высочайшим качеством и потенциалом. Вот почему доноры яйцеклеток тщательно проверяются перед назначением им цикла ЭКО. Доноры яйцеклеток проходят тест AMH, чтобы выяснить их способность производить яйцеклетки высокого качества.
Все доноры яйцеклеток, подписанные New Life, прошли проверку на уровень АМГ. Если пара хочет использовать своего собственного донора яйцеклеток, мы сначала проверяем ее уровень AMH, а затем рассматриваем ее как кандидата на эту важную роль. У нас есть большая база данных здоровых доноров яйцеклеток, работающих с нами, которые обеспечивают здоровые яйцеклетки. Помимо доноров яйцеклеток, пары могут использовать криоконсервированные яйца для завершения цикла ЭКО.
Помимо доноров яйцеклеток, пары могут использовать криоконсервированные яйца для завершения цикла ЭКО.Тест AMH для успешного цикла ЭКО
Тест на антимюллеровы гормоны (АМГ) измеряет резерв яичников и оценивает потенциал фертильности женщины.
Для более точной оценки тесты AMH обычно сочетаются с подсчетом антральных фолликулов (AFC). Этот конкретный тест определяет количество мелких фолликулов, присутствующих в двух яичниках. AFC выполняется центрами ЭКО с помощью ультразвукового сканирования. Это помогает сделать точную оценку фертильности.
Женщины, планирующие пройти цикл ЭКО, сначала проходят скрининг с помощью теста на анти-мюллеровский гормон (АМГ) для определения ее фертильности. Это один из самых надежных тестов для интерпретации способности любой женщины к беременности с точки зрения фертильности ее яйцеклеток.Этот тест можно проводить в любое время месяца и не имеет никакого отношения к образу жизни женщин, проходящих этот тест. Женщины, борющиеся с бесплодием, часто проходят этот тест, чтобы узнать точную картину своего репродуктивного здоровья.
ТестированиеAMH в настоящее время является важной частью программ в авторитетных клиниках репродуктивной медицины и центрах ЭКО. АМГ — это в основном белок, который вырабатывается клетками фолликулов яичников. Процедура тестирования AMH была впервые разработана еще в 1990 году. Она была введена в действие после многих лет исследований на женщинах, проходящих лечение ЭКО.Эксперты в этом исследовании установили положительную корреляцию между уровнем АМГ у женщины и количеством яйцеклеток, извлеченных после успешной процедуры стимуляции яичников.
Большинство клиник по лечению бесплодия доверяют уровням АМГ и не рассматривают женщину с низким уровнем АМГ как подходящего кандидата для донорства яйцеклеток или ЭКО. В некоторых случаях женщины с низким уровнем АМГ получают надлежащий курс лечения, чтобы избавиться от такого синдрома и получить здоровую беременность.
АМГ по номерам
Нормальные уровни АМГ — если уровень АМГ от 1.От 5 до 4,0 нг / мл, это считается нормальным и имеет повышенную фертильность и лучшую реакцию на лечение бесплодия.
Низкий уровень АМГ — если уровень АМГ от 1,0 до 1,5 нг / мл, он считается низким и со снижением резерва яичников. Тем не менее, есть хорошие шансы на хорошие результаты беременности после лечения.
Очень низкий уровень АМГ — если уровень АМГ ниже 0,5 нг / мл, это свидетельствует о чрезвычайно низком овариальном резерве. У таких женщин больше опасений по поводу фертильности, и они обычно не считаются донорами яйцеклеток.
Что влияет на уровни AMH?
Уровень АМГ у женщин регулируется гонадотропным гормоном. Он остается самым высоким на начальной стадии развития фолликула. Это когда количество фолликула составляет 4 мм. Секреция АМГ замедляется и в конечном итоге прекращается по мере постепенного увеличения фолликула. Исследования показывают, что производство AMH почти прекращается, когда фолликулы достигают 8 мм.
Очень важно понимать естественные колебания циркуляции уровня АМГ.Уровень AMH показывает потенциальное ограничение количества или качества яйцеклеток у женщин.
Низкие уровни AMH
Уровень АМГ у женщины падает по мере того, как она начинает стареть. Другие элементы, влияющие на яичники и функции яичников:
Напряжение
Нездоровое питание
Низкое кровообращение в яичниках
Болезнь
Гормональный дисбаланс
Травма
Другие генетические факторы
Аутоиммунные расстройства
Факторы нарушенного образа жизни
Если уровень АМГ оказывается низким у более молодых женщин, то есть женщин в возрасте до 35 лет, это признак ранней менопаузы.Необходимо немедленно принять медицинские меры, чтобы справиться с ситуацией и сохранить и повысить фертильность женщины.
Надежда на будущее
Если ваш уровень AMH в отчете об исследовании низкий, и вы беспокоитесь о его последствиях, вы должны помнить, что одного теста на AMH не всегда достаточно для прогнозирования вашей фертильности. Существуют и другие подходы к тестированию для оценки вашего уровня AMH. Другие тесты на фертильность могут принести вам еще один отчет о состоянии здоровья, в отличие от этого.
Существуют различные лекарства, связанные со здоровьем яиц, которые повышают фертильность. Существует множество лечебных процедур, которые могут помочь женщине нормализовать уровень АМГ. Медицинские методы лечения и природные средства значительно повышают фертильность женщин.
Влияние возраста на уровень антимуллеровых гормонов в сыворотке крови у женщин, посещающих отделение химиотерапии по поводу первичного рака груди
https://doi.org/10.1016/j.mefs.2017.09.008 Получить права и содержаниеРеферат
Цель
Цель Целью исследования является оценка сывороточного уровня антимюллеровского гормона у пациентов с первичным раком молочной железы, которым предлагается пройти химиотерапию, и изучение влияния возраста на антимюллеровский гормон и характер менструального цикла после химиотерапии.
Общие сведения
У выживших после рака груди репродуктивного возраста необходимы биомаркеры постхимиотерапевтической функции яичников в режиме реального времени.
Метод
Это проспективное когортное исследование было проведено с участием ста двадцати женщин, шестидесяти женщин в качестве группы пациентов (n = 60), которым впервые был поставлен диагноз первичного рака груди, и шестидесяти женщин в качестве контрольной группы (n = 60). . Их возраст от (21 до 41) года. Пациенты были разделены на подгруппы по возрасту: ≤35 и> 35 лет.
Результаты
Между пациентами и контрольными группами наблюдались достоверные различия в отношении ИМТ, регулярности менструального цикла (P <0,05). Были достоверные различия между антимуллеровым гормоном до и после первой дозы химиотерапии во всех возрастных группах (p <0,05). Наблюдалась значительная разница в антимуллеровом гормоне до и после введения второй дозы химиотерапии у лиц младше или равных 35 годам. Но нет такой разницы в антимуллеровом гормоне после второй дозы химиотерапии у тех, кто был старше 35 лет.
Заключение
Сывороточный АМГ — удобный и чувствительный индикатор истощения фолликулов и восстановления у молодых женщин во время и после химиотерапии, это должно быть подтверждено группой большего размера.
Ключевые слова
Химиотерапия
Рак груди
Женщины в возрасте
Антимулларианский гормон
Рекомендуемые статьиЦитирующие статьи (0)
© 2017 Middle East Fertility Society. Производство и хостинг компанией Elsevier B.V.
Рекомендуемые статьи
Цитирующие статьи
Diet Doc Партнеры с AMG предлагают биоидентичный гормон
ХЬЮСТОН, фев.10, 2016 (GLOBE NEWSWIRE) — Гормональный дисбаланс имеет множество побочных эффектов, вызывающих целый ряд симптомов, включая усталость, депрессию, головные боли и даже снижение либидо. Гормоны также могут играть важную роль в способности похудеть или сопротивляться увеличению веса с возрастом. До недавнего времени снижение уровня гормонов в организме было просто фактом жизни, неуклонно происходящим с возрастом. Однако благодаря новейшим технологиям и способности создавать биоидентичные гормоны в лаборатории заместительная гормональная терапия стала преобладающей в американской культуре.Чтобы помочь в лечении гормонального дисбаланса, Diet Doc заключила партнерские отношения с известным поставщиком биоидентичных гормональных препаратов AMG, сделав заместительную гормональную терапию доступной для пациентов Diet Doc по всей стране.
По мере старения организма многочисленные симптомы гормонального дисбаланса становятся все более распространенными, что в конечном итоге влияет на качество жизни многих. Мужчины начинают терять свободный тестостерон в организме со скоростью около 2% в год после 30 лет. Признаками низкого уровня тестостерона являются чрезмерная усталость, снижение мышечного тонуса и силы, депрессия и снижение полового влечения.Женщины не застрахованы от гормонального дисбаланса. По мере того как женщины стареют, наиболее резкое падение уровня гормонов начинается в период менопаузы. Симптомами менопаузы могут быть бессонница, приливы, перепады настроения, проблемы с памятью и многое другое.
Отличный новый способ лечения гормонального дисбаланса — это заместительная биоидентичная гормональная терапия, или сокращенно BiHRT. Биоидентичные гормоны ценятся за их сходство с естественными гормонами и обладают значительно улучшенными физиологическими эффектами по сравнению с их синтетическими аналогами, которые имеют другую химическую структуру.Вся биоидентичная гормональная терапия проходит под тщательным наблюдением врача, но проводится в домашних условиях.
Для предоставления более полного спектра услуг Diet Doc объединилась с Andro Medical Group (AMG), лидером в области биоидентичной заместительной гормональной терапии. Как и система похудания Diet Doc, AMG предлагает индивидуальную заместительную гормональную терапию, разработанную с учетом индивидуальных факторов организма пациента, его потребностей и состава.
В течение ограниченного времени Diet Doc предлагает БЕСПЛАТНУЮ первичную консультацию заинтересованным пациентам для оценки гормонального дисбаланса.Просто свяжитесь с Diet Doc напрямую по телефону 888-934-4451 и назначьте встречу для сбора образцов на дому. Квалифицированные специалисты AMG придут к пациенту домой, чтобы забрать все лаборатории, поэтому нет необходимости ехать в местную лабораторию.
После получения результатов пациенты будут иметь возможность проконсультироваться с одним из лицензированных врачей Diet Doc по поводу вариантов заместительной гормональной терапии. Единственный надежный способ проверить гормональный дисбаланс — это тестирование, и Diet Doc предоставляет пациентам по всей стране простоту домашнего гормонального лечения с легкостью телефонного звонка.
О компании:
Diet Doc Weight Loss — национальный лидер в области медицинского снижения веса, предлагающий полный набор рецептурных лекарств, врачей, медсестер и поддержку наставников по питанию. Более десяти лет Diet Doc разработала сложную, разработанную врачом программу похудания, которая учитывает каждую индивидуальную потребность в здоровье, чтобы способствовать быстрой, безопасной и долгосрочной потере веса.
Diet Doc Контактная информация:
Оказание помощи в США
Штаб-квартира:
Сан-Диего, Калифорния
(888) 934-4451
Info @ DietDoc.info
http://www.dietdoc.com
Twitter: https://twitter.com/DietDocMedical
Facebook: DietDocMedicalWeightLoss
Linkedin: https://www.linkedin.com/company/diet-doc-weight-loss ? trk = biz-brand-tree-co-logo
Сравнительные гормональные и иммуноглобулиновые профили женщин, прерванных абортами, с токсоплазмозом или без него
Аннотация
Токсоплазмоз — всемирное заболевание, вызывающее аборты у людей и животных. Цель : В этом исследовании предполагается, что аборты из-за токсопламы связаны с повышением уровня иммуноглобулинов IgM и IgG в результате нарушения гормонов эстрогена, прогестерона, кортизола и пролактина. Методы : Образцы крови T. gondii серо-положительных (n = 25) и серо-отрицательных (n = 10) прерванных женщин в трех триместрах гестации были подвергнуты серологическому анализу ELISA на IgM и IgG и гормональному анализу. Простой односторонний дисперсионный анализ был использован для проверки влияния триместра на концентрацию гормонов, а независимый t-критерий выборки был использован для изучения влияния серотипирования. Результаты : прерванные Toxoplasma серопозитивных женщин были моложе ( P = 0,004) и имели ( P = 0,0001) высокий уровень IgG, IgM и эстрогена ( P = 0,02), но низкий уровень кортизола ( P ). = 0,029) и пролактин ( P = 0,005). Заключение; изменения гормонов эстрогена, кортизола и пролактина, возможно, предрасполагают к латентному условно-патогенному токсоплазмозу во время беременности у женщин-носительниц.
Ключевые слова
токсоплазма — серопозитивные — аборт — репродуктивные гормоны — иммуноглобулины — женщины
Введение
Toxoplasma gondii — это внутриклеточное условно-патогенное простейшее, которое является одним из наиболее распространенных острых или скрытых абортивных зоонозов [1].Инфекционная стадия почвенных споровых ооцист развивается только в кишечнике кошачьих при заражении пищи или воды [2]. Стадия острых тахизоитов ответственна за диффузию матери и плода. В то время как стадия брадизоита сохраняется в спящей ткани в виде кисты и может реактивироваться до латентных острых тахизоитов, что приводит к резкому сдвигу гормональной или кортикостероидной терапии во время беременности, что приводит к временной гипергликемии беременности [3,4].
Женщины прервали последовательность до T.gondii во время беременности (недавняя или первичная инфекция), в основном с преобладающим титром IgM [5], или через латентную условно-патогенную динамику, стимулирующую обратную конверсию брадизоитов-тахизоитов, в основном с большим титром IgG [6]. Латентный токсоплазмоз потенциально опасен, несет риск передачи плода примерно в 30% случаев с тяжелыми осложнениями в зависимости от стадии беременности, в основном с абортом и смертью плода [7].
Эстроген и прогестерон синтезируются в основном в яичниках, и их колебания соответствуют фазе менструального цикла [8].Уровень кортизола повышается после воздействия стрессоров, и его концентрация у женщин выше, чем у мужчин [9]. Пролактин ( PRL ), поскольку подобный цитокину регулирует иммунный ответ и увеличивается в 10-20 раз во время беременности для выработки молока [10]. Изменения гормонов яичников из-за инфекции T. gondii были изучены у женщин [11]. Размер плюс зрелость плаценты, а также иммунный ответ эмбриона / плода повлияли на способность бороться с T.gondii инвазия [12].
Настоящее исследование направлено на оценку взаимосвязи между уровнями гормонов эстрогена, прогестерона, пролактина и кортизола у T. gondii серопозитивных и серонегативных абортированных женщин в течение трех триместров беременности.
Материалы и методы
В исследуемую популяцию вошли 35 женщин в возрасте от 22 до 37 лет, поступивших в гинекологическое отделение больницы общего профиля Бени-Суэф с осложненной беременностью в разных триместрах.Пациенты были разделены в зависимости от стадии беременности на G1 (n = 18), включая случаи, прерванные в течение первых 12 недель беременности, G2 (n = 7) включали пациенток с абортами на сроке от 13 до 26 недель гестации) и G3 (n = 10), соответствующих пациентам, у которых наступила внутриутробная гибель плода. Выполняемые процедуры соответствовали этическим стандартам и Комитету по институциональной этике Национального исследовательского центра и медицинского факультета Университета Бени-Суэфа. Пациенты позволили отобрать образцы, необходимые для исследования, и от каждого участника было получено письменное согласие
Забор крови и гормональный анализ
У каждой женщины сразу после аборта было взято 3 мл крови.Сыворотки отделяли и хранили при -20 ° C. Серологический скрининг на антитела к Toxoplasma проводили с помощью коммерческих наборов для ELISA IgM и IgG (Clinotech Diagnostics and Pharmaceuticals, Ричмонд, Канада). Прогестерон и эстроген анализировали с помощью коммерческого ELISA (DRG, International, Inc., США). Пролактин анализировали с использованием коммерческого набора для ELISA (BioCheck, Inc., Фостер-Сити, Калифорния). Чувствительность, интра-анализы и измерения между анализами составляли 0,045 нг / мл, 6,86 и 5,59% для прогестерона; 9,714 пг / мл, 2.71 и 6,72% для эстрадиола; 2,0 нг / мл, 4,6% и 7,4% для пролактина. Кортизол определяли с помощью EIA (Xema-Medica Co., Ltd., Москва, Россия), чувствительность анализа составляла 12 нмоль / л.
Статистический анализ
Данные представлены как среднее ± стандартное отклонение. Простой односторонний дисперсионный анализ ANOVA был использован для изучения влияния триместра на различные параметры в сероположительных и серо-отрицательных случаях. Множественный критерий диапазона Дункана использовался для различения значимых средних.Независимый выборочный t-критерий использовался для изучения влияния серотипа в течение триместра с использованием SPSS версии 20 (IBM, Армонк, Нью-Йорк, США). Уровни значимости были установлены на уровне P <0,05.
Результаты
Серологические тесты абортированных женщин (N = 35) показали, что количество серопозитивных случаев составляет 25 пациенток, а серо-отрицательных пациентов — 10 (Рисунок 1). Серопозитивные женщины после абортов были моложе ( P = 0,004) и имели значительно высокий уровень IgM ( P = 0.0001), IgG ( P = 0,0001) и эстроген ( P = 0,02), но низкий пролактин ( P = 0,005) и кортизол ( P = 0,029). Возраст сероположительных случаев значительно варьировал (P = 0,001) между тремя триместрами (Таблица 1). Серо-положительные женщины, прерванные в первом триместре, были моложе ( P = 0,002), чем серо-отрицательные. Как IgM, так и IgG серо-положительных ( P = 0,028; 0,005) и серо-отрицательных ( P = 0,001; 0,0001) случаев значительно различались.Серопозитивные пациенты имели значительно более высокий уровень IgM ( P = 0,0001) в течение первого и второго триместров. Серопозитивные пациенты имели высокий уровень IgG в течение трех триместров. Концентрация эстрогена в сероположительных и отрицательных случаях увеличилась ( P = 0,0001) в течение третьего триместра. У серопозитивных пациентов было ( P = 0,001) более высокое содержание эстрогенов в течение первого триместра (таблица 1). Прогестерон в сероположительных и серо-отрицательных случаях увеличивался ( P = 0,0001) с первого по третий триместры.Концентрация пролактина в серо-отрицательных случаях линейно снижалась ( P = 0,0001) с первого по третий триместр у серо-отрицательных женщин, но у серо-положительных пациентов достигла ( P = 0,0001) минимальных значений во втором триместре с очевидным ( P = 0,0001) снижение серо-положительных случаев по сравнению с серо-отрицательными случаями в первом триместре и тенденция ( P = 0,08) к снижению в серо-отрицательных случаях в течение третьего триместра. Серо-положительный ( P = 0.006) и серо-отрицательные ( P = 0,0001) случаи имели высокий уровень кортизола в течение третьего триместра, но сероположительные случаи имели тенденцию ( P = 0,06) иметь низкий уровень кортизола в течение первого триместра по сравнению с серо-отрицательными случаями (Таблица 1 ).
Таблица 1. Среднее ± Стандартное отклонение (SD) возраста / года, титра IgM, титра IgG, эстрогена пг / мл, прогестерона нг / мл, пролактина нг / мл и кортизола нмоль / л в различных случаях во время беременности
Параметры | Серо-тип | Триместр | P-значение | ||||
G1 | G2 | G3 | Итого | ||||
Возраст / год | положительный | 23.79 ± 3,10 а ** | 26,50 ± 4,93 б | 29,43 ± 6,01 в | 0,001 | 25,80 ± 4,99 ** | |
отрицательный | 27,00 ± 4,44 | 28.67 ± 1,30 | 30,00 ± 5,59 | 0,18 | 28,40 ± 4,30 | ||
Титр IgM | положительный | 0,62 ± 0,22 ab ** | 0,74 ± 0,24 б ** | 0.51 ± 0,36 а | 0,028 | 0,61 ± 0,28 ** | |
отрицательный | 0,32 ± 0,12 б | 0,24 ± 0,05 а | 0,38 ± 0,08 б | 0.001 | 0,31 ± 0,11 | ||
Титр IgG | положительный | 1,24 ± 0,78 б ** | 0,77 ± 0,86 а * | 1,55 ± 0,61 б ** | 0,005 | 1.25 ± 0,26 ** | |
отрицательный | 0,33 ± 0,03 а | 0,19 ± 0,03 а | 0,24 ± 0,07 б | 0,001 | 0,26 ± 0,07 | ||
Эстроген пг / мл | положительный | 406 ± 219 a ** | 339 ± 212 а | 592 ± 254 б | 0.001 | 448 ± 245 * | |
отрицательный | 199 ± 210 а | 273 ± 287 а | 584 ± 211 б | 0,001 | 337 ± 284 | ||
Прогестерон нг / мл | положительный | 10.038 ± 5,12 а | 17,41 ± 0,83 б | 20,0 ± 7,43 б | 0,001 | 14,08 ± 7,43 | |
отрицательный | 8,79 ± 2,67 а | 11,38 ± 8.75 | 19,87 ± 6,88 б | 0,001 | 12,89 ± 7,78 | ||
Пролактин нг / мл | положительный | 7,03 ± 8,99 ab ** | 0,77 ± 0,02 а | 16.03 ± 23.97 б | 0,031 | 9,41 ± 15,51 ** | |
отрицательный | 36,37 ± 18,00 б | 10,90 ± 15,17 а | 3,59 ± 4,20 а | 0.001 | 18,89 ± 7,78 | ||
Кортизол нмоль / л | положительный | 314 ± 101 а | 356 ± 35 ab | 369 ± 28 б | 0,006 | 336 ± 82 * | |
отрицательный | 361 ± 16 а | 354 ± 20 а | 382 ± 13 б | 0.001 | 365 ± 20 | ||
Средние значения с разными надстрочными индексами (a, b, c) внутри строки значительно различаются при P <0,05. * означает значимый при P <0,05, ** означает значимый при P <0,01
Рисунок 1. Количество различных серогрупповых состояний исследованных случаев
Обсуждение
Настоящий ответ на вопрос, почему токсоплазмоз чаще встречается у беременных женщин? Это то, что беременные женщины считают исключительным состоянием с ослабленным иммунитетом, связанным с гормональными изменениями.Хотя беременные и небеременные женщины в равной степени подвержены воздействию источников инфекции T. gondii , беременные и небеременные женщины различаются по гормональной кривой и возможной материнско-фетальной диффузии через ре-конверсию брадизоитов-тахизоитов [13 ]. Так, у беременных женщин риск сероконверсии в 2,2 раза выше, чем у небеременных [14]. Кроме того, беременные мыши более восприимчивы к инфекции Toxoplasma и прогрессируют более тяжелые кисты мозга с более высоким уровнем смертности, чем аналогично инфицированные небеременные мыши [15].Хотя Galván-Ramírez.et al. [16] сообщили, что эстроген не обнаруживает значительных различий между хроническими и неинфицированными женщинами, в текущем исследовании было замечено, что эстроген действует как стимул для повышенной восприимчивости к латентному условно-патогенному аборту T. gondii , который характеризуется высокой степенью значимости ( P = 0,02) у абортированных женщин. Текущие результаты согласуются с Aabasian et al. [17], которые обнаружили значительную взаимосвязь между эстрогенами и положительными женщинами по токсоплазме.Кроме того, введение фармакологического эстрогена морским свинкам и мышам увеличивает восприимчивость T. gondii и количество цист [18]. У мышей тканевые кисты уменьшались в отсутствие эстрогена из-за овариэктомии [19]. Повышение гестационного эстрогена (E2) у серопозитивных женщин усугубляет распространенность инфекции Toxoplasma , что приводит к ослаблению иммунных клеток за счет разрушения активности естественных киллеров (NK) и вызывает дисфункцию нейтрофилов [20].Повышенный эстроген сдвигает материнский иммунный ответ в сторону фенотипа Th3 для облегчения имплантации эмбриона, что противоположно тому, что требуется для контроля Toxoplasma , возможно, ускоряет репликацию T. gondii и увеличивает вероятность транс-плацентарной передачи [20]. Также резкое отклонение уровня E2 стимулирует рецидивирующую острую симптоматическую стадию через обратную конверсию брадизоитов-тахизоитов [3,21].
В настоящем исследовании; гормон кортизола, у серопозитивных пациентов был низкий уровень кортизола в течение первого триместра, а у всех серопозитивных женщин был значительно низкий уровень кортизола по сравнению с серонегативными пациентами.Напротив, Shirbazou et al. [22] показали, что уровень кортизола в сыворотке крови у женщин с положительным результатом токсоплазмы был выше, чем в контрольной группе со статистически значимой корреляцией ( P <0,0001), и была обнаружена значимая связь между токсоплазмой и стрессом ( P <0,0001) и тревогой ( P = 0,04). Более того, Mahbodfar et al. [23] показали, что уровень кортизола у инфицированных женщин был выше, чем у неинфицированных. Стрессовое поведение, возникающее в результате повышения уровня кортизола, действует как фактор иммуносупрессора, мотивируя рецидив острого токсоплазмоза за счет двойного увеличения числа T.gondii тахизоиты и кисты головного мозга [22]. Было высказано предположение, что кортизол действует, индуцируя повышенную восприимчивость T. gondii и повышая последовательность к инфекции Toxoplasma , которая, вероятно, рассматривается как важный стрессовый стимул, вызывающий повышение уровня кортизола в крови [24]. Таким образом, значимая корреляция уровня кортизола в текущем исследовании может быть связана с динамикой стресса токсоплазматического аборта, а не с нормальным физиологическим подъемом.
Результаты настоящего исследования символизируют статистически незначимое изменение ппрогестерона, и это согласуется с Galván-Ramírez et al.[16] и Aabasian et al. [17].
Пролактин (ПРЛ) стимулирует пролиферацию Т-клеток и высвобождает различные защитные цитокины, такие как TNF-α, которые эффективно контролируют течение инфекции T. gondii . Так, PRL должен снижать репликацию T. gondii из-за ограниченной способности паразитов проникать в клетки-хозяева [12,13]. Кроме того, сывороточный пролактин человека обладает способностью связываться с живыми штаммами тахизоитов RH (тип I) и ME49 (тип II), подавляя их способность к проникновению [25].Что касается PRL, Значительно низкие уровни, зарегистрированные у серопозитивных пациентов в настоящем исследовании по сравнению с серонегативными женщинами, не согласились с Mahbodfar et al. [23], но согласились с результатами Dzitko et al. [25], которые документально подтвердили, что у женщин с гиперпролактинемией наблюдается более низкая распространенность T. gondii .
Выводы
Серо-отрицательная беременная женщина требует регулярных проверок на предмет возможной сероконверсии.Тем не менее, инфекция могла быть передана в конце беременности, когда мать все еще оставалась серо-отрицательной при родах. Риск передачи инфекции плода в этот период составляет 70% при отсутствии клинических симптомов при рождении. Таким образом, после родов всем серо-отрицательным беременным женщинам или новорожденным рекомендуется провести дополнительный серологический анализ.
Благодарности
Авторы выражают благодарность штатным врачам больницы общего профиля Бени-Суэф за их техническую помощь и содействие в получении образцов крови пациентов.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов
Авторские взносы
Хассанаин профинансировал два гормона, Эльфадали профинансировал иммуноглобулины, Або Эль-Маати профинансировал два гормона,
Авторство и участие
Разработано Хассанаином, wr2021 Авторские права OAT. Все права защищены, измерили иммуноглобулины, собрали данные и написали рукопись.Абд Эль-Вахаб провел забор крови; и помогли измерить гормоны. Або Эль-Маати проверил все гормоны, провел статистический анализ, подготовил рукопись в формате журнала и отправил ее.
Список литературы
- эль-Он Дж., Пейзер Дж. (2003) [Токсоплазма и токсоплазмоз]. Harefuah 142: 48-55, 77. [Crossref]
- Dubey JP (2005) Неожиданное выделение ооцист у кошек, которых кормили тахизоитами Toxoplasma gondii: стадия превращения in vivo и вариация штамма. Вет. Паразитол 133: 289–98. [Crossref]
- Elfadaly HA, Hassanain MA, Shaapan RM, Hassanain NA, Barakat AM (2015) Кортикостероидные оппортунистические кисты головного мозга T.gondii у латентно инфицированных мышей. Внутр. J. Zool. Res. 11: 169-76.
- Hassanain MA, El-Fadaly HA, Hassanain NA (2014) Повышение паразитарной нагрузки Toxoplasma gondii у диабетических крыс как латентный условно-патогенный признак. Энн Троп Мед Паб Исцеление . 7: 110-5.
- Антониу М., Цували Х., Сифакис С., Галанакис Э., Георгопулу Э и др. (2004) Заболеваемость токсоплазмозом у 5532 беременных женщин на Крите, Греция: ведение 185 случаев риска. Eur J Obstet Gynecol Reprod Biol 117: 138-143. [Crossref]
- Boothroyd JC1 (2009) Toxoplasma gondii: 25 лет и 25 крупных достижений в этой области. Int J Parasitol 39: 935-946. [Crossref]
- Speroff L, Glass RH, Kase NG (1999) Клиническая гинекологическая эндокринология и бесплодие, 6-е изд.Филадельфия, Пенсильвания: Lippincott Willians & Wilkins.
- Робертс К.В., Уокер В., Александр Дж. (2001) Половые гормоны и иммунитет к простейшим паразитам. Clin.Microbiol. Ред. . 14: 476-88. [Crossref]
- Klein SL (2004) Гормональные и иммунологические механизмы, опосредующие половые различия при паразитарной инфекции. Parasite Immunol. 26: 247–64. [Crossref]
- Бенедетто Н., Фольгоре А, Романо Каррателли С., Галдьеро Ф (2001) Эффекты цитокинов и пролактина на репликацию Toxoplasma gondii в микроглии мышей. евро Cytokine Netw . 12: 348–58. [Crossref]
- Al-warid HS, Al-qadhi BN (2012) Оценка гормонального фона прогестерона и эстрогена у беременных женщин с токсоплазмозом. Eur J Sci Res . 91: 515–9.
- Ортис-Алегрия LB, Кабальеро-Ортега H, Каньедо-Соларес I, Rico-Torres CP, Sahagún-Ruiz A, et al. (2010) Врожденный токсоплазмоз: гены-кандидаты в иммунные гены-хозяева, имеющие отношение к вертикальной передаче и патогенезу. Гены иммунной .11: 363–73. [Crossref]
- Carneiro ACAV, Carneiro M, Gouveia AMG, Vitor RWA (2009) Распространенность серотипов и факторы риска токсоплазмоза коз в Минас-Жерайсе, Бразилия. Вет. Паразитол . 160: 225-9. [Crossref]
- Avelino MM, Campos JD, Parada JC, Castro AM (2003) Беременность как фактор риска острой сероконверсии токсоплазмоза. Eur J Obstet Gynecol Reprod Biol . 108: 19-24. [Crossref]
- Робинсон DP1, Klein SL (2012) Беременность и гормоны, связанные с беременностью, изменяют иммунные реакции и патогенез заболевания. Horm Behav . 62: 263–271. [Crossref]
- Galván-Ramírez Mde L, Gutiérrez-Maldonado AF, Verduzco-Grijalva F, Jiménez JM (2014) Роль гормонов на инфекцию Toxoplasma gondii: систематический обзор. Передний микробиол . 5: 503. [Crossref]
- Aabasian L, Shirbazou S, Shamsi M, Damghani S, Delpisheh A (2016) Гормональные изменения у женщин с раком груди, инфицированных Toxoplasma gondii. J Bas Res Med Sci .3: 16-21.
- Pung OJ, Lustre MI (1986) Toxoplasma gondii: снижение устойчивости к инфекции у мышей из-за эстрогена. Exp Parasitol 61: 48-56. [Crossref]
- Liesenfeld O, NguyenTA, Pharke C, Suzuki Y (2001) Важность половых и половых гормонов в регуляции восприимчивости тонкой кишки к пероральной инфекции тканевыми кистами Toxoplasma gondii. Дж Паразитол . 87: 1491–3. [Crossref]
- Montoya JG, Remington JS (2008) Управление инфекцией Toxoplasma gondii во время беременности. Clin Infect Dis. 47: 554–66.
- Нава-Кастро К., Эрн’андес-Белло Р., Мунис-Эрн’андес С., Камачо-Арройо I, Моралес-Монтор Дж. (2012) Половые стероиды, иммунная система и паразитарные инфекции: факты и гипотезы Ann NY Acad Sci. 1262: 16–26. [Crossref]
- Shirbazou S, Abasian L, Meymand FT (2011) Влияние инфекции Toxoplasma gondii на уровень тестостерона и кортизола в плазме и индекс стресса у пациентов, направленных в больницу Сина, Тегеран.JJM. 4: 167-173.
- Mahbodfar HR, Yousefi-Razin E, Saki J, Rafiei A, Khademvatan S (2015) Исследование роли скрытой токсоплазмы gondii в уровне тестостерона, ДГЭА, кортизола и пролактиновых гормонов у молодых людей. Asian J Epidemiol. 8: 64-71.
- Webster JI, Tonelli L, Sternberg EM (2002) Нейроэндокринная регуляция иммунитета. Анну Рев Иммунол 20: 125-163. [Crossref]
- Dzitko K1, Dziadek B, Gatkowska J, DÅ‚ugoÅska H (2013) Toxoplasma gondii связывает овечий пролактин. Exp Parasitol 134: 216-219. [Crossref]
диффузное МРТ исследование в британском Биобанке
% PDF-1.7 % 1 0 объект > / Метаданные 4 0 R / Страницы 2 0 R / StructTreeRoot 3 0 R / Тип / Каталог / Средство просмотра Предпочтения 5 0 R >> эндобдж 4 0 obj > поток application / pdf
Тестостерон стимулирует рост и секреторную активность женской простаты в Взрослая песчанка (Meriones unguiculatus) 1 | Биология размножения
Аннотация
Простата самки песчанки ( Meriones unguiculatus ) похожа на предстательную железу женщины (Скинская железа) человека и, несмотря на ее уменьшенный размер, функциональна и проявляет секреторную активность. Однако о его физиологической регуляции практически ничего не известно.Таким образом, это исследование было предпринято для оценки поведения предстательной железы самок песчанок в гиперандрогенном состоянии. Взрослые самки получали подкожные инъекции ципионата тестостерона (1 мг / кг массы тела каждые 48 ч) до 21 дня. Контролируют циркулирующие уровни тестостерона и эстрадиола, а простату и яичники — структурные и иммуноцитохимические анализы. Лечение привело к устойчивому высокому уровню циркулирующего тестостерона и вызвало временное повышение уровня эстрадиола.Наблюдалось усиление пролиферации эпителиальных клеток, сопровождающееся значительной реорганизацией эпителия и очевидным снижением секреторной активности с последующим прогрессивным увеличением объемной плотности просвета и накоплением секреторных продуктов. Иммуноцитохимия определила экспрессию рецептора андрогена и антигена, связанного с простатоспецифическим антигеном (ПСА), в эпителиальных клетках предстательной железы. Также был обнаружен циркулирующий антиген, связанный с ПСА, и его концентрация показала сильную отрицательную корреляцию с циркулирующим эстрогеном.Эпителиальная дисплазия была обнаружена в простате у пролеченных женщин. Анализ яичников показал наличие поликистоза и гиперплазии стромальных клеток. Результаты показывают, что тестостерон оказывает стимулирующее действие на женскую простату, вызывая пролиферацию эпителиальных клеток, дифференцировку, секреторную активность и дисплазию. Результаты также предполагают, что рост и активность предстательной железы, поликистоз яичников и гиперплазия стромальных клеток яичников связаны с гиперандрогенным состоянием у женщин.
Введение
Простата самки взрослой песчанки показывает парауретральное расположение, демонстрируя тесный контакт со стенкой уретры в дистальной и средней частях. Гистологией и ультраструктурным анализом были выделены два типа секреторных клеток. Первая — это типичная секреторная клетка простаты. Второй характеризуется уникальным набором секреторных органелл и был назван прозрачной секреторной клеткой из-за его бледного цвета после окрашивания HE.Хотя во взрослом возрасте она достигает очень ограниченного размера, простата самок песчанок морфологически сходна с вентральной долей простаты постпубертатных самцов [1]. Гистохимические и ультраструктурные аспекты железы позволили нам предположить, что она секретирует гликопротеины функционально и конститутивно [1, 2].
Несмотря на растущее количество сообщений о структурных характеристиках женской простаты разных видов [3–8], включая человека [9, 10], упоминание этого органа все еще вызывает разногласия среди людей, занимающихся женским здоровьем.Более того, ее небольшой размер привел некоторых авторов к выводу, что женская простата является рудиментарной железой [4, 11, 12].
Андрогены регулируют рост, дифференцировку и выживаемость мужских клеток простаты [13, 14]. Тестостерон и его производное, дигидротестостерон, наряду с другими гормонами, такими как эстроген и пролактин, регулируют физиологию простаты как во время развития, так и во взрослом возрасте [15–18]. Хотя Завячич [9] предположил, что деятельность этой железы регулируется стероидными гормонами, влияние андрогенов на этот орган неясно.
Андрогены играют важную роль в регуляции и развитии женской мочеполовой системы. Это подтверждается тем фактом, что рецепторы андрогенов были идентифицированы в различных органах, таких как яичники, яйцеводы и матка [19]. Иммуногистохимические исследования показали, что рецепторы андрогенов также присутствуют в женской простате человека (парауретральная железа Скина), что предполагает роль андрогенов в поддержании структуры и функционального состояния простаты в женском организме [10, 12].
Нам казалось важным исследовать, регулируют ли андрогены рост и активность женской предстательной железы, сравнивая эффекты этих гормонов с эффектами, наблюдаемыми у мужчин. Кроме того, эта модель может иметь некоторые клинические последствия, потому что 1) женщины страдают дисбалансом стероидных гормонов после менопаузы, 2) гиперандрогенизм не является необычным для некоторых групп населения, 3) использование андрогенов для адъювантной терапии транссексуалов от женщины к мужчине является обычным явлением. [20], и 4) его введение культуристам и спортсменкам-спортсменкам является распространенной (хотя и незаконной) процедурой.
Таким образом, целью настоящего исследования было оценить реакцию предстательной железы взрослой самки песчанки на экспериментальное введение тестостерона, моделируя гиперандрогенное состояние, с использованием серии структурных и иммуноцитохимических анализов.
Результаты, представленные здесь, демонстрируют, что эпителиальные клетки предстательной железы самок песчанок экспрессируют рецептор андрогенов и секретируют антиген, связанный с простатоспецифическим антигеном (PSA). Что наиболее важно, наши результаты показывают, что экзогенный тестостерон вызывает рост простаты в результате пролиферации, дифференцировки, секреторной активности и дисплазии эпителиальных клеток, а также влияет на концентрацию циркулирующих эстрадиола и ПСА, которые показали высокую отрицательную корреляцию друг с другом.Более того, мы также наблюдали, что лечение тестостероном приводит к поликистозу яичников, гиперплазии стромальных клеток яичников и утолщению стенки уретры. Взятые вместе, результаты показывают, что, помимо многих побочных эффектов, введение андрогенов женщинам может также привести к аномальному росту и дисплазии предстательной железы.
Материалы и методы
Животные и экспериментальный дизайн
Восемьдесят семь самок песчанок в возрасте 3 месяцев ( Meriones unguiculatus , Gerbillinae : Muridae ).Семьдесят одно животное получало внутрикожные инъекции тестостерона (1 мг / кг тестостерона ципионата [Novaquímica / Sigma Pharma, Hortolândia, São Paulo, Brazil] в 0,25 мл кукурузного масла) через день после начала лечения [21] и были разделены на группы, которые были подвергнуты различным анализам. Контрольным животным вводили кукурузное масло через день в течение 21 дня. Обработанных животных умерщвляли через 3, 7, 14 или 21 день лечения. После анестезии путем ингаляции CO 2 животных взвешивали и немедленно декапитировали.У некоторых из них были взяты образцы крови для серологического анализа, и простатический комплекс (уретра и прилегающие ткани) был вырезан, взвешен и зафиксирован в соответствии с различными протоколами, как указано ниже. Те, которые нелегко отделить от прилипшей ткани, не взвешивались. Яичники также собирали для оценки гистологических изменений, вызванных введением тестостерона. Обращение с животными и эксперименты проводились в соответствии с этическими принципами Государственного университета Кампинаса в соответствии с Руководством по уходу и использованию лабораторных животных .Большой размер образца, использованный в этой работе, был оправдан небольшим размером органа и большим количеством использованных аналитических процедур.
Уровни общего тестостерона, эстрадиола и ПСА в плазме
Уровни тестостерона, эстрадиола и ПСА в плазме крови определяли с помощью иммунохимических анализов. Кровь собирали сердечной пункцией непосредственно перед смертью и через 24 часа после последней инъекции тестостерона (за исключением дня 14, образец для которого собирали через 48 часов после последней инъекции).Плазму отделяли центрифугированием и хранили при -20 ° C для последующих анализов. Измерения проводились в двух экземплярах с использованием автоматизированного оборудования Vitros-ECi-Johnson & Johnson для сверхчувствительного хемилюминесцентного обнаружения. Чувствительность составляла 0,1–150 нг / мл для тестостерона, 0,1–3 814 пг / мл для эстрадиола и 0,1–100 нг / мл для человеческого ПСА. Вариации внутри анализа составляли 1%, 1,1% и 0,97%, а вариации между анализами составляли 2,1%, 1,5% и 1,75% для тестостерона, эстрадиола и человеческого ПСА соответственно.
Морфологический анализ
Уретру, прилегающие ткани и яичники фиксировали путем погружения в раствор Карновского (5% параформальдегид, 2,5% глутаральдегид в 0,1 М фосфатном буфере, pH 7,2) или в растворе Буэна на 24 часа. После фиксации ткани промывали проточной водопроводной водой, дегидратировали в серии этанола, очищали в ксилоле, заливали парафином (Histosec; Merck, Дармштадт, Германия) или гликольметакрилатной смолой (набор для заливки Historesin; Leica, Nussloch, Германия). и разрезать на срезы 3 мкм с помощью автоматического ротационного микротома Leica RM2155.Срезы женской простаты и яичников окрашивали гематоксилин-эозином [22]. Реакцию Фельгена на ДНК использовали для подсчета митотических клеток. Нейтральные углеводы идентифицировали с помощью периодического кислотного теста Шиффа (PAS) [22]. Образцы анализировали и фотографировали с помощью светового микроскопа Zeiss Jenaval (Zeiss-Jenaval, Йена, Германия) или светового микроскопа Olympus BX60 (Olympus, Гамбург, Германия).
Морфометрия и стереология
Относительный объем тканевых компартментов был определен в соответствии с процедурой Weibel [23] с использованием тестовой системы с сеткой из 168 точек, примененной к простате самца крысы Huttunen et al.[24] и Гарсия-Флорез и др. [25]. Случайным образом было выбрано двадцать микроскопических полей. Объемная плотность рассчитывалась после подсчета количества точек, которые совпадали с каждым из отделов ткани (эпителий, просвет или строма). Абсолютные объемы не могли быть определены, потому что было невозможно отделить женскую простату от прилегающей ткани и определить ее вес.
Число ацинарных профилей на простату было подсчитано после серийных срезов. Относительную площадь сечения просвета измеряли с помощью программного обеспечения NIH Image J (доступно по адресу http: // rsb.info.nih.gov/ij/; Национальные институты здоровья, Бетезда, Мэриленд). Вкратце, просвет искусственно окрашивали, а площадь его сечения измеряли в квадратных пикселях. Подсчитывали количество секреторных, прозрачных и базальных эпителиальных клеток на альвеолу, и индивидуальный вклад каждого типа клеток выражали в процентах. Морфометрический анализ также включал определение высоты эпителиальных клеток, соотношения ядро / цитоплазма, площади ядра (мкм 2 ), периметра ядра (мкм) и форм-фактора (4π × площадь ядра / [ядерный периметр] 2 ).
Для количественной оценки митотических клеток исследовали окрашенные по Фельгену срезы и оцифровали 10 ацинусов. Подсчитывали общее количество ядер на ацинус и количество митотических фигур. Результаты представлены как процент митотических клеток.
Иммуноцитохимия
Срезы фиксированной по Буэну простаты были подвергнуты иммуноцитохимии для обнаружения ПСА и рецептора андрогенов (AR), как описано в другом месте [26, 27]. Мышиный моноклональный иммуноглобулин G1 против PSA и кроличьи поликлональные антитела против AR (SC-7316 и SC-816, соответственно; Santa Cruz Biotechnology, Санта-Крус, Калифорния) использовали в разведении 1: 100.Конъюгированные с пероксидазой специфические антитела (Sigma Chemical Co., Сент-Луис, Миссури) и 3,3′-диаминобензидин использовали в качестве вторичных антител и субстрата пероксидазы соответственно. Срезы контрастировали гематоксилином Гарриса или метиловым зеленым.
Трехмерная реконструкция
После гистологической обработки целые простаты (контрольные и обработанные тестостероном) были серийно разделены на 5 мкм и окрашены гематоксилин-эозином, как описано выше. Захват и обработка изображений проводились с помощью Analysis 3.2 (сборка 743; Digivision – SIS, Сан-Диего, Калифорния). После совмещения изображений мочеиспускательный канал, протоки предстательной железы и альвеолы были изолированы на каждом изображении, а затем обработаны для получения границы раздела в каждом срезе, таким образом создавая трехмерную (3-D) модель [28]. Здесь важно упомянуть, что это программное обеспечение не могло работать с тупиковыми структурами, такими как ацинусы предстательной железы, и на изображениях видны тупые концы на концах.
Статистический анализ
Данные были проанализированы с помощью программы Statistica 6.0 (StarSoft, Inc., Талса, Оклахома). Тесты гипотез, использованные для определения статистической значимости, представляли собой тест Крускала-Уоллиса, ANOVA, тест множественного сравнения Тьюки или критерий медианы с уровнем значимости, установленным на 5% ( P ≤ 0,05). Значения представлены в виде медианы или среднего ± 1 SD (небольшое количество измерений) или SEM (большое количество измерений) или в виде прямоугольных диаграмм, как требуется для более четкого представления данных.
Результаты
Масса тела и масса простаты
Таблица 1 показывает изменение веса тела и веса простатического комплекса.После 21 дня приема тестостерона масса тела увеличилась на 14,6%. Значительное увеличение веса простатического комплекса, включая всю уретру и предстательную железу, наблюдалось через 7 дней лечения. Относительный вес простатического комплекса увеличился примерно на 52% после 21 дня лечения, демонстрируя заметную специфичность роста простатического комплекса.
Таблица 1Масса тела и простатического комплекса у контрольных женщин и женщин, получавших тестостерон (среднее ± SEM)
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Масса тела (г) | 59,1 ± 4,2 a (n = 6) | 58,0 ± 1,3 a (n = 7) | 62,6 ± 1,5 a (n = 9) | 63.7 ± 1,7 a (n = 6) | 67,7 ± 1,4 b (n = 9) |
| Масса простатического комплекса (г) | 0,091 ± 0,011 a | 0,091 ± 0,008 a | 0,139 ± 0,008 b | 0,136 ± 0,013 b | 0,157 ± 0,009 b |
| Относительный вес † | 0,0015 ± 0,0001 | 0.0022 ± 0,0001 b | 0,0022 ± 0,0002 b | 0,0023 ± 0,0001 b | |
| Относительное изменение веса (%) ‡ | — | +3,6 | ++52,3 | ||
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Масса тела (г) | 59,1 ± 4,2 a (n = 6) | 58,0 ± 1,3 a (n = 7) | 62,6 ± 1,5 a (n = 9) | 63,7 ± 1,7 a (n = 6) | 67,7 ± 1,4 b (n = 9) |
| Масса простатического комплекса (г) | 0,091 ± 0,011 a | 0.091 ± 0,008 a | 0,139 ± 0,008 b | 0,136 ± 0,013 b | 0,157 ± 0,009 b |
| Относительный вес † 0 | 90,000328 0,0015 ± 0,0001 a0,0022 ± 0,0001 b | 0,0022 ± 0,0002 b | 0,0023 ± 0,0001 b | ||
| Относительное изменение веса (%) | ‡— | 6 | +47,1 | +41,7 | +52,3 |
Вес тела и комплекса предстательной железы у контрольных самок и самок, получавших тестостерон (среднее ± SEM)
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Масса тела (г) | 59,1 ± 4,2 a (n = 6) | 58,0 ± 1,3 a (n = 7) | 62,6 ± 1,5 a (n = 9) | 63,7 ± 1,7 a (n = 6) | 67,7 ± 1,4 b (n = 9) |
| Масса простатического комплекса (г) | 0,091 ± 0,011 a | 0,091 ± 0,008 а | 0,139 ± 0,008 б | 0.136 ± 0,013 b | 0,157 ± 0,009 b |
| Относительная масса † | 0,0015 ± 0,0001 a | 0,0016 ± 0,0001 a 0,00309 ± 0,0002 b | 0,0023 ± 0,0001 b | ||
| Относительное отклонение веса (%) ‡ | — | +3,6 | +47,1 | +41,7 | 3 |
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Масса тела (г) | 59,1 ± 4,2 a (n = 6) | 58,0 ± 1,3 a (n = 7) | 62.6 ± 1,5 a (n = 9) | 63,7 ± 1,7 a (n = 6) | 67,7 ± 1,4 b (n = 9) |
| Масса простатического комплекса (г) | 0,091 ± 0,011 a | 0,091 ± 0,008 a | 0,139 ± 0,008 b | 0,136 ± 0,013 b | 0,157 ± 0,009 b |
| 0.0016 ± 0,0001 a | 0,0022 ± 0,0001 b | 0,0022 ± 0,0002 b | 0,0023 ± 0,0001 b | ||
| Относительное изменение веса (%)0 — | +47.1 | +41.7 | +52.3 | ||
Уровни сывороточного стероидного гормона и антигена, связанного с ПСА
Уровни сывороточного стероидного гормона и антигена, связанного с ПСА, показаны на рисунке 1.Как и ожидалось, введение экзогенного тестостерона привело к устойчивому высокому уровню циркулирующего тестостерона, достигающему 19 ± 2,1 нг / мл после 21 дня лечения. Этот устойчивый уровень примерно в 12 раз превышал нормальный уровень циркулирующего тестостерона у самок песчанок (рис. 1А). Лечение тестостероном вызывало значительное повышение уровней циркулирующего эстрадиола, что соответствовало удвоенной концентрации, наблюдаемой в контроле на третий день лечения. Однако это повышение было временным, и, несмотря на устойчивый высокий уровень тестостерона, эстрадиол вернулся к контрольным уровням через 21 день лечения, при этом к 7-му дню лечения не наблюдалось значительной разницы (рис.1Б).
Рис. 1
Абсолютные вариации сывороточного тестостерона ( A ), эстрадиола (E2) ( B ) и уровней антигена, связанного с ПСА ( C ), у самок песчанок во время лечения тестостероном. Наблюдайте за значительным увеличением E2 только в самый ранний момент (3 дня) лечения, и что не было значительных изменений в уровнях антигена, связанного с PSA, хотя снижение было отмечено в начале введения тестостерона.Отсутствие значимости в значительной степени связано с высокой индивидуальной вариабельностью уровней антигена, связанного с ПСА. Значения представляют собой средние значения ± SEM (n = 5)
Рис.1
Абсолютные вариации сывороточного тестостерона ( A ), эстрадиола (E2) ( B ) и уровней антигена, связанного с ПСА ( C ) в самка песчанки во время лечения тестостероном. Наблюдайте за значительным увеличением E2 только в самый ранний момент (3 дня) лечения, и что не было значительных изменений в уровнях антигена, связанного с PSA, хотя снижение было отмечено в начале введения тестостерона.Отсутствие значимости в значительной степени связано с высокой индивидуальной вариабельностью уровней антигена, связанного с ПСА. Значения представляют собой средние значения ± стандартная ошибка среднего (n = 5)
Концентрация антигена, связанного с ПСА, в сыворотке крови у контрольных самок составляла 0,156 нг / мл (рис. 1С). Лечение тестостероном вызывало незначительное снижение уровней ПСА, которые постепенно возвращались к контрольным уровням в течение продолжительности эксперимента, без каких-либо различий по сравнению с контролем, наблюдаемых через 7, 14 или 21 день (рис. 1C). Хотя значимой корреляции между тестостероном и концентрацией антигена, связанного с ПСА, не наблюдалось, наблюдалась высокая отрицательная корреляция между уровнями эстрадиола и уровня антигена, связанного с ПСА (r = -0.98). С другой стороны, корреляция между уровнями эстрадиола и тестостерона была очень низкой. Эта низкая корреляция была связана с заметной диссоциацией между самыми высокими концентрациями тестостерона, которые были связаны со снижением уровня эстрадиола. Более низкие концентрации циркулирующего тестостерона показали положительную корреляцию с уровнями эстрадиола (r = 0,86). Этот эффект был более очевиден в диапазоне концентраций тестостерона 13-17,5 нг / мл, представляя очень высокий коэффициент корреляции (r = 0.99).
Морфологические аспекты и изменения, вызванные лечением тестостероном
Простата самки песчанки установила тесный контакт со средней и дистальной частями стенки уретры. Этот орган образован небольшой группой желез и протоков, рассредоточенных в плотной строме. Железы выстланы мелкими кубовидными или умеренно высокими призматическими клетками (рис. 2, А и В). Эти железы обычно включают объемный просвет, содержащий PAS-положительный секрет (рис.2С). Были идентифицированы два различных типа эпителиальных клеток: секреторные и базальные клетки (рис. 2B). Секреторные клетки контактировали с просветом железы и преобладали в эпителии предстательной железы. Эти клетки характеризовались большими парабазальными ядрами и ацидофильной цитоплазмой. Было обнаружено, что PAS-положительный секреторный материал накапливается близко к апикальной поверхности (рис. 2C). Некоторые хромофобные секреторные клетки, ранее названные светлыми клетками [1], были вкраплены среди общих секреторных клеток.Базальные клетки располагались между секреторными клетками. Эти клетки были меньше и реже секреторных клеток и имели неправильную эллиптическую форму.
Рис. 2
Гистологические срезы нормальной женской простаты, окрашенные гематоксилин-эозином или PAS ( C , F , I и L ). A ) Общий вид предстательной железы с небольшим кубовидным эпителием (ep) и объемным просветом, в котором откладываются продукты секреции (звездочка). B ) Деталь эпителия, показывающая основные эпителиальные клетки. В строме наблюдается многослойное расположение гладкомышечных клеток. C ) PAS-окрашивание эпителия предстательной железы показывает присутствие секреторного материала, богатого нейтральными полисахаридами, накопленными в апикальной части эпителиальных клеток (прямоугольник и стрелка) и в просвете. D ) Внешний вид женской предстательной железы через 3 дня после начала лечения. Обратите внимание, что эпителий гиперпластичен, демонстрирует множество складок и наличие внутриэпителиальных пузырьков (или дуг [стрелка]). E ) Более высокое увеличение эпителия демонстрирует, что клетки выше и накапливают базофильный материал в апикальной части цитоплазмы. Стрелка указывает на базальную ячейку. F ) PAS-окрашивание эпителия, показывающее уменьшение окрашивания апикальной части основных эпителиальных клеток (прямоугольник) и увеличение количества прозрачных клеток (стрелка), которые, по-видимому, сильно окрашены нейтральными полисахаридами (звездочка) . G ) Аспект эпителия предстательной железы женщины, получавшей в течение 7 дней тестостерон.Обратите внимание на увеличение плотности эпителиальных клеток и их менее организованное расположение в эпителиальном слое. Стрелка указывает на интраэпителиальный пузырь. H ) Деталь эпителиального слоя, подтверждающая аспекты, наблюдаемые при малом увеличении. I ) PAS-окрашивание эпителия. В рамке показаны некоторые основные эпителиальные клетки, содержащие очень мало PAS-положительного материала по сравнению с контрольными клетками. Звездочки указывают на некоторые светлые клетки, которые учащаются в эпителии после лечения тестостероном. J ) Внешний вид предстательной железы после 14 дней лечения тестостероном. Обратите внимание на высокую плотность эпителиальных клеток в эпителиальном слое. K ) Деталь высоких эпителиальных клеток, содержащих некоторый базофильный материал в апикальной части цитоплазмы и множество неокрашенных пузырьков, разбросанных по клетке. L ) PAS-окрашивание демонстрирует, что эпителиальная клетка медленно восстанавливает окрашивание, наблюдаемое в контрольных клетках (прямоугольник), и что количество ярко окрашенных PAS-окрашенных светлых клеток (звездочки) еще больше. M ) Общий вид предстательной железы после 21 дня лечения тестостероном. Обратите внимание на наличие мелких эпителиальных структур и наличие интраэпителиальных пузырьков. Деталь ( N ) показывает, что эпителиальные клетки меньше в этот момент времени. Стрелка указывает на чистую ячейку. O ) PAS-окрашивание выявляет присутствие PAS-положительного материала в апикальной части основных эпителиальных клеток (прямоугольник), что более похоже на то, что наблюдалось в контроле.Количество светлых ячеек еще больше (звездочки). Штанги = 50 мкм ( A , D и G ), 15 мкм ( B , C , E , F , H — J и M — O ), 10 мкм ( K и L )
Рис.2
Гистологические срезы нормальной женской простаты, окрашенные гематоксилин-эозином или PAS ( C , F , I , и L ). A ) Общий вид предстательной железы с небольшим кубовидным эпителием (ep) и объемным просветом, в котором откладываются продукты секреции (звездочка). B ) Деталь эпителия, показывающая основные эпителиальные клетки. В строме наблюдается многослойное расположение гладкомышечных клеток. C ) PAS-окрашивание эпителия предстательной железы показывает присутствие секреторного материала, богатого нейтральными полисахаридами, накопленными в апикальной части эпителиальных клеток (прямоугольник и стрелка) и в просвете. D ) Внешний вид женской предстательной железы через 3 дня после начала лечения. Обратите внимание, что эпителий гиперпластичен, демонстрирует множество складок и наличие внутриэпителиальных пузырьков (или дуг [стрелка]). E ) Более высокое увеличение эпителия демонстрирует, что клетки выше и накапливают базофильный материал в апикальной части цитоплазмы. Стрелка указывает на базальную ячейку. F ) PAS-окрашивание эпителия, показывающее уменьшение окрашивания апикальной части основных эпителиальных клеток (прямоугольник) и увеличение количества прозрачных клеток (стрелка), которые, по-видимому, сильно окрашены нейтральными полисахаридами (звездочка) . G ) Аспект эпителия предстательной железы женщины, получавшей в течение 7 дней тестостерон. Обратите внимание на увеличение плотности эпителиальных клеток и их менее организованное расположение в эпителиальном слое. Стрелка указывает на интраэпителиальный пузырь. H ) Деталь эпителиального слоя, подтверждающая аспекты, наблюдаемые при малом увеличении. I ) PAS-окрашивание эпителия. В рамке показаны некоторые основные эпителиальные клетки, содержащие очень мало PAS-положительного материала по сравнению с контрольными клетками.Звездочки указывают на некоторые светлые клетки, которые учащаются в эпителии после лечения тестостероном. J ) Внешний вид предстательной железы после 14 дней лечения тестостероном. Обратите внимание на высокую плотность эпителиальных клеток в эпителиальном слое. K ) Деталь высоких эпителиальных клеток, содержащих некоторый базофильный материал в апикальной части цитоплазмы и множество неокрашенных пузырьков, разбросанных по клетке. L ) PAS-окрашивание демонстрирует, что эпителиальная клетка медленно восстанавливает окрашивание, наблюдаемое в контрольных клетках (прямоугольник), и что количество ярко окрашенных PAS-окрашенных светлых клеток (звездочки) еще больше. M ) Общий вид предстательной железы после 21 дня лечения тестостероном. Обратите внимание на наличие мелких эпителиальных структур и наличие интраэпителиальных пузырьков. Деталь ( N ) показывает, что эпителиальные клетки меньше в этот момент времени. Стрелка указывает на чистую ячейку. O ) PAS-окрашивание выявляет присутствие PAS-положительного материала в апикальной части основных эпителиальных клеток (прямоугольник), что более похоже на то, что наблюдалось в контроле.Количество светлых ячеек еще больше (звездочки). Штанги = 50 мкм ( A , D и G ), 15 мкм ( B , C , E , F , H — J и M — O ), 10 мкм ( K и L )
После экспериментального введения тестостерона в эпителиальном отделе предстательной железы женщин наблюдались многие морфологические изменения. После 3 дней лечения наблюдалось заметное увеличение высоты эпителия предстательной железы, при этом эпителий имел псевдостратифицированный столбчатый тип с преобладанием высоких эпителиальных клеток, расположенных в частых эпителиальных складках (рис.2, Г и Д). Секреторные клетки демонстрировали легко наблюдаемую хромофобную надъядерную область и апикальное скопление ацидофильного материала (рис. 2E), чего не наблюдалось в контрольных образцах. Одним из наиболее очевидных эпителиальных изменений, вызванных 3-дневным лечением тестостероном, было появление внутриэпителиальных пузырьков в ацинусах предстательной железы (рис. 2D, стрелка), которые наблюдались между двумя эпителиальными слоями. В большинстве случаев апикальная поверхность нижнего клеточного слоя контактировала с содержимым везикулы, тогда как базальная поверхность верхнего клеточного слоя ограничивала везикулу, а ее апикальная поверхность контактировала с основным просветом железы.Базальные клетки обычно наблюдались в эпителии (рис. 2E), но не наблюдались в клеточных слоях, которые формировали интраэпителиальные пузырьки. Окрашивание PAS выявило потерю апикального окрашивания, наблюдаемую в большинстве секреторных клеток простаты, обработанной носителем, и появление групп секреторных клеток, цитоплазма которых была заполнена нейтральными гликоконъюгатами (фиг. 2F).
Более длительное воздействие экзогенного тестостерона привело к дальнейшему росту железы. Гистологические аспекты, описанные для третьего дня, стали более выраженными после 7 и 14 дней лечения (рис.2, G, H, J и K соответственно). К 14 дню секреторные клетки были еще выше, а частота эпителиальных складок и эпителиальных пузырьков была выше (рис. 2, G и J). Также увеличивалось количество глубоко окрашенных PAS-положительных клеток (рис. 2, I и L).
Резкая перестройка железы наблюдалась через 21 день лечения. Эпителиальные клетки были значительно короче (рис. 2, M и N), несмотря на сохранение хромофобной надъядерной области. Количество светлых клеток, которые были редкими в нормальной простате и увеличивались к 7-м и 14-м дням, также увеличивалось после 21 дня лечения.На этом этапе интраэпителиальных пузырьков было мало. Повышенное ацидофильное апикальное окрашивание, наблюдаемое в секреторных клетках эпителия, почти исчезло (рис. 2N). Точно так же исчезновение апикального окрашивания PAS также было временным, и к 21 дню секреторные клетки снова показали это апикальное окрашивание. Очаги, содержащие PAS-положительные клетки, были меньше, но очень часты (рис. 20).
Морфометрия
Морфометрические результаты представлены в таблице 2.Наблюдалось значительное увеличение среднего количества эпителиальных клеток на ацинарный профиль после 7 дней лечения тестостероном. Большее количество сохранялось до 21 дня лечения. Светлые клетки чаще встречались среди эпителиальных клеток и соответствовали 7,2% эпителиальных клеток после 21 дня лечения тестостероном по сравнению с 1,6% в контрольных тканях. Эта повышенная частота привела к значительному снижению процента секреторных клеток. С другой стороны, количество базальных клеток оставалось относительно постоянным, начиная от 7.От 9% до 8,5% эпителиальных клеток. Высота эпителия значительно изменилась во время лечения тестостероном, от ~ 14,4 мкм в контроле до 23,6 мкм через 14 дней лечения. После 21 дня лечения наблюдалось укорочение эпителия, которое стало неотличимым от контроля.
Таблица 2 Типы эпителиальных клеток, морфометрические и кариометрические данные, полученные для женской простаты во время лечения тестостероном (среднее ± стандартное отклонение)
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Частота типов эпителиальных клеток (%) † | |||||
| Секреторные клетки | 90,4 ± 2,2 a | 86,1 ± 2,1 b | 86.1 ± 2,0 b | 86,7 ± 1,2 b | 84,9 ± 2,3 b |
| Чистые секреторные клетки | 1,6 ± 1,2 a | 5,7 ± 1,8 b | b5,4 ± 1,1 b | 7,2 ± 2,4 c | |
| Базальные клетки | 8,0 ± 1,8 | 8,2 ± 1,6 | 8,6 ± 1,3 | 7,9 ± 0,9 | 90.9 ± 1,4|
| Количество эпителиальных клеток / ацинус | 92,7 ± 5,8 a | 89,3 ± 12,3 a | 156,2 ± 12,8 b | 126,5 ± 8,4 132 b 8,3 b | |
| Морфометрические данные ‡ | |||||
| Высота секреторной клетки (мкм) | 14,4 ± 3,9 a | 21,8 ± 5,7 b | 239.3 ± 4,8 c | 14,8 ± 4,2 a | |
| Кариометрические данные ‡ | |||||
| Отношение ядро / цитоплазма | 0,24 ± 0,05 a | 0,08 ± 0,05 a0,20 ± 0,03 b | 0,22 ± 0,04 a | ||
| Площадь ядра (мкм 2 ) | 23 ± 5,4 a | 7328 28,80 b29,6 ± 6,6 b | 30,3 ± 6,1 b | 27,8 ± 6,5 b | |
| Периметр ядра (мкм) | 19,5 ± 2,5 a| b | 22 ± 2,6 b | 22,1 ± 2,4 b | 20,9 ± 2,6 c | |
| Ядерный форм-фактор | 0,76 ± 0,08 a | 0,083220.77 ± 0,10 a | 0,78 ± 0,09 b | 0,8 ± 0,08 b | |
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Частота типов эпителиальных клеток (%) † | |||||
| Секреторные клетки | 90.4 ± 2,2 a | 86,1 ± 2,1 b | 86,1 ± 2,0 b | 86,7 ± 1,2 b | 84,9 ± 2,3 b |
| 90 секреторные клетки 32 1,6 ± 1,2 a | 5,7 ± 1,8 b | 5,3 ± 1,2 b | 5,4 ± 1,1 b | 7,2 ± 2,4 c | |
| Базальные клетки | 8,0328 1,82 ± 1,6 | 8,6 ± 1,3 | 7,9 ± 0,9 | 7,9 ± 1,4 | |
| Количество эпителиальных клеток / ацинус | 92,7 ± 5,8 a | 89,3 ± 12,3 a | ± 12328 b126,5 ± 8,4 b | 132,8 ± 8,3 b | |
| Морфометрические данные ‡ | |||||
| Высота секреторной клетки | 14,48 ± 5,7 b | 23,6 ± 4,9 c | 23,3 ± 4,8 c | 14,8 ± 4,2 a | |
| Кариометрические данные ‡ | 0,23 ± 0,05 a | 0,23 ± 0,05 a | 0,20 ± 0,03 b | 0,22 ± 0,04 a | |
| 23 ± 5.4 a | 28,8 ± 7,0 b | 29,6 ± 6,6 b | 30,3 ± 6,1 b | 27,8 ± 6,5 b | |
| Ядерный периметр a | 21,9 ± 2,7 b | 22 ± 2,6 b | 22,1 ± 2,4 b | 20,9 ± 2,6 c | |
| Форм-фактор ядра a 9037 0,08328 | 0.75 ± 0,08 a | 0,77 ± 0,10 a | 0,78 ± 0,09 b | 0,8 ± 0,08 b | |
Типы эпителиальных клеток и морфометрические и кариологические данные, полученные для женской простаты во время лечения тестостероном (среднее ± стандартное отклонение)
| Параметр . | Управление (автомобиль) * . | Лечение тестостероном * . | |||
|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | ||
| Частота типов эпителиальных клеток (%) † | |||||
| Секреторные клетки | 90,4 ± 2,2 a | 86,1 ± 2,1 b | 0 86,1 ± 2,0 ± 1,2 b84,9 ± 2,3 b | ||
| Чистые секреторные клетки | 1.6 ± 1,2 a | 5,7 ± 1,8 b | 5,3 ± 1,2 b | 5,4 ± 1,1 b | 7,2 ± 2,4 c |
| Базальные клетки | 8,2 ± 1,6 | 8,6 ± 1,3 | 7,9 ± 0,9 | 7,9 ± 1,4 | |
| Количество эпителиальных клеток / ацинус | 92,7 ± 5,8 a | 89,3 ± 12,3 a| 15309 | 12.8 b | 126,5 ± 8,4 b | 132,8 ± 8,3 b |
| Морфометрические данные ‡ | |||||
| Высота секреторной клетки (мкм) | 14,4 ± 5,7 b | 23,6 ± 4,9 c | 23,3 ± 4,8 c | 14,8 ± 4,2 a | |
| Кариометрические данные ‡ | |||||
| Отношение Nucleasplus24 ± 0,05 a | 0,23 ± 0,05 a | 0,23 ± 0,05 a | 0,20 ± 0,03 b | 0,22 ± 0,04 a | |
| Ядерная зона | 23 ± 5,4 a | 28,8 ± 7,0 b | 29,6 ± 6,6 b | 30,3 ± 6,1 b | 27,8 ± 6,5 b | 19.5 ± 2,5 a | 21,9 ± 2,7 b | 22 ± 2,6 b | 22,1 ± 2,4 b | 20,9 ± 2,6 c |
| 0,0328 9 ядерный форм-фактор a | 0,75 ± 0,08 a | 0,77 ± 0,10 a | 0,78 ± 0,09 b | 0,8 ± 0,08 b | |
Отношение ядро клетки / цитоплазма показало временное снижение к 14 дню лечения (таблица 2). Также были обнаружены изменения ядерной структуры. Площадь и периметр ядра показали прогрессивное увеличение до 14-го дня лечения с последующим небольшим снижением этих ядерных параметров на 21-й день. Форм-фактор, выражающий округлость ядра, был немного увеличен после более длительных периодов лечения тестостероном (i .е., 14 и 21 день). Значения, близкие к 1, указывают на то, что ядро клетки более круглое и менее эллиптическое, что наблюдается через 14 и 21 день лечения. Изменения площади ядра, периметра и форм-фактора были статистически значимыми (таблица 2).
Объемная плотность отделов тканей
Стереологические данные, полученные для нормальной и обработанной простаты, показаны в таблице 3. В простате контрольных животных строма занимала большую часть объема простаты (~ 40%) и оставалась относительно постоянной на протяжении всего лечения, показывая небольшое, незначительное уменьшение. после 21 дня лечения.Оставшийся объем почти поровну распределялся между эпителием и просветом (27,5% и 32% соответственно) у контрольных животных. Лечение тестостероном вызывало увеличение объемной плотности эпителия, которая достигла примерно 46% и 43% объема желез после 7 и 14 дней лечения, соответственно, возвращаясь к контрольным уровням к 21 дню. Увеличение плотности эпителиального объема уравновешивалось снижение объемной плотности просвета, которое, однако, стало более заметным, чем у контрольных животных, после 21 дня лечения.ANOVA показал, что изменения, наблюдаемые в эпителиальном компартменте в период лечения тестостероном, были значительными. Применение параметрического теста Тьюки продемонстрировало значительную разницу между группами. Не наблюдалось значительных различий между группой, получавшей лечение в течение 21 дня, и контрольной группой, или между группами, получавшими лечение в течение 7 и 14 дней. Поскольку не было групповых различий в плотности объема стромы, нельзя было применить парный тест для сравнения временных точек с контролем.Однако при лечении наблюдалось явное изменение объема просвета.
Таблица 3Изменение объемной плотности в эпителиальном, просветном и стромальном отделах предстательной железы женщины во время лечения экзогенным тестостероном (среднее ± SEM)
| Ткань . | Control (автомобиль) * . | Лечение тестостероном * . | ||||
|---|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | |||
| Эпителий | 27,5 ± 2,2 a | 38,7 ± 2,7 b | 46,3 ± 2,3 c | 43,0 ± 3,0 c | 43,0 ± 3,0 c | |
| Люмен | 31,9 ± 3,1 | 18,0 ± 2,0 | 14,9 ± 1,8 | 17,0 ± 3.0 | 42,7 ± 2,9 | |
| Строма | 40,6 ± 3,0 | 43,3 ± 3,1 | 38,8 ± 3,2 | 40,0 ± 3,0 | 31,0 ± 2,4 | |
(автомобиль) * .
Изменение объемной плотности эпителиального, просветного и стромального отделов предстательной железы женщины во время лечения экзогенным тестостероном (среднее ± SEM)
| Ткань . | Control (автомобиль) * . | Лечение тестостероном * . | ||||
|---|---|---|---|---|---|---|
| 3 дня . | 7 дней . | 14 дней . | 21 день . | |||
| Эпителий | 27,5 ± 2,2 a | 38,7 ± 2,7 b | 46,3 ± 2,3 c | 43,0 ± 3,0 c | 43,0 ± 3,0 c | |
| Люмен | 31,9 ± 3,1 | 18,0 ± 2,0 | 14,9 ± 1,8 | 17,0 ± 3.0 | 42,7 ± 2,9 | |
| Строма | 40,6 ± 3,0 | 43,3 ± 3,1 | 38,8 ± 3,2 | 40,0 ± 3,0 | 31,0 ± 2,4 | |
(автомобиль) * .
Число ацинарных профилей и площадь просвета
Анализ среднего количества ацинусов на железу показал, что тестостерон индуцировал увеличение количества ацинусов до 7-го дня лечения. В нормальной простате количество ацинарных профилей варьировалось от 7 до 14 (медиана = 13). Простаты, обработанные в течение 3 дней, имели 21–29 ацинусов (медиана = 24), а те, которые лечили в течение 7 дней, имели 35–48 ацинусов (медиана = 37).После этого наблюдалось постепенное снижение количества ацинарных профилей на каждую железу. Простаты, получавшие тестостерон в течение 14 дней, имели 19-30 ацинусов (медиана = 25), тогда как у тех, которые лечились в течение 21 дня, было 14-20 ацинусов (медиана = 19). Использование медианы было необходимо, потому что для каждой простаты учитывалась только медиальная часть, что приводило к очень небольшому количеству измерений. Хотя тест медианы не показал заметных различий, применение теста Краскела-Уоллиса выявило значительные различия между контрольной и экспериментальной группами.С другой стороны, площадь просвета в разрезе показала заметное увеличение на 14 и 21 день, демонстрируя прогрессирующее увеличение просвета и накопление секреторных продуктов (Таблица 4). Произведение среднего числа ацинарных профилей на площадь просвета сечения продемонстрировало, что уменьшение количества ацинусов не соответствовало уменьшению объема просвета (таблица 4).
Таблица 4Вариации числа ацинарных профилей и площади просвета женской простаты после лечения тестостероном
| Лечение . | Медиана No. ацинарных профилей . | Площадь просвета * (квадратные пиксели x10 3 ) (среднее ± SEM) . | Произведение среднего числа ацинарных профилей и площади просвета в сечении (x10 3 ) . | |||
|---|---|---|---|---|---|---|
| Контроль | 13 | 1,0 ± 0,8 | 27,3 | |||
| Тестостерон | ||||||
| 3 дня | 24 | 1.7 ± 0,6 | 41,2 | |||
| 7 дней | 37 | 1,3 ± 0,4 | 49,4 | |||
| 14 дней | 25 | 7,3 ± 1,9 | 176,8 | 7,3 ± 1,9 | 176,8 | 21303 |
| 42,9 ± 16,0 | 814,2 | |||||
| Лечение . | Медиана No. ацинарных профилей . | Площадь просвета * (квадратные пиксели x10 3 ) (среднее ± SEM) . | Произведение среднего числа ацинарных профилей и площади просвета в сечении (x10 3 ) . |
|---|---|---|---|
| Контроль | 13 | 1,0 ± 0,8 | 27,3 |
| Тестостерон | |||
| 3 дня | 24 | 1,7 ± 0,6 | |
| 41 | 1,3 ± 0,4 | 49,4 | |
| 14 дней | 25 | 7.3 ± 1,9 | 176,8 |
| 21 день | 19 | 42,9 ± 16,0 | 814,2 |
Вариации количества ацинарных профилей и площади сечения просвета женской простаты после лечения тестостероном
| Лечение . | Медиана No. ацинарных профилей . | Площадь просвета * (квадратные пиксели x10 3 ) (среднее ± SEM) . | Произведение среднего числа ацинарных профилей и площади просвета в сечении (x10 3 ) . |
|---|---|---|---|
| Контроль | 13 | 1,0 ± 0,8 | 27,3 |
| Тестостерон | |||
| 3 дня | 24 | 1,7 ± 0,6 | |
| 41 | 1,3 ± 0,4 | 49,4 | |
| 14 дней | 25 | 7.3 ± 1,9 | 176,8 |
| 21 день | 19 | 42,9 ± 16,0 | 814,2 |
| Лечение . | Медиана No. ацинарных профилей . | Площадь просвета * (квадратные пиксели x10 3 ) (среднее ± SEM) . | Произведение среднего числа ацинарных профилей и площади просвета в сечении (x10 3 ) . |
|---|---|---|---|
| Контроль | 13 | 1,0 ± 0,8 | 27,3 |
| Тестостерон | |||
| 3 дня | 24 | 1,7 ± 0,6 | |
| 41 | 1,3 ± 0,4 | 49,4 | |
| 14 дней | 25 | 7,3 ± 1,9 | 176,8 |
| 21 день | 19 | 42.9 ± 16,0 | 814,2 |
Пролиферация клеток
Митотические клетки были редкими в эпителии предстательной железы контрольных животных, от 0,7% до 1,3% всех эпителиальных клеток (рис. 3). Большое колебание частоты митотических клеток наблюдалось в простате животных, получавших лечение в течение 3 дней, с большим отклонением в сторону более высоких цифр (до 3,6%). Частота митотических клеток оставалась постоянной и составляла примерно такие же значения, полученные для контроля после более длительных периодов лечения тестостероном.Не наблюдалось статистически значимых различий в среднем количестве митотических клеток между разными периодами лечения согласно медиане и тесту Краскела-Уоллиса. Таким образом, различия между группами были обусловлены вариациями внутри группы, получавшей тестостерон в течение 3 дней, что показало примерно в 4 раза более высокое стандартное отклонение (1,1%), чем полученное для других групп (стандартное отклонение контроля = 0,3%; 7 дней = 0,5%; 14 дней = 0,2%; 21 день = 0,2%).
Рис. 3
Коробчатая диаграмма представляет средний процент митотических клеток на ацинус в контрольной и обработанной тестостероном женской простате.Экспериментальные группы представлены последовательно по времени введения тестостерона, где 0 = контроль. Графики соответствуют подсчетам 10 ацинусов для каждой экспериментальной группы.
Рис. 3
Коробчатая диаграмма представляет средний процент митотических клеток на ацинус в контрольной и обработанной тестостероном женской простате. Экспериментальные группы представлены последовательно по времени введения тестостерона, где 0 = контроль. Графики соответствуют подсчетам 10 ацинусов для каждой экспериментальной группы
Трехмерная структура
На рис. 4 представлена трехмерная реконструкция предстательной железы и уретры самок песчанок контрольной группы и получавших тестостерон.В обоих случаях железистые структуры были сконцентрированы в средней части уретры, которая составляла 0,8–1,2 мм в длину и 0,06–0,1 мм в толщину. У контрольных животных (рис. 4, A и C) простата характеризовалась системой протоков, которая вставлялась в стенку уретры и соединяла орган с уретрой. Альвеолы были выровнены с уретрой и имели разную длину и толщину. Обработка тестостероном (рис. 4, B и D) привела к увеличению количества ацинусов, которые, по-видимому, были больше, чем у контрольных животных.Помимо роста предстательной железы, который способствовал утолщению стенки уретры, стало очевидно, что сама стенка мускулатуры гипертрофирована. Рост простаты и утолщение стенки уретры привели к заметному коллапсу уретры.
Рис. 4
Трехмерная реконструкция предстательной железы и связанного с ней сегмента уретры у самок песчанок, получивших носитель (контроль; A и C ) или тестостерон ( B и D ) на 21 год. дней.Очевидно увеличение количества ацинусов и объема. Вставка в A демонстрирует наличие протоков, пересекающих мышечную стенку на своем пути к уретре. В C и D показаны только границы стенки уретры, чтобы обеспечить лучший обзор ацинусов предстательной железы. Трехмерная реконструкция демонстрирует, что стенка уретры стала толще и что уретра, казалось, разрушилась после введения экзогенного тестостерона. A – P соответствует переднезадней оси уретры.Полосы = 600 мкм ( A и C ), 60 мкм (вставка в A ) и 150 мкм ( B и D )
Рис.4
Трехмерная реконструкция простаты железы и связанного с ней сегмента уретры у самок песчанок, получавших носитель (контроль; A и C ) или тестостерон ( B и D ) в течение 21 дня. Очевидно увеличение количества ацинусов и объема. Вставка в A демонстрирует наличие протоков, пересекающих мышечную стенку на своем пути к уретре.В C и D показаны только границы стенки уретры, чтобы обеспечить лучший обзор ацинусов предстательной железы. Трехмерная реконструкция демонстрирует, что стенка уретры стала толще и что уретра, казалось, разрушилась после введения экзогенного тестостерона. A – P соответствует переднезадней оси уретры. Столбики = 600 мкм ( A и C ), 60 мкм (вставка в A ) и 150 мкм ( B и D )
Иммунолокализация PSA-родственного антигена и AR
Антиген, связанный с ПСА, был обнаружен в предстательной железе самок песчанок иммуноцитохимическим методом, независимо от концентрации циркулирующего тестостерона.У контрольных животных реакция была диффузной в секреторном материале, накопленном в просвете, и обнаруживалась почти исключительно в апикальной цитоплазме. Иммуноцитохимическая реакция не была однородной, некоторые эпителиальные клетки вообще не окрашивались. Лечение тестостероном не повлияло на это распределение (рис. 5А). Однако после 14 дней лечения концентрация этой реактивной молекулы, связанной с PSA, была выше в везикулах, близких к апикальной части клетки (рис. 5B).
Рис.5
Иммуноцитохимическая идентификация связанного с ПСА антигена ( A и B ) и рецептора андрогена ( C и D ) в простате контрольной ( A и C ) и обработанной тестостероном ( B и D ) самки песчанок. Иммуноокрашивание антигена, связанного с ПСА, ограничивалось апикальной частью цитоплазмы эпителиальных клеток. Также наблюдалась диффузная реакция в люминальном секрете ( A ).Такая же картина наблюдалась через 21 день лечения тестостероном ( B ). На вставке — контрольная реакция. Рецептор андрогенов был обнаружен иммуноцитохимическим методом как в эпителиальных, так и в стромальных клетках. Иммуноокрашивание нерегулярно наблюдалось как в ядре клеток (стрелки), так и в цитоплазме (стрелки) контрольной простаты ( C ), тогда как реакция была в основном ядерной (стрелки) в обработанной тестостероном простате ( D ). Полосы = 25 мкм ( A и вставка в D ), 10 мкм ( B ) и 50 мкм ( C , D и вставка в B )
Рис.5
Иммуноцитохимическая идентификация связанного с ПСА антигена ( A и B ) и рецептора андрогена ( C и D ) в простате контрольной ( A и C ) и обработанной тестостероном ( B и D ) самки песчанок. Иммуноокрашивание антигена, связанного с ПСА, ограничивалось апикальной частью цитоплазмы эпителиальных клеток. Также наблюдалась диффузная реакция в люминальном секрете ( A ).Такая же картина наблюдалась через 21 день лечения тестостероном ( B ). На вставке — контрольная реакция. Рецептор андрогенов был обнаружен иммуноцитохимическим методом как в эпителиальных, так и в стромальных клетках. Иммуноокрашивание нерегулярно наблюдалось как в ядре клеток (стрелки), так и в цитоплазме (стрелки) контрольной простаты ( C ), тогда как реакция была в основном ядерной (стрелки) в обработанной тестостероном простате ( D ). Полосы = 25 мкм ( A и вставка в D ), 10 мкм ( B ) и 50 мкм ( C , D и вставка в B )
Иммуноцитохимическая реакция на AR показали, что он был сконцентрирован в ядрах эпителиальных клеток простаты контрольных самок, получавших носитель (рис.5С). Базальные эпителиальные клетки и стромальные клетки также были реактивными. Через 14 дней лечения идентифицируется такая же картина реакции, за исключением одной, в которой иммуноцитохимическое окрашивание на AR было обнаружено в цитоплазме многих, но не всех клеток (фиг. 5D). Эта картина сохранялась в течение более длительного периода лечения.
Диспластический рост простаты
На рис. 6 показаны некоторые аспекты диспластического роста эпителия у самок песчанок, получавших тестостерон.Аномальный рост эпителия наблюдался у 100% животных, получавших тестостерон в течение 21 дня. Наиболее частыми поражениями были интраэпителиальная неоплазия предстательной железы, атипичная гиперплазия и муцинозные аденокарциномы (рис. 6).
Рис. 6
Диспластический рост эпителия предстательной железы самок песчанок, получавших тестостерон. A ) Зона интраэпителиальной неоплазии предстательной железы (PIN) (звездочки). B ) Область атипичной гиперплазии (звездочки). C ) Области с небольшими ацинарными структурами, характерными для муцинозных аденокарцином (звездочки). Полосы = 25 мкм ( A ) и 50 мкм ( B и C )
Рис. 6
Диспластический рост эпителия предстательной железы самок песчанок, получавших тестостерон. A ) Зона интраэпителиальной неоплазии предстательной железы (PIN) (звездочки). B ) Область атипичной гиперплазии (звездочки). C ) Области с небольшими ацинарными структурами, характерными для муцинозных аденокарцином (звездочки).Полосы = 25 мкм ( A ) и 50 мкм ( B и C )
Структура яичника
На рис. 7 представлены гистологические аспекты яичников контрольных и получавших тестостерон самок песчанок. После лечения андрогенами стали очевидны два основных аспекта. Во-первых, мы наблюдали структуру поликистоза яичников, которая стала более очевидной после 14 дней лечения тестостероном. Во-вторых, наблюдалась выраженная гиперплазия стромальных клеток. Поскольку у этих животных не было кристаллов Рейнке, в то время мы не могли определить, соответствуют ли они клеткам Лейдига.
Рис. 7
Гистологические аспекты яичников контрольных и обработанных тестостероном самок песчанок. Общие виды ( A , C , E , G и I ), показывающие прогрессирующее развитие стромы и приобретение поликистозного состояния со временем после начала лечения тестостероном. Детали стромы яичника ( B , D , F , H и J ), демонстрирующие прогрессирующую гиперплазию стромальных клеток, которые характеризуются плотным клеточным ядром, прозрачной цитоплазмой и хордой. как аранжировка. A и B , управление; C и D , 3 дня; E и F , 7 дней; G и H , 14 дней; и I и J , 21 день лечения тестостероном. Полосы = 175 мкм ( A , C , E , G и I ) и 50 мкм ( B , D , F , H и J )
Рис. 7
Гистологические аспекты яичника самок песчанок контрольной группы и получавших тестостерон.Общие виды ( A , C , E , G и I ), показывающие прогрессирующее развитие стромы и приобретение поликистозного состояния со временем после начала лечения тестостероном. Детали стромы яичника ( B , D , F , H и J ), демонстрирующие прогрессирующую гиперплазию стромальных клеток, которые характеризуются плотным клеточным ядром, прозрачной цитоплазмой и хордой. как аранжировка. A и B , управление; C и D , 3 дня; E и F , 7 дней; G и H , 14 дней; и I и J , 21 день лечения тестостероном. Штанги = 175 мкм ( A , C , E , G и I ) и 50 мкм ( B , D , F , H и J )
Обсуждение
Это исследование демонстрирует, что введение тестостерона самкам песчанок вызывает важные изменения в предстательной железе.Основные изменения касались эпителиального компартмента железы, который проявлял двойное поведение во время лечения тестостероном, представленное начальным пролиферативным ответом с последующим секреторным взрывом.
Используемый здесь экспериментальный протокол привел к тому, что уровни тестостерона в крови в 12 раз превышали уровни, измеренные у нелеченных женщин. Результирующая концентрация циркулирующего тестостерона также примерно в четыре раза превышала уровни циркулирующего тестостерона, определенные для самцов песчанок, что соответствует примерно 4.8 нг тестостерона / мл плазмы (неопубликованные результаты) и поэтому считались гиперандрогенными.
Мы проследили влияние высокого тестостерона на уровни эстрадиола, чтобы проверить, как это повлияло на ось гипоталамус-гипофиз-гонады. В самом деле, это не повлияло на временную шкалу эксперимента. Кратковременное повышение уровня эстрадиола могло быть результатом немедленного превращения тестостерона через ароматазу. Это было подкреплено высокой корреляцией между уровнями тестостерона и эстрадиола в промежуточном диапазоне концентраций первого.При наивысшей достигнутой концентрации тестостерона, по-видимому, активируются другие механизмы, такие как повышенный катаболизм E2.
На третий день лечения отмечалось заметное увеличение количества пролиферирующих клеток в эпителии предстательной железы. Характер пролиферации характеризовался широкой вариабельностью, как показал статистический анализ, который можно отнести к локализованным клеточным делениям. На самом деле деления клеток чаще происходили в небольших, по-видимому, растущих ацинусах или почках.Повышенная пролиферация привела к гиперплазии эпителия, сопровождающейся значительным увеличением количества ацинусов и присутствием эпителиальных складок и пузырьков. Внутриэпителиальные пузырьки, часто наблюдаемые в эпителии предстательной железы, обработанной тестостероном в течение 3, 7 и 14 дней, подобны псевдокребничной модели интраэпителиальной неоплазии, обнаруженной в простате самцов песчанок [29, 30]. При неоплазиях предстательной железы человека эта эпителиальная организация может привести к развитию инвазивной аденокарциномы.Однако при лечении простаты в течение 21 дня эти цифры не были такими частыми, как в более ранние периоды, что позволяет предположить, что они представляют собой временную организацию эпителиального слоя.
Эпителиальные клетки стали выше и представили большую хромофобную область в надъядерной цитоплазме на 7 и 14 дни лечения. Эта хромофобная область соответствует области, занимаемой комплексом Гольджи и его везикулярной системой, а также наблюдается в нормальной мужской простате взрослых песчанок [1] и других грызунов [6, 7].Эти аспекты были подтверждены просвечивающей электронной микроскопией (неопубликованные результаты). Переход эпителия предстательной железы из маленького кубовидного или призматического в высокий призматический или псевдостратифицированный столбчатый показал интенсивное увеличение эпителиальных клеток и их участие в секреторной активности, которое сохранялось до 14-го дня лечения. Соответственно, статистический анализ выявил значительное увеличение объемной плотности эпителиального компартмента. В отличие от этого эпителиального развития, относительный объем просвета уменьшился менее чем наполовину за этот период.
Вторым типом клеток, часто наблюдаемым в секреторном эпителии, обработанном в течение 3, 7 и 14 дней, были базальные клетки. Было высказано предположение, что эти клетки ответственны за поддержание популяции эпителиальных клеток в женской простате [10]. Количество базальных клеток было относительно постоянным при лечении тестостероном, с соотношением 1 базальных клеток к примерно 12 люминальным секреторным клеткам. Этот аспект больше напоминает ситуацию, обнаруженную в вентральной части простаты крысы, и отличается от мужской простаты человека, в которой наблюдается соотношение один к одному [31].Иммуноцитохимические исследования мужской простаты человека выявили наличие рецепторов андрогенов в этих клетках [32], факт, который может позволить этим клеткам размножаться в ответ на тестостерон. Это было подтверждено для предстательной железы самок песчанок. Однако мы также наблюдали, что клетки просвета подвергаются митозу при обработке тестостероном (данные не показаны), что указывает на то, что пролиферация не зависит исключительно от базальных клеток.
Светлые клетки, которые экспрессировали и накапливали секреторный материал, состоящий в основном из нейтральных углеводов, были редкими в эпителии нормальной женской простаты [1], но постепенно становились более частыми при лечении тестостероном, увеличиваясь с 1:60 до 1:13. эпителиальные клетки после 21 дня лечения тестостероном (см. Таблицу 2).
Как морфометрический, так и стереологический анализ выявили уменьшение общего количества ацинусов и инверсию относительного объема эпителиального и просветного отделов. Это увеличение содержимого просвета было более очевидным, если принять во внимание площадь поперечного сечения просвета. Эпителий имел более короткие эпителиальные клетки, которые все еще демонстрировали развитый комплекс Гольджи и многочисленные секреторные пузырьки. Взятые вместе, эти результаты демонстрируют, что железа вошла в синтетическую фазу, что привело к накоплению секрета в просвете.Такая динамика эпителия привела к увеличению железы через 21 день лечения, что подтверждено трехмерной реконструкцией.
На основании этих результатов можно сделать вывод, что экспериментальное введение тестостерона способствовало росту и большей секреторной активности женской простаты. Стоит отметить, что динамика анализируемых здесь тканевых компартментов подробно воспроизводит развитие простаты мышей-самцов [33] и крыс Wistar (Vilamaior et al., Неопубликованные данные).
Мы пришли к выводу, что отсутствие андрогенных стимулов может способствовать недоразвитию простаты нормальной взрослой самки песчанки. Могут быть подняты новые вопросы, связанные с физиологическими процессами, которые поддерживают активное состояние простаты в женском организме, поскольку есть указания на то, что другие гормоны, такие как эстроген и пролактин, участвуют в гомеостазе мужской простаты [6, 13, 17, 18, 34]. Кроме того, в этой системе необходимо исследовать наличие ферментных комплексов, таких как 5α-редуктаза (продуцирующая дигидротестостерон из тестостерона) [32] и ароматаза (которая превращает тестостерон, но не дигидротестостерон, в эстроген) [35–38].
Временное снижение концентрации циркулирующего ПСА, по-видимому, представляет собой временное привлечение эпителиальных клеток для пролиферации и дифференцировки, происходящее вскоре после начала лечения. Удивительно, но существует сильная отрицательная корреляция между снижением уровня ПСА и повышением уровня эстрогена. На данный момент мы не можем отличить отрицательное влияние повышенных уровней эстрогена на секреторную активность простаты от рекрутирования эпителиальных клеток для пролиферации.Однако этот аспект следует проанализировать в будущем. Также еще предстоит определить, экспрессирует ли этот вид PSA или член семейства калликреинов, которые показали перекрестную реактивность с антителами, используемыми в этой работе, потому что хорошо известно, что крысы и мыши не экспрессируют PSA [39].
Как упоминалось здесь ранее, очень часто находили характеристики, связанные с псевдокреберной структурой эпителия сразу после фазы пролиферации. Также было упомянуто, что большинство этих характеристик исчезло после более длительного лечения тестостероном.Это псевдокребезное расположение указывает на высокую пролиферацию и обычно связано с развитием дисплазии предстательной железы. Хотя этот образец, очевидно, был связан с ростом эпителия у женщин, получавших тестостерон, он мог предвидеть диспластический рост органа. Фактически, в настоящем исследовании каждая простата, проанализированная после 21 дня лечения тестостероном, показывала признаки диспластического роста. Среди эпителиальных поражений были выявлены гистологические аспекты интраэпителиальной неоплазии предстательной железы, атипичной гиперплазии и муцинозных аденокарцином.Хотя продолжительность эксперимента была относительно короткой, мы можем предположить, что более длительное введение тестостерона приведет к раку простаты.
Наконец, мы также предполагаем, что гиперандрогения или потребление экзогенного тестостерона могут привести к комплексному ряду эффектов (рис. 8), угрожающих здоровью женщин, в результате чего повышается активность простаты с признаками эпителиальной дисплазии, утолщением стенки уретры, стромы яичников. гиперплазия и поликистоз яичников. Простое предположение, что гиперандрогения приводит к поликистозу яичников [40], должно быть пересмотрено, принимая во внимание другие органы, которые могут реагировать на андрогены.
Рис. 8
Возможные взаимодействия между высоким уровнем циркулирующего тестостерона, гормональным состоянием, наблюдаемым при гиперандрогении и заболеваниях яичников и простаты. Настоящая серия результатов, полученных для самок песчанок, предполагает, что эти четыре состояния могут быть коррелированы и приводить к серьезным осложнениям.
Рис. 8
Возможные взаимодействия между высоким уровнем циркулирующего тестостерона, гормональным состоянием, наблюдаемым при гиперандрогении и заболеваниях яичников и простаты.Настоящая серия результатов, полученных для самок песчанки, предполагает, что эти четыре состояния могут быть коррелированы и привести к серьезным осложнениям
Благодарности
Авторы признательны доктору М. Завячичу за предоставленный библиографический материал. Авторы выражают благодарность г-ну Л.Р. Фаллейросу-младшему за техническую помощь, Мануэлю Гарсиа-Флоресу за помощь в измерениях площади просвета и Марии Кристине К.Г. Marcondes за полезные обсуждения.
Список литературы
1.Santos
FCA
,Góes
RM
,Carvalho
HF
,Taboga
SR
.Структура, гистохимия и ультраструктура эпителия и стромы предстательной железы самки песчанки ( Meriones unguiculatus )
.Tissue Cell
2003
;35
:447
—457
.2.Custódio
AMG
,Góes
RM
,Taboga
SR
.Активность кислой фосфатазы в простате песчанок ( Meriones unguiculatus ): сравнительное исследование мужских и женских желез во время постнатального развития
.Cell Biol Int
2004
;28
:335
—344
.3.Шехата
R
.Уретральные железы в стенке уретры самок крыс, мышей и близкородственных грызунов
.Acta Anat (Базель)
1974
;90
:381
—387
.4.Шехата
R
.Женская простата Arvicanthis niloticus и Meriones libycus
.Acta Anat (Базель)
1975
;92
:513
—523
. 5.Шехата
R
.Самка предстательной железы и уретральных желез домашней крысы, Rattus norvegicus
.Acta Anat
1980
;107
:286
—288
.6.Smith
AF
,Landon
GV
,Ghanadian
R
,Chisholm
GD
.Ультраструктура мужской и женской простаты Praomys (Mastomys) natalensis
.Cell Tissue Res
1978
;190
:539
—552
.7.Брутто
SA
,Didio
LJA
.Сравнительная морфология предстательной железы у взрослых мужчин и женщин Praomys ( Mastomys ) natalensis изучена с помощью электронной микроскопии
.J Submicrosc Cytol
1987
;19
:77
—84
.8.Flamini
AM
,Barbieto
CG
,Gimeno
EJ
,Portiansky
EL
.Морфологическая характеристика женской простаты (Скинской железы или парауретральной железы) Lagostomus maximus maximus
.Анн Анат
2002
;184
:341
—345
.9.Завячич
M
.Женская простата: от рудиментарных парауретральных желез и протоков Скина до функциональной простаты женщины
.Братислава, Словакия
:Словацкая академическая пресса
;1999
10.Завячич
M
,Jakubovská
V
,Belošovič
M
,Breza
J
.Ультраструктура нормальной предстательной железы взрослой женщины (железа Скина)
.Анат Эмбриол (Берл)
2000
;201
:51
—61
.11.Скене
AJC
.Анатомия и патология двух важных желез женской уретры
.Am J Obstet Dis Women Child
1880
;13
:265
—270
.12.Wernet
N
,Albrecht
M
,Sesterhenn
I
,Goebbels
R
,Bonkhoff
H
000
GIGERРембергер
К
.«Женская простата»: расположение, морфология, иммуногистохимические характеристики и значение
.евро Урол
1992
;22
:64
—69
. 13.Айзекс
JT
.Роль андрогенов в развитии рака простаты
.Vitam Horm
1994
;49
:433
—502
. 14.Маркер
PC
,Donjacour
AA
,Dahiya
R
,Cunha
GR
.Гормональный, клеточный и молекулярный контроль развития простаты
.Дев Биол
2003
;253
:165
—174
.15.Merk
FB
,Leav
I
,Kwan
PW
,Ofner
P
.Влияние эстрогена и андрогена на ультраструктуру секреторных гранул и межклеточных соединений в регрессированной простате собак
.Anat Rec
1980
;197
:111
—132
.16.Wernet
N
,Gerdes
J
,Loy
V
,Seitz
G
,Scherr
O
,Dhom
.Исследование эстрогена (ER-ICA-тест) и рецептора прогестерона при карциноме простаты и простаты на иммуногистохимической основе
.Арка Вирхова Патол Анат Гистопатол
1988
;412
:387
—391
.17.Nevalainen
MT
,Клапан
EM
,Anhonen
T
,Yagi
A
.Андроген-зависимая экспрессия пролактина в эпителии простаты крысы in vivo и органной культуре
.FASEB J
1997
;11
:1297
—1307
. 18.Timms
BG
,Petersen
SL
,Von Saal
FS
.Рост предстательной железы во время развития у плодов крыс мужского и женского пола стимулируется внутриутробной близостью к плодам женского пола
.Дж Урол
1999
;161
:1694
—1701
.19.Staub
NL
,Пиво
MD
.Роль андрогенов у самок позвоночных
.Gen Comp Endocrinol
1997
;108
:1
—24
.20.Мур
E
,Вишневски
A
,Добс
A
.Эндокринное лечение транссексуалов: обзор схем лечения, исходов и побочных эффектов
.J Clin Endocrinol Metab
2003
;88
:3467
—3473
. 21.Тобин
VA
,Canny
BJ
.Регулирование сигналов кальция, индуцированных гонадотропин-рилизинг-гормоном, у самцов гонадотрофов крыс с помощью тестостерона опосредуется дигидротестостероном
.Эндокринология
1998
;139
:1038
—1045
. 22.Бехмер
АО
,Толоса
EMC
,Нето
AGF
.Руководство по гистологии нормальной и патологической.
Сан-Паулу, Бразилия
:Edart-Edusp
;1976
23.Weibel
ER
.Принципы и методы морфометрического исследования легкого и других органов
.Lab Invest
1978
;12
:131
—155
.24.Huttunen
E
,Romppanen
T
,Helminen
HJ
.Гистоколичественное исследование эффектов кастрации на вентральную долю простаты крыс
.J Anat
1981
;3
:357
—370
. 25.Гарсия-Флорес
M
,Oliveira
CA
,Carvalho
HF
.Ранние эффекты эстрогена на вентральную часть простаты крыс
.Braz J Med Biol Res
2005
;38
:487
—497
. 26.Carvalho
HF
,Линия
SRP
.Изменения базальной мембраны в вентральной части простаты крысы после кастрации
.Cell Biol Int
1996
;20
:809
—198
. 27.Виламайор
PSL
,Табога
SR
,Карвальо
HF
.Модуляция функции гладкомышечных клеток: морфологические доказательства перехода от сократительной способности к синтетической в вентральной части простаты крыс
.Cell Biol Int
2005
;29
:809
—816
. 28.Карвальо
КП
,Монтейро-Леаль
LH
.Хвостовой комплекс Giardia lamblia и его связь с подвижностью
.Exp Parasitol
2004
;108
:154
—162
.29.Vicent
AL
,Ясень
LR
.Дальнейшие наблюдения за спонтанными новообразованиями у монгольской песчанки, Meriones unguiculatus
.Lab Anim Sci
1978
;28
:297
—300
.30.Vicent
AL
,Gary
ER
,William
AS
.Патология монгольской песчанки ( Meriones unguiculatus ): обзор
.Lab Anim Sci
1979
;29
:645
—651
. 31.Эль-Альфи
M
,Пеллетье
G
,Hermo
LS
,Labrie
F
.Уникальные особенности базальных клеток эпителия простаты человека
.Microsc Res Tech
2000
;51
:436
—446
. 32.Рули
WD
.Активность 5α-редуктазы в простате
.Урология
2001
;58
:17
—24
. 33.Singh
J
,Zhu
Q
,Handelsman
DJ
.Стереологическая оценка развития простаты мыши
.Дж Андрол
1999
;20
:251
—258
. 34.Reiter
E
,Hennuy
B
,Bruyninx
M
,Cornet
A
,Klug
M
, McNamaraMcNamara
McNamara
McNamara
Хеннен
G
.Влияние гормонов гипофиза на простату
.простата
1999
;38
:159
—165
.35.Andó
S
,Sirianni
R
,Forastieri
P
,Casaburi
I
,Lanzino
M
,Rago
0005Джордано
C
,Carpino
A
,Pezzi
V
.Экспрессия ароматазы в препуберальных клетках Сертоли: влияние гормона щитовидной железы
.Mol Cell Endocrinol
2001
;178
:11
—21
. 36.Bulun
SE
,Yang
S
,Fang
Z
,Gurates
B
,Tamura
M
,Zhou
J4
J4
Роль ароматазы в заболевании эндометрия
.Дж. Стероид Биохим Мол Биол
2001
;79
:19
—25
0,37.Lephart
ED
,Lund
TD
,Horvarth
TL
.Ферменты, метаболизирующие андрогены и прогестерон в мозге: биосинтез, распределение и функции
.Brain Res
2001
;37
:25
—37
0,38.Kamat
A
,Hinshelwood
MM
,Murry
BA
,Mendelson
CR
.Механизмы тканеспецифической регуляции биосинтеза эстрогенов у человека
.Trends Endocrinol Metab
2002
;13
:122
—128
.39.Olsson
AY
,Lilja
H
,Lundwall
A
.Таксон-специфическая эволюция генов железистого калликреина и идентификация предшественника простат-специфического антигена
.Genomics
2004
;84
:147
—156
.40.Spinder
T
,Spijkstrat
J
,van den Tweel
J
,Burger
C
,van Kessel
H
,
H, Hл
.
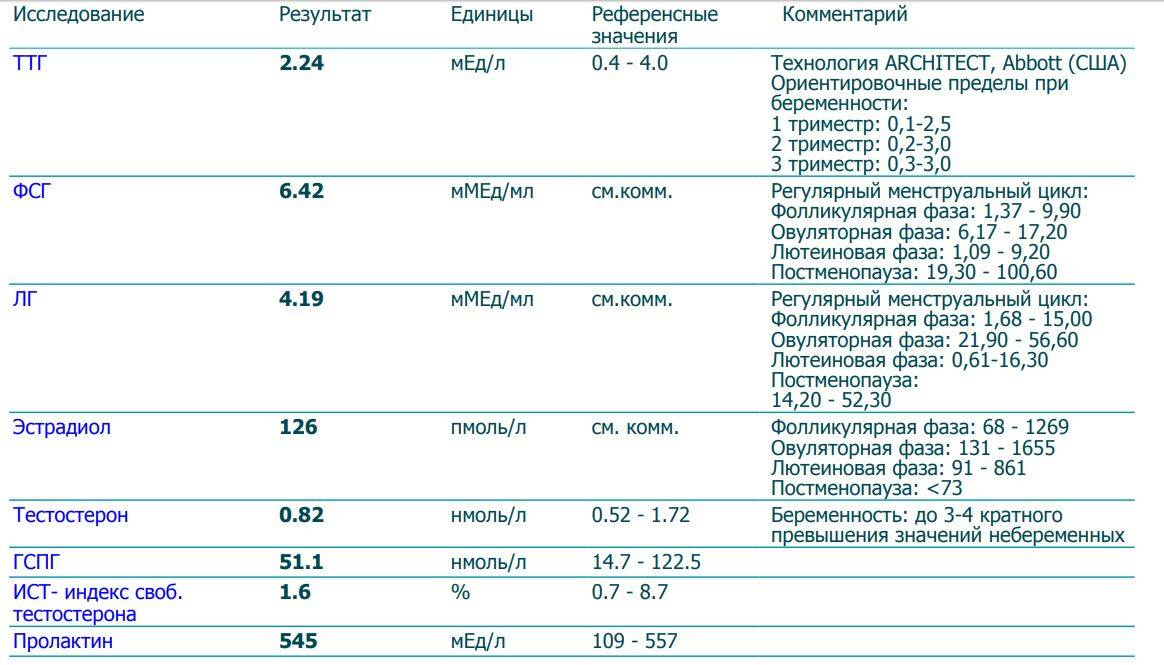



 В. «Антимюллеров гормон как маркер репродуктивной системы женщины.» Reproductive Endocrinology 1 (2011): 27-29.
В. «Антимюллеров гормон как маркер репродуктивной системы женщины.» Reproductive Endocrinology 1 (2011): 27-29.