Методы диагностики хромосомных болезней – Методы диагностики хромосомных болезней — Студопедия.Нет
Методы диагностики хромосомных болезней — Студопедия.Нет
Для подтверждения (или установления) диагноза хромосомной болезни используют цитогенетические методы. Наибольшее значение имеют:
1. Метод кариотипирования.
2. Метод определения полового хроматина.
Метод кариотипирования.
Позволяет изучить кариотип в целом (т.е. число и структуру хромосом). Кариотип изучают в делящихся клетках на стадии метафазы митоза, т.к. в этой стадии хромосомы максимально спирализованы и хорошо видны в световой микроскоп. Препарат метафазных хромосом называется метафазной пластинкой. Для диагностики большинства хромосомных болезней метафазные пластинки изготавливают из лимфоцитов периферической крови. Пригодны также фибробласты кожи, клетки красного костного мозга. Для пренатальной диагностики культивируют клетки амниотической жидкости, ворсин хориона, плаценты, эмбриональные ткани.
Рассмотрим получение метафазной пластинки из лимфоцитов периферической крови.
Для кариотипирования используют венозную кровь (I-2 мл) или из пальца. Кровь помещают в специальную питательную среду (Среда 199 «Игла» и др.) с фитогемагглютинином /ФГА/. ФГА получают из бобовых растений, он вызывает иммунологическую трансформацию лейкоцитов иих деление. Культуру помещают в термостат на 48-72 часа.
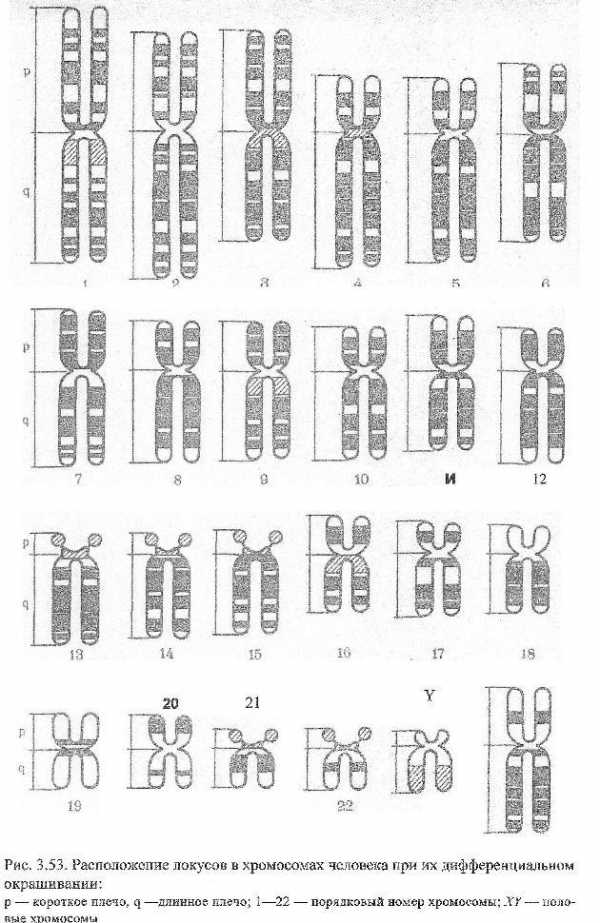
За 2-3 часа до конца культивирования добавляют колхицин (или колцемид). Колхицин получают из растения безвременника весеннего. Он разрушает веретено деления и останавливает деление клетки на стадии метафазы. Следующий этап изготовления препарата—обработка клеток гипотоническим раствором хлорида калияили нитрата натрия. В гипотоническом растворе клетки набухают, межхромосомные связи рвутся и хромосомы свободно плавают в цитоплазме. Клеточную суспензию фиксируют и наносят на предметное стекло. Привысыхании фиксатора клетки и хромосомы прочно прикрепляются к стеклу. Препарат окрашивают чаще всего по Романовскому-Гимзе. Такая окраска называется простойили рутинной. Все хромосомы окрашиваются равномерно по всей длине. Рутинная окраска позволяет подсчитать число хромосом, распределитьих по группам и обнаружить грубые хромосомные аберрации.
Для тонкойдиагностики хромосомных аберраций с середины 70-х годов используют метод «дифференциальной окраски хромосом».
Наиболее широко используют G-окраску. Хромосомы перед окраской по Романовскому-Гимзе предварительно обрабатывают протеазами (трипсином). Хромосомы после окраски становятся полосатыми. Чередованиетемных и светлых полос индивидуально в каждой паре хромосом. Предполагают,что темные полосы — гетерохроматиновыеучастки,а светлые — эухроматиновые.
Определение полового хроматина. Половой хроматин — это спирализованная Х-хромосома. Одна из Х-хромосом у женщин инактивируется на 16-19 сутки эмбрионального развития, а вторая остаетсяактивной. Спирализованная Х-хромосома обнаруживается в ядрахсоматическихклеток в виде темной, хорошо окрашивающейся глыбки.
Методика определения полового хроматина в буккальном соскобе следующая. После предварительного полоскания ротовой полости стоматологическим шпателем берут соскоб эпителия внутренней поверхности щеки у коренных зубов. Соскоб наносится равномерным слоем на предметное стекло, окрашивается в течение
Метод используют для диагностики хромосомных болезней, связанных с изменением числа Х-хромосом.
Существует также методика определения У-хроматина, которая используется для диагностики синдрома полисомии У.
Молекулярно-генетические методы диагностики наследственных болезней. ДНК-диагностика.
Молекулярно-генетические методы предназначаются для выявления вариаций в структуре исследуемого участка ДНК (аллеля, гена, региона хромосомы). В основе этих методов лежат манипуляции с ДНК и РНК. Это сложные методы диагностики, требуют определённых лабораторных условий и подготовки квалифицированного персонала. Молекулярно-генетические методы проводят в несколько этапов. Первый этап всех методов – получение образцов ДНК или РНК. Для этого используют каплю крови, лейкоциты, культуры фибробластов, соскоб эпителия со слизистой оболочки, волосяные луковицы. Выделенная ДНК одинаково пригодна для проведения различных вариантов и может долго сохраняться в замороженном состоянии.
Следующим этапом молекулярно-генетических методов является накопление (амплификация) нужных фрагментов ДНК. Его обеспечивает полимеразная цепная реакция (ПЦР) в invitro.
Метод амплификации (умножение числа копий определённого фрагмента ДНК) с помощью ЦПР позволяет в течение короткого времени размножить определённую последовательность ДНК в количестве, превышающем исходную в миллион раз.
Следующий этап молекулярно-генетической диагностики является рестрикция ДНК на фрагменты. Рестрикция ДНК (разрезание, разрывание) производится с помощью рестриктаз, относятся к группе бактериальных эндонуклеаз.
Разделение фрагментов ДНК обеспечивается методом электрофареза на агарозном или полиакриламидном геле. В процессе электрофареза каждый фрагмент ДНК занимает определённое положение в геле.
После обработки геля этидия бромидом, который связывается с ДНК, проводят ультрофиолетовое облучение и обнаруживают участки свечения. Существуют и другие методы окраски геля и выявления фрагментов ДНК.
ДНК-диагностика
С помощью прямых методов выявляются нарушения в первичной нуклеотидной последовательности ДНК (мутации и их типы). Прямые методы отличаются точностью, достигающей почти 100 %. Однако на практике указанные методы могут применяться при определенных условиях:
1) известной цитогенетической локализации гена, ответственного за развитие наследственного заболевания,
2) должен быть клонированным ген заболевания и известна его нуклеотидная последовательность.
Целью прямой диагностики является идентификация мутантных аллелей (нарушения в первичной нуклеотидной последовательности ДНК, мутации и их типы).
Высокая точность метода прямой ДНК-диагностики в большинстве случаев не требует ДНК-анализа всех членов семьи, так как выявление мутации в соответствующем гене позволяет почти со 100-процентной точностью подтвердить диагноз и определить генотип всех членов семьи больного ребенка, включая гетерозиготных носителей.
Недостатком метода прямой ДНК-диагностики является необходимость знания точной локализации гена и спектра его мутаций.
Методы прямой ДНК-диагностики показаны для таких заболеваний, как фенилкетонурия (мутация R408W), муковисцидоз — (наиболее частая мутация delF508), хорея Гентингтона (экспансия тринуклеотидных повторов-CTG-повторы) и др. Однако к настоящему времени гены многих заболеваний не картированы, неизвестна их экзонно-интронная организация, и многие наследственные болезни отличаются выраженной генетической гетерогенностью, что не позволяет в полной мере использовать прямые методы ДНК-диагностики. Поэтому информативность метода прямой ДНК-диагностики широко варьирует. В связи с этим используются косвенные методы молекулярно-генетической диагностики наследственных болезней.
Косвенные методы ДНК-диагностики основаны на анализе сцепления с исследуемым геном определенного полиморфного локуса (маркера), с помощью которого можно производить маркировку как мутантных, так и нормальных аллелей и проанализировать их передачу в поколениях, т.е. среди родственников обследуемого лица. Это особенно важно при решении вопроса о пренатальной (дородовой) диагностике наследственного заболевания. При использовании косвенных методов ДНК-диагностики следует помнить — чем теснее сцепление между маркерным локусом и мутантным геном, тем точнее диагноз. Чтобы свести до минимума ошибку диагностики, необходимо по возможности использовать внутригенные маркеры или использовать два маркерных локуса, фланкирующих мутантный аллель.
Таким образом, косвенная ДНК-диагностика проводится в следующих случаях:
1) когда ген не идентифицирован, а лишь картирован на определенной хромосоме,
2) когда методы прямой ДНК-диагностики не дают результата (например, в силу большой протяженности гена или широком спектре мутационных изменений,
3) при сложной экзонно-интронной организации гена.
При использовании косвенных методов ДНК-диагностики требуется семейный анализ аллелей полиморфных маркеров. Для косвенной диагностики могут использоваться так называемые гипервариабельныесателлитные повторы.
Косвенные методы ДНК-диагностики могут использоваться в пренатальной диагностике практически для всех моногенных заболеваний. Однако для этого необходимо иметь знания о том, что локус является высокополиморфным и находится вблизи от мутантного гена или внутри него. Поэтому для диагностики требуется обследование как можно большего числа родственников (в первую очередь родители—дети), чтобы проследить путь передачи маркеров потомству. Это повышает информативность выбранного маркера.
studopedia.net
|
Установлено, что более 40% спонтанных абортов и около 7% мертворождений обусловлено хромосомными аберрациями (ХА). Патология, сопровождающая дисбаланс хромосомного материала, вызывает различные аномалии развития у носителей и может быть связана не только с множественными врожденными пороками развития (МВПР), но и с умственной и физической отсталостью, нарушениями полового развития, бесплодием и невынашиванием беременности. Популяционная частота ХА у новорожденных составляет 0,6–0,8%, а у новорожденных с МВПР она возрастает до 40% [1, 2]. Лечение большинства таких пациентов пока малоэффективно, а прогноз неблагоприятен. Поэтому в современных условиях интенсивно развиваются методы дородовой диагностики ХА, а их использование в практическом здравоохранении позволяет предупредить рождение детей с тяжелой патологией. В настоящее время из-за экономических трудностей в России частично сокращается финансирование государственных программ дородового мониторинга состояния здоровья беременных женщин. Параллельно с этим процессом изменяется отношение врачей к скринингу анеуплоидий. В частности, предпринимаются попытки полностью отказаться от биохимического тестирования беременных женщин и заменить его более углубленным и расширенным ультразвуковым исследованием (УЗИ).
Целью настоящего обзора явился анализ как существующих методических подходов в пренатальной диагностике (ПД) хромосомопатий, так и ее принципиально новых направлений.
Обязательным условием успешного проведения ПД является предварительное выяснение семейного и акушерско-гинекологического анамнеза. Возраст и анамнез. Женщины 35 лет и старше составляют самую многочисленную группу среди беременных, которым проводится инвазивная ПД, хотя удельный вес этих рожениц составляет 5% от общего числа в популяции [3]. Более чем у 4% из них выявляются те или иные ХА плода [4, 5]. Подсчитано, что у женщины 40 лет индивидуальный риск синдрома Дауна (СД) у плода на 16-й неделе беременности равняется 1:67, тогда как у 20-летней беременной он равен 1:1053 [6]. Пороговый уровень риска (a risk level cutoff), превышение которого делает целесообразным выполнение инвазивных манипуляций, в отсеивающих компьютерных программах приближается по абсолютной величине к частоте рождения детей с СД у женщин 35–37 лет (1:200–1:400). В связи с этим во многих странах женщины с “возрастной” беременностью направляются на инвазивную диагностику без предварительного определения в сыворотке крови концентрации биохимических маркеров [7, 8]. Другие фетальные анеуплоидии, включая трипло-Х и синдром Клайнфельтера, также достоверно чаще наблюдаются в данной группе. Однако возраст как изолированное показание к пренатальному кариотипированию позволяет диагностировать не более 2% ХА, влияющих на прогноз жизни (5, 7–9]. Общеизвестно, что частота хромосомной патологии несколько выше у матерей, имеющих в анамнезе детей (плодов) с ХА или пороками развития, а также у женщин с привычным невынашиванием в ранних сроках беременности. Индивидуальный риск ХА плода наиболее высок у родителей-носителей хромосомных нарушений [10]. Прогностическая значимость данных анамнеза анализируется во многих работах и неодинаково оценивается разными авторами [4, 5, 9, 11, 12]. Биохимический скрининг. Наиболее распространенный вариант биохимического скрининга хромосомных нарушений включает оценку в сыворотке крови матери уровня АФП, ХГ и НЭ на 15–20-й неделе беременности. Эффективность этого «тройного теста» составляет 60–70% [13, 14]. Использование АФП в качестве единственного белкового маркера снижает эффективность биохимического скрининга более чем в 3 раза [13]. Замена в “тройном тесте” НЭ димерным ингибином А позволяет обнаружить 97% случаев СД плода без значительного изменения уровня ложноположительных результатов [15]. Финские исследователи пришли к заключению, что определение концентрации НЭ увеличивает стоимость данной отсеивающей программы без существенного улучшения выявляемости хромосомной патологии [7]. Однако, по данным других авторов, измерение сывороточного содержания НЭ достоверно повышает информативность иммунохимического тестирования [16]. В последние годы отмечается значительное усиление интереса клиницистов к ассоциированному с беременностью протеина А (pregnancy-associated plasma protein-A, PAPP, А), что обусловлено, главным образом, его высокой информативностью при диагностике ХА плода в конце I триместра беременности [17]. Пренатальный биохимический скрининг, который проводили в Англии, Швейцарии, США и многих других странах, показал, что выявляемость СД в I триместре беременности при одновременном определении концентраций РАРР-А и свободной ?-цепи ХГ, а также с учетом возраста матери достигает 70% при уровне ложноположительных результатов, приближающемся к 5%. Эффективность изолированной оценки сывороточного содержания свободной субъединицы ХГ была примерно вдвое ниже. По данным E.Casals и соавт., она равнялась только 9%, тогда как комбинированное исследование РАРР-А и АФП в I триместре позволяло обнаружить более 80% плодов с СД [18]. Диагностическая ценность определения свободной ?-цепи ХГ в моче приближалась к таковой в сыворотке крови [19]. Более подробная информация о свойствах и динамике сывороточной концентрации РАРР-А и других маркеров хромосомной патологии плода представлена в недавно опубликованном обзоре [17]. Эхографический скрининг. Несмотря на бесспорную информативность биохимических тестов, во многих центрах отдается предпочтение ультразвуковому скринированию фетальных хромосомопатий. С помощью тщательно проведенного рутинного УЗИ в 20 нед беременности можно выявить до 20% хромосомных нарушений и около 40% трисомий по хромосоме 21 (при 8% уровне ложноположительных результатов) [9,16]. При СД плода часто обнаруживаются утолщенная (более 5 мм) шейная складка, внутриутробная задержка развития плода, умеренный гидронефроз, укорочение бедренной кости, гиперэхогенный кишечник и пороки сердца. Описаны также разнообразные пренатальные маркеры и других анеуплоидий [6]. В некоторых случаях для их детекции показано проведение компьютерной томографии [20]. Комбинация эхографических отклонений с задержкой внутриутробного развития плода и аномальным количеством околоплодных вод повышает выявляемость хромосомной патологии до 82,4%. Обнаружено, что наибольшее количество грубых (т.е. приводящих к летальным исходам или тяжелой инвалидности) ХА диагностируется при наличии эхографических маркеров, а не в группе пороков развития плода (соответственно 21,6 и 14,9%) [9]. Увеличение воротникового пространства (3 мм и более) в сроке от 10 до 14 нед беременности является общим фенотипическим проявлением трисомий, синдрома Шерешевского–Тернера и триплоидии; оно наблюдается только у 5% плодов с нормальным кариотипом [6, 21]. Определение его толщины в одном из английских перинатальных центров привело к обнаружению 77% плодов с СД и 78% плодов с другими ХА [6]. В дальнейшем было показано, что выявляемость трисомий по хромосомам 21, 13 и 18 с помощью эхографического исследования составляет 73%, а в комбинации с иммунохимической оценкой сывороточной концентрации свободной ?-цепи и РАРР-А она возрастает до 87% [18, 22]. Развитие неинвазивных методов ПД привело к возникновению концепции о значительной эффективности последовательного и комбинированного пренатального скрининга хромосомных заболеваний, который состоит из следующих этапов:
Инвазивные методики. Помимо роста экономических затрат, одним из негативных последствий повсеместного внедрения широкого комплекса скрининговых исследований будет увеличение частоты инвазивных вмешательств, которое, несомненно, приведет к возрастанию количества ятрогенных фетальных потерь. Уже в настоящее время в Дании 10–12% беременных женщин подвергаются инвазивным диагностическим процедурам, что позволяет выявить пренатально 40% плодов с СД [23]. Между тем ПД обоснована и целесообразна только тогда, когда риск рождения больного ребенка выше риска осложнений после применения хирургических манипуляций, предназначенных для получения плодового материала, – хорионбиопсии, амниоцентеза и кордоцентеза. Наиболее низкий уровень перинатальных потерь отмечается после амниоцентеза, который выполняется обычно на 16–20-й неделе беременности, поскольку до этого срока в околоплодных водах присутствуют лишь единичные фибробласты плода, способные in vitro прикрепляться к пластику и размножаться. Результаты единственного сравнительного рандомизированного исследования, проведенного в Дании, показали, что частота спонтанных абортов после амниоцентеза составляет 1,7%, причем она достоверно выше, чем в контрольной группе (1%, р меньше 0,01). Датские ученые выявили также связь между амниоцентезом и возрастающим риском развития респираторного дистресс-синдрома и пневмонии у новорожденных: в основной группе наблюдалось 1,8% детей с этими постнатальными осложнениями, а в контрольной группе их было около 1% [24]. В Израиле, Канаде, Франции, Англии и во многих других странах амниоцентез в течение последних десятилетий остается основным методом получения клеток плода для последующего кариотипирования [14, 25–27]. Наш собственный опыт и данные зарубежных цитогенетиков свидетельствуют о том, что при использовании стандартного трипсин-метода можно получать высококачественные хромосомные препараты фибробластов плода из амниотической жидкости уже после 10–14-суточного культивирования их в плоскодонных флаконах в CO2-инкубаторе [7, 28, 29]. С помощью «пипеточного» метода У.Клауссена, суть которого заключается в индивидуальном сборе митотических клеток микропипеткой, удается приготовить любое необходимое количество G-дифференциально окрашенных метафазных пластинок уже к концу 1-й недели культивирования [30, 31]. Высокую эффективность имеет и метод in situ анализа метафаз в колониях фетальных клеток [30]. Анализ результатов раннего амниоцентеза и хорионбиопсии при сроке беременности 10–13 нед у женщин с развивающейся одноплодной беременностью показал, что обе методики имеют одинаковую эффективность при получении цитогенетического материала, однако увеличение риска перинатальных потерь на 2–3% при раннем амниоцентезе по сравнению с таковым при хорионбиопсии делает последнюю более перспективным методом ПД хромосомных болезней у плода в I триместре. Основным диагностическим материалом, используемым для цитогенетических исследований в I триместре беременности, являются ворсины хориона. После трансабдоминальной хорионбиопсии средняя частота потерь плодов составляет 1–3%, а после трансцервикальной хорионбиопсии она равняется 6,3–14% [9, 32). Доказано, что ее выполнение при сроке беременности менее 10 нед может привести к оромандибулярной гипоплазии (микрогнатии и микроглоссии) и более чем на порядок повышает частоту врожденных поперечных редукций конечностей, которая в общей популяции составляет 1,8 на 10 000 живорожденных [33]. К несомненным достоинствам этой методики относятся возможность быстрого (через 1–2 сут) получения результата, ее относительная простота и экономичность, а также высокая эффективность, практически не зависящая от срока беременности. Наиболее часто при кариотипировании цитотрофобласта выявляются аутосомные анеуплоидии и структурные аберрации, несколько реже встречаются анеуплоидии по гоносомам, сверхкомплектные маркеры и триплоидии [11]. Примерно у 1–2% женщин при кариотипировании ворсин хориона на 9–11-й неделе беременности обнаруживается анеуплоидия, чаще всего полная или мозаичная трисомия, при нормальном кариотипе плода. Такой ограниченный плацентарный мозаицизм обычно ассоциирован с внутриутробной задержкой развития плода [34]. С помощью современных молекулярно-генетических методов установлено, что в большинстве случаев он сочетается с унипарентной дисомией, при которой у плода обе гомологичные хромосомы наследуются от одного родителя [35]. Клиническими проявлениями последней могут быть синдромы Прадера–Вилли и Ангельмана (хромосома 15) и синдром Беквита–Видемана (хромосома 11), витальный прогноз которых неблагоприятен, а также различные аутосомно-рецессивные заболевания, возникающие вследствие гомозиготизации хромосомного материала. При обследовании женщин с высоким риском хромосомной патологии не рекомендуется полностью полагаться только на результаты кариотипирования цитотрофобласта и клеток ворсин хориона, имеющих экстраэмбриональное происхождение. Более надежными являются результаты цитогенетического анализа клеток амниотической жидкости и лимфоцитов. Взятие крови плода при пункции сосудов пуповины под контролем ультразвука, кордоцентез, который обычно проводят не ранее 20-й недели беременности, вызывает осложнения в среднем в 3,2–6,5% случаев [32, 36]. Частота фетальных потерь в течение 2 нед от момента его выполнения зависит от того, по каким показаниям он проводился, и составляет 1, 7 и 14% соответственно, при нормальном развитии плода, структурных аномалиях и задержке развития плода [37]. Кроме того, риск перинатальной смертности после кордоцентеза во многом определяется квалификацией и опытом хирурга. Во Франции доля кордоцентезов среди всех инвазивных вмешательств составляет 23% [27], а в США в ряде центров его назначают большинству женщин с УЗИ-маркерами хромосомных заболеваний [29]. Современные методы ДНК-анализа. В последние годы для ПД все чаще применяются молекулярно-генетические методы, наиболее важным из которых является FISH (fluorescence in situ hybridization). Он основан на использовании в реакции гибридизации in situ различных ДНК-проб (клонированных фрагментов ДНК человека), которые в фиксированных препаратах связываются со строго определенными (комплементарными им) районами хромосом. FISH превосходит классические методы кариотипирования по разрешающей способности и экономичности и в меньшей степени зависит от уровня подготовки цитогенетика [38]. С его помощью возможно определение числа хромосом в ядрах амниоцитов, цитотрофобласта, лимфоцитов и любых других клеток в течение 24–48 ч [29]. Обследование десятков тысяч пациенток показало, что эффективность интерфазного FISH-анализа некультивируемых амниоцитов превышает 80%. При одновременном применении центромероспецифичных зондов, взаимодействующих с хромосомами 13, 18, 21, X и Y, выявляется 90–95% всех фетальных ХА [29, 38]. Поэтому данный вариант FISH имеет гораздо более высокую информативность, чем другие скрининговые методы. Особую ценность он приобретает при проведении пренатальной экспресс-диагностики с целью уточнения степени мозаицизма неделящихся клетках ворсин хориона и амниотической жидкости. Некоторые авторы при постановке FISH-мeтoдa для выявления трисомий в амниоцитах отдают предпочтение теломерным ДНК-пробам космидных клонов [39]. Центромероспецифичные зонды не всегда пригодны для обнаружения несбалансированных робертсоновских транслокаций, доля которых среди всех трисомий составляет около 5%, и многих других структурных ХА. Поэтому в ПД для FISH-вepификaции транслокаций часто используются коммерческие хромосомоспецифичные ДНК-библиотеки (т.е. смесь уникальных последовательностей ДНК, покрывающих всю длину хромосомы – painting probes) [40]. Этот вариант позволяет также устанавливать семейный характер сверхкомплектных маркерных хромосом, который наблюдается в 40% случаев, что нередко играет решающую роль в выборе тактики ведения беременности. Показано, в частности, что обнаружение у плода дополнительной хромосомы, идентичной по молекулярному составу маркерной хромосоме одного из фенотипически здоровых родителей, свидетельствует о незначительном риске рождения ребенка с аномалиями развития [41]. Частота последних при наличии несателлитных фетальных хромосом, возникших de novo, может достигать 27%, а для маркеров, содержащих короткие плечи акроцентрических хромосом, она составляет около 8% [32]. Для успешного анализа многих ХА плода, например, микроделеций, инсерций или инверсий, часто необходим микро-FISH-метод (reverse chromosome painting). Суть его состоит в том, что с помощью микроманипулятора или проточной сортировки изолируют аберрантные хромосомы, их ДНК амплифицирует, продукты полимеразной цепной реакции (ПЦР) метят и используют затем как зонды сплошной окраски для гибридизации с нормальными метафазными хромосомами. Таким образом удается идентифицировать участки, присутствующие на аномальной хромосоме, и выявить ее делетированные районы. С помощью “обратного” окрашивания можно определить, является ли данная фетальная транслокация, наследуемая от одного из родителей, сбалансированной, что чрезвычайно важно для решения вопроса о прерывании беременности. Микро-FISH-анализ (в комбинации с микродиссекцией хромосом и ПЦР) культивируемых клеток амниотической жидкости был успешно использован для идентификации возникших de novo маркерных ХА: небольшой сверхкомплектной сателлитной хромосомы, изохромосомы i(9p) и кольцевой мини-хромосомы r(1) [42]. Первая из них образовалась в результате слияния центромерных гетерохроматических районов хромосом 14 и 22, поэтому какие-либо ее фенотипические проявления до и после рождения ребенка обнаружить не удалось. В двух других случаях наблюдались множественные аномалии и пороки развития плодов и ранняя постнатальная гибель новорожденных, вследствие присутствия в маркерных хромосомах эухроматических участков, содержащих структурные гены. Таким образом, FISH-анализ в комплексе с методами классической цитогенетики резко повышает эффективность ПД практически всех видов хромосомопатий. Быстрым и экономичным скрининговым методом определения анеуплоидии и триплоидии плода является тест, основанный на количественной флюоресцентной мультиплексной ПЦР. При его постановке амплифицируются небольшие повторяющиеся последовательности ДНК, маркирующие хромосомы 21, 18, 13, X и др., а последующий количественный флюоресцентный анализ ПЦР-продуктов позволяет дифференцировать образцы с нормальным и патологическим кариотипом. Продолжительность ПЦР-анализа обычно составляет несколько часов [43]. В.Perti и соавт. при исследовании 85 образцов ДНК, выделенной из клеток амниотической жидкости плодов, в 82 удалось достичь значительного совпадения с результатами стандартного цитогенетического анализа. Они обнаружили 20 плодов с СД, а также плоды с триплоидией (2 случая), синдромом Эдвардса (2 случая) и синдромом Патау (1 случай) [44]. Лишь в 3 наблюдениях при амплификации единственного маркерного повтора хромосомы 13 имела место гипердиагностика синдрома Патау, причем у одного из плодов она объяснялась дупликацией хромосомного материала. С помощью количественного ПЦР-метода возможно обнаружение нуклеотидной последовательности, соответствующей SRY-гену хромосомы Y, в крови женщин, беременных мужским плодом, после 7-й недели гестационного периода 145]. Положительный результат удается получить при наличии 1 мужской фетальной клетки среди 12 800 клеток матери. ПЦР-тест весьма эффективен при анализе малого количества генетического материала, полученного, например, при раннем амниоцентезе, выделении фетальных клеток, циркулирующих в материнском кровотоке, или трансцервикальном лаваже. Последний обычно проводится на 7–9-й неделе беременности, и трофобластические клетки, находящиеся в смывах слизи из цервикального канала или нижнего отдела полости матки, используют для диагностики трисомий плода и для определения его пола [46, 47]. Сообщается также об успешном выявлении СД плода с помощью FISH-анализа лаважных клеток [47]. Показана принципиальная возможность определения кариотипа по клеткам плода, циркулирующим в материнском кровотоке. Несмотря на то, что даже в конце беременности на 1 эритробласт плода приходится 10 000 материнских ядросодержащих клеток, с помощью современных иммунофлюоресцентных или магнитных модулей для проточной сортировки клеток (FACS, MACS и др.) удается получить обогащенную фракцию фетальных клеток, в которой их содержание может достигать 10% [48]. Для выделения эритробластов используются меченные флюорохромами или железными частицами моноклональные антитела к белкам, присутствующим на их мембранах – рецептору трансферрина (CD71), гликофорину А и рецептору тромбоспондина [49]. Предварительно клетки крови центрифугируют в тройном градиенте плотности, и в ряде случаев, проводят с помощью ядерных красителей селекцию клеток, содержащих ядра. Рекомендуется также негативная сортировка СD45-позитивных лимфоцитов. Помимо клеток эритроидного ряда в крови матери находятся фетальные лимфоциты и гранулоциты, а также трофобластические клетки, но они оказались менее удобными объектами для цитогенетических исследований [48, 49]. С помощью интерфазного FISH-анализа флотирующих в крови матери клеток были идентифицированы фетальные трисомии по хромосомам 21, 18, X, а также синдром Клайнфельтера (47,XXY) [48–50]. Так, исследование 42 312 ядер клеток, изолированных из кровотока 40 женщин, направленных для проведения ПД в различные сроки беременности (10–27 нед), позволил в 2 наблюдениях обнаружить СД плода, который в дальнейшем был подтвержден с помощью амниоцентеза [50]. Пол был правильно определен у всех плодов с кариотипом 46,ХХ и у 5 из 16 плодов с мужским кариотипом. В 1 случае у плода с синдромом Эдвардса аберрантные клетки среди 640 отсортированных клеток выявить не удалось. В остальных наблюдениях, по данным FISH и последующего кариотипирования амниоцитов, хромосомная патология плода отсутствовала. В большинстве публикаций сообщается лишь об единичных случаях ПД анеуплоидий. Их анализ свидетельствует о том, что данный тест имеет пока более низкую чувствительность и специфичность по сравнению с аналогичными показателями инвазивных методик. Главной проблемой остается низкая концентрация фетальных клеток в обогащенной фракции, причем значительная их часть не вступает в реакцию гибридизации с ДНК-зондами. Поэтому приходится проводить анализ ограниченного количества клеток, что увеличивает вероятность ошибки. Определенные трудности возникали даже при определении пола плода, тогда как при исследовании ДНК отсортированных клеток с помощью ПЦР-амплификации Y-специфических последовательностей пол плодов на 8–19-й неделе беременности был идентифицирован в 94–100% [51]. Таким образом, этот подход остается пока экспериментальным и по информативности не превосходит существующие скрининговые тесты. Его использованию в клинической практике в качестве скрининга анеуплоидий препятствуют значительная трудоемкость и высокая стоимость сортировки фетальных клеток. В настоящее время в связи с развитием методов экстракорпорального оплодотворения (ЭКО) широкое распространение получает преимплантационная диагностика хромосомных заболеваний. Преимущество данного подхода состоит в том, что он исключает проведение терапевтических абортов, поскольку хромосомные и генные нарушения определяются на уровне ооцитов-эмбрионов и возможно перенести в полость матки неповрежденные эмбрионы. Полярное тельце ооцита или бластомер эмбриона (4–8-клеточная стадия) предварительно изолируется с помощью микроманипулятора, а затем ДНК плода исследуется с помощью FISH или ПЦР. Преимплантационная диагностика особенно показана женщинам старше 35 лет, треть ооцитов которых имеет хромосомную патологию [52]. Наиболее надежным является анализ полярных телец методом FISH, в котором используются ДНК-зонды для одновременного определения хромосом X, Y, 18, 13 и 21. Для 440 ооцитов без признаков моносомии и трисомии, отобранных с помощью FISH из 648 ооцитов, было достигнуто нормальное оплодотворение, дробление и перенос в 122 циклах ЭКО, причем беременность наступила в 18 случаях, из которых 6 завершилось нормальными родами [52]. Частота ложноотрицательных результатов вследствие недостаточной эффективности FISH paвнялacь 18,1%. Значительную часть пациентов среди тех, которые нуждаются во вспомогательных репродуктивных технологиях, составляют индивидуумы со сбалансированными транслокациями. При проведении в этой группе риска FISH-анализа 625 бластомеров, изолированных на 3-й день развития, в 33 случаях были обнаружены различные ХА [53]. Мозаицизм эмбрионов и контаминация ДНК спермы могут вызывать ряд проблем при определении пола и выявлении анеуплоидий с помощью ПЦР-анализа. Так, эмбрионы, ДНК которых по данным ПЦР не содержала специфичных для хромосомы Y последовательностей нуклеотидов, по данным FISH-анализа имели следующие кариотипы: 45,Х, 46,XX / 46,XY или 46,XY / 47,XYY [54]. Показано, что в нормально развивающихся эмбрионах мозаицизм и полиплоидии наблюдаются соответственно в 3 и 3,6%, тогда как у отстающих и блокированных эмбрионов эти ХА встречаются во много раз чаще [54]. Совершенно ясно, что у некоторых пациентов цитогенетический анализ одного бластомера не дает полную характеристику всего эмбриона, поэтому во всех случаях наступления беременности после проведения преимплантационной диагностики следует выполнять инвазивную ПД с амниоцентезом или хорионбиопсией. Таким образом, отмечается дальнейшее интенсивное развитие базовых методов дородовой диагностики ХА: биохимического и ультразвукового скрининга, инвазивных методик для получения плодового материала, цитогенетического исследования метафазных препаратов хромосом. Активное применение методов ДНК-анализа, ПЦР и FISH обеспечивает прогресс традиционных направлений ПД и способствует практическому внедрению принципиально новых подходов – определения кариотипа по клеткам плода, циркулирующим в кровотоке матери, преимплантационной диагностики и других. В.С. Горин, В.Н. Серов, С.Г. Жабин, А.Г. Маркдорф, А.П. Шин, Р.В. Горин
Литература 1. Залетаев Д.В. Хромосомная патология у детей с олигофренией и множественными признаками дизморфогенеза. Автореф. дисс. … канд. биол. наук. М 1985; 24.
|
www.rusmedserv.com
Кариотипирование как метод диагностики хромосомных болезней
В клетках каждого человека заложена программа, исходный код, определяющий абсолютно всё. Цвет глаз, волос и кожи, рост, уровень интеллекта, даже характер и склонность к определённым заболеваниям – молекула ДНК хранит эту информацию, как жёсткий диск компьютера.
Если проводить такое сравнение, вся генетическая информация хранится в 46 папках. Каждая папка, содержащая нашу программу, называется хромосомой. Правильное считывание программы – залог точной работы системы.
Но что если переименовать, скопировать или удалить одну или более папку? В компьютере – придётся звать IT-специалиста. В человеческом организме такие изменения приводят к наследственным заболеваниям.
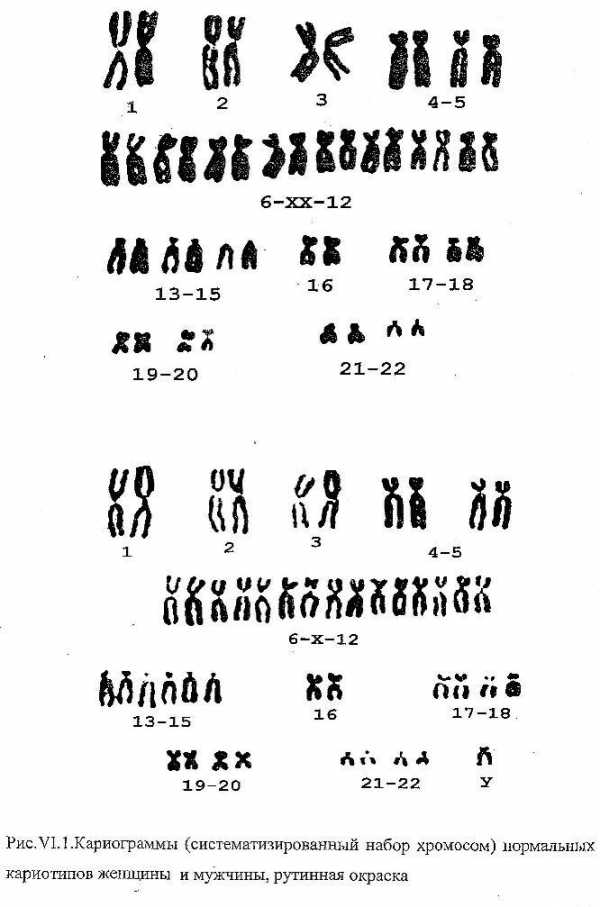
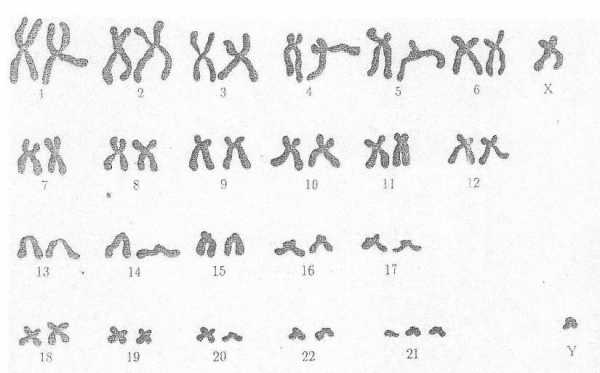
Человек имеет 46 хромосом, из них 1 пара отвечают за пол. Можно увидеть хромосомный набор человека под микроскопом, сфотографировать. Выстроить их попарно по размеру, форме. Определить кому, мужчине или женщине, соответствуют хромосомы.
Кариотип – хромосомный набор, принадлежащий определённому индивидууму, зафиксированный и выстроенный по размерам, форме, числу для хромосомного анализа.
Кариотип описывается следующими характеристиками:
- число хромосом;
- размер;
- длина плеч;
- позиция центромер;
- паттерны окрашивания или бандинг;
- дефекты (отсутствие, удвоение, инверсия, перемещение участков хромосом).
При многих наследственных заболеваниях зафиксировано изменение определённой хромосомы человека. Кариотип по этой причине обязательно входит в программу цитогенетического анализа и медицинской генетической консультации.
Нормальный кариотип человека состоит из 46 хромосом без видимых дефектов, из них 1 пара называется половыми хромосомами. Кариотип женщины имеет 2 Х хромосомы. Кариотип мужчины имеет 1 Х и 1 Y хромосому. Заболевания, сопровождающиеся патологическими изменениями кариотипа, называются хромосомными. Пример хромосомной болезни — синдром Дауна.
Кариотип при этой патологии представлен 47 хромосомами, у 21 пары обнаруживается добавочная, отвечающая за болезнь. Нормальный кариотип не исключает наличия генетических болезней, при которых изменений характеристики кариотипа не выявляется.
Определить кариотип необходимо в случае наличия любых наследственных заболеваний, бесплодии, невынашивании беременности.
Из-за возможности определить, мужской данный кариотип или женский, метод применяют в судебной медицине.
Кариотип животных отличается числом и видом хромосом. По образцам клеток возможно определить вид животного и его пол. Этот метод применяется в судебной медицине и сельском хозяйстве.
Как проводится анализ кариотипа человека
Кариотип человека определяют, используя культуру клеток, взятых у пациента. Определение кариотипа — достаточно сложная и долгая процедура. Определяют кариотип ин витро, т. е. в пробирке, на культуре клеток.
На первом этапе выделяют клетки, подходящие для этой процедуры. Это могут быть лимфоциты крови, клетки костного мозга или кожи. Выделенные клетки какое-то время культивируют в специальном инкубаторе, добавляя в культуру вещество, заставляющее их активно размножаться делением.
Вещество колхицин останавливает деление на этапе под названием метафаза. После добавления колхицина клетки фиксируют и окрашивают специальным красителем, активно поглощающимся хромосомами. Обычный микроскоп позволяет увидеть хромосомы в ядре клетки.
Видимый кариотип клетки несколько хаотичен. Специалист (медицинский генетик) фотографирует хромосомы и составляет карту. Процесс называется кариотипированием. Расположив хромосомы по парам, проводят анализ.
Показания к проведению анализа
Когда нужно определять кариотип? Генетика не прощает ошибок. Любое грубое нарушение нормального строения хромосом приводит к стиранию дефектного кода. Клинически это может проявляться бесплодием или выкидышами на ранних сроках беременности.
Природа редко допускает рождение больных детей. Исключением является ряд хромосомных болезней. Например, синдром Дауна, синдром Патау, синдром Клайнфельтера, синдром Тернера — Шерешевского, синдром Эдвардса, синдром кошачьего крика, синдром Прадера-Вилли и др. Описано более 700 патологий. Большинство больных не доживают до 1 года. Ведущий симптом у выживших детей — слабоумие, психические расстройства, пороки развития.
Любое наследственное заболевание является показанием к проведению анализа кариотипа. К сожалению, часто анализ делается ретроспективно, лишь подтверждая диагноз уже после рождения больного ребёнка.
Часть заболеваний не всегда приводят к рождению только больных детей. При наличии вероятности рождения больного ребёнка проводят специальную процедуру во время беременности, изучая кариотип плода. Определяют кариотип плода на клетках, полученных из плодных оболочек. В случае наличия грубых изменений беременность необходимо прервать.
Кариотип супругов определяется ещё до беременности. Врач-генетик изучит вероятность рождения больного ребёнка. Не старайтесь обмануть природу, если вам рекомендовали избегать беременности.
Причины аномалий хромосом
Возраст родителей старше 35 лет часто увеличивает вероятность хромосомных нарушений. Вероятно, механизм старения организма влияет на нормальное оплодотворение.
Работа с мутагенами, химикатами и вредными излучениями приводит к мутациям в половых клетках.
Инцест или кровные браки увеличивают вероятность возникновения хромосомных болезней.
Анализ можно сделать в большинстве крупных городов. Если нет возможности в своём городе определить кариотип, отправляйтесь в Москву. В столице много государственных и частных клиник, качественно проводящих этот анализ.
www.probirka.org
Цитогенетический метод изучения генетики человека. Кариотипический анализ. Значение метода для диагностики хромосомных заболеваний
Цитогенетический метод изучения генетики человека состоит в изучении строения генетического материала клетки.
Цитогенетический метод применяют для:
1. изучения нормального кариотипа человека;
2. диагностики хромосомных болезней;
3. изучения мутагенного действия различных веществ при геномных и хромосомных мутациях;
4. составления генетических карт хромосом.
Чаще этот метод применяют в культуре тканей (лейкоцитов). Их помещают в специальную питательную среду, где они делятся. После окраски в метафазе при делении клеток четко видно строение хромосом и их количество. Таким образом можно установить кариотип организма, поставить диагноз при хромосомных болезнях, связанных с хромосомными мутациями и геномными нарушениями.
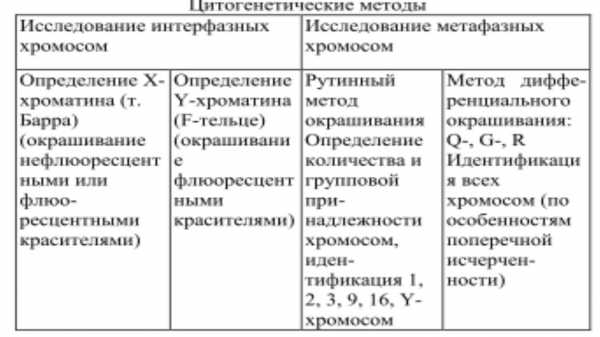
Методы идентификации хромосом при кариотипическом анализе:
1) Рутинный. При использовании этого метода хромосомы равномерно окрашиваются красителем в период метафазы митоза, затем хромосомы индивидуализируется благодаря их характеристикам.
2) Дифференциальные методы. Заключается в различной окрашиваемости различных участков хромосом. Существуют следующие методы дифференциального окрашивания: Q-метод, С-метод, R-метод и G-метод.
Благодаря цитогенетическому методу можно определит следующие хромосомные болезни:
Болезни, обусловленные нарушением числа аутосом
1) синдром Дауна — трисомия по 21 хромосоме,
2) синдром Патау — трисомия по 13 хромосоме
3) синдром Эдвардса — трисомия по 18 хромосоме
Болезни, связанные с нарушением числа половых хромосом
1) Синдром Шерешевского — Тёрнера — отсутствие одной Х-хромосомы у женщин (45 ХО) вследствие нарушения расхождения половых хромосом;
2) полисомия по Х-хромосоме — включает трисомию (кариотии 47, XXX), тетрасомию (48, ХХХХ), пентасомию (49, ХХХХХ),
3) полисомия по Y-хромосоме — как и полисомия по X-хромосоме, включает трисомию (кариотии 47, XYY), тетрасомию (48, ХYYY), пентасомию (49, ХYYYY
4) Синдром Клайнфельтера — полисомия по X- и Y-хромосомам у мальчиков (47, XXY; 48, XXYY и др.)
Цитогенетический метод изучения генетики человека. Определение Х- и У- хроматина. Значение метода для диагностики хромосомных заболеваний, связанных с нарушением числа половых хромосом в кариотипе
В интерфазных ядрах соматических клеток можно обнаружить тельце Барра или половой хроматин. Это генетически инактивированная Х-хромосома, которая всегда присутствует у женщин, и ее нет у мужчин. Проще всего изменение числа Х-хромосом можно обнаружить в эпителиальных клетках слизистой оболочки ротовой полости. После фиксации и окраски этих клеток определенными красителями, в них подсчитывают тельца Барра, или наблюдают их отсутствие. Х хромосомы у мужчин обнаруживают с помощью люминисцентной микроскопии.
Благодаря цитогенетическому методу можно определит следующие хромосомные болезни:
Болезни, связанные с нарушением числа половых хромосом
1) Синдром Шерешевского — Тёрнера — отсутствие одной Х-хромосомы у женщин (45 ХО) вследствие нарушения расхождения половых хромосом;
2) полисомия по Х-хромосоме — включает трисомию (кариотии 47, XXX), тетрасомию (48, ХХХХ), пентасомию (49, ХХХХХ),
3) полисомия по Y-хромосоме — как и полисомия по X-хромосоме, включает трисомию (кариотии 47, XYY), тетрасомию (48, ХYYY), пентасомию (49, ХYYYY
4) Синдром Клайнфельтера — полисомия по X- и Y-хромосомам у мальчиков (47, XXY; 48, XXYY и др.)
Современная теория эволюции. Элементарные эволюционные факторы. Генотипическая структура популяций. Закон Харди – Вайнберга
Современная теория эволюции представляет собой синтетическую науку, базирующуюся на всех науках биологического комплекса. Современная теория эволюции основана на учении Дарвина о происхождении жизни, возникновении разнообразия живой природы, адаптации и целесообразности у живых организмов, о возникновении человека, возникновении пород и сортов. Наука, изучающая процесс эволюции органического мира, называется эволюционной теорией.
Объект исследования теории эволюции: организмы, популяции, виды. Предмет изучения теории эволюции: процесс эволюции живой природы.
Задачи теории эволюции: изучение проблемы происхождения жизни на Земле, выяснение причин эволюции, определение закономерностей исторического развития живой материи, исследование развития царств живой природы, изучение происхождения и эволюции человека, прогнозирование эволюционных, микроэволюционных процессов, разработка способов научного управления микроэволюционными процессами
Основные положения современной синтетической теории.
1. Вид состоит из множества популяций
2. Популяция – наименьшая единица эволюции – элементарная эволюционная единица. В масштабах популяции:
а) Элементарным эволюционным материалом являются мутации.
б) Элементарным эволюционным явлением – изменение генотипической структуры популяции.
в) Элементарными эволюционными факторами являются мутационный процесс, популяционные волны, изоляция, естественный отбор.
3. Основным и направленным фактором эволюции и движущим механизмом её является естественный отбор
4. Эволюция носит постепенный, длительный характер, но могут возникать и скачкообразные процессы.
5. Обмен генами возможен не только внутри видов
6. Макроэволюция, то есть образование классов и типов идет только через микроэволюцию
7. Эволюция в целом непредсказуема, имеет ненаправленный характер
Элементарными эволюционными факторами являются мутационный процесс, популяционные волны, изоляция, естественный отбор
Мутационный процесс — это процесс спонтанного или индуцированного появления мутаций. Мутации являются элементарным экологическим материалом. Мутации возникают на протяжении всего периода существования жизни, таким образом генофонды популяций находятся под постоянным давлением со стороны мутационного процесса.
Популяционные волны — это колебания численности особей популяции, возникающие под влиянием различных факторов биотической и абиотической среды. Например при увеличении количества пищи, увеличивается количество особей зацев, а если их больше, то популяция хищников, питающихся зайцами также увеличивается и наоборот.
Изоляция — это ограничение свободы скрещивания (панмиксии). При снижении уровня панмиксии, происходит увеличение доли близкородственных скрещиваний, и вследствии этого происходит возникновение мутаций, накапливающихся в генофонде популяции. Изоляция — это необходимое условие сохранения, закрпеления и распросранения в популяциях более жизнеспособных генотипов.
Естественный отбор — процесс, приводящий к выживанию и преимущественному размножению более приспособленных к данным условиям среды особей, обладающих полезными наследственными признаками. Необходимая предпосылка естественного отбора: борьба за существование.
Генетически популяция характеризуется генофондом, который представлен совокупностью всех аллелей. Генофонды природных популяций отличаются наследственным разнообразием и динамическим равновесием доли особей с различным генотипом. Наследственное разнообразие заключается в присутствии в генофонде одновременно различных аллелей отдельных генов. Превично разнообразие создаётся благодаря мутационному процессу.
Закон Харди-Вайнберга — в популяции бесконечно большого размера, в которой не действует отбор, не идет мутационный процесс, отсутствует обмен особями с другими популяциями, не происходит дрейф генов и все скрещивания случайны — частоты генотипов по какому-либо гену будут поддерживаться постоянными из поколения в поколение и соответствовать уравнению:
p² + 2pq + q² = 1
Где p² — доля гомозигот по одному из аллелей; p — частота этого аллеля; q² — доля гомозигот по альтернативному аллелю; q — частота соответствующего аллеля; 2pq — доля гетерозигот.
studopedia.net
Хромосомные болезни человека
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Обоснование темы
Преподавание дисциплины «Медицинская генетика» для медицинских сестер требует особенно тщательной разработки тем, касающихся непосредственной практики в лечебных учреждениях.
В наше время огромное число заболеваний носит наследственный, врожденный характер. Знание этого факта может облегчить и постановку диагноза, и лечение, и профилактику заболевания.
Перед преподавателем ставятся следующие задачи
— научить студентов пользоваться в клинической практике теоретическими знаниями в области генетики
— пополнить знания по вопросам диагностики и профилактики наследственной патологии
-помочь студентам изучить ряд новых нозологических форм наследственной патологии
Хромосомные заболевания — большая группа врожденных наследственных болезней, клинически характеризующихся множественными врожденными пороками развития. В настоящее время известно более 1000 хромосомных аномалий.
Исследование таких болезней началось еще в середине 19 века. Но их точные механизмы и причины раскрываются до настоящего времени.
В задачу преподавателя входит не только описание таких болезней и их цитологических причин, но и объяснение в доступной, популярной форме методов лечения и адаптации больных людей, что развивает в студентах гуманное отношение к пациенту. Доступность, иллюстративность, новизна последних исследований в данной области должны привить интерес к дисциплине.
С точки зрения автора данной статьи, преподавателю важно привить заинтересованность у будущих медсестер в получении знаний с помощью современных электронных образовательных ресурсов- презентаций и компьютерных тестов, помогающих сделать лекцию более яркой и интерактивной. Усложнение материала в данной ситуации недопустима в связи со спецификой работы среднего медицинского персонала. На первый план необходимо выдвинуть такие задачи, как воспитание терпимости, доброго, гуманного отношения к больным с наследственными патологиями.
ЦЕЛЬ ЗАНЯТИЯ — ознакомить студентов с основными признаками хромосомных патологий, их лечением и профилактикой.
ТИП ЗАНЯТИЯ — комбинированный ДЛИТЕЛЬНОСТЬ урок 90 минут
ОБОРУДОВАНИЕ — тетради, учебники, мультимедийная установка
МЕТОДЫ ОБУЧЕНИЯ — иллюстративный, частично -поисковый, проблемный
ПЛАН ЛЕКЦИИ
- Общие признаки наследственных болезней человека
- Определение хромосомных болезней (синдромов)
- Классификация хромосомных аномалий
- Клинико-цитогенетические характеристики наиболее распространенных хромосомных болезней(Синдром Дауна, синдром Патау, синдром Эдвардса, полисомии по половым хромосомам, синдром кошачьего крика)
- Выводы. Проверочный тест. Оценка полученных знаний.
ОСОБЕННОСТИ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ
ВОПРОС: Попробуйте сформулировать особенности наследственности человека. В чем заключаются трудности в ее изучении?
(многочисленность хромосом, позднее половое созревание, малое количество потомков, невозможность экспериментировать)
ВОПРОС: Как вы думаете, можно ли внешне распознать хромосомные патологии?
- Семейный характер заболевания- наличие сходных случаев наследственной патологии у разных членов семьи. Но наличие заболевания только у одного человека в семье также не исключает наследственного характера заболевания.
- Хроническое, рецидивирующее течение заболевания.
- Специфические симптомы наследственных болезней- изменения в строении скелета, цвета волос и кожи, строения глаз, биохимических анализов крови и мочи и т. д.
- Патологические изменения органов и систем - патологии сердечно-сосудистой системы, ЖКТ, почек.
- Врожденный характер заболевания- проявляются при рождении
- Устойчивость к терапии
2. Определение хромосомных болезней
Хромосомные болезни- группа врожденных наследственных болезней, характеризующихся множественными пороками развития. В их основе лежат хромосомные или геномные мутации. Число описанных в наше время аномалий хромосом достигает 1000.
Диагностика хромосомных аномалий необходима в практике врачей разных специальностей- акушеров-гинекологов, педиатров, невропатологов, эндокринологов.
3. Классификация хромосомных аномалий
ВОПРОС: Что такое геном?(половинный набор хромосом)
Как он обозначается?
ВОПРОС: В результате каких процессов в ходе митоза или мейоза нарушается число хромосом? Строение хромосом?
ГЕНОМНЫЕ МУТАЦИИ — изменение количества хромосом, кратное гаплоидному набору
Тетраплоидия- 4n
Триплоидия -3n
Анеуплоидия — изменения числа одной или нескольких хромосом (моносомия, полисомия, трисомия)
ХРОМОСОМНЫЕ МУТАЦИИ (АБЕРРАЦИИ)
- Делеция- выпадение участка хромосомы
- Дупликация — удвоение участка хромосомы
- Инверсия- поворот участка хромосомы на 180 град
- Дефишенси — концевые нехватки хромосом
- Транслокация- обмен участками между хромосомами
- Кольцевая хромосома
ВОПРОС: Как вы думаете, могли ли указанные изменения числа и строения хромосом сыграть определенную роль в эволюции?
4. Характеристика хромосомных болезней
4. 1. Синдром Дауна
Трисомия 21. (ХХ +21, ХУ +21)
Частота встречаемости примерно 1:800. Зависит от возраста матери. Существенно возрастает после 35 лет, а после 45 лет составляет 1:12. Около 2% детей имеют мозаичную форму заболевания ( не все клетки имеют аномальный набор хромосом). В этом случае симптомы болезни несколько смягчены.
Симптомы синдрома
— монголоидный разрез глаз
— эпикант
— плоская спинка носа
-деформированные ушные раковины
— короткие и широкие кисти
— деформация грудной клетки
— помутнение хрусталика
— дефекты межжелудочковой или межпредсердной перегородки
— пороки развития ЖКТ
— гипоплазия почек
— лейкозы
— умственная отсталость
Врожденные пороки внутренних органов часто приводят к летальному исходу в первые пять лет жизни
Лечение — врожденные пороки устраняются оперативно, проводятся общеукрепляющие процедуры, защита от инфекций, укрепление физического здоровья.
Многие больные могут дожить до 50 лет.
Надо отметить, что люди с синдромом Дауна адаптируемы, при наличии грамотного ухода и лечения могут участвовать в общественной жизни, работать самостоятельно. Они весьма дружелюбны и контактны.
4. 2. Синдром Патау.
Это трисомия 13 (ХХ+13, ХУ+13). Частота встречаемости 1:5000-1:7000. От возраста родителей не зависит.
В связи с тяжелыми врожденными пороками развития дети с таким заболеванием умирают в первые недели жизни. 95% умирает до года, есть случаи продолжительности жизни до 5 и даже 10 лет.
Симптомы болезни
-низко расположенные ушные раковины
-расщелина верхней губы и неба
-дефект скальпа
-полидактилия кистей и стоп
-флексорное положение кистей
-стопа-качалка
-микроцефалия
-гипоплазия мозжечка
-микрофтальмия
-дефекты развития сердца
-пороки развития ЖКТ
-кисты почек
-удвоение мочеточников
-крипторхизм
Лечение — операция по поводу врожденных дефектов, профилактика простудных и инфекционных заболеваний
4. 3. Синдром Эдвардса
Трисомия 18 (ХХ+18, ХУ+18). Частота встречаемости 1:5000-1:7000. Соотношение мальчиков и девочек равно 1:3.
Характерны множественные пороки развития- микрофтальмия, микроцефалия, пороки
urok.1sept.ru
Диагностика хромосомных болезней — КиберПедия
Хорошо известно, что на долю всех ПД, связанных с хромосомной патологией, приходится основная часть (около 80-85%) женщин групп высокого риска, направляемых на ПД с применением инвазивных методов. Именно поэтому такое внимание уделяется разработке удобных, эффективных и надежных методов хромосомного (цитогенетического) анализа клеток плода. В настоящее время проблема надежной цитогенетической диагностики плода человека практически на любом сроке беременности успешно решена. Методически наиболее удобными для диагностики хромосомных болезней у плода являются 10-12-я недели беременности, когда в случае необходимости возможно проведение медицинского аборта. Хромосомные препараты из ворсин хориона (плаценты) прямым методом готовят до 19-20-й недель беременности (рис. 2), а на более поздних сроках предпочитают их получать из культивируемых лимфоцитов пуповинной крови. Кариотипирование культивированных клеток амниотической жидкости возможно на 13-21-й неделях беременности.
Число хромосомных нарушений, выявляемых на ранних сроках беременности (первый триместр), как правило, существенно выше, чем во втором. По обобщенным мировым данным, эффективность ПД хромосомных болезней в среднем составляет 5%, причем более половины всех хромосомных нарушений приходится на избыток хромосомы 21 — болезнь Дауна. Несложные математические подсчеты показывают, что, даже если бы вся пренатальная диагностика была ограничена только болезнью Дауна, она, безусловно, была бы рентабельной с экономической точки зрения.
Дальнейший прогресс в направлении ПД хромосомных болезней, по-видимому, будет достигнут на пути широкого привлечения методов и приемов молекулярной цитогенетики, которые позволяют проводить диагностику числовых нарушений даже на ядрах неделящихся клеток и более детально анализировать структурные перестройки хромосом.
ДНК-диагностика генных болезней
Число моногенных болезней, доступных молекулярной диагностике, уже превышает 1000 и продолжает быстро увеличиваться. Созданы и постоянно совершенствуются все новые эффективные и достаточно универсальные методы ДНК-диагностики, такие, как метод полимеразной цепной реакции (ПЦР), автор которой — американский ученый Кэй Муллис отмечен Нобелевской премией 1994 года, метод блот-гибридизации, увековечивший имя его создателя Эд. Саузерна (1975 год), и методы ДНК-секвенирования (анализ первичной последовательности нуклеотидов в цепочке ДНК), разработанные П. Сэнджером.
ДНК-диагностика в стране проводится только в нескольких федеральных медико-генетических центрах Санкт-Петербурга, Москвы, Томска и пока касается наиболее частых, социально значимых наследственных болезней, число которых увеличивается. Важно также подчеркнуть, что ДНК-методы позволяют не только диагностировать генные болезни, но и выявлять бессимптомных гетерозиготных носителей мутаций и, таким образом, вести эффективную профилактику болезней в семьях высокого риска [4].
В целом проблему ДНК-диагностики генных болезней, равно как и хромосомных, по сути можно считать принципиально решенной. Ее дальнейший прогресс может касаться не только увеличения числа диагностируемых болезней, но и переноса основной тяжести исследований в ранний постнатальный период для скринирования новорожденных на предрасположенность к мультифакториальным (полигенным) заболеваниям, таким, как атеросклероз, ишемия сердца, диабет, некоторые опухоли и нервно-психические заболевания.
Биохимическая диагностика
В последние годы удельный вес биохимических методов в ПД наследственных и врожденных болезней заметно снизился. Причина тому — решающие успехи в ДНК-диагностике, позволяющие анализировать сам ген, а не его продукты и, таким образом, дающие возможность диагностики на любых клетках плода, а не только на тех, где работает данный ген. Тем не менее биохимические методы широко применяются при ПД врожденных дефектов нервной системы (исследование АФП и ацетилхолинэстеразы в амниотической жидкости), при некоторых формах болезней обмена мукополисахаридов и лизосомальных белков и даже при ПД муковисцидоза — самого распространенного моногенного заболевания. Следует, однако, отметить, что по мере выяснения природы мутантного гена, понимания его функций и идентификации конкретного белка эффективными могут оказаться и прямые биохимические исследования, как, например, иммунохимический анализ белка дистрофина в миофибриллах при миодистрофии Дюшенна или анализ специфического белка в лимфоцитах при синдроме ломкой Х-хромосомы. Есть основания считать, что более дешевые, доступные для массового применения биохимические методы будут находить все более широкое применение в скрининге наследственных болезней.
31. Формы биотических связей в природе. Классификация форм паразитизма. Происхождение паразитизма.
Биотические факторы природы – это взаимоотношения всех живых организмов друг с другом и с окружающей средой. Биотические связи возникают в биогеоценозе между различными видами. Самой основной и важной формой таких связей являются пищевые взаимоотношения, которые формируют циклы питания и сложные цепи.
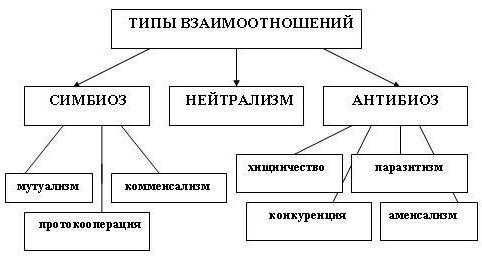
Нейтрализм
Биотические связи, при которых жизнедеятельность одного организма не оказывает никакого влияния на жизнь другого, называется нейтрализмом. Примерами данного взаимоотношения являются заяц-беляк и ленточный червь, бабочка-крапивница и блоха, а также бесконечное множество других.
Ученые заметили, что во время своей жизнедеятельности все живые организмы выделяют в окружающую среду твердые, жидкие и газообразные вещества, которые способны влиять на другие растения, животных и микроорганизмы.
Аллелопатия
Биотические связи, осуществляющиеся благодаря специфическим действующим продуктам обмена веществ, выделяющимся во внешнюю среду, называются аллелопатией.
Такое явление известно уже давно, но лишь в 1937 году немецкий ученый Молиш дал ему определенное название.
Более детально данное явление изучено на растительных организмах. Выделения многих растений могут оказывать на близрастущих соседей как токсичное, так и стимулирующее действие. Примеры биотических связей у растений могут быть такими:
- абсинтин листьев горькой полыни способен угнетать рост и развитие многих других растений;
- фасоль замедляет рост яровой пшеницы;
- выделения корней пырея плохо влияют не только на другие травы и кустарники, но и на деревья.
Животные также выделяют вещества – феромоны, способные влиять на поведение и развитие особей определенного вида. С их помощью также передается информация другим видам.
Выделение биологически активных веществ свойственно и микроорганизмам. Например, широко известны такие антибиотики, как пенициллин и стрептомицин.
Эффект группы
Групповой эффект – это оптимизация всех процессов, которая ведет к максимальному повышению жизнеспособности особей при их совместном обитании. Такая особенность проявляется у большого количества видов, которые могут нормально размножаться и развиваться только в том случае, если они объединились в небольшие или огромные группы.
Типы биотических связей зависят от ареала обитания особей и способов их существования. Например, для того чтобы выжило стадо африканских слонов, в нем должно находиться не менее тридцати особей.
Конкуренция
Биотические связи, во время которых происходят взаимоотношения между особями одного или разных видов, при которых используются одни и те же ресурсы при их значительном недостатке, называются конкуренцией. Внутривидовая конкуренция способна значительно повысить интенсивность естественного отбора. Самым популярным примером такого процесса является самоизреживание елей.
А вот межвидовой тип конкуренции чаще всего характерен для экологически близких особей или популяций разных видов. Может быть как пассивной, так и активной. Первая подразумевает использование природных богатств, необходимых обоим видам. А во время второй происходит подавление одного вида другим.
Конкуренция является одной из основных причин того, что несколько видов, характеризующихся похожими образом жизни, поведением и спецификой питания, не могут сожительствовать в одном сообществе. Такая конкуренция может превратиться во вражду.
Хищничество
Биотические связи в природе, которые характеризуются таким способом добычи пищи, как ловля, убийство и съедение пойманных особей, называются хищничеством. Основой таких взаимоотношений являются пищевые связи и цепочки питания. Хищник сначала убивает добычу, а только потом ее съедает. Но перед этим ее нужно поймать. Для этих целей у каждого хищника есть специальные приспособления. Исторически сложилось так, что и у жертв есть защитные элементы. Например, панцирь, колючки, шипы, ядовитые железы и защитная окраска.
Благодаря таким обоюдным приспособлениям и сформировались группировки организмов – хищники и жертвы. В таких взаимоотношениях сформированы принципы регуляции численности обоих компонентов.
Еще недавно ученые думали, что все хищники — вредные жители планеты, поэтому их нужно истреблять. Однако это мнение оказалось ошибочным. Такие действия будут иметь негативные глобальные последствия. Существует риск нанести ущерб не только дикой природе, но и всему хозяйству.
Симбиоз
Биотические связи в природе, во время которых один из партнеров (или сразу оба) извлекает пользу от взаимоотношений друг с другом, называются симбиозом.
В мире существует большое количество примеров взаимовыгодного симбиоза. Например, желудочные и кишечные бактерии, без которых невозможен процесс пищеварения. Или опыление некоторых орхидей, чью пыльцу может переносить только определенный тип насекомых. Такие отношения проходят успешно тогда, когда они увеличивают вероятность обоих партнеров выжить.
Другими словами – это абсолютно любая форма взаимоотношений между организмами разных видов (сюда относится и паразитизм – особый вид отношений, выгодных для одного партнера, но вредных для другого).
Симбиоз, который будет выгодным для обоих представителей, называется мутуализмом. А вот комменсализм – это взаимоотношения, полезные для одного, но безразличные для другого. Эндосимбиоз – способность одного партнера жить внутри клетки другого.
Мутуализм
Самой распространенной формой совместного сожительства считается мутуализм. Биотические связи в природе (9 класс школьной программы подробно описывает данную тему) в виде мутуализма ставят обязательное условие – существование обоих партнеров. Во время такой связи каждый из партнеров получает свою выгоду. Например, один партнер использует другого в качестве источника питания, а второй оказывается под защитой от врагов или в благоприятных условиях для развития и размножения.
Каждый участник мутуалистической пары является эгоистом, и взаимная выгода возникает лишь от того, что полученная польза перевесит все затраты, которые требуются на поддержание взаимоотношений.
Взаимовыгодные связи формируются также благодаря поведенческим реакциям. Примеры биотических связей мутуализма – птицы совмещают собственное питание, и в это же время являются распространителями семян. Иногда возникают физические взаимоотношения.
Тесный контакт видов при мутуализме способствует их совместной эволюции. Таким примером являются приспособления, которые сформировались у цветков и их опылителей.
Комменсализм
Биотические связи выделяют три вида комменсализма:
- Используют пищу других видов.
- Прикрепляются к другому организму, который становится «хозяином».
- Поселяются во внутренних органах хозяина.
Отношения такого типа очень важны для природы, так как дают возможность на каждом кусочке Земли сожительствовать большому количеству видов, а также максимально освоить окружающую среду и использовать пищевые ресурсы. Однако очень часто данный тип связи переходит в другие взаимоотношения. Когда поедание пищи начинает вредить хозяину, то отношения переходят на новый уровень и становятся паразитизмом или конкуренцией.
Паразитизм
Паразитизм – это вид отношений, при которых паразит использует хозяина как основное место жительства и источник питания. Биотические связи (таблица представлена в статье) описывают данный вид сосуществования особей так: паразит поселяется внутри хозяина или же на его поверхности. Паразитизм может встречаться среди различных групп организмов (у растений, животных, грибов и человека).
Физиология паразита подчиняется жизненным процессам хозяина. Поэтому для продуктивного существования необходимо использовать биологические ресурсы. Чем дольше происходит сосуществование, тем лучше данный вид паразита приспосабливается к своему хозяину и наносит ему меньше вреда.
cyberpedia.su
Хромосомные болезни
Хромосомные болезни, или синдромы — это группа врожденных патологических состояний, проявляющихся множественными пороками развития, различающихся по своей клинической картине, часто сопровождающихся тяжелыми нарушениями психического и соматического развития. Основной дефект — различные степени интеллектуальной недостаточности, что может осложняться нарушениями зрения, слуха, опорно-двигательного аппарата, более выраженными, чем интеллектуальный дефект, расстройствами речи, эмоциональной сферы и поведения.
Диагностические признаки хромосомных синдромов можно разделить на три группы:
неспецифические, т.е. такие, как выраженная умственная отсталость, сочетающаяся с дисплазиями, врожденными пороками развития и черепно-лицевыми аномалиями;
признаки, характерные для отдельных синдромов;
патогномоничные для конкретного синдрома, например, специфический плач при синдроме «кошачьего крика».
Хромосомные заболевания не подчиняются менделеевским закономерностям передачи заболевания потомству и в большинстве случаев обнаруживаются спорадически, являясь следствием мутации в половой клетке одного из родителей.
Хромосомные болезни могут быть унаследованы, если мутация имеется во всех клетках родительского организма.
К механизмам, лежащим в основе геномных мутаций, относятся:
нерасхождение — хромосомы, которые должны были разделяться во время клеточного деления, остаются соединенными и относятся к одному полюсу;
«анафазное отставание» — утрата отдельной хромосомы (моносомия) может иметь место во время анафазы, когда одна хромосома может отстать от остальных;
полиплоидизация — в каждой клетке геном представлен более чем дважды.
Факторы, повышающие риск рождения детей с хромосомными болезнями
Причины возникновения хромосомных болезней до настоящего времени недостаточно изучены. Имеются экспериментальные данные о влиянии на мутационный процесс таких факторов, как: действие ионизирующих излучении, химических веществ, вирусов. Другими причинами нерасхождения хромосом могут быть: сезонность, возраст отца и матери, порядок рождения детей, прием лекарств во время беременности, гормональные нарушения, алкоголизм и др. Не исключается до определенной степени и генетическое детерминирование нерасхождения хромосом. Повторим, однако, что причины образования геномных и хромосомных мутаций на ранних стадиях развития зародыша до сих пор окончательно не раскрыты.
К биологическим факторам повышения риска рождения детей с хромосомными аномалиями может быть отнесен возраст матери. Риск рождения больного ребенка особенно резко возрастает после 35 лет. Это характерно для любых хромосомных болезней, но наиболее четко наблюдается для болезни Дауна.
В медико-генетическом планировании беременности особое значение уделяется двум факторам — наличию анеуплоидии по аутосомам у ребенка и возрасту матери старше 35 лет.
К кариотипическим факторам риска у супружеских пар относятся: анеуплоидия (чаще в мозаичной форме), робертсоновские транслокации (слияние двух телоцентрических хромосом в области деления) кольцевые хромосомы, инверсии. Степень повышения риска зависит от типа хромосомных нарушений.

Синдром Дауна (трисомия по 21 паре хромосом)
Причина: Нерасхождение 21 пары аутосом, транслокация 21 аутосомы на аутосому группы D или G. У 94% кариотип — 47 хромосом. Частота проявления синдрома увеличивается с возрастом матери.
Клиника: Признаки, позволяющие диагностировать заболевание, в типичных случаях выявляются на самых ранних этапах жизни ребенка. Малый рост ребенка, маленькая круглая голова со скошенным затылком, своеобразное лицо — бедная мимика, косой разрез глаз со складкой у внутреннего угла, нос с широкой плоской переносицей, маленькие деформированные ушные раковины. Рот обычно полуоткрыт, язык толстый, неповоротливый, нижняя челюсть иногда выступает вперед. На щеках часто отмечается сухая экзема. Обнаруживается укорочение конечностей, особенно в дистальных отделах. Кисть плоская, пальцы рук широкие, короткие. В физическом развитии отстают, однако не резко, но нервно-психическое развитие замедленно (плохо развита речь). С возрастом выявляется ряд новых черт заболевания. Голос грубеет, отмечается близорукость, косоглазие, конъюнктивиты, неправильный рост зубов, кариес.Слабо развита иммунная система, инфекционные заболевания протекают крайне тяжело и в 15 раз чаще, чем у других детей. Встречается острый лейкоз.
Патогенез: Патологии внутренних органов, сердечно-сосудистые дефекты.
Диагностика: Клиническое обследование, подтверждаемое цитогенетическим анализом кариотипа.
Лечение: Комплексная терапия, включающая правильную организацию режима, рационально построенная медико-педагогическая работа, лечебная физкультура, массаж, медикаментозное лечение.

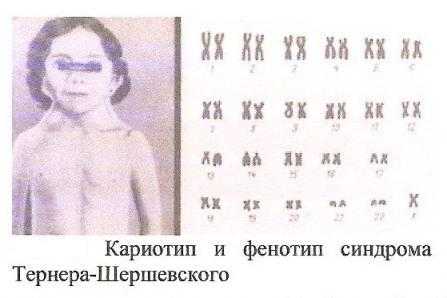
Синдром Тернера-Шершевского (ХО)
Причина: Нерасхождение половых хромосом, отсутствие одной Х-хромосомы, кариотип — 45 хромосом.
Клиника:Низкий рост,непропорциональное строение тела, полная короткая шея с крыловидными кожными складками, широкая грудная клетка, Х-образное искривление коленей. Уши деморфированы, низко расположены. Отмечается неправильный рост зубов. Половой инфантилизм. Снижение умственного развития.
Патогенез: В пубертатный период недоразвитие половых органов и вторичных половых признаков, поражение сосудистой системы, аномалии мочевой системы, уменьшение остроты зрения, слуха.
Диагностика: У новорожденных ее установить трудно. С возрастом диагностика основывается на клинической картине и определении патологии кариотипа и полового хроматина.
Лечение: Симптоматическое, направленное на увеличение роста. Для увеличения роста используются анаболические гормоны. С 13-15 лет начинают лечение эстрогенными препаратами. Полного выздоровления не наблюдается, однако лечебные мероприятия могут улучшить состояние
больных.

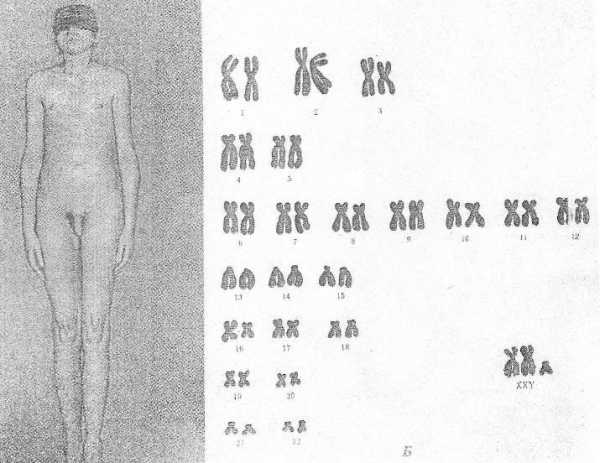
Синдром Клайнфельтера (XXY; XYY; XYYYY; XXXY)
Причина: Нерасхождение половых хромосом, вследствие чего увеличивается число X или Y хромосом в клетке, кариотип — 47 (XXY), 48 и более хромосом.
Клиника: Высокий рост, отсутствие залысин на лбу, плохой рост бороды, гинекомастия, остеохондроз, бесплодие, слаборазвиты мышцы, аномалия зубов и костной системы. Больные могут демонстрировать сниженный интеллект. С увеличением X-хромосом увеличивается умственная отсталость до полной идиотии, с увеличением Y-хромосом — агрессивность. Больные с более глубокой степенью интеллектуального дефекта могут обнаруживать ряд психопатологических признаков: они мнительны, склонны к алкоголизму, способны совершать различные правонарушения.
Патогенез: В пубертатном периоде обнаруживается недоразвитие первичных половых признаков.
Диагностика: Основана на клинических данных, а также на определении патологического кариотипа цитогенетическим методом, что подтверждается исследованием полового хроматина в клетках.
Лечение: Терапия с помощью мужских половых гормонов для увеличения потенции. Психотерапия.
Синдром Волъфа-Хиршхорна
Причина: У 80 % страдающих им новорожденных цитологическую основу данного синдрома составляет деления короткого плеча 4-й хромосомы. Размеры делеции колеблются от небольших терминальных до занимающих около половины дистальной части короткого плеча. Отмечается, что большинство делеции возникает заново, около 13 % происходит, в результате транслокаций у родителей. Реже в геноме больных, помимо траснлокации, имеются и кольцевые хромосомы. Наряду с делениями хромосом, патология у новорожденных может быть обусловлена инверсиями, дупликациями, изохромосомами.
Клиника: У новорожденных небольшой вес при нормальной продолжительности беременности. Также отмечаются микроцефалия, клювовидный нос, эпикант, антимонголоидный разрез глаз (опущение наружных углов глазных щелей), аномальные ушные раковины, расщелина верхней губы и неба, маленький рот, деформация стоп и др. Дети с синдромом Вольфа-Хиршхорна маложизнеспособны, как правило умирают в возрасте до одного года.
Патогенез: Болезнь характеризуется многочисленными врожденными пороками развития, задержкой умственного и психомоторного развития.
Диагностика: По клинической картине.
Лечение: Не существует.
Синдром трисомии (XXX)
Причина: Нерасхождение половых хромосом в результате нарушения работы митотического веретена деления во время мейоза, кариотип — 47 хромосом.
Клиника: Пузырное нерасхождение плаценты; новорожденный имеет небольшой, широкий задний родничок, недоразвитые затылочные и теменные кости черепа. Отставание в развитии на 6-7 месяцев. Низко расположены деформированные ушные раковины. Синдактилия пальцев кисти, расщелина губы и неба, гидроцефалия. Многие женщины нормально развиты, интеллект ниже среднего. Частота развития шизофреноподобных психозов увеличивается второе.
Патогенез: Пороки развития внутренних органов.
Диагностика: По клинической картине и цитогенетическому определению патологии кариотипа и полового хроматина.
Лечение: Симптоматическое.

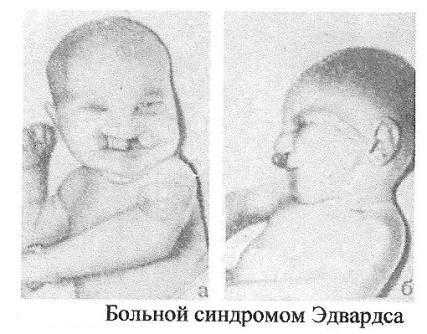
Синдром Эдвардса (трисомия по 18 паре хромосом)
Причина: Нерасхождение аутосом на стадии гамет (иногда зигот). Лишняя хромосома в 18 паре. Кариотип 47, Е18+. Выражена зависимость частоты рождения больных детей от возраста родителей.
Клиника: Пренатальное недоразвитие, слабая активность плода, нарушения строения лица (короткие глазные щели, маленькая верхняя челюсть) и костно-мышечной системы практически постоянны. Ушные раковины деформированы и в подавляющем большинстве случаев расположены низко. Грудина короткая, ядра окостенения расположены неправильно и в меньшем количестве. Спинномозговые грыжи и расщелины губ.
Патогенез: Наиболее постоянны пороки сердца и крупных сосудов. Нарушения развития головного мозга, в основном гипоплазия мозжечка и мозолистого тела. Из пороков глаз чаще всего обнаруживается микроанафтольмия. Врожденное отсутствие щитовидной железы и надпочечников.
Диагностика: Клинический осмотр, дерматоглифика,
цитогенетическое обследование.
Лечение: Отсутствует, 90% детей умирают на первом году жизни. Выжившие дети умирают от инфекционных заболеваний, чаще от пневмонии.

Синдром Патау (трисомия но 13 таре аутосом)
Причина: Нерасхождение аутосом 13 пары в гаметогенезе у одного из родителей. Кариотип — 47, D13+ .
Клиника: Аномалии черепа и лица, окружность черепа обычно уменьшена, в ряде случаев имеется выраженная тригоноцефалия. Умеренная микроцефалия сочетается со сравнительно низким и скошенным лбом, узкими глазными щелями, запавшим предносьем с широким основанием носа, низко расположенными и деформированными ушными раковинами. Расстояние между глазными щелями часто уменьшено. На коже головы имеются дефекты скальпа овальной или круглой формы. Часто – заячья губа и волчья пасть. Аномалии костно-мышечной системы, полидактилия.
Патогенез: Смертность в течение первого года жизни (90%). Основной причиной смерти детей являются тяжелые, несовместимые с жизнью пороки развития: дефекты сердечно-сосудистой и мочеполовой систем, аномалии толстой кишки, пупочная грыжа, нарушения строения глазных яблок, постоянны микроанофтальмия, дисплазия сетчатки, катаракты. Врожденные пороки сердца встречаются у 80% детей.
Диагностика: Основана на клиническом, цитогенетическим исследованиях.

Синдром «кошачьего крика»
Причина: Делеция короткого плеча хромосомы 5-й пары. Кариотип 46, 5р-.
Клиника: Патологическое строение голосовых связок — сужение, мягкость хрящей, отечность и необычная складчатость слизистой, мяуканье кошки. Недоразвитие речи. Микроцефалия. Лунообразное лицо, монголоидный разрез глаз, косоглазие, катаракта, атрофия зрительного нерва, плоская спинка носа, высокое нёбо, деформированные ушные раковины. Косолапость. Задержка умственного и физического развития. Продолжительность жизни значительно снижена, только около 14% больных переживают возраст 10 лет.
Патогенез: Порок сердца.
Диагностика: Клиническое обследование с выявлением наиболее постоянного признака синдрома — «кошачий крик», дерматоглифика и цитогенетическое выявление патологии кариотипа.
Лечение: Отсутствует.
Синдром Орбели
Причина: Деления длинного плеча аутосомы 13.
Клиника: Лоб переходит в нос, не образуя носовой вырезки. Большое расстояние между глазами. Широкая спинка носа, высокое нёбо, низко расположенные диспластичные ушные раковины, пороки развития глаз (косоглазие, катаракта). Пороки опорно-двигательного аппарата -неспецифические аномалии (косолапость, вывих тазобедренных суставов). Задержка роста и психомоторного развития; характерна глубокая олигофрения. Больные с развернутой клинической картиной синдрома погибают на первом году жизни.
Патогенез: Аномальное развитие практически всех органов и систем; микроцефалия; врожденные пороки сердца и аномалии прямой кишки.
Диагностика: Цитогенетическое, клиническое обследование.
Лечение: Отсутствует.
Синдром Мориса
Причина: Мутация гена, нарушающая образование нормального белка — рецептора, делает ткани-мишени невосприимчивому гормону, направляющему их развитие по мужскому типу. Не использовав такую возможность на определенном этапе онтогенеза, организм осуществляет развитие по женскому типу.
Клиника: Появляется особь с кариотипом XY, но внешне более сходна с женщиной. Такие субъекты не способны иметь потомство, так как их половые железы (семенники) недоразвиты, а их выводные протоки часто формируются по женскому типу (недоразвитая матка, влагалище). Вторичные половые признаки также характерны для женского пола.
Патогенез: Недоразвитые половые органы.
Диагностика: Цитогенетическое, клиническое обследование.
Лечение: Гормональная терапия.
studfile.net