Нормы гормонов для эко: Гормоны при ЭКО: какие гормоны сдать перед ЭКО?
Амг для ЭКО по ОМС. Что это такое?
Что такое АМГ для ЭКО
Антимюллеров гормон (сокращенно АМГ) – важнейший гормон, применяемый для оценки овариального резерва и, соответственно, перспектив для ЭКО (или естественного зачатия, если речь о консультировании при планировании беременности). АМГ как диагностический маркер появился и утвердился в клинической практике относительно недавно, и, вместе с данными УЗИ, позволяет прогнозировать ответ яичников на стимуляцию, включая риск развития синдрома гиперстимуляции и, наоборот, плохой (бедный) ответ. В соответствии с оценкой фолликулярного резерва репродуктологи могут подбирать препараты, их дозы и схемы применения (протоколы).
Назван гормон в честь ученого, Иоганна Мюллера, выделившего у мужских и женских эмбрионов общую канал-трубку — мюллеров проток, из которого развиваются матка, маточные трубы и влагалище у женщин и простатическая «маточка» и придаток яичка у мужчин. Считается доказанным, что существует прямая зависимость между уровнем гормона и количеством оставшихся в яичниках яйцеклеток (овариального резерва).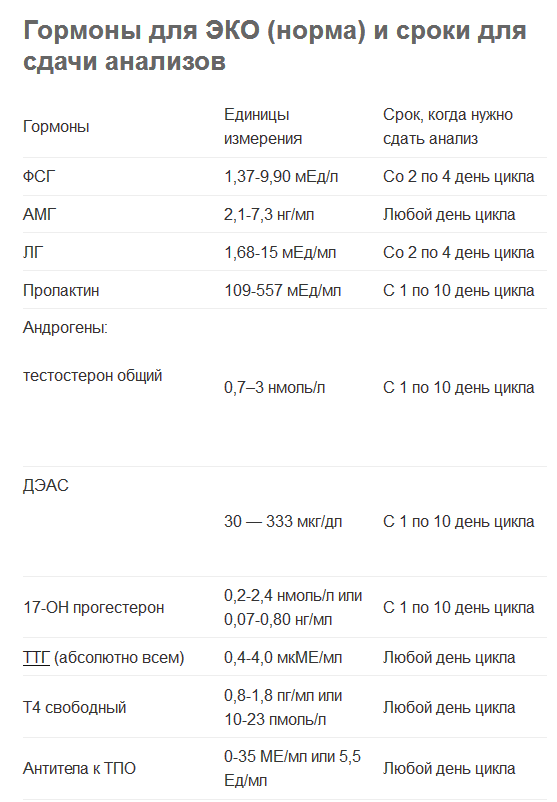
Обычно необходимость сдать анализ крови на АМГ возникает для решения вопроса о выборе плана лечения бесплодия; хотя все чаще супружеские пары, особенно старшего (35+) возраста, сдают анализ на этапе планирования беременности. Анализ АМГ для ЭКО имеет важнейшее значение, он указывает, насколько срочно нужно начинать процедуру, какие дозы гонадотропинов стоит назначать, наконец, необходимость применения донорских клеток в процедуре ЭКО.
Какая норма гормона для ЭКО
В классическом варианте (с использованием стандартного диагностического набора) норма АМГ составляет от 0,03 до 7,37 нг/мл для женщин в возрасте от 26 до 40 лет. С широким распространением теста на АМГ появились диагностические наборы разных производителей, поэтому нормы могут быть разные: перед интерпретацией результатов следует изучить норму, принятую в данной лаборатории.
Интерпретация полученных цифр не сводится только к оценке уровня (выше или ниже нормы). В наилучшем варианте интерпретировать полученные результаты должен врач-репродуктолог: именно он может сопоставить данные анамнеза пациентки, ультразвукового исследования и, только после этого давать оценку репродуктивной функции.
Отклонения от нормы и прогнозы на беременность
Имеющиеся нормы основаны на многолетних исследованиях и наблюдениях физиологов и репродуктологов всего мира. Полученные результаты можно условно разделить на три категории:
-
АМГ выше нормы или близко/на уровне верхней границы нормы. Прогноз на беременность естественным путем или путем инсеминации вполне благоприятный; нужно учитывать, что при таких показателях АМГ нередко выявляются гормональные нарушения, ановуляция, которые и могут приводить к бесплодию. В таких случаях необходимо подробное обследование с целью уточнения диагноза и составления правильного плана лечения.

-
АМГ в норме. Прогноз благоприятный как на естественную беременность, так и на зачатие с помощью ЭКО/ВМИ. Нормальный АМГ — прогностически наиболее благоприятный показатель для ЭКО.
-
АМГ ниже нормы. Ситуация требует незамедлительных мер по достижению беременности, так как овариальный резерв истощён. Предпочтительнее всего ЭКО. Перспективы ЭКО таковы: может понадобиться не одна попытка и тут оптимизация плана лечения напрямую зависит от искусства врача.
Повторим, что судить отдельно о прогнозе только по результатам исследования крови на АМГ неправильно: во-первых, имеют значения все обстоятельства, учитываемые при оценке ситуации, а, во вторых, любой, даже самый рутинный, анализ требует подтверждения; в случае с АМГ таким подтверждающим показателем считается уровень ФСГ (фолликулостимулирующего гормона).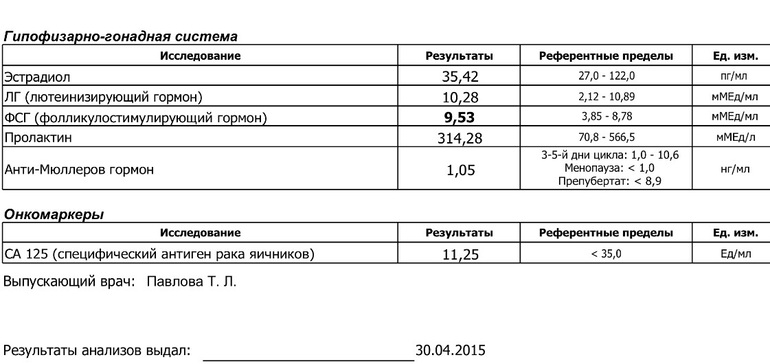
Тем не менее, из скрининговых методов прогнозирования анализ на АМГ самый важный.
Можно ли повысить АМГ
Ответ однозначный – нет! Небольшие колебания показателей при понятной общей тенденции – не в счет. Нужно понять, что искусственное повышение АМГ (если такие способы и существуют) – занятие довольно бессмысленное и не ведет к улучшению прогноза, ведь АМГ только отражает овариальный запас. Единственное, для чего оправданы попытки наших пациенток добиться повышения АМГ – это увеличение шансов на получение «квоты» по ОМС. Но это никаким образом не улучшает прогноз и намного перспективнее связаться с клиникой, где планируется проведение ЭКО, и получить некое «гарантийное письмо», которое может помочь в получении направления («квоты»).
Низкий АМГ и зачатие
Наиболее сложная ситуация, когда низкие цифры АМГ указывают на снижение овариального резерва и это подтверждается на УЗИ. В некоторых случаях ультразвуковая картина вполне позволяет надеяться на самостоятельное зачатие или успешное ЭКО/ВМИ. Но вот когда уровень АМГ подтверждается ультразвуковой картиной, важно правильно оценить общую ситуацию, и, если низкий овариальные резерв обнаружен у женщины младше 35 лет, и спермограмма супруга нормальная, имеет смысл попытаться достичь беременности с помощью «программированного зачатия», когда попытки забеременеть делаются под ультразвуковым контролем овуляции. И напротив, если скудный запас яйцеклеток обнаружен у пациенток старше 35, нужно подумать об ЭКО, чтоб не тратить зря драгоценное время (и не терять яйцеклетки).
ЭКО при низком показателе антимюллерова гормона
ЭКО – наиболее эффективный способ лечения бесплодия, уже 40 лет доказывающий эффективность во всем мире.
Снижение овариального резерва, подтвержденное низким уровнем АМГ, — показание к ЭКО у большинства пар старше 35 лет. Сложность ЭКО в таких ситуациях в том, что стимуляция яичников гонадотропинами менее эффективна, чем при нормальном овариальном резерве. Другими словами, количество яйцеклеток, которые можно получить в процессе стимуляции, мало, а, значит, вероятность получения беременности в результате одной стимуляции снижается. С целью повышения эффективности принято повышение доз гонадотропинов для стимуляции и, в случае отсутствия эффекта, «накопление яйцеклеток/эмбрионов. В последнем случае проводится несколько протоколов ЭКО со стимуляцией или в естественном цикле, перенос не делают, а эмбрионы «накапливают» — замораживают с тем, чтобы перенос сделать позже.
Нередко накопление эмбрионов нужно для проведения ПГД (преимплантационной генетической диагностики) с целью выбора «здоровых» эмбрионов; это резко повышает вероятность беременности. Если получить яйцеклетки не удается, ставится вопрос о применении донорских.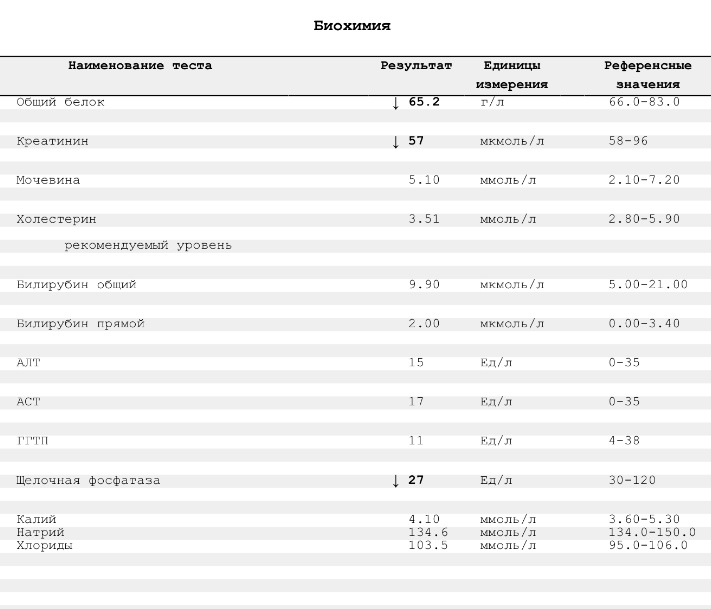
Особенности проведения процедуры по ОМС
Процедура получения «Направления на ЭКО по ОМС» стандартна и незначительно различается в зависимости от региона. Самое главное – в некоторых регионах применяются критерии отбора пациентов в зависимости от цифр АМГ. Объясняется это следующим:
Общеизвестно, что с возрастом овариальный резерв снижается в связи с расходованием его в течение репродуктивного периода. Возраст, когда снижение станет критичным, зависит от многих обстоятельств: от исходного резерва, операций на яичниках, от наследственных факторов. И, при достижении критического снижения овариального резерва, беременность с применением своей яйцеклетки становится для женщины проблематичной. Именно на этом (а не на возрасте) основаны ограничения, установленные в некоторых регионах. Другими словами, отбор пациенток проводится на основании не возраста, а цифр АМГ. И действенным способом «добиться» направления на ЭКО по ОМС – пройти консультацию репродуктолога в клинике, в которой планировалась ЭКО и выработать план лечения.
Заключение
Супружеская пара, планирующая беременность или испытывающая проблемы с наступлением беременности, должна пройти первичное обследование у репродуктолога. Накопленные к настоящему моменту знания и имеющиеся технологии позволяют получить практически полную картину в сжатые сроки. АМГ – одна из важнейших составляющих общей картины, которая помогает максимально точно представить состояние репродуктивной системы женщины, готовящейся стать матерью.
ЭКО при низком АМГ в ICLINIC
Одним из возможных проявлений эндокринной формы женского бесплодия является сниженный уровень антимюллерова гормона ( АМГ или антимюллерова фактора). Недостаточная выработка этого вещества не только приводит к проблемам с естественным зачатием, но и считается важнейшей причиной неудач при использовании ВРТ. Поэтому проведение ЭКО при низком АМГ требует от врача тщательнейшего подбора индукционной терапии.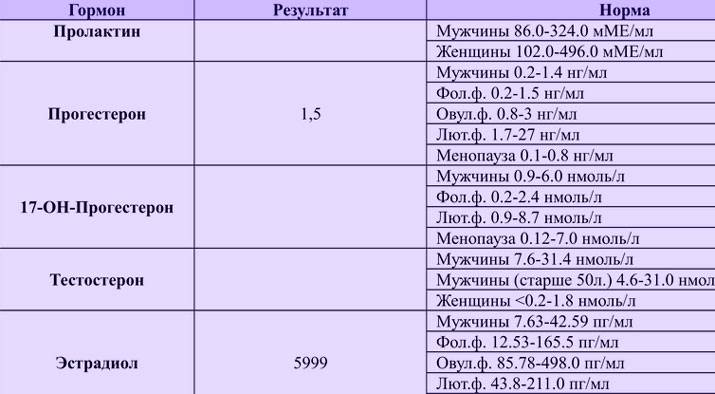
Антимюллеров гормон: зачем он нужен?
АМГ начинает вырабатываться уже внутриутробно. И основной его задачей в этот период является регулирование половой дифференцировки. Это обеспечивается подавлением развития так называемого Мюллерова (парамезонефрального) протока у эмбрионов мужского пола. Поэтому гормон так и называется.
Дело в том, что поначалу у всех эмбрионов имеются зачатки обоих типов репродуктивной системы. Дальнейшая дифференцировка по полу происходит путем регресса одного образования-предшественника с продолжением развития другого. Этот процесс является гормонально зависимым, и его важнейшим регулятором является АМГ .
Первично подавляется развитие Мюллерова протока у эмбрионов мужского пола. Это происходит примерно с 8 недели гестации, причем выработка АМГ сохраняется в течение всего последующего внутриутробного периода. А вот у девочек этот фактор активируется только в антенатальном периоде. К тому же вырабатывается он в гораздо меньших количествах во избежание подавления нормального органогенеза репродуктивной системы. Если же у эмбриона низкий АМГ , ребенок рождается с малодифференцированными гениталиями.
Если же у эмбриона низкий АМГ , ребенок рождается с малодифференцированными гениталиями.
Но функция этого гормона не ограничивается влиянием на развитие репродуктивной системы. Большое значение он имеет и при наступлении фертильного периода у женщин. До подросткового возраста (у девочек) АМГ низкий . Активация его секреции совпадает с началом «пробуждения» заложенных внутриутробно примордиальных фолликулов. В них содержатся незрелые ооциты (яйцеклетки) в остановившейся фазе мейотического деления.
Основной функцией АМГ в детородном периоде у женщин является контроль над количеством примордиальных фолликулов, которые будут развиваться в текущем овариально-менструальном цикле. Такой механизм регуляции предотвращает созревание чрезмерного количества яйцеклеток и позволяет избегать быстрого истощения фолликулярного запаса. При этом АМГ действует только на фолликулы, которые находятся на доантральной стадии развития и еще не чувствительны к гонадотропинам. Его считают ключевым фактором, регулирующим выбор доминантного фолликула.
Чем АМГ отличается от других половых гормонов?
Антимюллеров фактор – особое регуляторное вещество репродуктивной системы. К его ключевым особенностям относят:
- Белковая, а не стероидная основа. АМГ – димерный гликопротеин, в отличие от всех остальных половых гормонов.
- Наличие в организме у лиц обоих полов, хотя и в разной концентрации и в различные возрастные периоды.
- Независимость от активности гипоталамо-гипофизарной системы. Поэтому выработка антимюллерова фактора не регулируется каким-либо гонадотропным гормоном.
- Отсутствие клинически значимых цикличных изменений уровня этого гормона в крови. Количество вырабатываемого АМГ практически не зависит от фазы овариального цикла.
- Недостаток АМГ восполнить с помощью препаратов невозможно. Нельзя и простимулировать его выработку. Поэтому период подготовки к ЭКО при низком АМГ не включает никаких мер для коррекции уровня этого фактора.
Какова норма АМГ у женщин?
Уровень АМГ зависит от возраста женщины. Его активная секреция регистрируется с момента полового созревания, постепенно усиливаясь. В 20–30 лет обычно продуцируется максимально возможное количество этого гормона, что соответствует наиболее фертильному возрасту женщины. В последующем, по мере естественного обеднения запаса фолликулов, уровень АМГ начинает снижаться. И в период менопаузы он необратимо падает практически до 0.
Его активная секреция регистрируется с момента полового созревания, постепенно усиливаясь. В 20–30 лет обычно продуцируется максимально возможное количество этого гормона, что соответствует наиболее фертильному возрасту женщины. В последующем, по мере естественного обеднения запаса фолликулов, уровень АМГ начинает снижаться. И в период менопаузы он необратимо падает практически до 0.
Общепринятой нормой АМГ у женщин репродуктивного возраста считается концентрация в крови в пределах 4,0–6,8 нг/мл. Допустимым (нормально низким) является уровень 2,2–4,0 нг/мл. При показателе менее 0,3 нг/мл говорят об очень низком АМГ .
Обязательно учитывают и возрастной фактор. У женщин в 25 лет средний уровень АМГ составляет 4,1 нг/мл. К 35 годам он снижается до 2,1 нг/мл, а к 40-летнему возрасту – уже до 1,1 нг/мл.
Клиническое значение результатов теста на АМГ
Источником АМГ у женщин являются яичники. Точнее, гранулезная ткань фолликулов диаметром менее 8 мм. При этом имеется прямая зависимость между количеством потенциально готовых к развитию незрелых ооцитов и уровнем гормона в крови. Поэтому определение антимюллерова фактора – важное и очень информативное исследование в репродуктологии.
При этом имеется прямая зависимость между количеством потенциально готовых к развитию незрелых ооцитов и уровнем гормона в крови. Поэтому определение антимюллерова фактора – важное и очень информативное исследование в репродуктологии.
Анализ на АМГ в ICLINIC позволяет оценивать:
- Сохранность фолликулярного резерва. Снижение АМГ до менопаузальных показателей у женщины репродуктивного возраста служит признаком преждевременного истощения яичников. Такое возможно также при массивном склерозе их тканей или вследствие хирургического вмешательства на придатках.
- Функциональность яичников.
- Потенциал фертильности, особенно у молодых женщин.
- Перспективность ответа на индукцию гиперовуляции при использовании ЭКО . При низком АМГ можно ожидать слабую фолликулярную реакцию в стандартных протоколах.
- Риск формирования синдрома гиперстимулированных яичников. Вероятность такого осложнения увеличивается в случае повышенного уровня АМГ при ЭКО .

- Вероятность раннего наступления менопаузы. Низкий АМГ – предиктор преждевременного завершения детородного периода у женщин.
Рекомендуется определять АМГ при ЭКО , после цитотоксической терапии и перенесенных оперативных вмешательств на придатках, наследственной отягощенности по синдрому поликистозных яичников и ранней менопаузе, при ряде других состояний.
Но не стоит забывать, что адекватно оценить результаты анализов может только врач. Ведь для определения возможности самостоятельного зачатия и прогноза ЭКО при низком АМГ необходимо комплексное обследование. И уточнение уровня антимюллерова фактора обычно является лишь одним из его компонентов.
Кроме того, даже нормальный и высокий АМГ при ЭКО не всегда означает хорошую перспективу зачатия. Например, у женщин старше 41 года не прослеживается прямой корреляции между успешностью ВРТ и уровнем антимюллерова фактора. Поэтому норма АМГ при ЭКО не является единственным определяющим условием для выбора тактики лечения.
Особенности ЭКО при низком АМГ
Нормой АМГ для ЭКО признаны показатели, укладывающие в границы 1,2–5,0 нг/мл. Но и отклонения от таких цифр не означают для женщины невозможность участия в программах ВРТ. В протоколы могут быть включены пациентки с недостаточной или повышенной продукцией этого фактора.
ЭКО при низком АМГ имеет свои особенности и требует от врача тщательного подбора протокола. Это необходимо не только для повышения вероятности получения ооцитов хорошего качества, но и для уменьшения риска осложнений от индукции овуляции. Нередко дополнительно используются криоконсервация полученных ооцитов и ИКСИ.
При низком АМГ ЭКО проводится чаще всего по длинному протоколу, с назначением невысоких доз гонадотропинов и агонистов ГнРГ. В большинстве случаев такая тактика снижает вероятность снятия пациентки с цикла ВРТ из-за синдрома гиперстимуляции яичников.
Но репродуктолог может принять решение и об использовании других протоколов ЭКО при низком АМГ у женщины. Ведь согласно данным клинических исследований, ни один из современных вариантов индукции овуляции не обладает достоверным преимуществом перед другими у пациенток с недостаточным фолликулярным резервом. Поэтому тактика лечения определяется репродуктологом индивидуально.
Ведь согласно данным клинических исследований, ни один из современных вариантов индукции овуляции не обладает достоверным преимуществом перед другими у пациенток с недостаточным фолликулярным резервом. Поэтому тактика лечения определяется репродуктологом индивидуально.
Наступление беременности даже с помощью ЭКО при низком АМГ – не рядовая задача. И многое зависит от опыта и навыков врача, подбирающего женщине оптимальный протокол индукции овуляции. Важна также возможность использования криопрограмм, которые помогают сохранить полученные ооциты для последующих попыток зачатия. Поэтому при выявлении отклонений АМГ желательно обращаться к действительно квалифицированному врачу.
Клиника репродуктивной медицины «ICLINIC» – один из ведущих специализированных центров СПб по лечению практически любых форм супружеского бесплодия. Эффективность проводимых здесь ЭКО обеспечивается высокой квалификацией врачей, вниманием к малейшим деталям, использованием только современных, проверенных и результативных методик вкупе с индивидуализацией подхода к каждой пациентке.
Беременность при низком АМГ — Семейный медицинский центр «Лейб Медик»
АМГ или антимюллеров гормон – важный фактор в планировании беременности, так как он является маркером овариального резерва женщин. Вероятность забеременеть при низком АМГ незначительна – в яичниках нет яйцеклеток, готовых к зачатию. Главная причина снижения показателя – возраст после 35, но у молодых истощение резерва тоже бывает. Искусственно повысить АМГ нельзя, однако шанс зачать и выносить ребенка все же есть. На помощь приходит вспомогательный метод оплодотворения – ЭКО.
О чем говорит низкий АМГ?
АМГ (антимюллеров гормон) – это показатель, точно отражающий состояние овариального резерва женщины. Этот резерв показывает количество яйцеклеток в яичниках, которые необходимы для зачатия и наступления беременности. АМГ определяется также у мужчин и тоже может быть маркером нарушений сперматогенеза.
Антимюллеров гормон выявляется у мужчин и женщин на протяжении всей жизни. Максимальные показатели у мужчин отмечаются в пубертатном периоде, у женщин пик гормона – этап полового созревания, во время формирования фолликулов.
Максимальные показатели у мужчин отмечаются в пубертатном периоде, у женщин пик гормона – этап полового созревания, во время формирования фолликулов.
Определение показателя назначается в следующих ситуациях:
- Возраст старше 35 лет
- Не была выявлена причина бесплодия в ходе предварительных обследований
- Повышен ФСГ (или верхняя граница нормы)
- Неудачные попытки ЭКО в анамнезе
- Отсутствие ответа яичников на гормональную стимуляцию
Особенности и нормы АМГ у мужчин и женщин
| Где вырабатывается? | За что отвечает? | Показатели нормы (нг/мл) | |
| Женщины | Вырабатывается гранулезными клетками яичников до наступления менопаузы. | Регулирует формирование доминантного фолликула. | • До 9 лет – 1,7-5,3 • Средняя норма – 4-6,8 • Нижний порог нормы – 2,2-4 • Возраст 35-40 лет – 2,1-1,0 • После 40 – меньше 1,0 |
| Мужчины | Вырабатывается клетками Сертоли в семенных канальцах. |
• Сперматогенез • Синтез андрогенов |
• До 9 лет – 46,4-53,6 • Начало полового созревания – 31,2-38,6 • По окончании полового созревания –4,8-9,6 • Взрослые – 4,8-5,6 |
Снижение АМГ свидетельствует об истощении овариального резерва у женщин. Данная проблема очень актуальна в современной репродуктологии, так как встречается не только у женщин старше 35 лет, но и у молодых девушек. Сдача АМВ – один из признаков истощения, дополнительно проверяется число антральных фолликулов в естественном цикле на 4-5 день.
Причины низкого АМГ
- Возраст (ключевой фактор естественного снижения показателя, но даже при патологическом истощении резерва процент успешных беременностей и протоколов ЭКО выше в молодом возрасте)
- Хирургические вмешательства на яичниках и органах малого таза в анамнезе
- Генетические аномалии (в том числе дефекты развития репродуктивной системы)
- Гипергонадотропная аменорея
- Ожирение или чрезмерное истощение
- Преждевременная менопауза
- Синдром поликистозных яичников
- Криптогенное истощение резерва
Можно ли забеременеть при низком АМГ?
Недостаток АМГ – ниже 1 нг/мл – все равно оставляет женщине шанс забеременеть. Критически низкий показатель гормона отмечается при результатах менее 0,2 нг/мл. Шанс успешной самостоятельной беременности крайне мал. Однако даже в таких ситуациях остается возможность забеременеть самостоятельно.
Критически низкий показатель гормона отмечается при результатах менее 0,2 нг/мл. Шанс успешной самостоятельной беременности крайне мал. Однако даже в таких ситуациях остается возможность забеременеть самостоятельно.
При сниженном показателе АМГ от 0,9 до 0,2 нг/мл проверяется фолликулостимулирующий гормон. Если ФСГ низкий, то остается шанс естественной беременности с низким АМГ. Однако планирование нужно начинать сразу же, ведь с течением времени показатель антимюллерова гормона будет только падать.
Женщинам с низким АМГ и планами на самостоятельную беременность в клинике «Лейб Медик» предоставляется комплексная поддержка. В случае необходимости проводится поддерживающая гормональная терапия для стимуляции созревания фолликулов. Индивидуальный подход позволяет добиться положительного результата даже при незначительных уровнях АМГ.
Каковы шансы успешного ЭКО?
При отсутствии результатов консервативного лечения остается возможность проведения ЭКО при низком АМГ. Стоит учитывать, что неудачи в искусственном оплодотворении с истощенным резервом случаются достаточно часто.
Стоит учитывать, что неудачи в искусственном оплодотворении с истощенным резервом случаются достаточно часто.
Особенности проведения ЭКО с низким АМГ:
- Обязательное проведение предимплантационного генетического исследования
- Применение донорских яйцеклеток, если АМГ стремится к 0, а антральных фолликулов нет вообще
- Заморозка эмбрионов во всех циклах и последующая селекция самого сильного (японский протокол)
- Предварительная гормональная стимуляция для созревания фолликула с повышенной кратностью программы ЭКО
При сниженном АМГ, но с числом антральных фолликулов более 3 проводится классический протокол ЭКО. Но при этих показателях также можно попробовать добиться естественной беременности.
Как повысить АМГ?
Повысить амнтимюллеров гормон искусственным образом не представляется возможным. Он всего лишь маркер истощения овариального резерва. Даже лучший репродуктолог не сможет увеличить концентрацию гормона, а небольшие колебания при повторных сдачах анализа обусловлены погрешностями лаборатории. Для планирования беременности важно определить число антральных фолликулов.
Даже лучший репродуктолог не сможет увеличить концентрацию гормона, а небольшие колебания при повторных сдачах анализа обусловлены погрешностями лаборатории. Для планирования беременности важно определить число антральных фолликулов.
Считается, что прием КОК (контрацептивов) повышает уровень АМГ. Однако это всего лишь заблуждение. Всегда нужно помнить, что в женском организме изменение показателя гормона АМГ происходит только в сторону уменьшения. Поэтому лучше заранее определить этот маркер, чтобы проанализировать состояние репродуктивной системы.
Отзывы врачей и пациентов
Отзывы об ЭКО при низком АМГ достаточно разнообразные, но неудачные попытки – очень распространенное явление. Мнения врачей о низком АМГ и реальные истории пациентов показывают, что шансы на самостоятельную беременность есть всегда.
Врач
«Низкий АМГ – распространенное явление среди женщин старше 35 лет. Сейчас идет тенденция к позднему планированию беременности, поэтому подобные ситуации встречаются часто. Несмотря на то, что повлиять на показатель невозможно, многое зависит от ЧАФ. Если при исследовании их хотя бы 3-4, то можно попробовать добиться беременности даже без применения ЭКО.»
Несмотря на то, что повлиять на показатель невозможно, многое зависит от ЧАФ. Если при исследовании их хотя бы 3-4, то можно попробовать добиться беременности даже без применения ЭКО.»
Врач
«Многие стремятся сразу идти на протокол ЭКО с низким АМГ. Такая поспешность ни к чему, тем более при показателе АМГ меньше 1 в бесплатном проведении процедуры чаще всего отказывают. Да, современные протоколы учитывают овариальную истощенность, однако риск напрасно потраченных денег все равно остается. При этом, если у женщины не нулевое ЧАФ, то вполне можно пробовать забеременеть естественным путем. Единственное, что хочется добавить, не затягивайте, так как АМГ будет только снижаться.»
Пациент
«Когда мне было 26 лет, то начали планировать с мужем ребенка. Пытались даже не год, как положено, а два. Соблюдали все возможные предписания, но никакого эффекта. Потом начали оба обследоваться, но основные показатели были в норме. Пока мне не провели тест на АМГ. Точный результат не помню, но близко к 1. В общем, мы были в отчаянии, так как прочитали, что низкий показатель – предвестник климакса. Спасибо лечащему врачу, который грамотно подошел к нашей проблеме и буквально спустя полгода желанная беременность все же наступила.»
Пока мне не провели тест на АМГ. Точный результат не помню, но близко к 1. В общем, мы были в отчаянии, так как прочитали, что низкий показатель – предвестник климакса. Спасибо лечащему врачу, который грамотно подошел к нашей проблеме и буквально спустя полгода желанная беременность все же наступила.»
Пациент
«Мне всегда говорили, что низкий АМГ – это приговор. Повысить его нельзя, лечения нет. Делала несколько попыток ЭКО, но все неудачные. Но все же не сдалась и продолжила ходить по врачам, спрашивать мнения разные. Как хорошо, что в итоге натолкнулась на клинику «Лейб Медик». Меня комплексно обследовали, назначили курс лечения, наконец-то правильно проинформировали. Теперь нас в семье трое! До сих пор не верю, что все получилось.»
Видео
АМГ – маркер работы репродуктивной системы женщины. Беременность при низком АМГ может наступить, однако при определенных условиях. Рекомендуется заранее планировать ребенка, так как у молодых девушек больше шансов на зачатие при недостатке АМГ. Для тех, у кого уровень гормона на критическом уровне, существуют специальные программы ЭКО. Даже если подходящие яйцеклетки для ЭКО обнаружить не получается, всегда можно воспользоваться донорскими. Поэтому отчаиваться не стоит. Клиника «Лейб Медик» помогает планировать беременность и борется за естественное зачатие в клинических случаях любой сложности.
Для тех, у кого уровень гормона на критическом уровне, существуют специальные программы ЭКО. Даже если подходящие яйцеклетки для ЭКО обнаружить не получается, всегда можно воспользоваться донорскими. Поэтому отчаиваться не стоит. Клиника «Лейб Медик» помогает планировать беременность и борется за естественное зачатие в клинических случаях любой сложности.
Анализы на гормоны
Как правильно сдать анализы на гормоны
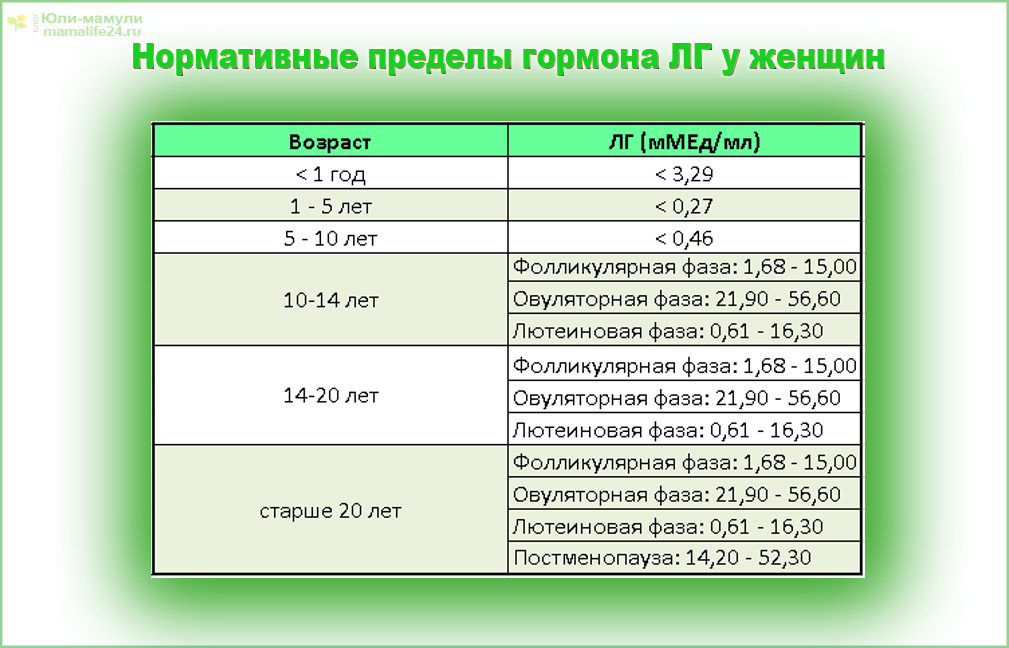
Анализы на фолликулостимулирующий (ФСГ) и лютеинезирующий (ЛГ) гормоны сдаются утром натощак, на 3-5 день цикла.
- За неделю до сдачи крови рекомендуется ограничить физическую активность,
- За 2-3 суток исключить алкоголь,
- В течение 3-х суток перед анализом соблюдать режим дня с полноценным сном и не допускать психоэмоциональных перегрузок.

Анализ на определение уровня прогестерона обычно сдают во второй половине менструального цикла (на 19-24 день).
Анализ на тестостерон рекомендуется сдавать на 2-5 день цикла.
Анализ на уровень эстрадиола в крови сдают натощак до 7 дня цикла.
Анализ на антимюллеров гормон (АМГ) желательно сдавать на 2-5 день (но не позднее 7 дня) менструального цикла.
Анализ на пролактин сдают в разные фазы цикла. Как подготовиться?
- Накануне необходимо: исключить алкоголь, стрессовые ситуации, физическую и половую активность, не посещать баню и сауну.
- За 1 час, а лучше за сутки до сдачи анализа откажитесь от курения.
- Перед сдачей анализа необходимо посидеть в полном покое 10-15 минут.
Сдать анализы на гормоны женского и мужского профиля вы можете в нашей клинике “БэбиБум” в рабочие дни клиники с понедельника по пятницу, а также в любой другой лаборатории по месту жительства.
ПОЛОВЫЕ ГОРМОНЫ
Фолликулостимулирующий и лютеинезирующий гормоны
При нарушениях менструального цикла, отклонениях в половом развитии и в поисках причин мужского и женского бесплодия, репродуктолог направит вас сдать анализы на фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны. Оба гормона играют важную роль в процессе зачатия и оплодотворения.
У женщин ФСГ и ЛГ контролируют развитие и функционирование фолликулов яичников. При овуляции вырабатывается наибольшее количество гормона, а затем происходит снижение его уровня. Соответственно при недостаточном уровне ФСГ фолликул не растет, а овуляция не происходит.
В мужском организме ФСГ отвечает за рост тестостерона в крови, активизирует развитие семявыносящих канальцев и семенников, созревание сперматозоидов.
Если фолликулостимулирующий гормон (ФСГ) выше нормы, это может сигнализировать о синдроме истощения яичников, аденоме гипофиза, о наличии эндометриоидных кист яичников, дисфункциональных маточных кровотечениях и др.
Если фолликулостимулирующий гормон (ФСГ) ниже нормы, это может говорить о гипоталамической аменорее, гиперлактинемии, голодании или ожирении.
Предпосылками к повышению лютеинизирующего гормона (ЛГ) могут быть: аденома гипофиза, синдром истощения яичников, СПКЯ, эндометриоз, почечная недостаточность и др.
Снижение уровня лютеинизирующего гормона (ЛГ) может говорить о стрессе, ожирении, гиперпролактинемии, вторичной аменорее.
Прогестерон
Относится к стероидным гормонам. Вырабатывается яичниками, желтым телом и плацентой. Его также называют гормоном беременности.
Прогестерон необходим для успешной имплантации эмбриона в матке, его дальнейшего роста и развития.
Снижение уровня прогестерона может спровоцировать прерывание беременности.
Тестостерон
Относится к стероидным гормонам (андрогенам). Вырабатывается преимущественно у мужчин, у женщин вырабатывается в значительно меньшем количестве.
У женщин повышение уровня тестостерона может приводить к нарушениям менструального цикла и препятствовать наступлению овуляции – развивается гиперандрогенное бесплодие.
У мужчин снижение уровня тестостерона приводит к снижению оплодотворяющей способности спермы и эректильной дисфункции.
Пролактин
Пролактин — главный женский гормон, который контролирует процессы овуляции, несёт ответственность за детородные функции и циклы менструаций.
Выработка пролактина происходит в передних долях гипофиза, в головном мозге. Его количество резко возрастает под воздействием стрессовых факторов, эмоциональных и физических перенапряжений. Именно поэтому гормон ещё называют стрессовым.
Пролактин оказывает огромное влияние на работу репродуктивной системы женщин и мужчин.
Во время беременности и кормления грудью он выступает в роли естественного контрацептива, предупреждая зачатие.
Однако существуют патологические причины повышения уровня этого гормона в крови.
Врачи рекомендуют пройти обследование на пролактин, если у женщины длительное время не получается забеременеть, нарушился менструальный цикл, снизилось сексуальное влечение, увеличился вес, ухудшилась работа щитовидной железы. Более подробно о гиперпролактинемии читайте в нашей статье
Эстрадиол
Женский стероидный гормон с наибольшей эстрогенной активностью, вырабатывается в основном в яичниках у женщин, в меньшей степени – яичками у мужчин, а также надпочечниками.
Эстрадиол влияет на общее состояние женщины: в первую очередь, он на функционирование яичников.
Антимюллеров гормон (АМГ)
Вырабатывается в организме мужчин и женщин.
Анализ крови на АМГ позволяет количественно оценить овариальный запас и спрогнозировать ответ яичников на стимуляцию овуляции.
Гормоны щитовидной железы
Большое значение имеет правильная работа щитовидной железы.
Ее состояние и функционирование отражает уровень тиреотропного гормона (ТТГ), свободного тироксина, антитела к тиреоглобулину и тиреопероксидазе.
При необходимости, коррекция уровня гормонов помогает подготовить организм женщины к ЭКО.
Какие именно анализы на гормоны нужно сдать, и в какие дни цикла потребуется провести исследования, определит ваш лечащий врач на консультации.
| Обследование женщины | Срок действия анализа | Условия сдачи | Где сдавать |
| Общий анализ мочи** | 1 месяц | вне менструации | Процедурный кабинет, необходима предварительная запись |
| Группа крови, резус-фактор* | однократно | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови клинический с лейкоцетарной формулой и СОЭ** | 1 месяц | строго натощак (не принимать пищу за 8 часов) | Процедурный кабинет, необходима предварительная запись |
| Анализ крови биохимический: креатинин, билирубин, общий белок, АСТ, АЛТ, мочевина, глюкоза** | 1 месяц | строго натощак (не принимать пищу за 8 часов) | Процедурный кабинет, необходима предварительная запись |
| Коагулограмма** | 1 месяц | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на ВИЧ 1,2 (антитела M и G)* | 3 месяца | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на сифилис (anti-Treponema pallidum IgG+IgM)* | 3 месяца | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гепатит B: суммарные антитела IgM+IgG к ядерному антигену вируса гепатита B (anti-HB core total)* | 3 месяца | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гепатит B: антитела IgM к ядерному антигену вируса гепатита B (anti-HB core IgM)* | 3 месяца | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гепатит С (anti-HCV)* | 3 месяца | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на антитела IgG и IgM к вирусу краснухи* | однократно | не принимать пищу за 3-4 часа | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гормоны: фолликулостимулирующий гормон (ФСГ, FSH)* | 6 месяцев | 2-5 день цикла, строго натощак | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гормоны: пролактин (Prolactin)* | 6 месяцев | НЕ привязаны ко дню цикла, строго натощак | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гормоны: ТТГ* | 6 месяцев | НЕ привязаны ко дню цикла, строго натощак | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гормоны: свободный Т4* | 6 месяцев | НЕ привязаны ко дню цикла, строго натощак | Процедурный кабинет, необходима предварительная запись |
| Анализ крови на гормоны: АМГ* | 6 месяцев | НЕ привязаны ко дню цикла, строго натощак | Процедурный кабинет, необходима предварительная запись |
| Исследование на SARS CoV-2, рейл тайм ПЦР | 1 программа ЭКО | в день первого мониторинга в протоколе стимуляции или за 5-7 дней до переноса | Процедурный кабинет, необходима предварительная запись |
| Мазок из цервикального канала и влагалища на флору и степень чистоты** | 1 месяц | вне менструации | Записаться к репродуктологу/акушеру-гинекологу (оплата приема не требуется) |
| Цитологическое исследование соскобов шейки матки и цервикального канала* | 1 год | вне менструации | Записаться к репродуктологу/акушеру-гинекологу (оплата приема не требуется) |
ПЦР соскоба из цервикального канала на Neisseria gonorrhoeae, Chlamydia trachomatis, Ureaplasma spp. (Ureaplasma parvum+Ureaplasma urealyticum), Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis* (Ureaplasma parvum+Ureaplasma urealyticum), Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis* |
3 месяца | вне менструации | Записаться к репродуктологу/акушеру-гинекологу (оплата приема не требуется) |
| ПЦР соскоба из цервикального канала на Herpes simplex 1,2 и Cytomegalovirus* | 1 год | вне менструации | Записаться к репродуктологу/акушеру-гинекологу (оплата приема не требуется) |
| УЗИ трансвагинальное органов малого таза | 1 месяц | Записаться к репродуктологу/акушеру-гинекологу (оплата приема не требуется) | |
| ЭКГ в 12-ти отведениях** | 1 месяц | Записаться к терапевту | |
| Заключение терапевта об отсутствии противопоказаний к ЭКО и вынашиванию беременности** | 1 год | Записаться к терапевту | |
| Флюорография** | 1 год | ||
| Заключение маммолога об отсутствии противопоказаний к ЭКО и беременности* | 1 год | Записаться к маммологу | |
| УЗИ молочных желез (независимо от возраста)* | 1 год | 2-10 день цикла | Записаться к маммологу |
| Моммография (женщинам старше 40 лет)* | 1 год | 2-10 день цикла | Записаться к маммологу |
| Медико-генетическое консультирование по показаниям | 1 год | Записаться к генетику |
Низкий АМГ
Хочу рассказать свою историю пути за детьми, растянувшуюся на долгие годы.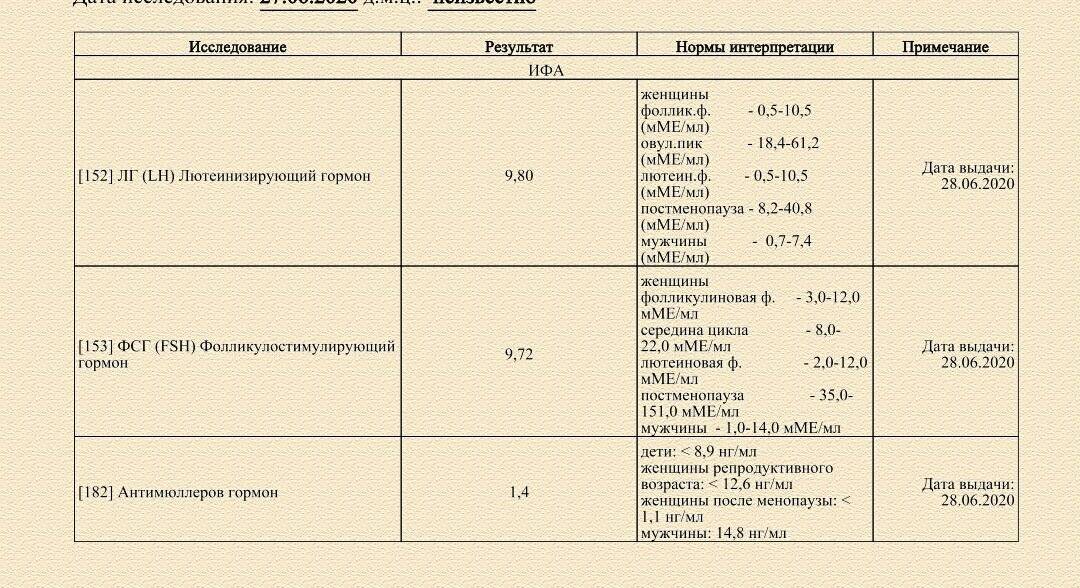 Началась она, когда мне было около 23 лет.
Началась она, когда мне было около 23 лет. Решили завести ребенка, но как то не получалось. Начались походы в женскую консультацию, где мне советовали то попить несколько месяцев противозачаточные, то выписывали фольку и дюфастон, то антибиотики при не очень хороших анализах, ну а в общем говорили, что все нормально, занимайтесь и дальше.
Однажды у меня заболело в боку и я пошла сделала узи, где мне объявили диагноз – гидросальпинкс. Сразу положили в больницу, где сделали лапароскопию. В итоге сказали, что трубы «почистили», убрали спайки и кисту на яичнике. В результате прошли пол года, год и чуда не случилось. Дальше я начала опять ходить по больницам, лечиться от чего-то, причем ходила к разным врачам и каждый пытался поставить свой диагноз. И вот опять узи показало гидросальпинкс. Снова лапароскопия, удаление одной трубы и кисты на яичнике. И опять проходит время и ничего не случается.
Тогда мы решили, что пора делать ЭКО. Врач (делали в Новокузнецке у Маркдорф А.Г.) посмотрел все анализы, сделал узи и тогда сказал сдать мне гормон АМГ. Результат поверг в шок – 0,5, а это значит что запас моих яйцеклеток уже на исходе. В процессе ЭКО выросло 5 фолликулов, взяли 3 яйцеклетки хорошего качества. ИКСИ не стали делать, т.к. у мужа были хорошие показатели спермограммы. Получился всего один 6-клеточный эмбрион, который подсадили на 3 сутки. Но прошло 2 недели и ХГЧ оказался меньше 1. Тогда мне казалось это конец света, ревела неделю. Врач сказал, что если бы у меня была родная сестра, то можно было бы взять у нее яйцеклетку. Но сестры у меня не оказалось.
Где то через полгода нам досталась квота на ЭКО. Опять меряем АМГ, он уже 0,3. В процессе ЭКО выросло 5 фолликулов, взяли 3 хороших яйцеклетки. ИКСИ опять не стали делать. Получились 2 эмбриона. Подсадка на 3 сутки – 6- и 8-клеточных эмбрионов. Эндометрий 10 мм. Результат ХГЧ
Тогда мы обратились в другую клинику. Начали заново все проверять. И опять увидели гидросальпинкс. Решено было пойти на лапару, т.к. гидрос плохо влияет на эмбрионов. В итоге удалили вторую трубу. Опять стресс, ведь ушел шанс забеременеть самой. Врач начал меня лечить всякими витаминами, цитаминами, гормонами и прочими полезностями и настраивать на положительный результат. У нее же и делали ЭКО. В итоге выросло 6 фолликулов, взяли 2 яйцеклетки, одна совсем никакая, другая плохого качества. Но сделали ИКСИ, подсадка на 3 сутки 6-клеточного эмбриона. Результат ХГЧ
Решили делать следующее ЭКО в Красноярске в «Центре репродуктивной медицины». Мне было уже 30 лет. Записались заранее на прием к Новосельцевой А.В. Было лето, отпуск и мы поехали на море. Отдохнули и по приезду сдала снова АМГ и он был 1,3! Конечно я удивилась, т. к. ожидала результат ближе к 0. Съездили к А.В. Она прописала 3 месяца Дюфастон, витамины Фемибион, от себя я добавила «Овариамин». За месяц до ЭКО в первой фазе цикла 10 сеансов магнита на низ живота и яичники, уколы «Овариум-Композитум». И еще я сходила на 5 процедур гирудотерапии (ставили около 7-8 пиявок) где-то за полтора месяца до ЭКО. В итоге взяли 9 яйцеклеток! Сделали ИКСИ. На 3 сутки подсадили 2 отличных 8-клеточных эмбриона. Я попросила, может еще одного, но сказали, что шансы у меня очень высокие. В результате ХГЧ на 13 сутки 666,96! Цифра очень удивила Тогда мы решили, что будет двойня. Но УЗИ показало 3 плодных яйца! Оказалось, что одна из клеток разделилась на 2 части и получились однояйцевые близнецы. Мне предложили убрать одного эмбриона, но решено было оставить всех, слишком долго мы за них сражались!
Хочу сказать всем – НЕ СДАВАЙТЕСЬ и тогда все получится!!!
P.S. Прошло уже 3 года, как я написала эту историю. Только сейчас у меня появилось время ее выложить…. мы самые счастливые родители, благодаря Новосельцевой Алене Валерьевне!!! Огромная благодарность ей и всему коллективу КРЦМ от всей нашей семьи!!!!!
Обследование перед ЭКО в Самаре в клинике «Мать и дитя
Одним из составляющих успеха лечения методом ЭКО является подготовка супружеской пары к лечению, а именно выявление и устранение возможных факторов, которые могут снизить шансы на беременность или привести к ее прерыванию на раннем сроке.
Наша с Вами цель — не только получить беременность, но и добиться родов здоровым малышом! Именно поэтому и необходимо тщательное обследование обоих супругов.
Все анализы должны быть готовы и представлены к моменту ввода в программу. Напротив каждого анализа указан срок его годности. Просроченные анализы на момент начала программы считаются недействительными!
Перечисленное обследование вы можете пройти в Клинике «Мать и дитя-ИДК» или по месту жительства.
Если Вы сдаете анализы в нашей клинике, то все результаты, по мере готовности, будут внесены в Вашу амбулаторную карту.
Если Вы сдаете анализы по месту жительства, то Вам необходимо предоставить их результаты лечащему врачу. Все справки и анализы (особо обратить внимание на анализы: ВИЧ, сифилис, гепатит В, гепатит С) должны быть обязательно заверены печатью лечебного учреждения. Бланк результатов анализов должен содержать реквизиты лечебного учреждения (наименование лечебного учреждения, почтовый адрес, телефон) и подпись лаборанта.
Если в анализах будут выявлены отклонения, вам будет назначено лечение или дополнительное обследование, программа будет отложена.
Это требование основано на приказе Министерства Здравоохранения РФ № 107н от 30 августа 2013 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Для чего необходимо сдавать анализы и проходить обследования
Гормоны
Нарушения гормонального фона — одна из наиболее частых причин нарушения имплантации и невынашивания беременности даже в результате ЭКО. Коррекция любых гормональных нарушений к моменту начала протокола ЭКО значительно повысит вероятность рождения здорового ребенка.
Инфекции
Любая инфекция может быть причиной воспалительного процесса, осложненного течения беременности и внутриутробной инфекции плода. При выявлении инфекции даже у одного из супругов, лечение лучше проводить обоим партнерам до планирования беременности. Это позволит избежать многих осложнений во время беременности и родов.
Краснуха
Особенно опасно инфицирование вирусом краснухи во время беременности. Вирус распространяется в тканях плода беспрепятственно, приводя к формированию врожденных пороков развития или гибели плода. Именно поэтому, всем женщинам, планирующим беременность (независимо от «вида» лечения бесплодия), в том числе спонтанную беременность, рекомендуется определение в крови защитных белковых соединений (антител класса G). Если их концентрация ниже нормы или их вовсе нет, рекомендуется проведение вакцинации против краснухи. Если уровень своего иммунитета достаточно высокий — вакцинация не требуется.
Гепатиты
Хроническое течение гепатитов В и С не является противопоказанием для планирования беременности и ЭКО. Однако, острый процесс и период активного размножения вирусов могут быть опасны для организма беременной женщины и плода. В этом случае инфекционист может предложить лечение и выбрать более оптимальный и безопасный период планирования беременности.
Сифилис
Острая инфекция может переходить от матери к плоду и вызвать у него пороки развития. Беременность можно планировать только после проведенного лечения.
ВИЧ инфекция
При беременности или во время родов существует риск передачи ВИЧ-инфекции от матери плоду.
Осмотр терапевта
Многие хронические заболевания могут проявиться во время беременности, так как нагрузка на организм увеличивается. При этом страдает не только организм мамы, но и плода. Внимательный врач может заподозрить ранние симптомы в результате осмотра и оценки результатов обследований. Своевременно проведенное лечение и специальная подготовка могут улучшить состояние матери во время беременности и позволят получить здорового ребенка.
Осмотр маммолога и УЗИ молочных желез
В процессе лечения методом ЭКО проводится стимуляция роста фолликулов в яичниках женщины гормональными препаратами. Молочные железы являются гормонально — зависимым органом, то есть строение ткани молочной железы зависит от гормонального фона в организме женщины. При наличии отклонений в железистой ткани (любые уплотнения, узелки и т. д.), в процессе стимуляции возможен рост этих образований, что может привести к отрицательному влиянию на здоровье женщины в целом. Исходя из этого, всем нашим пациенткам перед началом программы ЭКО, мы рекомендуем пройти ультразвуковое исследование молочных желез, и при выявлении любых отклонений необходима консультация специалиста — маммолога.
Цитологическое исследование мазков с поверхности шейки матки и цервикального канала
Мазок на онкоцитологию дает возможность обнаружить изменения в строении клеток слизистой оболочки половых органов женщины. Это обследование обязательно для каждой женщины, независимо от того, планирует она беременность или нет, и проводится 1 раз в год.
Гистероскопия
Гистероскопия — исследование полости матки с помощью оптической системы рекомендуется перед началом программы ЭКО для исключения «маточного» фактора.
Перечень обязательного обследования, для проведения лечения методами ВРТ
Ниже представлен список необходимых обследований супружеской пары перед началом программы ЭКО с указанием срока годности каждого анализа.
Для женщины:
| № | Обследование | Срок действия |
|---|---|---|
| 1. |
Исследование крови на: Сифилис: суммарные антитела ИФА+RPR или РПГА+RPR. При ранее перенесенном сифилисе необходимо заключение венеролога, что пациент здоров, в лечении не нуждается. ВИЧ 1,2 (ОФОРМИТЬ ИДС на ВИЧ!) (обвести код 108, 109, 118, 200, другой _______), Гепатит В (HBsAg), гепатит С (anti-HCV). |
3 месяца |
| 2. | Кровь на группу, резус-фактор (печати в паспорте недостаточно). При отрицательном резус-факторе необходимо уточнить резус-принадлежность партнера. | Не ограничен, должен быть подтвержден однократно в МК ИДК |
| 3. | Общеклинический анализ крови, СОЭ, лейкоформула, время свертывания по Сухареву | 1 месяц |
| 4. | Биохимический анализ крови (общий белок, альбумин, глюкоза, креатинин, мочевина, билирубин (общий, прямой), АЛАТ, АСАТ, холестерин) | 1 месяц |
| 5. | Гемостазиограмма: протромбиновый тест, фибриноген, АЧТВ, ТВ, антитромбин, D-димер количественный. | 1 месяц |
| 6. | Длительность кровотечения | 1 месяц |
| 7. | Агрегация тромбоцитов (индуктор АДФ) | 1 месяц |
| 8. | Общеклинический анализ мочи | 1 месяц |
| 9. | Кровь на Ig М и Ig G к краснухе | При наличии IgM – 1месяц, при наличии IgG – не ограничен |
| 10. | Исследование гормонов крови: пролактин, ТТГ, антитела к ТПО, общий тестостерон, ЛГ, эстрадиол на 2-5 день цикла, АМГ, ФСГ | 12 месяцев 6 месяцев |
| 11. |
Обследование на ИППП (мазки, исследование методом ПЦР): Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Mycoplasma genitalium, Ureaplasma spp., Mycoplasma hominis, Herpes simplex 1, 2, Cytomegalovirus. |
3 месяца 12 месяцев |
| 12. | Мазок с шейки матки и цервикального канала на онкоцитологию | 12 месяцев |
| 13. | Микроскопическое исследование влагалищных мазков | 1 месяц |
| 14. | Флюорография | 12 месяцев |
| 15. | Электрокардиограмма | 12 месяцев |
| 16. | Заключение терапевта о состоянии здоровья и возможности вынашивания беременности | 12 месяцев |
| 17. | УЗИ молочных желез на 5-11 день цикла | 12 месяцев |
| 18. | Маммография (для женщин старше 40 лет) | 12 месяцев |
| 19. | Консультация онколога (при обнаружении патологии на УЗИ молочных желез и маммографии) | 12 месяцев |
| 20. | УЗИ органов малого таза (матки и придатков) трансвагинальное | 2 недели |
| 21. | Мазок на COVID19 (в условиях эпидемии) | 3 дня |
| 22. | Осмотр терапевта в день госпитализации (начала программы ЭКО) в условиях эпидемии | 1 день |
Для мужчины:
| № | Обследование | Срок действия |
|---|---|---|
| 1 | Мазок на COVID19 | 3 дня |
| 2 | Спермограмма и MAR – тест (в наших клиниках запись предварительная) | 6 месяцев |
| 3 |
Исследование крови на: Сифилис: суммарные антитела ИФА. При ранее перенесенном сифилисе необходимо заключение венеролога, что пациент здоров, в лечении не нуждается. ВИЧ 1,2 (ОФОРМИТЬ ИДС на ВИЧ!) (обвести код 108, 109, 118, 200, другой _______), Гепатит В (HBsAg), гепатит С (anti-HCV). |
3 месяца |
| 4 | Кровь на резус-фактор (в случае отрицательного резус-фактора у женщины) | Не ограничен |
| 5 | Обследование на ИППП (мазки, или эякулят): Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Mycoplasma genitalium, Ureaplasma spp., Mycoplasma hominis. | 12 месяцев |
| 6 | Консультация уролога (андролога) | 12 месяцев |
По показаниям дополнительно:
| № | Обследование | Срок действия |
|---|---|---|
| 1. | Определение концентрации в крови гомоцистеина | |
| 2. | Определение концентрации в крови витамина Д 25(OH)D | |
| 3. | Гистеросальпингография (перед ВМИ, ИСД, стимуляцией моноовуляции) | 12 месяцев |
| 4. | Гистероскопия с 7 по 10 день цикла. | 12 месяцев |
| 5. | Аспирационная биопсия эндометрия с гистологическим исследованием/ ИГХ исследовнием. | 12 месяцев |
| 6. | Аспирационная биопсия эндометрия с бактериологическим исследованием. | 12 месяцев |
| 7. | УЗИ щитовидной железы | |
| 8. | Дуплексное ангиосканирование нижних конечностей (при планировании манипуляции под наркозом) | |
| 9. | Кольпоскопия | 12 месяцев |
| 10. | ВПЧ тест (в возрасте 30 лет и старше) | 12 месяцев |
| 11. | Консультация эндокринолога. | |
| 12. | Консультация стоматолога | 12 месяцев |
| 13. | Кровь на кариотип (мужчине и женщине). | |
| 14. | Медико-генетическое консультирование для пациентов с наследственными заболеваниями, ВПР, нарушениях полового развития, привычным невынашиванием (2 и более потери), бесплодием неясного генеза, близкородственном браке, неудачах ВРТ (3 до 35 лет, 2 старше 35 лет), тяжелых нарушениях сперматогенеза, для доноров ооцитов, спермы, эмбрионов. | 12 месяцев |
| 15. | Консультация инфекциониста. | 1 месяц |
| 16. | Справка из психоневрологического диспансера (для доноров и суррогатных матерей) | 12 месяцев |
| 17. | Справка из наркологического диспансера (для доноров и суррогатных матерей) | 12 месяцев |
Необходимо прийти на прием, до начала лечебного цикла по одному из нижеперечисленных вариантов, предварительно записавшись на «ввод в программу» по тел. 8 800 600-9-006:
- На 1−5 день цикла;
- На 1−3 день цикла;
- За 7 дней до менструации, при условии предохранения от беременности в данном цикле.
Рекомбинантный гормон роста человека для лечения нарушений роста у детей: систематический обзор и экономическая оценка
Задний план: Рекомбинантный гормон роста человека (rhGH) лицензирован для лечения низкого роста, связанного с дефицитом гормона роста (GHD), синдромом Тернера (TS), синдромом Прадера-Вилли (PWS), хронической почечной недостаточностью (CRI), дефицитом гена, содержащего гомеобокс низкого роста ( SHOX-D) и рождение маленьким для гестационного возраста (SGA).
Цели: Оценить клиническую эффективность и экономическую эффективность rhGH по сравнению со стратегиями лечения без rhGH для детей с GHD, TS, PWS, CRI, SHOX-D и рожденных SGA.
Источники данных: В систематическом обзоре использовались априорные методы.Был проведен поиск в ключевых базах данных (например, MEDLINE, EMBASE, База данных экономической оценки NHS и восемь других) на предмет соответствующих исследований с момента их создания до июня 2009 года. Для определения экономической эффективности в Великобритании была разработана модель анализа решений.
Выбор исследования: Два рецензента оценили названия и аннотации исследований, определенных с помощью стратегии поиска, получили полный текст соответствующих статей и проверили их по критериям включения.
Оценка учебы: Данные из включенных исследований были извлечены одним рецензентом и проверены вторым. Качество включенных исследований оценивалось с использованием стандартных критериев, применяемых одним рецензентом и проверенных вторым. Исследования клинической эффективности были синтезированы посредством описательного обзора.
Полученные результаты: В систематический обзор было включено 28 рандомизированных контролируемых испытаний (РКИ) в 34 публикациях.GHD: Дети в группе rhGH росли на 2,7 см / год быстрее, чем дети, не получавшие лечения, и имели статистически значимо более высокий показатель стандартного отклонения роста (HtSDS) через 1 год: -2,3 ± 0,45 против -2,8 ± 0,45. ТС: В одном исследовании девочки, прошедшие курс лечения, выросли на 9,3 см больше, чем не леченные девочки. При исследовании детей младшего возраста разница составила 7,6 см через 2 года. Значения HtSDS были статистически значимо выше у пролеченных девочек. PWS: Младенцы, получавшие рчГР в течение 1 года, вырастали значительно выше (на 6,2 см больше), чем дети, не получавшие лечения.Два исследования сообщили о статистически значимой разнице в HtSDS в пользу rhGH. CRI: дети, получавшие rhGH, в течение года исследования выросли в среднем на 3,6 см больше, чем дети, не получавшие лечения. HtSDS был статистически значимо выше у леченных детей в двух исследованиях. SGA: В критерии были внесены поправки, чтобы включить детей в возрасте от 3 лет без догоняющего роста, без привязки к среднему росту родителей. Только в одном из РКИ использовалась лицензированная доза; другие использовали более высокие дозы. Рост взрослого (AH) был примерно на 4 см выше у пациентов, получавших rhGH, в одном исследовании, сообщившем об этом исходе, и SDS прироста AH также был статистически значимо выше в этой группе.Среднее значение HtSDS было выше у пролеченных пациентов, чем у нелеченых, в четырех других исследованиях (значимо в двух). SHOX-D: после 2 лет лечения дети были примерно на 6 см выше, чем в контрольной группе, а HtSDS был статистически значимо выше у детей, получавших лечение. Оценка дополнительных затрат на год жизни с поправкой на качество (QALY) rhGH по сравнению с отсутствием лечения составляла: 23 196 фунтов для GHD, 39 460 фунтов для TS, 135 311 фунтов для PWS, 39 273 фунтов для CRI, 33079 фунтов для SGA и 40 531 фунт для SHOX. -D.Вероятность того, что лечение каждого из состояний будет рентабельным при 30 000 фунтов, составляла: 95% для GHD, 19% для TS, 1% для PWS, 16% для CRI, 38% для SGA и 15% для SHOX-D.
Ограничения: Как правило, исследования с плохим описанием, некоторые краткосрочные.
Выводы: Статистически значимо более высокие значения HtSDS были зарегистрированы для детей, получавших rhGH, с GHD, TS, PWS, CRI, SGA и SHOX-D.Дети с СПВ, получавшие рчГР, также показали статистически значимые улучшения в показателях состава тела. Только лечение GHD будет считаться экономически эффективным при пороговом уровне готовности платить от 20 000 до 30 000 фунтов за полученный QALY. Этот анализ предполагает, что будущие исследования должны включать исследования за более чем 2 года, сообщающие о почти конечном росте или окончательном росте взрослого человека.
Заявление о консенсусепо диагностике и лечению детей с идиопатическим низкорослым ростом: Резюме Общества по исследованию гормона роста, Детского эндокринного общества Лоусона Уилкинса и Семинар Европейского общества детской эндокринологии | Журнал клинической эндокринологии и метаболизма
Цель: Наша цель заключалась в том, чтобы обобщить важные достижения в лечении детей с идиопатическим низким ростом (ISS).
Участники: Участниками были 32 приглашенных лидера в этой области.
Доказательства: Доказательства были получены путем обширного обзора литературы и клинического опыта.
Консенсус: Участники рассмотрели итоги обсуждения, проголосовали и приняли решение большинством голосов по каждому разделу документа.
Выводы: ISS определяется ауксологически по высоте ниже -2 sd (SDS) без признаков заболевания, что подтверждается полной оценкой детского эндокринолога, включая стимулированные уровни GH.У пациентов с МКС нет необходимости в магнитно-резонансной томографии. ISS может быть фактором риска психосоциальных проблем, но настоящая психопатология встречается редко. В США и семи других странах регулирующие органы одобрили лечение GH (в дозах до 53 мкг / кг · сут) для детей с возрастом менее -2,25 SDS, тогда как в других странах предлагаются более низкие пороговые значения. Ингибирование ароматазы увеличивает прогнозируемый рост взрослого человека у мужчин с ISS, но данные о росте взрослого человека недоступны. Психологическое консультирование стоит рассмотреть вместо или в качестве дополнения к гормональному лечению.Прогнозируемая высота может быть неточной и не является абсолютным критерием для принятия решения о лечении GH. Чем ниже рост ребенка, тем больше внимания следует уделять ГР. Успешный ответ на лечение GH в первый год включает увеличение SDS роста более чем на 0,3–0,5. Среднее увеличение взрослого роста у детей с ISS, связанное с терапией GH (средняя продолжительность 4–7 лет), составляет 3,5–7,5 см. Ответы очень разные. Уровни IGF-I могут быть полезны при оценке соответствия и чувствительности к GH; уровни, которые постоянно повышаются (> 2.5 SDS) должны побудить задуматься о снижении дозы GH. Терапия GH для детей с ISS имеет такой же профиль безопасности, как и другие показания GH.
Низкий рост — одна из наиболее частых проблем, с которыми сталкиваются педиатрические эндокринологи и другие врачи, ухаживающие за детьми. У детей с серьезным низким ростом необходимо учитывать и исключать различные болезненные состояния, однако большое количество таких детей остается без окончательного диагноза и считается имеющим идиопатический низкий рост (ISS).Общество исследования гормона роста вместе с Детским эндокринным обществом Лоусона Уилкинса и Европейским обществом детской эндокринологии договорились об организации международного семинара в 2006 году и созвали его 17–20 октября 2007 года в Санта-Монике, Калифорния, чтобы рассмотреть и взвесить имеющиеся доказательства, относящиеся к оценке и лечению детей с СКС. Ведущие эксперты в этой области, включая представителей всех международных педиатрических эндокринных обществ, были приглашены для участия в создании консенсусного документа по этой теме.Промышленные сторонники Общества исследования гормона роста были приглашены прислать своих представителей на встречу. Эти люди участвовали во всех обсуждениях, ведущих к разработке консенсусного документа, и посещали заседания, на которых представлялись консенсусные заявления, но не участвовали в написании этих заявлений и не голосовали по ним. Участники семинара определили и рассмотрели ключевые проблемы, используя ранее определенную модель, используемую для достижения консенсусных заявлений для диагностики и лечения дефицита GH (GHD) у взрослых и детей (1–3), и подготовили это всеобъемлющее заявление, которое объединяет рекомендации клинической практики для этого подхода детям с МКС.Перед семинаром оргкомитетом (без участия представителей отрасли) были подготовлены два дискуссионных документа: один по оценке, а другой по ведению детей с ISS. Эти две обзорные статьи публикуются отдельно (4, 5), и читателю предлагается ознакомиться с ними для получения дополнительных сведений. Семинар проходил в рамках строгой структуры обсуждения в секционных группах и рассмотрения ключевых вопросов. Группа написания переписала отчеты групп и резюме обсуждений в согласованный проект, который был тщательно и критически рассмотрен всеми участниками пленарного форума в последний день.Участники (за исключением отраслевых делегатов) проголосовали и приняли решение большинством голосов по каждому разделу документа. Им был отправлен доработанный черновик для дополнительных комментариев, и они подписали одобрение окончательной редакции.
Определение и эпидемиология
ISS определяется как состояние, при котором рост человека более чем на 2 стандартных балла (SDS) ниже соответствующего среднего роста для данного возраста, пола и группы населения без признаков системных, эндокринных, пищевых или хромосомных аномалий. (6).В частности, дети с ISS имеют нормальный вес при рождении и имеют достаточный уровень GH. ISS описывает разнородную группу детей, состоящую из многих, пока неустановленных причин низкого роста. Подсчитано, что приблизительно 60–80% всех детей невысокого роста с уровнем ± 2 SDS или ниже соответствуют определению ISS (7). Это определение ISS включает в себя невысоких детей с конституциональной задержкой роста и полового созревания (CDGP) и семейным низким ростом. Частота направления этих детей зависит от социально-экономической среды; более того, мальчики чаще воспринимают инвалидность из-за низкого роста по сравнению с девочками, независимо от социального класса.Дети с дисморфическими фенотипами, такими как скелетная дисплазия или синдром Тернера, а также дети с массой тела при рождении или малой длиной тела для гестационного возраста должны быть исключены из диагностической категории ISS, как и дети с четко идентифицированными причинами низкого роста (, например, целиакия). , воспалительное заболевание кишечника, ювенильный хронический артрит, резистентность к GHD или GH, гипотиреоз, синдром Кушинга, и т. д. ).
Подкатегория
ISS следует подразделить на подкатегории, главным образом на основе ауксологических критериев.Основное различие заключается между детьми с семейным анамнезом низкого роста, рост которых находится в пределах ожидаемого диапазона родительского целевого роста, и теми детьми, которые невысокого роста для своих родителей. Хотя средний рост родителей обычно рассчитывается по методу Таннера (средний рост отца и матери плюс-минус 6,5 см), более точную оценку можно получить, используя скорректированный SDS целевой высоты, который рассчитывается как 0,72 × среднее значение роста отца и SDS роста матери и нижний предел диапазона роста цели как скорректированная высота цели минус 1.6 паспортов безопасности (8). Принято считать, что в среднем взрослый рост, достигаемый у детей с ISS, ниже родительского целевого роста (9).
ISS также следует классифицировать по наличию или отсутствию задержки костного возраста, что указывает на вероятность задержки роста и полового созревания. Разделение на подкатегории может помочь предсказать рост взрослого, который, как ожидается, будет больше у ребенка с задержкой созревания. Низкорослые люди без семейного анамнеза низкого роста обычно имеют более низкий рост взрослого человека по сравнению с заданным ростом.
Оценка невысокого ребенка
Оценка невысокого ребенка всегда начинается с тщательного сбора анамнеза, включая семейный и прошлый медицинский анамнез, а также всестороннего физического обследования, включая фенотипические характеристики, пропорции тела и стадию полового созревания. Особое внимание следует уделять возможности кровного родства и времени полового созревания у родителей, а также росту родственников первой и второй степени родства. В анамнезе родов должны быть рассмотрены аномалии роста плода и перинатальные осложнения, а также собранная информация, относящаяся к прошлому заболеванию или симптомам хронического заболевания, использованию лекарств, состоянию питания, а также психосоциальному и когнитивному развитию.Следует оценить восприятие проблемы ребенком и родителями, а также степень их обеспокоенности. Следует приложить все усилия, чтобы получить и нанести все предыдущие измерения роста на соответствующую диаграмму (10). Для оценки детей младше 5 лет Всемирная организация здравоохранения рекомендует использовать недавно опубликованные кривые роста (11). Для оценки детей старшего возраста предпочтительнее использовать диаграммы роста с учетом этнической принадлежности, если таковые имеются. Для детей, усыновленных из развивающихся стран, рекомендуются специальные карты из страны происхождения для первого поколения.После этого диаграммы, характерные для принимающей страны, кажутся более подходящими. Медицинский осмотр следует начинать с количественной оценки степени задержки роста и пропорциональности с использованием размаха рук, высоты сидения или соотношения верхнего и нижнего сегментов, индекса массы тела, а для детей младше 4 лет — измерения окружности головы. Следует искать дисморфические признаки, которые могут указывать на синдромный диагноз, а также признаки хронического заболевания или эндокринопатии.
Скрининговые и первичные диагностические тесты
Пациентам, у которых анамнез и физикальное обследование не позволяют установить конкретный диагноз, показаны скрининговые лабораторные исследования.К ним относятся общий анализ крови, скорость оседания эритроцитов, креатинин, электролиты, бикарбонат, кальций, фосфат, щелочная фосфатаза, альбумин, ТТГ и уровни свободного T 4 и IGF-I. Также рекомендуется обследование на целиакию. Кариотип следует выполнять у всех девочек с необъяснимым низким ростом и у мальчиков низкого роста с сопутствующими аномалиями гениталий. Рентген костного возраста должен быть получен и рассмотрен экспертом. Это дает представление об остаточном потенциале роста ребенка и может сузить дифференциальный диагноз.Обследование скелета должно быть зарезервировано для пациентов с подозрением на дисплазию скелета, например, с аномальными пропорциями тела или SDS роста значительно ниже SDS среднего роста родителей, и его должен прочитать специалист по заболеваниям костей.
Исследование оси GH-IGF
GHD должен быть исключен для диагностики ISS. Это требует как клинической, так и биохимической оценки, потому что ни один тест или набор тестов не может определить GHD. Тест на GH должен проводиться у любого пациента с совместимым анамнезом и физическим осмотром, с низкой скоростью роста или у которого наблюдаются низкие уровни IGF-I.Большинство экспертов сходятся во мнении, что пациенту невысокого роста, с нормальной скоростью роста, без задержки костного возраста и с уровнем IGF-I в плазме выше среднего для возраста не требуется тестирование GH. Меньшинство рекомендовало проводить тестирование на GH независимо от концентрации IGF-I. Выбор используемых стимулов GH сильно зависит от страны, так же как и решение о введении половых стероидов. У ребенка с клиническими критериями GHD для подтверждения диагноза традиционно использовалась пиковая концентрация GH менее 10 нг / мл.В настоящее время вводится новый эталонный стандарт GH, который может потребовать корректировки нижнего предела нормы в сторону понижения. Кроме того, изменения в методологии анализа влияют на выбор пороговых значений для диагностики GHD. Измерения спонтанной секреции GH (ночной или 24-часовой профиль) не показаны для рутинной оценки статуса GH. Напротив, настоятельно рекомендуется получать уровни IGF-I как часть оценки. Измерения IGFBP-3 мало что добавляют к оценке низкого роста, за исключением детей младше 3 лет, у которых низкие уровни IGFBP-3 полезны при диагностике GHD (12).Надежные результаты анализа и соответствующие нормативные данные имеют решающее значение для успешного использования измерений GH и IGF-I в клинической практике. Признано, что существует большая вариабельность значений GH и IGF-I и их интерпретации среди доступных в настоящее время коммерческих и собственных анализов. Это отражает разнообразную методологию анализа, а также адекватность и применимость нормативных данных. При обследовании невысокого ребенка проводится магнитно-резонансная томография гипоталамо-гипофиза у детей с подтвержденным диагнозом GHD или при подозрении на внутричерепное поражение.Если поставлен диагноз ISS, магнитно-резонансная томография не показана. Хотя ясно, что существует различная чувствительность к GH среди детей с низким ростом, тест поколения IGF-I, хотя и способен документировать тяжелую нечувствительность к GH, в настоящее время не может определить более умеренные степени. Следует предпринять попытки улучшить диагностическую полезность за счет получения более точных нормативных данных. Следует поощрять поиск альтернативных показателей чувствительности к GH.
Генетические тесты
В ситуациях, когда ожидается конкретный генетический диагноз, связанный с низким ростом (например, синдром Нунана или синдром нечувствительности к GH), следует исследовать интересующие гены.Существуют онлайн-ресурсы, такие как Genetest (www.genetests.org), которые определяют лаборатории, способные проводить эти тесты. Хотя рутинный анализ SHOX не следует проводить у всех детей с ISS, анализ гена SHOX следует рассматривать для любого пациента с клиническими данными, совместимыми с гаплонедостаточностью SHOX (13).
Психосоциальные последствия ISS
При имеющихся в настоящее время данных трудно сделать обобщения о влиянии низкого роста на психосоциальную адаптацию.Низкий рост может быть фактором риска психосоциальных проблем, таких как социальная незрелость, инфантилизация, низкая самооценка и издевательства, особенно в отношении тех, кого направляют для оценки. Значительные межиндивидуальные различия в адаптации к низкорослости и влиянию низкого роста могут быть функцией нескольких факторов риска и защитных факторов, включая отношение родителей и преобладающие культурные мнения (14). Стрессовые переживания могут быть частыми, но настоящая психопатология встречается редко (15). В целом, как клинические, так и популяционные исследования показывают, что большинство низкорослых людей функционируют в широком диапазоне нормальных значений; однако следует отметить, что очень маленькие дети (<−2.5 SDS) изучены недостаточно.
Этические принципы обращения с детьми с ISS
Диагностика и лечение детей с ISS должны проводиться под эгидой детских эндокринологов, а управленческие решения должны быть основаны на доказательствах. Интерес ребенка — это главная забота. Следует избавиться от ожиданий, что более высокий рост обязательно связан с положительными изменениями качества жизни. Меры, способствующие росту, должны быть эффективными и учитывать риски, преимущества и альтернативы лечения, включая консультирование.Лечение должно включать постоянную и постоянную оценку эффективности и безопасности, а также возможность изменения терапии, стратегии дозирования или прекращения терапии, когда реакция роста плохая, когда достигается приемлемый рост или если молодой человек отказывается от своего согласия. для лечения. Основная цель лечения — достижение нормального роста взрослого человека. Желаемая вторичная цель — достичь нормального роста в детстве. Врачи несут ответственность за вовлечение семей в обсуждение, которое должно включать честную и реалистичную оценку ожиданий от лечения в отношении увеличения роста и вариабельности клинических результатов (16).
Критерии лечения детей с помощью ISS
Ауксологический
Критерии роста для рассмотрения терапии варьируются в зависимости от географических и клинических параметров. В США и семи других странах регулирующие органы одобрили лечение GH для детей с возрастом менее -2,25 SDS (1,2 процентиля). Среди этой рабочей группы консенсуса мнения относительно подходящей высоты, ниже которой можно рассматривать лечение GH, варьировались от -2 до -3 SDS.При принятии решения о начале лечения следует учитывать возраст. Считается, что оптимальный возраст для начала лечения — 5 лет до раннего полового созревания; в большинстве исследований, посвященных терапии гормоном роста детей с ISS, изучались дети старше 3–4 лет.
Биохимический
Не существует общепринятых биохимических критериев для начала лечения GH в ISS.
Психологический
Врач должен взвесить степень роста и способность ребенка справляться с трудностями.Терапия, как правило, не рекомендуется для невысокого ребенка, которого не беспокоит его / ее рост; в качестве альтернативы, врач может с большей вероятностью рассмотреть вопрос о медицинском или психологическом вмешательстве для ребенка, который, кажется, страдает от его / ее роста. Психологические преимущества терапии гормоном роста у таких детей еще предстоит доказать (14). Однако надежные меры, подтверждающие психологическую ценность терапии гормоном роста для таких детей, остаются труднодостижимыми, по крайней мере, частично из-за признанных ограничений в количественной оценке результатов (17).
Роль альтернатив лечения гормона роста
Анаболические стероиды
В нескольких контролируемых исследованиях было показано, чтоОксандролон увеличивает скорость роста в краткосрочной перспективе, но не приводит к значительному увеличению прогнозируемого или измеренного роста взрослого человека. Терапия низкими дозами тестостерона вызывает кратковременное ускорение линейного роста с минимальным увеличением или отсутствием увеличения костного возраста или снижения потенциала роста взрослого человека. Хотя оба этих препарата полезны для мужчин с CDGP с низким и средним ростом (> -2.5 SDS) (18), тестостерон является наиболее подходящим лечением для мальчиков с CDGP с прогнозом роста взрослого в пределах нормы. Оксандролон дает преимущество перорального приема, но его недостатки заключаются в слабой андрогенности и отдаленном риске гепатотоксичности.
IGF-I
В США, Японии и Европе IGF-I одобрен для людей с низким ростом с тяжелым дефицитом IGF, связанным с нормальной секрецией GH (или нечувствительностью к GH) (19).
Для детей с ISS, которые не реагируют на лечение GH, терапия IGF-I является теоретическим вариантом; однако данных об эффективности и безопасности в этой популяции нет.
Аналоги ГнРГ (ГнРГ)
Монотерапия гонадолиберином у обоих полов продемонстрировала небольшой и непостоянный эффект на увеличение роста взрослых и, как правило, не рекомендуется. Высказывались опасения относительно возможных побочных эффектов ГнРГ, в том числе на краткосрочную минеральную плотность костей (20) и на психологические последствия задержки полового созревания (21).Комбинированная терапия с GnRHa и GH, однако, имеет потенциальную ценность, если GnRHa используется не менее 3 лет.
Ингибиторы ароматазы
Подавление ароматазы может способствовать росту в присутствии андрогенов, тогда как увеличение костного возраста замедляется из-за подавления выработки эстрогена. Увеличение прогнозируемого роста взрослого человека было показано у мужчин с ISS (22), но данные о росте взрослого человека отсутствуют. Доказательств его использования у женщин с ISS недостаточно.Долгосрочная эффективность и безопасность ингибиторов ароматазы у мужчин с ISS не была продемонстрирована. Результаты продолжающихся исследований комбинированного лечения ингибиторами GH и ароматазы показывают, что комбинированное лечение в течение как минимум 2 лет замедляет темп ускорения костного возраста и увеличивает прогнозируемый рост взрослого человека (23). По-прежнему требуется долгосрочное наблюдение за этими пациентами.
Психологическое консультирование
Психосоциальные вмешательства для поддержки процесса адаптации к низкорослости и увеличения личных ресурсов для преодоления стрессовых переживаний, а также социальных действий для уменьшения предрассудков стоит рассматривать вместо или в качестве дополнения к гормональному лечению (14).Данных о влиянии таких вмешательств не поступало.
Существуют ли специальные методы лечения для различных подтипов пациентов?
У детей с CDGP, у которых период полового созревания и костного возраста существенно замедлен и у которых рост выше -2,5 SDS, тестостерон является подходящей терапией для мальчиков, у которых эта клиническая картина гораздо более распространена, чем у девочек. У девочек позднего созревания низкие дозы эстрогенов представляют собой теоретический вариант; однако опубликованных данных, подтверждающих его использование, нет.У детей с ISS, у которых CDGP маловероятен, может быть рассмотрена терапия GH.
Роль прогнозируемого роста взрослого в принятии решения о лечении препаратом GH
Прогнозируемый рост взрослого человека может быть неточным для отдельных лиц, но может быть полезен вместе с другими критериями (семейный пубертатный анамнез и целевой рост среднего родителя) при принятии решения о лечении с помощью GH. В продольном исследовании субъектов с ISS задержка костного возраста повлияла на точность прогнозов. У детей с задержкой костного возраста около 2 лет средний рост взрослого был близок к прогнозируемому, а у детей без задержки костного возраста рост взрослого значительно превышал первоначальный прогноз, хотя, если костный возраст отставал более чем на 2 года. год рост взрослой особи был значительно ниже прогнозируемого (24).
Роль текущего роста в принятии решения о применении GH
Чем ниже рост ребенка, тем больше внимания следует уделять лечению гормоном роста. Утвержденное Управлением по контролю за продуктами и лекарствами США (FDA) пороговое значение в Соединенных Штатах (и семи других странах) составляет -2,25 SDS, тогда как в других странах предлагаются более низкие пороговые значения. Дети, рост которых ниже -2,0 SDS и более чем на 2,0 SDS ниже их целевого роста среднего родителя и / или прогнозируемый рост ниже -2.0 Некоторые эксперты полагают, что SDS требует лечения.
Определение ответа на лечение гормона роста
Краткосрочные ауксологические признаки, которые предполагают успешный ответ на лечение GH в первый год у отдельных пациентов, включают изменение SDS роста более чем на 0,3–0,5, увеличение скорости роста в течение первого года более чем на 3 см / год или высота скорости SDS более +1. Восстановление более нормального роста в детстве — важное соображение.Математические модели могут использоваться для оценки ответа на терапию выбранной дозой (25).
Биохимические особенности
Последовательные измерения IGF-I во время терапии GH полезны для оценки эффективности, безопасности и соблюдения режима лечения и были предложены в качестве инструмента для корректировки дозы GH. Никакие другие биохимические тесты обычно не рекомендуются для пациентов с ISS, принимающих GH.
Психологические особенности
Важным аргументом в пользу лечения с помощью GH является предположение, что оно улучшит качество жизни.Необходимы проверенные инструменты, чувствительные к конкретным областям, которые затрагиваются у маленьких детей и которые легко применяются в клинике, но в настоящее время не рекомендуются как часть повседневной помощи.
Интерпретация результатов, оценивающих успех лечения GH
При оценке краткосрочных результатов (, т. Е. <2 лет) необходимо учитывать возраст, пубертатный статус и степень задержки роста конкретного пациента. У большинства детей с ISS изменение высоты SDS является лучшим индикатором реакции, но скорость роста, скорость роста SDS и изменение скорости роста (сантиметры в год или SDS) - все они полезны, а иногда и превосходят их. оценка реакции при интерпретации в свете клинической ситуации пациента.Долгосрочные ауксологические параметры, определяющие успех терапии, включают SDS роста взрослого человека, SDS роста взрослого минус SDS роста в начале GH, рост взрослого человека минус прогнозируемый рост и рост взрослого человека минус целевой рост. Долгосрочные психосоциальные и метаболические исходы должны оцениваться в регистрах для этих пациентов.
Результат терапии гормона роста у детей с ISS
Среднее увеличение роста взрослого человека, связанное с терапией GH (средняя продолжительность 4–7 лет) у детей с ISS, равно 3.5–7,5 см по сравнению с историческим контролем (26, 27), с прогнозируемым ростом взрослых пациентов до лечения (28) или с контрольными группами без лечения или контрольными группами плацебо (29, 30).
Ответы сильно различаются и зависят от дозы. Высказывались опасения, что более высокие дозы гормона роста (> 53 мкг / кг · сут) могут способствовать увеличению костного возраста и наступлению половой зрелости (31), но в других исследованиях этого не обнаружено (32).
На реакцию роста на GH влияет множество факторов, многие из которых неизвестны.Дети младше или тяжелее, получающие более высокие дозы гормона роста и имеющие самый низкий рост относительно целевого роста, имеют лучшую реакцию роста. Эти факторы составляют примерно 40% дисперсии реакции роста. На результат роста взрослого отрицательно влияет возраст в начале и положительно — рост в середине родителей, рост в начале, задержка костного возраста и реакция на GH в первый год (23, 24). Полезность исходных и связанных с лечением биохимических данных, включая IGF-I, не была подтверждена в долгосрочных исследованиях, но двухлетние исследования показывают, что повышение IGF-I коррелирует с кратковременным увеличением роста (30).
Мониторинг эффективности и безопасности у детей, получавших GH, с помощью ISS
Дети, получающие GH, должны контролироваться на предмет роста, веса, пубертатного развития и побочных эффектов с интервалами от 3 до 6 месяцев. Регулярное наблюдение за сколиозом, гипертрофией миндалин, отеком диска зрительного нерва и смещением эпифиза головки бедренной кости должно проводиться как часть регулярного медицинского осмотра во время последующих посещений. Мы рекомендуем, чтобы через 1 год ответ на терапию оценивался путем расчета SDS скорости роста, а также SDS изменения роста.Стадия полового созревания должна оцениваться регулярно, а костный возраст можно периодически определять для повторной оценки прогноза роста и рассмотрения возможности вмешательства для изменения темпа полового созревания. Уровни IGF-I могут быть полезны при корректировке дозы GH, но значение аномально повышенных уровней IGF-I остается неизвестным. До сих пор не сообщалось ни о каких случаях повышенного уровня глюкозы в крови у пациентов с ISS, получавших GH, но есть разногласия относительно необходимости рутинного мониторинга метаболизма глюкозы.
Стратегии корректировки лечения GH
Дозировка обычно выбирается и регулируется по весу. Если реакция роста считается недостаточной, доза может быть увеличена. Нет окончательных данных относительно долгосрочной безопасности доз выше 50 мкг / кг · сут у детей с синдромом раздраженного кишечника. Верхний предел дозировки GH, используемой в других педиатрических условиях, составляет приблизительно 70 мкг / кг · сут (28, 33), но возможность использования таких доз варьируется с точки зрения национальной экономики здравоохранения.В Соединенных Штатах в настоящее время одобренные FDA дозы гормона роста при ISS составляют до 0,3–0,37 мг / кг · нед (34). В будущем модели прогнозирования роста могут улучшить стратегии дозирования гормона роста. Уровни IGF-I могут быть полезны при оценке соответствия и чувствительности к GH; уровни, которые постоянно повышаются (> 2,5 SDS), должны побуждать к рассмотрению вопроса о снижении дозы GH. Недавние исследования корректировки дозы на основе IGF в ISS продемонстрировали ускоренный краткосрочный рост, когда были выбраны более высокие цели IGF, но эта стратегия не была подтверждена в долгосрочных исследованиях в отношении безопасности, экономической эффективности или роста взрослого человека (31).
Рассмотрение добавления модуляторов полового созревания
Если прогнозируемый рост ниже -2,0 SDS во время начала полового созревания у любого пола, добавление GnRHa можно рассматривать, как обсуждалось выше (35, 36). В качестве альтернативы для мужчин возможны ингибиторы ароматазы (22). Однако данные по долгосрочной эффективности и безопасности ни для одного из этих вмешательств отсутствуют. Также неизвестно влияние задержки полового созревания на соматическое и психологическое развитие. Мы не рекомендуем девочкам ингибиторы ароматазы.
Продолжительность лечения гормона роста
Существуют две точки зрения о продолжительности лечения. Во-первых, лечение следует прекратить при достижении роста, близкого к взрослому (скорость роста <2 см / год и / или костный возраст> 16 лет у мальчиков и> 14 лет у девочек). В качестве альтернативы терапию можно прекратить, когда рост находится в нормальном диапазоне взрослых (выше -2 SDS) или достиг другого порогового значения для эталонного взрослого населения (например, в Австралии — 10-го процентиля; в других местах — 50-го процентиля).На прекращение терапии влияет удовлетворенность пациента / семьи результатом терапии или продолжающимся анализом затрат и выгод, или когда ребенок хочет прекратить лечение по другим причинам.
Возможные побочные эффекты GH
Возможные побочные эффекты у детей, принимающих GH, с ISS аналогичны тем, о которых ранее сообщалось у детей, получающих терапию GH по другим показаниям (37). Однако частота нежелательных явлений обычно меньше (38). Никаких долгосрочных побочных эффектов не зарегистрировано.Рекомендуется наблюдение после лечения с акцентом на распространенность рака и метаболические побочные эффекты, но осуществимость таких исследований неясна.
Анализ затрат и выгод
Средний конечный прирост роста, связанный с лечением GH у детей с ISS, а также его стоимость известны (10 000–20 000 долларов / см), но краткосрочные и долгосрочные преимущества для человека и общества неясны (26 ). В настоящее время неизвестно, связано ли увеличение роста с изменением качества жизни и каким образом.Следовательно, лечение GH детей с ISS следует рассматривать в контексте бюджета здравоохранения конкретной страны. В настоящее время данные, демонстрирующие улучшение качества жизни, улучшение психологического здоровья, и т.д. еще не были собраны в хорошо контролируемых исследованиях. Следовательно, рекомендации по лечению, увеличивающему рост взрослого человека, должны быть сбалансированы с высокой стоимостью этих методов лечения.
Определение отсутствия ответа GH
Ожидаемый результат лечения GH в ISS — увеличение SDS роста и скорости роста, что приводит к увеличению роста взрослого человека.Поскольку существует непрерывный поток ответов GH, определение отсутствия ответа является произвольным. Предлагаемые критерии плохой реакции в первый год включают SDS скорости роста менее +1 или SDS изменения роста менее 0,3–0,5, в зависимости от возраста. Новые инструменты для определения неудач лечения GH включают моделирование прогнозов и графики реакции роста с учетом возраста и пола (39). Если реакция роста ниже и соблюдение режима гарантировано, среди рассматриваемых вариантов может быть увеличение дозы GH.Значения IGF-I можно использовать для оценки соответствия и чувствительности к GH. Если после 1-2 лет и более высоких доз GH скорость роста все еще недостаточна, лечение GH следует прекратить и использовать альтернативные методы лечения.
Исследования будущего
Будущие исследования по ведению детей с СКС должны охватывать три основных направления. Первый — это усовершенствование диагностических инструментов для классификации различных субпопуляций, подпадающих под определение ISS, и их реакции на терапию.К ним относятся молекулярная генетика, протеомика и фармакогеномика, более точные измерения чувствительности к GH и IGF-I, а также улучшенные модели прогнозирования. Вторая область должна включать психосоциальные инструменты, вмешательства и результаты. Третья область — это проведение хорошо контролируемых исследований по использованию дополнительных фармакологических вмешательств, таких как комбинация GH и GnRHa, ингибиторов ароматазы или IGF-I.
Выводы
ISS представляет собой важную клиническую единицу в педиатрической эндокринологической практике, и после проведения соответствующей оценки для этих пациентов могут быть рассмотрены несколько терапевтических вмешательств.Необходимы дальнейшие клинические исследования и разработки для оптимизации лечения таких детей и обеспечения безопасности и эффективности лечения.
Благодарности
участников консенсусного семинара: Дэвид Аллен, Школа медицины и общественного здравоохранения Университета Висконсина, Мэдисон, Висконсин; Иво Арнхольд, Университет Сан-Паулу, Сан-Паулу, Бразилия; Питер Банг, Каролинский институт, Стокгольм, Швеция; Фернандо Кассорла, Чилийский университет, Сантьяго, Чили; Стефано Чианфарани, Университет Тор Вергата, Рим, Италия; Стивен Чернаусек, Центр медицинских наук Университета Оклахомы, Оклахома-Сити, Оклахома-сити; Йенс Кристиансен, больница Орхусского университета, Орхус, Дания; Пинхас Коэн, Калифорнийский университет в Лос-Анджелесе, Калифорния; Леона Каттлер, Университет Кейс Вестерн Резерв, Кливленд, Огайо; Пол Чернихоу, Университетская больница Неккер Энфантс Младес, Париж, Франция; Питер Дэвис, Университет Квинсленда, Херстон, Австралия; Университет Монреаля, Монреаль, Канада; Юкихиро Хасэгава, Токийская столичная детская больница Киёсе, Токио, Япония; Крис Кельнар, Эдинбургский университет, Шотландия, Великобритания; Сандро Лоче, Региональная больница по микрокитемии, Кальяри, Италия; Луи Лоу, Университет Гонконга, Гонконг, Китай; Нелли Маурас, Детская клиника Немур, Джэксонвилл, Флорида; Мейнольф Ноекер, Боннский университет, Бонн, Германия; Джон Паркс, Медицинский факультет Университета Эмори, Атланта, Джорджия; Моше Филип, Детский медицинский центр Шнайдера, Израиль, Тель-Авивский университет, Петах-Тиква, Израиль; Михаэль Ранке, Университетская больница для детей и подростков, Тюбинген, Германия; Салли Радовик, медицинский факультет Университета Джона Хопкинса, Балтимор, Мэриленд; Эдвард Рейтер, медицинский факультет Университета Тафтса, Спрингфилд, Массачусетс; Алан Рогол, Университет Вирджинии, Шарлоттсвилль, Вирджиния; Стивен Розенталь, UCSF, Сан-Франциско, Калифорния; Джуди Росс, Университет Томаса Джефферсона, Филадельфия, Пенсильвания; Пол Сэнгер, Медицинский колледж Альберта Эйнштейна, Бронкс, Нью-Йорк; Дэвид Сэндберг, Мичиганский университет, Анн-Арбор, Мичиган; Мартин Сэвидж, Лондонская школа медицины и стоматологии, Лондон, Великобритания; Ларс Савендаль, Каролинский институт, Стокгольм, Швеция; Ян-Маартен Вит, Медицинский центр Лейденского университета, Лейден, Нидерланды; и Susumu Yokoya, Национальный центр здоровья и развития детей, Токио, Япония.
В число отраслевых участников, не имеющих права голоса, входили Eli Lilly and Co .; Барбара Липпе, Genentech; Анн-Мари Каппельгаард, Ново Нордиск А / С; Мирей Боннемэр, Ипсен, Лтд .; Джордж Брайт, Tercica, Inc.; и Хосе Кара, Pfizer Global Pharmaceuticals.
Консенсус-семинар был организован и поддержан Обществом исследования гормона роста, Детским эндокринным обществом Лоусона Уилкинса и Европейским обществом детской эндокринологии при частичной поддержке неограниченных образовательных грантов от Eli Lilly and Co., Ferring, Genentech, Ipsen, JCR Pharmaceuticals, Novartis, Novo Nordisk, Pfizer и Tercica.
Подтверждения: Консенсусный документ был одобрен Обществом исследования гормона роста, Детским эндокринным обществом Лоусона Уилкинса (LWPES), Европейским обществом детской эндокринологии (ESPE), Латиноамериканским обществом детской эндокринологии (SLEP), Японским обществом. детской эндокринологии (JSPE), Канадской педиатрической эндокринной группы (CPEG), Азиатско-Тихоокеанского педиатрического эндокринного общества (APPES) и Австралазийской педиатрической эндокринной группы (APEG).
Заявление о раскрытии информации: P.C. является консультантом Tercica и Novo Nordisk и получил грантовую поддержку от Pfizer, Genentech и Eli Lilly and Co. A.D.R. является консультантом Tercica, Novo Nordisk, Genentech, Serono и Pfizer. C.L.D. является консультантом Serono and Eli Lilly, and Co. и спикером Novo Nordisk. P.S. консультант Sandoz. E.O.R. консультант Pfizer и спикер Genentech. J.L.R. является консультантом Eli Lilly and Co. S.D.C. консультант Tercica. М.ОПЕРАЦИОННЫЕ СИСТЕМЫ. консультант Ipsen. J.M.W. является консультантом компаний Ipsen, Eli Lilly и Tercica и получил грантовую поддержку от Pfizer, Novo Nordisk, Ferring и Ipsen.
Сокращения
CDGP
Конституциональная задержка роста и полового созревания
GnRHa
ISS
SDS
1998 Консенсус рекомендаций по диагностике и лечению гормональной недостаточности для взрослых семинар Общества исследования гормона роста по дефициту гормона роста у взрослых.
J Clin Endocrinol Metab
83
:379
—381
22000 Консенсусное руководство по диагностике и лечению дефицита гормона роста (GH) в детском и подростковом возрасте: сводное заявление Исследовательского общества GH.
J Clin Endocrinol Metab
85
:3990
—3993
3Ho
KK
,2007
Консенсус семинара по дефициту GH для взрослых Рекомендации по лечению и рекомендации по лечению 2007 г. гормональная недостаточность.II. Сводное заявление Общества исследования гормона роста совместно с Европейским обществом детской эндокринологии, Обществом Лоусона Уилкинса, Европейским обществом эндокринологии, Японским эндокринным обществом и Австралийским эндокринным обществом.Eur J Endocrinol
157
:695
—700
4Wit
JM
,Clayton
PE
,Rogol
AD
,Savage PH
,Cohen
P
2008
Идиопатический низкий рост: определение, эпидемиология и диагностическая оценка.
Гормона роста IGF Res
18
:89
—110
5Wit
JM
,Reiter
EO
,Ross
JL
, 9000 Savage5, 9000 Savage5MO
,Rogol
AD
,Cohen
P
2008
Идиопатический низкий рост: управление и лечение гормоном роста.
Гормона роста IGF Res
18
:111
—135
6Ранке
MB
1996
На пути к консенсусу в определении идиопатического невысокого роста
.Horm Res
45
(Suppl 2
):64
—66
7Lindsay
R
,Feldkamp
M
,Harris
000 9000 9000 D ,Rallison
M
1994
Utah Growth Study: стандарты роста и распространенность дефицита гормона роста.
J Pediatr
125
:29
—35
8Hermanussen
M
,Cole
J
2003
Расчет высоты цели пересмотрен.
Horm Res
59
:180
—183
9Luo
ZC
,Albertsson-Wikland
K
,Karlberg
J9000 родительский рост в популяционном исследовании.
Pediatr Res
44
:563
—571
12Cianfarani
S
,Liguori
A
,Boemi
S
L
,Wasniewska
M
,Street
ME
,Zucchini
S
,Aimaretti
G
,Germani
D
инсулин
000
инсулин
, как фактор роста Оценка IGF) -связывающего белка (IGFBP) -3 при диагностике дефицита гормона роста (GH) от детства до юношеского возраста: связь с низкой зависимостью IGF-II от GH и присутствием циркулирующего 18-килодальтонного фрагмента IGFBP-3.
J Clin Endocrinol Metab
90
:6028
—6034
13Rappold
G
,Blum
WF
,Shavrikova
000 Robo
000 EP
EP
R
,Quigley
CA
,Ross
JL
,Niesler
B
2007
Генотипы и фенотипы у детей с низким ростом: клинические показатели SHOX haploins.
J Med Genet
44
:306
—313
14Visser-van Balen
H
,Geenen
R
,Kamp
GA
5,
Wit
JM
,Sinnema
G
2007
Долгосрочные психосоциальные последствия гормонального лечения для лиц с низким ростом.
Acta Paediatr
96
:715
—719
15Sandberg
DE
,Colsman
M
2005
Гормон роста качества жизни лечение короткого роста .
Horm Res
63
:275
—283
16Allen
DB
,Fost
NC
2004
Гормон роста для невысокого роста: подняты этические проблемы.
J Педиатр
144
:648
—652
17Росс
JL
,Sandberg
DE
,Rose
SR
,Leschek
, Leschek E J,Chipman
JJ
,Cassorla
FG
,Quigley
CA
,Crowe
BJ
,Робертс
K
ler0002 K, GBКат. Психологическая адаптация у детей с идиопатическим низким ростом, получавших гормон роста или плацебо.
J Clin Endocrinol Metab
89
:4873
—4878
18De Luca
F
,Argente
J
,Cavallo
L
Delemarre-Van de WaalHA
,De Sanctis
C
,Di Maio
S
,Norjavaara
E
,Oostdijk
W
,000 Sever
,G
,Trifiro
G
,Voorhoeve
PG
,Wu
F
2001
Международный семинар по управлению периодом полового созревания для достижения оптимальных ауксологических результатов
.Управление половым созреванием при конституциональной задержке роста и полового созревания. J Pediatr Endocrinol Metab
14
(Suppl 2
):953
—957
19Чернаусек
SD
,Backeljauw
000 PF
,000 JR000,
000, Франция000
,Underwood
LE
, Совместная группа по синдрому нечувствительности GH2007
Долгосрочное лечение рекомбинантным инсулиноподобным фактором роста (IGF) -I у детей с тяжелым дефицитом IGF-I из-за нечувствительности к гормону роста.
J Clin Endocrinol Metab
92
:902
—910
20Yanovski
JA
,Rose
SR
,Municchi
G
SC
,Cassorla
FG
,Cutler Jr
GB
2003
Лечение агонистом лютеинизирующего гормона рилизинг-гормона у подростков с низким ростом.
N Engl J Med
348
:908
—917
21Mazur
T
,Clopper
RR
1991
Психология и клинические расстройства.
Endocrinol Metab Clin North Am
20
:211
—227
22Hero
M
,Wickman
S
,2006 Dunkel
L ar
at
ингибитор летрозол в подростковом возрасте увеличивает почти конечный рост у мальчиков с конституциональной задержкой полового созревания.
Clin Endocrinol (Oxf)
64
:510
—513
23Mauras
N
,Gonzalez de Pijem
L
,Hsiang
000000 Hsiang ,Rapaport,
R
,Schwartz
ID
,Klein
KO
,Singh
RJ
,Miyamoto
A
,000
000
епископа прогнозируемый рост взрослых мужчин невысокого роста, получавших гормон роста: рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование продолжительностью от одного до трех лет.
J Clin Endocrinol Metab
93
:823
—831
24Wit
JM
,Rekers-Mombarg
LT
2002 Dutch Growth Group
Окончательный набор роста при терапии гормоном роста у детей с идиопатическим низким ростом зависит от дозы.
J Clin Endocrinol Metab
87
:604
—611
25Ranke
MB
,Lindberg
A
,Price
DA
del,iler
DA
del,-Wikland
K
,Wilton
P
,Reiter
EO
2007 Международный совет KIGS.Возраст начала терапии гормоном роста и реакция на гормон роста в первый год являются основными определяющими факторами роста при идиопатическом низком росте.Horm Res
68
:53
—62
26Bryant
J
,Baxter
L
,Cave
CB
,000000 Рекомбинантный гормон роста при идиопатическом невысоком росте у детей и подростков.Кокрановская база данных Syst Ред. Июл
18
:CD004440
27Hintz
RL
,Attie
KM
,Baptista
J
,9000 9000
000Roche
лечение гормоном роста на взрослом росте детей с идиопатическим низким ростом. Совместная группа Genentech.N Engl J Med
340
:502
—507
28Wit
JM
,Rekers-Mombarg
LT
,Cutler
GB
Beck
TJ
,Roberts
K
,Gill
A
,Chaussain
JL
,Frisch
H
,Yturriaga
000000 R9000
000 2005Лечение гормоном роста (GH) до окончательного роста у детей с идиопатическим низким ростом: доказательства эффекта дозы.
J Pediatr
146
:45
—53
29Finkelstein
BS
,Imperiale
TF
,Speroff
T
000
000 Radi000000000 DJ,Cuttler
L
2002
Влияние терапии гормоном роста на рост у детей с идиопатическим низким ростом: метаанализ.
Arch Pediatr Adolesc Med
156
:230
—240
30Leschek
EW
,Rose
SR
,Yanovski
JA
0005 TroeleyCA
,Chipman
JJ
,Crowe
BJ
,Ross
JL
,Cassorla
FG
,Blum
9000 RG 9000 Bar
GB2 9000 Cutler
J
, Национальный институт детского здоровья и развития человека — Eli Lilly, Co.Совместная группа по гормону роста2004
Влияние лечения гормоном роста на рост взрослых у детей периубертатного возраста с идиопатическим низким ростом: рандомизированное двойное слепое плацебо-контролируемое исследование.
J Clin Endocrinol Metab
89
:3140
—3148
31Kamp
GA
,Waelkens
JJ
,de Muinck Keizer- Delemar-9000 Delemar-Schrama
000 WaalHA
,Verhoeven-Wind
L
,Zwinderman
AH
,Wit
JM
2002
Обработка высоких доз гормона роста вызывает ускорение раннего начала созревания скелета дети с идиопатическим невысоким ростом.
Arch Dis Child
87
:215
—220
32Cohen
P
,Rogol
AD
,Howard
CP
,Bright
apAM
,Rosenfeld
RG
, Американская группа изучения нордитропина2007
Дозирование гормона роста у детей на основе инсулинового фактора роста: рандомизированное контролируемое исследование.
J Clin Endocrinol Metab
92
:2480
—2486
33Clayton
PE
,Cianfarani
S
,Czernichow
POWER
R
,Rogol
A
2007
Ведение ребенка, рожденного малым для гестационного возраста и до взрослого возраста: согласованное заявление Международного общества детской эндокринологии и Общества исследования гормона роста.
J Clin Endocrinol Metab
92
:804
—810
35Tanaka
T
2007
Достаточно долгое лечение комбинированным гормоном роста и аналогом гонадотропина у взрослых может улучшить высвобождение гормона роста и аналога гонадотропина. у невысоких детей с изолированным дефицитом гормона роста (GHD) и у маленьких детей без GHD.
Pediatr Endocr Ред.
5
:471
—481
36van Gool
SA
,Kamp
GA
,Visser-van Balen
H
H
Mul000 ,Waelkens
JJ
,Jansen
M
,Verhoeven-Wind
L
,Delemarre-van de Waal
HA
,de Muinck Keizer-Schrama
000000000 G,Roos
JC
,Wit
JM
2007
Окончательный результат роста после трех лет лечения гормоном роста и агонистами гонадотропин-рилизинг-гормона у подростков с относительно ранним половым созреванием.
J Clin Endocrinol Metab
92
:1402
—1408
37Tanaka
T
,Cohen
P
,E Clayton
P
P
L Hintz
R
,C Sizonenko
P
2002
Диагностика и лечение дефицита гормона роста в детском и подростковом возрасте. Часть 2. Лечение гормоном роста у детей с дефицитом гормона роста.
Гормона роста IGF Res
12
:323
—341
38Quigley
CA
,Gill
AM
,Crowe
0002 BJ,JJ
,Rose
SR
,Ross
JL
,Cassorla
FG
,Wolka
AM
,Wit
000 Regers, Катлер младшийGB
2005
Безопасность лечения гормоном роста у педиатрических пациентов с идиопатическим низким ростом.
J Clin Endocrinol Metab
90
:5188
—5196
39Bakker
B
,Frane
J
,Anhalt
H
pe
RG
2008
Целевые показатели скорости роста из национального кооперативного исследования роста гормона роста в первый год у детей невысокого возраста.
J Clin Endocrinol Metab
93
:352
—357
Авторские права © 2008 Общество эндокринологов
Использование гормона роста в США в эпоху идиопатического невысокого роста: тенденции в выплатах страховщикам и финансовое бремя пациентов | Журнал эндокринного общества
Аннотация
Цель
Изучить тенденции в распространенности и расходах использования гормона роста (GH) среди молодежи США за последние 15 лет — период, в течение которого Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило лечение GH идиопатического невысокого роста (ISS). , а страховщики установили более серьезные препятствия для возмещения расходов на лечение GH.
Дизайн
С использованием данных о коммерческих заявках OptumInsight с 2001 по 2016 гг. Мы проанализировали тенденции в заявках на препараты GH среди бенефициаров в возрасте от 0 до 18 лет (n = 38 857 бенефициаров, получающих GH). Показатели результатов включали годовое преобладание претензий по GH и общий годовой объем страховых выплат и общие выплаты пациентам по претензиям GH. t Тесты использовались для линейных временных тенденций в результатах. Также был рассчитан процент бенефициаров, сменивших бренды GH.
Результаты
Число участников с претензиями GH на 10 000 бенефициаров в возрасте до 18 лет неуклонно росло с 5.1 в 2001 г. до 14,6 в 2016 г., без существенных изменений примерно в 2003 г., дате утверждения ISS. Средние общие расходы на ГР снизились (-26% в постоянных долларах), как и расчетная сумма страховых выплат (-28%). Однако средние общие расходы пациентов увеличились на 163%. Бенефициары, сменившие бренды GH в течение года, варьировались от 1,4% до 3,6% в 2001–2007 годах и от 5,1% до 8,8% после, с переходом на 25,6% в 2009 году и на 13,9% в 2015 году.
Выводы
Утверждение FDA ISS было не является переломным моментом в устойчивом росте употребления гормона роста среди молодежи США.Прогрессивные ограничения на страховое покрытие и стратегии покрытия рецептурных предпочтений, по-видимому, позволили снизить общие расходы и нагрузку на страховщиков, связанных с лечением гормонов роста, в расчете на одного бенефициара. Тем не менее, эти сбережения не были переданы пациентам, которые несли более тяжелое финансовое бремя из-за смены бренда.
В 2003 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило лечение гормоном роста (GH) идиопатического невысокого роста (ISS), расширив потенциальные права на лечение GH с 1: 3500 детей с дефицитом GH [1] до минимального 1.2% населения США [2]. Исходя из 74 181 467 человек в возрасте до 18 лет, подсчитанного в переписи населения США 2010 года, это означает повышение потенциального права на участие в программе GH с примерно 21 000 молодых людей с дефицитом GH до примерно 890 000 молодых людей с ростом, соответствующим критерию ISS, что означает увеличение потенциала на 869 000 человек. Получатели GH на национальном уровне [3]. ISS был первым показанием FDA, которое подчеркивало рост, а не лежащую в основе патологию как квалификационный критерий для лечения, и GH стал парадигмой «обширной биотехнологии», в которой биомедицинская технология, первоначально разработанная для лечения болезней (дефицит GH), расширилась, с поощрением врачей и поддержку промышленности в лечении состояний, стирающих границу между болезнью и изменчивостью [4].
В ответ на это за последние десять лет страховая отрасль ввела прогрессивные ограничения на покрытие лечения GH. Страховые компании приняли формулярные стратегии преференциального покрытия в качестве меры по ограничению затрат. Поскольку предпочтительный бренд может измениться, когда пациенты меняют своего поставщика страховых услуг или когда страховщики пересматривают свои контракты с различными производителями GH, стратегия предпочтений в формуле может привести к смене бренда во время длительного курса лечения GH у детей, иногда с неблагоприятными последствиями [ 5].Совсем недавно многие страховые компании ввели более строгие правила покрытия, включая принятие критериев для конкретного плана, более строгих, чем те, которые рекомендованы руководящими принципами Педиатрического эндокринного общества для лечения дефицита GH [6], и отказ в любом покрытии для лечения GH ISS. .
Таким образом, мы стремились исследовать, как распространенность употребления гормона роста среди молодежи США изменилась за последние 15 лет, сосредоточив внимание на дате утверждения FDA ISS и общих светских тенденциях в выплатах страховщикам и расходах пациентов, поскольку страховщики налагают более высокие барьеры на рост гормона роста. возмещения.Мы также изучили тенденции смены бренда GH.
1. Материалы и методы
A. Данные
Мы использовали данные об административных претензиях OptumInsight за 2001–2016 гг. (Clinformatics DataMart ™ 7.0, 2017; Optum, Eden Prairie, MN), которые охватывают от 15 до 18 миллионов человек в год, зарегистрированных в коммерческих планах здравоохранения США. OptumInsight — это большая база данных коммерческих заявлений о медицинских услугах, широко используемая в исследованиях медицинских услуг [7]. База данных с разнообразным охватом населения во всех 50 штатах считается репрезентативной для населения страны, застрахованного на коммерческой основе.
Аналитическая выборка состояла из бенефициаров в возрасте от 0 до 18 лет со страховым покрытием на 6 или более месяцев и имевших по крайней мере одну заявку на GH в том году (n = 38 857). Препараты GH были идентифицированы как препараты с активным ингредиентом соматропина и включали фирменные препараты Genotropin, Humatrope, Norditropin, Nutropin, Saizen и Tev-Tropin, а также биоподобные препараты Omnitrope и Zomacton.
B. Результаты
В качестве меры распространенности мы подсчитали годовое количество бенефициаров, подавших по крайней мере одну заявку на лекарство от GH, на 10 000 бенефициаров в возрасте до 18 лет.Мы изучили пол, расу / этническую принадлежность (белые / черные / азиатские; испаноязычные / неиспаноязычные) и возрастной состав бенефициаров с заявлениями о ГР.
Из соображений конфиденциальности Optum не сообщает фактическую сумму, выплаченную страховщику, но усредняет разрешенные выплаты по планам медицинского обслуживания и контрактам с поставщиками услуг. Мы использовали этот стандартизированный разрешенный платеж в качестве оценочной меры суммы, уплаченной страховщиком. В качестве меры расходов пациентов мы рассчитали годовые общие платежи пациентов по совместному страхованию, сооплате, отпуску и франшизе, связанной с претензиями GH для каждого бенефициара.Общие расходы на ГР были рассчитаны как сумма расчетной суммы, выплаченной страховщику, и общих выплат пациентам. Из-за длительного периода времени мы рассчитывали платежи как в номинальном, так и в постоянном долларах, дефлятируя номинальные суммы с помощью индекса потребительских цен до долларов 2004 года [8].
Чтобы определить частоту переключения, мы подсчитали процент участников с заявками GH, чей бренд GH менялся хотя бы один раз в этом году.
C. Статистический анализ
Описательный анализ проводился в графической и табличной форме. t Тесты использовались для проверки линейных временных тенденций распространенности, демографических характеристик пациентов с гормон роста и финансового бремени.
2. Результаты
A. Характеристики получателей GH
Число участников с претензиями GH на 10 000 бенефициаров в возрасте до 18 лет неуклонно росло с 5,1 в 2001 году до 14,6 в 2016 году ( P <0,001) без значительных изменений примерно в 2003 году, дате утверждения ISS (рис. 1). Чтобы представить эти показатели в перспективе, предполагаемая распространенность дефицита GH соответствует 2.857 на 10 000 [1], и распространенность 120 на 10 000 бенефициаров была бы применима, если бы каждый ребенок, удовлетворяющий критерию роста FDA для ISS, проходил лечение.
Рисунок 1.
Рост распространенности жалоб на GH с 2001 по 2016 год. Для сравнения, оценочная распространенность 1: 3500 дефицита GH (GHD) [1] показана горизонтальной линией.
Рисунок 1.
Растущая распространенность жалоб на GH с 2001 по 2016 год. Для сравнения, оценочная распространенность 1: 3500 дефицита GH (GHD) [1] показана горизонтальной линией.
С 2001 по 2016 год доля девочек, получающих лечение ГР, снизилась (с 34% до 28%, P <0,001; рис. 2), как и доля белой молодежи (от 80% до 77%), тогда как пропорции черной (от 3% до 4%) и азиатской (от 1% до 4%) молодежи увеличилось (все P <0,001). Доля латиноамериканской молодежи за это время не изменилась (от 9% до 10%). Средний и средний возраст оставался стабильным на уровне от 12 до 13 лет.
Рис. 2.
Доля женщин-реципиентов ГР с течением времени.
Рис. 2.
Доля женщин-реципиентов ГР с течением времени.
B. Расходы GH
Как показано в таблицах 1 и 2, средние общие расходы на ГР снизились как в номинальных долларах (-6%, P <0,001), так и в постоянных долларах 2004 г. (-26%, P <0,001), как и предполагалось. страховые суммы (−8% в номинальных долларах, P <0,001; −28% в постоянных долларах, P <0,001). Однако среднее общее финансовое бремя пациента увеличилось (234% в номинальном выражении, P <0.001; 163% в постоянных долларах, P <0,001). Эти изменения в долларах привели к увеличению на 2,5 процентных пункта средней доли расходов пациентов с 1,4% в 2004 г. до 3,9% в 2016 г. (Таблица 3). Медианные расходы и доли страховых компаний и пациентов следовали аналогичным схемам (Таблицы 1–3).
Таблица 1.Тенденции в страховании и финансовом бремени пациентов для использования GH среди молодежи младше 18 лет: номинальные доллары
| . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | ||||||||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 35,810 | 28,750 | 351 | 220 | ||||||||||||||||
| 2006 | 36,383 | 27,578 | 29,789 | 34,047 | 35,880 | 29,328 503 | 29,328 503 | 27,886 | 32,333 | 33,734 | 27,387 | 615 | 235 | |||||||||||||||
| 2008 | 34,266 | 26,484 | 28,596 33704 | 26,484 | 28,596 33704 | 5 | ||||||||||||||||||||||
| 2009 | 34,820 | 25,894 | 28,535 | 32,973 | 34,147 | 27,490 | 673 | 260 | ||||||||||||||||||||
| 2010 33,1704 | 275703 | 25,919 | 714 | 270 | ||||||||||||||||||||||||
| 2011 | 33,081 | 25,817 | 27,204 | 31,560 | 32,234 | 25,946 | 8504 | 25,946 | 85016 9703 | 31703 31703 31703 31704 | 25,946 | 8503 2012 | 30,848 | 31,373 | 25,742 | 941 | 330 | |||||||||||
| 2013 | 30,617 | 23,342 | 25,358 | 29,648 29704 | 9703 9703 704 | 32,642 | 24,486 | 27,516 | 32,816 | 31,584 | 26,486 | 1059 | 375 | |||||||||||||||
| 2015 | 33,563,9703 | 33,563,9703 | 33,563,9704 | 360 | ||||||||||||||||||||||||
| 2016 | 33,304 | 23,661 | 28,805 | 31,383 | 32,206 | 27,341 | 1099 | 38504 | 2 | −8 | −2 | 234 | 93 | |||||||||||||||
| . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | |||||||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 35,810 | 28,750 | 351 | 220 | |||||||||||||||
| 2006 | 36,383 | 27,578 | 29,789 | 34,047 | 35,880 | 29,328 503 | 29,328 503 | 27,886 | 32,333 | 33,734 | 27,387 | 615 | 235 | ||||||||||||||
| 2008 | 34,266 | 26,484 | 28,596 33704 | 26,484 | 28,596 33704 | 5 | |||||||||||||||||||||
| 2009 | 34,820 | 25,894 | 28,535 | 32,973 | 34,147 | 27,490 | 673 | 260 | |||||||||||||||||||
| 2010 33,1704 | 275703 | 25,919 | 714 | 270 | |||||||||||||||||||||||
| 2011 | 33,081 | 25,817 | 27,204 | 31,560 | 32,234 | 25,946 | 8504 | 25,946 | 85016 9703 | 31703 31703 31703 31704 | 25,946 | 8503 2012 | 30,848 | 31,373 | 25,742 | 941 | 330 | ||||||||||
| 2013 | 30,617 | 23,342 | 25,358 | 29,648 29704 | 9703 9703 704 | 32,642 | 24,486 | 27,516 | 32,816 | 31,584 | 26,486 | 1059 | 375 | ||||||||||||||
| 2015 | 33,563,9703 | 33,563,9703 | 360 | ||||||||||||||||||||||||
| 2016 | 33,304 | 23,661 | 28,805 | 31,383 | 32,206 | 27,341 | 1099 | 38504 | 2 | −8 | −2 | 234 | 93 | ||||||||||||||
Тенденции в страховании и финансовом бремени пациентов при использовании гормона роста среди молодежи младше 18 лет: номинальные доллары
| . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | ||||||||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 35,810 | 28,750 | 351 | 220 | ||||||||||||||||
| 2006 | 36,383 | 27,578 | 29,789 | 34,047 | 35,880 | 29,328 503 | 29,328 503 | 27,886 | 32,333 | 33,734 | 27,387 | 615 | 235 | |||||||||||||||
| 2008 | 34,266 | 26,484 | 28,596 33704 | 26,484 | 28,596 33704 | 5 | ||||||||||||||||||||||
| 2009 | 34,820 | 25,894 | 28,535 | 32,973 | 34,147 | 27,490 | 673 | 260 | ||||||||||||||||||||
| 2010 33,1704 | 275703 | 25,919 | 714 | 270 | ||||||||||||||||||||||||
| 2011 | 33,081 | 25,817 | 27,204 | 31,560 | 32,234 | 25,946 | 8504 | 25,946 | 85016 9703 | 31703 31703 31703 31704 | 25,946 | 8503 2012 | 30,848 | 31,373 | 25,742 | 941 | 330 | |||||||||||
| 2013 | 30,617 | 23,342 | 25,358 | 29,648 29704 | 9703 9703 704 | 32,642 | 24,486 | 27,516 | 32,816 | 31,584 | 26,486 | 1059 | 375 | |||||||||||||||
| 2015 | 33,563,9703 | 33,563,9703 | 33,563,9704 | 360 | ||||||||||||||||||||||||
| 2016 | 33,304 | 23,661 | 28,805 | 31,383 | 32,206 | 27,341 | 1099 | 38504 | 2 | −8 | −2 | 234 | 93 | |||||||||||||||
| . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | ||||||||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 35,810 | 28,750 | 351 | 220 | ||||||||||||||||
| 2006 | 36,383 | 27,578 | 29,789 | 34,047 | 35,880 | 29,328 503 | 29,328 503 | 27,886 | 32,333 | 33,734 | 27,387 | 615 | 235 | |||||||||||||||
| 2008 | 34,266 | 26,484 | 28,596 33704 | 26,484 | 28,596 33704 | 5 | ||||||||||||||||||||||
| 2009 | 34,820 | 25,894 | 28,535 | 32,973 | 34,147 | 27,490 | 673 | 260 | ||||||||||||||||||||
| 2010 33,1704 | 275703 | 25,919 | 714 | 270 | ||||||||||||||||||||||||
| 2011 | 33,081 | 25,817 | 27,204 | 31,560 | 32,234 | 25,946 | 8504 | 25,946 | 85016 9703 | 31703 31703 31703 31704 | 25,946 | 8503 2012 | 30,848 | 31,373 | 25,742 | 941 | 330 | |||||||||||
| 2013 | 30,617 | 23,342 | 25,358 | 29,648 29704 | 9703 9703 704 | 32,642 | 24,486 | 27,516 | 32,816 | 31,584 | 26,486 | 1059 | 375 | |||||||||||||||
| 2015 | 33,563,9703 | 33,563,9703 | 360 | |||||||||||||||||||||||||
| 2016 | 33,304 | 23,661 | 28,805 | 31,383 | 32,206 | 27,341 | 1099 | 38504 | 2 | −8 | −2 | 234 | 93 | |||||||||||||||
Тенденции в страховании и финансовом бремени пациентов при использовании гормона роста среди молодежи младше 18 лет: в постоянных долларах (база = 2004)
| год . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | |||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 34,923 | 28,038 | 342 | 215 | ||||||||||
| 2006 | 34,057 | 25,815 | 27,885 | 31,871 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 2007 | 25,419 | 29,472 | 30,750 | 24,964 | 561 | 214 | |||
| 2008 | 29,765 | 23,005 | 24,840 | 9703 24,840 | 5 | |||||||||||||||||
| 2009 | 30,623 | 22,773 | 25,095 | 28,999 | 30,031 | 24,176 | 592 | 229 229 | ||||||||||||||
| 2010 282704 | 22,542 | 621 | 235 | |||||||||||||||||||
| 2011 | 27,797 | 21,694 | 22,859 | 26,519 | 27,086 | 21,802 | 714 | 21,802 | 714 | 21802 | 714 9702 | 21802 | 714 9702 | 25,499 | 25,933 | 21,279 | 778 | 273 | ||||
| 2013 | 24,881 | 18,969 | 20,608 | 24,09417 9704 | 9703 24,09417 | 04 | 25,992 | 19,497 | 21,910 | 26,130 | 25,149 | 21,090 | 843 | 299 | ||||||||
| 2015 | 26,674,1703 | 21703 | 21703 | 21703 21703 | 21703 | 21703 21704 | 286 | |||||||||||||||
| 2016 | 26,195 | 18,610 | 22,656 | 24,684 | 25,331 | 21,505 | 864 | 2004 | −20 | −28 | −23 | 163 | 51 | |||||||||
| Год . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | |||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 34,923 | 28,038 | 342 | 215 | ||||||||||
| 2006 | 34,057 | 25,815 | 27,885 | 31,871 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 2007 | 25,419 | 29,472 | 30,750 | 24,964 | 561 | 214 | |||
| 2008 | 29,765 | 23,005 | 24,840 | 9703 24,840 | 5 | |||||||||||||||||
| 2009 | 30,623 | 22,773 | 25,095 | 28,999 | 30,031 | 24,176 | 592 | 229 229 | ||||||||||||||
| 2010 282704 | 22,542 | 621 | 235 | |||||||||||||||||||
| 2011 | 27,797 | 21,694 | 22,859 | 26,519 | 27,086 | 21,802 | 714 | 21,802 | 714 | 21802 | 714 9702 | 21802 | 714 9702 | 25,499 | 25,933 | 21,279 | 778 | 273 | ||||
| 2013 | 24,881 | 18,969 | 20,608 | 24,09417 9704 | 9703 24,09417 | 04 | 25,992 | 19,497 | 21,910 | 26,130 | 25,149 | 21,090 | 843 | 299 | ||||||||
| 2015 | 26,674,1703 | 21703 21703 | 21703 21703 | 21703 21704 | 21703 21703 | 286 | ||||||||||||||||
| 2016 | 26,195 | 18,610 | 22,656 | 24,684 | 25,331 | 21,505 | 864 | 2004 | −20 | −28 | −23 | 163 | 51 | |||||||||
Тенденции в страховании и финансовом бремени пациентов при использовании гормона роста среди молодежи младше 18 лет: в постоянных долларах (база = 2004)
| год . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | |||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 34,923 | 28,038 | 342 | 215 | ||||||||||
| 2006 | 34,057 | 25,815 | 27,885 | 31,871 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 2007 | 25,419 | 29,472 | 30,750 | 24,964 | 561 | 214 | |||
| 2008 | 29,765 | 23,005 | 24,840 | 9703 24,840 | 5 | |||||||||||||||||
| 2009 | 30,623 | 22,773 | 25,095 | 28,999 | 30,031 | 24,176 | 592 | 229 229 | ||||||||||||||
| 2010 282704 | 22,542 | 621 | 235 | |||||||||||||||||||
| 2011 | 27,797 | 21,694 | 22,859 | 26,519 | 27,086 | 21,802 | 714 | 21,802 | 714 | 21802 | 714 9702 | 21802 | 714 9702 | 25,499 | 25,933 | 21,279 | 778 | 273 | ||||
| 2013 | 24,881 | 18,969 | 20,608 | 24,09417 9704 | 9703 24,09417 | 04 | 25,992 | 19,497 | 21,910 | 26,130 | 25,149 | 21,090 | 843 | 299 | ||||||||
| 2015 | 26,674,1703 | 21703 | 21703 | 21703 21703 | 21703 | 21703 21704 | 286 | |||||||||||||||
| 2016 | 26,195 | 18,610 | 22,656 | 24,684 | 25,331 | 21,505 | 864 | 2004 | −20 | −28 | −23 | 163 | 51 | |||||||||
| Год . | Общие расходы, $ . | Бремя страховщика, $ . | Бремя пациента, $ . | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD . | Медиана . | IQR а . | Среднее . | Медиана . | Среднее . | Медиана . | ||||||||||||||
| 2004 | 35,427 | 28,459 | 28,296 | 34,106 | 35,099 | 27,827 | 329 | 200 | 34,923 | 28,038 | 342 | 215 | |||||||||
| 2006 | 34,057 | 25,815 | 27,885 | 31,871 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 33,586 | 27,453 | 2007 | 25,419 | 29,472 | 30,750 | 24,964 | 561 | 214 | ||
| 2008 | 29,765 | 23,005 | 24,840 | 9703 24,840 | 5 | ||||||||||||||||
| 2009 | 30,623 | 22,773 | 25,095 | 28,999 | 30,031 | 24,176 | 592 | 229 229 | |||||||||||||
| 2010 282704 | 22,542 | 621 | 235 | ||||||||||||||||||
| 2011 | 27,797 | 21,694 | 22,859 | 26,519 | 27,086 | 21,802 | 714 | 21,802 | 714 | 21802 | 714 9702 | 21802 | 714 9702 | 25,499 | 25,933 | 21,279 | 778 | 273 | |||
| 2013 | 24,881 | 18,969 | 20,608 | 24,09417 9704 | 9703 24,09417 | 04 | 25,992 | 19,497 | 21,910 | 26,130 | 25,149 | 21,090 | 843 | 299 | |||||||
| 2015 | 26,674,1703 | 21703 21703 | 21703 21703 | 21703 21704 | 21703 21703 | 286 | |||||||||||||||
| 2016 | 26,195 | 18,610 | 22,656 | 24,684 | 25,331 | 21,505 | 864 | 30316704 | −20 | −28 | −23 | 163 | 51 | ||||||||
Тенденции в страховании и финансовом бремени пациентов для использования GH среди молодежи моложе 18 лет: доля расходов на страхование и пациентов
| . | Доля страховщика,% . | Доля пациентов,% . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | Медиана . | Среднее . | Медиана . | ||||||||
| 2004 | 98,6 | 99,3 | 1,4 | 0,7 | ||||||||
| 2005 | 98,6 | 99,3 | 1,4 | 0,71675 | 1,4 | 0,716 9704 | 0,7 | |||||
| 2007 | 97,6 | 99,2 | 2,4 | 0,8 | ||||||||
| 2008 | 97,4 | 99.1 | 2,6 | 0,9 | ||||||||
| 2009 | 97,5 | 99,1 | 2,5 | 0,9 | ||||||||
| 2010 | 97,2 | 99,0 | 97,2 | 99,0 | 2,8 | 98,9 | 3,3 | 1,1 | ||||
| 2012 | 96,4 | 98,7 | 3,6 | 1,3 | ||||||||
| 2013 | 95.8 | 98,5 | 4,2 | 1,5 | ||||||||
| 2014 | 95,9 | 98,6 | 4,2 | 1,4 | ||||||||
| 2015 | 96,0 | |||||||||||
| 96,1 | 98,6 | 3,9 | 1,4 | |||||||||
| Изменение с 2004 по 2016 год | −2,5 | −0,7 | +2,5 | +0,7 | ||||||||
| Доля страховщика,% . | Доля пациентов,% . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | Медиана . | Среднее . | Медиана . | |||||||
| 2004 | 98,6 | 99,3 | 1,4 | 0,7 | |||||||
| 2005 | 98,6 | 99,3 | 1.4 | 0,7 | |||||||
| 2006 | 98,1 | 99,3 | 1,9 | 0,7 | |||||||
| 2007 | 97,6 | 99,2 | 2,4 | 2008 | 2,6 | 0,9 | |||||
| 2009 | 97,5 | 99,1 | 2,5 | 0,9 | |||||||
| 2010 | 97,2 | 99.0 | 2,8 | 1,0 | |||||||
| 2011 | 96,7 | 98,9 | 3,3 | 1,1 | |||||||
| 2012 | 96,4 | 98,7 | 96,4 | 98,5 | 4,2 | 1,5 | |||||
| 2014 | 95,9 | 98,6 | 4,2 | 1,4 | |||||||
| 2015 | 96.0 | 98,7 | 4,0 | 1,3 | |||||||
| 2016 | 96,1 | 98,6 | 3,9 | 1,4 | |||||||
| -2,5 | −2,5 | 0,7 |
Тенденции в страховании и финансовом бремени пациентов для использования GH среди молодежи младше 18 лет: доля расходов на страхование и пациентов
| . | Доля страховщика,% . | Доля пациентов,% . | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | Медиана . | Среднее . | Медиана . | |||||||
| 2004 | 98,6 | 99,3 | 1,4 | 0,7 | |||||||
| 2005 | 98,6 | 99,3 | 1.4 | 0,7 | |||||||
| 2006 | 98,1 | 99,3 | 1,9 | 0,7 | |||||||
| 2007 | 97,6 | 99,2 | 2,4 | 2008 | 2,6 | 0,9 | |||||
| 2009 | 97,5 | 99,1 | 2,5 | 0,9 | |||||||
| 2010 | 97,2 | 99.0 | 2,8 | 1,0 | |||||||
| 2011 | 96,7 | 98,9 | 3,3 | 1,1 | |||||||
| 2012 | 96,4 | 98,7 | 96,4 | 98,5 | 4,2 | 1,5 | |||||
| 2014 | 95,9 | 98,6 | 4,2 | 1,4 | |||||||
| 2015 | 96.0 | 98,7 | 4,0 | 1,3 | |||||||
| 2016 | 96,1 | 98,6 | 3,9 | 1,4 | |||||||
| -2,5 | −2,5 | 0,7 | |||||||||
| . | Доля страховщика,% . | Доля пациентов,% . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Год . | Среднее . | Медиана . | Среднее . | Медиана . | ||||||||
| 2004 | 98,6 | 99,3 | 1,4 | 0,7 | ||||||||
| 2005 | 98,6 | 99,3 | 1,4 | 0,71675 | 1,4 | 0,716 9704 | 0,7 | |||||
| 2007 | 97.6 | 99,2 | 2,4 | 0,8 | ||||||||
| 2008 | 97,4 | 99,1 | 2,6 | 0,9 | ||||||||
| 2009 | 97,5 | 99,19704 | 97,2 | 99,0 | 2,8 | 1,0 | ||||||
| 2011 | 96,7 | 98,9 | 3,3 | 1,1 | ||||||||
| 2012 | 96.4 | 98,7 | 3,6 | 1,3 | ||||||||
| 2013 | 95,8 | 98,5 | 4,2 | 1,5 | ||||||||
| 2014 | ||||||||||||
| 9166 9166 9166 | 96,0 | 98,7 | 4,0 | 1,3 | ||||||||
| 2016 | 96,1 | 98,6 | 3,9 | 1,4 | ||||||||
| Изменение с 2004 по 2016 | −2.5 | −0,7 | +2,5 | +0,7 | ||||||||
C. Коммутаторы марки GH
Как показано на рис. 3, в период с 2001 по 2007 год процент бенефициаров, чей бренд GH менялся по крайней мере один раз в год, колебался от 1,4% до 3,6% (в среднем 2,7%). После 2007 года средний годовой процент бенефициаров, чей бренд GH был изменен, составлял 9,4%, причем наибольшая частота приходилась на период с 2008 по 2009 год (переключение 25,6%) и с 2014 по 2015 год (13.9% переключения). В 2008–2009 годах наблюдалась высокая активность переключения с генотропина, хуматропа и нордитропина на нутропин и сайзен; в 2014–2015 годах наблюдалась высокая активность перехода с Тев-Тропина, который в конечном итоге был прекращен, а также с Сайзена и Генотропина на Нутропин. Без учета этих двух всплесков средняя распространенность смены бренда GH после 2007 г. составила 6,0%.
Рисунок 3.
Члены меняют бренды GH не реже одного раза в год.
Рисунок 3.
Участники меняют торговую марку GH не реже одного раза в год.
3. Обсуждение
Таким образом, одобрение FDA ISS не стало переломным моментом в устойчивом росте использования GH молодежью США. Прогрессивные ограничения на страхование и стратегии страхового покрытия преференций, похоже, позволили снизить общие расходы и нагрузку на страховщика по лечению гормонов роста на одного бенефициара. Однако эта экономия не была передана пациентам, которые несли более тяжелое финансовое бремя из-за смены бренда.
Несколько факторов, вероятно, способствовали тому, что одобрение FDA для показаний ISS в 2003 г. не оказало серьезного влияния на тенденцию к росту использования GH в педиатрии в США, наблюдаемую в этом исследовании. Рост произошел до 2003 г., вероятно, из-за рецептов, не отпускаемых по рецепту, для лечения СР и других состояний с помощью гормона роста. Обзор базы данных Pfizer International Growth Study показал, что значительное число пациентов в США, прошедших курс лечения по поводу синдрома раздраженного дыхания, с момента начала исследования постмаркетингового наблюдения в 1987 г. (введено в США в 1996 г.) и в Европе, несмотря на отсутствие одобрения Европейского агентства по лекарственным средствам [ 9].Распространенность заявлений о GH с 2001 по 2016 г. в текущем исследовании всегда превышала 1: 3500 распространенность дефицита GH [1], чему способствовали, по крайней мере частично, другие одобренные FDA показания для лечения GH у детей: хроническая почечная недостаточность. (1993), синдром Тернера (1996), синдром Прадера-Вилли (2000), малость для гестационного возраста без догоняющего роста (2001), гаплонедостаточность гена SHOX (2007) и синдром Нунана (2008) [4 ]. Однако распространенность заявлений о GH никогда не приближалась к 1.2% -ный порог высоты для индикации FDA ISS [2]. Некоторая часть дефицита может быть результатом все более строгих правил страхового покрытия, включая отказ от до в покрытии для лечения ISS. Некоторые из них могут быть результатом неполного доступа к медицинской помощи или отсутствия интереса к GH-лечению ISS со стороны некоторых семей пациентов и / или их эндокринологов. Самые последние рекомендации Педиатрического эндокринного общества рекомендуют «воздерживаться от рутинного использования GH у каждого ребенка с показателем SD роста ≤ -2.25 », но предлагал совместный подход к принятию решений на индивидуальной основе после оценки физического и психологического бремени и обсуждения потенциальных рисков и преимуществ [6].
Черты реципиентов GH в этом исследовании соответствовали другим исследованиям. О преобладании мужчин [9–12] и белых [11, 12] реципиентов GH ранее сообщалось в постмаркетинговых исследованиях GH. Снижение процента женщин-реципиентов GH с течением времени в этом исследовании, вероятно, отражает усиление лечения ISS, поскольку соотношение мужчин и женщин в четырех детских регистрах GH в США составляло 2: 1 для всех показаний, но 3: 1 для ISS [10].Распределение по возрасту в этом исследовании также напоминало предыдущие отчеты [10].
Модели расходов на GH, рассмотренные в этом исследовании, согласуются с более широкими тенденциями в США в отношении личных расходов пациентов и страхового покрытия. Общие и душевые расходы на здравоохранение увеличивались за последние 15 лет, в основном в результате более высоких отчислений, увеличения подверженности пациентов растущим расходам на здравоохранение и увеличения доли лиц, охваченных планами с высокие наличные расходы [13, 14].В частности, в отношении специализированных лекарств коммерческие страховые компании агрессивно используют предварительное разрешение, формуляры и ограничения по страховому покрытию, чтобы ограничить свою подверженность воздействию высоких цен на лекарства и сдержать рост расходов на лекарства [15, 16]. Эти стратегии страховщиков, а также частые изменения в формулярах, основанные на изменении цен, согласованных с производителями, также приводят к смене бренда.
В то время как использование базы данных OptumInsight предоставляло платежную информацию по большой национальной выборке педиатрических получателей GH в США в течение длительного периода времени, ее использование также привело к некоторым ограничениям.Зависимость от страховых выплат коммерческими планами медицинского страхования не проливает света на фактические цены, общее количество первоначально поданных рецептов или долю, в которой было отказано. Указанные цены представляют собой «стандартные цены», которые объединяют информацию по всем планам медицинского обслуживания и контрактам с поставщиками услуг. Хотя они и не являются точной мерой уплаченных сумм, они должны обеспечивать разумную косвенную меру для сравнений с течением времени. Эти разрешенные суммы платежей, однако, не отражают скидки, предлагаемые производителями GH менеджерам по льготам в аптеках за предоставление своим продуктам статуса льготных условий по формуле, и, вероятно, завышают размер взноса страховщика.Также отсутствуют данные о купонах и других субсидиях, предоставляемых производителями программ помощи пациентам, и данные о пациентах, которые полностью оплачивают лечение GH из своего кармана или покрываются планами страхования правительства штата или федерального правительства. База данных OptumInsight включает жизни, охваченные коммерческими поставщиками с контрактами Medicare (, например, , участники Medicare Advantage), но не включает жизни, охваченные управляемым медицинским обслуживанием Medicaid. Поскольку участникам программы Medicare Advantage более 65 лет, включение этого покрытия не оказывает существенного влияния на наш анализ.
Кроме того, хотя этот план исследования позволял собирать финансовые затраты, скрытые затраты — для всех заинтересованных сторон — были недоступны для анализа. В исследовании была проведена количественная оценка смены бренда на уровне группы, но не отражено их влияние на семьи пациентов [5]. Поскольку разные бренды GH поставляются в разных устройствах для инъекций, для смены бренда в соответствии с требованиями страховки в течение многих лет, когда пациент лечится с GH, требуется переподготовка по правильному введению (, то есть , более сложно, чем просто переключиться с одной таблетки на другую).Скрытые расходы также несут страховые компании, которые несут бремя заработной платы, а также время и обучение персонала для проверки постоянно растущего числа форм предварительной авторизации и апелляций об отказе, а также для вынесения и написания решений. В этих анализах полностью отсутствуют скрытые затраты и профессиональное влияние на педиатрическую эндокринную практику. Невозмещенное время и усилия с годами росли, начиная с обращений по страхованию и частой подачи форм, переписывая рецепты при каждом изменении формуляра, обучая семьи пациентов работе с новыми устройствами при каждой смене бренда, а также успокаивая семьи пациентов и отвечая на их вопросы, когда они обеспокоены. их новые продукты или возможные перерывы в лечении [5].Растущее невозмещаемое бюрократическое бремя эндокринологической практики усугубляется утратой автономии принятия решений пациентом и врачом, что в совокупности способствует высокому уровню выгорания врачей [17]. Усиление выгорания врачей само по себе может отрицательно сказаться на качестве ухода за пациентами [18].
В заключение, в то время как употребление наркотиков GH молодежью США, похоже, увеличилось за последние 15 лет, рост не был таким высоким, как мы могли бы подумать; ни одобрение FDA лечения ISS, ни введение биосимиляров не привели к значительному увеличению (последнее просто привело к смене бренда).Тем не менее, использование GH увеличилось, несмотря на возрастающие страховые барьеры и нагрузку на врачей. Общие расходы на ГР на душу населения снизились, но эти выгоды в основном достались страховщикам, которые также не несут нематериального бремени, которое ложится на клиницистов и пациентов. Кроме того, пациенты несут растущее финансовое бремя из-за GH, как в долевом отношении, так и в долларовом выражении. Эти закономерности согласуются с более широкими тенденциями в США к увеличению доли пациентов в расходах и агрессивному использованию формуляров и ограничений по страховому покрытию, чтобы ограничить воздействие на страховщика высоких цен на специальные лекарства.Эти тенденции, возможно, наиболее наглядно проиллюстрированы инсулином, растущие расходы на который пациенты в Соединенных Штатах недавно стали важной проблемой здравоохранения [19], вызвав слушания в Конгрессе и пересмотр законодательства.
Благодарности
Мы благодарим Центр данных исследований служб здравоохранения Института Леонарда Дэвиса за предоставление доступа к базе данных OptumInsight. Это исследование было вдохновлено Саммитом по дефициту GH, созванным Эндокринным обществом в Вашингтоне, округ Колумбия, 1 августа 2017 года.
Финансовая поддержка: A.G. была поддержана премией фонда повышения квалификации педиатров от детской больницы Филадельфии.
Дополнительная информация
Сводка раскрытия информации: A.G. входит в состав Руководящего комитета базы данных Pfizer International Growth Study (KIGS).
Доступность данных: На доступность данных, сгенерированных или проанализированных в ходе этого исследования, действуют ограничения для сохранения конфиденциальности пациента или потому, что они использовались по лицензии.Соответствующий автор по запросу подробно расскажет об ограничениях и любых условиях, при которых может быть предоставлен доступ к некоторым данным.
Сокращения:
FDA
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
GH
ISS
Сокращения:
Ссылки и примечания
1.Lindsay
R
,Feldkamp
M
,Harris
D
,Robertson
J
,Rallison
M
.Utah Growth Study: стандарты роста и распространенность дефицита гормона роста
.J Педиатр
.1994
;125
(1
):29
—35
. 2.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
. .3.Бюро переписи населения США
. .4.Grimberg
A
,Allen
DB
.Лечение гормоном роста дефицита гормона роста и идиопатического невысокого роста: новые рекомендации, сформированные с учетом наличия и отсутствия доказательств
.Curr Opin Pediatr
.2017
;29
(4
):466
—471
. 5.Grimberg
A
,Feudtner
C
,Gordon
CM
.Последствия смены бренда во время курса лечения детским гормоном роста
.Endocr Pract
.2012
;18
(3
):307
—316
.6.Grimberg
A
,DiVall
SA
,Полихронакос
C
,Allen
DB
,Cohen
LE
,WC
WC
000 J QuintosFeudtner
C
,Murad
MH
;Комитет по лекарствам и терапии и Комитет по этике Общества педиатрических эндокринологов
.Рекомендации по лечению гормоном роста и инсулиноподобным фактором роста-I у детей и подростков: дефицит гормона роста, идиопатический низкий рост и дефицит первичного инсулиноподобного фактора роста-I
.Horm Res Paediatr
.2016
;86
(6
):361
—397
. 8.Министерство труда США
;Бюро статистики труда
. .9.Grimberg
A
,Stewart
E
,Wajnrajch
MP
.Пол педиатрических реципиентов рекомбинантного гормона роста человека в США и во всем мире
.Дж. Клин Эндокринол Метаб
.2008
;93
(6
):2050
—2056
.10.Grimberg
A
,Huerta-Saenz
L
,Grundmeier
R
,Ramos
MJ
,Pati
S
0005,Cu0002 S
0002,Cu0002
.Гендерная предвзятость при лечении детей гормоном роста в США
.Научный сотрудник
.2015
;5
(1
):11099
. 11.августа
GP
,Lippe
BM
,Blethen
SL
,Rosenfeld
RG
,Seelig
SA
,0005Frane
JW
,McClellan
BH
,Sherman
BM
.Лечение гормоном роста в США: демографические и диагностические особенности 2331 ребенка
.J Педиатр
.1990
;116
(6
):899
—903
. 12.Grimberg
A
,Lindberg
A
,Wajnrajch
M
,Cucchiara
AJ
,Camacho-Hübner
C
C
C
Расовые / этнические различия в лечении детей гормоном роста в США
.Horm Res Paediatr
.2018
;90
(2
):102
—108
. 13.Фонд семьи Генри Дж. Кайзера
. .14.Baicker
K
,Goldman
D
.Распределение затрат пациентов и рост расходов на здравоохранение
.Дж. Экон Перспектива
.2011
;25
(2
):47
—68
. 15.Камеры
JD
,Kim
DD
,Pope
EF
,Graff
JS
,Wilkinson
CL
,0002 NeumannПокрытие специальных лекарств варьируется в зависимости от коммерческих планов медицинского страхования в США
.Филиал Здоровья (Миллвуд)
.2018
;37
(7
):1041
—1047
. 16.Mullins
CD
,Lavallee
DC
,Pradel
FG
,DeVries
AR
,Caputo
N
.Стратегии медицинского страхования для управления специализированными фармацевтическими препаратами в амбулаторных условиях
.Филиал Здоровья (Миллвуд)
.2006
;25
(5
):1332
—1339
. 17.Гришем
S
.Отчет эндокринолога Medscape об образе жизни 2018: личное счастье vs рабочее выгорание
.Medscape
. .18.Scheepers
RA
,Boerebach
BC
,Arah
OA
,Heineman
MJ
,Lombarts
KM
.Систематический обзор влияния профессионального благополучия врачей на качество ухода за пациентами
.Int J Behav Med
.2015
;22
(6
):683
—698
. 19.Herkert
D
,Vijayakumar
P
,Luo
J
,Schwartz
JI
,Rabin
TL
,000
DeFilipsНедостаточное использование инсулина, связанное с затратами, пациентами с диабетом
.JAMA Intern Med
.2019
;179
(1
):112
—114
.Авторские права © 2019 Эндокринное общество
Войти | регистр- Дом
- О JMCP
- Заявление о миссии
- Редакция
- Редакционно-консультативный совет
- Функции примечаний и комментариев
- Премия JMCP за выдающиеся достижения
- Импакт-фактор
- Медиацентр
- Проблемы
- Авторы / рецензенты
- Редакционная политика и свидетельство автора
- Правила для авторов
- Отправить рукопись
- Контрольный список для подачи рукописей
- Контрольный список для подачи дополнений
- Зарегистрируйтесь, чтобы стать рецензентом
- Призыв плакатов
- Express EPub впереди печати
- Разрешения
- Подписаться
- Объявление
- AMCP
- © 2021 JMCP
- Заявление об отказе от ответственности на веб-сайте
- Авторские права
- Политика конфиденциальности
- Интернет ISSN 2376-1032
- Печатный ISSN 2376-0540
Дефицит гормона роста — NORD (Национальная организация по редким заболеваниям)
Врожденный GHD возникает в результате генетической ошибки и может быть связан с дефектами структуры мозга или дефектами средней линии лица, такими как волчья пасть или единственный центральный резец.
Было идентифицировано несколько генетических дефектов:
Дефицит гормона роста IA является аутосомно-рецессивным и характеризуется задержкой роста в утробе матери. Больные дети малы по сравнению со своими братьями и сестрами. Младенец обычно сначала имеет нормальную реакцию на введение гормона роста человека (hGH), но затем вырабатывает антитела к гормону и превращается в очень маленького взрослого человека.
Дефицит гормона роста IB также является аутосомно-рецессивным и аналогичен IA.Тем не менее, при рождении у ребенка присутствует некоторое количество гормона роста (GH), и обычно ребенок продолжает реагировать на лечение hGH.
Дефицит гормона роста IIB и III аналогичны IB, но IIB является аутосомно-доминантным, а III является X-сцепленным.
Классические генетические заболевания являются продуктом взаимодействия двух генов, одного от отца, а другого от матери.
Доминирующие генетические нарушения возникают, когда для того, чтобы вызвать конкретное заболевание, необходима только одна копия аномального гена.Аномальный ген может быть унаследован от любого из родителей или может быть результатом новой мутации (изменения гена) у пораженного человека. Риск передачи аномального гена от пораженного родителя к потомству составляет 50% для каждой беременности. Риск одинаков для мужчин и женщин.
Рецессивные генетические нарушения возникают, когда человек наследует две копии аномального гена одного и того же признака, по одной от каждого родителя. Если человек получает один нормальный ген и один ген заболевания, он будет носителем болезни, но обычно не проявляет симптомов.Риск для двух родителей-носителей передать дефектный ген и иметь больного ребенка составляет 25% при каждой беременности. Риск иметь ребенка, который будет носителем, как и родители, составляет 50% при каждой беременности.
Вероятность того, что ребенок получит нормальные гены от обоих родителей и будет генетически нормальным по этому конкретному признаку, составляет 25%. Риск одинаков для мужчин и женщин.
Близкие родственники (кровные родственники) имеют более высокий шанс, чем неродственные родители, иметь один и тот же аномальный ген, что увеличивает риск рождения детей с рецессивным генетическим заболеванием.
Х-сцепленные генетические нарушения — это состояния, вызванные аномальным геном на Х-хромосоме и проявляющиеся в основном у мужчин. Самки, у которых есть дефектный ген на одной из их Х-хромосом, являются носителями этого заболевания. Самки-носители обычно не проявляют симптомов, потому что самки имеют две Х-хромосомы и только одна несет дефектный ген. У мужчин есть одна Х-хромосома, унаследованная от их матери, и если мужчина унаследует Х-хромосому, содержащую дефектный ген, у него разовьется болезнь.
Женщины-носительницы Х-сцепленного расстройства имеют 25% шанс при каждой беременности иметь дочь-носителя, как они сами, вероятность 25% иметь дочь, не являющуюся носителем, вероятность 25% иметь сына, пораженного этим заболеванием. и 25% шанс иметь здорового сына.
Если мужчина с Х-сцепленными нарушениями способен к воспроизводству, он передаст дефектный ген всем своим дочерям, которые будут носителями. Мужчина не может передать Х-сцепленный ген своим сыновьям, потому что мужчины всегда передают свою Y-хромосому вместо своей Х-хромосомы мужскому потомству.
Приобретенный GHD может возникать в результате множества различных причин, включая травму головного мозга (перинатальную или послеродовую), инфекцию центральной нервной системы, опухоли гипоталамуса или гипофиза (аденома гипофиза, краниофарингиома, киста расщелины Ратке, глиома, герминома, метастазы), лучевая терапия, инфильтративные заболевания (гистиоцитоз из клеток Лангерганса, саркоидоз, туберкулез) или, если нет другого диагноза, это считается идиопатическим.
Цыплята не получают гормоны роста: так к чему все такое непонимание?
Природные гормоны, такие как эстроген, прогестерон и тестостерон, необходимы для различных физиологических процессов у людей и животных.На протяжении всей истории эти естественные гормоны проникали в окружающую среду, создавая риск заражения.
Всемирная организация здравоохранения (ВОЗ) определила определенные загрязнители окружающей среды как глобальную проблему. Эти загрязнители способны нанести вред воспроизводству и развитию, изменяя эндокринные функции у людей и диких животных. По мере роста численности населения и увеличения концентрации животноводства количество и концентрация гормонов в местных районах увеличивается.
В результате многие из нас, работающих в птицеводстве, все чаще слышат один и тот же вопрос: «Почему вы добавляете в корм гормоны, чтобы цыплята вырастали такими большими и быстрыми?» Тот факт, что вопрос начинается с «почему» вместо «делать», указывает на уровень замешательства и непонимания потребляющей публики. На самом деле гормоны не используются в птицеводстве более 50 лет. Использование гормонов в птицеводстве было запрещено в США в 1950-х годах.
* «Правда в том, что в птицеводстве гормоны не используются» |
Почему неразбериха?
Некоторая путаница и недоразумения могут быть связаны с тем фактом, что птицеводство и мясное скотоводство работают по разным правилам.Хотя использование гормона роста запрещено в птицеводстве, это совершенно законная и общепринятая практика в мясном скотоводстве.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) впервые одобрило гормоны роста для увеличения роста, эффективности корма и похудания мясного скота в 1956 году. В настоящее время есть пять гормонов (прогестерон, тестостерон, эстроген, зеранол и тренболона ацетат), одобренных для роста имплантаты для крупного рогатого скота (Archibeque et al., 2007). Тренболона ацетат и зеранол являются синтетическими гормонами, и Служба инспекции безопасности пищевых продуктов Министерства сельского хозяйства США регулярно отслеживает остатки этих продуктов, чтобы гарантировать безопасность поставок говядины.
Прогестерон, тестостерон и эстроген являются естественными гормонами как у людей, так и у животных. Эти гормоны необходимы для нормального развития, роста и размножения. Кроме того, люди могут принимать стероидные гормоны как часть заместительной гормональной терапии и в виде противозачаточных таблеток. Из этих гормонов в настоящее время наибольшее внимание уделяется эстрогену. Эстроген естественным образом встречается как у мужчин, так и у женщин и играет роль в половом развитии, воспроизводстве и поведении (Swyers, 2011).Федеральный регулирующий мониторинг эстрогена, прогестерона и тестостерона невозможен, поскольку невозможно отличить гормоны, используемые для лечения, от гормонов, вырабатываемых организмом естественным путем.
В отличие от домашней птицы (которая не получает дополнительных гормонов роста), большинство крупного рогатого скота, выращиваемого в Соединенных Штатах, действительно получают имплантат гормона, стимулирующего рост, обычно при попадании на откормочную площадку. Эти имплантаты обычно вводят мясному скоту в виде гранул, которые хирургическим путем имплантируют под кожу на задней части уха животного.(Ухо используется, потому что уши не попадают в пищу.) В течение периода от 100 до 120 дней имплант медленно растворяется и высвобождает гормон.
Эти имплантаты важны для мясного скотоводства, поскольку животные проводят от 100 до 200 дней на откорме. Признанные преимущества имплантатов включают сокращение количества дней кормления, улучшение выхода туш, повышение эффективности процесса кормления крупного рогатого скота и сохранение низких цен на говядину для потребителей. Однако ростовые имплантаты можно использовать только у мясного скота.Стероидные гормоны, одобренные для выращивания домашней птицы, молочного скота, телят или свиней, не одобрены.
Авторы несколько раз упоминали гормональные имплантаты роста, но не обсуждали кормление животных гормонами. Для этого есть причина. Независимо от того, что вы читали или что вам сказали, гормоны роста, добавленные в корм для кур, не будут эффективны. Это одна из многих причин, по которым цыплята не получают гормоны, и еще один возможный источник путаницы.
Гормоны существуют в двух различных химических формах: они могут быть стероидами или белками.Стероидные гормоны активны в организме при пероральном приеме. Например, противозачаточные таблетки — это стероидные гормоны, которые можно принимать перорально, и они остаются эффективными даже после прохождения через пищеварительный тракт. Однако белковые гормоны расщепляются в желудке и интенсивно метаболизируются после выхода из кишечника; они теряют способность действовать в организме при проглатывании. Поэтому для воздействия на организм необходимо вводить белковые гормоны. Вот почему большая часть крупного рогатого скота на откормочных площадках получает гормон роста в виде гранул, вводимых под кожу уха, а не в качестве добавки к корму.
Гормоны роста — это белки, похожие на инсулин, используемый для лечения диабета. Людям с диабетом хорошо известно, что не существует пероральной формы инсулина, которую можно было бы принимать, чтобы избежать всех этих инъекций инсулина. Инсулин, принимаемый перорально, расщепляется в пищеварительном тракте, как и любой другой белок, и не будет эффективным. Если бы протеиновые гормоны роста давали цыплятам перорально с кормом, они бы расщеплялись в пищеварительном тракте и становились неэффективными.
Следовательно, как и инсулин для человека, гормоны роста, вводимые цыплятам, должны быть инъекционными, чтобы быть эффективными. И что еще больше усложняет ситуацию, исследования показывают, что для успешного введения цыплятам необходимо будет делать инъекции гормона роста несколько раз в день (Czarick and Fairchild, 2012). Это мероприятие невозможно с точки зрения логистики. Большинство производителей бройлеров содержат по 20 000 и более цыплят в каждом птичнике и во многих птичниках на ферме. Невозможно поймать каждого цыпленка в каждом птичнике несколько раз в день и сделать ему гормональную инъекцию.Кроме того, современные бройлеры были генетически отобраны племенными компаниями, чтобы вырасти до своего физиологического предела. Дело в том, что цыплята растут так быстро, как должны, без использования гормонов роста. Кроме того, использование гормонов для слишком быстрого роста цыплят может вызвать проблемы с ногами и даже преждевременную смерть.
Причины быстрого роста
Существует три основных причины быстрого роста, которые мы наблюдаем у современного коммерческого птицеводства, но ни одна из них не связана с гормонами.
Первое, о чем упоминалось ранее, — это успех первичных племенных компаний в выборе лучших птиц по росту и продуктивности. За последние несколько десятилетий генетикам удавалось примерно на один день в год сокращать время, необходимое для достижения заданного целевого веса. Они извлекли выгоду из короткого интервала между поколениями (продолжительности жизни) курицы, что позволило им добиться огромных успехов за короткий период времени. Генетическое улучшение в производстве свинины и говядины происходит намного медленнее из-за увеличения интервала между поколениями и времени, необходимого для распознавания генетической изменчивости и улучшения.
Второе — это исследование, связанное с потребностями птицы в питании. Теперь мы точно знаем, чем нам следует кормить различные генетические породы, и птицы содержатся с определенным целевым весом с точки зрения энергии, белка, витаминов и минералов для оптимизации производительности и роста.
В-третьих, мы лучше понимаем, в какой среде обитает птица, чтобы максимально использовать ее генетический и пищевой потенциал. Это включает обеспечение надлежащей температуры, качества воздуха, вентиляции, освещения, а также помещения для кормления и поилки для достижения оптимальной производительности.Правильная среда в сочетании с высококачественным кормом и превосходной генетикой дает птицу, которая не требует гормонов роста и не получает от них никакой пользы.
Повышение осведомленности о гормонах
Гормоны — это естественные химические сообщения, которые выделяются в кровоток органами, вырабатывающими гормоны, в телах всех животных, включая человека. Это означает, что люди, куры и другие животные всегда имеют в организме естественные гормоны. В результате стероидные гормоны, вырабатываемые людьми и животными, постоянно выводятся в окружающую среду в своих активных формах.
Среди широкой общественности растет интерес и осведомленность об уровнях гормонов в окружающей среде и в еде, которую мы едим. Хотя природные стероидные гормоны всегда присутствовали в окружающей среде, они вызывают растущую озабоченность у многих людей. Увеличение численности населения и интенсивное животноводство, необходимое для прокормления населения, могут привести к концентрированному выбросу гормонов.
Сегодня остатки гормонов в мясе часто являются первой проблемой для потребителей в Европе и США (Sundlof, 1994).Отчасти это связано с тем, что синтетические стероидные гормоны, используемые в качестве фармацевтических препаратов, влияют на риск рака. Например, синтетический эстроген, используемый в 1960-х годах, диэтилстильбестрол, был изъят из употребления после того, как было обнаружено, что он увеличивает риск рака влагалища у дочерей лечившихся женщин (Gandhi and Snedeker, 2000).
Дополнительная путаница в отношении гормонов проистекает из того факта, что в течение многих лет люди не осознавали, что стероидные гормоны могут быть получены из растений. Они думали, что это воздействие происходило только из пищи животного происхождения.Однако многие растения, важные для питания человека, содержат фитоэстрогены. Фитоэстрогены — это эстрогенные соединения, содержащиеся в растениях, включая фрукты, овощи, бобы, горох и злаки (Swyers, 2011). А некоторые продукты содержат гормонально активные вещества в концентрациях, превышающих их содержание в мясе.
Фактически, Hartmann et al. 1998) сообщил, что мясо не играет доминирующей роли в ежедневном потреблении стероидных гормонов. Эти исследователи указали, что основным источником эстрогенов и прогестерона являются молочные продукты (60–80 процентов).Вклад в поставку гормонов яиц и овощных продуктов был того же порядка, что и мясо, мясные продукты и рыба. Однако Handa et al. (2010) пришли к выводу, что потребление эстрогена в результате ежедневного потребления мяса нельзя игнорировать как фактор, определяющий здоровье человека.
Среди диетических факторов риска Ganmaa и Sato (2005) сообщили, что их больше всего беспокоило молоко и молочные продукты, потому что сегодня молоко производится от беременных коров, у которых уровни эстрогена и прогестерона заметно повышены.Напротив, Parodi (2012) сообщил, что при приеме внутрь только от двух до пяти процентов биоактивной формы эстрогена выживает при метаболизме в слизистой оболочке кишечника и при первом прохождении через печень. Hartmann et al. (1998) указали, что эффект первого прохождения через печень инактивирует около 90 процентов проглоченных гормонов. Хотя гормональные риски продолжают обсуждаться и исследоваться по нескольким направлениям, окончательные ответы в настоящее время получить трудно, а противоречивые отчеты продолжают вносить путаницу среди потребителей.
Понимание проблемы осложняется тем фактом, что естественное производство стероидов человеком намного превышает суточное потребление гормонов растительной или животной пищей. В таблице 1 приведена суточная выработка естественных гормонов человека в зависимости от их количества в противозачаточных таблетках и некоторых других продуктах питания. Продукция эстрогена указывается в нанограммах. Нанограмм равен одной миллиардной грамма (0,000000001), что сопоставимо с одной травинкой на футбольном поле (NCBA, 2007). Дети производят примерно в 20 раз больше прогестерона и примерно в 1000 раз больше тестостерона и эстрогенов, чем они потребляют с пищей в среднем за день; а у детей самый низкий уровень продукции стероидов среди всех людей (Hartmann et al., 1998).
Данные по гормонам у кур ограничены, поскольку цыплята не получают добавки с гормоном роста. Поэтому, в отличие от мясного скотоводства, у цыплят не существует синтетических гормонов, которые можно было бы проверить. Однако, как упоминалось ранее, у кур и всех других животных есть естественные уровни эстрогена, прогестерона и тестостерона. Handa et al. (2010) сообщили об уровнях эстрогена в образцах куриного жира в США и Японии (Таблица 1). Данные для куриного жира были представлены потому, что уровни эстрогена в жире, как правило, были выше, чем в мясе (Handa et al., 2010).
Таблица 1. Суточная выработка эндогенного (естественного) эстрогена по отношению к количеству в противозачаточных таблетках и некоторых других продуктах питания
Источники включают Anonymous, 2010; Аноним, 2011; Handa et al., 2010; NCBA, 2007; Swyers, 2011. Полный список цитат см. В разделе «Ссылки».
Есть основания для беспокойства относительно воздействия гормонов, попадающих в окружающую среду или выбрасываемых в окружающую среду. По мере роста населения и увеличения животноводства для удовлетворения растущего спроса на продовольствие защита окружающей среды становится еще более важной.Кроме того, следует продолжить исследования ежедневных уровней потребления гормонов как растений, так и животных, чтобы отслеживать их влияние на здоровье и благополучие человека. Однако очень важно помнить, что ежедневно люди вырабатывают гораздо больше гормонов, чем потребляют с пищей.
Разоблачение мифов
И люди, и животные выделяют гормоны, которые могут попасть в окружающую среду. Усердие в программах управления питательными веществами для сельскохозяйственных предприятий является необходимостью, и мы должны продолжать внимательно следить за их воздействием на окружающую среду.Кроме того, птицеводство должно лучше предоставлять потребителям фактическую информацию, чтобы бороться с путаницей, мифами и неточной информацией, которая стала настолько распространенной в отношении использования гормонов и производства кур. Правда в том, что в птицеводстве гормоны не используются. И хотя правда говорит сама за себя, птицеводство должно громко заявить о себе, если мы ожидаем, что сообщение будет услышано.
Список литературы
Archibeque, S.L., T. Borch, T.E. Энгл, Дж. Дж. Вагнер и Х.Хан. 2007. Остатки эндокринных разрушителей в потоках откормочных площадок и молочных отходов. В: Proc. 68-й Миннесотский Nutr. Конф. 94-108.
Аноним. 2010. Противозачаточные таблетки, пластырь или кольцо. По состоянию на 4 января 2013 г.
Аноним. 2011. Факты о стимуляторах роста. По состоянию на 4 января 2013 г.
Czarick, M. and B. Fairchild. 2012. Семь причин, по которым цыплят НЕ кормят гормонами. Советы по содержанию птицы 24 (4): 1-4.
Ганди, Р. и С.М. Снедекер. 2000. Беспокойство потребителей о гормонах в пище.Информационный бюллетень № 37. Кооперативное расширение Корнелла. Программа Корнельского университета по раку груди и факторам риска окружающей среды в штате Нью-Йорк.
Ганмаа, Д. и А. Сато. 2005. Возможная роль женских половых гормонов в молоке от беременных коров в развитии рака груди, яичников и тела матки. Med. Гипотезы 65 (6): 1028-37.
Ханда, Ю., Х. Фудзита, Ю. Ватанабэ, С. Хонма, М. Канеучи, Х. Минаками и Р. Киши. 2010. Связано ли потребление эстрогена с пищей с мясом с частотой гормонозависимого рака? Дж.Clin. Онколо. 28:15 с. 2010 г. (доп .; абстракция 1553).
Хартманн, С., М. Лакорн и Х. Стейнхарт. 1998. Естественное присутствие стероидных гормонов в пище. Food Chem. 62 (1): 7-20.
NCBA. Национальная ассоциация животноводов по говядине. 2007. Информационный бюллетень: Использование стимуляторов роста в животноводстве. По состоянию на 4 января 2013 г.
Parodi, P.W. 2012. Влияние эстрогена коровьего молока на риск рака. Int. Молочный J. 22 (1): 3-14.
Sundlof, S.F. 1994. Риски для здоровья человека, связанные с остатками лекарств в продуктах животного происхождения.Ж. Агромедицина 1: 5-20.
Swyers, K. 2011. Фитоэстрогены. Лист сведений. Кормление на ранчо. Форт-Коллинз, Колорадо
Апрель 2013 г.
MAGIC Foundation
Гормон роста (GH) — это белок, вырабатываемый гипофизом и выпускаемый в кровь короткими импульсами. Основной способ, которым GH способствует росту, — это повышение уровня гормона, янсулиноподобный фактор роста-1 (IGF-1) и его белок-носитель, IGF-связывающий белок-3 (IGFBP-3) в крови.GH и IGF-1 работают вместе с хрящевыми клетками пластинки роста в длинных костях, увеличивая длину кости, что приводит к увеличению высоты.
Дефицит гормона роста (GHD) у детей определяется как нарушение роста, связанное с недостаточной выработкой гормона роста. Нарушение роста следует оценивать у детей, длина или рост которых остается ниже нормального диапазона (т. Е. <3 rd процентилей) или у которых процентиль длины или роста падает и с течением времени пересекает основные процентильные ориентиры.Прежде чем рассматривать дефицит гормона роста в качестве возможного диагноза, необходимо обследовать ребенка с задержкой роста на предмет более распространенных состояний, которые могут повлиять на рост. Нарушение роста может возникать у детей с воспалениями (рецидивирующие заболевания, артрит, воспалительные заболевания кишечника и т. Д.), Плохим питанием (недостаточное потребление или нарушения всасывания, такие как целиакия, муковисцидоз и т. Д.), Другими хроническими состояниями (психосоциальный низкий рост. , хроническая почечная недостаточность, заболевания печени, гипотиреоз и др.) и генетические условия, влияющие на рост (скелетная дисплазия, семейный невысокий рост, синдром Рассела-Сильвера, синдром Тернера и т. д.). Дети, получающие терапию стимуляторами при дефиците внимания и гиперактивности, могут иметь нарушение роста, особенно если существенно снижается потребление калорий. Однако терапия стимуляторами не вызывает GHD. Хроническая терапия глюкокортикоидами (ингаляционная или пероральная) может вызвать значительную задержку роста. У детей с конституциональной задержкой роста и полового созревания («поздно цветущие») может наблюдаться задержка роста, которую трудно отделить от GHD.
ТестированиеСкрининговые тесты на GHD у детей с задержкой роста без установленной причины включают рентгенографию костного возраста и уровни IGF-1 и IGFBP-3 в сыворотке. Отсроченный костный возраст чаще встречается у детей с GHD. IGF-1 в нижней части нормального диапазона или ниже нормы увеличивает вероятность GHD. МРТ-изображение головного мозга, показывающее небольшой или внематочный (смещенный) гипофиз, подтверждает диагноз GHD. Золотым стандартом диагностики GHD является отсутствие повышения уровня GH в тесте на стимуляцию гормона роста (GHST).GHST проводится у детей после ночного голодания путем приема лекарств или медикаментов (таких как инсулин, клонидин, аргинин, глюкагон, L-допа и т. Д.), Чтобы вызвать выброс гормона роста в кровь и частое взятие крови. Если наивысший уровень гормона роста, полученный после двух отдельных стимулов, составляет менее 10 нг / мл, это является диагностическим признаком GHD. Однако GHST не требуется для диагностики GHD, если присутствуют другие клинические параметры. Изолированный врожденный GHD может быть связан с низким уровнем сахара в крови у младенцев и маленьким пенисом у младенцев мужского пола.Врожденный GHD также может быть связан с множественными другими недостатками гипофиза у младенцев и увеличивается у детей с гипоплазией зрительного нерва и дефектами средней линии, включая волчью пасть.
Диагностика и лечениеДети с диагнозом GHD получают пользу от заместительной терапии GH с улучшенным линейным ростом до слияния пластинок роста. rhGH терапия проводится путем ежедневных подкожных инъекций. Дети и их семьи
учат самостоятельно вводить rhGH в домашних условиях.Начальная доза rhGH зависит от веса ребенка и может корректироваться во время терапии в зависимости от прибавки в весе, реакции роста и уровней IGF-1. Дети, получающие терапию rhGH, должны посещаться детским эндокринологом каждые 3–6 месяцев для контроля роста и корректировки дозы rhGH. Чем раньше ребенку будет поставлен диагноз GHD, тем лучше будет достигнут окончательный рост и тем выше вероятность того, что ребенок достигнет нормального для взрослого роста. Некоторым детям с тяжелым GHD потребуется терапия rhGH как взрослым из-за метаболических эффектов GH.
Как гормон роста влияет на организм, кроме ростаПомимо роста, гормон роста регулирует обмен веществ. По мере потребления калорий гормон роста контролирует, используются ли эти калории для наращивания костей, мышц и хрящей или откладываются в виде жира. Между приемами пищи гормон роста регулирует мобилизацию жира для использования в качестве энергии. Дефицит гормона роста — это состояние, которое включает в себя нарушение линейного роста и значительные метаболические различия, включая изменения в составе тела (снижение костной массы, уменьшение мышечной массы и увеличение висцерального ожирения) и липидном профиле (повышение холестерина ЛПНП и триглицеридов).У детей с дефицитом гормона роста заместительная терапия гормоном роста важна для нормализации метаболизма и максимизации этих метаболических преимуществ. Если ребенок преждевременно прекратит прием гормона роста, он / она не сможет получить преимущества максимального накопления минеральных веществ в костях и безжировой массы тела во время пубертатного скачка роста и будет иметь повышенное висцеральное ожирение и аномальный липидный профиль; это может иметь долгосрочное негативное влияние на здоровье его / ее костей и сердечно-сосудистой системы.
Специалист по оказанию медицинской помощи
Брэдли С.Миллер, доктор медицины, доктор философии
Профессор
Детская эндокринология
Масонская детская больница Университета Миннесоты
Миннеаполис, Миннесота
Член Медицинского консультативного комитета
The MAGIC Foundation
Если вы взяли в руки эту брошюру, вполне вероятно, что вас беспокоит физический рост кого-то из близких вам людей.Физический рост часто является признаком общего состояния здоровья ребенка. Учитывая, что рост во многом связан со здоровьем, важно, чтобы дети, которые не растут со средней скоростью, были оценены медицинским персоналом (1). Для детей, которые очень малорослые по сравнению со своими сверстниками, жизненно важна оценка роста и возможных проблем со здоровьем.
К сожалению, мы мало знаем о психосоциальном воздействии низкого роста на детей и подростков, потому что было проведено мало исследований.Мы знаем, что низкий рост может подвергать детей риску издевательств, социальной незрелости и низкой самооценки (2). Исследователи обнаружили, что дети с хроническими заболеваниями / ограниченными возможностями подвержены более высокому риску школьных трудностей, беспокойства и депрессии (3, 4, 5). Дети с задержкой роста часто имеют связанные заболевания, повышающие их риск возникновения социальных, эмоциональных и академических проблем.
Однако помните, что только то, что у ребенка задержка роста, не означает, что он будет испытывать эмоциональные или психосоциальные проблемы.Многие дети с задержкой роста, кажется, быстро принимают свой низкий рост и проходят этапы развития в пределах ожидаемого возрастного диапазона. Однако важно, чтобы воспитатели, врачи и педагоги контролировали психологическое, эмоциональное и физическое благополучие детей с задержкой роста.
Низкий рост и социально-эмоциональное развитиеС детьми, у которых наблюдается задержка роста, могут обращаться с ними сверстники, воспитатели, педагоги и другие лица моложе их хронологического возраста.К сожалению, люди часто судят других по внешнему виду. Люди делают предположения, основываясь на том, как люди выглядят, какого они роста и даже того, сколько они весят. Для многих детей с задержкой роста рост ассоциируется с возрастом. Когда дети намного ниже своих сверстников, может произойти несколько вещей. Взрослые и сверстники относятся к ребенку как к младшему, что может мешать психосоциальному развитию. Когда поведенческие и академические ожидания занижаются в зависимости от роста, а не хронологического возраста, дети могут не усвоить соответствующие и ожидаемые поведения для ребенка их возраста.Дети часто ведут себя ожидаемым образом. Если с ребенком обращаются так, как будто он моложе своего хронологического возраста, ребенок, вероятно, будет вести себя так, как если бы он себя вел. Если эта модель будет продолжаться, ребенок, вероятно, будет отставать от своих сверстников в социальной, поведенческой и эмоциональной зрелости (6).
Проблемы и проблемы школыУ большинства родителей, независимо от роста их ребенка, возникают вопросы об академических способностях и успеваемости своего ребенка.У детей с задержкой роста, как и у детей с другими хроническими заболеваниями, наблюдаются различия в успеваемости и школьных проблемах, как и у населения в целом. Однако несколько исследователей указали, что дети с нарушениями роста, особенно с сопутствующими проблемами со здоровьем или инвалидностью, подвергаются повышенному риску академических трудностей и психосоциальных проблем (3, 4, 5, 7). Кроме того, дети, которые значительно ниже своих сверстников, могут стать легкой мишенью для издевательств.Родители и преподаватели играют огромную роль в выявлении возможных академических трудностей, включая проблемы с обучением, проблемы с вниманием и социальные / эмоциональные проблемы. Если у родителей есть какие-либо опасения по поводу академической успеваемости, интеллектуальных способностей, физического или эмоционального здоровья своего ребенка, социального / социального развития или доступа к поддержке и услугам, им следует поговорить со школьным консультантом, школьной медсестрой, учителем или администрацией своего ребенка. Школа несет ответственность за выявление детей с потребностями в обучении и должна принимать меры, если родители беспокоятся о своем ребенке.Школьные консультанты, учителя и другой персонал могут стать огромным источником поддержки для детей и их родителей. Если в школе обнаруживается, что дети испытывают трудности в учебе или поведении, их часто направляют на дальнейшую оценку школьного психолога или других специалистов для выявления проблем с обучением, поведенческими или эмоциональными проблемами.
Советы для родителей и опекуновДети часто реагируют на эмоции своих опекунов.Наличие ребенка с серьезным заболеванием может вызвать стресс и беспокойство у родителей, братьев и сестер и расширенной семьи (8, 9, 10, 11). Родители и опекуны должны убедиться, что они практикуют хороший уход за собой, в то же время обеспечивая медицинскую, медицинскую, социальную и эмоциональную поддержку своему пострадавшему ребенку, а также другим своим детям. Братья и сестры могут испытывать стресс, беспокоиться и беспокоиться или чувствовать, что им необходимо взять на себя дополнительные обязанности, чтобы облегчить стресс для своих родителей (11).Профессионалы рекомендуют родителям обращать внимание на эмоциональные реакции и здоровье своих братьев и сестер, поскольку они подвержены повышенному риску депрессии и тревоги (11). Дети с задержкой роста часто сталкиваются со многими медицинскими обследованиями и процедурами, которые могут быть пугающими и / или болезненными. Повторные госпитализации из-за тестов, болезней, медицинских процедур или осложнений хронического заболевания могут создать хаос и стресс для всей семьи (10). Дети, особенно маленькие дети, которые испытывают повторяющиеся факторы стресса или хаотичную среду (т.е. госпитализации, хирургические операции, повторные медицинские процедуры) могут иметь повышенный риск возникновения тревожности, депрессии и состояний, связанных со стрессом (12). Очень важно найти способы уменьшить стресс для всех членов семьи.
Создание благоприятной и заботливой среды при одновременном установлении и поддержании границ важно для всех детей. Если у ребенка хроническое заболевание или инвалидность, особое внимание следует уделять эмоциональному и психологическому здоровью (10, 13).Ниже приведены советы для родителей о том, как создать стабильную, заботливую и поддерживающую среду среди хаоса хронических заболеваний, медицинских обследований, госпитализаций и режима приема лекарств.
Создавайте и придерживайтесь распорядка как можно больше . Дети меньше подвержены стрессу, когда они находятся в предсказуемой среде с одинаковым временем приема пищи, времени купания, отхода ко сну и т. Д. Даже когда происходят какие-то медицинские потрясения, полезно стараться поддерживать распорядок в меру своих возможностей (10).Взрослые могут снизить уровень стресса, взяв с собой любимую книгу, сонную игрушку, подушку и т. Д. Кроме того, если у вас есть роскошь большой семьи или опекунов, это может помочь уменьшить беспокойство братьев и сестер, если дети смогут оставаться в собственном доме и в собственной постели, пока пострадавший ребенок находится в больнице или путешествует для лечения. Старайтесь сохранять одинаковый распорядок дня, даже когда речь идет о госпитализации, лечении или поездке.
Развивайте или поддерживайте чувство юмора. Юмор снижает напряжение и стресс. Юмор позволяет нам видеть забавные вещи, которые происходят, и может помочь нам смеяться над ситуациями, а не относиться к ним так, как будто они — конец света. Смех — хорошее лекарство. Иногда нам нужно научиться не воспринимать вещи так серьезно. Выбирайте битвы с умом и научитесь смеяться над нелепостями.
Обеспечьте благоприятную и безопасную среду, но не становитесь родителем вертолета. .Легко стать чрезмерно опекающим родителем, когда у вас есть ребенок, который болеет, может заболеть или легко получить травму. Обеспечьте поддержку и меры безопасности, разработайте план действий в чрезвычайных ситуациях, чтобы оставить его для няни и опекунов (даже для себя), и создайте запасной план. Тогда живите полной жизнью. Позвольте детям быть детьми и позвольте себе, как родителю, иметь время для отдыха, веселья и отдыха. Мы не можем предотвратить каждую болезнь, каждую болезнь, каждую ошибку или каждый несчастный случай. Если вы обернете ребенка пузырчатой пленкой, вы можете непреднамеренно снизить его самооценку и устойчивость.
Будьте твердыми и соблюдайте дисциплину и границы . Даже когда дети сталкиваются с проблемами, им нужна постоянная дисциплина и границы. Последовательные границы и правила помогают детям знать, чего ожидать (10, 13). Излишнее потакание детям, балование их и оправдание их поведения не поможет им развить соответствующее их возрасту поведение, которое так важно для установления и поддержания дружеских отношений. Умение оставаться в рамках границ помогает детям развить контроль над импульсами, научиться межличностным границам и уважению.
Научитесь распознавать типичные стихи нетипичного поведения . Когда вы воспитываете ребенка с хроническим заболеванием или инвалидностью, родители иногда очень внимательно следят за его поведением и развитием. Хотя это может быть полезно, оно также может заставить нас больше беспокоиться о том, является ли поведение нашего ребенка типичным или нет. Существуют отличные ресурсы, которые помогут вам понять, когда следует беспокоиться о поведении вашего ребенка в зависимости от уровня его развития (10, 13).Помните, что вам, возможно, придется «подстроиться» под возраст, если ваш ребенок родился преждевременно или провел свои первые несколько недель / месяцев в отделении интенсивной терапии.
Знайте, когда следует беспокоиться, и обращайтесь за помощью. В большинстве случаев дети с задержкой роста, их братья и сестры и их родители прекрасно себя чувствуют. Однако наличие ребенка с хроническим заболеванием создает дополнительные стрессовые факторы для всех в семье, и иногда членам семьи может потребоваться небольшая дополнительная помощь извне (9, 13).Ниже приведены несколько советов, когда следует обращаться за помощью.
Если пострадавший ребенок или братья и сестры:
· Испытывают необычно высокий уровень тревожности (9)
· Выглядит подавленным, чрезмерно грустным в течение длительного времени, кажется, не получает удовольствия от вещей, которые когда-то приносили удовольствие, уходит от друзей или занятий (9, 13)
· Кажется, что чувствует себя виноватым или чрезмерно ответственным за здоровье пострадавшего ребенка (9, 13)
· Действует, ненадлежащим образом привлекает к себе внимание или нарушает порядок (9)
· Угрожает причинить вред себе или другим
· Вступает в драку, бросает вещи или пытается причинить вред себе, другим или животным (9)
· Падение оценок или ребенок требует совершенства во всей школьной работе и / или деятельности (13)
· Терпит нервное расстройство, набрасывается на гнев или часто плачет из-за мелочей
· Употребляет алкоголь или наркотики
· Кажется, нужны навыки совладания или кто-то, с кем можно поговорить (9, 13)
· Другое поведение, которое сохраняется и кажется несвойственным вам, которое вас беспокоит
Консультанты, духовенство, школьные консультанты, педиатры и другие специалисты могут помочь вам найти помощь пострадавшему ребенку, братьям и сестрам и даже вам как попечителю.Помните, что эмоциональное и психологическое здоровье влияет на физическое здоровье. Продолжающийся стресс может быть вредным, поэтому обязательно обращайтесь за помощью при необходимости.
Родить ребенка с задержкой роста или нарушением роста может быть сложно физически и эмоционально (8, 10, 13). Родители и опекуны часто испытывают стресс (8, 10, 14). и хотят убедиться, что делают все возможное, чтобы обеспечить физическое и эмоциональное благополучие своего ребенка. Если у вас есть вопросы или опасения по поводу роста ребенка или того, как вы можете поддержать и воспитать ребенка с задержкой роста или расстройством, свяжитесь с MAGIC для получения информации, ресурсов и поддержки.
Список литературы1. FloridaHealthFinder.gov (2018). Энциклопедия здоровья. Замедленный рост . Проверено 28 января 2018 г. http://www.floridahealthfinder.gov/mobile/healthencyclopedia/health%20illustrated%20encyclopedia/1/003021.aspx
2. Коэн П., Рогол А.Д., Дил С.Л. и др. (2008) Консенсусное заявление по диагностике и лечению детей с идиопатическим низким ростом: Резюме Общества исследования гормона роста, Детского эндокринного общества Лоусона Уилкинса и Семинара Европейского общества детской эндокринологии.Журнал клинической эндокринологии и метаболизма, 93, 4210-4217. Получено 5 февраля 2018 г. с сайта http://dx.doi.org/10.1210/jc.2008-0509
.3. Пинкварт, М., Шен, Ю. (2011). Беспокойство у детей с хроническими заболеваниями: метаанализ. Acta Paediatrica: Воспитание ребенка, 100 (8), 1069-1076. DOI: 10.1111 / j.1651-2227.2011.02223.x
4. Пинкварт, М., Шен, Ю. (2011). Проблемы поведения у детей и подростков с хроническими соматическими заболеваниями: метаанализ. Журнал детской психологии, 36 (9), 1003-1016. DOI: 10.1093 / jpepsy / jsr042
5. Мартинес, Й.Дж. и Эрджикан, К. (2009). Хронические заболевания у канадских детей: как детские болезни влияют на успеваемость, тревогу и эмоциональные расстройства. Ребенок: уход, здоровье и развитие, 35 (3), 391-401. DOI: 10.1111 / j.1365-2214.2008.00916.x
6. Стейблер Б. Психосоциальные проблемы задержки роста детей. Фонд MAGIC для развития детей. Получено 28 октября 2017 г. с сайта https://www.magicfoundation.org/downloads/PsychosocialIssuesofGrowthDelayedChildren.pdf
.7. Пинкварт, М., Шен, Ю. (2011). Симптомы депрессии у детей и подростков с хроническими соматическими заболеваниями: обновленный метаанализ. Журнал детской психологии, 36 (4), 375-384. DOI: 10.1093 / jpepsy / jsq104
8. Холмс, А. И Деб П. (2003). Влияние хронических заболеваний на психологическое здоровье членов семьи. Журнал политики и экономики здоровья металлов, 6, 13-22.
9. Healthy Children.org (2015). Братья и сестры детей с хроническими заболеваниями. Получено 28 января 2018 г. с сайта http://www.healthychildren.org/English/health-issues/conditions/chroini/Pages/Siblings-of-Children-with-Chronic-Illities.aspx
.10. Мичиганская медицина. (2012). Ресурсы по развитию и поведению вашего ребенка: справочник по информации и поддержке для родителей. Дети с хроническими заболеваниями. Получено 28 января 2018 г. с сайта http://www.med.umich.edu/yourchild/topics/chronic.htm
.11. Шарп Д. и Росситер Л. (2002). Братья и сестры детей с хроническими заболеваниями: метаанализ. Журнал детской психологии , 27 (8), 699–710. https://doi.org/10.1093/jpepsy/27.8.699
12. Леруик, Дж. Л. (2013). Психосоциальные последствия детской хирургической госпитализации. Семинары по детской хирургии, 22 (3), 129-133.
13.Понимание детей и хронических заболеваний: защита эмоционального здоровья вашего ребенка (2008). Национальное еврейское здоровье. Проверено 28 января 2018 г. https://www.nationaljewish.org/NJH/media/pdf/pdf-Understanding-ChildrenChronicIllness.pdf
14. Экер Л. и Тузун С. Х. (2004). Оценка качества жизни матерей детей с церебральным параличом. Инвалидность и реабилитация, 26, 1354-1359. Doi: 10.1080 / 09638280400000187
Иветт К.Гетч, доктор философии, CRC
Доцент и
Координатор программ консультирования выпускников
Кафедра консультирования и педагогических наук
Университет Южной Алабамы
Мобильный, AL
.Ресурсы
»Загрузите версию брошюры GHD
для печати»Загрузите версию для печати брошюры
« Стоматологические проблемы, связанные с дефицитом гормона роста »»Щелкните здесь, чтобы увидеть стоматологическую клиническую статью: Окклюзионные характеристики людей с GHD, ISS и RSS
»Загрузите версию для печати« Психосоциальное воздействие низкого роста на детей и подростков
»»Загрузите версию для печати брошюры
« Часто задаваемые вопросы при начале терапии гормоном роста »»Щелкните здесь, чтобы узнать о преимуществах участника или присоединиться к The MAGIC Foundation
»» ЛАЙК «Страница
фонда MAGIC Foundation в Facebook»Нужна помощь со стоимостью лекарств? Посмотрите, может ли NeedyMeds помочь!
»Присоединяйтесь к нашей закрытой группе GHD в Facebook для родителей.После того, как вы запросите присоединение, напишите администратору, чтобы получить доступ, или напишите Терезе по адресу [email protected]
»История Джейми — Путешествие матери о своем ребенке с дефицитом гормона роста
»Хотели бы вы поговорить с кем-нибудь о GHD? В таком случае позвоните в The MAGIC Foundation по телефону 800-3MAGIC3 или (630) 836-8200 или напишите нам по электронной почте
Чтобы получить помощь за пределами Северной Америки, посетите нашу Международную коалицию, чтобы ознакомиться с ресурсами в вашей стране