Плацентобиопсия: Способы получения материала
Инвазивная пренатальная диагностика плода в Уфе, цена, записаться на прием
Консультирует о необходимости проведения инвазивной диагностики во время беременности
Крюкова Нурия Искандаровна
врач ультразвуковой диагностики высшей категории, к.м.н., специалист по медицине плода
Если при ультразвуковом исследовании были найдены маркеры (признаки) хромосомной патологии плода, то это еще НЕ означает, что у плода есть хромосомная патология, и надо обязательно прерывать беременность. Всем женщинам, у которых были найдены ультразвуковые маркеры хромосомной патологии плода, предлагается инвазивная пренатальная диагностика хорионбиопсия/плацентобиопсия с целью взятия клеток плода и их тонкого микроскопического анализа.
Хорионбиопсия – это взятие нескольких ворсинок из хориона плода под ультразвуковым контролем и подсчет количества хромосом в его клетках. Хорион – орган плода, из которого потом образуется плацента.
Хорионбиопсия выполняется до 14 недель беременности, после этого срока на месте хориона образуется плацента и тогда проводится уже плацентобиопсия. Техника выполнения и риск при плацентобиопсии принципиально не отличаются от хорионбиопсии. В нашем центре вы можете пройти инвазивную диагностику хромосомных болезней плода и получить полный ответ.
Техника выполнения и риск при плацентобиопсии принципиально не отличаются от хорионбиопсии. В нашем центре вы можете пройти инвазивную диагностику хромосомных болезней плода и получить полный ответ.
Плацентобиопсия. Это не сташно — 12 ответов на Babyblog
Хочу поделиться своей историей.
Сейчас я на 19 неделе беременности. Это вторая беременность. Старшей доченьке 2,5 года, здоровенькая. И мне и мужу по 26 лет
В 12 недель мы поехали в Центр Алмазова на скрининговое узи. Малыш оказался на 4 дня меньше срока, доктор 20 минут пыталась измерить ТВП, в итоге написал 2,6мм. При этом сказала,что малыш неудобно лежит и возможно измерила она не очень точно. Но именно с этого момента и начались все волнения. Я перерыла весь инет, кто пишет,что норма 2,5, а кто-то 3. Про биохимический скрининг мне не сказали и поэтому его пропустили.
Стали ждать второй биохимический скрининг. Я его сдала в 16 недель. И вот в прошлый вторник узнала,что у нас чуть пониженный афп на фоне чуть повышенного хгч.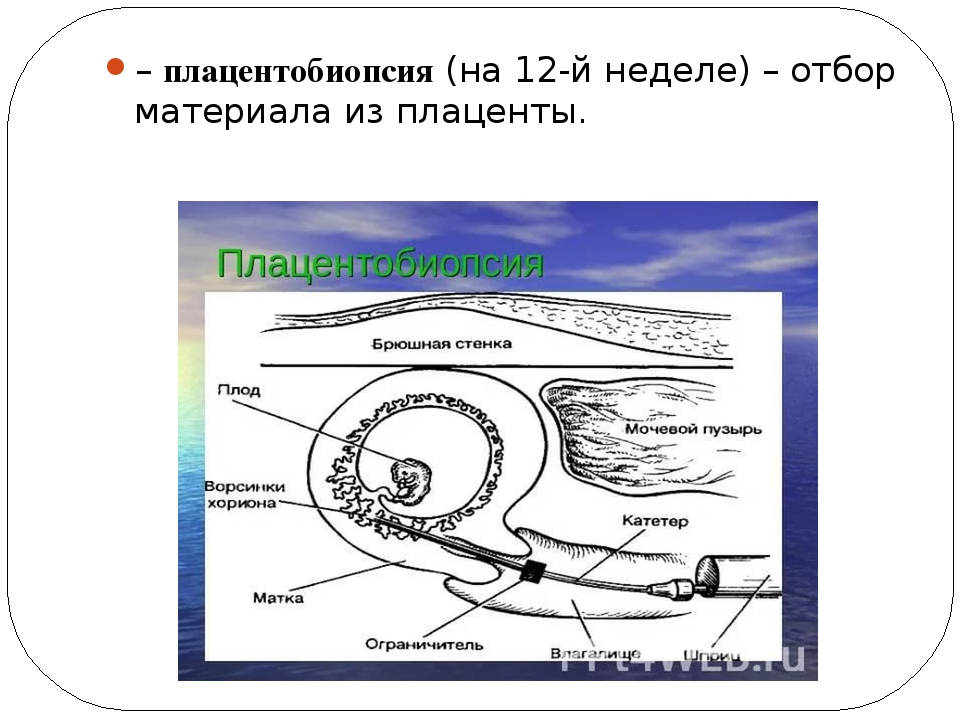
В понедельник я приехала на прием к гинекологу пренатальной диагностики. Он посмотрел узи и анализ. И порекомендовал в моем случае сделать плацентобиопсию, так как там анализируют 15 хромосомных отклонений (при амниоцентозе-5).
Во вторник в 9.30 я приехала в Отто. Нас там было 7-8 девочек. Делали разные процедуры-хорионобиопсию, амниоцентоз или плацентобиопсию.
Сначала всем по очереди сделали узи,чтобы посмотреть, нет ли угрозы. Затем по одной мы проходили в мини-операционную. Там нужно лечь на стол, перед животом ставят шторку. Одна врач контролирует прибором узи,чтобы другая при заборе материала не задела малыша. Скажу честно, это не больно и не страшно. Главное расслабиться и убеждать себя и малыша, что так надо,что это просто очередной анализ.
Скажу честно, это не больно и не страшно. Главное расслабиться и убеждать себя и малыша, что так надо,что это просто очередной анализ.
Потом мы плежали минут по 30, нам повторно слелали узи и отправили домой. Первый день потягивало живот (как при месячных), на второй день болело место прокола. На третий уже все нормально было. Но все эти три дня я старалась лежать. Муж специально взял выходные и занимался дочкой и домашними делами.
В пятницу к 9.15 нас всех собрали,чтобы сообщить результаты. Я уже в 8 утра была на месте. В итоге попала к генетику первой. И у нас оказалось все хорошо, не обнаружен ни один из 15 отклонений. И еще на узи перед процедурой мне сказали,что у нас мальчик)))
Если честно, то я была уверена,что с малышом все хорошо. У нас не сильно повышенные результаты анализов и узи. Но рада, что сделала эту процедуру. Так как теперь я смогу полностью наслаждаться беременностью, а не думать все время, здоровый ли у меня малыш.
Кафедра репродуктивного здоровья женщин
Кафедра репродуктивного здоровья женщин
Михайлов Антон Валерьевич,
главный врач Родильного Дома №17,
доктор медицинских наук,
профессор кафедры акушерства, гинекологии и репродуктологии СПбГМУим. И.И.Мечникова.
И.И.Мечникова.
Родился в 1960 году в Ленинграде, окончил 1 Ленинградский Медицинский институт им. акад. И.П. Павлова.
С 01.09.2003 является главным врачом СПбГБУЗ “Родильный дом №17” (бывший 11).
За время работы в Родильном доме № 17 Михайловым А.В. разработаны и внедрены в клиническую практику УНИКАЛЬНЫЕ методы
— наружного поворота плода на головку при тазовомпредлежании.
Под руководством Михайлова А.В. на базе родильного дома создан центр пренатальной диагностики врожденных и наследственных заболеваний плода, где впервые в России выполнены ПЕРВЫЕ ИНВАЗИВНЫЕ ВМЕШАТЕЛЬСТВА – плацентобиопсия, кордоцентез. Под руководством Михайлова А.В. родильный дом №17 начал специализироваться на оказании перинатальной помощи при ранних преждевременных родах, резус-конфликте матери и плода.
Область основных клинических и научных интересов: перинатальная медицина — пренатальная диагностика и
лечение врожденных и наследственных заболеваний плода, методы оценки состояния плода при беременности и в родах,
экстренные состояния в акушерстве и неонатологии,
гемолитическая болезнь плода и новорожденного в следствие изоиммунизация матери по Rh-фактору, тазовое предлежание плода.
Автор более 130 научных печатных работ, 2 монографий, редактор многих мировых изданий по акушерству и гинекологии.
Член правления Всемирной ассоциации перинатальной медицины, вропейкой ассоциации перинатальной медицины, исполкома Российской ассоциации врачей специалистов ультразвуковой диагностики в медицине. Председатель правления ассоциации врачей специалистов ультразвуковой диагностики в акушерстве и гинекологии Санкт-Петербурга. За период работы в отрасли родовспоможения Михайлов А.В. награжден “Нагрудным знаком “Отличник здравоохранения”, Почетной грамотой Министерства Здравоохранения и социального развития РФ “За многолетний добросовестный труд”, ведомственной наградой “Почетный донор России”.
Женат, имеет троих детей.
Сертификат по специальности «акушерство и гинекология» с 08.02.2014 по 08.02.2019, категория — высшая
Сертификат по специальности «организация здравоохранения и общественного
здоровья» с 19.04.2017 по 19.04.2022, категория — высшая
Инвазивные методы пренатальной диагностики
К инвазивным диагностическим процедурам относятся:
· амниоцентез,
· кордоцентез,
· хорион биопсия,
· плацентобиопсия
· биопсия органов плода с последующим лабораторным исследованием полученного материала методами, соответствующими конкретным целям пренатального исследования.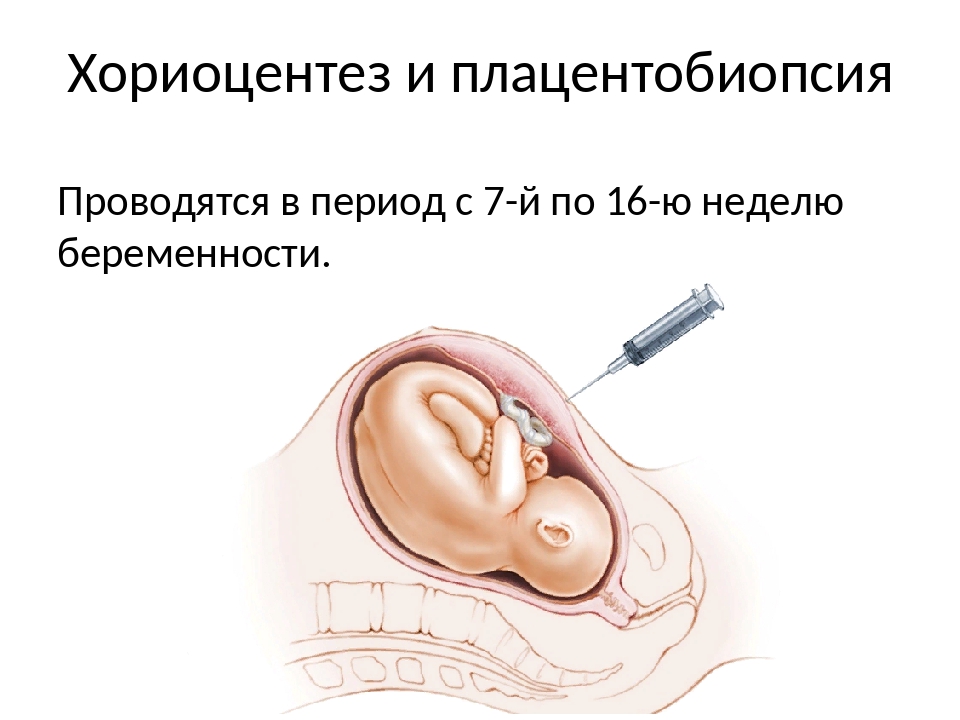
Хорион- и плацентобиопсия
Биопсия ворсин хориона проводится в 9-11 недель беременности.
Плацентобиопсия – с 11 по 18 неделю беременности.
Показаниями к проведению данных методов пренатальной диагностики служат:
· в 1-ом триместре — сбалансированные хромосомные перестройки у родителей, обменные заболевания в семье, возраст женщины более 36 лет, рождение в анамнезе ребенка с хромосомной патологией;
· во 2-ом триместре — необходимость кариотипирования плода или морфологического исследования плаценты;
· в 3-м триместре биопсия плаценты используется крайне редко, как правило, в случае, когда специалисты не владеют более информативными методами исследования.
Различают щипцовую и аспирационную биопсию хориона. Щипцовая биопсия хориона производится путем трансцервикального введения специальных биопсийных щипцов. Аспирационная биопсия хориона (АБХ) производится путём вакуумного отсасывания в шприц ворсин хориона.
Схема аспирационной биопсии хориона
Диагностическая ценность АБХ состоит, прежде всего, в исключительности применения в 1-ом триместре, а также в скорости проведения анализов на образцах культуры хориона.
Амниоцентез
Амниоцентез- пункция амниотической полости с целью аспирации амниотической жидкости. Рекомендуемые сроки проведения- 15-18 недель, ранний амниоцентез проводят в 12 -15 недель.
Амниоцентез (АЦ) производится трансабдоминальным или трансвагинальным путём (пунктируется передний свод влагалища). Применяется в целях:
· цитогенетической диагностики хромосомной патологии плода;
· диагностики эритробластоза, наследственных заболеваний обмена;
· при необходимости проведения иммуноферментного анализа амниотической жидкости на АФП при подозрении на наличие открытых свищевых дефектов нервной трубки;
· оценки зрелости легочной ткани на основании анализа соотношения лецитин — сфингомиелинопределения уровня фосфатидилглицерида и других биохимических компонентов амниотической жидкости;
· диагностики степени выраженности гипоксического состояния плода на основании уровня кислотности.
Схема амниоцентеза
Риск осложнений при проведении амниоцентеза не превышает 0,5 — 1% и практически не зависит от срока беременности.
Диагностическая ценность амниоцентеза состоит в простоте выполнения манипуляции и широте спектра диагностических возможностей. Неудобство применения амниоцентеза для целей цитогенетической диагностики состоит в длительности и сложности культивирования клеток амниотической жидкости. Несмотря на это, амниоцентез остается одной из самых распространенных диагностических процедур в большинстве пренатальных диагностических центров.
Кордоцентез
Кордоцентез — пункция вены пуповины с целью получения плодной крови в настоящее время является наиболее актуальным методом пренатальной диагностики, поскольку кровь плода является наиболее благодатным и информативным биологическим материалом.
В настоящее время кровь плода используется для:
· цитогенетической пренатальной диагностики хромосомной патологии;
· диагностики наследственных болезней обмена;
· диагностики гемоглобинопатий;
· исследований белкового спектра крови;
· диагностики коагулопатий;
· оценки степени выраженности гипоксического состояния плода и его инфицированности;
· определения АВО-антигенов и Rh-фактора плода;
· диагностики и лечения резус-конфликтной беременности
· внутриутробного переливания крови при гемолитической болезни плода.
Наиболее часто кордоцентез применяется, с 18 по 24 недели беременности, однако, при наличии УЗ-сканеров с высокой разрешающей способностью, кордоцентез можно выполнять с 12-й недели.
Риск осложнений после кордоцентеза колеблется от 1,5 до 2,5%. Основным осложнением является продолжительное кровотечение из прокола вены пуповины, вследствие чего развивается внутриутробная анемия и гипоксия плода, что в ряде случаев может приводить к его гибели. В различные сроки беременности допускается аспирация от 0,5 до 5 мл крови плода.
Узнать еще:
Инвазивные вмешательства в пренатальной диагностике наследственных и врожденных болезней Текст научной статьи по специальности «Клиническая медицина»
© А. Л. Коротеев ИНВАзИВНЬ1Е ВМЕШАТЕЛьСТВА
НИИ акушерства и гинекологии В ПрЕНАТАЛЬНОЙ ДИАГНОСТИКЕ
им. Д. а °тта рАМН, НАСЛЕДСТВЕННЫХ И ВРОЖДЕННЫХ
Санкт-Петербург _
БОЛЕЗНЕЙ
■ Инвазивные вмешательства, выполняемые под ультразвуковым контролем, с целью получения плодного материала для последующего лабораторного анализа — одно из важнейших направлений работы службы пренатальной диагностики. Кратко рассмотрены основные исторические этапы становления каждого из инвазивных методов, применяемых на разных сроках беременности: амниоцентез, хорионбиопсия, плацентобиопсия, кордоцентез. Приведены результаты анализа инвазивных вмешательств, их влияния на состояние плода и матери. На основании собственного опыта дается критическая оценка различных инвазивных методов, рациональное использование которых минимизирует частоту послеоперационных осложнений и способствует повышению эффективности пренатальной диагностики.
Кратко рассмотрены основные исторические этапы становления каждого из инвазивных методов, применяемых на разных сроках беременности: амниоцентез, хорионбиопсия, плацентобиопсия, кордоцентез. Приведены результаты анализа инвазивных вмешательств, их влияния на состояние плода и матери. На основании собственного опыта дается критическая оценка различных инвазивных методов, рациональное использование которых минимизирует частоту послеоперационных осложнений и способствует повышению эффективности пренатальной диагностики.
■ Ключевые слова: инвазивные вмешательства; амниоцентез; хорионбиопсия; плацентобиопсия; кордоцентез
Инвазивные методы пренатальной диагностики (ПД) включают хорионбиопсию в I триместре беременности, плаценто-биопсию, амниоцентез и кордоцентез во II и III триместрах, реже — биопсию кожи, печени и других органов плода. Они относятся к верифицирующим методам, так как позволяют получить материал плода, необходимый для точной диагностики врожденной или наследственной патологии с помощью специальных лабораторных методов исследования и определения оптимальной тактики ведения беременности. В настоящее время эта задача успешно решена [1, 7, 9].
В настоящее время эта задача успешно решена [1, 7, 9].
Являясь производными одной клетки — зиготы, ткани эмб-риобласта и трофобласта несут одинаковую генетическую информацию. Это определяет возможность проведения ПД наследственных заболеваний плода путем исследования ворсин хориона. Клетки трофобласта имеют высокую митотическую активность, что позволяет проводить их быстрое прямое ка-риотипирование. Они широко используются и для диагностики моногенных заболеваний. Цитогенетическое исследование ворсин хориона может быть проведено и после их предварительного кратковременного или продолжительного культивирования.
Исследование ворсин хориона в I триместре беременности имеет важное преимущество перед другими инвазивными методами. Оно позволяет получить быстрый ответ и, при необходимости, прервать беременность уже на ранних сроках с наименьшим риском для здоровья женщины [2].
Впервые о возможности получения биоптата хориона было сообщено в 1968 году при проведении пункции через свод стенки матки эндоскопом, оснащенным биопсийными щипцами [42]. В дальнейшем был предложен трансцервикальный эндоскопический метод, который первоначально был апробирован перед проведением искусственного аборта [29, 37]. Место локализации хориона определяли под контролем эндоскопа, создавали разрежение в тубусе и иссекали хориальную ткань цилиндрическим скальпелем. При использовании этой техники биоптат содержал ворсины хориона только в половине случаев. Кроме того, отмечались значительные трудности в культивировании клеток хориона — число успешных попыток составляло всего около 30 %. Существенные технические проблемы возникали и при трансцервикальном способе получения хорионбиоптатов в связи с необходимостью механического расширения цервикального канала у нерожавших женщин при введении эндоскопа диаметром 7 мм. В 75 % случаев визуализация хориона была существенно затруднена. Попытки получения ворсин хориона с помощью трансцервикальной хорионбиопсии зачастую осложнялись внутриматочной инфекцией, перфорацией плодного пузыря и излитием околоплодной жидкости.
В дальнейшем был предложен трансцервикальный эндоскопический метод, который первоначально был апробирован перед проведением искусственного аборта [29, 37]. Место локализации хориона определяли под контролем эндоскопа, создавали разрежение в тубусе и иссекали хориальную ткань цилиндрическим скальпелем. При использовании этой техники биоптат содержал ворсины хориона только в половине случаев. Кроме того, отмечались значительные трудности в культивировании клеток хориона — число успешных попыток составляло всего около 30 %. Существенные технические проблемы возникали и при трансцервикальном способе получения хорионбиоптатов в связи с необходимостью механического расширения цервикального канала у нерожавших женщин при введении эндоскопа диаметром 7 мм. В 75 % случаев визуализация хориона была существенно затруднена. Попытки получения ворсин хориона с помощью трансцервикальной хорионбиопсии зачастую осложнялись внутриматочной инфекцией, перфорацией плодного пузыря и излитием околоплодной жидкости. Так, в 70-х годах прошлого века, каждая 3-5-я попытка забора плодного материала
Так, в 70-х годах прошлого века, каждая 3-5-я попытка забора плодного материала
в I триместре завершалась прерыванием беременности, что стимулировало временный запрет на проведение этой операции [2].
Сообщение о возможности проведения транс-цервикальной аспирации клеток хориона через металлический катетер с целью цитогенетического определения пола плода по половому хроматину [20] стимулировало использование этого метода и для ПД [28]. К сожалению, в связи с высокой частотой осложнений и выраженной контаминацией биоптата материнскими клетками было сделано заключение о том, что «ПД в I триместре в настоящее время невозможна». Таким образом, высокая частота осложнений и технические ограничения не позволили в то время внедрить эти методы с целью ПД.
Повторный интерес к ПД в I триместре возник в начале 1980-х годов. Он был связан с появлением возможности достаточно точной визуализации места локализации хориона в полости матки при ультразвуковом сканировании. В 1978 году В. А. Бахаревым и сотрудниками впервые была осуществлена трансцервикальная щипцовая биопсия ткани хориона [4, 10, 36]. В настоящее время этот метод успешно применяется только в НЦАГП (Москва).
В 1978 году В. А. Бахаревым и сотрудниками впервые была осуществлена трансцервикальная щипцовая биопсия ткани хориона [4, 10, 36]. В настоящее время этот метод успешно применяется только в НЦАГП (Москва).
Внедрение трансцервикальной аспирацион-ной биопсии ворсин хориона под ультразвуковым контролем [40], разработка специального катетера [22] привели к значительному повышению эффективности биопсии и снижению количества осложнений. Это способствовало широкому внедрению данного метода во многих перинатальных центрах в 90-х годах ХХ века [1, 41].
Наиболее удачной методической модификацией биопсии ворсин хориона в I триместре беременности явилось появление и усовершенствование трансабдоминальной аспирационной биопсии [41]. В настоящее время этот метод стал основным в ПД I триместра беременности [16, 39].
Разработаны и широко применяются два варианта трансабдоминальной хорионбиопсии. Одно-игольная методика выполняется в НИИ акушерства и гинекологии им. Д. О. Отта РАМН с помощью иглы с мандреном для биопсии диаметром 18G длиной 150-200 мм (Mediplast, Швеция; Шег.У, США). При ее выполнении используются ультразвуковые датчики, оснащенные пункционными адаптерами. Траектория движения выбирается с помощью пункционной трассы на экране монитора ультразвукового сканера таким образом, чтобы игла проходила через ткань хориона параллельно хориальной оболочке. Необходимо тщательно следить, чтобы в начале пункции не повредить петлю кишечника или стенку мочевого пузыря. Игла должна погрузиться в ткань хориона на мак-
Одно-игольная методика выполняется в НИИ акушерства и гинекологии им. Д. О. Отта РАМН с помощью иглы с мандреном для биопсии диаметром 18G длиной 150-200 мм (Mediplast, Швеция; Шег.У, США). При ее выполнении используются ультразвуковые датчики, оснащенные пункционными адаптерами. Траектория движения выбирается с помощью пункционной трассы на экране монитора ультразвукового сканера таким образом, чтобы игла проходила через ткань хориона параллельно хориальной оболочке. Необходимо тщательно следить, чтобы в начале пункции не повредить петлю кишечника или стенку мочевого пузыря. Игла должна погрузиться в ткань хориона на мак-
симально возможную глубину, оставаясь при этом расположенной параллельно хориальной оболочке, чтобы избежать ее случайного повреждения. Убедившись в правильном расположении иглы, из нее извлекают мандрен и присоединяют шприц с 5 мл питательной среды, закрепленный в специальном холдере (держателе). Постоянно производя аспирацию, в толще хориона выполняют несколько возвратно-поступательных движений. Извлечение иглы также сопровождается процессом аспирации. Такая «вакуумная» техника хорионбиопсии необходима для получения такого количества материала, которое достаточно для лабораторных, прежде всего, цитогенетических исследований.
Извлечение иглы также сопровождается процессом аспирации. Такая «вакуумная» техника хорионбиопсии необходима для получения такого количества материала, которое достаточно для лабораторных, прежде всего, цитогенетических исследований.
Успешность аспирации ворсин хориона, то есть количество ворсин, достаточное для последующей лабораторной диагностики, определяют врачи лаборанты-цитогенетики, присутствующие при манипуляции. Они исследуют содержимое шприца визуально в проходящем свете и под контролем бинокулярной лупы в чашках Петри с питательной средой отбирают ворсинки хориона. Количество аспирированных ворсин оценивают с помощью стандартных таблиц. Для стабильного проведения цитогенетических исследований требуется не менее 5 мг ворсин, а для молекуляр-но-генетического исследования может быть достаточно около 1 мг [7, 11].
Вторая модификация трансабдоминальной хори-онбиопсии, так называемая двухигольная методика, в настоящее время менее распространена и применяется только в некоторых зарубежных перинатальных центрах. При ее выполнении используется две иглы: проводниковая (наружная) тонкостенная игла 18G или иглы для спинномозговой пункции диаметром 16G длиной 100-150 мм и биопсий-ная (внутренняя) игла диаметром 20G длиной 150-200 мм. Игла большего диаметра используется как троакар, который вводится в миометрий, а более тонкая и длинная погружается непосредственно в толщу хориона. Затем из нее извлекают манд-рен и присоединяют шприц с питательной средой. В дальнейшем аспирация осуществляется вышеописанным способом. При этом варианте существует возможность повторной аспирации без дополнительного прокола передней брюшной стенки. По нашему опыту одноигольная техника занимает меньше времени, менее дискомфортна для пациентки и при достаточном навыке оператора обеспечивает получение необходимого для лабораторных исследований количества биоптата.
При ее выполнении используется две иглы: проводниковая (наружная) тонкостенная игла 18G или иглы для спинномозговой пункции диаметром 16G длиной 100-150 мм и биопсий-ная (внутренняя) игла диаметром 20G длиной 150-200 мм. Игла большего диаметра используется как троакар, который вводится в миометрий, а более тонкая и длинная погружается непосредственно в толщу хориона. Затем из нее извлекают манд-рен и присоединяют шприц с питательной средой. В дальнейшем аспирация осуществляется вышеописанным способом. При этом варианте существует возможность повторной аспирации без дополнительного прокола передней брюшной стенки. По нашему опыту одноигольная техника занимает меньше времени, менее дискомфортна для пациентки и при достаточном навыке оператора обеспечивает получение необходимого для лабораторных исследований количества биоптата.
Если при первой попытке получено недостаточное количество материала, то процедуру можно повторить без дополнительного риска [17]. Угроза прерывания беременности достоверно возрастает при проведении более двух попыток
Угроза прерывания беременности достоверно возрастает при проведении более двух попыток
и может достигать 10 %, если выполняется третья попытка [34, 62]. Она должна предприниматься только в том случае, если имеется полная уверенность в необходимости получения нужного объема материала. Прежде чем решиться на третью попытку, необходимо еще раз оценить анатомическую картину, добиться полной релаксации миометрия и найти возможность альтернативного предыдущим попыткам оперативного доступа. В НИИ акушерства и гинекологии им. Д. О. Отта РАМН, так же как и в большинстве перинатальных центров, трансабдоминальная биопсия ворсин хориона успешно выполняется с первой попытки в 96-99 % случаев. В настоящее время ее эффективность приближается к 100 %. Эффективность хорионбиопсии возрастает пропорционально опыту врача, выполняющего внутриматочное вмешательство. Так, при выполнении первых 200 вмешательств ворсины хориона были получены с первой попытки в 80 % случаев, но в последующем этот показатель возрастал до 96-99 % [6].
В начале 1990-х годов появились единичные сообщения, что хорионбиопсия в I триместре может сочетаться с увеличением частоты изолированных аномалий развития плода [38, 57]. Так, было описано повышение частоты поперечных редукций конечностей и оромандибулярных гипогене-зий [21]. Отмечено увеличение частоты подобных нарушений после хорионбиопсий, выполненных в период с 8-й по 9-ю недели беременности. Известно, что формирование конечностей завершается к 56-му дню развития плода. Высказано предположение, что возможной причиной пороков развития конечностей у плодов, перенесших хорионбиопсию до 9,5 недель беременности, могли быть нарушения кровообращения у плода после оперативного вмешательства. В настоящее время считается, что риск развития аномалий конечностей практически отсутствует, если инвазивное вмешательство проводится после 70-го дня беременности (от первого дня последнего менструального цикла) [21, 25, 38, 57].
Во время трансцервикальной хорионбиопсии неизбежен контакт с микрофлорой, и вследствие нарушения цервикального барьера при прохождении катетера существует возможность инфицирования полости матки и последующее развитие хориоамнионита. В многочисленных исследованиях, однако, показано отсутствие связи между влагалищной микрофлорой, ее высевом с аспи-рационного катетера и осложнениями беременности [25]. Риск развития хориоамнионита после трансцервикальной хорионбиопсии составляет 0,1-0,3 % и не отличается от популяционного [51]. В случае трансабдоминальной хорионбиоп-сии применение одноразовых игл практически полностью исключает возможность инфицирова-
В многочисленных исследованиях, однако, показано отсутствие связи между влагалищной микрофлорой, ее высевом с аспи-рационного катетера и осложнениями беременности [25]. Риск развития хориоамнионита после трансцервикальной хорионбиопсии составляет 0,1-0,3 % и не отличается от популяционного [51]. В случае трансабдоминальной хорионбиоп-сии применение одноразовых игл практически полностью исключает возможность инфицирова-
ния хориона, однако при повторной пункции все же рекомендуется использовать новую иглу.
Нарушения целостности плодного пузыря чаще встречаются при трансцервикальной хорионбиоп-сии. Обычно они сопровождаются видимым подтеканием околоплодной жидкости. Однако при достаточном опыте врача акушера-гинеколога нарушение целостности плодного пузыря происходит очень редко, менее чем в 0,3 % случаев, а при трансабдоминальной хорионбиопсии практически не встречается. Появление кровянистых выделений из половых путей — нередкое явление при трансцер-викальной хорионбиопсии.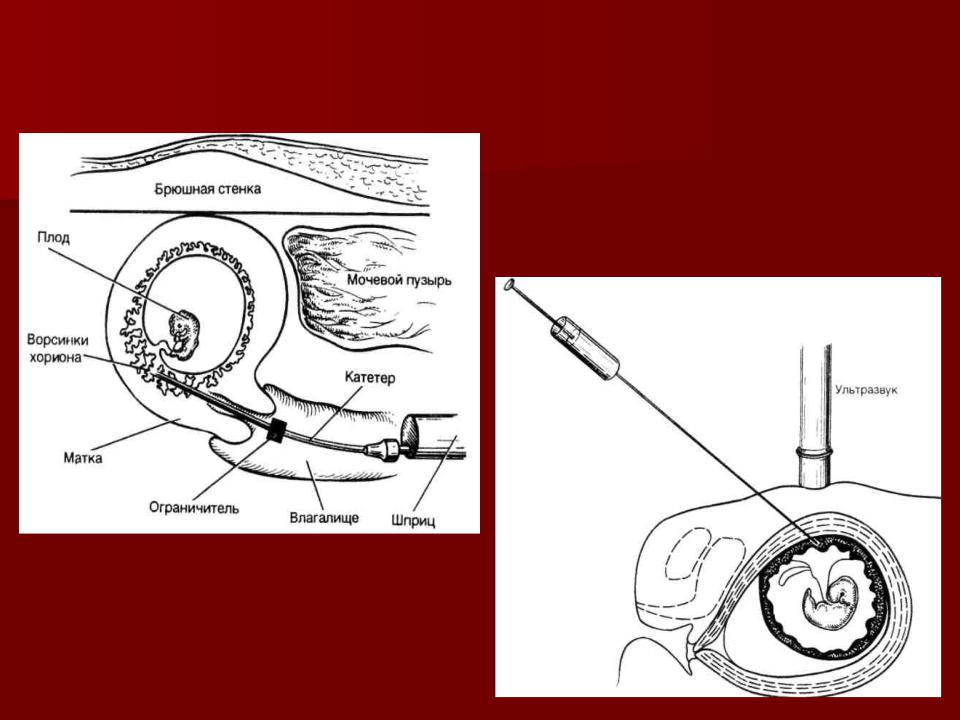 Оно встречается почти у 30 % пациенток, однако серьезные кровотечения с образованием ретрохориальных гематом бывают редко [13]. При трансабдоминальном доступе кровотечения из половых путей после операции отмечаются в единичных случаях.
Оно встречается почти у 30 % пациенток, однако серьезные кровотечения с образованием ретрохориальных гематом бывают редко [13]. При трансабдоминальном доступе кровотечения из половых путей после операции отмечаются в единичных случаях.
Известно, что серьезную проблему для кариоти-пирования плода по клеткам хориона представляет хромосомный мозаицизм. Одним из источников мозаицизма могут быть клетки материнских тканей (эндометрия), отсасываемые шприцом вместе с ворсинками хориона. При строгом соблюдении методики биопсии возможность аспирации и попадания клеток материнского происхождения в препараты составляет 0,1-1,3 %. Контаминация более вероятна при использовании трансцервикального метода.
Учитывая повышение риска Rh-изоиммуни-зации при повреждении плацентарного барьера во время хорионбиопсии, женщинам с Rh(-) с целью профилактики после вмешательства показано введение антирезусного гамма-глобулина [44]. В случаях необходимости выполнения инвазивной пренатальной диагностики у изоиммунизирован-ных беременных женщин целесообразно отдавать предпочтение менее травматичному кордоцентезу. В НИИ акушерства и гинекологии им. Д. О. Отта РАМН разработан и широко применяется специальный алгоритм инвазивной ПД у беременных с Rh(-) принадлежностью крови [9, 12].
В случаях необходимости выполнения инвазивной пренатальной диагностики у изоиммунизирован-ных беременных женщин целесообразно отдавать предпочтение менее травматичному кордоцентезу. В НИИ акушерства и гинекологии им. Д. О. Отта РАМН разработан и широко применяется специальный алгоритм инвазивной ПД у беременных с Rh(-) принадлежностью крови [9, 12].
Введение в клиническую практику биохимического и ультразвукового скринингов врожденных и наследственных заболеваний плода выявило актуальность пренатального кариотипи-рования во II триместре беременности. С целью получения клеток плодового происхождения на этом сроке первым применили амниоцентез [35, 43, 50, 59]. В настоящее время это самый распространенный вариант инвазивного вмешательства, который широко применяется в зарубежных перинатальных центрах с целью кариотипирования плода. Этот метод не свободен, однако, от ряда существенных ограничений. Во-первых, они касаются длительности культивирования амнио-
цитов (до 28 дней), что может быть сопряжено с поздним прерыванием беременности в случае подтверждения диагноза [48]. Во-вторых, необходимость длительного ожидания ответа может быть причиной психоэмоциональных расстройств у беременной [58]. Применение ускоренного прямого метода приготовления хромосомных препаратов из биоптатов ворсин хориона позволяет с успехом использовать метод трансабдоминальной биопсии как в I, так и во II триместрах беременности. Методика и практические аспекты применения плацентобиопсии практически идентичны таковым при хорионбиопсии.
Во-вторых, необходимость длительного ожидания ответа может быть причиной психоэмоциональных расстройств у беременной [58]. Применение ускоренного прямого метода приготовления хромосомных препаратов из биоптатов ворсин хориона позволяет с успехом использовать метод трансабдоминальной биопсии как в I, так и во II триместрах беременности. Методика и практические аспекты применения плацентобиопсии практически идентичны таковым при хорионбиопсии.
Кордоцентез (КЦ) — внутриматочная пункция сосудов пуповины для получения крови плода во время беременности и ее исследования для ПД врожденных и наследственных заболеваний плода и оценки его функционального состояния. Впервые исследование крови плода до его рождения было выполнено Saling (1960) [55]. Пробы крови получали из кожных покровов головки плода после отхождения околоплодных вод в родах. Основной целью забора крови плода в родах была оценка состояния его кислотно-основного равновесия. В последующем этот метод стал общепризнанным и рекомендован при ведении родов у женщин в случае подозрения на развитие гипоксии плода.
Попытки получения крови плода во время беременности были предприняты еще в середине 70-х годов прошлого века. Так в 1974 году Y. W. Кап еt а1. [24] сообщили о возможности проведения ПД гемоглобинопатий при исследовании крови плода, извлеченной с помощью множественных пункций плацентарной ткани. Однако таким образом практически невозможно извлечь кровь плода без примеси материнской крови [46], что не позволяло использовать ее для пренатальной диагностики большинства наследственных заболеваний плода. При этом в связи с развитием кровотечений и возникновением маточной активности частота гибели плодов достигала 10 %.
В дальнейшем, для извлечения крови плода была предложена фетоскопия, позволяющая осуществлять оптическую визуализацию сосудов плода в полости матки. При фетоскопии проводилась пункция сосудов плодовой поверхности плаценты [31] или непосредственно сосудов пуповины [53]. Эти методики позволяли извлекать кровь плода без примесей околоплодной жидкости и/или крови матери, однако они имели существенные технические ограничения. Так, использование операционных фетоскопов связано со значительной травмой матки и, вследствие этого, с существенным увеличением частоты прерываний беременности непосредственно после операции — до 5-8 % [33]. Кроме того, данное вмешательство
Так, использование операционных фетоскопов связано со значительной травмой матки и, вследствие этого, с существенным увеличением частоты прерываний беременности непосредственно после операции — до 5-8 % [33]. Кроме того, данное вмешательство
невозможно при расположении плаценты по передней стенке матки, при уменьшении количества амниотической жидкости, а также требует стационарных условий и применения анестезии.
Эти недостатки фетоскопии привели к ее полному забвению после появления альтернативной методики получения крови плода путем пункции вены пуповины под ультразвуковым контролем [19]. Существуют несколько технически различных вариантов забора крови плода с помощью КЦ. Исторически более ранней является трансабдоминальная трансплацентарная пункция сосудов пуповины в области ее «корня» методом £гее hand (свободной руки). Методика заключается в пункции сосуда пуповины достаточно «толстыми» иглами — 18-20G, что является определенным недостатком, так как при этом увеличивается риск кровотечения из места пункции.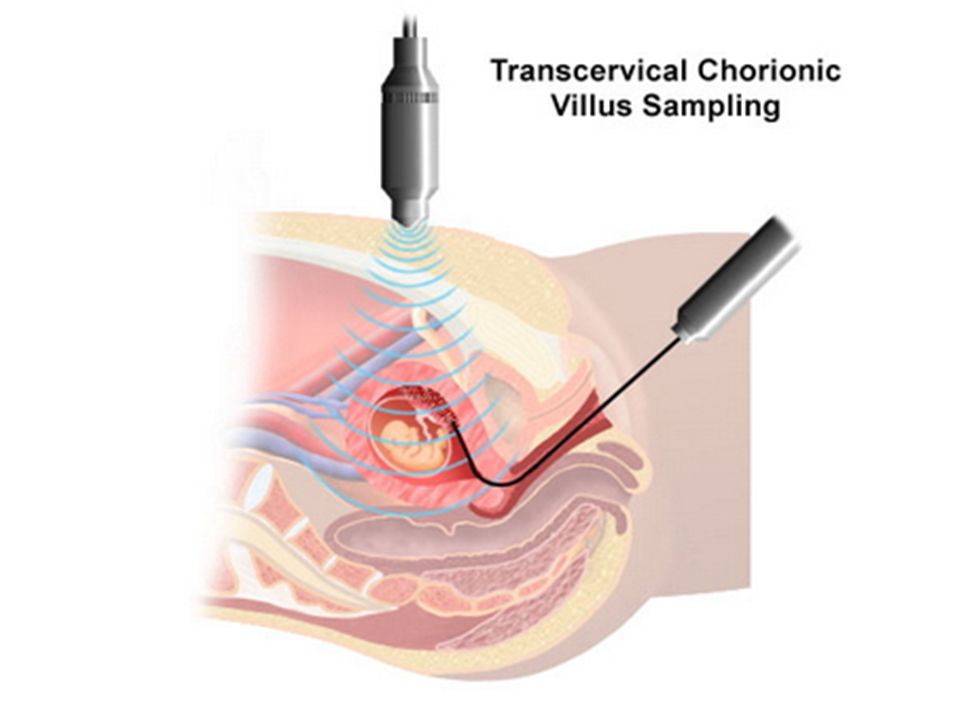 Ее другим существенным недостатком является необходимость латеральных движений иглой при выборе оптимальной плоскости для выполнения пункции сосуда, что увеличивает травматичность вмешательства [32, 54].
Ее другим существенным недостатком является необходимость латеральных движений иглой при выборе оптимальной плоскости для выполнения пункции сосуда, что увеличивает травматичность вмешательства [32, 54].
В настоящее время КЦ под ультразвуковым контролем является амбулаторной процедурой, не требующей премедикации и анестезии. Соблюдение правил асептики и антисептики однотипно для всех внутриматочных вмешательств. Методика выполнения вмешательства зависит от опыта и выбора врача. Она может включать технику «свободной руки» или использование пунк-ционного адаптера к ультразвуковому датчику с трассой продвижения иглы на экране монитора ультразвукового сканера. Возможно использование одно- или двухигольного метода. Предпочтительна пункция вены пуповины, в связи с меньшим количеством осложнений со стороны плода по сравнению с аспирацией крови плода из артерий. Пункция вены пуповины может проводиться в месте выхода ее из плаценты, на свободном участке петель пуповины вблизи места вхождения вены пуповины в брюшную полость плода или на ее внутрипеченочной части. В зависимости от взаиморасположения плаценты, петель пуповины и плода прохождение иглы к пунктируемому сосуду может осуществляться трансамнионально, трансплацентарно или трансплацентарно-транс-амнионально [5].
В зависимости от взаиморасположения плаценты, петель пуповины и плода прохождение иглы к пунктируемому сосуду может осуществляться трансамнионально, трансплацентарно или трансплацентарно-транс-амнионально [5].
По нашим данным, предпочтительным является использование пункционного адаптера, двух-игольного метода и трансамнионального доступа к вене пуповины на любом доступном ее участке. После соответствующей обработки передней брюшной стенки проводят детальное ультразвуковое исследование. Определяют место пункции таким образом, чтобы траектория движения иглы
по возможности не проходила через плацентарную ткань, не затрагивала тело плода, а вена являлась близлежащим к датчику сосудом пуповины. Метод предусматривает использование двух игл. Первой иглой (18-20G, длиной 100-150 мм) через пункционный адаптер выполняют амниоцентез. После извлечения мандрена шприцем аспириру-ют небольшой объем околоплодной жидкости для последующего анализа (при необходимости). Через просвет первой иглы в амниотическую полость вводят вторую иглу (22-25G, длиной 150-200 мм) для непосредственного выполнения пункции вены пуповины. Конец иглы подводят к вене в проекции ее наибольшего диаметра и коротким, но резким движением осуществляют пункцию сосуда с введением конца иглы в его просвет. Расположение конца иглы в сосуде необходимо контролировать визуально. При расположении иглы в пупочной вене к ней подсоединяют гепаринизи-рованный шприц объемом 1-2 мл. В зависимости от показаний к КЦ и от срока беременности извлекают 1-3 мл крови, после чего иглы медленно удаляют из полости матки. Успешность получения крови плода с первой попытки при проведении КЦ составляет 95-99 % [5, 6].
Через просвет первой иглы в амниотическую полость вводят вторую иглу (22-25G, длиной 150-200 мм) для непосредственного выполнения пункции вены пуповины. Конец иглы подводят к вене в проекции ее наибольшего диаметра и коротким, но резким движением осуществляют пункцию сосуда с введением конца иглы в его просвет. Расположение конца иглы в сосуде необходимо контролировать визуально. При расположении иглы в пупочной вене к ней подсоединяют гепаринизи-рованный шприц объемом 1-2 мл. В зависимости от показаний к КЦ и от срока беременности извлекают 1-3 мл крови, после чего иглы медленно удаляют из полости матки. Успешность получения крови плода с первой попытки при проведении КЦ составляет 95-99 % [5, 6].
Использование биопсийных адаптеров для игл снижает риск травматизации пуповины или смещения иглы во время взятия образца крови [52]. Однако следует учитывать, что ограничение латеральной подвижности пунктированной петли пуповины в этом случае может затруднять выполнение вмешательства, если возникает необходимость изменить положение иглы. В этих случаях иглу из пункционного адаптера можно отсоединить и продолжить процедуру.
В этих случаях иглу из пункционного адаптера можно отсоединить и продолжить процедуру.
Контроль качества образца крови, полученного при инвазивном вмешательстве, является важным этапом процедуры КЦ. Контаминация его кровью матери и амниотической жидкостью может снизить диагностическую ценность КЦ. Для дифференцирования плодовой и материнской крови предложено несколько тестов [11]. В НИИ акушерства и гинекологии им. Д. О. Отта РАМН применяют следующий тест. В пробирку, содержащую 5 мл дистиллированной воды, добавляют непосредственно перед употреблением 1 мл 0,25N №ОН. Затем добавляют 0,05 мл (1-2 капли) крови. Перемешивают содержимое пробирки покачиванием в течение 1 минуты. Переход цвета от розового до темного зелено-коричневого свидетельствует о присутствии в образце крови матери. Ярко-розовый цвет указывает на отсутствие контаминации.
Диагностические возможности исследования крови плода определяют и основные показания
для КЦ. К ним относятся: кариотипирование плода и диагностика моногенных заболеваний. Прямой анализ факторов свертывающей системы крови при гемофилии А и В и гемоглобина плода при Р-талассемии долгое время были единственными методами ПД [63]. Однако в связи с быстрым прогрессом молекулярно-генетичес-ких методов, получение крови плода с помощью КЦ только для диагностики моногенных болезней в настоящее время представляет скорее исторический интерес. Возможность быстрого кариотипирования при культивировании лимфоцитов крови плода делают КЦ процедурой выбора для лабораторной диагностики врожденных и наследственных заболеваний при выявлении нарушений развития плода во второй половине беременности или при позднем обращении женщин. Другим, наиболее частым показанием для выполнения КЦ, является диагностика гемолитической болезни плода, возникающей вследствие резус-изоиммунизации матери. Величина титра Rh-антител в крови беременной женщины и исследование оптической плотности околоплодной жидкости не дают точной прогностической информации о состоянии плода [63].
К ним относятся: кариотипирование плода и диагностика моногенных заболеваний. Прямой анализ факторов свертывающей системы крови при гемофилии А и В и гемоглобина плода при Р-талассемии долгое время были единственными методами ПД [63]. Однако в связи с быстрым прогрессом молекулярно-генетичес-ких методов, получение крови плода с помощью КЦ только для диагностики моногенных болезней в настоящее время представляет скорее исторический интерес. Возможность быстрого кариотипирования при культивировании лимфоцитов крови плода делают КЦ процедурой выбора для лабораторной диагностики врожденных и наследственных заболеваний при выявлении нарушений развития плода во второй половине беременности или при позднем обращении женщин. Другим, наиболее частым показанием для выполнения КЦ, является диагностика гемолитической болезни плода, возникающей вследствие резус-изоиммунизации матери. Величина титра Rh-антител в крови беременной женщины и исследование оптической плотности околоплодной жидкости не дают точной прогностической информации о состоянии плода [63]. КЦ и последующее исследование крови плода, извлеченной из вены пуповины, являются методом выбора при диагностике и оценке степени тяжести гемолитической болезни. Переливание крови плоду при помощи КЦ позволяет проводить лечение тяжелых форм этого заболевания [6, 19].
КЦ и последующее исследование крови плода, извлеченной из вены пуповины, являются методом выбора при диагностике и оценке степени тяжести гемолитической болезни. Переливание крови плоду при помощи КЦ позволяет проводить лечение тяжелых форм этого заболевания [6, 19].
Адекватная оценка состояния плода при осложненном течении беременности является одной из основных задач перинатальной медицины. Раннее появление тяжелых форм задержки развития плода, особенно сопровождающихся маловодием, даже при отсутствии пороков развития, нередко связано с наличием у него хромосомной патологии, риск которой, по некоторым данным, составляет 6-16 % [54, 63]. Существенный научный и практический интерес представляет исследование крови, извлеченной при КЦ, для оценки степени нарушения кислотно-основного, биохимического и гормонального состояния плода при осложненном течении беременности. Выяснение клинического значения исследования крови плода актуально и при других осложнениях течения беременности, например, при сахарном диабете у матери.
Риск осложнений при выполнении КЦ минимален, однако его не следует недооценивать. Так, при наличии нарушений развития плода риск КЦ становится существенно выше. По данным литературы, при оценке частоты осложнений КЦ в зависимости от показаний к его проведению, частота прерывания беременности в течение двух недель после операции существенно варьиру-
ет. Она составляла 1,3 %, если выполнялась при неосложненном течении беременности; 6,6 % — в связи с выявлением у плода пороков развития; 13,8 % — в связи с задержкой развития плода и 25 % — в связи с неиммунным отеком у плода [23]. Эти данные согласуются с результатами исследований, проведенных в НИИ акушерства и гинекологии им. Д. О. Отта РАМН [8]. Показано также, что частота осложнений не связана с наличием у беременных женщин локального напряжения миометрия, миоматозных узлов, рубца на матке после операции кесарева сечения и невынашивания беременности в анамнезе.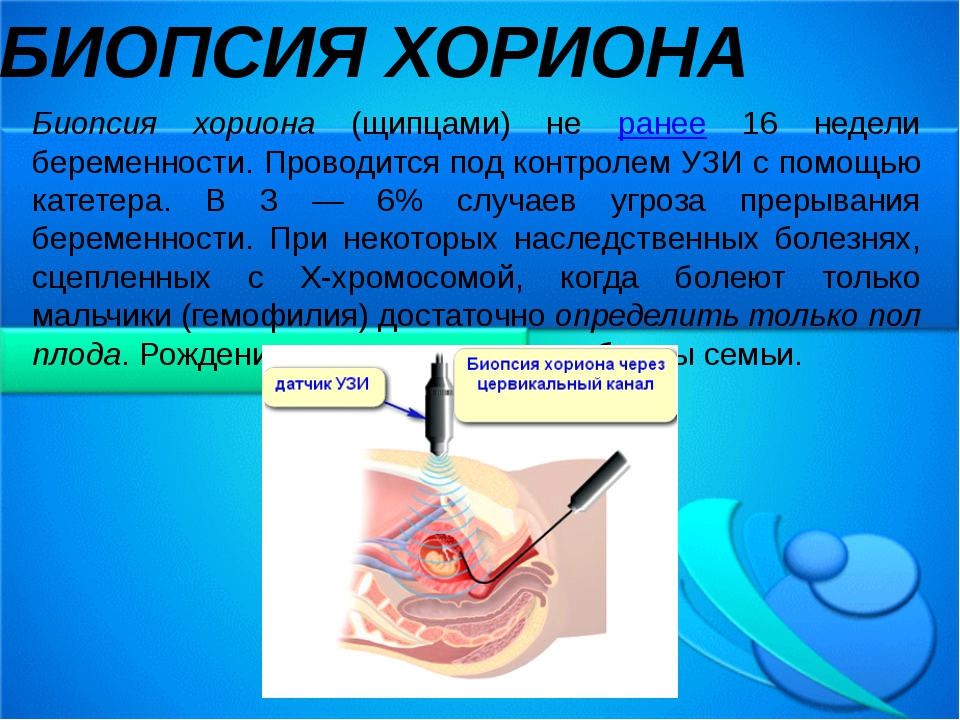 Кроме того, риск осложнений после инвазивных вмешательств не различался при их выполнении как в стационарных, так и в амбулаторных условиях [6].
Кроме того, риск осложнений после инвазивных вмешательств не различался при их выполнении как в стационарных, так и в амбулаторных условиях [6].
Безусловно, важное значение имеют метод, с помощью которого проводился забор крови плода, и срок беременности на момент вмешательства. По данным литературы, пункция внутрипеченочной части вены пуповины или кардиоцентез чаще осложняется повышением до 6,2 % риска антенатальной гибели плода [14]. КЦ обычно выполняется после 20 недель беременности, но его проведение в более ранние сроки не сопряжено с достоверным повышением риска прерывания беременности [61].
Кровотечения из места пункции сосуда пуповины после извлечения иглы отмечаются достаточно часто, приблизительно в 40 % случаев. Из них только в 4-20 % случаев кровотечение имеет длительность свыше 60 секунд. При пункции артерии пуповины частота, интенсивность и длительность кровотечений существенно больше, чем при пункции вены пуповины.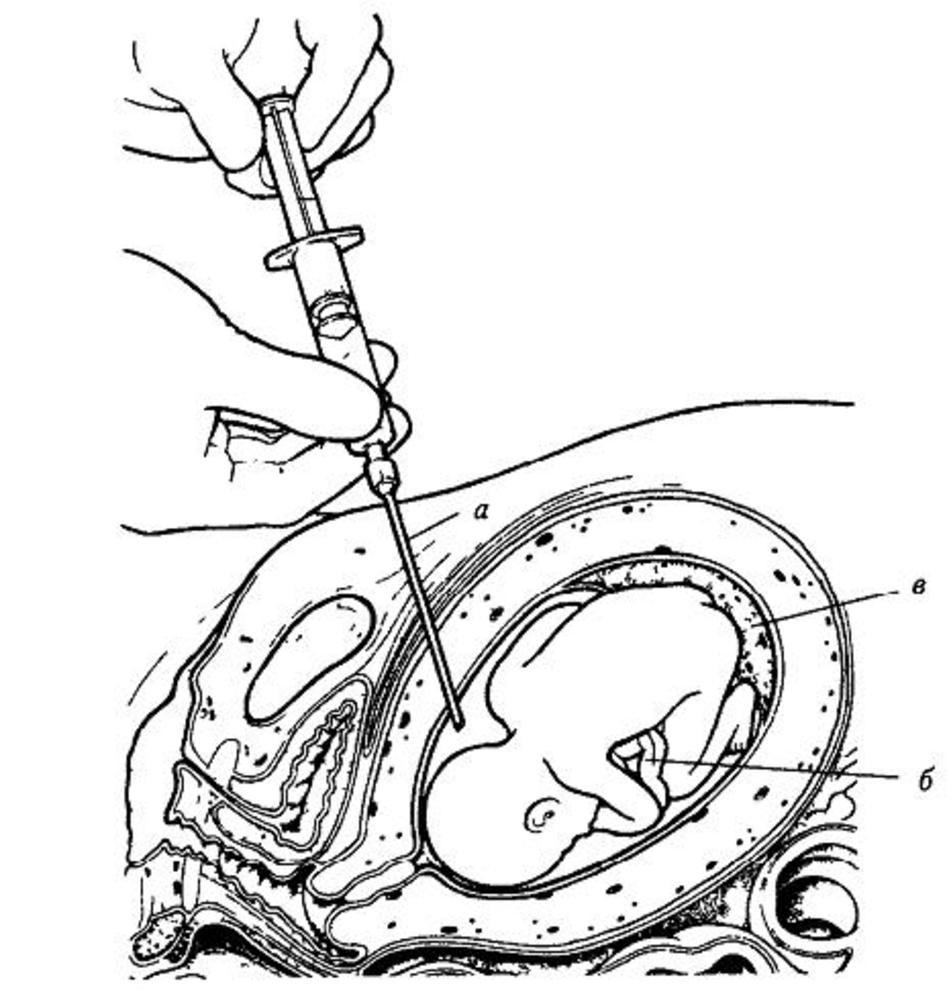 Увеличение длительности и частоты кровотечений отмечено при использовании пункционных игл диаметром больше чем 22G, а также при тромбоцитопении у плода. При трансплацентарно-трансамниональ-ном кордоцентезе в 40 % случаев могут наблюдаться кровотечения в амниотическую полость из плодовой части плаценты. Обычно источником кровотечения являются межворсинчатые пространства плаценты, содержащие кровь матери. Несмотря на высокую тромбопластическую активность околоплодной жидкости, во избежание серьезных кровотечений при использовании трансплацентарного доступа необходимо исключить прохождение пункционной иглы через участки расширения межворсинчатого пространства и краевые синусы плаценты. Кровотечения из места пункции стенки матки при трансамнио-нальном доступе обычно не наблюдаются [23].
Увеличение длительности и частоты кровотечений отмечено при использовании пункционных игл диаметром больше чем 22G, а также при тромбоцитопении у плода. При трансплацентарно-трансамниональ-ном кордоцентезе в 40 % случаев могут наблюдаться кровотечения в амниотическую полость из плодовой части плаценты. Обычно источником кровотечения являются межворсинчатые пространства плаценты, содержащие кровь матери. Несмотря на высокую тромбопластическую активность околоплодной жидкости, во избежание серьезных кровотечений при использовании трансплацентарного доступа необходимо исключить прохождение пункционной иглы через участки расширения межворсинчатого пространства и краевые синусы плаценты. Кровотечения из места пункции стенки матки при трансамнио-нальном доступе обычно не наблюдаются [23].
При ультразвуковом исследовании образование гематом в месте пункции пуповины в большинстве случаев не определяется. Однако при исследовании пуповины у плодов, родоразрешен-
ных в течение 48 часов после КЦ, в 17 % случаев обнаружены незначительные гематомы, которые не проявляли себя клинически при кардиотоко-графическом и допплерометрическом наблюдении. Образование больших гематом в месте пункции описано в единичных случаях [45].
Образование больших гематом в месте пункции описано в единичных случаях [45].
Более чем в 40 % случаев после КЦ в крови у беременных женщин определяется повышение уровня альфа-фетопротеина, что говорит о развитии плодово-материнских микрогемотрансфузий, которые могут привести к изоиммунизации. При трансплацентарном доступе вероятность микро-трансфузий в 3-4 раза выше. Профилактика изо-иммунизации является обязательной [48].
Хориоамнионит — одна из основных причин перинатальной смертности после КЦ, встречается приблизительно в 1 % случаев. Описаны случаи гибели плодов, в тканях которых после КЦ обнаруживали стрептококк группы В, коринебак-терии и др. В некоторых перинатальных центрах при проведении КЦ профилактически назначают применение антибиотиков [23, 27].
КЦ не вызывает достоверного увеличения числа преждевременных родов. В группе женщин, подвергшихся вмешательству, частота преждевременных родов соответствует популяционной и составляет 5-6 %. В 7 % случаев непосредственно после КЦ отмечается повышение тонуса матки, которое может потребовать корригирующей терапии. Отслойка плаценты является очень редким осложнением КЦ. Она встречается в 0,1-0,3 % случаев, обычно как позднее осложнение, непосредственно не связанное с операцией [23].
В 7 % случаев непосредственно после КЦ отмечается повышение тонуса матки, которое может потребовать корригирующей терапии. Отслойка плаценты является очень редким осложнением КЦ. Она встречается в 0,1-0,3 % случаев, обычно как позднее осложнение, непосредственно не связанное с операцией [23].
Самопроизвольно проходящая кратковременная брадикардия у плода, возникающая сразу после КЦ, встречается сравнительно часто (3-12 %). Выраженная брадикардия чаще имеет место при исходно нарушенном состоянии плода при осложненном течении беременности: задержке развития плода, наличии у него выраженной анемии и нарушения кислотно-основного состояния крови.
Даже при наименее травматичном трансамни-ональном подходе к пуповине КЦ связан с неизбежным повреждением стенки матки и эндотелия сосудов пуповины. В экспериментах на овцах показано, что при повреждении эндотелия сосудов пуповины происходит высвобождение определенного количества вазоактивных веществ, которые играют заметную роль в регуляции фетоплацен-тарного кровообращения [15]. Эндотелий является источником широкого спектра вазоактивных веществ, к которым, в частности, относятся про-стациклины, эндотелиальный релаксирующий фактор (N0), эндотелиины. При этом взаимодействие вазорелаксирующих и вазоконстриктор-ных агентов поддерживает оптимальный тонус
Эндотелий является источником широкого спектра вазоактивных веществ, к которым, в частности, относятся про-стациклины, эндотелиальный релаксирующий фактор (N0), эндотелиины. При этом взаимодействие вазорелаксирующих и вазоконстриктор-ных агентов поддерживает оптимальный тонус
сосудов фетоплацентарной системы [3]. Одним из основных вазоактивных веществ, влияющих на тонус гладкомышечной мускулатуры сосудов, является оксид азота, выделение которого приводит к релаксации сосудов и уменьшению периферического сосудистого сопротивления [18]. Механизм высвобождения оксида азота при травме эндотелия еще до конца не изучен.
Считается, что при повреждении сосудистой стенки происходит активизация фермента эндо-телиальной NO-синтазы, запускающей механизм высвобождения оксида азота [60]. Клинические исследования гемодинамики плода в ответ на ин-вазивные вмешательства показали, что после выполнения КЦ происходит снижение сосудистой резистентности кровотоку в сосудах плаценты. Это проявляется в уменьшении допплерометрических индексов [30]. Вместе с тем, при травматизации эндотелия вены пуповины происходит значительное выделение мощного вазоконстриктора — эндоте-лиина [49]. Действуя как Са2+-мобилизирующий агент, эндотелиин способен приводить к сокращению сосудов плодово-плацентарной системы, при этом по мощности воздействия на фетальные сосуды он в 30 раз превосходит ангиотензин II.
Это проявляется в уменьшении допплерометрических индексов [30]. Вместе с тем, при травматизации эндотелия вены пуповины происходит значительное выделение мощного вазоконстриктора — эндоте-лиина [49]. Действуя как Са2+-мобилизирующий агент, эндотелиин способен приводить к сокращению сосудов плодово-плацентарной системы, при этом по мощности воздействия на фетальные сосуды он в 30 раз превосходит ангиотензин II.
Таким образом, КЦ не следует рассматривать как простое и совершенно безопасное инвазивное вмешательство. К этой операции следует прибегать в том случае, когда другие возможности получения плодного материала уже исчерпаны. Нам представляется малооправданным предпочтение КЦ для кариотипирования плода перед другими инвазивными вмешательствами, которое наблюдается в некоторых отечественных центрах ПД.
Важно напомнить, что забор крови плода в целях ПД является хирургической операцией, которая должна проводиться высококвалифицированными специалистами. Хирург должен иметь значительный опыт ультразвуковой диагностики в акушерстве и гинекологии, а также опыт выполнения других манипуляций, связанных с ПД. После приобретения определенных навыков хирург допускается к проведению операции КЦ под контролем более опытного врача и предпочтительно у пациенток, которым планируется прерывание беременности по медицинским показаниям во II триместре беременности [32]. Недостаточный практический опыт приводит к увеличению частоты прерываний беременности [47]. Наш опыт работы подтверждает это положение. Выполняемые нерегулярно, от случая к случаю, такие процедуры могут представить определенный риск для здоровья пациентки, и величина этого риска пропорциональна опыту и квалификации оперирующего акушера-гинеколога.
Хирург должен иметь значительный опыт ультразвуковой диагностики в акушерстве и гинекологии, а также опыт выполнения других манипуляций, связанных с ПД. После приобретения определенных навыков хирург допускается к проведению операции КЦ под контролем более опытного врача и предпочтительно у пациенток, которым планируется прерывание беременности по медицинским показаниям во II триместре беременности [32]. Недостаточный практический опыт приводит к увеличению частоты прерываний беременности [47]. Наш опыт работы подтверждает это положение. Выполняемые нерегулярно, от случая к случаю, такие процедуры могут представить определенный риск для здоровья пациентки, и величина этого риска пропорциональна опыту и квалификации оперирующего акушера-гинеколога.
Представляется целесообразным затронуть также вопрос о некоторых организационно-методичес-
ких аспектах применения инвазивных внутрима-точных вмешательств. Являясь неотъемлемой частью ПД наследственных и врожденных болезней, данное клиническое направление всегда находится в зависимости от общих алгоритмов ПД и применяемых в каждом перинатальном центре или стране лабораторных технологий. Например, во Франции, как и в большинстве зарубежных стран, абсолютное большинство инвазивных вмешательств с целью ПД составляет амниоцентез, что связано с широким использованием методики культивирования амниоцитов. В то же время, в нашей стране и в странах ближнего зарубежья удельный вес амниоцентеза среди других инвазив-ных вмешательств невысок. Доминирующими ин-вазивными методами в России остаются хорион-биопсия и плацентобиопсия. В последнее время в ряде диагностических центров отмечается явная тенденция к более широкому использованию кор-доцентеза. По нашему мнению, такое увлечение, скорее всего, отражает слабую организацию цито-генетической службы в соответствующих центрах и недостатки в организации медико-генетической службы [9].
Являясь неотъемлемой частью ПД наследственных и врожденных болезней, данное клиническое направление всегда находится в зависимости от общих алгоритмов ПД и применяемых в каждом перинатальном центре или стране лабораторных технологий. Например, во Франции, как и в большинстве зарубежных стран, абсолютное большинство инвазивных вмешательств с целью ПД составляет амниоцентез, что связано с широким использованием методики культивирования амниоцитов. В то же время, в нашей стране и в странах ближнего зарубежья удельный вес амниоцентеза среди других инвазив-ных вмешательств невысок. Доминирующими ин-вазивными методами в России остаются хорион-биопсия и плацентобиопсия. В последнее время в ряде диагностических центров отмечается явная тенденция к более широкому использованию кор-доцентеза. По нашему мнению, такое увлечение, скорее всего, отражает слабую организацию цито-генетической службы в соответствующих центрах и недостатки в организации медико-генетической службы [9].
Совершенствование и внедрение новых методов обследования, распространение алгоритмов ПД в масштабах города, региона или страны также влияют на структуру и динамику различных типов инвазивных процедур. Как следует из рисунка и таблицы, введение в Санкт-Петербурге в конце 2001 года биохимического скрининга всех беременных II триместра, утверждение новых региональных нормативных документов по ПД [12] и, наконец, смещение приоритетов последних лет в пользу ПД на более ранних сроках беременности оказывают существенное влияние на динамику и методы инвазивной диагностики.
Как следует из рисунка и таблицы, введение в Санкт-Петербурге в конце 2001 года биохимического скрининга всех беременных II триместра, утверждение новых региональных нормативных документов по ПД [12] и, наконец, смещение приоритетов последних лет в пользу ПД на более ранних сроках беременности оказывают существенное влияние на динамику и методы инвазивной диагностики.
Вместе с тем, независимо от этих особенностей, важно помнить о неукоснительном соблю-
70 60 50 40 30 20 10 0
62
42—
25 13
I
I Хорионбиопсия Плацентобиопсия Кордоцентез
37.
J27
36
-Ц2
t
2001 2002 2003 2004 2005 2006
Рис. Динамика и вид инвазивных вмешательств, проведенных в НИИ акушерства и гинекологии им. Д. О. Отта РАМН с целью пренатальной диагностики врожденных и наследственных болезней (2001-2006 годы)
Динамика и вид инвазивных вмешательств, проведенных в НИИ акушерства и гинекологии им. Д. О. Отта РАМН с целью пренатальной диагностики врожденных и наследственных болезней (2001-2006 годы)
Таблица
Количество и вид инвазивных вмешательств, проведенных в НИИ акушерства и гинекологии им. Д. О. Отта РАМН с целью пренатальной диагностики врожденных и наследственных болезней (2001-2006 годы)
Вид вмешательства Абсолютное число инвазивных вмешательств за указанный период Всего
2001 2002 2003 2004 2005 2006 Абсолютное число %
Хорионбиопсия 271 205 251 371 285 319 1702 34
Плацентобиопсия 292 501 416 342 325 263 2139 43
Кордоцентез 82 106 231 290 286 188 1183 23
Всего 645 812 898 1003 896 770 5024 100
% осложнений 0,32 0,33 0,35 0,49 0,31 0,39 — —
дении основных рекомендаций Европейской ассоциации перинатальной медицины, которыми должен руководствоваться врач, выполняющий инвазивные вмешательства с целью получения плодного материала [9, 48].
Литература
1. Бахарев В. А. Пренатальная диагностика / Бахарев В. А. // Диагностика и лечение врожденных и наследственных заболеваний у детей: путеводитель по клинической генетике. — М.: Триада-Х, 2004. — С. 351-406.
2. Бочков Н. П. Клиническая генетика / Бочков Н. П. — М.: ГЭОТАР-МЕД, 2004. — 475 с.
3. Громыко Г. Л. Современные представления о механизме регуляции кровообращения в плаценте при физиологической и осложненной беременности / Громыко Г. Л., Шпаков А. О. // Вестн. Рос. ассоц. акуш.-гин. — 1995. — № 4. — С. 35-41.
4. Кази З. Пренатальная диагностика пола плода и некоторых моногенных заболеваний в первом триместре беременности с помощью биопсии хориона: автореф. дис. … канд. мед. наук. — М., 1979. — 19 с.
5. Михайлов А. В. Внутриматочные вмешательства под ультразвуковым контролем во время беременности / Михайлов А. В. // Клиническое руководство по ультразвуковой диагностике. Т. 2 / Ред. В. В. Митьков, М. В. Медведев. — М.: Видар, 1996. — С. 280-302.
Михайлов А. В. Внутриматочные вмешательства под ультразвуковым контролем во время беременности / Михайлов А. В. // Клиническое руководство по ультразвуковой диагностике. Т. 2 / Ред. В. В. Митьков, М. В. Медведев. — М.: Видар, 1996. — С. 280-302.
6. Михайлов А. В. Клинико-патофизиологические аспекты внутриматочных вмешательств в целях диагностики и лечения врожденных и наследственных заболеваний плода: автореф. дис. … д-ра мед. наук. — СПб., 1999. — 39 с.
7. Наследственные болезни / Баранов В. С., Горбунова В. Н., Вахарловский В. Г. [и др.] // Медицинская лабораторная диагностика. Т. 3. — СПб.: Интермедика, 1997. — С. 203-227.
8. Пренатальная диагностика в акушерстве: современное состояние, методы, перспективы: метод. пособие / Кузнецова Т. В., Вахарловский В. Г., Баранов В. С. [и др.]. — СПб.: Изд-во Н-Л, 2002. — 64 с.
9. Пренатальная диагностика наследственных и врожденных болезней / Ред. Э. К. Айламазян, В. С. Баранов. — М.: МЕДпресс-информ, 2006. — 416 с.
Пренатальная диагностика наследственных и врожденных болезней / Ред. Э. К. Айламазян, В. С. Баранов. — М.: МЕДпресс-информ, 2006. — 416 с.
10. Розовский В. С. Определение пола плода в первом триместре беременности / Розовский В. С., Кази З., Бахарев В. А. // Акуш. и гин. — 1980. — № 8. — С. 35-37.
11. Цитогенетические методы / Кузнецова Т. В., Логинова Ю. А., Чиряева О. Г. [и др.] // Медицинская лабораторная диагностика. Т. 2. — СПб.: Интермедика, 1999. — С. 551.
12. Частота, диагностика, профилактика наследственных болезней и врожденных пороков развития в Санкт-Петербурге / Баранов В. С., Романенко О. П., Симаходский А. С. [и др.]; Ред. И. А. Красильников. — СПб., 2004. — 128 с.
13. Brambati B. Chorion villus sampling: an analysis of the obstetrics experience of 1000 cases / Brambati B. , Oldrin A., Ferrazzi E., Lanzani A. // Prenatal Diagn. — 1987. — Vol. 7. — P. 157-169.
, Oldrin A., Ferrazzi E., Lanzani A. // Prenatal Diagn. — 1987. — Vol. 7. — P. 157-169.
14. Cardiocentesis: An alternative method of fetal blood sampling for the prenatal diagnosis of hemoglobinopathies / Antsa-kis A. L., Papantoniou N. E., Mesogilitis S. A. [et al.] // Obstet. Gynecol. — 1992. — Vol. 79. — P. 630.
15. Chang J.-M. Effect of endothelium-derived relaxing factor inhibition on the umbilical circulation in fetal lamb in utero / Chang J.-M., Roman C., Heymann M. A. // Am. J. Obstet. Gynecol. — 1992. — Vol. 166. — P. 727-734.
16. Chorionic villus sampling and placental biopsy / Holzgreve W., Miny P. // High Risk Pregnancy / Eds. D. K. James, P. J. Steer, C. P. Weiner, B. Gonik. — London, 1996. — P. 635-643.
17. Chorionic villus sampling: Quality control-m-A continuous improvement model / Boehm F. H., Salyer S. L., Dev V. G. [et al.] // Am. J. Obstet. Gynecol. — 1993. — Vol. 168. — P. 1766-1777.
H., Salyer S. L., Dev V. G. [et al.] // Am. J. Obstet. Gynecol. — 1993. — Vol. 168. — P. 1766-1777.
18. Collier J. Physiological impotance of nitric oxide an endogenous nitrovasodilatator / Collier J., Vallance P. // Br. J. Med. — 1991. — Vol. 302. — P. 1289-1290.
19. Daffos F. Fetal blood sampling via the umbilical cord using a needle guided by ultrasound. Report of 66 cases / Daffos F., Capella-Pavlovsky M., Forestier F. // Prenat. Diagn. — 1983. — Vol. 3.— P. 271-277.
20. Department of Obstetrics and Gynecology, Tietung Hospital of Anshan Iron and Steel Co. Anshan, China. Fetal sex prediction by sex chromatin of chorion cells sampling during early pregnancy // Chinese Medical J. — 1975. — Vol. 1. — P. 117-126.
21. Dolk H. Chorionic villus sampling and limb abnormalities / Dolk H. , Bernard F., Leshat M. F. // Lancet. — 1992. — Vol. 339. — P. 876-877.
, Bernard F., Leshat M. F. // Lancet. — 1992. — Vol. 339. — P. 876-877.
22. Efficient direct chromosome analyses and enzyme determinations from chorionic villi samples in first trimester of pregnancy / Simoni G., Brambati B., Danesino C. [et al.] // Hum. Genet. — 1983. — Vol. 63. — P. 349-357.
23. Fetal blood sampling and pregnancy loss in relation to indication / Maxwell D. J., Johnson P., Hurley P. [et al.] // Br. J. Obstet. Gynecol. — 1991. — Vol. 98. — P. 892.
24. Fetal blood sampling in utero / Kan Y. W., Valenti C., Guidotti R. [et al.] // Lancet. — 1974. — Vol. i.— P. 79-80.
25. Froster U. G. Limb defects and chorionic villus sampling: Results from an international registry. 1992-1994 / Froster U. G., Jackson L. // Lancet. — 1996. — Vol. 347. — P. 489.
26. Garden A. S. Chorion villus sampling / Garden A. S., Reid G., Benzie R. J. // Lancet. — 1985. — Vol. 325. — P. 1270.
Garden A. S. Chorion villus sampling / Garden A. S., Reid G., Benzie R. J. // Lancet. — 1985. — Vol. 325. — P. 1270.
27. Giovangrandi Y. Fetal infection / Giovangrandi Y., Weiner C. P., Smoleniec J., Brettes J. P. // High risk pregnancy / Eds. D. K. James, P. J. Steer, C. P. Weiner, B. Gonik. — London, 1996. — P. 841-870.
28. Goldberg M. F. First trimester prenatal diagnosis using endocervical lavage: a negative evaluation / Goldberg M. F., Chen A., Ahn Y. W., Reidy J. A. // Am. J. Obstet. Gynecol. — 1980. — Vol. 138. — P. 436-439.
29. Hahnemann N. Genetics diagnosis in the embrio by means biopsy from extra embryonic membranes / Hahnemann N., Mohr J. // Bull. Europ. Soc. Hum. Genet. — 1968. — Vol. 2. — P. 29-32.
30. HecherK. The effect of cordocentesis on umbilical and middle cerebral artery blood flow velocity waveforms / Hecher K. , Spensor R., Szalay S. // Br. J. Obstet. Gynaecol. — 1993. — Vol. 100. — P. 828-831.
, Spensor R., Szalay S. // Br. J. Obstet. Gynaecol. — 1993. — Vol. 100. — P. 828-831.
31. Hobbins J. C. In utero diagnosis of hemoglobinopathies: technic for obtaining fetal blood / Hobbins J. C., Mahoney M. // New Engl. J. Med. — 1974. — Vol. 290. — P. 1065-1067.
32. Instructional model for percutaneous fetal umbilical blood sampling / Angel J. L., O’Brien W. F., Michelson J. A. [et al.] // Obstet. Gynecol. — 1989. — Vol. 73. — P. 669.
33. International fetoscopic group. The status of fetoscopy and fetal tissue sampling // Prenat. Diagn. — 1984. — Vol. 4. — P. 79-81.
34. Jackson L. G. Risks of chorionic villus sampling / Jackson L. G., Wapner R. J. // Clin. Obset. Gynec. — 1987. — Vol. 1. — P. 513.
35. Jacobson C. B. Intrauterine diagnosis and management of genetic defects / Jacobson C. B., Barter R. N. // Am. J. Obstet. Gynecol. — 1967. — Vol. 99. — P.795-807.
B., Barter R. N. // Am. J. Obstet. Gynecol. — 1967. — Vol. 99. — P.795-807.
36. Kazy Z. Chorion biopsy in early pregnancy: a method for early prenatal diagnosis for inherited disorders / Kazy Z., Rozovsky I. S., Bakharev V. A. // Prenat. Diagn. — 1982. — Vol. 2. — P. 39-45.
37. Kullander S. Fetal chromosome analysis after transcervical placental biopsies during early pregnancy / Kullander S., Sandahl B. // Obstet. Gynecol. Scand. — 1973. — Vol. 52. — P. 355-359.
38. Limb abnormalities and chorion villus sampling [Letter] / Firth H. V., Boyd P. A., Chamberline P. [et al.] // Lancet. — 1991. — Vol. 338. — P. 51.
39. Lyndon M. H. Invasive ultrasound principles (OB/GYN) / Lyndon M. H. // Diagnostic ultrasound / Eds. J. P. McCrahan, B. B. Goldberg. — Philadelphia, 1997. — P. 77-106.
40. Method of sampling chorionic villi in first trimester of pregnancy under guidance of real time ultrasound / Ward R. H. T., Model B., Petrou M. [et al.] // Brit. Med. J. — 1983. — Vol. 286. — P. 1542-1544.
41. Methods of chorionic villus sampling / Brambati B., Oldrini A. // Chorionic villus sampling / Ed. Brambati B. — N.-Y.: Livingstone, 1986. — P. 73-97.
42. Mohr J. Fetal genetics diagnosis: development of techniques for early sampling of fetal cells / Mohr J. // Acta Patholog. Microbiolog. Scand. — 1968. — Vol. 73. — P. 73-77.
43. Nadler H. Antenatal detection of hereditary disorders / Nadler H. // Pediatrics. — 1968. — Vol. 42. — P. 912-918.
44. NicolaidesK.H. Comparison of chorion villus sampling and early amniocentesis for kariotyping in 1492 singleton pregnancies / Nicolaides K. H., Brizot M. L., Patel F., Snijders R. J. M. // Fetal Diagn. Ther. — 1996. — Vol. 11. — P. 9-15.
H., Brizot M. L., Patel F., Snijders R. J. M. // Fetal Diagn. Ther. — 1996. — Vol. 11. — P. 9-15.
45. Percutaneous fetal umbilical blood sampling: Procedure safety and normal fetal hematologic indices / Ludomirsky A., Weiner S., Ashmead G. G. [et al.] //Am. J. Perinatol. — 1988. — Vol. 5. — P. 264.
46. Prenatal diagnosis of hemoglobinopathies: a rewiew of 15 cases / Alter B., Modell B., Fairweather D. [et al.] // New Engl. J. Med. — 1976. — Vol. 295. — P. 1437-1439.
47. Pure fetal blood samples obtained by cordocentesis: technical aspects of 322 cases / Boulot P., Deschamps F., Lefort G. [et al.] // Prenat. Diagn. — 1990. — Vol. 10. — P. 93-98.
48. Recommendations and protocols for prenatal diagnosis / Eds. Carrera J. M., Di Renzo G. C. — Barcelona, 1993. — P. 31-42.
49. Release of vasoactive agents during cordocentesis: differences between normal grown and grown-retarded fetuse / Rizzo G., Capponi A., Rinaldo D. [et al.] // Am. J. Obstet. Gynecol. — 1996. — Vol. 175. — P. 563-570.
Release of vasoactive agents during cordocentesis: differences between normal grown and grown-retarded fetuse / Rizzo G., Capponi A., Rinaldo D. [et al.] // Am. J. Obstet. Gynecol. — 1996. — Vol. 175. — P. 563-570.
50. Riis P. Antenatal determination of foetal sex in prevention of hereditary disease / Riis P., Fuchs F. // Lancet. — 1960. — Vol. II. — P. 180-182.
51. Risk evaluation of CVS / Kuliev A. M., Modell B., Jackson L. [et al.] // Prenat. Diagn. — 1993. — Vol. 13. — P. 197-209.
52. Risk factors for cordocentesis and fetal intravascular transfusion / Weiner C. P., Wenstrom K. D., Sipes S. L. [et al.] // Am. J. Obstet. Gynecol. — 1991. — Vol. 165. — P. 1020.
53. Rodeck C. H. Sampling pure fetal blood by fetoscopy in second trimester of pregnancy / Rodeck C. H., Campbell S. // Br. Med. J. — 1978. — Vol. 2. — P. 728-730.
// Br. Med. J. — 1978. — Vol. 2. — P. 728-730.
54. Rote N. S. Fetal blood sampling before labor / Rote N. S. // High risk pregnancy / Eds. D. K. James, P. J. Steer, C. P. Weiner, B. Gonik. — London, 1996. — P. 735-744.
55. Rote N. S. Pathophisiology of Rh-isoimmunisation / Rote N. S. // Clin. Obstet. Gynecol. — 1982. — Vol. 25. — P. 243-253.
56. Seer D. M. Diagnosis of fetal sex in a sex linked hereditary disorders / Seer D. M., Margolis E. // Am. J. Obstet. Gynecol. — 1964. — Vol. 88. — P. 230-232.
57. Severe limb abnormalities after chorion villus sampling at 56-66 days gestation / Firth H. V., Boyd P. A., Chamberline P. [et al.] // Lancet. — 1991. — Vol. 337. — P. 762-763.
58. Statham H. Serum screening for Down’s syndrome: some women’s experiences / Statham H. , Green J. // Br. Med. J. — 1993. — Vol. 307. — P. 174.
, Green J. // Br. Med. J. — 1993. — Vol. 307. — P. 174.
59. Steele M. W. Chromosome analysis of human amniotic fluid cells / Steele M. W., Breg W. T. // Lancet. — 1966. — Vol. I. — P. 383-385.
60. The endovascular contractile system in human placenta. Morphological and immunocytochemical investigation / Graf R., Langer J. U., Schonfelder G. [et al.] // Anat. Embriol. Berl. — 1994. — Vol. 190. — P. 561-568.
61. The risk of early cordocentesis (12-21 weeks): Analysis of 500 procedures / Orlandi F., Damiani G., Jakil C. [et al.] // Prenat. Diagn. — 1990. — Vol. 10. — P. 425.
62. The safety and efficacy of chorionic villus sampling for early prenatal diagnosis of cytogenetic abnormalities / Rhoads G. G., Jackson I. G., Schlesselman S. E. [et al.] // N. Engl. J. Med. — 1989. — Vol. 320. — P. 609-619.
320. — P. 609-619.
63. Weiner C. P. Fetal hemolytic disease / Weiner C. P. // High risk pregnancy / Eds. D. K. James, P. J. Steer, C. P. Weiner, B. Gonik. — London, 1996. — P. 783-801.
INVASIVE MANIPULATIONS IN PRENATAL DIAGNOSIS FOR INHERITED DISEASES
Koroteev A. L.
■ Summary: Invasive manipulations are among most important stages of prenatal diagnostics. Invasive manipulations are performed under direct ultrasound control and aim getting material for laboratory study. Historical and own experience of invasive procedures — amniocentesis, chorionic villi sampling (CVS), placentocentesis and cordocentesis — are discussed. The examples of invasive manipulations influence on health of both mother and fetus are given. Guidelines on timing and techniques are suggested to decrease a risk and increase efficiency of prenatal diagnosis.
■ Key words: invasive procedures; amniocentesis; chorionbiopsy; placentobiopsy; cordocentesis
На базе медикогенетической консультации, отделения ультразвуковой диагностики и гинекологического отделения Республиканской больницы проводится пренатальная инвазивная диагностика врожденных и наследственных заболеваний плода
Дородовая диагностика хромосомых аберраций (ХА)остается одной из основных проблем пренатальной диагностики (ПД). По данным ВОЗ более половины всех наследственных заболеваний обусловлены хромосомными аномалиями, частота которых составляет 6,9 на 1000 населения. Около 5% мертворожденных детей имеют ХА. Патология хромосом является причиной многих врожденных пороков развития. Например пороки сердца встречаются у 8 – 10 новорожденных из 1000, при этом 50% этих пороков вызваны ХА. Частота ХА у плодов значительно выше, чем у новорожденных, поскольку эта патология в большинстве случаев приводит к антенатальной гибели. Многочисленными исследованиями доказано, что до 70% самопроизвольных прерываний беременностей во все сроки происходит по причине ХА.
Многочисленными исследованиями доказано, что до 70% самопроизвольных прерываний беременностей во все сроки происходит по причине ХА.
С января 2004 года на базе медикогенетической консультации (МГК), отделения ультразвуковой диагностики (УЗД) и гинекологического отделения Республиканской больницы проводитсяпренатальная инвазивная диагностика врожденных и наследственных заболеваний плода и определение пола ребенка с 10 недель беременности. Инвазивными методами пренатальной диагностики (ПД) называются внутриматочные вмешательства под ультразвуковым контролем, выполняемые в операционных условиях с целью получения плодного материала для последующих анализов.
Эта диагностика позволяет во время беременности выявить врожденные и наследственные заболевания плода (например, болезнь Дауна), которые другими методами диагностировать невозможно.
Показания для направления на инвазивную ПД:
- ультразвуковые маркеры хромосомных болезней плода
- высокий риск болезни Дауна по результатам биохимического скрининга в 16-20 недель беременности,
- наличие в семье ребенка с болезнью Дауна, другими хромосомными заболеваниями или с множественными врожденными пороками развития,
- семейное носительство хромосомных перестроек, моногенных заболеваний,
- возраст женщины старше 35 лет.

Диагностические процедуры проводятся специалистами высшей квалификационной категории в специальной операционной на высокотехнологическом оборудовании под ультразвуковым контролем. Исследование материала осуществляется по современным цитогенетическим методикам. Точность диагностики составляет 99,9%.
В зависимости от срока беременности материал для анализа берется:
- из хориона — при сроке беременности 10-14 недель (аспирация ворсин хориона),
- из плаценты — при сроке беременности 15-17 недель (плацентобиопсия),
- из вены пуповины плода — при сроке беременности 20-24 недели (кордоцентез).
При недостаточном количестве клеток в полученном материале требуется повторная диагностическая манипуляция.
После проведения манипуляции пациентки в течение трех часов наблюдаются в гинекологическом отделении и выписываются после ультразвукового контроля состояния плода и места пункции.
Риск прерывания беременности в течение первых двух недель после манипуляции согласно нашим данным составляет от 0,2% до 1,2%, что соответствует среднероссийским показателям. За последние два года случаев прерывания беременности не было
Сроки получения цитогенетического ответа:
- через 2 дня — после хорион- и плацентобиопсии,
- через 5 дней — после кордоцентеза.
За период работы выполнено более 260 инвазивных диагностических процедур.Диагностированы синдромы:
- Дауна — у 15 плодов,
- Эдвардса — у 3 плодов,
- Патау — у 1 плода,
- Другие хромосомные болезни — у 2 плодов.
По желанию женщин беременности прерваны. Во всех случаях диагноз был подтвержден.
Удалось предотвратить рождение 21 ребенка с тяжелыми, неизлечимыми наследственными заболеваниями.
Адрес медико-генетической консультации ГУЗ «Республиканская больница им. В.А.Баранова»:
В.А.Баранова»:
г.Петрозаводск, Леной проспект, д.40, клинико-диагностический центр.
Заведующая МГК
Новожилова Тамара Семеновна
Врач генетик высшей категории.
Контактный телефон: (8142) 753-517.
НИИ акушерства и гинекологии им. Д.О.Отта РАМН › ДокторПитер.ру
Научно-исследовательский институт акушерства и гинекологии им. Д.О. Отта – одно из ведущих медицинских учреждений акушерско-гинекологического профиля. Врачи института оказывают высококвалифицированную медицинскую помощь бесплатно (по полису ОМС и родовому сертификату) и платно (по полису ДМС).
Диагностика
Лаборатория иммунологии:
- диагностика инфекций, передающихся половым путем
- группы крови и резус-фактор
- антиспермальные тела
- изменения работы иммунной системы.
Лаборатория перинатальной биохимии:
Лаборатория пренатальной диагностики врожденных и наследственных заболеваний:
- медико-генетическое консультирование до и во время беременности
- комплексное биохимическое и ультразвуковое обследование для выявления нарушений развития плода в 1-м триместре беременности
- биохимический и ультразвуковой скрининг для выявления женщин групп высокого риска по рождению детей с хромосомными болезнями во 2-м триместре беременности
- безопасные для матери и плода внутриматочные операции под контролем ультразвука (хорионбиопсия, амниоцентез, плацентобиопсия, кордоцентез) с целью получения плодного материала, необходимого для точной лабораторной диагностики наследственных болезней
- все виды современной диагностики генных и хромосомных болезней у плода в 1-м и 2-м триместрах беременности
- консультирование по результатам пренатальной диагностики и обследования функционального состояния плода
- организация и проведение пренатальных консилиумов для определения тактики ведения беременности и родов с привлечением ведущих специалистов института и врачей смежных специальностей
- кариотипирование супружеских пар
- анализ кариотипов при сложных хромосомных перестройках
- выяснение причин мужского и женского бесплодия
- установление отцовства
- уточнение клинических диагнозов моногенных болезней
- выяснение наследственной предрасположенности к бронхиальной астме, остеопорозу, эндометриозу, гестозам, сердечно-сосудистым заболеваниям, диабету, гипертонии, устойчивости к ВИЧ-инфекции.

- диагностика беременности
- ультразвуковое исследование
- внутриматочные операции с целью получения плодного материала выполняемые под ультразвуковым контролем (хорионбиопсия, амниоцентез, кордоцентез)
- кардиотокография
- допплерометрия маточно-плацентарного и плодово-плацентарного кровотока.
Отдел эндокринологии репродукции:
- гормональную недостаточность яичников
- нарушения менструального цикла
- заболевания щитовидной железы
- различные типы сахарного диабета
- заболевания гипофиза
- заболевания надпочечников
- все виды бесплодия (в первую очередь — гормональное)
- наружный генитальный эндометриоз
- невынашивание беременности (обследование и лечение проводится вне и во время беременности)
- гиперпластические заболевания эндометрия
- доброкачественные заболевания молочных желез
- воспалительные заболевания органов малого таза
- дефицит массы тела
- ожирение
- климактерический невроз
- остеопороз
- гирсутизм.

Отделение оперативной гинекологии:
- нарушения репродуктивной функции (бесплодие, невынашивание беременности, внематочная беременность)
- эндометриоз
- аденомиоз
- доброкачественные и злокачественные опухоли матки, яичников, наружных половых органов
- хронические тазовые боли
- миома матки
- полипы эндометрия
- инфекционные и воспалительные заболевания женских половых органов
- спаечная болезнь органов брюшной полости и малого таза
- нарушения менструальной функции в различные возрастные периоды женщины
- аномалии развития женских половых органов
- предменструальный синдром
- синдром склерокистозных яичников
- опущение и выпадение матки
- недержание мочи
- гиперактивный мочевой пузырь
- генитальные свищи.
Отделение физических методов лечения:
- аднексит
- спаечная болезнь
- бесплодие
- угроза прерывания беременности
- токсикоз I половины беременности
- гестоз
- анемии
- гиповитаминоз витамина D.

Отделение физиотерапевтических методов лечения
Отделение анестезиологии и реанимации
Дородовое отделение
Родильное отделение
Послеродовое отделение
Отделение новорожденных
Центр планирования семьи и здоровья женщины
Центр подготовки беременных к родам
История НИИ акушерства и гинекологии им. Д.О. Отта
8(21) сентября 1797 года по инициативе и на средства императрицы Марии Федоровны при участии основоположника отечественного акушерства, великого русского врача-энциклопедиста Н. М. Максимовича-Амбодика был открыт Императорский клинический повивально-гинекологический институт, будущий НИИ акушерства и гинекологии им. Отта. Он стал первым в мире родовспомогательным и одновременно образовательным и научным учреждением, специально предназначенным для оказания помощи беременным женщинам и их детям, а также для подготовки высококвалифицированных кадров в области повивального искусства. В нем был родильный госпиталь на 20 коек и повивальная школа.
В нем был родильный госпиталь на 20 коек и повивальная школа.
Впервые в России в Повивальном институте были применены акушерские щипцы, сконструированы различные инструменты, которые используются и в наше время, обоснованы и внедрены методы антисептики и изоляции для предупреждения «родильной горячки». Здесь же впервые был применен наркоз для длительного обезболивания родов. Также в НИИ акушерства и гинекологии им. Отта впервые в России был осуществлен комплекс мероприятий по оказанию помощи больным с врожденными аномалиями полового развития (полный объем необходимого хирургического вмешательства по перемене пола с гормональной коррекцией, психологической поддержкой).
В 1893 году директором института стал Дмитрий Оскарович Отто. До 1904 года институт находился на набережной реки Фонтанки у Калинкина моста. Но новый директор решил перенести институт в другое место. Специально для института на месте Биржевого сквера по проекту архитектора Л.Н. Бенуа было построено новое здание. А 24 февраля 1904 года состоялось торжественное открытие института.
А 24 февраля 1904 года состоялось торжественное открытие института.
Здание будущего НИИ акушерства и гинекологии соответствовало самым высоким требованиям. В центральном корпусе находились помещения для учебно-научных целей, там же находился актовый зал с органом фирмы «Валькер», музей, библиотека, две аудитории и две операционные. Помещения были оборудованы системой кондиционирования, проводкой стерилизованной воды во все покои, регулируемым по яркости электрическим освещением, системой звуколечения. Каждая постель оборудовалась «театрофоном», по которому передавалась музыка органа.
До 1917 года институт находился под покровительством дома Романовых. В 1917-м он перешел в ведение Наркомздрава РСФСР и стал называться «Государственный клинический акушерско-гинекологический институт». В 1931 году учреждение переименовали в ЦНИ акушерско-гинекологический институт. А в 1988-м НИИ акушерства и гинекологии присвоили имя Д.О. Отта.
Сегодня НИИ акушерства и гинекологии предлагает широкий спектр услуг. Отделения оснащены современным оборудованием, которое позволяет провести полную диагностику будущей мамы и плода. Также для будущих родителей организованы курсы психофизиопрофилактической подготовки беременных.
Отделения оснащены современным оборудованием, которое позволяет провести полную диагностику будущей мамы и плода. Также для будущих родителей организованы курсы психофизиопрофилактической подготовки беременных.
В НИИ им. Д.О. Отта есть отделение интенсивной терапии и реанимации недоношенных детей, где благодаря современным технологиям и опытному персоналу выхаживают даже самых маленьких детей.
Раз в месяц в НИИ акушерства и гинекологии проводится День открытых дверей. Все желающие могут получить подробную информацию о дородовом наблюдении и родах в этом медицинском учреждении.
Лицензия: ott.ru/files/info/licence/licence-2015.pdf
Взятие пробы ворсинок хориона (CVS) | Johns Hopkins Medicine
Что такое биопсия ворсин хориона?
Взятие пробы ворсин хориона (CVS) или биопсия ворсинок хориона — это пренатальный тест, который включает в себя взятие образца ткани из плаценты для выявления хромосомных аномалий и некоторых других генетических проблем. Плацента — это структура в матке, которая обеспечивает кровь и питательные вещества от матери к плоду,
Плацента — это структура в матке, которая обеспечивает кровь и питательные вещества от матери к плоду,
Ворсинки хориона представляют собой крошечные выступы плацентарной ткани, похожие на пальцы и содержащие тот же генетический материал, что и плод.Тестирование может быть доступно для других генетических дефектов и нарушений в зависимости от семейного анамнеза и наличия лабораторных тестов во время процедуры.
CVS обычно выполняется между 10 и 12 неделями беременности. В отличие от амниоцентеза (другой вид пренатального теста), CVS не дает информации о дефектах нервной трубки, таких как расщепление позвоночника. По этой причине женщинам, перенесшим сердечно-сосудистую систему, также требуется повторный анализ крови в период от 16 до 18 недель беременности для выявления дефектов нервной трубки.
Существует два типа процедур CVS:
Трансцервикальный. В этой процедуре катетер вводится через шейку матки в плаценту для получения образца ткани
Трансабдоминальный.
. В этой процедуре игла вводится через брюшную полость и матку в плаценту для получения образца ткани
В этой процедуре игла вводится через брюшную полость и матку в плаценту для получения образца ткани
Другой родственной процедурой, которая может использоваться для диагностики генетических и хромосомных дефектов, является амниоцентез.
Анатомия плода в утробе матери
Амниотический мешок. Это тонкостенный мешок, окружающий плод во время беременности. Мешок заполнен околоплодными водами (жидкостью, производимой плодом) и амнионом (оболочкой, покрывающей плодную сторону плаценты), которая защищает плод от травм и помогает регулировать температуру плода.
Анус. Это отверстие в конце анального канала.
шейка матки. Это нижняя часть матки, которая выступает во влагалище. Шейка матки, состоящая в основном из фиброзной ткани и мышц, имеет круглую форму.
Плод. Еще не родившийся ребенок с восьмой недели после оплодотворения до рождения называется плодом.

Плацента. Это орган в форме лепешки, который растет только во время беременности и обеспечивает обмен веществ между плодом и матерью.(Плод потребляет кислород, пищу и другие вещества и выводит углекислый газ и другие отходы.)
Пуповина. Это веревка, соединяющая плод с плацентой. Пуповина состоит из 2 артерий и вены, которые переносят кислород и питательные вещества к плоду и продукты жизнедеятельности от плода.
Стенка матки. Это стенка матки.
Матка (также называемая маткой). Матка — это полый орган грушевидной формы, расположенный в нижней части живота женщины между мочевым пузырем и прямой кишкой. Она сбрасывает слизистую каждый месяц во время менструации, в которой оплодотворенная яйцеклетка (яйцеклетка) имплантируется и развивается плод.
Вагина.
 Это часть женских половых органов, находится позади мочевого пузыря и перед прямой кишкой. Он образует канал, идущий от матки к вульве.
Это часть женских половых органов, находится позади мочевого пузыря и перед прямой кишкой. Он образует канал, идущий от матки к вульве.
Причины проведения процедуры
Образцы ворсин хориона можно использовать для генетического и хромосомного тестирования в первом триместре беременности.Вот несколько причин, по которым женщина может выбрать CVS:
Ранее пораженный ребенок или семейный анамнез генетического заболевания, хромосомных аномалий или нарушения обмена веществ
Возраст матери старше 35 лет к сроку беременности
Риск генетического заболевания, связанного с полом
Предыдущее ультразвуковое исследование с сомнительными или ненормальными результатами
Аномальный тест внеклеточной ДНК
Ваш врач может порекомендовать взятие пробы ворсин хориона по другим причинам.
Риски процедуры
Как и при любой инвазивной процедуре, могут возникнуть осложнения. Некоторые возможные осложнения могут включать, помимо прочего, следующее:
Спазмы, кровотечение или подтекание околоплодных вод (разрушение воды)
Инфекция
Выкидыш
Преждевременные роды
Дефекты конечностей у младенцев, особенно при процедурах CVS, сделанных до 9 недель (редко)
Люди, страдающие аллергией на лекарства или латекс или чувствительные к ним, должны сообщить об этом своему врачу.
Женщинам, имеющим близнецов или других близнецов, потребуется отбор проб каждой плаценты для изучения каждого ребенка.
В зависимости от вашего состояния могут быть другие риски. Обязательно обсудите любые опасения со своим врачом перед процедурой.
Определенные факторы или условия могут мешать работе CVS. Эти факторы включают, но не ограничиваются, следующее:
Эти факторы включают, но не ограничиваются, следующее:
Беременность раньше семи недель или позже 13 недель
Положение ребенка, плаценты, количество околоплодных вод или анатомия матери
Инфекция влагалища или шейки матки
Образцы, непригодные для тестирования или которые могут содержать материнскую ткань
Перед процедурой
Врач объяснит вам процедуру и предложит вам задать любые вопросы, которые могут у вас возникнуть относительно процедуры.
Вам будет предложено подписать форму согласия, которая дает ваше разрешение на выполнение процедуры. Внимательно прочтите форму и задавайте вопросы, если что-то не понятно.
Как правило, нет никаких особых ограничений в отношении диеты или активности перед забором проб ворсинок хориона.
Сообщите своему врачу, если вы чувствительны или имеете аллергию на какие-либо лекарства, латекс, йод, скотч или анестетики (местные и общие).

Сообщите своему врачу обо всех лекарствах (прописанных и отпускаемых без рецепта) и травяных добавках, которые вы принимаете.
Сообщите своему врачу, если у вас в анамнезе есть нарушения свертываемости крови или если вы принимаете какие-либо антикоагулянты (разжижающие кровь) лекарства, аспирин или любые другие лекарства, которые могут повлиять на свертываемость крови. Возможно, вам придется прекратить прием этих лекарств до процедуры.
Сообщите своему врачу, если у вас отрицательный резус-фактор.Во время процедуры CVS клетки крови матери и плода могут смешиваться. Это может привести к сенсибилизации резус-фактора и разрушению эритроцитов плода. В большинстве случаев пренатальный анализ крови позволяет определить, отрицательный ли у вас резус-фактор. Вас могут попросить предоставить эти лабораторные результаты перед процедурой.
Вас могут попросить или не попросить наполнить мочевой пузырь прямо перед процедурой.
 В зависимости от положения матки и плаценты полный или пустой мочевой пузырь может помочь переместить матку в более удобное положение для процедуры.
В зависимости от положения матки и плаценты полный или пустой мочевой пузырь может помочь переместить матку в более удобное положение для процедуры.В зависимости от состояния вашего здоровья врач может запросить другие специальные препараты.
Во время процедуры
Процедура CVS может проводиться амбулаторно или как часть вашего пребывания в больнице. Процедуры могут отличаться в зависимости от вашего состояния и практики вашего врача.
Обычно процедура CVS следует за этим процессом:
Вам будет предложено раздеться полностью или ниже пояса и надеть больничную одежду.
Вам будет предложено лечь на экзаменационный стол и заложить руки за голову.
Ваши жизненно важные функции (артериальное давление, частота сердечных сокращений и частота дыхания) будут проверены.
Будет проведено ультразвуковое исследование для проверки частоты сердечных сокращений плода, а также положения плаценты, плода и пуповины.
В зависимости от расположения плаценты процедура CVS будет проводиться через шейку матки (трансцервикально) или через брюшную стенку (трансабдоминально).
Для трансцервикальной процедуры CVS:
Врач вставит вам во влагалище инструмент, называемый расширителем, чтобы он или она могли видеть вашу шейку матки.
Ваше влагалище и шейку матки промоют антисептическим раствором.
С помощью ультразвукового контроля тонкую трубку проведут через шейку матки к ворсинкам хориона.
Клетки аккуратно всасывают через трубку в шприц.Вы можете почувствовать покалывание или легкие спазмы. Для получения достаточного количества ткани для исследования может потребоваться более одного образца.
Затем трубка будет удалена.
Для трансабдоминальной процедуры CVS:
Для абдоминальной CVS ваш живот промывают антисептиком. Вас попросят не прикасаться к стерильной области живота во время процедуры.
Врач может ввести местный анестетик, чтобы обезболить кожу.Если используется местный анестетик, вы почувствуете укол иглы при введении анестетика. Это может вызвать кратковременное покалывание.
Ультразвук будет использоваться для ввода длинной тонкой полой иглы через брюшную полость в матку и плаценту. Это может быть немного болезненно, и вы можете почувствовать спазм, когда игла входит в матку.
Клетки осторожно всасывают в шприц. Для получения достаточного количества ткани для исследования может потребоваться более одного образца.
После этого игла будет удалена. На место введения иглы в брюшную полость накладывается пластырь.
Завершение процедуры, оба метода:
Будет произведена повторная оценка частоты сердечных сокращений плода и ваших показателей жизнедеятельности.
Если у вас отрицательный резус-фактор, вам могут назначить иммуноглобулин Rho (D). Это специально разработанный продукт крови, который может предотвратить реакцию резус-отрицательных материнских антител на резус-положительные клетки плода.
Ткань ворсинок хориона будет отправлена в лабораторию.
После процедуры
Некоторое время после процедуры вы и ваш плод будете находиться под наблюдением. Ваши жизненно важные показатели и частота сердечных сокращений плода будут периодически проверяться в течение часа или дольше.
Ткань CVS будет отправлена в специальную генетическую лабораторию для анализа. В зависимости от результатов анализов может быть рекомендована консультация генетика.
В течение нескольких часов после CVS вы можете испытывать легкие спазмы и легкие пятна.
Вам следует отдыхать дома и избегать физических нагрузок в течение как минимум 24 часов. Вы не должны спринцеваться или вступать в половую связь в течение 2 недель или до назначения врача.
Попросите своего врача сообщить о любом из следующего:
Если выполнялась трансабдоминальная процедура, проверьте место перевязки иглы на животе на предмет кровотечения или оттока жидкости.
Ваш врач может дать вам дополнительные или альтернативные инструкции после процедуры, в зависимости от вашей конкретной ситуации.
Методы биопсии для изучения плацентарного ложа человека
Основные моменты
- •
Мы обобщили все исследования с использованием методов биопсии плацентарного ложа.
- •
Средние показатели успеха были рассчитаны для каждого метода.
- •
Мы предложили единый протокол отбора проб из плацентарного ложа.
Реферат
Предпосылки
Физиологическая трансформация спиральных артерий матки в плацентарном ложе человека имеет важное значение для здоровой беременности.Считается, что неудача этого преобразования из-за недостаточной инвазии трофобластов лежит в основе осложнений беременности, таких как преэклампсия, задержка роста плода, выкидыш и преждевременные роды. Понимание инвазивного поведения и свойств ремоделирования трофобластов в стенке матки имеет важное значение для выяснения этиологии этих осложнений беременности. Тем не менее, нет удовлетворительных образцов плацентарного ложа, чтобы расширить наши знания о механизмах, контролирующих инвазию трофобластов.Для получения биопсии из плацентарного ложа можно использовать несколько методов, и обработка образцов может осуществляться по-разному в зависимости от вопроса исследования.
Методы
В этом систематическом обзоре представлен обзор всех исследований, посвященных изучению плацентарного ложа и используемых методов отбора проб. Были включены статьи, описывающие хирургические методы, обращение с образцами, осложнения и / или степень успешности процедуры биопсии плацентарного ложа. Биопсия плацентарного ложа — важный и возможный метод изучения аномалий плацентарного ложа, связанных с осложнениями беременности.
Результаты
В зависимости от используемой техники вероятность взятия пробы спиральной артерии и трофобласта из плацентарного ложа составляет 51–78% на случай без значительных осложнений.
Выводы
Следует проявлять осторожность при интерпретации данных, если плацентарное ложе подвергается труду. Мы предлагаем единообразную методику отбора проб и протокол сохранения для исследования плацентарного ложа и предоставляем инструменты для выбора подходящей техники для будущих сборов с плацентарного ложа.
Ключевые слова
Спиральные артерии
Преэклампсия
Биопсия плацентарного ложа
Методы отбора проб
Extravillous
Инвазия трофобласта
Рекомендуемые статьиЦитирующие статьи (0)
. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Амниоцентез и отбор проб плаценты для предродовой диагностики
Мы включили в общей сложности 16 рандомизированных исследований, в которых приняли участие 33 555 женщин, 14 из которых, как считается, имели низкий риск систематической ошибки.Количество женщин, включенных в исследования, варьировалось от 223 до 4606.
Исследования были разделены на шесть категорий: 1. АК во втором триместре по сравнению с контролем; 2. AC в раннем или втором триместре; 3. CVS по сравнению с AC во втором триместре; 4. Методы CVS; 5. Ранний AC против CVS; и 6. AC с ультразвуком или без него.
В одном исследовании сравнивали AC во втором триместре с отсутствием AC (контроль) в популяции низкого риска (женщины = 4606). Фоновая потеря беременности составила около 2%. AC во втором триместре по сравнению с отсутствием тестирования увеличил общую потерю беременности еще на 1%.Доверительные интервалы (ДИ) вокруг этого избыточного риска были относительно большими (3,2% против 2,3%, среднее отношение рисков (ОР) 1,41, 95% ДИ от 0,99 до 2,00; доказательства среднего качества). В том же исследовании частота самопроизвольных выкидышей также была выше (2,1% против 1,3%; средний ОР 1,60, 95% ДИ 1,02–2,52; доказательства высокого качества). Количество врожденных аномалий было одинаковым в обеих группах (2,0% против 2,2%, средний ОР 0,93, 95% ДИ от 0,62 до 1,39; доказательства среднего качества).
Одно исследование (женщины = 4334) показало, что ранний амниоцентез не был безопасной ранней альтернативой по сравнению с амниоцентезом во втором триместре из-за увеличения общего числа выкидышей (7.6% против 5,9%; средний RR 1,29, 95% ДИ 1,03–1,61; доказательства высокого качества), самопроизвольные выкидыши (3,6% против 2,5%, средний ОР 1,41, 95% ДИ от 1,00 до 1,98; доказательства среднего качества) и более высокая частота врожденных аномалий, включая косолапость (4,7% против 2,7%; в среднем) ОР 1,73, 95% ДИ 1,26–2,38; доказательства высокого качества).
При сравнении потери беременности после CVS с AC во втором триместре наблюдалась клинически значимая неоднородность в размере и направлении эффекта в зависимости от используемого метода (трансабдоминального или трансцервикального), поэтому результаты не были объединены.Только в одном исследовании сравнивали трансабдоминальное CVS с AC во втором триместре (женщины = 2234). Они не обнаружили четкой разницы между двумя процедурами в отношении общего невынашивания беременности (6,3% против 7%; средний ОР 0,90, 95% ДИ от 0,66 до 1,23, доказательства низкого качества), самопроизвольных выкидышей (3,0% против 3,9%; средний ОР 0,77. , 95% ДИ от 0,49 до 1,21; доказательства низкого качества) и перинатальная смертность (0,7% против 0,6%; средний ОР 1,18, 95% ДИ от 0,40 до 3,51; доказательства низкого качества). Трансцервикальный CVS может нести более высокий риск потери беременности (14.5% против 11,5%; средний ОР 1,40, 95% ДИ 1,09–1,81), но результаты были довольно неоднородными.
В пяти исследованиях сравнивали трансабдоминальное и трансцервикальное CVS (женщины = 7978). Не было четких различий между этими двумя методами в отношении выкидышей (средний ОР 1,16, 95% ДИ от 0,81 до 1,65; доказательства очень низкого качества), самопроизвольных выкидышей (средний ОР 1,68, 95% ДИ от 0,79 до 3,58; доказательства очень низкого качества. ) или аномалиями (средний ОР 0,68, 95% ДИ 0,41–1,12; доказательства низкого качества). Мы снизили качество доказательств до низкого из-за разнородности исследований.Трансцервикальный CVS может быть более сложным с технической точки зрения, чем трансабдоминальный CVS, с большим количеством неудач при получении образца (2,0% против 1,1%; средний ОР 1,79, 95% ДИ 1,13–2,82, доказательства среднего качества).
В целом, мы обнаружили доказательства низкого качества результатов при сравнении раннего амниоцентеза с трансабдоминальным CVS. Самопроизвольный выкидыш был единственным исходом, подтвержденным доказательствами среднего качества, что привело к большему количеству выкидышей после раннего AC по сравнению с трансабдоминальным CVS (2,3% против 1.3%; средний ОР 1,73, 95% ДИ 1,15–2,60). Не было четких различий в потерях беременности (средний ОР 1,15, 95% ДИ от 0,86 до 1,54; доказательства низкого качества) или аномалиях (средний ОР 1,14, 95% ДИ от 0,57 до 2,30; доказательства очень низкого качества).
Мы нашли одно исследование, в котором изучали АК с ультразвуком или без него, в котором оценивали тип процедуры с ультразвуковой поддержкой, который сейчас считается устаревшим.
Биопсия ткани плода | Павильон для женщин
Концепция использования ультразвукового контроля для взятия образца ткани плода в качестве средства пренатальной диагностики была впервые описана в 1970-х годах.Эта процедура используется для выявления наследственных состояний плода, которые не могут быть идентифицированы с помощью более традиционных методов, таких как амниоцентез или забор проб плаценты из ворсинок хориона. Например, биопсия кожи плода является важным диагностическим инструментом, который позволяет пациентам, несущим аномальный ген тяжелого кожного заболевания, забеременеть, зная, поражен ли их плод аналогичным образом.
Когда это выполняется?
Биопсию обычно проводят на сроке беременности 17-20 недель.Для обезболивания кожи матери используется местный анестетик. Врач вводит интродьюсер (троакар) в брюшную полость матери и через гестационный мешок для достижения плода под постоянным ультразвуковым контролем. Троакар позволяет проводить биопсийные щипцы, которые используются для получения образца кожи плода — обычно из грудной клетки, спины, ягодиц или иногда кожи головы. При необходимости матери назначают небольшое количество внутривенного седативного средства (например, диазепама). Таким же образом можно диагностировать и другие заболевания, взяв образцы печени или мышц плода.Биопсия печени или мышцы плода выполняется с помощью тонкой иглы (обычно диаметром 16,5 процента) — опять же, под местной анестезией и при необходимости легкой внутривенной седацией матери.
Результаты и риски
Образцы тканей можно анализировать с помощью микроскопа (например, световой и электронной микроскопии), а также множества других тестов, таких как ферменты. Биопсия ткани плода используется для выявления кожных заболеваний, таких как буллезная болезнь, нарушения пигментных клеток и проблемы с правильным развитием эпидермальных придатков (например,г. эктодермальные дисплазии). Со временем биопсия ткани плода станет менее распространенной, поскольку мы улучшим наше понимание того, как наследственные заболевания, связанные с конкретными генами, и как мутации могут быть охарактеризованы с помощью сложного анализа ДНК амниотической жидкости, ткани плаценты или, возможно, фетальных клеток в материнской крови. тираж.
Например, пренатальная диагностика недостаточности орнитин-транскарбамилазы в последнее время упростилась благодаря обнаружению специфических генных мутаций.Хотя это открытие теперь позволяет проводить пренатальную диагностику этого заболевания с помощью анализа ДНК околоплодных вод или плацентарной ткани, все еще есть случаи, когда обычные исследования ДНК не могут быть информативными для обнаруженной мутации. Тогда биопсия печени плода может быть использована в качестве альтернативного диагностического теста.
Основными рисками, связанными с биопсией ткани плода, являются самопроизвольный выкидыш, инфекция, преждевременные роды и возможное кровотечение. В специализированных центрах частота потери плода в результате биопсии кожи составляет менее 5 процентов.
Обзор заборов плаценты. A) Биопсии ткани были взяты из …
Предпосылки: Было высказано предположение, что коррекция процентилей веса потомства (настройка) может улучшить прогноз неблагоприятного исхода беременности; однако этот подход не является общепринятым. Сложность интерпретации данных заключается в том, что в основном методе расчета индивидуальных процентилей используется стандарт роста плода, а результаты множественных анализов сравнивали со стандартами, основанными на массе тела при рождении.Цели: Во-первых, мы стремились определить, отличаются ли женщины, родившие детей с малым для гестационного возраста возрастом с использованием индивидуализированного стандарта, от других женщин. Во-вторых, мы стремились сравнить связь между процентилем массы тела при рождении и неблагоприятным исходом, используя 3 различных метода расчета процентилей: (1) нестандартный стандарт фактической массы тела при рождении, (2) нестандартный стандарт роста плода и (3) полностью адаптированный стандарт роста плода. . Дизайн исследования: Мы проанализировали данные исследования прогноза исходов беременности, проспективного когортного исследования первородящих женщин, родивших в Кембридже, Великобритания, в период с 2008 по 2013 год.Мы использовали комбинированный неблагоприятный исход, а именно перинатальную заболеваемость или преэклампсию. Анализ кривой рабочих характеристик приемника был использован для сравнения трех методов расчета процентилей массы тела при рождении в отношении совокупного неблагоприятного исхода. Результаты: Мы подтвердили предыдущие наблюдения, что рождение ребенка, который был маленьким для гестационного возраста (<10-го процентиля) с использованием полностью индивидуализированного стандарта роста плода, но подходящего для гестационного возраста с использованием нестандартного фактического стандарта веса при рождении, было связано с более высокими показателями. неблагоприятных исходов.Однако мы также заметили, что матери этих младенцев в 3-4 раза чаще страдали ожирением и рожали преждевременно. Когда мы сравнивали риск неблагоприятного исхода из моделей логистической регрессии, которые были подогнаны к процентилям массы тела при рождении, которые были получены каждым из 3 предопределенных методов, области под кривыми рабочих характеристик приемника были одинаковыми для всех 3 методов: 0,56 (95% достоверность интервал, 0,54-0,59) полностью настроен, 0,56 (95% доверительный интервал, 0,53-0,59) нестандартный стандарт веса плода и 0.55 (доверительный интервал 95%, 0,53–0,58) нестандартный стандарт фактической массы тела при рождении. Когда мы классифицировали верхние 5% прогнозируемого риска как высокий риск, методы, в которых использовался стандарт роста плода, показали ослабление после корректировки на гестационный возраст, тогда как стандарт веса при рождении - нет. Дальнейшая корректировка материнских характеристик, включая вес, ослабила связь с индивидуальным стандартом, но не с двумя другими методами. Связи после полной настройки были аналогичными, когда мы сравнивали 3 подхода.Заключение: Независимая связь между процентилем массы тела при рождении и неблагоприятным исходом была аналогичной, когда мы сравнивали фактические стандарты массы тела при рождении и стандарты роста плода и сравнивали индивидуализированные и нестандартные стандарты. Использование стандартов веса плода и индивидуальных процентилей для характеристик матери может привести к более сильной связи с неблагоприятным исходом из-за преждевременных родов и материнского ожирения.
Взятие пробы ворсин хориона — что происходит
Взятие пробы ворсин хориона (CVS) включает забор клеток из ткани плаценты (ворсинок хориона).
Подготовка к CVS
Обычно вам не нужно делать ничего особенного для подготовки к CVS. Вы можете заранее есть и пить как обычно.
В некоторых случаях вас могут попросить не ходить в туалет в течение нескольких часов перед тем, как пройти CVS, потому что иногда легче сделать тест, когда ваш мочевой пузырь полон.
Ваш врач или акушерка расскажут вам об этом до того, как вы придете на прием.
Вы можете привести партнера, друга или члена семьи для поддержки во время прохождения теста.
Как выполняется CVS
CVS проводится под постоянным контролем ультразвукового исследования.
Это делается для того, чтобы ничего не попало в амниотический мешок (защитный мешок, который смягчает ребенка) и не коснется ребенка.
Тест может быть проведен с использованием 2 различных методов: трансабдоминальной CVS и трансцервикальной CVS.
Трансабдоминальный CVS
Кредит:SATURN STILLS / НАУЧНАЯ ФОТОБИБЛИОТЕКА
https: // www.sciencephoto.com/media/548241/view
Ваш животик промывают антисептиком перед инъекцией местного анестетика, чтобы обезболить его.
Игла вводится через кожу в матку и направляется к плаценте, используя изображение на ультразвуковом сканировании.
К игле прикреплен шприц, который используется для взятия небольшого образца клеток из ворсинок хориона.
После удаления образца игла удаляется.
Трансцервикальный CVS
Образец клеток ворсинок хориона собирается через шейку матки (шейку матки).
Тонкая трубка, прикрепленная к шприцу или маленьким щипцам, вводится через влагалище и шейку матки и направляется к плаценте с помощью ультразвукового сканирования.
Какой метод будет использоваться?
В большинстве случаев предпочтение отдается трансабдоминальному методу, так как его зачастую проще выполнить.
Трансцервикальный CVS также с большей вероятностью может вызвать вагинальное кровотечение сразу после процедуры, что случается примерно у 1 из 10 женщин, прошедших эту процедуру.
Но нет никакой разницы в частоте выкидышей между двумя методами.
Трансцервикальный CVS может быть предпочтительнее трансабдоминального CVS, если таким путем легче достичь плаценты.
Болезненно ли CVS?
CVS обычно описывается как неудобный, а не болезненный.
В большинстве случаев инъекция местного анестетика будет сделана перед трансабдоминальной CVS, чтобы обезболить область, в которую вводится игла, но после этого у вас может возникнуть боль в животе.
Трансцервикальный CVS похож на скрининговый тест шейки матки.
Сколько времени это займет?
CVS обычно занимает около 10 минут, хотя вся консультация может занять около 30 минут.
После этого вы будете находиться под наблюдением в течение часа на случай возникновения каких-либо побочных эффектов, таких как сильное кровотечение.
После этого вы можете пойти домой отдохнуть.
Хорошая идея — попросить кого-нибудь отвезти вас домой, поскольку вы сами можете этого не чувствовать.
Восстановление после CVS
После CVS в течение нескольких часов обычно возникают спазмы, похожие на менструальные боли, и легкое вагинальное кровотечение, называемое кровянистыми выделениями.
Вы можете принимать обезболивающие, которые вы можете купить в аптеке или магазине, например парацетамол (но не ибупрофен или аспирин), если испытываете дискомфорт.
Возможно, вы захотите избежать какой-либо физической активности до конца дня.
Как можно скорее обратитесь к акушерке или в больницу, где проводилась процедура, за консультацией, если у вас после этого разовьются какие-либо из следующих симптомов:
- постоянная или сильная боль
- Высокая температура или ощущение жара или дрожь
- Сильное вагинальное кровотечение
- Выделение прозрачной жидкости из влагалища
- схваток
Получение результатов
Первые результаты должны быть доступны в течение нескольких дней.Это скажет вам, было ли обнаружено генетическое или хромосомное заболевание.
Если проверяются и более редкие условия, на получение результатов может уйти от 2 до 3 недель или больше.
Обычно вы можете выбрать, получать ли результаты по телефону или во время личной встречи в больнице или дома.
Узнайте больше о результатах CVS
Последняя проверка страницы: 20 июля 2018 г.
Срок следующей проверки: 20 июля 2021 г.
Служба плацентарной и перинатальной патологии: SLU
SLUCare Pathology обеспечивает ультрасовременное вскрытие плацентарной и перинатальной патологии диагностические услуги для семей, умерших в утробе матери, перинатальной смерти или беременность с неожиданным исходом.Плацентарные случаи и перинатальные вскрытия для плоды менее 500 г оцениваются перинатальными патологами, прошедшими стажировку с большим опытом проведения всесторонних аутопсийных исследований и предоставления консультация в сложных случаях с повышенным риском. Распознавание генетических заболеваний позволяет родителям получить надлежащую консультацию при последующих беременностях.
Мы предлагаем:
- Предварительные результаты на плаценту в большинстве случаев через 48 часов.Предварительные результаты вскрытия отправляются к акушеру в течение 72 часов.
- Интерпретация сложной и рутинной патологии плаценты и перинатальной патологии.
- Экспертная диагностика двойных плацент и оценка синдрома трансфузии близнецов.
- Обсуждение результатов с направившим акушером и членами семьи по запросу.
- Экспертная диагностика редких и распространенных заболеваний плаценты.
- Информацию о вскрытии плода более 500 г см. В Службе аутопсии.
Подготовка и отправка плаценты и плода для перинатального вскрытия
Заявка на вскрытие плаценты и перинатального вскрытия
Запрос по факсу на:
314-977-7898 и 314-977-7879
Отправляйте дела на:
Гистопатологическая лаборатория Кафедра патологии Медицинский факультет Университета Сент-Луиса 1402 С.Гранд бул., К. 462 Сент-Луис, Миссури 63104 314-977-7874Пожалуйста, позвоните в лабораторию, чтобы договориться о доставке в выходные или в нерабочее время.
Результаты Отчеты
доступны в Интернете или могут быть отправлены по факсу в кабинет врача. Если требуется, результаты можно вызвать к врачу.
Комиссия
Служба плацентарной и перинатальной аутопсии поддерживает конкурентоспособную структуру оплаты. Чтобы узнать о конкретных тарифах, позвоните в офис по телефону 314-977-4567.
Для получения дополнительной информации
По медицинским вопросам или информации об услугах обращайтесь к доктору Саре Старнс по адресу 314-419-8050 или по электронной почте perinatalpath @ slu.

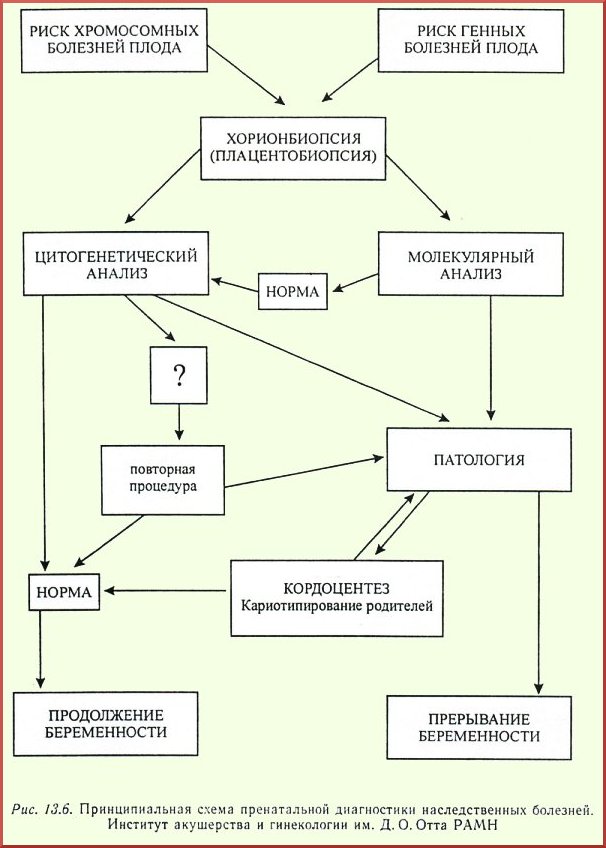
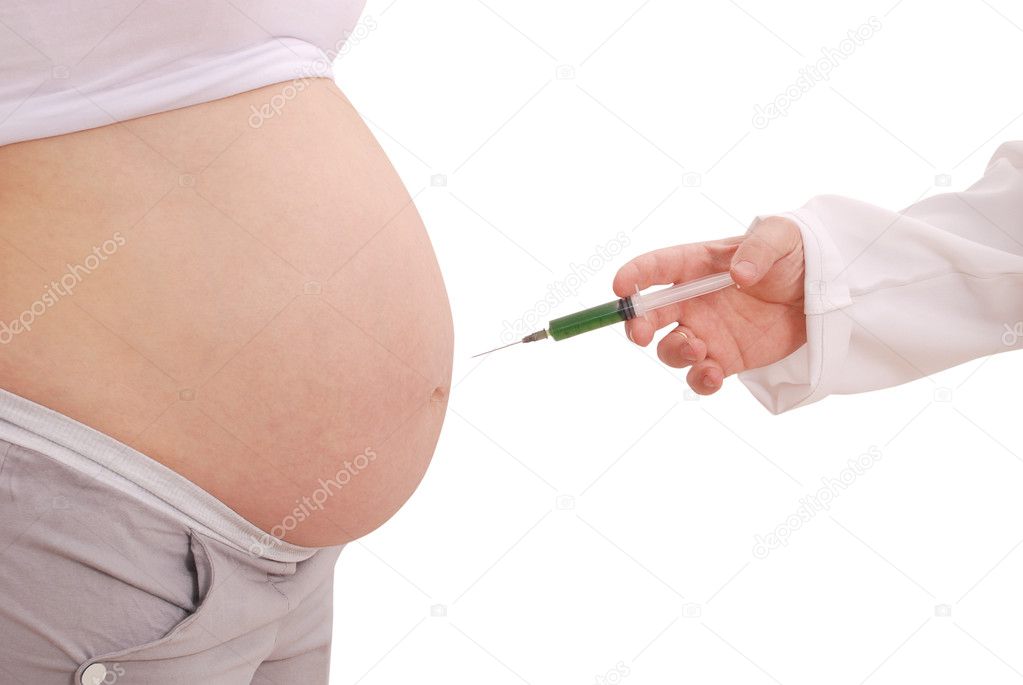

 В этой процедуре игла вводится через брюшную полость и матку в плаценту для получения образца ткани
В этой процедуре игла вводится через брюшную полость и матку в плаценту для получения образца ткани
 Это часть женских половых органов, находится позади мочевого пузыря и перед прямой кишкой. Он образует канал, идущий от матки к вульве.
Это часть женских половых органов, находится позади мочевого пузыря и перед прямой кишкой. Он образует канал, идущий от матки к вульве.
 В зависимости от положения матки и плаценты полный или пустой мочевой пузырь может помочь переместить матку в более удобное положение для процедуры.
В зависимости от положения матки и плаценты полный или пустой мочевой пузырь может помочь переместить матку в более удобное положение для процедуры.