Повышен антимюллеров гормон у женщин: Антимюллеров гормон (АМГ)
Антимюллеров гормон (АМГ, AMH, anti-Mullerian hormone)
Метод определения Хемилюминесцентный анализ на парамагнитных частицах
Исследуемый материал Сыворотка крови
Синонимы: АМГ, ингибирующее вещество Мюллера. Anti-Müllerian hormone, AMH, Müllerian inhibiting factor, MIF, Müllerian-inhibiting hormone, MIH, Müllerian-inhibiting substance, MIS.
Краткая характеристика определяемого вещества Антимюллеров гормон
Антимюллеров гормон – представитель семейства трансформирующих факторов роста, включённых в процессы роста и дифференцировки тканей.
Мужчины. У мужчин АМГ продуцируется в семенных канальцах клетками Сертоли. В период эмбрионального развития АМГ, наряду с тестостероном, необходим для нормального формирования внутренних репродуктивных органов: антимюллеров гормон вызывает редукцию у мужского эмбриона Мюллеровых протоков (зачатков женского репродуктивного тракта).
Андрогены и развивающиеся сперматоциты ингибируют секрецию АМГ. В отсутствие андрогенов и герминативных клеток (или при резистентности к андрогенам) проявляется усиливающие экспрессию АМГ эффекты фолликулостимулирующего гормона (ФСГ). Исследования АМГ могут быть полезны при дифференциальной диагностике интерсексуальных расстройств, диагностике преждевременного пубертата (АМГ понижен относительно возраста) или, напротив, отсроченного полового развития (АМГ повышен относительно возраста), оценке тестикулярной функции. В детстве АМГ может быть реальным маркёром наличия тестикулярной ткани в условиях, когда концентрация тестостерона очень низка.
Женщины. У женщин АМГ продуцируют гранулёзные клетки яичников. Уровень АМГ у женщин до пубертата, в отличие от мужчин, низкий (почти неопределимый), во время пубертата он растёт, затем поддерживается на относительно низком уровне, плавно снижаясь до менопаузы, во время которой падает опять до неопределимых величин. Показано, что экспрессия АМГ начинается в гранулёзных клетках первичных фолликулов после их дифференциации из прегранулёзных клеток примордиальных фолликулов, максимальна в гранулёзных клетках преантральных и малых антральных фолликулов и далее градуально снижается на последующих стадиях развития фолликулов, практически теряясь при размере фолликулов более 8 мм.
АМГ не экспрессируется во время финальных ФСГ-зависимых стадий роста фолликула. Полагают, что изменения экспрессии АМГ играют важную роль в механизмах рекрутирования и селекции фолликулов, поскольку в отсутствие АМГ фолликулы более чувствительны к ФСГ. В ряде исследований показано, что АМГ является количественным маркёром овариального резерва и может использоваться при применении вспомогательных репродуктивных технологий в комплексе обследований для оценки овариального резерва и прогнозирования ответа яичников на стимуляцию овуляции.
С какой целью определяют уровень Антимюллерова гормона в сыворотке крови
Антимюллеров гормон служит маркером овариального резерва у женщин репродуктивного периода и тестикулярной функции в препубертате у мужчин.
Что может повлиять на результат теста «Антимюллеров гормон» и дополнительные варианты применения
Уровень АМГ повышен при синдроме поликистозных яичников, что указывает на потенциальную важность этого теста в лабораторной диагностике данной патологии.
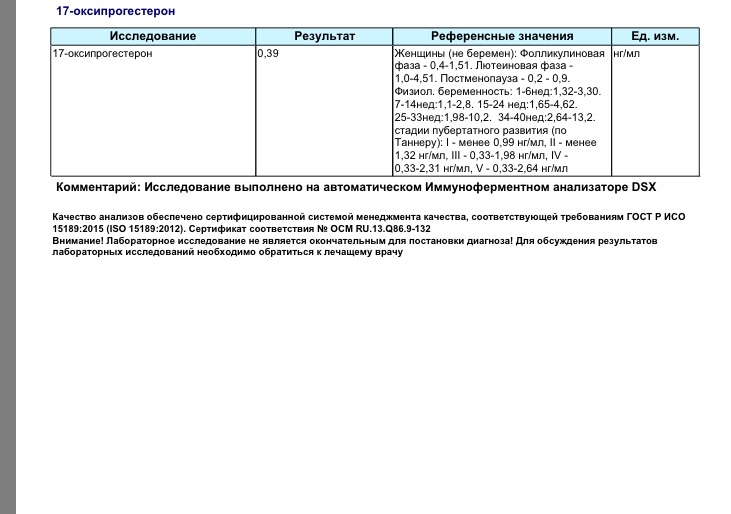
Предел определения: 0,01 нг/мл.
Норма антимюллерова гормона у женщин — почему это важно для зачатия? Антимюллеров гормон повышен: причины, последствия и лечение.
Антимюллеров гормон (амг) – гормон, относящийся к факторам роста, отражает в женском организме популяцию готовых к репродукции фолликулов в яичнике. Уровень в организме помогает диагностировать ряд патологии женской половой системы.
Понижение уровня антимюллерова гормона может говорить о:
- менопаузе;
- снижении овариального резерва;
- преждевременном половом развитии;
- ожирении в позднем репродуктивном возрасте;
- яичниковой недостаточности.
Повышение антимюллерова гормона может говорить о:
- опухоли в гранулезных тканях яичника;
- задержке полового развития;
- нормогонадотропном ановуляторном бесплодии;
- поликистозе яичников;
- дефекте рецепторов лютеинизирующего гормона.

Антимюллеров гормон в крови снижен при его значении – 0,2-1 нг/мл, сильно снижен, если его уровень меньше – 0,2 нг/мл, в пределах нормы – 1-3 нг/мл.
Антимюллеров гормон понижен – как повысить амг?
По мнению специалистов, повысить антимюллеров гормон невозможно. По уровню этого гормона определяют количество яйцеклеток в яичнике. Его искусственное повышение не приведет к увеличению овариального резерва.
Низкий антимюллеров гормон – лечение
Низкий уровень антимюллерова гормона является одним из диагностических признаков бесплодия, понижения овариального резерва. Современные методики позволяют простимулировать активность яичников для получения здоровых яйцеклеток. Возможно также использование метода ЭКО с использованием стимулирующей терапии или .
Низкий антимюллеров гормон – еще не повод отчаиваться и отказываться от долгожданной беременности. Низкий показатель антимюллерова гормона должен сочетаться с высоким показателем ФСГ. Если такого соотношения нет – ищите проблему дальше.
Низкий антимюллеров гормон – что делать
Если уровень антимюллерова гормона низкий и ваш возраст уже за 30, необходимо подумать о процедуре ЭКО и других методах, которые может предложить современная репродуктивная медицина. Потому что это первый сигнал наступления ранней менопаузы, уровень антимюллерова гормона вы не повысите, а время будет потеряно.
Помните, что сдавать анализ на этот гормон следует на 3-5 день менструального цикла. Для консультации и направления на анализ уровня антимюллерова гормона следует обращаться к эндокринологу.
В женском теле с рождения присутствует так называемый антимюллеров гормон. Его запасы иссякают лишь при наступлении менопаузы. Известно, что этот важный элемент занимается учетом яйцеклеток, медики это используют так: измеряют уровень АМГ у женщины, и на основании результатов данного анализа выносят вердикт, содержащий количество подготовленных к оплодотворению единиц яйцеклеток. Не у всех, кто сдает тест на антимюллеров гормон, норма его обнаруживается, ниже разберем этот вопрос, важный для всех женщин.
Не у всех, кто сдает тест на антимюллеров гормон, норма его обнаруживается, ниже разберем этот вопрос, важный для всех женщин.
АМГ или антимюллеров гормон
В каких случаях назначают тест на АМГ
Случается, что поначалу женщину обследуют, чтобы выяснить состояние других гормонов, не включая в перечень АМГ. Согласно результатам таких стандартных тестов, по самым важным гормонам может быть выявлен нормальный результат. Нередко можно наблюдать такую ситуацию, когда при достаточной концентрации других гормонов, проблема остается на месте — не наступает беременность при нормальной половой жизни. Тогда для увеличения глубины обследования организма врачи назначают анализы, чтобы выяснить, в какой концентрации находится антимюллеров гормон. Хоть его и не включают в начальные гормональные тесты, все же нужно отметить, что за счет данного показателя удается выяснить реальный потенциал яичников. Итак, врач принимает решение сделать расширенный Efort-Тест, не только в случаях проблем с оплодотворением.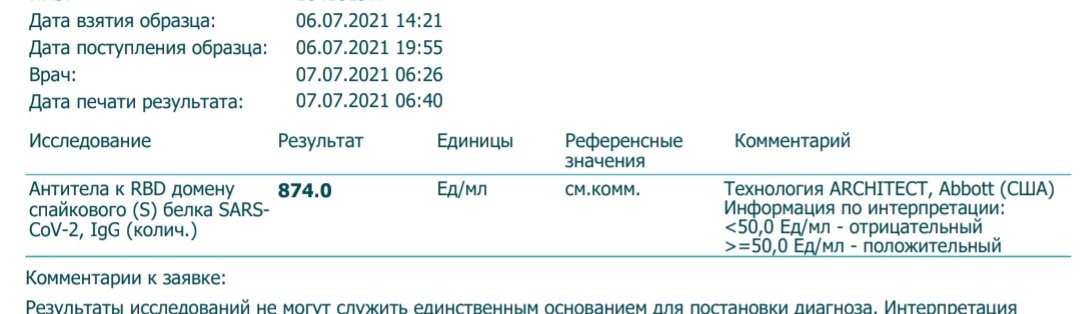
Антимюллеров гормон и его нормальный показатель
Чтобы корректно определился уровень гормона, сдается анализ в начале цикла, оптимально на третий-пятый его день. Перед сдачей крови недопустимо подвергать себя физическим нагрузкам или разрушительному воздействию стресса, нельзя принимать пищу. Когда обнаруживается, что недавно протекало острое заболевание или организм находится в состоянии недомоганий, не следует сдавать анализ. Медработник, исследующий кровь, способен адекватно определить, сколько в наличии активных фолликулов, их выдает антимюллеров гормон, норма для женщин варьируется от 1 до 2,5 нг/мл. Но не всегда результат укладывается в этот диапазон, иногда показатель оказывается за пределами нормы в сторону повышения или понижения, это происходит по разным причинам.
Когда обнаруживается, что недавно протекало острое заболевание или организм находится в состоянии недомоганий, не следует сдавать анализ. Медработник, исследующий кровь, способен адекватно определить, сколько в наличии активных фолликулов, их выдает антимюллеров гормон, норма для женщин варьируется от 1 до 2,5 нг/мл. Но не всегда результат укладывается в этот диапазон, иногда показатель оказывается за пределами нормы в сторону повышения или понижения, это происходит по разным причинам.
АМГ: что о нем нужно знать?
В основном ненормально завышенный уровень АМГ, выявленный у женщины, сигнализирует о следующих сбоях в организме:
- поликистозные поражения яичников,
- замедленное половое развитие,
- наличие на яичниках гранулезных образований.
Это наиболее распространенные причины повышения рассматриваемого гормона.
Понижен антимюллеров гормон
Ситуация с заниженным показателем антимюллерова гормона сообщает о разных процессах, протекающих в женском организме, укажем наиболее часто встречающиеся состояния и патологии, сопровождающие понижение показателя:
- предклимактические изменения,
- снижение овариального резерва в силу возраста,
- состояние ожирения.

Названы наиболее вероятные причины снижения АМГ у женщин.
Можно ли изменить показатель АМГ?
Дело в том, что антимюллеров гормон является лишь индикатором, отражающим факт нахождения в полости яичников антральных фолликулов. Если пытаться препаратами понизить или повысить содержание данного гормона, то все равно не удастся никак воздействовать на процесс образования яйцеклеток в яичниках. Результаты будут достигнуты исключительно при подходе, начинающемся с устранения причин отсутствия здоровых яйцеклеток.
После сдачи анализа на гормоны
Когда лаборанты путем исследования венозной крови женщины сделали свои выводы и выдали на руки результат, не нужно пытаться самостоятельно оценить эти данные и ни в коем случае не следует предпринимать любых мер с самолечением, даже если явно заметно, что присутствуют отклонения от нормы. Когда по веществу АМГ норма не обнаружена, а наоборот, получены завышенные или заниженные данные, следует решать данный вопрос вместе со специалистом, например, с репродуктологом, эндокринологом. А еще случается так, что происходит пересдача крови, например, для другой лаборатории, и результаты получаются другие. Такое может произойти за счет ошибочного исследования на фоне неправильной подготовки пациентки к сдаче крови.
А еще случается так, что происходит пересдача крови, например, для другой лаборатории, и результаты получаются другие. Такое может произойти за счет ошибочного исследования на фоне неправильной подготовки пациентки к сдаче крови.
Не обязательно при анализе на антимюллеров гормон норма в результатах будет констатирована, но все равно не следует расстраиваться, лучше оперативно начать предпринимать меры для устранения обнаруженной патологии.
Антимюллеров гормон в организме женщины и мужчины вырабатывается в течение жизни, но выполняет разные функции. У мужчин он оказывает влияние на формирование половых органов и активно производится до полового созревания, а затем, постепенно снижаясь, остается на одном уровне.
У женщин гормон, представляющий собой белок, который синтезируется в клетках яичников, активен с рождения вплоть до менопаузы. Поэтому АМГ у женщин позволяет определить фолликулярный резерв женщины и оценить эффективность выбранного метода зачатия.
При обращении семейных пар к репродуктологу с целью достижения беременности большое внимание уделяется состоянию овариального резерва яичников. Овариальный или фолликулярный резерв отражает количество антральных фолликулов в начале менструального цикла, в каждом из которых может созреть полноценная яйцеклетка.
Овариальный или фолликулярный резерв отражает количество антральных фолликулов в начале менструального цикла, в каждом из которых может созреть полноценная яйцеклетка.
Зная свой овариальный резерв, существует возможность полноценного самостоятельного или искусственного оплодотворения. Если по каким-то причинам девушка решила отложить беременность, замороженная яйцеклетка станет гарантией материнства в будущем с помощью эко при низком АМГ.
Факторы, влияющие на состояние овариального резерва, следующие:
- Возрастной фактор. С начала менструальной функции каждый месяц происходит небольшое истощение функции яичников, которые наиболее выражены после 35 лет.
- Хронические воспалительные заболевания малого таза и хирургические операции на яичниках.
- Радиационное облучение, химиотерапия.
- Курение. Уровень гормона гипофиза (ФСГ), регулирующего нормальное функционирование репродуктивной системы, у курящих женщин в целом выше, чем у тех, кто не имеет пагубной привычки.

При повышении уровня ФСГ и повышении эстрадиола, а также снижении тестостерона фиксируют снижение функции яичников. Минус определения ФСГ – вариабельность показателей, которые меняются от цикла к циклу. Более точными показателями при определении овариального резерва признается анализ на антимюллеров гормон, который измеряется в любой день менструального цикла.
Антимюллеровский гормон также определяет:
- как хорошо сейчас работают яичники;
- не приближается ли старение яичников;
- не наступило ли сейчас истощение фолликулярного резерва.
Определение гормона основано на показателях выработки в фолликулах яичников. Надо учитывать, что показатель антимюллерова гормона будет разным в зависимости от норм лабораторий, выполняющих этот анализ.
Показатели АМГ гормона – что это такое?
Нормой АМГ у женщин считаются данные 1.2–7 нг/мл. Если фолликулов мало, то соответственно АМГ будет низкий. Ниже 1 – значение, при котором уровень антимюллерова гормона понижен.
Возможна ли беременность, если в этом случае говорят о резком истощении функции яичников и затруднительном получении у женщины яйцеклеток? Что делать в этой ситуации и как повысить антимюллеров гормон? Прежде всего, необходимо правильно оценить настоящее положение. Важную роль играет не увеличение гормона, а нормальное функционирование здоровых фолликулов. К нормализации значений может привести отдых, если снижение было вызвано стрессом.
Чаще всего причиной понижения АМГ служит не психоэмоциональный фактор, а физиологическое старение женщины. С помощью АМГ репродуктолог определяет не только качество и количество яйцеклеток в ходе стимуляции овуляции, а также возможные заболевания, которые можно пролечить и таким образом, повысить АМГ.
Медикаментозным способом задача повышения гормона не решается. В зарубежной практике антимюллеров гормон у женщин начинают контролировать с пубертатного периода, чтобы потом вовремя законсервировать яйцеклетку. Криоконсервация ооцитов в дальнейшем помогает сохранить репродуктивную функцию и забеременеть с низким АМГ.
В таблице представлены результаты нормы и отклонения от нормы у женщин репродуктивного возраста. Погрешности в несколько сотых не имеют информативной значимости. В каждом отдельном случае вопрос о снижении или превышении нормы решается с врачом.
Уровень АМГ – 2,0 входит в нормативное значение. При показателях ниже этого уровня обследование дополняется критериями овариального резерва – ФСГ, ультразвукового исследования на количество антральных фолликулов. Низкий АМГ и самостоятельная беременность сопоставимы в ряде случаев, если условия, влияющие на качество овариального резерва не достигнуты.
Причины отклонений от нормы АМГ
Если показатели гормона выше нормы, это значит, что изменения наступили по причине:
- отсутствия овуляции – бесплодия;
- поликистоза яичников, выросшего из-за отсутствия овуляции. Для поликистозных яичников характерен показатель АМГ выше 5;
- опухолевых клеток яичников. АМГ с превышением показателя 30 является маркером для онкологов.

Причинами понижения гормона являются:
- Возрастное снижение фолликулярного резерва. Пик снижения ооцитов приходится на 38 лет.
- Ожирение в позднем репродуктивном периоде.
- Яичниковая недостаточность. Фолликулярный запас существенно истощается вследствие оперативных вмешательств или химиотерапии.
- Наступление менопаузы.
Женщинам, которые не рассматривают вопрос зачатия с помощью программы ЭКО, желательно сдавать анализ, поскольку по антимюллерову гормону определяется общее состояние женского здоровья.
Анализ на гормон рекомендуется сдавать не чаще 1 раза в полгода, а лучшим временем считается 3–5 день менструального цикла. Вопрос, возникающий у многих пациенток относительно того, на какой день цикла сдавать этот анализ, решающего значения не имеет. Врач посоветует придерживаться непосредственно перед сдачей крови на гормон:
- сохранять спокойное состояние;
- избегать чрезмерных физических нагрузок;
- воздержаться от алкоголя;
- не употреблять пищу в утренние часы перед анализом, но с промежутком голодания не больше 14 часов.

При обнаружении хронического заболевания пациентке предложат отложить обследование до выздоровления.
Лечение по результатам исследований АМГ
АМГ используется в репродуктивных технологиях для оценки овариального резерва, прогноза на стимуляцию яичников и входит в обязательную программу обследования перед ЭКО. При наличии условий может проводиться эко в циклах со стимуляцией гонадотропинами. При отсутствии условий рекомендуется эко в естественном цикле. Если вывод основывается на том, что получение яйцеклеток невозможно, специалисты рекомендуют женщине использование незрелых форм будущих яйцеклеток – ооцитов донора.
Лечение народными средствами предполагает соблюдение диеты и включение в нее биодобавок. Продукты пчеловодства признаются среди них эффективными для наступления зачатия и повышения лактации при наступившей беременности. О назначении альтернативных средств следует посоветоваться с лечащим врачом. Необходимо помнить о том, что величина АМГ не решает проблему зачатия, а позволяет выявить патологию при отсутствии результата в течение длительного времени.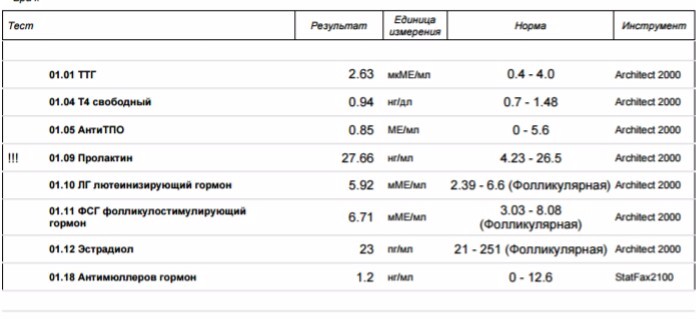
В любом случае отклонение от нормы не повод отчаиваться. Важно своевременно принять меры, чтобы нивелировать нежелательные последствия. Правильно оценить ситуацию поможет консультация с репродуктологом и данные анализов. Современные возможности репродуктивной медицины позволяют найти выход из любой ситуации.
Нет похожих записей.
Антимюллеров гормон норма которого имеет большое значение, влияет на детородную функцию. Уровень данного вещества является важным критерием репродуктивного здоровья. Причем содержится данный гормон как в женском, так и в мужском организме, однако выполняет разные функции. Специфическая особенность заключается в том, что антимюллеровский гормон не контролируется гонадотропинами и не зависит от менструального цикла.
Что это такое
Антимюллеров гормон (сокращенно АМГ гормон) вырабатывается у женщин и мужчин. В мужском организме этот вид гормонов оказывает воздействие на процесс формирования органов половой системы, активно выделяясь до момента полового созревания. У женщины данное вещество образуется в половых железах с момента рождения до периода менопаузы. Достижение АМГ гормоном определенного уровня говорит о том, что можно выносить и родить ребенка (то есть сформирована фертильность). Причем женский возраст не влияет на содержание данного вещества.
У женщины данное вещество образуется в половых железах с момента рождения до периода менопаузы. Достижение АМГ гормоном определенного уровня говорит о том, что можно выносить и родить ребенка (то есть сформирована фертильность). Причем женский возраст не влияет на содержание данного вещества.
Главная особенность АМГ — это отсутствие регулирования головным мозгом. Он является местным гормоном, то есть зависимым от функционирования яичников. Следует отметить, что не все образующиеся в женском организме фолликулы формируют зрелую яйцеклетку. Именно антимюллеров гормон определяет, сколько фолликулов будут полноценными.
Когда необходимо сдавать анализ
Существует перечень показаний, определяющих кому следует сдавать анализ крови на АМГ. К ним относятся следующие моменты:
- необходимость обследования на причину нарушений на этапе полового созревания;
- необходимо подтвердить принадлежность к полу при наличии ложного гермафродизма;
- контроль развития раковой опухоли, когда возможно было затронуто функционирование половых желез женщины;
- выявление причины неудавшейся попытки экстракорпорального оплодотворения.

Анализ на антимюллеров гормон позволяет помимо прочего узнать овариальный резерв яичников и определить возможности женского организма для зачатия. Это дает врачу информацию о том, почему возникают проблемы с выполнением детородной функции.
Особенности сдачи анализа
Любая девушка может сдать анализ в клинической лаборатории. Для проведения исследования берется венозная кровь. Через два — три дня результаты будут готовы. Накануне проведения исследования необходимо соблюдать определенные рекомендации:
- ограничить физическую активность;
- исключить стрессовый фактор;
- лучше отложить проведения анализа после недавно перенесенного простудного заболевания;
- исключить употребление алкогольных напитков, ограничить курение.
Часто у женщин возникает вопрос не только, что такое антимюллеров гормон, но и когда сдавать его лучше всего.
Наиболее верные результаты будут получены при исследовании крови на 2–5 день менструального цикла.
Это связано с тем, что в этот период уровень вещества не меняется. При проведении анализа мужчиной строгих ограничений по дням нет. Кровь нужно сдавать на голодный желудок утром. При необходимости разрешается выпить немного воды.
Нормальные величины
Исследование на АМГ позволяет определить количество фолликулов у женщины в определенный момент времени. Нормальные величины вещества находятся в пределах от 2,2 до 6,8 нг/мл. Эти показатели являются нормальными при достижении совершеннолетнего возраста. В некоторых случаях антимюллеров гормон повышен, иногда показатель бывает понижен. Конкретные причины данных явлений может выяснить только врач на основании дополнительных диагностических мероприятий.
Если показатели понижены
Не всегда гормональный фон женщины стабилен. Иногда антимюллеров гормон у женщин бывает ниже нормы. Это встречается при:
- наступлении климактерического периода, когда истощается овариальный резерв по естественным причинам;
- снижении овариального резерва, когда становится меньше фолликулов, способных выработать полноценную яйцеклетку;
- раннем половом созревании;
- наличии чрезмерной массы тела женщины на репродуктивном этапе.

Если показатели выше нормальных величин
В некоторых ситуациях уровень АМГ гормона может повышаться. Это бывает при наличии у женщины:
- поликистоза яичников, когда нарушено функционирование половых желез;
- нарушении нормального полового развития;
- появлении такого новообразования, как гранулезоклеточная опухоль.
Что делать
Норма антимюллерова гормона у женщин очень важна, так как определяет полноценную репродуктивную функцию. Поэтому его высокий или низкий уровень требует проведения определенных действий. Не следует паниковать. Ведь стресс оказывает негативное воздействие на нормальный гормональный фон женщины. Необходимо обратится к специалисту и строго выполнять назначения врача.
При выявлении низких показателей женщину волнует: можно ли повысить антимюллеров гормон? Методов, которые помогли бы естественным образом поднять концентрацию гормона нет. На помощь приходит экстракорпоральное оплодотворение.
Для ЭКО необходимо соблюдение определенных требований.
Врач может назначить прием некоторых добавок, соблюдение диеты. Эти мероприятия немного повышают содержание важного вещества, облегчая подготовку к процедуре искусственного зачатия. Помимо этого, для выполнения ЭКО необходимо проведение полного обследования женщины. Это позволит наиболее точно определить причину бесплодия.
Как влияет антимюллеров гормон на беременность
Низкая концентрация гормона снижает возможность женщины забеременеть и родить ребенка. Огромное значение играет то, насколько низко опустился или поднялся уровень. Поможет определиться в этом следующая таблица:
Оптимальное количество для зачатия соответствует нормальному показателю. В некоторых случаях у женщин с низким уровнем гормона происходили выкидыши. Однако реальная медицинская практика показала, что концентрация гормона мало влияет на возможность самопроизвольного аборта.
Иногда женщины, узнав о нарушении детородной функции без рекомендаций врача пытаются самостоятельно назначить себе лекарственные препараты. Однако самолечением можно только нанести себе вред. Необходимо обратиться к специалисту, который и определит направление лечения. Ведь необходимо бороться не с последствиями, а искать причину изменения уровня гормона. Следует вовремя проходить профилактические осмотры. Даже незначительные отклонения показателей от нормы требуют дополнительного обследования.
Однако самолечением можно только нанести себе вред. Необходимо обратиться к специалисту, который и определит направление лечения. Ведь необходимо бороться не с последствиями, а искать причину изменения уровня гормона. Следует вовремя проходить профилактические осмотры. Даже незначительные отклонения показателей от нормы требуют дополнительного обследования.
Вопросы о том, что такое антимюллеров гормон и норма у женщин, должны интересовать любую представительницу прекрасного пола, решившую стать мамой. Ведь выполнение детородной функции и возможность иметь детей напрямую зависят от концентрации данного вещества. О том, как повысить антимюллеров гормон, может ответить только специалист на основании полученных данных после поведения дополнительной диагностики. Не следует опускать руки, если показатель будет понижен. Соблюдение врачебных рекомендаций, забота о своем здоровье поможет женщине насладиться счастьем материнства.
Вопрос о том, как повысить антимюллеров гормон у женщин, интересует многих пациенток. Важно знать, что антимюллеров гормон (АМГ) играет большую роль в регулировании функций и работы репродуктивной системы. Выработка гормона происходит с первых дней жизни ребенка, достигая самого активного уровня, когда наступает половая зрелость. Потом начинает происходить постепенное снижение АМГ.
Важно знать, что антимюллеров гормон (АМГ) играет большую роль в регулировании функций и работы репродуктивной системы. Выработка гормона происходит с первых дней жизни ребенка, достигая самого активного уровня, когда наступает половая зрелость. Потом начинает происходить постепенное снижение АМГ.
Функции вещества в организме
У мужчин гормон будет держаться на одинаковой отметке в течение жизни. Для женщин ситуация несколько иная. Нормальное значение гормона наблюдается до прихода менопаузы, а потом АМГ станет снижаться. Если же в течение репродуктивного периода уровень гормона низкий, то в организме наступает серьезный гормональный дисбаланс, начинают развиваться различные патологии, угрожающие здоровью женщины.
Присутствует в организме мужчин и женщин, но именно у последних данный гормон часто либо понижен, либо повышен.
Гинеколог назначает сдачу , чтобы понять, готова ли женщина к оплодотворению, в каком состоянии находятся яичники пациентки. Для яичников нормальный уровень АМГ очень важен, поскольку отвечает и контролирует рост, а потом и созревание фолликулов.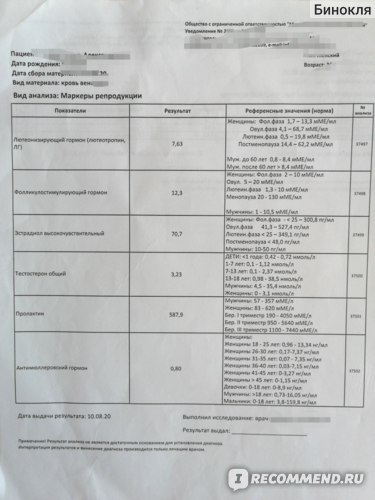
Нормой для женщины считается показатель гормона, который находится в диапазоне от 1,0 до 2,5 нг/мл. При подозрении на различные заболевания, связанные с яичниками и гормональным сбоем, результаты анализа помогают конкретизировать патологию, выбрать адекватный курс терапии.
К чему приводит снижение АМГ?
Если показатели снижены, тогда у женщины могут наблюдаться:
- 1 Трудности наступления беременности.
- 2 Наступление или приближение менопаузы.
- 3 Дисфункция яичников и их плохая работа.
- 4 Признак ожирения.
Методы нормализации показателя
На синтез АМГ не влияют другие гормоны, поскольку он отвечает за работу яичников, их функциональность. Если показатели очень высокие, то врач начинает лечить патологию яичников. Особенности терапии зависят от вида заболевания, но перед этим нужно пройти ультразвуковое обследование, сдать различные анализы. Причем сдавать анализы на гормон нужно несколько раз, чтобы точно подтвердить его повышенность. Часто повышенный уровень может быть вызван и другими факторами, среди которых самыми распространенными являются:
Часто повышенный уровень может быть вызван и другими факторами, среди которых самыми распространенными являются:
- 1 Интенсивные занятия спортом.
- 2 Активные физические нагрузки.
- 3 Стресс.
- 4 Наличие в организме воспалений или острых заболеваний.
Поэтому перед обследованием надо отказаться от курения, алкоголя, интенсивные тренировки исключить, предпочтение отдать прогулкам и бегу, вести обычный образ жизни.
Особенности пониженного АМГ. Если исследование покажет, что антимюллеров гормон понижен, то это говорит о том, что у женщины очень низкое количество яйцеклеток, а соответственно, наступление беременности будет затруднено.
Медицинские исследования установили, что снижение АМГ является не причиной, затрудняющей беременность, а следствием многочисленных процессов. Анализы, показывающие пониженный АМГ, говорят о том, что в организме, как и в яичниках, начались изменения опасного характера. Поэтому и не происходит выработка яйцеклеток, которые могут быть оплодотворены.
Медицинские препараты способны простимулировать работу яичников, чтобы яйцеклетки были готовы к зачатию, а организм — к вынашиваю ребенка. Когда низкий уровень АМГ является следствием бесплодия, тогда для оплодотворения используют ЭКО, т. е. проводят стимуляцию или используют яйцеклетку донора. Пониженный уровень АМГ — еще не повод отказываться от материнства. Сложности возникнут, если пониженный АМГ будет сопровождаться высоким уровнем фолликулстимулирующего гормона, который тоже принимает участие в функционировании репродуктивной системы женщины.
Стимуляция с помощью ЭКО проводится, если женщине больше 30 лет, а она еще не рожала. Репродуктивная медицина в этом случае применяет ЭКО и другие методы. Обычно снижение уровня АМГ в таком возрасте говорит о том, что начался период менопаузы. Поэтому повысить уровень гормона нельзя.
Врачи утверждают, что повысить АМГ невозможно, что связано со следующими причинами.
Ингибирующее вещество Мюллера (АМГ) — это показатель запасов яйцеклетки в яичниках.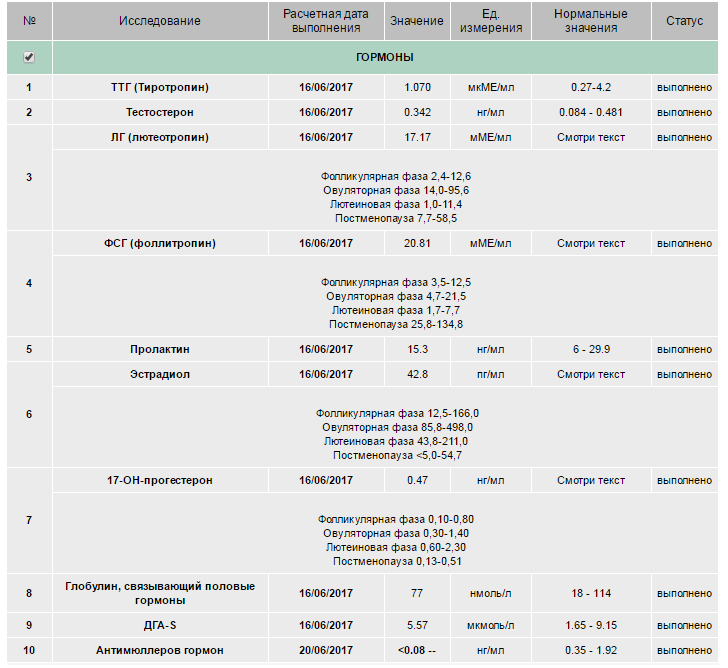 Поэтому если он низкий, то повысить его нельзя.
Поэтому если он низкий, то повысить его нельзя.
Повышение количества гормона не будет провоцировать образование новых яйцеклеток.
- 1 Беременность.
- 2 Период лактации.
- 3 Прием противозачаточных средств.
Поэтому запас истощается и снижается, а новые не образуются, в результате чего забеременеть становится все сложнее.
Что делать при пониженном уровне АМГ? Единственным шансом того, как повысить антимюллеров гормон у женщин, является срочное устранение причины, провоцирующей подобное состояние. Поэтому врачи начинают лечение основного заболевания, для чего используют различные современные медицинские препараты. Например, DHEA, способные увеличить количество фолликулов, вернуть показатели гормона на необходимый уровень, чтобы произошло оплодотворение.
Данные виды лекарств созданы как полифункциональные стероидные гормоны, чтобы стимулировать работу андрогенных рецепторов и увеличивать количество фолликулов антрального типа. Дополнительно назначается прием витамина D3 — как таблетки и солнечные ванны. Лечение длится от трех месяцев и дольше, пока женщина не будет способна забеременеть и выносить ребенка.
Лечение длится от трех месяцев и дольше, пока женщина не будет способна забеременеть и выносить ребенка.
И немного о секретах…
Если вы когда-нибудь пытались изучить проблему нарушений горманального фона, то наверняка столкнулись со следующими трудностями:
- медикаментозное лечение, назначаемое врачами, решая одну проблему создает другие;
- препараты заместительной терапии, попадающие в организм извне помогают только на время приема;
- медикаменты, применяемые для лечения гормональных нарушений стоят больших денег;
- лекарства, принимаемы перорально нарушают работу ЖКТ;
- постоянные колебания гормонального фона портят настроение и не дают наслаждаться жизнью.
А теперь ответьте на вопрос: Вас это устраивает? Разве в таком сложном механизме, как ваше тело не предусмотрены механизмы саморегуляции уровня гормонов? А сколько денег вы уже «слили» на неэффективное лечение? Правильно — пора с этим кончать! Согласны? Именно поэтому мы решили опубликовать эксклюзивный метод Елены Малышевой , в котором она раскрыла простой секрет гормонального здоровья. Вот её метод…
Вот её метод…
Антимюллеров гормон. Максимальные значения и норма АМГ.
Антимюллеров гормон (АМГ) – это «побочный» продукт работы яичников, своеобразная «лакмусовая бумажка» женской фертильности и женского здоровья.
Его вырабатывают клетки содержащих яйцеклетки фолликулов, только в период своего созревания. По уровню АМГ можно судить о том, как именно яичники работают и сколько содержат яйцеклеток, которые могут «дозреть» для оплодотворения.
В зависимости от возраста женщины антимюллеров гормон имеет разный уровень. Его невозможно определить у девочек до начала первого менструального цикла. Он равен нулю у женщин, вышедших из детородного возраста в силу естественных причин – в период менопаузы.
Максимальные значения АМГ в норме фиксируются на пике женской фертильности – с 20 до 30 лет. Он имеет низкие значения у тех женщин, которые испытывают трудности с естественным зачатием. Чем уровень антимюллерова гормона ниже, тем меньше шансов у женщины на беременность.
Существует термин «овариальный резерв» — это оставшееся у женщины количество яйцеклеток, которые еще могут овулировать и быть оплодотворенными.
С момента первой менструации число яйцеклеток, способных к оплодотворению, будет только уменьшаться. А то, что еще остается в яичниках женщины – и есть ее детородный «резерв». И эту динамику можно увидеть с помощью теста на антимюллеров гормон. Его уровень у взрослой женщины фертильного возраста является самым точным на сегодняшний день маркером овариального резерва женщины.
По уровню АМГ можно с очень большой точностью предсказать время наступления менопаузы, то есть, тот момент, когда у женщины уже больше не останется яйцеклеток.
Диагностическое значение имеет не только пониженный уровень АМГ. Если анализ показывает, что антимюллеров гормон повышен, — это может указывать на определенные дисфункции яичников.
НОРМА ДЛЯ ЖЕНЩИН:
В диагностике овариального резерва у женщин репродуктивного возраста принято считать нормой колебания уровня АМГ в пределах от 0,2 до 11 нг/мл (по другим данным – от 0,5 до 12,6 нг/мл). Данные могут варьировать в различных лабораториях. Нужно иметь в виду, что интерпретацией результатов теста на антимюллеров гормон должны заниматься специалисты.
Данные могут варьировать в различных лабораториях. Нужно иметь в виду, что интерпретацией результатов теста на антимюллеров гормон должны заниматься специалисты.
Направление на анализ АМГ, как правило, выдает врач-эндокринолог. Для анализа на антимюллеров гормон сдается кровь из вены натощак на 3-5 день цикла. Одновременно назначают тест на фолликулостимулирующий гормон (ФСГ) для комплексной оценки работы яичников.
АМГ является маркером:- овариального резерва;
- овариального старения;
- овариальной дисфункции;
- овариального ответа.
АМГ отвечает за регуляцию выхода фолликула в состоянии покоя, устанавливает темп, с которым происходит мейоз. Это незаменимый гормон, который секретируется фолликулом и дает информацию о количестве фолликулов, которые еще малы и только входят в фазу роста.
Повышение уровня этого гормона у женщины свидетельствует о наличии большего количества маленьких антральных фолликулов и клинически проявляется как синдром поликистоза яичников.
Снижение уровня этого гормона говорит об истощении яичников.
Физиологическое понижение уровня антимюллерова гормона наблюдается в зрелом репродуктивном возрасте женщины по сравнению с началом репродуктивного периода.
Антимюллеров гормон и ФСГ являются маркерами овариального резерва. Уровень антимюллерова гормона наиболее точно отражает количество и качество ооцитов в яичниках, более чем уровень ФСГ, так как является цикл независимым маркером.
Уровни АМГ и ингибина В используются совместно в оценке овариального резерва и являются новыми маркерами в процедурах ЭКО.
Антимюллеров гормон у женщин также используется для диагностики:- замедленного полового созревания;
- преждевременного полового созревания;
- контроль гранулематозного рака яичника;
- бесплодие неясного генеза;
- неудачные попытки ЭКО;
- повышенные значения ФСГ.
АМГ имеет большое значение в диагностике гранулезоклеточного рака яичников, является его специфическим маркером. Повышение уровня антимюллерова гормона является поводом для прохождения дальнейшего обследования.
Повышение уровня антимюллерова гормона является поводом для прохождения дальнейшего обследования.
Чтобы подготовится к сдаче анализов на АМГ, необходимо не курить за 3 часа до сдачи анализа, помнить, что стресс, интенсивные тренировки, острые заболевания его уровень снижают.
Ингибин В и АМГ играют важную роль в определении также и мужского бесплодия, является маркером сперматогенеза!!!
Лекция врача-нутрициолога Аркадия Бибикова
Предыдущий постКашемировая помада Bremani Бургунди
Следующий постИнгибин В
Высокий уровень антимуллеровых гормонов в сыворотке крови связан с более низким уровнем живорождения у женщин с синдромом поликистозных яичников, перенесших вспомогательные репродуктивные технологии | Репродуктивная биология и эндокринология
La Marca A, Sighinolfi G, Radi D, Argento C, Baraldi E, Artenisio AC, Stabile G, Volpe A. Антимюллеров гормон (AMH) как прогностический маркер вспомогательных репродуктивных технологий ( ИЗОБРАЗИТЕЛЬНОЕ ИСКУССТВО). Обновление Hum Reprod. 2010; 16: 113–30.
Обновление Hum Reprod. 2010; 16: 113–30.
Артикул CAS Google ученый
Тал Р., Сейфер ДБ. Тестирование яичникового резерва: руководство пользователя. Am J Obstet Gynecol. 2017; 217: 129–40.
Артикул Google ученый
Дурлингер А.Л., Виссер Дж.А., Теммен А.П. Регуляция функции яичников: роль антимюллерова гормона. Репродукция. 2002; 124: 601–9.
Артикул CAS Google ученый
Роттердам EA-SPCWG: Revised 2003 Консенсус по диагностическим критериям и долгосрочным рискам для здоровья, связанным с синдромом поликистозных яичников . Fertil Steril 2004, 81 : 19–25.
Пеллатт Л., Ханна Л., Бринкат М., Галеа Р., Мозг Н., Уайтхед С., Мейсон Х. Производство антимюллеровского гормона гранулезными клетками увеличивается в поликистозных яичниках. J Clin Endocrinol Metab. 2007. 92: 240–5.
J Clin Endocrinol Metab. 2007. 92: 240–5.
Артикул CAS Google ученый
Dewailly D, Gronier H, Ponsel E, Robin G, Leroy M, Pigny P, Duhamel A, Catteau-Jonard S. Диагностика синдрома поликистозных яичников (СПКЯ): пересмотр пороговых значений количества фолликулов на УЗИ и уровня АМГ в сыворотке для определения поликистозных яичников.Hum Reprod. 2011; 26: 3123–9.
Артикул CAS Google ученый
Лин YH, Chiu WC, Wu CH, Tzeng CR, Hsu CS, Hsu MI. Антимуллерный гормон и синдром поликистозных яичников. Fertil Steril. 2011; 96: 230–5.
Артикул CAS Google ученый
Нардо Л.Г., Йейтс А.П., Робертс С.А., Пембертон П., Лэйнг I. Взаимосвязь между АМГ, андрогенами, инсулинорезистентностью и базальным фолликулярным статусом яичников у женщин с субфертильной функцией без ожирения с синдромом поликистозных яичников и без него. Hum Reprod. 2009; 24: 2917–23.
Hum Reprod. 2009; 24: 2917–23.
Артикул CAS Google ученый
Pigny P, Jonard S, Robert Y, Dewailly D. Сывороточный антимюллеров гормон как заменитель количества антральных фолликулов для определения синдрома поликистозных яичников. J Clin Endocrinol Metab. 2006; 91: 941–5.
Артикул CAS Google ученый
Пиука А., Фармакиотис Д., Кацикис И., Макут Д., Геру С., Панидис Д.Уровни антимюллерова гормона отражают тяжесть СПКЯ, но на них отрицательно влияет ожирение: связь с повышенным уровнем лютеинизирующего гормона. Am J Physiol Endocrinol Metab. 2009; 296: E238–43.
Артикул CAS Google ученый
Тал Р., Сейфер Д.Б., Ханимов М., Мальтер Х.Э., Граци Р.В., Лидер Б. Характеристика женщин с повышенным уровнем антимуллерова гормона (АМГ): корреляция АМГ с фенотипами синдрома поликистозных яичников и результатами вспомогательных репродуктивных технологий. Am J Obstet Gynecol . 2014; 211: 59 e51–8.
Am J Obstet Gynecol . 2014; 211: 59 e51–8.
Артикул CAS Google ученый
Ла Марка А., Орвието Р., Джулини С., Ясонни В. М., Вольпе А., Де Лео В. Вещество, ингибирующее Муллериан, у женщин с синдромом поликистозных яичников: взаимосвязь с гормональными и метаболическими характеристиками. Fertil Steril. 2004; 82: 970–2.
Артикул Google ученый
Бродин Т., Хадзиосманович Н., Берглунд Л., Оловссон М., Холте Дж. Уровни антимуллеровых гормонов сильно связаны с коэффициентом живорождения после искусственного оплодотворения. J Clin Endocrinol Metab. 2013; 98: 1107–14.
Артикул CAS Google ученый
Илиодромити С., Келси Т.В., Ву О, Андерсон Р.А., Нельсон С.М. Прогностическая точность антимюллерова гормона для живорождения после вспомогательного зачатия: систематический обзор и метаанализ литературы. Обновление Hum Reprod. 2014; 20: 560–70.
Обновление Hum Reprod. 2014; 20: 560–70.
Артикул CAS Google ученый
Tal R, Tal O, Seifer BJ, Seifer DB. Антимуллеровый гормон как предиктор имплантации и клинической беременности после искусственного оплодотворения: систематический обзор и метаанализ. Fertil Steril. 2015; 103: 119–30 e113.
Артикул CAS Google ученый
Кая К., Пабучу Р., Сатироглу Х.Концентрация антимуллерного гормона в сыворотке крови на 3-й день цикла стимуляции экстракорпорального оплодотворения позволяет прогнозировать оплодотворение, имплантацию и беременность у пациентов с синдромом поликистозных яичников, которым проводится вспомогательная репродукция. Fertil Steril. 2010; 94: 2202–7.
Артикул CAS Google ученый
Xi W, Gong F, Lu G. Корреляция сывороточных концентраций антимюллеровского гормона на 3-й день цикла стимуляции экстракорпорального оплодотворения с исходом вспомогательной репродукции у пациентов с синдромом поликистозных яичников. J Assist Reprod Genet. 2012; 29: 397–402.
J Assist Reprod Genet. 2012; 29: 397–402.
Артикул PubMed PubMed Central Google ученый
Алебич М.С., Стоянович Н., Дюамель А., Дьюайли Д. Фенотипическое разнообразие перфолликулярной продукции антимюллерова гормона при синдроме поликистозных яичников. Hum Reprod. 2015; 30: 1927–33.
Артикул CAS PubMed PubMed Central Google ученый
Де Вос М., Парейн С., Дракопулос П., Раймундо Дж. М., Анкаерт Э, Сантос-Рибейро С., Полизос Н. П., Турне Х., Блокил С. Совокупная частота живорождений после ЭКО у пациентов с поликистозом яичников: фенотип имеет значение. Воспроизвести BioMed Online. 2018; 37: 163–71.
Артикул Google ученый
Рамезанали Ф., Ашрафи М., Хемат М., Арабипур А., Джалали С., Мойни А. Вспомогательные репродуктивные результаты у женщин с различными фенотипами синдрома поликистозных яичников: прогностическая ценность антимюллеровского гормона.Воспроизвести BioMed Online. 2016; 32: 503–12.
Артикул CAS PubMed PubMed Central Google ученый
Сейфер Д.Б., Бейкер В.Л., Лидер Б. Возрастные значения сывороточного антимюллерова гормона для 17 120 женщин, обращающихся в центры репродуктивной медицины в США. Fertil Steril. 2011; 95: 747–50.
Артикул CAS PubMed PubMed Central Google ученый
Buyuk E, Seifer DB, Illions E, Grazi RV, Lieman H. Повышенный индекс массы тела связан с более низким уровнем антимюллерова гормона в сыворотке крови у бесплодных женщин с пониженным овариальным резервом, но не с нормальным яичниковым резервом. Fertil Steril. 2011; 95: 2364–8.
Артикул CAS PubMed PubMed Central Google ученый
Келси Т.В., Райт П., Нельсон С.М., Андерсон Р.А., Уоллес У. Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы.PLoS One. 2011; 6: e22024.
Артикул CAS PubMed PubMed Central Google ученый
Сейфер Д.Б., Маклафлин Д.Т., Кристиан Б.П., Фэн Б., Шелден Р.М. Ранние уровни фолликулярной сыворотки, ингибирующей мюллериан, связаны с реакцией яичников во время циклов вспомогательных репродуктивных технологий. Fertil Steril. 2002; 77: 468–71.
Артикул PubMed PubMed Central Google ученый
Visser JA, de Jong FH, Laven JS, Themmen AP. Антимюллеров гормон: новый маркер функции яичников. Репродукция. 2006; 131: 1–9.
Артикул CAS PubMed PubMed Central Google ученый
Пеллатт Л., Райс С., Мейсон HD. Антимюллеров гормон и синдром поликистозных яичников: гора слишком высока? Репродукция. 2010; 139: 825–33.
Артикул CAS PubMed PubMed Central Google ученый
Гарг Д., Тал Р. Роль АМГ в патофизиологии синдрома поликистозных яичников. Воспроизвести BioMed Online. 2016; 33: 15–28.
Артикул CAS PubMed PubMed Central Google ученый
Jonard S, Dewailly D. Избыток фолликулов в поликистозных яичниках из-за гиперандрогении внутри яичников может быть основным виновником остановки фолликулов. Обновление Hum Reprod. 2004; 10: 107–17.
Артикул Google ученый
Pigny P, Merlen E, Robert Y, Cortet-Rudelli C, Decanter C, Jonard S, Dewailly D. Повышенный уровень антимюллерова гормона в сыворотке крови у пациентов с синдромом поликистозных яичников: связь с избытком фолликулов яичников и задержкой фолликулов . J Clin Endocrinol Metab. 2003. 88: 5957–62.
Артикул CAS Google ученый
Гроссман М.П., Накадзима С.Т., Фаллат М.Э., Сиоу Ю. Вещество, ингибирующее мюллериан, ингибирует активность ароматазы цитохрома Р450 в культуре клеток лютеина гранулезы человека.Fertil Steril. 2008; 89: 1364–70.
Артикул CAS Google ученый
Пеллатт Л., Райс С., Дилавер Н., Хешри А., Галеа Р., Бринкат М., Браун К., Симпсон Э.Р., Мейсон HD. Антимюллеров гормон снижает чувствительность фолликулов к фолликулостимулирующему гормону в клетках гранулезы человека. Fertil Steril. 2011; 96: 1246–51 e1241.
Артикул CAS Google ученый
Vendola KA, Zhou J, Adesanya OO, Weil SJ, Bondy CA. Андрогены стимулируют ранние стадии роста фолликулов в яичниках приматов. J Clin Invest. 1998. 101: 2622–9.
Артикул CAS PubMed PubMed Central Google ученый
Weil S, Vendola K, Zhou J, Bondy CA. Взаимодействие андрогенов и фолликулостимулирующих гормонов в развитии фолликулов яичников приматов. J Clin Endocrinol Metab. 1999; 84: 2951–6.
Артикул CAS Google ученый
Цяо Дж., Фэн Х.Л. Экстра- и интраовариальные факторы при синдроме поликистозных яичников: влияние на созревание ооцитов и компетентность эмбриона в развитии. Обновление Hum Reprod. 2011; 17: 17–33.
Артикул Google ученый
Filicori M, Cognigni GE, Ciampaglia W. Влияние ЛГ на выход ооцитов и компетентность в развитии. Hum Reprod. 2003; 18: 1357–8, ответ автора 1358-1360.
Артикул CAS Google ученый
Rosas C, Orostica L, Poblete C, Carvajal R, Gabler F, Romero C, Lavandero S, Vega M. Гиперандрогенизм снижает уровень белка GRP78 и поглощение глюкозы стромальными клетками эндометрия человека. Reprod Sci. 2016; 23: 761–70.
Артикул CAS Google ученый
Tal R, Seifer DB, Arici A. Возникающая роль дисрегуляции ангиогенного фактора в патогенезе синдрома поликистозных яичников. Semin Reprod Med. 2015; 33: 195–207.
Артикул CAS Google ученый
Ван Дж., Дикен С., Люстбейдер Дж. В., Торториелло Д.В. Доказательства наличия в эндометрии взрослого человека вещества, подавляющего мюллериан, аутокринной / паракринной системы. Fertil Steril. 2009; 91: 1195–203.
Артикул CAS Google ученый
Carrarelli P, Rocha AL, Belmonte G, Zupi E, Abrao MS, Arcuri F, Piomboni P, Petraglia F.Повышенная экспрессия антимуллерового гормона и его рецептора при эндометриозе. Fertil Steril. 2014; 101: 1353–8.
Артикул CAS Google ученый
Signorile PG, Petraglia F, Baldi A. Антимюллеров гормон экспрессируется тканями эндометриоза и вызывает остановку клеточного цикла и апоптоз в клетках эндометриоза. J Exp Clin Cancer Res. 2014; 33: 46.
Артикул CAS PubMed PubMed Central Google ученый
Габа А., Хорат С., Хагер М., Маркулеску Р., Отт Дж. Базальные уровни антимюллеровского гормона и толщина эндометрия в середине цикла могут предсказать исход после стимуляции цитратом кломифена у ановуляторных женщин с СПКЯ, ретроспективное исследование. Arch Gynecol Obstet. 2019; 300: 1751–7.
Артикул CAS PubMed PubMed Central Google ученый
Chen ZJ, Shi Y, Sun Y, Zhang B, Liang X, Cao Y, Yang J, Liu J, Wei D, Weng N и др.Сравнение свежих и замороженных эмбрионов при бесплодии при синдроме поликистозных яичников. N Engl J Med. 2016; 375: 523–33.
Артикул PubMed PubMed Central Google ученый
Повышенный уровень антимюллерова гормона и снижение уровня ФСГ в фолликулярной жидкости, полученные у женщин с поликистозом яичников во время пункции фолликула для экстракорпорального оплодотворения
https://doi.org/10.1016/j.fertnstert.2009.03.004 Получить права и содержаниеЦель
Подтвердить повышенные уровни антимюллерова гормона (АМГ) в преовуляторных фолликулах у пациентов с синдромом поликистозных яичников (СПКЯ) и изучить роль других гормонов, участвующих в фолликулогенезе, в этой повышенной секреции.
Учреждение
Университетская больница во Франции.
Пациенты
Двадцать два пациента с СПКЯ и 20 контрольных пациентов, перенесших ЭКО.
Вмешательство
В день забора ооцитов у каждого пациента собирали фолликулярную жидкость (FF) из одного маленького фолликула (8–13 мм) (SF) и одного большого фолликула (16-23 мм) (LF).
Основные показатели результата
Уровни АМГ, ФСГ, эстрадиола, андростендиона, ХГЧ и прогестерона в перфолликулах, а также частота наступления беременности.
Результат (ы)
При FF как в SF, так и в LF пациентов с СПКЯ уровень AMH был значительно повышен, а уровень FSH значительно снижен по сравнению с контролем. Уровни обоих гормонов были отрицательно и значительно связаны в контрольной группе, но не при СПКЯ. Уровни АМГ от SF и LF были значительно ниже у пациенток, начавших беременность.
Заключение
Наши результаты показывают, что клетки гранулезы поликистозных яичников продолжают вырабатывать повышенные уровни АМГ, возможно, из-за нарушения доступа ФСГ к фолликулам.Такой избыток FF AMH может иметь вредные последствия для качества и окончательного созревания ооцитов через неизвестные механизмы.
Ключевые слова
Антимюллеров гормон
Мюллерова субстанция
Синдром поликистозных яичников
ФСГ
фолликулярная жидкость
Рекомендуемые статьи Цитирующие статьи (0)
Полный текстCopyright © 2010 American Society for Reproductive Medicine. Опубликовано Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Высокий уровень антимюллерова гормона увеличивает риск рака груди у женщин в пременопаузе
26 января 2019
Читать 3 мин.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если проблема не исчезнет, обратитесь по адресу [email protected].Вернуться в Healio
Анна Зеленюх-Жакотт
Согласно результатам исследования, опубликованным в International Journal of Cancer , высокий уровень антимюллерова гормона связан с повышенным риском рака груди среди большой группы женщин в пременопаузе.
«Связь, которую мы обнаружили между антимюллеровым гормоном и риском рака груди, интересна, потому что у женщин в пременопаузе выявлено мало маркеров риска рака груди», — Энн Зелениух-Жакотт, доктор медицины, профессор кафедры здоровья населения и экологическая медицина в Медицинской школе Нью-Йоркского университета, говорится в пресс-релизе.
Исследователи проанализировали образцы крови 2835 женщин в пременопаузе из 10 предполагаемых когорт с инвазивным раком груди (80%) или раком груди in situ (20%).Исследователи также оценили образцы из 3,122 контрольной группы того же возраста.
Зелениух-Жакотт и его коллеги использовали высокочувствительный иммуноферментный анализ для измерения уровней антимюллерова гормона (АМГ) — биомаркера в яичниковом резерве — и применили условную логистическую регрессию к агрегированному набору данных.
Анализ, скорректированный с учетом других факторов риска рака молочной железы, показал статистически значимую тенденцию к повышению риска рака молочной железы с более высокой концентрацией АМГ ( P <.0001 для тренда).
Исследователи рассчитали OR 1,6 (95% ДИ, 1,31–1,94) для женщин из верхнего квартиля концентрации АМГ по сравнению с женщинами из нижнего квартиля. Эта тенденция сохранялась как среди женщин в пременопаузе (OR = 1,35; 95% ДИ, 1,05–1,73), так и среди женщин в постменопаузе (OR = 1,61; 95% ДИ, 1,03–2,53).
«Наше исследование показало умеренное увеличение риска, и мы надеемся, что могут быть найдены дополнительные маркеры, которые — в сочетании с антимюллеровым гормоном — могут существенно улучшить индивидуальные прогнозы риска рака груди», — заявила Зеленюх-Жакотт в своем сообщении.
HemOnc Today поговорила с Зеленюх-Жакотт об исследовании, важности результатов ее команды и других исследованиях, проводимых в этой области.
Вопрос: Можете ли вы объяснить обоснование исследования?
A nswer : Американское онкологическое общество рекомендует ежегодно проходить маммографический скрининг начиная с 45 лет. Целевая группа профилактических услуг США рекомендует проводить скрининг раз в два года для женщин в возрасте от 50 до 74 лет, хотя в этой рекомендации указывается, что женщины могут решить начать раньше, исходя из своих «ценностей, касающихся конкретных преимуществ и вреда».«Мы хотели улучшить модели прогнозирования риска, чтобы женщины могли учитывать свой индивидуальный риск рака груди при принятии решения, в каком возрасте начинать маммографический скрининг. . Выявление маркеров риска — это первый шаг в улучшении моделей прогнозирования риска. Предоставление молодым женщинам точной оценки риска рака груди также может помочь им решить, принимать ли тамоксифен для профилактики рака груди в относительно молодом возрасте.
ПЕРЕРЫВ
Q: Что делает это исследование уникальным ?
A: Наше исследование было первым консорциумным исследованием большого числа женщин, целью которого была оценка степени риска, связанного с уровнем АМГ.В каждую когорту входили женщины с разными характеристиками, проживавшие в США, Великобритании, Италии и Швеции, что дает уверенность в обобщаемости результатов. Подобных исследований проводилось не так много, и степень увеличения риска, наблюдаемая в этих исследованиях, варьировалась. Более крупные исследования дают более точные оценки риска.
Q: Как ваши ключевые выводы могут быть включены в модели прогнозирования риска, чтобы лучше выявлять женщин с повышенным риском рака груди?
A: Модель Гейл — модель прогнозирования риска, наиболее часто используемая для женщин, которые, как известно, не подвержены повышенному риску рака груди из-за семейного анамнеза или генетической мутации, — доступна в Интернете под названием «Риск рака груди». Инструмент оценки.Модель прогнозирует риск рака груди на основе возраста, расы / этнической принадлежности, возраста наступления менархе и первой доношенной беременности, семейного анамнеза рака груди и анамнеза доброкачественных заболеваний груди. Эта модель дает довольно хорошие оценки количества женщин, у которых разовьется рак груди, в группах, определенных возрастом и другими характеристиками, но она не позволяет предсказать, у каких женщин разовьется рак груди, а у каких — нет. Включение в эту модель маркеров, тесно связанных с риском рака груди, может улучшить прогнозирование индивидуального риска.
Q: Какие дополнительные исследования запланированы?
A: Мы изучаем влияние включения AMH и тестостерона — другого гормона, связанного с повышенным риском рака груди при измерении до менопаузы — в модели Гейл на точность прогнозирования риска. Эти результаты еще не опубликованы. Однако, поскольку повышенный риск, связанный с АМГ и тестостероном, имеет умеренную величину, мы уже можем сказать, что потребуются дополнительные маркеры для повышения точности модели Гейл до уровня, который оправдал бы измерение этих гормонов для прогнозирования риска рака груди.Поэтому важно продолжать поиск маркеров риска рака груди.
ПЕРЕРЫВ
Q: Есть ли еще что-нибудь, что вы хотели бы упомянуть?
A: Подобное международное сотрудничество имеет решающее значение для обнаружения в крови маркеров рака груди у молодых женщин, поскольку в индивидуальные исследования часто включается слишком мало молодых женщин, чтобы получить надежные результаты. — Дженнифер Саутхолл
Артикул:
Ge W и др. Инт Дж. Рак . 2018; DOI: 10.1002 / ijc.31249.
Для дополнительной информации:
Anne Zeleniuch-Jacquotte, MD , можно добраться в офисе NYU Langone Academic, 650 First Ave., Fifth Floor, New York, NY 10016; электронная почта: [email protected].
Раскрытие информации : Зеленюх-Жакотт не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей. Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже.Если проблема не исчезнет, обратитесь по адресу [email protected].Вернуться в Healio
Антимюллеров гормон (АМГ) помогает прогнозировать фертильность
Что такое антимюллеров гормон (АМГ)?
Антимюллеров гормон (АМГ) — это гормон, вырабатываемый клетками, которые поддерживают спящий пул яиц в яичниках. Следовательно, более высокий уровень АМГ предполагает больший пул яиц (или больший резерв яичников). «Это очень полезный тест для нас, потому что он не склонен к таким сильным колебаниям, как уровни фолликулостимулирующего гормона (ФСГ), и дает нам еще один угол для оценки резерва яичников.Что касается фертильности человека, то чем выше уровень, тем лучше », — говорит доктор Джозеф Дойл из офиса Shady Grove Fertility в Роквилле, штат Мэриленд.
Знаете ли вы: уровень АМГ более 1 свидетельствует о хорошем резерве яичников? УровеньАМГ определяется с помощью анализа крови, и, в отличие от других гормонов, уровни существенно не меняются в течение менструального цикла. Это означает, что вы можете проверять его в любой день цикла, и он не имеет тенденции меняться от цикла к циклу, как уровни ФСГ.Еще одним преимуществом AMH является то, что он дает представление об ориентировочном количестве яйцеклеток, которое можно извлечь во время цикла ЭКО или замораживания яиц, а также о том, сколько лекарств потребуется для стимуляции яичников во время цикла лечения.
Антимюллеров гормон (АМГ): часть первоначальной оценки фертильностиИзмерение уровня антимюллерова гормона теперь является частью первоначальной оценки фертильности вместе с:
Эти тесты вместе с вашим медицинским, репродуктивным и семейным анамнезом помогут вашему специалисту по фертильности определить наиболее подходящее для вас лечение.Пациенты, которые хотят сохранить свою фертильность и заморозить яйцеклетки, не заполняют HSG или анализ спермы
Что такое хороший яичниковый резерв по сравнению со сниженным яичниковым резервом?Яичниковый резерв — это количество и качество яйцеклеток (женских яиц), которые есть у женщины. Хороший резерв яичников означает, что у вас большое количество ооцитов хорошего качества, в то время как низкий резерв яичников означает, что у вас меньшее количество ооцитов низкого качества. Количество яйцеклеток можно измерить с помощью теста яичникового резерва, который оценивает уровень ваших репродуктивных гормонов, включая AMH, а также ультразвукового исследования для оценки вашего AFC.
Яичниковый резерв неуклонно и естественным образом уменьшается по мере того, как женщина стареет примерно до 35 лет, когда это сокращение начинает увеличиваться, пока, наконец, не наступит менопауза. Фертильность каждой женщины уникальна, и количество яиц во время полового созревания и скорость изменения от полового созревания до менопаузы варьируется от женщины к женщине. Эта скорость изменений частично предопределена вашей генетикой. У женщин с семейным анамнезом ранней менопаузы больше шансов начать снижение фертильности в более молодом возрасте.
Возраст имеет наибольшее значение
Несмотря на то, что семейный анамнез важен, наиболее важным модифицирующим фактором хорошего резерва яичников является возраст. Снижение овариального резерва у более молодой пациентки (<35 лет) не обязательно совпадает с уменьшением овариального резерва у пожилой пациентки. У более молодой женщины, возможно, уменьшился овариальный резерв, и, хотя количество имеющихся яиц может быть уменьшено, из-за ее возраста качество яйцеклеток все еще может быть высоким. Возраст в сочетании с оценкой резерва яичников и другими элементами вашей оценки фертильности и целей построения семьи будет определять ваш путь лечения.
Примечание редактора: этот пост был первоначально опубликован в декабре 2012 года и был обновлен для полноты с января 2018 года.
РАСПИСАНИЕ НАЗНАЧЕНИЯ
Для получения дополнительной информации или по телефону назначьте встречу с одним из наших врачей, пожалуйста, поговорите с одним из наших контактных лиц для новых пациентов по телефону 877-971-7755.
ассоциации между биомаркерами яичникового резерва и бесплодием у пожилых женщин репродуктивного возраста | Гериатрия | JAMA
Ключевые моментыВопрос Связано ли уменьшение овариального резерва, измеряемое низким уровнем антимюллерова гормона (АМГ), с бесплодием у женщин позднего репродуктивного возраста?
Выводы В этом когортном исследовании времени до наступления беременности среди женщин в возрасте от 30 до 44 лет без бесплодия в анамнезе женщины с низким значением АМГ имели 84% прогнозируемую кумулятивную вероятность зачатия к 12 циклам попытки забеременеть по сравнению с 75% у женщин с нормальное значение АМГ, разница несущественная.
Значение У женщин, пытающихся забеременеть естественным путем, снижение резерва яичников не было связано с бесплодием; женщин следует предостеречь от использования уровней АМГ для оценки их текущей фертильности.
Важность Несмотря на отсутствие доказательств их полезности, биомаркеры овариального резерва продвигаются как потенциальные маркеры репродуктивного потенциала.
Объектив Определить связь между биомаркерами овариального резерва и репродуктивным потенциалом женщин позднего репродуктивного возраста.
Дизайн, обстановка и участники Проспективное когортное исследование срока до беременности (2008 г. — дата последнего наблюдения в марте 2016 г.) женщин (N = 981) в возрасте от 30 до 44 лет без бесплодия в анамнезе, которые пытались забеременеть в течение 3 месяцев или менее, набран из общины в районе Роли-Дарем, Северная Каролина.
Открытия Уровень сыворотки антимуллерова гормона (АМГ), фолликулостимулирующего гормона (ФСГ) и ингибина В в сыворотке крови в ранней фолликулярной фазе и уровень ФСГ в моче.
Основные результаты и мероприятия Основными исходами были совокупная вероятность зачатия к 6 и 12 циклам попытки и относительная плодовитость (вероятность зачатия в данном менструальном цикле). Зачатие было определено как положительный результат теста на беременность.
Результаты В общей сложности 750 женщин (средний возраст 33,3 [SD, 3,2] года; 77% белые; 36% с избыточным весом или ожирением) сдали образцы крови и мочи и были включены в анализ.После поправки на возраст, индекс массы тела, расу, текущий статус курения и недавнее использование гормональных контрацептивов у женщин с низкими значениями АМГ (<0,7 нг / мл [n = 84]) прогнозируемая вероятность зачатия на 6 лет существенно не различалась. циклы попыток (65%; 95% ДИ, 50-75%) по сравнению с женщинами (n = 579) с нормальными значениями (62%; 95% ДИ, 57-66%) или 12 циклами попыток (84%). % [95% ДИ, 70% -91%] против 75% [95% ДИ, 70% -79%], соответственно). У женщин с высокими значениями ФСГ в сыворотке (> 10 мМЕ / мл [n = 83]) прогнозируемая вероятность зачатия после 6 циклов попыток существенно не отличалась по сравнению с женщинами. (n = 654) с нормальными значениями (62%; 95% ДИ, 57% -66%) или после 12 циклов попыток (82% [95% ДИ, 70% -89%] по сравнению с 75% [95% ДИ, 70% -78%] соответственно).У женщин с высокими значениями ФСГ в моче (> 11,5 мМЕ / мг креатинина [n = 69]) прогнозируемая вероятность зачатия после 6 циклов попыток существенно не различалась (61%; 95% ДИ, 46% -74%) по сравнению с женщины (n = 660) с нормальными значениями (62%; 95% ДИ, 58% -66%) или после 12 циклов попытки (70% [95% ДИ, 54% -80%] против 76% [95% ДИ , 72% -80%] соответственно). Уровни ингибина B (n = 737) не были связаны с вероятностью зачатия в данном цикле (отношение рисков на увеличение на 1 пг / мл, 0.999; 95% ДИ, 0,997-1,001).
Выводы и значимость Среди женщин в возрасте от 30 до 44 лет без бесплодия в анамнезе, которые пытались забеременеть в течение 3 месяцев или меньше, биомаркеры, указывающие на снижение резерва яичников по сравнению с нормальным резервом яичников, не были связаны со снижением фертильности. Эти данные не подтверждают использование тестов мочи или фолликулостимулирующих гормонов крови или уровней антимюллерова гормонов для оценки естественной фертильности у женщин с этими характеристиками.
Женщины откладывают свои попытки зачать ребенка до более старшего возраста. 1 С возрастом количество ооцитов и фолликулов у женщины уменьшается. 2 По мере уменьшения пула ооцитов и фолликулов клетки гранулезы секретируют меньше ингибина B и антимуллерова гормона (AMH). 3 , 4 Более низкие уровни ингибина B приводят к более раннему и быстрому увеличению фолликулостимулирующего гормона (ФСГ) во время фолликулярной фазы. 5 В совокупности АМГ, ФСГ в ранней фолликулярной фазе и ингибин В называются биомаркерами овариального резерва.
Способность этих биомаркеров прогнозировать репродуктивный потенциал сомнительна. Антимуллеров гормон был связан со временем наступления менопаузы в ряде когорт. 6 , 7 Среди женщин с бесплодием, которым проводят контролируемую гиперстимуляцию яичников для экстракорпорального оплодотворения, АМГ является отличным предсказателем выхода ооцитов. 8 Исследования способности этих биомаркеров предсказать, какие женщины забеременеют при экстракорпоральном оплодотворении, не дали согласованных результатов. 9 -11 Несмотря на отсутствие доказательств их полезности, биомаркеры овариального резерва используются в качестве маркеров репродуктивного потенциала или тестов фертильности. В продаже имеются домашние тесты на фертильность, основанные на уровне ФСГ на третий день в моче. Кроме того, врачи используют эти тесты при консультировании по поводу плановой криоконсервации ооцитов.
Целью данного исследования было определить степень, в которой биомаркеры овариального резерва (сывороточный AMH в ранней фолликулярной фазе, сывороточный FSH, сывороточный ингибин B и мочевой FSH) были связаны с репродуктивным потенциалом, как измерено с помощью вероятности зачатия. естественно, в когорте женщин старшего репродуктивного возраста, набранных из общины. Была выдвинута гипотеза, что женщины со значениями биомаркеров, предполагающими снижение резерва яичников, будут иметь более низкую вероятность зачатия в данном цикле (оплодотворяемость) на 6 циклов и на 12 циклов попыток зачать ребенка.
Исследование «Время зачатия», проспективное когортное исследование времени до наступления беременности, проводилось с апреля 2008 г. по март 2016 г. (дата последнего наблюдения). Женщины имели право участвовать в исследовании, если им было от 30 до 44 лет, они пытались зачать ребенка в течение 3 месяцев или меньше и проживали вместе с партнером-мужчиной. Женщины были исключены, если у них были известные проблемы с фертильностью (стерилизация в анамнезе, диагноз синдрома поликистозных яичников, предыдущее или текущее использование методов лечения бесплодия, известная закупорка маточных труб, хирургически диагностированный эндометриоз) или партнер с историей бесплодия.Женщины, которые в настоящее время кормили грудью или использовали инъекционные гормональные контрацептивы в предыдущем году, также были исключены. Это исследование было одобрено институциональным наблюдательным советом Университета Северной Каролины; все участники дали письменное информированное согласие.
Женщин набирали через листовки в общине, радио и печатную рекламу, информационные письма и массовую рассылку по электронной почте. Их проверяли на соответствие критериям по телефону с помощью стандартной анкеты. Женщины, которые соответствовали критериям отбора, заполнили анкету, включая демографические данные и информацию о факторах, потенциально связанных с фертильностью.Чтобы охарактеризовать исследуемую популяцию, в эту анкету был включен вопрос о расе. Женщины самостоятельно выбрали свою расу из представленных категорий. Женщинам было предложено связаться с координатором исследования при последующих менструациях. У них был запланирован исследовательский визит на 2, 3 или 4 день менструального цикла. Женщинам отправили по почте набор для сбора мочи и инструктировали собрать образец мочи в первый раз в день их посещения для исследования. Во время этого визита у участника были взяты образцы крови и мочи (если они не были собраны дома).Женщинам были предоставлены домашние тесты на беременность (чувствительность: 20 мМЕ / мл хорионического гонадотропина человека). В течение первых 3 лет исследования женщинам предлагалось выполнять тест на беременность при пропущенных менструациях; впоследствии женщины были проинструктированы проводить тесты, начиная с 28-го дня менструального цикла и затем каждые 3 дня.
Пытаясь зачать ребенка, женщины вели ежедневный дневник, в который они записывали кровотечение, половой акт, лекарства и результаты тестов на беременность. Женщины заполняли эти дневники на срок до 4 месяцев, а затем заполняли ежемесячные анкеты.Первоначальные версии анкет были на бумаге, а более поздние версии были размещены в Интернете. Женщины были проинструктированы связаться с персоналом исследования, если у них положительный результат теста на беременность. Им было предоставлено бесплатное ультразвуковое исследование при беременности на сроке от 6 до 8 недель, чтобы стимулировать передачу результатов. Первоначальное наблюдение за женщинами длилось до 6 месяцев, но впоследствии в марте 2010 года протокол был изменен для наблюдения за всеми женщинами на срок до 12 месяцев после попытки забеременеть. Женщины были исключены из исследования при начале приема лекарств от бесплодия, по запросу (чаще всего из-за того, что они двигались или перестали пытаться зачать ребенка) или когда они были потеряны для последующего наблюдения.
Образцы сыворотки хранили при -30 ° C до анализа. Образцы были отправлены замороженными одной партией в лабораторию репродуктивной эндокринологии Университета Южной Калифорнии. Там они были проанализированы с использованием чувствительных и специфических тестов на ФСГ (анализатор Immulite, Siemens), ингибин B (иммуноферментный анализ [ELISA], Ansh Laboratories) и AMH (сверхчувствительный AMH ELISA, Ansh Laboratories; нижний предел обнаружения, 0,078 нг / мл).Коэффициенты вариации между анализами варьировались от 4% до 5% для ФСГ, от 5% до 8% для ингибина В и от 9% до 11% для АМГ.
Образцы мочи хранились и отправлялись замороженными в лабораторию репродуктивной эндокринологии Национального института охраны труда, Цинциннати, Огайо. Там их анализировали на ФСГ и креатинин, как описано ранее. 12 Для корректировки скорости потока мочи значения ФСГ в моче были разделены на соответствующую концентрацию креатинина.Результаты представлены в миллиметровых единицах ФСГ на миллиграмм креатинина. Коэффициенты вариации внутри анализа составляли 3,5% для ФСГ и 1,5% для креатинина.
Основными критериями результатов исследования были совокупная вероятность зачатия к 6 менструальным циклам и к 12 менструальным циклам и относительная плодовитость. Вторичных исходов не было, но запланированный исследовательский анализ изучал связи между уровнями АМГ и первичными исходами среди возрастных подгрупп и между подгруппами с паритетом.
Биомаркеры овариального резерва считались категориальными переменными, когда был доступен информированный выбор точек отсечения. Было высказано предположение, что связь между AMH и фертильностью будет нелинейной. После изучения клинических пороговых значений АМГ, составляющих 0,4 нг / мл, 0,7 нг / мл и 1,0 нг / мл, на основании предыдущих исследований было выбрано среднее пороговое значение 0,7 нг / мл. 13 90-й процентиль был выбран в качестве порогового значения АМГ верхнего уровня (8,5 нг / мл).Клиническое значение 10 мМЕ / мл было выбрано априори в качестве порогового значения сывороточного ФСГ. 14 Для мочи соответствующее значение ФСГ составляет 11,5 мМЕ / мг креатинина, как указано ранее. 13 Ингибин B был смоделирован как непрерывная переменная, поскольку клинические пороговые значения отсутствовали.
Непараметрический двухфакторный анализ использовался для сравнения медианных уровней биомаркеров по характеристикам участников. Поскольку не все женщины вошли в один и тот же момент во время своих попыток зачать ребенка, а некоторые женщины отказались, начали принимать лекарства от бесплодия или были потеряны для последующего наблюдения, когорта была проанализирована с использованием модели пропорциональных рисков Кокса с дискретным временем.Время было менструальным циклом с риском беременности (цикл попытки беременности). Цикл попытки забеременеть определялся с момента начала попытки женщины зачать ребенка, а не с момента включения в исследование. Цикл попыток при включении определялся циклом попытки беременности (обычно цикл 1, 2 или 3), в котором женщина начала участие (заполненные дневники или исходный вопросник). Женщины подвергались цензуре в то время, когда они отказывались от участия, начинали принимать лекарства от бесплодия или были потеряны для последующего наблюдения. Таким образом, в анализ были включены циклы от зачисления до цензуры.Поскольку время в этих моделях измеряется менструальными циклами (а не хронологическим временем), коэффициенты риска (HR) упоминаются как коэффициенты оплодотворяемости, которые представляют собой относительную вероятность беременности в данном цикле для подвергшейся воздействию группы по сравнению с контрольной группой. 15 В таких моделях HR менее 1 предполагает снижение фертильности в группе, подвергшейся воздействию (или нереферентной).
Затем были использованы модели пропорциональных рисков Кокса для расчета совокупной вероятности зачатия (с 95% доверительным интервалом) в 6 и 12 циклах попыток для каждого уровня биомаркера.Все модели были скорректированы с учетом возраста (3 категории: <35, 35-37 или 38-44 лет), 16 индекса массы тела (4 категории: <18,5, 18,5-24,9, 25-29,9 или ≥30; рассчитано) вес в килограммах, разделенный на рост в квадратных метрах), 17 раса (белая или небелая), текущий статус курения (да или нет) и использование гормональных контрацептивов в предыдущем году (да или нет). Также были построены скорректированные кривые Каплана-Мейера с 95% доверительным интервалом. Прогнозируемые вероятности и кривые Каплана-Мейера были рассчитаны путем установки всех ковариат на среднее значение когорты.Планируемый анализ подгрупп проводился по возрасту и паритету. Для проверки взаимодействия по возрасту и паритету использовался тест отношения правдоподобия, чтобы сравнить соответствие модели без элемента взаимодействия с параметром модели, включая член взаимодействия. Кроме того, был проведен апостериорный анализ чувствительности путем создания дополнительных моделей Кокса для оценки различных значений отсечения и оценки потенциальных систематических ошибок.
Размер выборки 750 женщин был выбран на основе априорного анализа мощности.Консервативно предполагалось, что 10% потери для последующего наблюдения, 70% беременностей в контрольной группе, 57% беременностей к 6 месяцам в группе с пониженным резервом яичников и 80% мощности при уровне ошибок I типа 0,05 были консервативными. пилотное исследование. 13 SAS версии 9.3 (SAS Institute Inc) и R версии 3.3.0 (R Project) использовались для статистического анализа. Все тестирование было двусторонним. P < .05 считалось статистически значимым; поправки на множественные сравнения не было.
Схема исследования представлена на Рисунке 1.Было зачислено девятьсот восемьдесят одна женщина; 770 из этих женщин посетили учебный визит; В конечном итоге в анализ были включены 750 женщин. Из них 37 (5%) отказались от лечения, 47 (6%) начали прием препаратов для лечения бесплодия, 56 (7%) были потеряны для последующего наблюдения, 487 (65%) забеременели и 123 (17%) завершили исследование, но не приняли участие в исследовании. зачать. Из проанализированной когорты 69% участников были в возрасте от 30 до 34 лет, 19% были в возрасте от 35 до 37 лет и 12% были в возрасте 38 лет и старше. Большинство участников были белыми (77%) и высокообразованными (62% с высшим образованием).Большинство женщин имели нормальный индекс массы тела (62%), в то время как 3% имели недостаточный вес, а 36% имели избыточный вес или ожирение. Анализ Кокса показал, что вероятность зачатия составляла 65% при 6 циклах попытки и 77% при 12 циклах попытки. Плодовитость за каждый цикл попыток представлена в Таблице 1.
Статистика распределения наблюдаемых биомаркеров овариального резерва выглядит следующим образом. Значения сывороточного АМГ, ингибина В и ФСГ отсутствовали у 13 участников исследования (2%), которые были исключены из анализов АМГ, ингибина В и ФСГ соответственно.Значения ФСГ в моче отсутствовали у 21 участника (3%), которые были исключены из анализа уровня ФСГ в моче. У каждого участника было зарегистрировано как минимум 1 значение биомаркера. Одиннадцать процентов женщин имели значение АМГ 0,7 нг / мл или меньше; По замыслу, 10% имели значение АМГ 8,5 нг / мл или выше. Одиннадцать процентов имели значение сывороточного ФСГ 10 мМЕ / мл или выше; 9% имели скорректированный на креатинин уровень ФСГ в моче 11,5 мМЕ / мг креатинина или выше. Среднее значение ингибина B составляло 70 (межквартильный размах, 38-102) пг / мл.
В таблице 2 представлены нескорректированные медианные значения каждого биомаркера (с межквартильными диапазонами) по характеристикам участников. Как и ожидалось, с возрастом уровень АМГ снизился, а уровень ФСГ в моче увеличился. По сравнению с женщинами, не страдающими ожирением, женщины с ожирением имели более низкие значения АМГ ( P = 0,007) и ингибина B ( P = 0,005). Значения биомаркеров существенно не различались в зависимости от уровня образования, расы, статуса курения, использования гормональных контрацептивов в предыдущем году или цикла попытки беременности, в котором участвовала участница исследования.В этом нескорректированном анализе у женщин, которые ранее были беременными, были значительно более низкие значения АМГ и более высокие значения ФСГ в моче.
Значенияантимюллерова гормона статистически не различались в разные годы сбора образцов (тест Круксала-Уоллиса: P = 0,83), что позволяет предположить, что уровни АМГ, измеренные с помощью анализа Ansh, стабильны при длительном хранении при -30 ° C. Подмножество образцов (n = 99) было проанализировано на наличие AMH с использованием лабораторного анализа диагностических систем, анализа Gen II (Beckman Coulter) и анализа Ansh.Между значениями анализа была высокая парная корреляция (Pearson r = 0,96-0,97; P <0,001).
Прогнозируемая вероятность зачатия на 6 циклов или 12 циклов попыток, рассчитанная по моделям Кокса, не была ниже для женщин с низким АМГ или высоким ФСГ, как предполагалось (таблица 3). У женщин с низкими значениями АМГ (<0,7 нг / мл) кумулятивная вероятность зачатия к 6 циклам попытки существенно не различалась (65%; 95% ДИ, 50-75%) по сравнению с женщинами с нормальными значениями (62%). ; 95% ДИ, 57% -66%) или 12 циклов попыток (84% [95% ДИ, 70% -91%] против 75% [95% ДИ, 70% -79%], соответственно).У женщин с высокими значениями сывороточного ФСГ (> 10 мМЕ / мл) кумулятивная вероятность зачатия после 6 циклов попытки существенно не различалась (63%; 95% ДИ, 50-73%) по сравнению с женщинами с нормальными значениями (62 %; 95% ДИ, 57–66%) или после 12 циклов попыток (82% [95% ДИ, 70–89%] против 75% [95% ДИ, 70–78%]). Кривые Каплана-Мейера, сравнивающие скорректированные кумулятивные вероятности зачатия по категориям биомаркеров яичникового резерва, представлены на рисунке 2. Хотя кривые показывают более длительное время до беременности у женщин с более высокими значениями АМГ и для женщин с более низкими значениями ФСГ, доверительные интервалы перекрываются для обоих биомаркеров. .Кривые высокого и нормального уровня ФСГ в моче практически неотличимы друг от друга.
Относительная плодовитость в соответствии со значениями биомаркеров, рассчитанными по моделям Кокса с дискретным временем, представлена как HR в таблице 3. У женщин с низкими значениями АМГ или высокими значениями ФСГ в сыворотке, которые предполагают уменьшение овариального резерва, не снижалась плодовитость, как предполагалось. . Уровни ингибина B (n = 737) также не были связаны с вероятностью зачатия в данном цикле (HR на увеличение на 1 пг / мл, 0.999; 95% ДИ, 0,997-1,001).
Был проведен плановый анализ подгрупп по возрасту и рождению (Таблица 4). В каждой возрастной группе низкий уровень АМГ не был связан со снижением фертильности. Точечные оценки предполагали более высокую фертильность среди женщин с низким уровнем АМГ в любом возрасте. Взаимосвязь между высоким уровнем АМГ и фертильностью, по-видимому, различалась в зависимости от возраста женщины. У более молодых женщин высокий уровень АМГ свидетельствует о снижении фертильности. Однако у пожилых женщин высокий уровень АМГ свидетельствует о более высокой плодовитости.Хотя эти точечные оценки различались, доверительные интервалы перекрываются, и возрастное взаимодействие не оказалось статистически значимым ( P = 0,35). Последующий анализ в подгруппах по истории беременности также не выявил значительного изменения эффекта от истории беременности (Таблица 4).
При анализе чувствительности были изучены различные пороговые значения для AMH. Женщины со значениями АМГ 0,4 нг / мл или ниже имели ОР 1,40 (95% ДИ, 0,95–2,07) по сравнению с женщинами со значениями АМГ между 0.4 нг / мл и 5,0 нг / мл. Женщины со значениями АМГ 1,0 нг / мл или ниже имели ОР 1,16 (95% ДИ 0,89–1,50) по сравнению с женщинами со значениями АМГ от 1,0 до 5,0 нг / мл. Также после корректировки на использование гормональных контрацептивов в предшествующие 3 месяца (информация доступна для 552 женщин) HR были дальше от нуля, но оставались статистически незначимыми (для низкого AMH: HR, 1,30 [95% ДИ, 0,92–1,86]; для высокий АМГ: ОР 0,75 [95% ДИ 0,51–1,10]). Ограничение анализа женщинами, включенными в исследование в циклах 1, 2 или 3 попытки беременности, не изменило результатов.
В этой когорте женщин более старшего репродуктивного возраста, пытающихся зачать ребенка естественным путем, биомаркеры уменьшенного резерва яичников (низкий АМГ или высокий ФСГ) не были связаны со снижением фертильности или более низкой совокупной вероятностью зачатия к 6 или 12 циклам попытки беременности. Уровни ингибина B в ранней фолликулярной фазе также не были связаны с исходами фертильности.
В более раннем небольшом пилотном исследовании (n = 100 женщин) мы обнаружили, что низкий АМГ (≤0.7 нг / мл), измеренная с помощью лабораторного анализа диагностических систем, была связана с 60% снижением вероятности зачатия в зависимости от дня. 13 Эти результаты отличаются от текущих результатов в этой более крупной когорте, скорее всего, из-за размера выборки. Кроме того, в пилотном исследовании использовался анализ вероятности для конкретного дня. Этот метод использует информацию о моделях полового акта во время овуляции, основанную на календарном методе, который мог привести к ошибочной классификации. Кроме того, использовали другой анализ AMH.Есть некоторые свидетельства того, что анализ Ansh дает более высокие значения по сравнению с другими анализами. 18 Однако был проведен анализ чувствительности с более высокими (АМГ ≤1,0 нг / мл) и более низкими (АМГ ≤0,4 нг / мл) значениями отсечения, и все еще не было доказательств снижения фертильности ни в одной из групп с низким АМГ. .
В трех других публикациях изучались АМГ и оплодотворяемость у женщин, пытающихся зачать ребенка естественным путем, и ни в одной из них не сообщалось о значимых ассоциациях. 19 -21 В проспективном исследовании 186 датских женщин Hagen et al 19 обнаружили, что у женщин с низким уровнем АМГ (≤10 пмоль / л; примерно ≤1.4 нг / мл) по сравнению с женщинами с нормальным уровнем АМГ (ОР 0,81; 95% ДИ 0,44–1,40). В когорту вошли женщины в возрасте от 20 до 20 лет, размер выборки был меньше (n = 186). Вторичный анализ исследования EAGER, которое представляло собой рандомизированное клиническое испытание аспирина у женщин (средний возраст 28,7 [SD, 4,8] лет) с предшествующей потерей беременности, не обнаружил статистически значимой связи между низким уровнем АМГ и фертильностью с использованием Gen II. анализ с пороговым значением 1,0 нг / мл (HR, 1,13; 95% ДИ, 0,85–1,49). 20
Учитывая, что предыдущие исследования были небольшими или основывались на вторичных анализах, вывод текущего исследования о том, что у женщин со сниженным овариальным резервом не снижалась фертильность, был неожиданным и противоречил гипотезе. Хотя и резерв яичников, и фертильность снижаются с хронологическим возрастом, если смотреть на данные поперечного сечения, связь между резервом яичников данной женщины и факторами, влияющими на ее фертильность, такими как качество яйцеклеток, может быть незначительной.Однако уровни антимюллерова гормона и ФСГ могут влиять на рекрутирование фолликулов у лиц с пониженным овариальным резервом. Возможно, что низкий уровень АМГ позволяет большей части оставшегося пула примордиальных фолликулов активироваться и стать растущими фолликулами. Кроме того, высокий уровень ФСГ, наблюдаемый у женщин с низким резервом, может привести к «суперовуляции» с мультифолликулярной овуляцией, увеличивая шансы на беременность. Ранее было показано, что женщины преклонного возраста матери подвергаются более высокому риску дизиготных близнецов. 22
Была выдвинута гипотеза, что у более молодых женщин с уменьшенным овариальным резервом, возможно, не снизилась фертильность, а у женщин старшего возраста снизилась. Однако исследовательский анализ подгрупп не подтвердил это. Ни у более молодых (30-35 лет), ни у пожилых женщин с пониженным овариальным резервом (по данным AMH) не наблюдалось снижения фертильности. Однако высокий уровень АМГ несущественно ассоциировался со снижением фертильности у молодых женщин и повышением фертильности у пожилых женщин.Хаген и др. Аналогичным образом обнаружили, что у молодых женщин с высоким уровнем АМГ была снижена оплодотворяемость (ОР 0,62; 95% ДИ 0,39–0,99). 19 Антимюллеров гормон является не только маркером яичникового резерва, но и потенциальным маркером синдрома поликистозных яичников. В то время как соответствующее значение порогового значения АМГ для синдрома поликистозных яичников обсуждается, многочисленные исследования показали, что АМГ повышен у женщин с синдромом поликистозных яичников. 18 , 23 У молодых женщин высокие значения АМГ могут указывать на недиагностированный синдром поликистозных яичников.Высокий уровень АМГ может препятствовать чувствительности фолликулов к ФСГ и последующему привлечению фолликулов. 24 У пожилых женщин высокий уровень АМГ может просто отражать превышение нормального овариального резерва. Необходимы дальнейшие исследования женщин с высоким уровнем АМГ в различных возрастных группах и с течением времени.
Это исследование имеет несколько сильных сторон. Во-первых, он был специально разработан для решения важного вопроса общественного здравоохранения: является ли снижение резерва яичников причиной бесплодия у женщин позднего репродуктивного возраста? Во-вторых, размер выборки достаточно велик, чтобы обнаруживать даже относительно небольшие эффекты.В-третьих, его перспективный дизайн позволяет проводить тестирование биомаркеров в подходящее время и включать участников с полным спектром естественной фертильности. В-четвертых, большинство женщин были включены в исследование во время первых трех менструальных циклов попытки зачать ребенка. Позднее набираемые в исследование женщины отбирают менее фертильную когорту, поскольку 50% женщин могут зачать ребенка в течение первых трех циклов. 25 В-пятых, исследуемый возрастной диапазон (30–44 года) ориентирован на женщин с риском снижения резерва яичников. В-шестых, протокол исследования стандартизировал критерий результата (зачатие женщины в какой-либо конкретный менструальный цикл).Это было сделано путем предоставления женщинам бесплатных тестов на беременность и инструктажей о том, когда проводить тесты на беременность. Таким образом, чувствительность теста была одинаковой для всех, а установленные сроки тестирования сводили к минимуму возможность дифференциальной идентификации беременностей. В-седьмых, оцениваемые маркеры овариального резерва включают ФСГ в моче, который используется в имеющихся в продаже тест-наборах для женщин для оценки их естественной фертильности. Таким образом, результаты напрямую связаны с полезностью таких тестов.В-восьмых, биомаркеры измерялись у всех участников исследования на ранней фолликулярной фазе, что сводило к минимуму возможные вариации биомаркеров из-за фазы менструального цикла.
Это исследование имеет несколько ограничений. Во-первых, основным результатом было зачатие, а не рождение ребенка. Плодовитость, способность к воспроизводству, состоит из способности как зачать, так и вынести плод до жизнеспособности. Уменьшение резерва яичников может повлиять на плодовитость, увеличивая риск выкидыша, возможно, из-за влияния на качество яйцеклеток.Предыдущие исследования на сегодняшний день не показали такой связи. 26 , 27 Во-вторых, не все женщины оставались в исследовании в течение 12 циклов попыток. Это было ожидаемо, учитывая когорту людей старшего репродуктивного возраста. Текущие рекомендации советуют женщинам старше 35 лет пройти обследование на бесплодие после 6 месяцев попытки. Средний цикл попыток, с которого женщины начали лечение бесплодия в исследовании, составлял 8 циклов. По этой причине было рассчитано зачатие за 6 циклов попыток, и были построены модели Кокса, которые позволяют участникам, которые начинают принимать лекарства от бесплодия, вносить свой вклад в анализ до тех пор, пока они не будут подвергнуты цензуре на использование их лекарств от бесплодия.В-третьих, овуляция не оценивалась. Эта информация позволила бы нам оценить самое строгое определение оплодотворяемости (вероятность зачатия в данном овуляторном менструальном цикле). В-четвертых, партнеры-мужчины не предоставили образец спермы для анализа. Однако нет оснований полагать, что женщины с уменьшенным овариальным резервом с большей или меньшей вероятностью будут иметь партнера с мужчиной с аномальными параметрами спермы. В-пятых, не все женщины участвовали в первом, втором или третьем цикле попытки; однако, когда были исключены менее 10% женщин, поступивших после третьего цикла попыток, результаты не различались.В-шестых, хотя были изучены различные пороговые значения AMH, исследование не имело возможности рассматривать очень низкие (≤0,1 нг / мл) значения AMH, которые отражают уменьшение резерва яичников, более соответствующее позднему перименопаузальному переходу. Возможно, что на таких поздних стадиях может быть нарушена оплодотворяемость, особенно если это приводит к частой ановуляции.
Среди женщин в возрасте от 30 до 44 лет без бесплодия в анамнезе, которые пытались забеременеть в течение 3 месяцев или меньше, биомаркеры, указывающие на снижение резерва яичников по сравнению с нормальным резервом яичников, не были связаны со снижением фертильности.Эти данные не подтверждают использование тестов на ФСГ в моче или крови или уровней АМГ для оценки естественной фертильности у женщин с этими характеристиками.
Автор для переписки: Энн З. Штайнер, доктор медицины, магистр здравоохранения, Университет Северной Каролины, CB 7570, 4001 Old Clinic Bldg, Chapel Hill, NC 27599 ([email protected]).
Принято к публикации: 7 сентября 2017 г.
Вклад авторов: Доктора Штайнер и Херринг имели полный доступ ко всем данным в исследовании и несут ответственность за целостность и точность данных. анализ.
Концепция и дизайн: Steiner, Herring, Baird.
Сбор, анализ или интерпретация данных: Все авторы.
Составление рукописи: Штайнер.
Критический пересмотр рукописи на предмет важного интеллектуального содержания: Все авторы.
Статистический анализ: Steiner, Pritchard, Herring.
Получено финансирование: Steiner, Herring.
Административная, техническая или материальная поддержка: Steiner, Stanczyk, Kesner, Meadows.
Куратор: Штайнер, Херринг.
Раскрытие информации о конфликте интересов: Все авторы заполнили и отправили ICMJE Форму раскрытия информации о потенциальных конфликтах интересов. Доктор Станчик сообщает о получении личных гонораров от компаний Merck, TherapeuticsMD, Agile Therapeutics, Abbvie, Noven, Pantarhei Bioscience и Mithra. О других раскрытиях информации не сообщалось.
Финансирование / поддержка: Это исследование финансировалось Национальным институтом здравоохранения / Национальным институтом здоровья детей и человеческого развития им. Юнис Кеннеди Шрайвер, грантами R21 HD060229 и RO1 HD067683, а также Программой внутренних исследований Национального института наук об окружающей среде (Dr Бэрд).
Роль спонсора / спонсора: Спонсоры исследования не играли никакой роли в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; или решение представить рукопись для публикации.
Заявление об ограничении ответственности: Выводы и заключения в этом отчете принадлежат авторам и не обязательно отражают точку зрения Национального института безопасности и гигиены труда (NIOSH).Упоминание какой-либо компании или продукта не означает одобрения NIOSH.
1 Мэтьюз TJ, Гамильтон БЫТЬ. Средний возраст матерей растет: США, 2000–2014 годы. Краткий обзор данных NCHS . 2016; (232): 1-8.PubMedGoogle Scholar2.Hansen KR, Knowlton Н.С., Тьер AC, Чарльстон JS, Соул MR, Кляйн NA. Новая модель репродуктивного старения: уменьшение количества нерастущих фолликулов яичников от рождения до менопаузы. Репродукция Человека . 2008; 23 (3): 699-708. PubMedGoogle ScholarCrossref 3. Ли ММ, Донахью ПК. Вещество, ингибирующее Мюллериан: гонадный гормон с множеством функций. Endocr Ред. . 1993; 14 (2): 152-164.PubMedGoogle Scholar4.Roberts VJ, Барт S, эль-Рой A, иена SS. Экспрессия субъединиц ингибина / активина и рибонуклеиновых кислот и белков-мессенджеров фоллистатина в фолликулах яичников и желтом теле во время менструального цикла человека. Дж. Клин Эндокринол Метаб . 1993; 77 (5): 1402-1410.PubMedGoogle Scholar5, Санторо N, Исаак B, Нил-Перри ГРАММ, и другие. Нарушение фолликулогенеза и овуляции у женщин старшего репродуктивного возраста. Дж. Клин Эндокринол Метаб . 2003; 88 (11): 5502-5509.PubMedGoogle ScholarCrossref 6.Freeman EW, Sammel MD, Lin H, Бурман DW, Грация CR. Вклад скорости изменения антимюллерова гормона в оценку времени наступления менопаузы у женщин позднего репродуктивного возраста. Fertil Steril . 2012; 98 (5): 1254-1259.PubMedGoogle ScholarCrossref 7.Dólleman М, Фэдди MJ, ван Дисселдорп J, и другие. Взаимосвязь между антимюллеровым гормоном у женщин, получающих оценку фертильности, и возрастом наступления менопаузы у субфертильных женщин: данные крупных популяционных исследований. Дж. Клин Эндокринол Метаб . 2013; 98 (5): 1946-1953. PubMedGoogle ScholarCrossref 8.Wu CH, Chen YC, Wu ДХ, Ян JG, Чанг YJ, Цай HD.Сывороточный антимюллеров гормон позволяет прогнозировать ответ яичников и исход цикла у пациенток с ЭКО. Дж. Ассистент Репрод Генет . 2009; 26 (7): 383-389.PubMedGoogle ScholarCrossref 9.Broer SL, ван Дисселдорп J, Broeze КА, и другие; ИМПОРТ Исследовательская группа. Дополнительная ценность тестирования овариального резерва на характеристиках пациенток в прогнозировании ответа яичников и продолжающейся беременности: индивидуальный подход к данным пациента. Обновление Hum Reprod . 2013; 19 (1): 26-36. PubMedGoogle ScholarCrossref 10.Broer SL, Мол BW, Хендрикс Д, Брукманс FJ. Роль антимуллерова гормона в прогнозировании исхода после ЭКО: сравнение с количеством антральных фолликулов. Fertil Steril . 2009; 91 (3): 705-714.PubMedGoogle ScholarCrossref 11.Brodin Т., Хадзиосманович N, Берглунд L, Оловссон М, Холте J. Уровни антимюллерова гормона тесно связаны с коэффициентом живорождения после вспомогательной репродукции. Дж. Клин Эндокринол Метаб .2013; 98 (3): 1107-1114.PubMedGoogle ScholarCrossref 12.Steiner AZ, Long DL, Селедка AH, Кеснер JS, Луга JW, Бэрд DD. Фолликулостимулирующий гормон в моче как мера естественной фертильности в когорте сообщества. Репродукция науки . 2013; 20 (5): 549-556.PubMedGoogle ScholarCrossref 13.Steiner Аризона, Селедка AH, Кеснер JS, и другие. Антимуллеров гормон как предиктор естественной оплодотворяемости у женщин в возрасте 30-42 лет. Акушерский гинекол . 2011; 117 (4): 798-804.PubMedGoogle ScholarCrossref 14.Jain Т, Соул MR, Коллинз JA. Сравнение базального фолликулостимулирующего гормона с провокационным тестом кломифена цитрата для скрининга овариального резерва. Fertil Steril . 2004; 82 (1): 180-185.PubMedGoogle ScholarCrossref 15.Weinberg CR, Уилкокс AJ. Репродуктивная эпидемиология. В: Ротман KJ, Гренландия S, ред. Современная эпидемиология .2-е изд. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 1998: 585-608.
16.Центры по контролю и профилактике заболеваний; Общество вспомогательных репродуктивных технологий. Национальный сводный отчет по вспомогательным репродуктивным технологиям, 2014 г. . Атланта, Джорджия: Департамент здравоохранения и социальных служб США; 2016.
18.Li HW, Вонг АД, ИП WK, Юнг WS, Ho ПК, нг Э. Сравнительная оценка трех новых коммерческих иммуноанализов для измерения антимюллерова гормона. Репродукция Человека . 2016; 31 (12): 2796-2802. PubMedGoogle ScholarCrossref 19.Hagen CP, Вестергаард S, Юул А, и другие. Низкая концентрация циркулирующего антимуллерова гормона не является признаком снижения фертильности у молодых здоровых женщин: проспективное когортное исследование. Fertil Steril . 2012; 98 (6): 1602-1608. PubMedGoogle ScholarCrossref 20. Зарек СМ, Митчелл EM, Sjaarda Лос-Анджелес, и другие. Связан ли антимюллеров гормон с фертильностью? результаты исследования EAGER. Дж. Клин Эндокринол Метаб . 2015; 100 (11): 4215-4221.PubMedGoogle ScholarCrossref 21.Depmann М, Броер SL, Эйкеманс MJC, и другие. Антимюллеров гормон не предсказывает время наступления беременности: результаты проспективного когортного исследования [опубликовано в Интернете 10 апреля 2017 г.]. Гинекол Эндокринол . DOI: 10.1080 / 09513590.2017.1306848PubMedGoogle Scholar23.Pigny П, Горисс E, Гулам А, и другие. Сравнительная оценка пяти анализов сывороточного антимюллерова гормона для диагностики синдрома поликистозных яичников. Fertil Steril . 2016; 105 (4): 1063-1069.PubMedGoogle ScholarCrossref 24.Pellatt L, рис S, Дилавер N, и другие. Антимюллеров гормон снижает чувствительность фолликулов к фолликулостимулирующему гормону в клетках гранулезы человека. Fertil Steril . 2011; 96 (5): 1246-1251.PubMedGoogle ScholarCrossref 25.Gnoth C, Годехардт D, Годехардт Э, Франк-Херрманн П, Фрейндль G. Время до беременности: результаты немецкого проспективного исследования и влияние на лечение бесплодия. Репродукция Человека . 2003; 18 (9): 1959-1966.PubMedGoogle ScholarCrossref 26.Grande М, Боробио V, Беннасар М, и другие. Роль маркеров резерва яичников, антимюллерова гормона и количества антральных фолликулов как маркеров анеуплоидии при продолжающейся беременности и выкидышах. Fertil Steril . 2015; 103 (5): 1221-1227.PubMedGoogle ScholarCrossref 27.Zarek СМ, Митчелл EM, Sjaarda Лос-Анджелес, и другие. Антимуллеров гормон и потеря беременности из-за воздействия аспирина в испытании беременности и репродукции. Fertil Steril . 2016; 105 (4): 946-952. PubMedGoogle ScholarCrossrefНормализация уровня антимюллерова гормона после заместительной терапии гормона роста у пациента с врожденным дефицитом гормона роста: тематическое исследование
Аннотация
Цель: Описать случай врожденного дефицита гормона роста у пациентки, у которой восстановилась функция яичников после замены гормона роста после неопределяемого уровня антимюллерова гормона (АМГ).
Дизайн: Пример из практики.
Место: Клиника Мейо.
Пациенты: 32-летняя женщина с врожденным дефицитом гормона роста (CGHD) была обследована в клинике Mayo и обнаружила, что у нее неопределяемый уровень AMH.
Вмешательство (я): Пациенту был начат прием Хуматропа в дозе 0,4 мг в день. Пациентке была назначена терапия гормоном роста до тех пор, пока ее уровень IGF-1 не стал в пределах нормы.
Основные показатели результата: Возврат циклических менструаций и повышение уровня АМГ до нормального диапазона.
Результаты: После 12 месяцев замещения гормона роста менструации у пациентки вернулись к нормальному 28-дневному циклу, и ее гипоэстрогенные симптомы исчезли. Ее GH был адекватно заменен на уровень IGF-1 151 нг / мл. Ее AFC увеличился до 16 по сравнению с предыдущим УЗИ, показывающим 1 антральный фолликул, и ее лабораторные анализы вернулись к нормальным уровням; ФСГ 7.7 МЕ / л, эстрадиол 33 пг / мл и АМГ 1,9 нг / мл.
Заключение: Это документ пациента с CGHD и подавленным уровнем AMH. В этом случае значительную роль в восстановлении функции яичников сыграла коррекция гормона роста. Оценка состояния резерва яичников у пациенток-подростков с CGHD является ключевым компонентом в их оценке и может позволить криоконсервацию яйцеклеток у молодых девушек, у которых функция яичников нормализуется после лечения. Это важно, поскольку нет четких данных о долгосрочном потенциале фертильности у пациентов с CGHD.Было показано, что AMH является маркером яичникового резерва у пациентки с CGHD, который продемонстрировал динамический сдвиг AMH, который был связан со статусом GH пациента.
Ключевые слова
гормон роста, антимюллеров гормон, количество антральных фолликулов, инсулиноподобный фактор роста I, резерв яичников
Введение
Гормон роста участвует в различных областях тела, от линейного роста до регуляции мужского и женского бесплодия.Гормон роста вырабатывается не только гипофизом, но и яичниками, и было показано, что он связывается с гранулезными, теками и лютеиновыми клетками, способствуя стероидогенезу [1,2]. Гормон роста также действует через инсулиноподобный фактор роста-1, повышая чувствительность яичников к гонадотропинам [3,4]. Отмечается, что у детей с дефицитом гормона роста наблюдается задержка полового созревания и, как правило, менархе не наступает до замены гормона роста [5]. В исследовании, в котором участвовали 34 пациента с CGHD без спонтанного пубертатного развития, после замены гормона роста была менархе, а у 12 впоследствии развивалась вторичная аменорея после отмены [6].
И гормон роста, и IFG-1 играют роль в рекрутировании фолликулов яичников [7]. При дефиците GH наблюдается снижение чувствительности яичников к FSH, что приводит к росту монофолликулов, в отличие от рекрутирования доминантного фолликула и, возможно, снижения стимуляции всех антральных фолликулов [8,9]. Недавнее исследование отметило, что у женщин с гипопитуитаризмом заместительная терапия гормоном роста приводит к увеличению толщины эндометрия и лучшей реакции яичников на гонадотропины при экстракорпоральном оплодотворении [10].
Многим пациентам с дефицитом гормона роста требуются вспомогательные репродуктивные технологии [11]. Оценка овариального резерва пациента очень важна для определения наилучшего варианта лечения для пациентки. Антимюллеров гормон (AMH) и количество антральных фолликулов (AFC) — два маркера, используемые для измерения резерва яичников, и они важны при прогнозировании фертильности пациента [6]. Оба, как известно, уменьшаются с возрастом и могут стать неопределяемыми после менопаузы. Отмечается, что у пациентов с преждевременной недостаточностью яичников или сниженным овариальным резервом также очень низкие уровни AMH и AFC, которые обычно не улучшаются при любом варианте лечения [12].
Насколько нам известно, не существует никаких исследований, демонстрирующих повышение AMH и AFC после замены гормона роста у пациентов с дефицитом гормона роста. Здесь мы представим случай пациентки, у которой был CGHD, который остановил замену гормона роста, и у которой был обнаружен неопределяемый AMH, который значительно улучшился после коррекции ее дефицита гормона роста; это приводило к неверному впечатлению, что у нее был пониженный овариальный резерв.
Презентация кейса
32-летняя женщина с врожденной недостаточностью гормона роста (CGHD) была обследована в нашем центре на множественные сопутствующие заболевания. Пациентке был поставлен диагноз CGHD в возрасте 6 лет, и до 2007 года она получала заместительную терапию хуматропом на гормон роста. После желудочно-кишечного заболевания у нее развилась IgA-нефропатия, которую лечили высокими дозами кортикостероидов. В это время она прекратила прием хуматропа, и у нее была отмечена аменорея с гипоэстрогенными симптомами.После разрешения IgA-нефропатии она начала принимать оральные контрацептивы, которые улучшили ее гипоэстрогенные симптомы.
В ноябре 2009 г. был проведен тест яичникового резерва, и было обнаружено, что AFC равняется единице. Гормональное обследование не проводилось, так как принимала оральные контрацептивы. Было обнаружено, что ее IGF-1 был чрезвычайно низким — <25 нг / мл, что побудило возобновить прием Хуматропа в дозе 0,4 мг в день.
В марте 2010 г. у нее была диагностирована аменорея после прекращения приема оральных контрацептивов в течение 6 месяцев.Повторная оценка отметила стабильную AFC, равную единице, ФСГ, равный 12,4 МЕ / л, и эстрадиол, равный 40 пг / мл. Уровень АМГ с помощью ELISA не был определен. Несмотря на шесть месяцев приема Хуматропа, ее уровень IGF-1 оставался низким — 108 нг / мл. Дозировка была увеличена до 0,5 мг в день.
Результат
В августе 2010 года, после 12 месяцев приема Хуматропа, ее менструация вернулась к нормальному 28-дневному циклу, и ее гипоэстрогенные симптомы исчезли. Было отмечено, что ее уровень IGF-1 находится в пределах нормы — 151 нг / мл.Ее коэффициент чувствительности увеличился до 16, а лабораторные анализы вернулись к нормальному уровню; ФСГ 7,7 МЕ / л, эстрадиол 33 пг / мл и АМГ 1,9 нг / мл.
Обсуждение
Насколько нам известно, этот отчет является первым документом о пациенте с CGHD и сниженным уровнем AMH. Как уже отмечалось ранее, многим детям с дефицитом GH в конечном итоге требуется помощь в воспроизведении и снижении фертильности. Было несколько случаев, демонстрирующих улучшение фертильности при замене гормона роста, но на сегодняшний день не было исследований, оценивающих взаимосвязь между коррекцией гормона роста и улучшением предикторов овариального резерва, которые могли бы позволить более оптимальное время для продолжения криоконсервации ооцитов. [9].
Было показано, чтоAMH является стабильным маркером овариального резерва и, как полагают, остается стабильным на протяжении всего менструального цикла, что позволяет ему быть полезным предиктором фертильности пациентки [6]. Типичное увеличение значения АМГ — снижение в течение жизни женщины до неопределяемого [12]. Это исследование демонстрирует, что при терапии гормоном роста может наблюдаться динамический сдвиг в AMH и AFC.
Основываясь на этом отчете о случае, важно оценить статус гормона роста пациента с CGHD, поскольку может быть ограниченное окно для продолжения криоконсервации ооцитов, что, вероятно, будет наиболее выгодным в более раннем возрасте.Коррекция позволяет пациенту выбрать несколько вариантов фертильности, включая немедленную вспомогательную репродуктивную функцию, или продолжить мониторинг резерва яичников, поскольку нам еще неизвестны сроки или вероятность возврата AMH и AFC к уровням, соответствующим уменьшению резерва яичников.
Сводка
После коррекции дефицита гормона роста наблюдается значительное улучшение уровней антимюллерова гормона и количества антральных фолликулов.
Сводка по капсуле
После коррекции дефицита гормона роста наблюдается значительное улучшение АМГ.
Источники исследования
Клиника Майо
Раскрытие информации о финансировании / конфликте интересов
Финансирование не получено или конфликт интересов.
Список литературы
- Hull KL, Harvey S (2001) Гормон роста: роли в женском воспроизводстве. Дж. Эндокринол 168: 1-23. [Crossref]
- Spiliotis BE (2003) Недостаточность гормона роста и ее влияние на функцию яичников. Ann N Y Acad Sci 997: 77-84. [Crossref]
- Чандрашекар В., Зачек Д., Бартке А. (2004) Последствия измененной соматотропной системы на репродуктивную функцию. Biol Reprod 71: 17-27. [Crossref]
- Chang SY, Tsai MY, Huang FJ, Kung FT (2002) Экспрессия инсулиноподобного фактора роста (IGF), рецептора IGF и рибонуклеиновых кислот-мессенджеров IGF-связывающего белка в лютеинизированных клетках гранулезы из фолликулов разного размера после контролируемой гиперстимуляции яичников. J Assist Reprod Genet 19: 121-126. [Crossref]
- de Boer JA, Schoemaker J, van der Veen EA (1997) Нарушение репродуктивной функции у женщин, лечившихся от дефицита гормона роста в детстве. Clin Endocrinol (Oxf) 46: 681-689. [Crossref]
- Hehenkamp WJ, Looman CW, Themmen AP, de Jong FH, Te Velde ER и др. (2006) Уровни антимюллерова гормона в спонтанном менструальном цикле не обнаруживают существенных колебаний. J Clin Endocrinol Metab 91: 4057-4063. [Crossref]
- Hull KL, Harvey S (2014) Гормон роста и воспроизводство: обзор эндокринных и аутокринных / паракринных взаимодействий. Int J Endocrinol 2014: 234014. [Crossref]
- Магон Н., Агравал С., Малик С., Бабу К.М. (2011) Гормон роста в лечении женского бесплодия. Indian J Endocrinol Metab 15 (Suppl3): S246-S247. [Crossref]
- Adashi EY, Resnick CE, Hurwitz A, Ricciarelli E, Hernandez ER, et al.(1991) Инсулиноподобные факторы роста: связь яичников. Hum Reprod 6: 1213-1219. [Crossref]
- Drakopoulos P, Pluchino N, Bischof P, Cantero P, Meyer P (2016) Влияние гормона роста на толщину эндометрия и результат фертильности при лечении женщин с пангипопитуитаризмом: отчет о клиническом случае. J Reprod Med 61: 78-82. [Crossref]
- Salle A, Klein M, Pascal-Vigneron V, Dousset B, Leclere J, et al. (2000) Успешная беременность и роды после последовательного совместного лечения гормоном роста и гонадотропинами у женщины с пангипопитуитаризмом: новый протокол лечения. Fertil Steril 74: 1248-1250. [Crossref]
- Lunding SA, Aksglaede L, Anderson RA, Main KM, Juul A, et al. (2015) AMH как предиктор преждевременной недостаточности яичников: продольное исследование 120 пациентов с синдромом Тернера. J Clin Endocrinol Metab 100: E1030-E1038. [Crossref]
Новое понимание роли антимюллерова гормона в гипоталамо-гипофизарно-гонадной оси и нейроэндокринном развитии
Jost A (1947) Возрастной фактор кастрации плодов кроликов мужского пола. Proc Soc Exp Biol Med 66: 302–303
CAS PubMed Google ученый
Йост А. (1952) Исследование гормонального контроля генеза половых органов у кролика и заметки о некоторых пороках развития полового аппарата человека. Ginecol Obstet Mex 7: 477–492
CAS PubMed Google ученый
Лилли Ф.Р. (1916) Теория фри-мартина. Наука (80-) 43: 611–613
CAS Google ученый
Munsterberg A, Lovell-Badge R (1991) Экспрессия гена антимюллеровского гормона мышей предполагает его роль как в мужской, так и в женской половой дифференциации. Разработка 113: 613–624
CAS PubMed Google ученый
Lebeurrier N, Launay S, Macrez R et al (2008) Зависимая от мюллерова гормона регуляция нейросерпина, ингибитора сериновой протеазы в головном мозге.J Cell Sci 121: 3357–3365
CAS PubMed Google ученый
Cimino I, Casoni F, Liu X et al (2016) Новая роль антимюллерова гормона в регуляции возбудимости нейронов GnRH и секреции гормонов. Nat Commun 7: 10055
CAS PubMed PubMed Central Google ученый
Wang PY, Protheroe A, Clarkson AN et al (2009) Мюллерово ингибирующее вещество вносит вклад в связанные с полом предубеждения в мозге и поведении.Proc Natl Acad Sci USA 106: 7203–7208
CAS PubMed Google ученый
Гаррель Дж., Расин С., Л’От Д. и др. (2016) Антимюллеров гормон: новый фактор полового диморфизма в активности гонадотропов гипофиза до полового созревания. Научный представитель 6: 23790
CAS PubMed PubMed Central Google ученый
Garrel G, Denoyelle C, L’Hôte D et al (2019) GnRH трансактивирует ген рецептора AMH человека через Egr1 и FOXO1 в гонадотропных клетках.Нейроэндокринология 108: 65–83
CAS PubMed Google ученый
Plant TM (2015) Гипоталамо-гипофизарно-гонадная ось. J Эндокринол 226: T41 – T54
CAS PubMed PubMed Central Google ученый
Malone SA, Papadakis GE, Messina A et al (2019) Дефектная передача сигналов AMH нарушает развитие и функцию нейронов GnRH и способствует гипогонадотропному гипогонадизму.Элиф 8: 1
Google ученый
Bédécarrats GY, Kaiser UB (2003) Дифференциальная регуляция активности промотора гена субъединицы гонадотропина пульсирующим гонадотропин-высвобождающим гормоном (GnRH) в перифузированных клетках LβT2: роль концентрации рецептора GnRH. Эндокринология 144: 1802–1811
PubMed Google ученый
Kereilwe O, Kadokawa H (2019) Гонадотрофы крупного рогатого скота экспрессируют антимюллеров гормон (AMH): сравнение уровней экспрессии мРНК AMH и белка между старыми голштинами и молодыми и старыми японскими черными самками.Reprod Fertil Dev 31: 810–819
CAS PubMed Google ученый
Lee MM, Seah CC, Masiakos PT et al (1999) Экспрессия и функция рецептора Müllerian-ингибирующего вещества типа II в очищенных клетках Лейдига крыс. Эндокринология 140: 2819–2827
CAS PubMed Google ученый
Salmon NA, Handyside AH, Joyce IM (2004) Ооцитная регуляция экспрессии антимюллерова гормона в клетках гранулезы во время развития фолликула яичника у мышей.Dev Biol 266: 201–208
CAS PubMed Google ученый
Кейт Р.Л., Матталиано Р.Дж., Хессион С. и др. (1986) Выделение бычьих и человеческих генов для вещества, ингибирующего мюллеров, и экспрессия человеческого гена в клетках животных. Ячейка 45: 685–698
CAS PubMed Google ученый
Кэмпбелл Б.К., Клинтон М., Уэбб Р. (2012) Роль антимюллерова гормона (АМГ) во время развития фолликулов у моновуляторных видов (овцы).Эндокринология 153: 4533–4543. https://doi.org/10.1210/en.2012-1158
CAS Статья PubMed Google ученый
Picard JY, Josso N (1976) Антимюллеров гормон: оценка молекулярной массы с помощью гель-фильтрации. Биомедицина 25: 147–150
CAS PubMed Google ученый
Pepinsky RB, Sinclair LK, Chow EP et al (1988) Протеолитический процессинг вещества, ингибирующего мюллериан, дает фрагмент, подобный трансформирующему фактору роста-бета.J Biol Chem 263: 18961–18964
CAS PubMed Google ученый
Wilson CA, di Clemente N, Ehrenfels C et al (1993) Мюллерово-ингибирующее вещество требует своего N-концевого домена для поддержания биологической активности, новое открытие в суперсемействе трансформирующего фактора роста-бета. Мол эндокринол 7: 247–257
CAS PubMed Google ученый
di Clemente N, Wilson C, Faure E et al (1994) Клонирование, экспрессия и альтернативный сплайсинг рецептора антимюллерова гормона. Мол эндокринол 8: 1006–1020
PubMed Google ученый
Faure E, Gouédard L, Imbeaud S. et al (1996) Мутантные изоформы рецептора антимюллерова гормона типа II не экспрессируются на клеточной мембране. J Biol Chem 271: 30571–30575
CAS PubMed Google ученый
Josso N, di Clemente N (2003) Путь трансдукции антимюллерова гормона, полоспецифичного члена семейства TGF-бета. Тенденции метаболизма эндокринола 14: 91–97
CAS PubMed Google ученый
Jamin SP, Arango NA, Mishina Y et al (2002) Требование Bmpr1a для регрессии мюллерова протока во время полового развития самцов. Нат Генет 32: 408–410
CAS PubMed Google ученый
Yi SE, LaPolt PS, Yoon BS et al (2001) Рецептор BMP типа I BmprIB необходим для женской репродуктивной функции. Proc Natl Acad Sci USA 98: 7994–7999
CAS PubMed Google ученый
Hayes E, Kushnir V, Ma X et al (2016) Внутриклеточный механизм антимюллерова гормона (AMH) в регуляции развития фолликулов. Эндокринол клеток Mol 433: 56–65
CAS PubMed Google ученый
Klüver N, Pfennig F, Pala I et al (2007) Дифференциальная экспрессия антимюллеровского гормона (amh) и рецептора антимюллерова гормона типа II (amhrII) в костистых костях Medaka. Dev Dyn 236: 271–281
PubMed Google ученый
Vaillant S, Magre S, Dorizzi M et al (2001) Экспрессия AMH, SF1 и SOX9 в гонадах генетических самок кур во время смены пола, индуцированной ингибитором ароматазы. Dev Dyn 222: 228–237
CAS PubMed Google ученый
Wang P-Y, Koishi K, McGeachie AB et al (2005) Вещество, ингибирующее мюллериан, действует как фактор выживания моторных нейронов in vitro. Proc Natl Acad Sci USA 102: 16421–16425
CAS PubMed Google ученый
Ван К., Сюй Ф., Кэмпбелл С.П. и др. (2020) Быстрое действие антимюллерова гормона в регулировании синаптической передачи и долговременной синаптической пластичности в гиппокампе. FASEB J 34: 706–719
CAS PubMed Google ученый
Goodman HM, Goodman HM (2009) Глава 13: гормональный контроль воспроизводства у женщин: менструальный цикл. В: Основы медицинской эндокринологии, стр. 257–275
Herbison AE (2014) Физиология нейрональной сети взрослого гонадотропин-рилизинг-гормона. В: Физиология воспроизводства Нобила и Нейла: двухтомный набор. pp 399–467
Herbison AE (2016) Контроль наступления полового созревания и фертильности нейронами гонадотропин-рилизинг-гормона. Nat Rev Endocrinol 12: 452–466
CAS PubMed Google ученый
Schwanzel-Fukuda M, Pfaff DW (1989) Происхождение нейронов высвобождающего лютеинизирующий гормон гормона. Nature 338: 161–164
CAS PubMed Google ученый
Forni PE, Taylor-Burds C, Melvin VS et al (2011) Нервный гребень и эктодермальные клетки смешиваются в носовой плакоде, давая начало нейронам GnRH-1, сенсорным нейронам и обонятельным клеткам. J Neurosci 31: 6915–6927
CAS PubMed PubMed Central Google ученый
Wray S, Grant P, Gainer H (1989) Доказательство того, что клетки, экспрессирующие мРНК лютеинизирующего гормона-рилизинг-гормона у мышей, происходят из клеток-предшественников в обонятельной плакоде. Proc Natl Acad Sci USA 86: 8132–8136
CAS PubMed Google ученый
Касони Ф., Мэлоун С.А., Белль М. и др. (2016) Развитие нейронов, контролирующих фертильность у людей: новые открытия от трехмерной визуализации и прозрачного мозга плода.Разработка 143: 3969–3981
CAS PubMed PubMed Central Google ученый
Jennes L, Stumpf WE, Sheedy ME (1985) Ультраструктурная характеристика нейронов, продуцирующих гонадотропин-рилизинг-гормон (GnRH). J Comp Neurol 232: 534–547
CAS PubMed Google ученый
Silverman AJ, Jhamandas J, Renaud LP (1987) Локализация нейронов высвобождающего гормона лютеинизирующего гормона (LHRH), которые выступают на срединное возвышение.J Neurosci 7: 2312–2319
CAS PubMed PubMed Central Google ученый
Han SY, McLennan T, Czieselsky K, Herbison AE (2015) Селективная оптогенетическая активация дугообразных нейронов кисспептина генерирует пульсирующую секрецию лютеинизирующего гормона. Proc Natl Acad Sci USA 112: 13109–13114
CAS PubMed Google ученый
Кэмпбелл Р.Э., Гайдамака Г., Хан С.К., Гербисон А.Е. (2009) Дендро-дендритное связывание и общие синапсы между нейронами гонадотропин-рилизинг-гормона.Proc Natl Acad Sci USA 106: 10835–10840
CAS PubMed Google ученый
Кэмпбелл Р. Е. (2007) Определение нейронной сети гонадотропин-рилизинг-гормона: трансгенные подходы к пониманию нейросхемы. J Нейроэндокринол 19: 561–573
CAS PubMed Google ученый
Tata B, Mimouni NEH, Barbotin A-L et al (2018) Повышенный пренатальный антимюллеров гормон перепрограммирует плод и вызывает синдром поликистозных яичников во взрослом возрасте.Nat Med 24: 834–846
CAS PubMed PubMed Central Google ученый
Наварро В.М., Готч М.Л., Чавкин С. и др. (2009) Регулирование секреции гонадотропин-рилизинг-гормона нейронами кисспептина / динорфина / нейрокинина B в дугообразном ядре мыши. J Neurosci 29: 11859–11866
CAS PubMed PubMed Central Google ученый
Clarkson J, Han SY, Piet R et al (2017) Определение гипоталамического генератора импульсов GnRH у мышей.Proc Natl Acad Sci USA 114: E10216 – E10223
CAS PubMed Google ученый
Silva MSB, Desroziers E, Hessler S et al (2019) Активация ГАМК-нейронов дугообразного ядра способствует секреции лютеинизирующего гормона и репродуктивной дисфункции: последствия для синдрома поликистозных яичников. EBioMedicine 44: 582–596
PubMed PubMed Central Google ученый
Roa J, Herbison AE (2012) Прямая регуляция возбудимости нейронов GnRH с помощью нейропептидов нейронов POMC дугообразного ядра и NPY у самок мышей. Эндокринология 153: 5587–5599
CAS PubMed Google ученый
Коутиньо Э., Прескотт М., Хесслер С. и др. (2019) Активация классического цикла голода замедляет пульсацию лютеинизирующего гормона. Нейроэндокринология
Parkash J, Messina A, Langlet F et al (2015) Semaphorin7A регулирует нейроглиальную пластичность в среднем возвышении гипоталамуса у взрослых.Nat Commun 6: 6385
CAS PubMed PubMed Central Google ученый
Превот В., Дехук Б., Шариф А. и др. (2018) Универсальный таницит: гипоталамический интегратор воспроизводства и энергетического метаболизма. Endocr Ред. 39: 333–368
PubMed Google ученый
Clarke IJ, Cummins JT (1982) Временная взаимосвязь между секрецией гонадотропин-рилизинг-гормона (GnRH) и лютеинизирующего гормона (LH) у овариэктомированных овец.Эндокринология 111: 1737–1739
CAS PubMed Google ученый
Belchetz PE, Plant TM, Nakai Y et al (1978) Гипофизические реакции на непрерывную и прерывистую доставку гипопталамического гонадотропин-рилизинг-гормона. Наука 202: 631–633
CAS PubMed Google ученый
Clarke IJ, Cummins JT (1985) Частота пульса GnRH определяет амплитуду импульса LH, изменяя количество высвобождаемого LH в гипофизе овец.J Reprod Fertil 73: 425–431
CAS PubMed Google ученый
Clarke IJ, Burman KJ, Doughton BW, Cummins JT (1986) Эффекты постоянного вливания гонадотропин-рилизинг-гормона овариэктомированным овцам с гипоталамо-гипофизарным отключением: дополнительные доказательства дифференциального контроля секреции ЛГ и ФСГ и отсутствие грунтовочного эффекта. J Endocrinol 111: 43–49
CAS PubMed Google ученый
Thompson IR, Kaiser UB (2014) Зависимая от частоты пульса дифференциальная регуляция экспрессии генов LH и FSH. Эндокринол клеток Mol 385: 28–35
CAS PubMed Google ученый
Weiss J, Crowley WF, Halvorson LM, Jameson JL (1993) Перифузия клеток гипофиза крысы с гонадотропин-высвобождающим гормоном, активином и ингибином показывает различные эффекты на экспрессию и секрецию гена гонадотропина. Эндокринология 132: 2307–2311
CAS PubMed Google ученый
Durlinger ALL, Kramer P, Karels B et al (1999) Контроль рекрутирования примордиальных фолликулов антимюллеровым гормоном в яичнике мыши. Эндокринология 140: 5789–5796
CAS PubMed Google ученый
Racine C, Rey R, Forest MG et al (1998) Рецепторы антимюллерова гормона на клетках Лейдига ответственны за его эффекты на стероидогенез и дифференцировку клеток. Proc Natl Acad Sci USA 95: 594–599
CAS PubMed Google ученый
Bédécarrats GY, O’Neill FH, Norwitz ER et al (2003) Регулирование экспрессии гена гонадотропина с помощью вещества, ингибирующего Мюллеров. Proc Natl Acad Sci USA 100: 9348–9353
PubMed Google ученый
Devillers M, Petit F, Cluzet V et al (2018) ФСГ ингибирует АМГ для поддержки синтеза эстрадиола в яичниках у инфантильных мышей. J Эндокринол 1: 215–228
Google ученый
Kuiri-Hänninen T, Sankilampi U, Dunkel L (2014) Активация гипоталамо-гипофизарно-гонадной оси в младенчестве: минипубертат. Horm Res Paediatr 82: 73–80
PubMed Google ученый
Wolfe MW, Call GB (1999) Белок 1 ранней реакции роста связывается с промотором лютеинизирующего гормона-бета и опосредует экспрессию генов, стимулированную гонадотропин-высвобождающим гормоном. Мол эндокринол 13: 752–763
CAS PubMed Google ученый
Choi Y-S, Lee HJ, Ku CR et al (2014) FoxO1 является негативным регулятором экспрессии гена FSHβ в базальных и стимулированных GnRH условиях у женщин. Эндокринология 155: 2277–2286
PubMed Google ученый
Josso N, Picard JY, Rey R, di Clemente N (2006) Тестикулярный антимюллеров гормон: история, генетика, регулирование и клиническое применение. Pediatr Endocrinol Rev 3: 347–358
PubMed Google ученый
Sansone A, Kliesch S, Isidori AM, Schlatt S (2019) AMH и INSL3 в патофизиологии яичек и внегонад: что мы знаем? Андрология 7: 131–138
CAS PubMed Google ученый
Dewailly D, Robin G, Peigne M. et al (2016) Взаимодействие между андрогенами, ФСГ, антимюллеровым гормоном и эстрадиолом во время фолликулогенеза в нормальных и поликистозных яичниках человека. Обновление Hum Reprod 22: 709–724
CAS PubMed Google ученый
Dewailly D, Andersen CY, Balen A et al (2014) Физиология и клиническое применение антимюллерова гормона у женщин. Обновление Hum Reprod 20: 370–385
PubMed Google ученый
Convissar S, Armouti M, Fierro MA et al (2017) Регулирование AMH с помощью ооцит-специфичных факторов роста в первичных кумулюсных клетках человека. Репродукция 154: 745–753
CAS PubMed PubMed Central Google ученый
Roy S, Gandra D, Seger C et al (2018) Факторы, происходящие из ооцитов (GDF9 и BMP15), и ФСГ регулируют экспрессию AMH посредством модуляции h4K27AC в клетках гранулезы. Эндокринология 159: 3433–3445
CAS PubMed PubMed Central Google ученый
Visser JA, Durlinger ALL, Peters IJJ et al (2007) Повышенная дегенерация ооцитов и атрезия фолликулов во время эстрального цикла у мышей, у которых отсутствует антимюллеров гормон. Эндокринология 148: 2301–2308
CAS PubMed Google ученый
Durlinger ALL, Gruijters MJG, Kramer P et al (2001) Антимюллеров гормон ослабляет эффекты ФСГ на развитие фолликулов в яичнике мыши. Эндокринология 142: 4891–4899
CAS PubMed Google ученый
Нильссон Э., Роджерс Н., Скиннер М.К. (2007) Действие антимюллерова гормона на транскриптом яичников для ингибирования перехода от первичного фолликула к первичному. Воспроизведение 134: 209–221
CAS PubMed Google ученый
Vigier B, Forest MG, Eychenne B et al (1989) Антимюллеров гормон вызывает эндокринное изменение пола яичников плода. Proc Natl Acad Sci USA 86: 3684–3688
CAS PubMed Google ученый
Андерсен С.Ю., Бысков А.Г. (2006) Эстрадиол и регуляция секреции антимюллерова гормона, ингибина-A и ингибина-B: анализ жидкости малых антральных и преовуляторных фолликулов человека. J Clin Endocrinol Metab 91: 4064–4069
CAS PubMed Google ученый
Xu J, Bishop CV, Lawson MS et al (2016) Антимюллеров гормон способствует росту преантрального фолликула, но подавляет созревание антрального фолликула и отбор доминантного фолликула у приматов. Hum Reprod 31: 1522–1530
CAS PubMed PubMed Central Google ученый
van Helden J, Evliyaoglu O, Weiskirchen R (2019) Имеет ли ГнРГ прямую роль в регулировании AMH? Clin Endocrinol (Oxf) 90: 827–833
Google ученый
Al-Attar L, Noël K, Dutertre M et al (1997) Гормональная и клеточная регуляция производства антимюллеровского гормона клетками Сертоли у постнатальных мышей. J Clin Invest 100: 1335–1343
CAS PubMed PubMed Central Google ученый
Chemes HE, Rey RA, Nistal M et al (2008) Физиологическая нечувствительность к андрогенам плодных, неонатальных и ранних младенческих семенников объясняется онтогенезом экспрессии рецепторов андрогенов в клетках Сертоли.J Clin Endocrinol Metab 93: 4408–4412
CAS PubMed Google ученый
Lukas-Croisier C, Lasala C, Nicaud J et al (2003) Фолликулостимулирующий гормон увеличивает производство тестикулярного антимюллерова гормона (AMH) за счет пролиферации клеток Сертоли и неклассического циклического аденозин-5′-монофосфата. активация гена AMH. Мол эндокринол 17: 550–561
CAS PubMed Google ученый
Fallat ME, Siow Y, Belker AM et al (1996) Присутствие вещества, ингибирующего мюллериан, в семенной плазме человека. Hum Reprod 11: 2165–2169
CAS PubMed Google ученый
Belville C, Jamin SP, Picard JY et al (2005) Роль рецепторов типа I для антимюллерова гормона в линии клеток SMAT-1 Сертоли. Онкоген 24: 4984–4992
CAS PubMed Google ученый
Hoshiya Y, Gupta V, Segev DL et al (2003) Mullerian Inhibiting Substance индуцирует передачу сигналов NFkB в клетках рака груди и простаты. Эндокринол клеток Mol 211: 43–49
CAS PubMed Google ученый
Трбович AM, Sluss PM, Laurich VM et al (2001) Мюллерова ингибирующая субстанция снижает уровень тестостерона у грызунов, стимулированных лютеинизирующим гормоном. Proc Natl Acad Sci USA 98: 3393–3397
CAS PubMed Google ученый
Лизнева Д., Сутурина Л., Уокер В. и др. (2016) Критерии, распространенность и фенотипы синдрома поликистозных яичников. Fertil Steril 106: 6–15
PubMed Google ученый
Сирманс С.М., Пейт К.А. (2013) Эпидемиология, диагностика и лечение синдрома поликистозных яичников. Clin Epidemiol 6: 1–13
PubMed PubMed Central Google ученый
Роттердамская рабочая группа по консенсусу по СПКЯ, спонсируемая ESHRE / ASRM (2004 г.) Пересмотрела консенсус 2003 г. по диагностическим критериям и долгосрочным рискам для здоровья, связанным с синдромом поликистозных яичников.Fertil Steril 81: 19–25
Google ученый
Аззиз Р., Кармина Э., Дьюайли Д. и др. (2009) Критерии синдрома поликистозных яичников Общества избытка андрогенов и СПКЯ: полный отчет целевой группы. Fertil Steril 91: 456–488
PubMed Google ученый
Аззиз Р., Кармина Э., Дьюайли Д. и др. (2006) Критерии определения синдрома поликистозных яичников как преимущественно гиперандрогенного синдрома: руководство общества с избытком андрогенов.J Clin Endocrinol Metab 91: 4237–4245
CAS PubMed Google ученый
Barber TM, Dimitriadis GK, Andreou A, Franks S (2016) Синдром поликистозных яичников: понимание патогенеза и общей связи с инсулинорезистентностью. Clin Med (Northfield Il) 16: 262–266
Google ученый
Conway G, Dewailly D, Diamanti-Kandarakis E et al (2014) Синдром поликистозных яичников: заявление о позиции Европейского общества эндокринологов.Eur J Endocrinol 171: P1 – P29
CAS PubMed Google ученый
Куни Л.Г., Ли И., Саммел, доктор медицины, Докрас А. (2017) Высокая распространенность умеренных и тяжелых депрессивных и тревожных симптомов при синдроме поликистозных яичников: систематический обзор и метаанализ. Репродукция человека 32: 1075–1091
PubMed Google ученый
Dumesic DA, Lobo RA (2013) Риск рака и СПКЯ.Стероиды 78: 782–785
CAS PubMed Google ученый
Hughesdon PE (1982) Морфология и морфогенез яичника Штейна-Левенталя и так называемого «гипертекоза». Obstet Gynecol Surv 37: 59–77
CAS PubMed Google ученый
Dumesic DA, Richards JS (2013) Онтогенез яичника при синдроме поликистозных яичников. Fertil Steril 100: 23–38
PubMed PubMed Central Google ученый
Мур AM, Кэмпбелл Р.Э. (2017) Синдром поликистозных яичников: понимание роли мозга. Фронтальный нейроэндокринол 46: 1–14
PubMed Google ученый
Mcarthur JW, Ingersoll FM, Worcester DRPH (1958) Выведение с мочой ICSH и активности FSH женщинами с заболеваниями репродуктивной системы. J Clin Endocrinol Metab 18: 1202–1215
CAS PubMed Google ученый
Таймор М.Л., Барнард Р. (1962) Экскреция лютеинизирующего гормона при синдроме поликистозных яичников. Fertil Steril 13: 501–512
CAS PubMed Google ученый
Patton WC, Berger MJ, Thompson IE et al (1975) Гипофизарные гонадотропные реакции на синтетический высвобождающий лютеинизирующий гормон гормон у пациентов с типичной и атипичной поликистозной болезнью яичников. Am J Obstet Gynecol 121: 382–386
CAS PubMed Google ученый
Rebar R, Judd HL, Yen SSC et al (1976) Характеристика несоответствующей секреции гонадотропина при синдроме поликистозных яичников. J Clin Invest 57: 1320–1329
CAS PubMed PubMed Central Google ученый
Berga SL, Guzick DS, Winters SJ (1993) Повышенная секреция лютеинизирующего гормона и альфа-субъединиц у женщин с гиперандрогенной ановуляцией. J Clin Endocrinol Metab 77: 895–901
CAS PubMed Google ученый
Daniels TL, Berga SL (1997) Устойчивость гонадотропин-рилизинг-гормона к индуцированному половыми стероидами подавлению при гиперандрогенной ановуляции. J Clin Endocrinol Metab 82: 4179–4183
CAS PubMed Google ученый
Cook CL, Siow Y, Brenner AG, Fallat ME (2002) Взаимосвязь между веществом, ингибирующим мюллериан, и другими репродуктивными гормонами у нелеченных женщин с синдромом поликистозных яичников и нормальных женщин.Fertil Steril 77: 141–146
PubMed Google ученый
Крисосто Н., Коднер Э., Маликео М. и др. (2007) Уровни антимюллерова гормона у перипубертатных дочерей женщин с синдромом поликистозных яичников. J Clin Endocrinol Metab 92: 2739–2743
CAS PubMed Google ученый
Abbara A, Eng PC, Phylactou M et al (2019) Антимюллеров гормон (AMH) в диагностике нарушения менструального цикла из-за синдрома поликистозных яичников.Фронт-эндокринол (Лозанна) 10: 656
Google ученый
Pigny P, Jonard S, Robert Y, Dewailly D (2006) Сывороточный антимюллеров гормон как суррогат количества антральных фолликулов для определения синдрома поликистозных яичников. J Clin Endocrinol Metab 91: 941–945
CAS PubMed Google ученый
Piltonen TT, Giacobini P, Edvinsson Å et al (2019) Уровни циркулирующих антимуллеровых гормонов и стероидных гормонов остаются высокими у беременных с синдромом поликистозных яичников в срок.Fertil Steril 111: 588–596.e1
CAS PubMed Google ученый
Пеллатт Л., Ханна Л., Бринкат М. и др. (2007) Производство антимюллерова гормона гранулезными клетками увеличивается в поликистозных яичниках. J Clin Endocrinol Metab 92: 240–245
CAS PubMed Google ученый
Пеллатт Л., Райс С., Мейсон HD (2010) Антимюллеров гормон и синдром поликистозных яичников: гора слишком высока? Репродукция 139: 825–833
CAS PubMed Google ученый
Laven JSE, Mulders AGMGJ, Visser JA et al (2004) Концентрации сывороточных антител против мюллерова гормона у нормовуляторных и ановуляторных женщин репродуктивного возраста. J Clin Endocrinol Metab 89: 318–323
CAS PubMed Google ученый
Sova H, Unkila-Kallio L, Tiitinen A et al (2019) Профилирование гормонов, включая антимюллеров гормон (АМГ), для диагностики синдрома поликистозных яичников (СПКЯ) и характеристики фенотипов СПКЯ.Гинекол Эндокринол 35: 595–600
CAS PubMed Google ученый
Abbott DH, Rayome BH, Dumesic DA et al (2017) Кластеризация СПКЯ-подобных признаков у естественно гиперандрогенных самок макак-резусов. Репродукция Человека 32: 1–14
Google ученый
Пеллатт Л., Райс С., Дилавер Н. и др. (2011) Антимюллеров гормон снижает чувствительность фолликулов к фолликулостимулирующему гормону в клетках гранулезы человека.Fertil Steril 96: 1246–51.e1
CAS PubMed Google ученый
Willis DS, Watson H, Mason HD et al (1998) Преждевременный ответ на лютеинизирующий гормон гранулезных клеток у ановуляторных женщин с синдромом поликистозных яичников: отношение к механизму ановуляции 1. J Clin Endocrinol Metab 83: 3984– 3991
CAS PubMed Google ученый
Дилавер Н., Пеллатт Л., Джеймсон Э. и др. (2019) Регулирование и передача сигналов антимюллерова гормона в клетках гранулезы человека: актуальность для синдрома поликистозных яичников.Hum Reprod 34: 2467–2479
CAS PubMed Google ученый
Мур А.М., Прескотт М., Кэмпбелл Р.Э. (2013) Отрицательная и положительная обратная связь по эстрадиолу в пренатальной андроген-индуцированной модели синдрома поликистозных яичников на мышах. Эндокринология 154: 796–806
CAS PubMed Google ученый
Мур А.М., Прескотт М., Маршалл С.Дж. и др. (2015) Усиление надежного дугообразного ГАМКергического входа в нейроны гонадотропин-рилизинг-гормона в модели синдрома поликистозных яичников.Proc Natl Acad Sci USA 112: 596–601
CAS PubMed Google ученый
Blank SK, McCartney CR, Chhabra S. et al (2009) Модуляция чувствительности генератора импульсов гонадотропин-рилизинг-гормона к ингибированию прогестерона у девочек-подростков с гиперандрогенностью: значение для регуляции полового созревания. J Clin Endocrinol Metab 94: 2360–2366
CAS PubMed PubMed Central Google ученый
Hague WM, Adams J, Rodda C et al (1990) Распространенность поликистоза яичников у пациентов с врожденной гиперплазией надпочечников и их близких родственников. Clin Endocrinol (Oxf) 33: 501–510
CAS Google ученый
Dumesic D, Goodarzi M, Chazenbalk G, Abbott D (2014) Внутриутробная среда и синдром поликистозных яичников. Семин Репрод Мед 32: 159–165
PubMed PubMed Central Google ученый
Sir-Petermann T, Codner E, Pérez V et al (2009) Метаболические и репродуктивные особенности до и во время полового созревания у дочерей женщин с синдромом поликистозных яичников. J Clin Endocrinol Metab 94: 1923–1930
CAS PubMed PubMed Central Google ученый
Abbott DH, Rogers J, Dumesic DA, Levine JE (2019) Естественные и экспериментально индуцированные модели макак-резус для синдрома поликистозных яичников: трансляционные пути к клиническому применению.Med Sci (Базель, Швейцария) 7: 107
CAS Google ученый
Падманабхан В., Вейга-Лопес А. (2013) Овцы-модели фенотипа синдрома поликистозных яичников. Mol Cell Endocrinol 373: 8–20
CAS PubMed Google ученый
McNeilly AS, Duncan WC (2013) Модели синдрома поликистозных яичников на грызунах. Mol Cell Endocrinol 373: 2–7
CAS PubMed Google ученый
Caldwell ASL, Edwards MC, Desai R et al (2017) Действие нейроэндокринных андрогенов является ключевым экстраовариальным медиатором в развитии синдрома поликистозных яичников. Proc Natl Acad Sci USA 114: E3334 – E3343
CAS PubMed Google ученый
Stener-Victorin E, Padmanabhan V, Walters KA и др. (2020) Животные модели для понимания этиологии и патофизиологии синдрома поликистозных яичников. Endocr Rev (предварительная печать). https: // doi.org / 10.1210 / ENDREV / BNAA010
McCarthy MM (2010) Как это сделано: организационные эффекты гормонов на развивающийся мозг. J Нейроэндокринол 22: 736–742
CAS PubMed PubMed Central Google ученый
Салливан С.Д., Моэнтер С.М. (2004) Пренатальные андрогены изменяют ГАМКергическую тягу к нейронам гонадотропин-рилизинг-гормона: последствия для общего расстройства фертильности. Proc Natl Acad Sci USA 101: 7129–7134
CAS PubMed Google ученый
Risal S, Pei Y, Lu H et al (2019) Пренатальное воздействие андрогенов и трансгендерная предрасположенность к синдрому поликистозных яичников. Nat Med 25: 1894–1904
CAS PubMed Google ученый
Сэр-Петерманн Т., Коднер Э., Маликео М. и др. (2006) Повышенные концентрации антимюллерова гормона в сыворотке крови у дочерей женщин с синдромом поликистозных яичников в препубертатном возрасте. J Clin Endocrinol Metab 91: 3105–3109
CAS PubMed Google ученый
Torchen LC, Legro RS, Dunaif A (2019) Отличительные репродуктивные фенотипы у девочек периубертатного возраста с риском синдрома поликистозных яичников. J Clin Endocrinol Metab 104: 3355–3361
PubMed PubMed Central Google ученый
Gorsic LK, Kosova G, Werstein B et al (2017) Патогенные варианты антимюллерова гормона при синдроме поликистозных яичников. J Clin Endocrinol Metab 102: 2862–2872
PubMed PubMed Central Google ученый
Gorsic LK, Dapas M, Legro RS et al (2019) Функциональные генетические вариации пути антимюллерова гормона у женщин с синдромом поликистозных яичников. J Clin Endocrinol Metab 104: 2855–2874
PubMed PubMed Central Google ученый
Echiburú B, Milagro F, Crisosto N et al (2020) Метилирование ДНК в промоторных областях генов, участвующих в репродуктивной и метаболической функции детей, рожденных женщинами с СПКЯ.Эпигенетика 20: 1–17. [Epub перед печатью] https://doi.org/10.1080/15592294.2020.1754674.
Рекабаррен С.Е., Сэр-Петерманн Т., Риос Р. и др. (2008) Функция гипофиза и яичек у сыновей женщин с синдромом поликистозных яичников от младенчества до взрослого возраста. J Clin Endocrinol Metab 93: 3318–3324
CAS PubMed Google ученый
Seminara SB, Hayes FJ, Crowley WF (1998) Дефицит гонадотропин-рилизинг-гормона у человека (идиопатический гипогонадотропный гипогонадизм и синдром Каллмана): патофизиологические и генетические соображения.Endocr Ред. 19: 521–539
CAS PubMed Google ученый
Boehm U, Bouloux PM, Dattani MT et al (2015) Документ о консенсусе экспертов: Европейское консенсусное заявление о врожденном гипогонадотропном гипогонадизме — патогенез, диагностика и лечение. Nat Rev Endocrinol 11: 547–564
Google ученый
Дуайер А.А., Куинтон Р., Морин Д., Питтелуд Н. (2014) Выявление неудовлетворенных медицинских потребностей пациентов с врожденным гипогонадотропным гипогонадизмом с помощью оценки потребностей через Интернет: значение для онлайн-вмешательств и поддержки со стороны коллег .Orphanet J Rare Dis 9:83
PubMed PubMed Central Google ученый
Tello JA, Newton CL, Bouligand J et al (2012) Врожденный гипогонадотропный гипогонадизм из-за мутаций рецептора GnRH у трех братьев выявляет сайты, влияющие на конформацию и сцепление. PLoS ONE 7: e38456
CAS PubMed PubMed Central Google ученый
Митчелл А.Л., Дуайер А., Питтелуд Н., Куинтон Р. (2011) Генетические основы и вариабельное фенотипическое выражение синдрома Каллмана: к объединяющей теории.Тенденции метаболизма эндокринола 22: 249–258
CAS PubMed Google ученый
Teixeira L, Guimiot F, Dodé C et al (2010) Дефектная миграция нейроэндокринных клеток GnRH в арринэнцефалических условиях человека. J Clin Invest 120: 3668–3672
CAS PubMed PubMed Central Google ученый
Питтелуд Н., Куинтон Р., Пирс С. и др. (2007) Дигенные мутации составляют вариабельные фенотипы при идиопатическом гипогонадотропном гипогонадизме.J Clin Invest 117: 457–463
CAS PubMed PubMed Central Google ученый
Sykiotis GP, Pitteloud N, Seminara SB et al (2010) Расшифровка генетических заболеваний в эпоху генома: модель дефицита GnRH. Sci. Пер. Med. 2:32
Google ученый
Taguchi O, Cunha GR, Lawrence WD, Robboy SJ (1984) Время и необратимость ингибирования Мюллерова протока в эмбриональном репродуктивном тракте мужчины.Dev Biol 106: 394–398
CAS PubMed Google ученый
Tsuji M, Shima H, Yonemura CY et al (1992) Эффект человеческого рекомбинантного вещества, ингибирующего мюллериан, на изолированные эпителиальные и мезенхимальные клетки во время регрессии мюллерова протока у крысы. Эндокринология 131: 1481–1488
CAS PubMed Google ученый
ван Никерк В.А., Ретиф А.Е. (1981) Гонады истинных гермафродитов человека.Hum Genet 58: 117–122
PubMed Google ученый
Мейерс-Валлен В.Н., Донахью П.К., Манганаро Т., Паттерсон Д.Ф. (1987) Мюллерово-ингибирующее вещество у собак с измененным полом. Биол Репрод 37: 1015–1022
CAS PubMed Google ученый
Picard J-Y, Cate RL, Racine C, Josso N (2017) Постоянный синдром Мюллерова протока: обновление, основанное на личном опыте 157 случаев.