Прл гормон: Повышенный пролактин у женщин: что это такое, норма у женщин в крови
Пролактин
ПРЛ – пептид, один из гормонов передней доли гипофиза. Физиологическая роль его полностью не ясна, действие ПРЛ обеспечивает рост и развитие молочных желез, способствует наступлению и поддержанию лактации после родов. Именно ПРЛ поддерживает физиологический механизм предотвращения беременности у кормящей матери – гормон тормозит овуляцию, способствуя продлению существования желтого тела яичников, снижает секрецию эстрогенов фолликулами яичников и секрецию прогестерона желтым телом. ПРЛ оказывает влияние на обмен натрия и воды, стимулирует всасывание кальция. С 8-й недели беременности уровень пролактина повышается, достигая пика к 20–25 неделям, затем снижается непосредственно перед родами и вновь увеличивается в период лактации.
Уровень ПРЛ подвержен суточным ритмам с максимальной концентрацией в ранние утренние часы перед пробуждением и минимумом в поздние утренние часы, при этом суточные колебания уровня находятся в пределах нормальных значений.
Повышение концентрации ПРЛ в сыворотке крови не всегда является показателем истинного увеличения уровня биологически активного гормона, поскольку фракция общего ПРЛ крови состоит из нескольких форм, отличающихся по ММ и биологической активности – низкомолекулярный ПРЛ (нмПРЛ), ММ 23 кД, биологически активная форма, высокомолекулярный ПРЛ (вмПРЛ, big), ММ 50–60 кД, неактивная форма, макропролактин (мПРЛ, big-big), ММ 150–170 кД, малоактивная форма.
При лабораторном исследовании на фоне наличия классической симптоматики гиперпролактинемии в большинстве случаев обнаруживается преобладание нмПРЛ.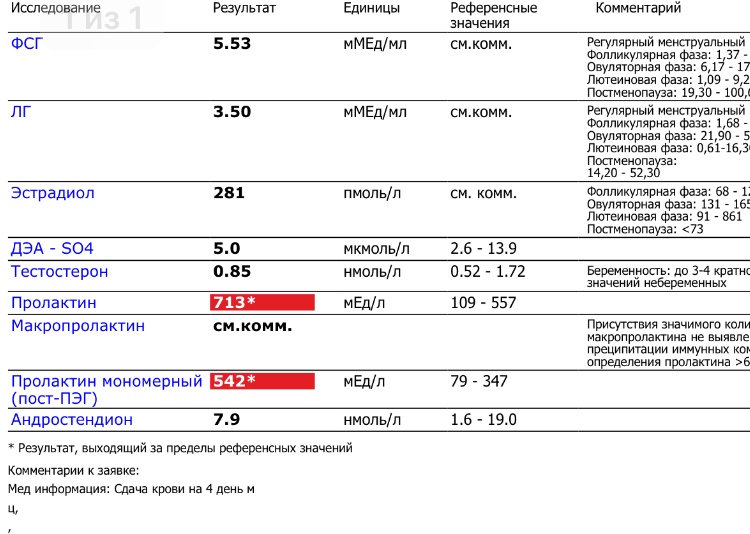 При содержании мПРЛ 60% от общего гормона и более состояние диагностируется как гипермакропролактинемия, в этих случаях отмечают отсутствие симптомов или слабо выраженную клиническую картину гиперпролактинемии при значительно повышенном уровне общего ПРЛ сыворотки. Содержание в крови биологически активного ПРЛ у большинства таких пациентов в пределах нормы, т.е. определение мПРЛ при повышенном содержании общего ПРЛ позволяет избежать ненужных, обременительных для пациента диагностических процедур, направленных на установление причин гиперпролактинемии. Распространенность гипермакропролактинемии среди пациентов с гиперпролактинемией, составляет 15–30%.
При содержании мПРЛ 60% от общего гормона и более состояние диагностируется как гипермакропролактинемия, в этих случаях отмечают отсутствие симптомов или слабо выраженную клиническую картину гиперпролактинемии при значительно повышенном уровне общего ПРЛ сыворотки. Содержание в крови биологически активного ПРЛ у большинства таких пациентов в пределах нормы, т.е. определение мПРЛ при повышенном содержании общего ПРЛ позволяет избежать ненужных, обременительных для пациента диагностических процедур, направленных на установление причин гиперпролактинемии. Распространенность гипермакропролактинемии среди пациентов с гиперпролактинемией, составляет 15–30%.
Показания к исследованию
- Выбор тактики лечения гиперпролактинемических состояний;
- остеопороз;
- галакторея.
У женщин:
- цикличные боли в молочной железе, мастопатия, мастодиния;
- ановуляция;
- олигоменорея, аменорея, дисфункциональные маточные кровотечения;
- бесплодие;
- диагностика полового инфантилизма;
- комплексная оценка функционального состояния фетоплацентарного комплекса;
- дифференциальная диагностика истинного перенашивания беременности;
- нарушение лактации в послеродовом периоде;
- тяжело протекающий климакс;
- ожирение;

У мужчин:
- снижение либидо и потенции;
- гинекомастия.
Повышенные значения
- Заболевания, повреждения или опухоли гипоталамуса;
- заболевания, повреждения или опухоли гипофиза;
- эктопическая секреция гормонов;
- недостаточность или врождённая дисфункция коры надпочечников;
- синдром поликистозных яичников;
- гиповитаминоз В6;
- хроническая почечная недостаточность;
- цирроз печени;
- неврогенная анорексия;
- злоупотребление пивом.
Пониженные значения
- Синдром Шихана;
- истинное перенашивание беременности.
Мультигормональная секреторная активность клеток клинически не функционирующих опухолей гипофиза in vitro и влияние на нее тиролиберина | Булатов
Опухоли гипофиза, как правило, представляют собой аденомы, активно продуцирующие и секретирующие гормоны; проявляются высоким уровнем того или иного гормона в циркулирующей крови и характерным клиническим синдромом его гиперсекреции. Однако 25—30% опухолей гипофиза относятся к так называемым клинически не функционирующим или гормонально-неактивным опухолям [9, 10]. Они не сопровождаются существенным возрастанием содержания гипофизарных гормонов в крови и потому их клеточная биология, патогенетические механизмы, ранняя диагностика и клинический мониторинг составляют особую проблему. Одним из важных направлений исследований является поиск маркеров этих опухолей. В качестве возможных биохимических маркеров гипофизарных опухолей, в том числе клинически не функционирующих, рассматриваются свободные субъединицы гликопротеиновых гормонов, которые могут секретироваться опухолевыми клетками гипофиза [2, 3, 8, 9].
Однако 25—30% опухолей гипофиза относятся к так называемым клинически не функционирующим или гормонально-неактивным опухолям [9, 10]. Они не сопровождаются существенным возрастанием содержания гипофизарных гормонов в крови и потому их клеточная биология, патогенетические механизмы, ранняя диагностика и клинический мониторинг составляют особую проблему. Одним из важных направлений исследований является поиск маркеров этих опухолей. В качестве возможных биохимических маркеров гипофизарных опухолей, в том числе клинически не функционирующих, рассматриваются свободные субъединицы гликопротеиновых гормонов, которые могут секретироваться опухолевыми клетками гипофиза [2, 3, 8, 9].
Поскольку эффективным методологическим приемом в изучении клеточно-биологических особенностей различных типов опухолей гипофиза может быть клеточное культивирование [1, 4, 6], в настоящей работе в опытах на культурах изолированных клеток клинически не функционирующих опухолей гипофиза исследованы их базальная секреторная активность по целому спектру возможных продуктов секреции и влияние на нее гипоталамического пептидного гормона тироли- берина.
Материалы и методы
Ткань клинически не функционирующих опухолей гипофиза была получена из операционного материала (НИИ нейрохирургии им. акад. Н. Н. Бурденко РАМН) от 4 больных, у которых до операции содержание гипофизарных гормонов в сыворотке крови было в пределах нормы и не отмечалось клинических признаков их гиперсекреции.
Кусочек опухолевой ткани содержали до начала исследования в среде 199 (’’Flow», Англия) при 4°С не более 1 сут. Ткань после отмывания от крови растворами Версена и ЭДТА и удаления сосудов разрезали на мелкие фрагменты толщиной около 1 мм и подвергали дезагрегации на отдельные клетки воздействием 0,25% раствора трипсина (’’Sigma’’, США) в течение 30 мин при 37°С. Более подробно техника получения изолированных клеток из ткани опухолей гипофиза описана ранее [1,6].
После центрифугирования при 800 g клетки ресуспендировали в среде инкубации, состоящей из среды 199 с добавлением 10% сыворотки крови эмбрионов коров («Calbiochem”, США) и пенициллина (50 ЕД/мл). Клеточную суспензию высевали в 24-луночные пластиковые макропанели («Flow, Англия) по 600 тыс. клеток в лунку в 1 мл среды. Клетки инкубировали в термостате при 37°С в атмосфере воздуха с 5% СО Клетки инкубировали в свежей среде в течение 48 ч. После инкубации клеток среду отбирали, замораживали и хранили при —30°С до проведения анализа в ней содержания гормонов. В объединенной среде из 3 лунок определяли содержание лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, ТТГ, Прл, гормона роста (ГР), а также свободной а-субъеди- ницы (АС) гликопротеиновых гормонов.
Клетки инкубировали в свежей среде в течение 48 ч. После инкубации клеток среду отбирали, замораживали и хранили при —30°С до проведения анализа в ней содержания гормонов. В объединенной среде из 3 лунок определяли содержание лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, ТТГ, Прл, гормона роста (ГР), а также свободной а-субъеди- ницы (АС) гликопротеиновых гормонов.
При исследовании влияния тиролиберина на секреторную активность опухолевых клеток в лунки макропанели после предыдущей 48-часовой инкубации добавляли свежую порцию питательной среды с синтетическим препаратом тиролиберина (Институт органического синтеза, Латвия) в концентрации 10 нг/мл или без него (контроль) и клетки продолжали инкубировать в течение 1 или 24 ч. По завершении инкубации в среде определяли содержание гормонов.
Для изучения действия тиролиберина на уровень гонадотропинов и АС в сыворотке крови у больных с клинически не функционирующей опухолью гипофиза вводили внутривенно по 200 мг этого гипоталамического гормона (препарат ’’TRH-Ferring», Германия).
Определение содержания гормонов и свободной АС в среде инкубации изолированных опухолевых клеток или в сыворотке крови осуществляли радиоиммунологическим методом с использованием тест-систем, разработанных в Институте экспериментальной эндокринологии ЭНЦ РАМН на основе высокоочищенных антигенов и моноспецифических поликлональных антисывороток. В качестве рабочих стандартов при этом применяли препараты гормонов высокой степени очистки, аттестованные по международным стандартам ВОЗ. Чувствительность радиоиммунологиче- ской тест-системы для ЛГ составляла 0,05 нг/мл (0,8 мЕД/мл), для ФСГ — 0,24 нг/мл (0,85 мЕД/мл), для ТТГ — 0,05 нг/мл (0,5 мкЕД/мл), для Прл — 0,5 нг/мл (20 мкЕД/мл), для ГР — 0,1 нг/мл, для АС — 0,15 нг/мл. Коэффициент вариации результатов определения в тест-системах не превышал 8%.
Результаты и их обсуждение
Культивируемые in vitro клетки клинически не функционирующих опухолей гипофиза, как можно видеть из табл. 1, проявляли определенный секреторный потенциал, освобождая в среду измеряемое радиоиммунологическим методом количество гормонов. Иначе говоря, эти опухолевые клетки не утратили внутриклеточные структуры и механизмы, осуществляющие биосинтез и секрецию гормонов.
1, проявляли определенный секреторный потенциал, освобождая в среду измеряемое радиоиммунологическим методом количество гормонов. Иначе говоря, эти опухолевые клетки не утратили внутриклеточные структуры и механизмы, осуществляющие биосинтез и секрецию гормонов.
Важной особенностью секреторной активности клеток исследуемых опухолей является ее мультигормональный характер, что отличает их от нормальных высокодифференцированных клеток гипофиза или клеток так называемых гормонально-активных опухолей, способных к продукции и секреции преимущественно одного из гипофизарных гормонов. Все клеточные культуры секретировали несколько гормонов, в том числе оба гонадотропина или Л Г (опухоль № 1), свободную АС гликопротеиновых гормонов, Прл, а культуры клеток двух опухолей (№ 1 и № 3) дополнительно секретировали ГР. Ни в одной клеточной культуре в среде не обнаружено ТТГ.
Следует отметить, что в наших опытах с клеточным культивированием после 48 ч инкубации довольно значительного числа клеток в небольшом объеме среды (600 тыс. клеток в 1 мл) содержание гормонов в среде было невелико. Оно вполне сопоставимо с нормальным содержанием гормонов гипофиза в сыворотке крови и во много раз ниже содержания гормонов, обнаруживаемого в среде при культивировании примерно в тех же условиях клеток гормонально-активных опухолей гипофиза [1, 3, 4, 6]. Это означает, что уровень секреторной активности клеток исследуемых нами опухолей был явно недостаточным для существенного пополнения пула гипофизарных гормонов, циркулирующих в крови. Исключением была свободная АС. Ее содержание в среде инкубации всех опухолей заметно превышало нормальное содержание АС в сыворотке крови, составляющее, по нашим данным [2], в среднем 0,90 ± 22 (М ± о).
клеток в 1 мл) содержание гормонов в среде было невелико. Оно вполне сопоставимо с нормальным содержанием гормонов гипофиза в сыворотке крови и во много раз ниже содержания гормонов, обнаруживаемого в среде при культивировании примерно в тех же условиях клеток гормонально-активных опухолей гипофиза [1, 3, 4, 6]. Это означает, что уровень секреторной активности клеток исследуемых нами опухолей был явно недостаточным для существенного пополнения пула гипофизарных гормонов, циркулирующих в крови. Исключением была свободная АС. Ее содержание в среде инкубации всех опухолей заметно превышало нормальное содержание АС в сыворотке крови, составляющее, по нашим данным [2], в среднем 0,90 ± 22 (М ± о).
По современным представлениям, основанным на молекулярно-биологических исследовани-
Табл и ца 1
Содержание гормонов (в нг/мл) в среде культивирования клеток клинически не функционирующих опухолей гипофиза через 48 ч инкубации
Номер опухоли | ЛГ | ФСГ | ТТГ | АС | ГР | Прл |
1 | 1,17 | 0 | 0 | 6,65 | 8,79 | 32,50 |
2 | 0,94 | 0,54 | 0 | 3,65 | 0 | 1,84 |
3 | 1,15 | 0,70 | 0 | 2,65 | 0,95 | 1,18 |
4 | 0,80 | 0,65 | 0 | 2,98 | 0 | 0,85 |
Примечание. Условия культивирования см. в разделе “Материалы и методы”. Здесь и в табл. 2: 0 — содержание гормона в среде ниже чувствительности используемой ра- диоиммунологической тест-системы: в случае ТТГ — ниже 0,05 нг/мл, в случае ГР — ниже 0,1 нг/мл.
Условия культивирования см. в разделе “Материалы и методы”. Здесь и в табл. 2: 0 — содержание гормона в среде ниже чувствительности используемой ра- диоиммунологической тест-системы: в случае ТТГ — ниже 0,05 нг/мл, в случае ГР — ниже 0,1 нг/мл.
Таблица 2
Влияние тиролиберина на секреторную активность культур клеток клинически не функционирующих опухолей гипофиза
Номер опухоли | Условия опыта | Содержание гормонов в среде, нг/мл (Л/ ± пг, п — 4) | ||||
ЛГ | ФСГ | АС | ГР | Прл | ||
1 | Инкубация 1 ч без тиролиберина (контроль) | 0,20 ± 0,05 | 0 | 0,54 ± 0,01 | 0,28 ± 0,20 | 10,00 ± 1,10 |
Инкубация 1 ч с тиролиберином (10 нг/мл) | 0,92 ± 0,01 | 0 | 4,84 ± 0,40 | 2,53 ± 0,09 | 54,80 ± 7,70 | |
Р | < 0,001 | < 0,001 | < 0,001 | < 0,01 | ||
2 | Инкубация 24 ч без тиролиберина (контроль) | 0,68 ± 0,07 | 1,01 ± 0,06 | 2,02 ± 0,11 | 0 | 1,65 ± 0,19 |
Инкубация 24 ч с тиролиберином (10 нг/мл) | 1,80 ± 0,09 | 5,66 ± 1,08 | 9,32 ± 1,95 | 0 | 2,57 ± 1,54 | |
Р | < 0,001 | < 0,01 | < 0,01 | > 0,05 | ||
ях, опухоли гипофиза, в том числе клинически не функционирующие, имеют моноклональную природу [7, 9, И], т. е. опухоль гипофиза является результатом экспансии одного клона генетически трансформированных клеток, что предполагает однородность ее клеточной популяции. Исходя из этого, мультигормональный характер базальной секреторной активности изученных нами клинически не функционирующих опухолей гипофиза может свидетельствовать об их слабой морфофункциональной дифференцировке. Вполне возможно, что процесс опухолевой трансформации клетки сопровождается большей или меньшей клеточной дедифференцировкой и активацией в клетке экспрессии целого ряда генов гормонов и клеточных рецепторов, не свойственной нормальным специализированным клеткам гипофиза. Таким образом, в основе формирования клинически не функционирующей опухоли гипофиза может лежать пролиферация клона малодифференцированных трансформированных клеток. Невысокий уровень гормональной секреции, обнаруживаемый в культурах клеток опухолей такого типа, указывает на их функциональную неполноценность. Нарушение нормальных внутрисекреторных механизмов процессинга продуктов генной экспрессии, проявляющееся в секреции клетками наряду со зрелыми гонадотропинами значительного количества свободной АС гликопротеиновых гормонов, подтверждает функциональную неполноценность клеток клинически не функционирующих опухолей гипофиза.
е. опухоль гипофиза является результатом экспансии одного клона генетически трансформированных клеток, что предполагает однородность ее клеточной популяции. Исходя из этого, мультигормональный характер базальной секреторной активности изученных нами клинически не функционирующих опухолей гипофиза может свидетельствовать об их слабой морфофункциональной дифференцировке. Вполне возможно, что процесс опухолевой трансформации клетки сопровождается большей или меньшей клеточной дедифференцировкой и активацией в клетке экспрессии целого ряда генов гормонов и клеточных рецепторов, не свойственной нормальным специализированным клеткам гипофиза. Таким образом, в основе формирования клинически не функционирующей опухоли гипофиза может лежать пролиферация клона малодифференцированных трансформированных клеток. Невысокий уровень гормональной секреции, обнаруживаемый в культурах клеток опухолей такого типа, указывает на их функциональную неполноценность. Нарушение нормальных внутрисекреторных механизмов процессинга продуктов генной экспрессии, проявляющееся в секреции клетками наряду со зрелыми гонадотропинами значительного количества свободной АС гликопротеиновых гормонов, подтверждает функциональную неполноценность клеток клинически не функционирующих опухолей гипофиза.
Слабая дифференцировка клеток исследуемых опухолей проявляется не только множественностью секретируемых ими в клеточной культуре гормонов, но и неспецифическим характером реакции со стороны их секреции на тиролиберин. В табл. 2 представлены результаты изучения влияния этого гипоталамического стимулятора на секреторную активность культур клеток опухолей № 1 и 2. Можно видеть, что клетки обеих культур оказались достаточно высокочувствительными к тиролиберину, что свидетельствует об активной экспрессии в клетках гена его рецептора. Тиролиберин, присутствовавший в среде инкубации в концентрации 10 нг/мл, существенно увеличивал освобождение в среду всего изученного спектра секретируемых клеточными культурами продуктов. В культуре клеток опухоли № 1 (инкубация в течение 1 ч) содержание Л Г возрастало в 4,6 раза, Прл — в 5,5 раза, АС и ГР — в 9 раз. В культуре клеток опухоли № 2 (инкубация в течение 24 ч) содержание ЛГ возрастало в 2,6 раза, АС — в 4,6 раза, ФСГ — в 5,6 раза, увеличение содержания Прл (в 1,6 раза) было статистически недостоверным.
Выявленная в опытах in vitro способность тиролиберина вызывать освобождение из клеток клинически не функционирующих опухолей гипофиза гонадотропинов и АС гликопротеиновых гормонов соответствует клиническим данным. Как указывают Н. Katznelson и соавт. [9], до 40% больных с клинически не функционирующими опухолями гипофиза отвечают на введение тиролиберина увеличением содержания в сыворотке
Таблица 3
Содержание ЛГ, ФСГ, АС и Прл в сыворотке крови у больных с клинически не функционирующей опухолью гипофиза до и через 15—120 мин после внутривенного введения 200 мг тиролиберина
Больная | Время, мин | ФСГ | ЛГ | АС | Прл | |||
мЕд/мл | нг/мл | мЕд/мл | нг/мл | нг/мл | мкЕд/мл | нг/мл | ||
0 | 3,65 | 1,04 | 2,87 | 0,19 | 1,65 | 401,80 | 10,05 | |
15 | 3,50 | 1,00 | 7,31 | 0,49 | 1,36 | 1322,20 | 33,06 | |
30 | 4,82 | 1,38 | 1,17 | 1122,50 | 28,06 | |||
Г. | 60 | 2,46 | 0,70 | 5,94 | 0,40 | 1,48 | 707,20 | 17,68 |
90 | 2,75 | 0,80 | 6,23 | 0,42 | 1,46 | 630,30 | 15,76 | |
120 | 2,86 | 0,82 | 5,98 | 0,40 | 363,90 | 9,10 | ||
0 | 2,13 | 0,61 | 3,44 | 0,23 | 0,68 | 268,10 | 6,70 | |
15 | 2,14 | 0,61 | 4,30 | 0,29 | 1,33 | 867,80 | 21,70 | |
30 | 2,69 | 0,77 | 6,30 | 0,42 | 1,53 | 698,20 | 17,46 | |
Н. | 60 | 2,85 | 0,80 | 6,09 | 0,41 | 0,97 | 439,10 | 10,98 |
90 | 1,54 | 0,44 | 3,49 | 0,23 | 0,74 | 334,30 | 8,36 | |
120 | 2,64 | 0,75 | 2,78 | 0,19 | 0,66 | 145,40 | 3,64 | |
0 | 3,47 | 0,99 | 5,88 | 0,39 | 0,87 | 277,67 | 6,94 | |
15 | 3,50 | 1,00 | 3,39 | 0,23 | 1,65 | 1618,96 | 40,47 | |
30 | 5,06 | 1,45 | 4,65 | 0,31 | 2,05 | 1350,3 | 33,76 | |
Р. | 60 | 2,45 | 0,70 | 4,18 | 0,28 | 1,27 | 730,5 | 18,26 |
90 | 2,66 | 0,76 | 6,22 | 0,41 | 0,88 | 466,86 | 11,67 | |
120 | 3,18 | 0,91 | 5,00 | 0,33 | 1,39 | 350,18 | 8,75 | |
0 | 6,17 | 1,76 | 9,77 | 0,65 | 2,00 | 219,80 | 5,50 | |
15 | 7,50 | 2,14 | 7,74 | 0,52 | 2,05 | 1428,90 | 35,72 | |
30 | 6,20 | 1,77 | 7,27 | 0,49 | 2,24 | 1316,40 | 32,91 | |
С. | 60 | 5,85 | 1,67 | 7,90 | 0,53 | 1,47 | 484,10 | 12,10 |
90 | 7,96 | 2,27 | 10,79 | 0,72 | 1,78 | 417,90 | 10,37 | |
120 | 6,44 | 1,84 | 8,23 | 0,55 | 1,75 | 307,00 | 7,68 | |
крови гонадотропинов и/или их свободных субъединиц. Нами были исследованы изменения содержания Прл, ЛГ, ФСГ и АС в сыворотке крови в ходе фармакодинамической пробы с внутривенным введением тиролиберина у 4 женщин репродуктивного возраста с клинически не функционирующей эндоселлярной опухолью гипофиза и синдромом поликистозных яичников. Согласно клиническим наблюдениям [5], у женщин сочетание опухоли такого типа с синдромом поликистозных яичников встречается довольно часто и может свидетельствовать о существовании определенной патогенетической связи между ними. Опухоль гипофиза у обследованных больных была выявлена в результате компьютерной или магнитно-резонансной томографии области турецкого седла. Результаты наших исследований подтвердили, что у больных с клинически не функционирующими опухолями гипофиза тиролиберин может стимулировать секрецию не только Прл, но и Л Г, ФСГ или АС. Из табл. 3 видно, что у больной Г. тиролиберин через 15—30 мин после введения вызывал повышение уровня Прл в 3,3 раза, ЛГ в 2,6 раза, ФСГ в 1,3 раза. У больной Н. уровень Прл повышался в 3,2 раза, АС — в 2,25 раза, ЛГ — в 1,8 раза. У больной Р. отмечено повышение уровня АС в сыворотке крови в 2,4 раза и ФСГ в 1,5 раза. Только у больной С. в ответ на введение тиролиберина содержание ЛГ, ФСГ и АС в сыворотке крови не изменялось при повышении содержания Прл в 6,5 раза.
Таким образом, исследование реакции Л Г, ФСГ и свободной АС сыворотки крови в ходе фармакодинамической пробы с тиролиберином может быть одним из подходов к более раннему выявлению клинически не функционирующих опухолей гипофиза. Причина неспецифического ответа на тиролиберин может состоять в том, что клетки клинически не функционирующих опухолей гипофиза, в большинстве случаев способные к продукции и секреции гонадотропинов и их субъединиц, в отличие от нормальных гонадотрофов, несут рецепторы тиролиберина.
Выводы
- Изолированные клетки клинически не функционирующих опухолей гипофиза в клеточной культуре способны освобождать в среду в небольшом количестве несколько гормонов, в том числе ЛГ, ФСГ, АС гликопротеиновых гормонов, а также Прл и ГР. Мультигормональный характер секреторной активности этих клеток свидетельствует об их слабой морфофункциональной дифференцировке.
- Трансформированные клетки клинически не функционирующих опухолей гипофиза в отличие от нормальных гипофизарных клеток отвечают на гипоталамический гормон тиролиберин неспецифически — усилением секреции не только Прл, но и гонадотропинов, АС гликопротеиновых гормонов и ГР.
- Выявленное в условиях in vitro свойство опухолевых клеток существенно усиливать под влиянием тиролиберина секрецию гонадотропинов и АС гликопротеиновых гормонов согласуется с возможностью повышения их уровня в крови больных с клинически не функционирующей опухолью гипофиза в ответ на введение им этого гипоталамического гормона. Реакция в ходе фармакодинамической пробы с тиролиберином со стороны гонадотропинов и/или свободной АС гликопротеиновых гормонов сыворотки крови может быть одним из подтверждающих диагностических признаков такого рода опухолей.
1. Булатов А. А., Комолов И. С., Смирнова Н. Б. и др. // Бюл. экспер. биол. — 1992. — № 4. — С. 406—409.
2. Булатов А. А., Киселева А. Г., Горшкова Т. В., Акопова Н. Б. // Пробл. эндокринол. — 1994. — № 6. — С. 44—47.
3. Булатов А. А., Киселева А. Г., Горшкова Т. В. и др. // Вопр. мед. химии. — 1995. — № 5. — С. 19—23.
4. Булатов А. А., Мартынов А. В., Григорьян А. ГТ, Комолов И. С. Ц Биохимия. — 1995. — № 10. — С. 1637-1646.
5. Вакс В. В., Марова Е. И., Гончаров Н. П. и др. // Пробл. эндокринол. — 1997. — № 4. — С. 13—18.
6. Комолов И. С., Булатов А. А., Макаровская Е. Е. и др. // Бюл. экспер. биол. — 1994. — № И. — С. 543—546.
7. Alexander J. М., Biller В. М., Bikkal Н. et al. // J. clin. Invest. — 1990- Vol. 86. — P. 336-340.
8. Faglia G. // Eur. J. Endocrinol. — 1995. — Vol. 133. — P. 23-24.
9. Katsnelson H., Alexander J. M., Klibanski A. // J. clin. Endocrinol. Metab. — 1993. — Vol. 76. — P. 1089-1095.
10. Luizzi A., Tassi V., Pierro M. T. et al. // Metabolism. — 1996. — Vol. 45, N 8. — Suppl. 1. — P. 80-82.
11. Spcida A., Vallar L., Faglia G. // Eur. J. Endocrinol. — 1994. — Vol. 130. — P. 43-52.
Анализы на гормоны, цены в Новосибирске
Виды исследований
Комплекс АФП+ХГЧ+НЭ-3 (PRISKA)Срок готовности: 14 рабочих дней, исследуемый биоматериал: Сыворотка 1320₽ Тропонин I
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 580₽ Антитела к кардиолипину суммарные (IgA IgM IgG) (качественный) (диагностика фосфолипидного синдрома)
Срок готовности: 17 рабочих дней, исследуемый биоматериал: Сыворотка 1370₽ Трехкомпонентный кардиотест (Тропонин I, миоглобин, КФК МВ)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Сыворотка 1840₽ Комплекс ПАПП-А + свободный бета-ХГЧ (PRISKA)
Срок готовности: 2 рабочих дня, исследуемый биоматериал: Сыворотка 1260₽ Тиреотропный гормон (ТТГ)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 320₽ Альдостерон
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 480₽ Мозговой натрийуретический пептид (В-типа) (BNP)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 2310₽ Ренин
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 790₽ Прокальцитонин
Срок готовности: 1 рабочий день, исследуемый биоматериал: Кровь 2100₽ Гастрин
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 690₽ Инсулиноподобный фактор роста I (ИПРФ-I) (Соматомедин-С)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 950₽ Лептин
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Кровь 740₽ Гормон роста (СТГ)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Кровь 480₽ Проинсулин
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Кровь 900₽ Фруктозамин
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Сыворотка 320₽ Иммунореактивный инсулин (ИРИ)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 560₽ С – пептид
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 470₽ N-терминальный пропептид проколлагена 1 типа (маркер формирования костного матрикса P1NP)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 1320₽ С-концевые телопептиды коллагена I типа (Бета- cross laps)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Сыворотка 790₽ Остеокальцин
Срок готовности: 6 рабочих дней, исследуемый биоматериал: Сыворотка 580₽ Паратгормон
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Кровь 630₽ Витамин D (25-ОН)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Сыворотка 2420₽ Тироксин связывающая способность сыворотки (T-Uptake )
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 580₽ Антитела к рецепторам ТТГ
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Кровь 1530₽ Тироксин свободный (св. Т4)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 350₽ Тироксин (T4)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Кровь 350₽ Трийодтиронин свободный (св. Т3)
Срок готовности: 2 рабочих дня, исследуемый биоматериал: Сыворотка 350₽ Трийодтиронин (T3)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Кровь 350₽ Тиреотропный гормон (ТТГ)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 320₽ Антитела к тиреопероксидазе (АТ-ТПО)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 450₽ Тироксин — связывающий глобулин (ТСГ)
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 480₽ Антитела к тиреоглобулину (АТ-ТГ)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Сыворотка 480₽ Антитела к микросомальной фракции тиреоцитов (АТ-МАГ)
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Сыворотка 690₽ Тиреоглобулин (ТГ)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Сыворотка 580₽ Андростендион
Срок готовности: 6 рабочих дней, исследуемый биоматериал: Сыворотка 900₽ Миоглобин
Срок готовности: 2 рабочих дня, исследуемый биоматериал: Кровь 580₽ Гомоцистеин
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Кровь 1160₽ Эритропоэтин
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 630₽ Фолиевая кислота
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Кровь 570₽ Витамин В 12 (цианкобаламин)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 480₽ Гликоделин (кровь)
Срок готовности: 14 рабочих дней, исследуемый биоматериал: Сыворотка 1580₽ Андростендион
Срок готовности: 6 рабочих дней, исследуемый биоматериал: Сыворотка 900₽ Адренокортикотропный гормон (АКТГ)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Кровь 580₽ Дезоксипиридинолин (утренняя порция мочи)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Моча 1370₽ Свободный кортизол в суточной моче
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Моча 790₽ 17-КС в суточной моче (17-кетостероиды)
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Суточная моча 710₽ Нефрины в плазме (метанефрин и норметанефрин)
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Плазма 1890₽ Нефрины в суточной моче (метанефрин и норметанефрин)
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Моча 1840₽ Катехоламины (адреналин норадреналин дофамин)
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Кровь 2050₽ Катехоламины в суточной моче (адреналин норадреналин дофамин)
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Моча 2050₽ Дигидроэпиандростерон сульфат (ДЭАС)
Срок готовности: 5 рабочих дней, исследуемый биоматериал: Кровь 370₽ 17-оксипрогестерон
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Цельная кровь 480₽ Кортизол
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 480₽ Альфа-фетопротеин человека (АФП)
Срок готовности: 14 рабочих дней, исследуемый биоматериал: Кровь 370₽ Антимюллеров гормон (АМГ)
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 1160₽ Глобулин-связывающий половой гормон (ГСПГ)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 420₽ Дегидротестостерон (DHT)
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 1210₽ Ингибин А
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 1580₽ Ингибин В
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Сыворотка 1420₽ Комплекс АФП+ХГЧ+НЭ-3 (PRISKA)
Срок готовности: 14 рабочих дней, исследуемый биоматериал: Сыворотка 1320₽ Комплекс ПАПП-А + свободный бета-ХГЧ (Центр планирования семьи)
Срок готовности: 10 рабочих дней, исследуемый биоматериал: Сыворотка 1890₽ Лютеинизирующий гормон (ЛГ)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Сыворотка 370₽ Неконьюгированный этриол (НЭ-3)
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 580₽ Общий бета-хорионический гонадотропин (ХГЧ)
Срок готовности: 6 рабочих дней, исследуемый биоматериал: Сыворотка 420₽ ПАПП-А
Срок готовности: 2 рабочих дня, исследуемый биоматериал: Кровь 580₽ Плацентарный лактоген (HPL)
Срок готовности: 11 рабочих дней, исследуемый биоматериал: Кровь 690₽ Прогестерон (Прг)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 370₽ Пролактин (Прл)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 370₽ Свободный бета-ХГЧ
Срок готовности: 2 рабочих дня, исследуемый биоматериал: Сыворотка 580₽ Свободный тестостерон
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Кровь 840₽ Тестостерон (Тст)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 370₽ Трофобластический гликопротеин (ТБГ)
Срок готовности: 7 рабочих дней, исследуемый биоматериал: Сыворотка 480₽ Фолликулостимулирующий гормон (ФСГ)
Срок готовности: 3 рабочих дня, исследуемый биоматериал: Кровь 370₽ Эстрадиол (Э-2)
Срок готовности: 1 рабочий день, исследуемый биоматериал: Сыворотка 370₽ показать еще 70
Гормон пролактин (лактотропный гормон) | Москва
Пролактин (лактотропный гормон) — это гормон, который воздействует на ткани молочных желез
Стимулирует и поддерживает выработку молока в молочных железах, регулирует менструальный цикл. Во время беременности повышается содержание эстрогенов, стимулирующих выработку пролактина. Стимулирует синтез белка, жиров и углеводов, образования желтого тела и выработку прогестерона. Влияет на водно-солевой обмен, усиливает эффекты альдостерона и вазопрессина.
Пролактин синтезируется в передней доли гипофиза. Вырабатывается во сне и после пробуждения. Также участвует в формировании иммунного ответа.
Анализ крови на пролактин назначается при подозрении и первичной диагностики пролактиномы. Аденома гипофиза – наиболее частая причина высокого уровня ПРЛ в крови. Аденомы гипофиза гормонально активные:
- пролактинома (продукция пролактина),
- соматотропинома (продукция СТГ. проявляется симптомами гигантизма и акромегалией),
- кортикотропинома (продукция АКТГ, при болезни Иценко-Кушинга),
- тиреотропинома (продукция ТТГ, развитием гипотиреоза),
- гонадотропинома (продукция ФСГ, ЛГ).
Причины развития аденомы гипофиза
Перенесенные инфекционные заболевания головного мозга, внутриутробные аномалии развития плода, последствия черепно-мозговых травм. В зависимости от размеров: микропролактинома (менее 1 см) и макропролактинома (более 1 см).
Чаще всего аденома гипофиза диагностируется у женщин в возрасте 30-40 лет.
Симптомы гиперпролактинемии
У женщин:
- развитие бесплодия, в связи с отсутствием овуляции, невынашивания беременности,
- нарушение менструального цикла, олиго и аменореи,
- дисфункциональные маточные кровотечения,
- снижение либидо,
- галакторея — выделение жидкости (молозива) из молочных желез. Встречается в 80%случаев.
При макропролактиноме отмечается появление головных болей, нарушение зрительных функций (снижение остроты зрения, двоение в глазах), внутричерепная гипертензия.
Неврологические нарушения: нарушение сна, снижение памяти, головокружения, также рост волос на лице, выпадение волос.
Гиперпролактинемия в кровотоке снижает пролиферацию (рост и деление клеток), индуцирует апоптоз кератиноцитов волосяной луковицы. Это приводит к снижению роста волос. Помимо прямого действия на фолликул, пролактин оказывает опосредованное влияние на волосы, так как происходит повышение уровня андрогенов к коре надпочечников. Таким образом, гиперпролактинемия может приводить к диффузному телогенному выпадению волос.
У мужчин:
- геникомастия (увеличение молочных желез),
- снижение уровня тестостерона,
- сексуальные расстройства,
- снижение образования сперматозоидов,
- снижение либидо,
- эректильная дисфункция,
- также приводит к развитию бесплодия.
Гиперпролактинемия также может быть при многих других эндокринных заболеваниях: заболевания щитовидной железы(гипотиреоз), синдромом поликистозных яичников, гипогонадизмом, недостаточностью коры надпочечников (гипокортицизм), врожденной гиперплазией коры надпочечников, заболевания гипоталамуса (краниофарингиомы, глиомы, метастатические поражения и аномальное развитие сосудов), эстрогенпродуцирующие опухоли яичников.
При гиперпролактинемии снижается уровень андрогенов, изменяется уровень женских половых гормонов. В связи с повышенность хрупкостью костей развивается остеопения и остеопороз. Также гиперпролактинемия может быть при системных заболеваниях, при поражении гипоталамо-гипофизарной области: туберкулезе, бактериальных абсцессах, саркоидозе, ХПН. Гиперпролактинемия в ряде случаев является составной частью синдрома МЭН-1.
При сочетании недостаточности диафрагмы турецкого седла с повышением давления ликвора в желудочках мозга развивается синдром «пустого» турецкого седла. При этом синдроме содержание пролактина часто повышается.
Функциональные причины, не требующие лечения:
- сон,
- физические нагрузки,
- курение,
- прием белковой пищи,
- стрессы,
- половой акт женщины,
- послеродовой период,
- кормление грудью.
Гиперпролактинемия наблюдается при приеме большого ряда фармакологических препаратов (таких как блокаторов дофамина, нейролептики, антидепрессанты, блокаторы кальциевых каналов, оральные эстрогенсодержащие контрацептивы, опиаты)
Психогенная гиперпролактинемия наблюдается в ряде случаев психо-неврологических расстройств органического и функционального генеза.
Гиперпролактинемия замедляет метаболизм и усиливает аппетит, что приводит к избыточной массе тела или ожирению (50% случаев). Нарушается углеводный и жировой обмен. Повышение активности В-клеток поджелудочной железы приводит к нарушению метаболизма глюкозы и развитию инсулинорезистентности, что ведет к развитию метаболического синдрома.
Нормализация уровня пролактина ведет к снижению массы тела. Снижение веса на 4-8 кг у 50-70% спустя 6-18 месяцев лечения пролактином. Основа лечения ожирения — медикаментозная терапия, направленная на нормализацию уровня пролактина, а также — формирование принципов рационального питания.
Исследование пролактина во время беременности не информативно, так как в организме женщины повышено содержание эстрогена, происходит стимуляция пролактина, его уровень повышается в несколько раз что является абсолютной нормой.
Проведение исследования
Анализ крови на пролактин проводится строго натощак утром, на 3 -5 день менструального цикла, за 2 дня до исследования исключить стрессовые ситуации , физические нагрузки, за 2 часа до сдачи анализа не курить.
При лабораторной диагностике гиперпролактинемии проводится исследование на мономерный пролактин, макропролактин (Big-big пролактин), соматотропин, ТТГ, тироксин, кортизол, женских половых гормонов (ЛГ, ФСГ, эстрадиола, прогестерона, дегидроэпиандростерона), также андрогенов (общего тестостерона). При макропролактиномах — уровень АКТГ, ИФР-1.
Так как гиперпролактинемия сопровождается ожирением — определение инсулина, С-пептида. Также тест на беременность.
При топической диагностике: рентгенография черепа в 2-х проекциях или КТ (с контрастированием) или МРТ гипоталамо-гипофизарной области, УЗИ органов малого таза и молочных желез, исследование полей зрения.
Лечение
Лечение гиперпролактинемии зависит от причин, вызвавших повышение уровня пролактина. Лечение заболеваний эндокринной системы приводит к нормализации гормонального статуса и снижению пролактина.
Медикаментозное лечение
При лечении пролактиномы гипофиза для подавления уровня пролактина назначается агонисты дофаминовых рецепторов: Препарат 1 поколения — бромокриптин 1.25 мг 1-3 раза в день во время еды. Максимальная суточная доза — 10-12.5 мг.
При лечении бесплодия — овуляция наступает на 4-8 неделе беременности. При микроаденоме — лечение не менее 12 месяцев. При отмене препарата — ремиссия длительностью более года наступает у 12% больных с микро- и 17% с макропролактиномами.
Препарат 2 поколения: квинаголид — однократно принимается, ежедневно.
Препарат 3 поколения: достинекс (каберголин) 0.25 мг 2 раза в неделю (при микроаденомах).
Контроль уровня пролактина через 2-4 недели при подборе дозировки, далее каждые 3-6 месяцев.
При отмене препарата, достинекс выводится 3-4 месяца. Контроль уровня пролактина через 6 месяцев. 1 мг 2 раза в неделю (при лечении макроаденомы). Лечение не менее 12 месяцев. Достинекс эффективно восстанавливает фертильность у женщин с гиперпролактинемией: у 72% больных при приеме в течение 24 недель восстанавливается овуляция и наступает беременность, при продолжительности терапии до 40 недель — у 90%. Препарат вызывает регрессию аденомы гипофиза, уменьшение размеров аденомы через год после непрерывной терапии. А в некоторых случаях — до полного исчезновения. Контроль МРТ ежегодно.
Также применяется лучевая терапия — разрушение аденомы гипофиза ионизирующим излучением. Показана при наличии макроаденом гипофиза, при неэффективности медикаментозной терапии.
Хирургическое лечение
Удаление макроаденомы гипофиза (трансназально, трансфеноидально, транскраниально) показано при неэффективности медикаментозного лечения и нарушения функции зрения.
Эффективность лечения при макроаденомах — 50-60%. При микроаденомах -70 -90%.
Идиопатическая гиперпролактинемия: при отсутствии клинической симптоматики и умеренном повышении неактивных форм пролактина, без патологии ГМ (гипофиза) не требует лечения.
Лечение соматотропиноты — медикоментозно. Аналоги соматостатина (октреатид), а также применяется лучевая терапия.
Лечение кортикоторопиномы — нормализация уровня гормонов коры надпочечников. Также симптоматическое лечение для коррекции нарушений белкового и углеводного обмена. Лучевая терапия используется как дополнение к оперативному лечению.
Лечение тиреотропиномы — удаление опухоли.
Эффективность лечения микроаденом гипофиза при своевременной диагностике заболевания — высокая. Макроаденомы — имеют тенденцию к росту, требуется мониторирование эффективности проводимого лечения.
Гормональные исследования — Мечников
Гормоны — биологически активные вещества, синтезируемые организмом, управляют функциями организма, их регуляцией и координацией. Гормоны вырабатываются железами внутренней секреции (эндокринными железами): щитовидной и паращитовидной железами, вилочковой железой, надпочечниками, параганглиями, инкреторной частью поджелудочной железы, гипоталамо-гипофизарной системой (гипоталамусом и гипофизом), эпифизом и половыми железами. Поэтому заболевания, обусловленные гормональными нарушениями, являются одними из наиболее сложных.
Гормональные исследования включают в себя множество тестов и делятся на несколько групп, характеризующие поражение органов и систем организма. Основные из них представлены ниже.
Щитовидная железа:
- Тиреотропный гормон (ТТГ)
- Тироксин свободный (Т4 свободный)
- Трийодтиронин свободный (Т3 свободный)
- Антитела к тиреоидной пероксидазе (АТ-ТПО)
- ТГ (Тиреоглобулин)
Гипофизарно-гонадная система
- Фолликулостимулирующий гормон (ФСГ)
- Лютеинизирующий гормон (ЛГ)
- Пролактин
- Макропролактин
- Эстрадиол
- Прогестерон
- Тестостерон
- Глобулин, связывающий половые гормоны (ГСПГ)
- Индекс свободного тестостерона (расчетный метод)
- Свободный тестостерона (расчетный метод)
Маркер репродуктивной системы
- Антимюллеров гормон Гипофизарно-надпочечниковая система
- Адренокортикотропный гормон (АКТГ)
- Кортизол
Эндокринная функция поджелудочной железы
- С-Пептид
- Инсулин (ИРИ)
Фосфорно-кальциевый обмен, метаболизм костной ткани
- Паратиреоидный гормон (Паратгормон)
- 25-OH витамин D (витамин Д3)
- Остеокальцин
Пролактин (Prolaсtin)
Пролактин (Prolaсtin)
Пролактин – один из гормонов, выделяемых гипофизом. Пролактин необходим для нормального развития молочных желез, обеспечения лактации. Также он контролирует секрецию прогестерона и тормозит секрецию фолликулостимулирующего гормона, обеспечивая нормальный менструальный цикл. В крови мужчин и не беременных женщин он обычно присутствует в малых количествах. Уровень пролактина в крови обычно повышается во время беременности и в послеродовой период. У беременной женщины гормоны пролактина, эстрогена и прогестерона стимулируют выработку молока. Когда мать не кормит новорождённого грудью, пролактин в её крови падает обратно. Существует зависимость между тем, как часто ребенок сосёт грудь матери, и количеством пролактина и грудного молока, вырабатываемых её организмом. Другая причина повышения уровня пролактина – пролактинома – производящая пролактин опухоль гипофиза. Она встречается редко и, как правило, не бывает злокачественной. Наиболее часто такая опухоль развивается у женщин, но также бывает и у мужчин.
Подготовка к исследованию
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. За 24 часа исключить половое сношение и тепловые воздействия (сауну), за 1 час курение. Желательно исключить факторы, влияющие на результаты исследований: физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение.
Показания к исследованию
— При симптомах пролактиномы (головные боли, ухудшение зрения, галакторея).
— При бесплодии и нарушении половой функции у мужчин и женщин.
— При пониженном уровне тестостерона у мужчин.
— Если у пациента выявлена пролактинома (для наблюдения за развитием опухоли).
— При подозрении на общую недостаточность функции гипофиза (в сочетании с тестом на гормон роста).
— Когда пациент принимает медикаменты, влияющие на выработку допамина организмом (в целях наблюдения за изменениями уровня пролактина).
Интерпретация
Референсные значения : еденица измерения мМЕ/л.
| Общая норма | Норма |
| для женщин | 40-530 |
| для мужчин | 53-360 |
Пол, возраст Референсные значения
1 — 12 мес Женский 4,2 — 633,9 мкМЕ/мл
Мужской 6,4 — 612,7 мкМЕ/мл
1 — 4 лет Женский 21,2 — 362,5 мкМЕ/мл
Мужской 48,8 — 279,8 мкМЕ/мл
4 — 7 лет Женский 33,9 — 277,7 мкМЕ/мл
Мужской 16,9 — 358,3 мкМЕ/мл
7 — 10 лет Женский 6,4 — 273,5 мкМЕ/мл
Мужской 40,3 — 245,9 мкМЕ/мл
10 — 13 лет Женский 40,3 — 203,5 мкМЕ/мл
Мужской 19,1 — 273,5 мкМЕ/мл
13 — 16 лет Женский 63,6 — 305,3 мкМЕ/мл
Мужской 33,9 — 351,9 мкМЕ/мл
16 — 18 лет Женский 44,5 — 390,1 мкМЕ/мл
Мужской 57,2 — 322,2 мкМЕ/мл
> 18 лет Женский (не беременные) 102 — 496 мкМЕ/мл
Мужской 86 — 324 мкМЕ/мл
Концентрация пролактина увеличивается при:
беременности и после родов, в период грудного вскармливания, нервно-психической анорексии, употреблении эстрогенов, трициклических антидепрессантов, опиатов, амфетаминов, препаратов, понижающих кровяное давление (резерпина, верапамила, метилдофы), заболеваниях, связанных с патологией гипоталамуса, гипотиреозе, заболеваниях почек, других онкологических заболеваниях гипофиза.
Воздействие стресса, возникшего в результате травмы, болезни или даже страха перед анализом, может приводить к умеренному увеличению уровня пролактина.
На результаты могут влиять
В течение суток уровень пролактина в крови меняется, увеличиваясь во время сна и достигая пиковых значений в утренние часы. Брать венозную кровь лучше после пробуждения пациента или хотя бы после того, как он отдохнул в спокойной обстановке минут 30.
Назначается в комплексе с
— лютеинизирующий гормон (ЛГ)
— фолликулостимулирующий гормон (ФСГ)
— тестостерон
— глобулин, связывающий половые гормоны (ГСПГ)
Гормоны — Медицинский центр «Допомога+»
Анализ на гормоны является важной частью лабораторной диагностики. От количества гормонов в организме напрямую зависит как настроение человека, так и его состояние здоровья, и самочувствие каждый день. Лабораторное исследование данного вида дает врачу больше возможностей увидеть, что происходит в организме человека и что влияет на его болезнь. Соответственно, доктор сможет поставить точный диагноз и назначить соответствующую ему схему лечения.
Принято думать, что анализ на гормоны сдают исключительно женщины в рамках гинекологических и репродуктивных исследований или же ведения беременности. Но это не так: дисбаланс половых гормонов может наблюдаться и у мужчин, а в достаточно частых случаях анализ на гормоны актуален для обоих полов. Например, в случае исследования надпочечников, поджелудочной железы, щитовидной железы и прочих.
Чтобы сдать анализ на гормоны в Киеве, необходимо для начала обратиться за консультацией врача и получить направление. Дело в том, что анализ на гормоны – достаточно сложная процедура, ее не назначают без необходимости.
Анализы на разные гормоны предполагают и разного рода подготовку к ним: в некоторых случаях нужно ограничить физическую активность и придерживаться строгой диеты, в других – сдавать анализ в определенный день цикла (для женщин) или же в определенное время суток. Поэтому сначала проконсультируйтесь с профильным врачом – специалист расскажет, как подготовиться к тому анализу на гормоны, который он назначил именно вам. И строго и точно выполняйте все рекомендации, так как исследование может показать неточные результаты в том случае, если будут нарушены правила подготовки к анализу на гормоны.
Сдать анализ на гормоны в Киеве можно в медицинском центре «Допомога Плюс», выбирайте необходимую гормональную панель из присутствующих в клинике:
- панель гипоталамо-гипофизарно-надпочечниковых гормонов;
- панель диабета;
- репродуктивная панель;
- тиреоидная панель.
Специалисты центра «Допомога Плюс» помогут разобраться с конкретным видом анализа и всегда подскажут, какой должна быть подготовка к процедуре.
Если у вас возникли дополнительные вопросы, которые касаются подготовки к анализу на гормоны, вы всегда можете позвонить в медицинский центр «Допомога Плюс» по телефонам: (044) 221 59 37 или (067) 103 31 72, чтобы уточнить рекомендации доктора или записаться на анализ на гормоны в Киеве. Также для записи можно использовать форму обратной связи на сайте центра «Допомога Плюс».
Ознакомиться с ценами на каждый пункт каждой конкретной гормональной панели можно ниже.
Пролактин — обзор | ScienceDirect Topics
Действия пролактина в почках
Хотя существует четкое согласие, что рецепторы ПРЛ существуют в почках, в литературе мало единого мнения относительно потенциального действия пептида на почки. Это может быть результатом различных экспериментальных протоколов или использования препаратов гетерологичных пептидов. Отсутствие согласия также может быть результатом широко распространенного убеждения, что все эффекты ПРЛ в почках будут результатом пептида, доставляемого общим кровообращением.Это может быть не так, и уникальная изоформа ПРЛ может фактически быть эффективным агентом.
Horrobin et al. 17 вводил полуочищенный овечий ПРЛ внутримышечно пяти добровольцам-самцам. В дополнение к длительному недомоганию они наблюдали уменьшение объема мочи и экскреции натрия и калия с мочой, что сопровождалось повышением натрия в плазме и осмоляльности. Волонтеры также испытывали чувство жажды. В то время нельзя было гарантировать абсолютную чистоту пептидного препарата, и, таким образом, нельзя было исключить загрязнение другими гормонами передней доли, а также нейрогипофизарными пептидами, окситоцином и вазопрессином.Это исследование на людях было задумано как отражение работы Локетта и др. 20 , в котором антинатрийуретические, антидиуретические и антикалиуретические эффекты очищенных препаратов ПРЛ наблюдались у находящихся в сознании крыс в отсутствие очевидного воздействия на скорость клубочковой фильтрации. Таким образом, канальцевые эффекты для увеличения реабсорбции натрия были первыми предполагаемыми действиями ПРЛ.
Уменьшение объема мочи, наблюдаемое у добровольцев, заставило многих предположить, что ПРЛ является уникальным антидиуретическим средством.Об этом также свидетельствует наблюдение на крысах, что инфузии овечьего ПРЛ снижают диурез и натрийурез при внутривенном введении физиологического раствора. 22 Однако в том же году появилось сообщение, в котором предполагалось, что антидиуретический эффект ПРЛ является результатом захвата рецепторов вазопрессина (АВП) в почках. 14 Действительно, Клапп и его коллеги элегантно показали, что пролактин, вводимый в мозг, или системно способствует высвобождению АВП и окситоцина. 35
В отсутствие AVP (крысы Brattleboro или крысы Sprague Dawley, нагруженные жидкостью для уменьшения эндогенной секреции AVP) рекомбинантный мышиный ПРЛ оказывает антинатриетический и антидиуретический эффекты.Однако при наличии АВП действует мочегонное средство. Эти превосходные исследования показывают несколько важных недостатков более ранних работ: использование рекомбинантного материала, исключающего возможность контаминации другими реотропными факторами, использование видоспецифичного пептида и разделение потенциальных эффектов ПРЛ на действия АВП. Однако исследование 26 не изолирует проблему идентификации действия циркулирующего (гипофизарного происхождения) по сравнению с местно продуцируемым пептидом.
Он также не рассматривает возможность того, что пролактин почечного происхождения может оказывать действие в сегментах нефронов, отличных от тех, которые вводятся системно. Фактически, более недавние убедительные доказательства натрийуретического действия 12 в проксимальных извитых канальцах (ПКТ) опровергаются более ранней работой 6 , указывающей на антинатрийуретический эффект в костномозговой восходящей конечности (MAL) и дистальных извитых канальцах (DCT). В самом деле, хотя пролактин снижает активность Na +, K + -АТФазы при ПКТ, 19 , по-видимому, он увеличивает активность при MAL и DCT. 6
Физиологическая значимость участка действия ПКТ пролактина, продуцируемого в почках, начинает получать поддержку. Здесь пролактин не только снижает активность Na +, K + -АТФазы, он сигнализирует об активации протеинкиназы A, протеинкиназы C и фосфорилировании клеточных белков (включая Na +, K + -ATPase) и через гетерологичное рекрутирование дофамина, D-1. рецептор. 12 Дофамин, действующий через рецептор D-1, является мощным натрийуретическим агентом и взаимодействует между дофамином и другими натрийуретическими агентами (например,g., предсердный натрийуретический фактор) в результате гетерологичного рекрутирования рецептора D-1. Crambert et al. 12 развивают их аргументы еще на один шаг, показывая, что пролактин не изменяет активность Na +, K + -АТФазы у крыс SHR, линии, которая демонстрирует притупленный натрийуретический ответ на дофамин.
Гиперпролактинемия (нарушение пролактации) | ColumbiaDoctors
Что такое гиперпролактинемия?
Гиперпролактинемия — это наличие аномально высокого уровня пролактина в крови.Пролактин — это гормон, вырабатываемый гипофизом. Многочисленные функции пролактина в организме в основном связаны с беременностью и производством грудного молока новорожденным. Однако уровень пролактина может повышаться, когда женщина не беременна или не кормит грудью, вызывая ряд состояний, которые могут повлиять на нормальную менструальную функцию и фертильность.
Что вызывает гиперпролактинемию?
Аномальное повышение уровня пролактина может происходить, когда пролактин-продуцирующие клетки внутри гипофиза, называемые лактотрофами, производят больше гормона, чем требуется, или когда лактотрофы ненормально растут с образованием опухолей.Повышенный уровень пролактина также может возникать как побочный эффект некоторых психиатрических препаратов.
Как диагностируется гиперпролактинемия?
Простые анализы крови для измерения количества пролактина в крови могут подтвердить диагноз повышенного уровня пролактина. Уровень пролактина выше 25 нг / мл у небеременных женщин считается повышенным. Поскольку каждый человек испытывает ежедневные колебания уровня пролактина, может потребоваться повторить анализ крови, если уровень гормона повышен лишь незначительно.Многие женщины получают этот диагноз после обследования на бесплодие или нерегулярные периоды, но у других симптомы отсутствуют вообще. Иногда у пациентов появляются спонтанные молочные выделения из сосков, но у большинства этот симптом не проявляется. Умеренное повышение пролактина, от 25 до 50 нг / мл, обычно не вызывает заметных изменений менструального цикла, хотя может снизить общую фертильность. Более высокие уровни пролактина от 50 до 100 нг / мл могут вызвать нерегулярные менструальные периоды и значительно снизить фертильность женщины.Уровни пролактина более 100 нг / мл могут изменить нормальную функцию репродуктивной системы женщины, вызывая симптомы менопаузы (отсутствие менструации, приливы, сухость влагалища) и бесплодие.
Как лечится гиперпролактинемия?
Лекарства, имитирующие химический состав мозга дофамин, могут успешно использоваться для лечения большинства пациентов с повышенным уровнем пролактина. Эти лекарства ограничивают выработку пролактина гипофизом и вызывают регрессию пролактин-продуцирующих клеток.Два наиболее часто назначаемых лекарства — это каберголин (Достинекс®) и бромокриптин (Парлодел®). Начиная с небольшой дозы, которую постепенно увеличивают, можно свести к минимуму побочные эффекты, в том числе изменения артериального давления и умственную «затуманенность». Пациенты обычно хорошо реагируют на это лекарство, и уровень пролактина упадет через 2–3 недели. Как только уровень пролактина упадет, лекарство можно скорректировать для поддержания нормального уровня пролактина, а иногда можно полностью прекратить прием. Спонтанный регресс опухоли обычно происходит в течение нескольких лет без каких-либо клинических последствий.
У небольшого количества пациентов лекарства неэффективны для снижения уровня пролактина, и большие опухоли (макроаденомы) сохраняются. Эти пациенты являются кандидатами на хирургическое лечение (резекция трансфеноидальной аденомы) и / или лучевая терапия.
Программа лечения пролактиновых заболеваний в Emory Healthcare
Пролактин — гормон, секретируемый гипофизом, расположенным в головном мозге. Во время беременности стимулирует образование молока. У небеременных женщин он секретируется в небольших количествах.Избыточное производство пролактина, называемое гиперпролактинемией , у небеременных женщин может привести к выделениям из груди, нерегулярным или отсутствующим менструациям, нечастой или отсутствию овуляции, а иногда и к головным болям и визуальным симптомам. Женщины с гиперпролактинемией также могут иметь проблемы с зачатием.
Причины повышенного уровня пролактина включают опухоли гипофиза (аденомы) , гипотиреоз (недостаточная активность щитовидной железы) и лекарства, такие как транквилизаторы, некоторые лекарства от высокого кровяного давления, антидепрессанты, препараты от тошноты и оральные контрацептивы.
Рекреационные наркотики, такие как марихуана, также могут вызывать повышение уровня пролактина. Секреция пролактина может немного увеличиться после осмотра груди, физических упражнений, полового акта, стимуляции сосков, стресса, сна и некоторых продуктов.
Каждая третья женщина с избытком пролактина не имеет установленной причины, и примерно от 30 до 40 процентов случаев вызваны доброкачественной доброкачественной опухолью гипофиза.
Диагноз гиперпролактинемии ставится путем определения уровня пролактина в крови.Также может потребоваться проверка уровня других гормонов, например гормона щитовидной железы. МРТ или компьютерная томография полезны для определения наличия и размера опухоли.
Лечение зависит от причины, тяжести симптомов и наличия или отсутствия опухоли. Более крупные опухоли требуют хирургического удаления. Большинство пациентов можно лечить пероральными препаратами, подавляющими выработку пролактина. Прием лекарств можно прекратить, когда женщина забеременеет, хотя некоторым женщинам может потребоваться продолжить лечение во время беременности.
Позвоните по телефону 404-778-3401, чтобы записаться на прием к нашим эндокринологам-репродуктологам.
пролактин | Labcorp
Просмотр источников
Источники, использованные в текущем обзоре
Шененбергер, Д. (обновлено 16 марта 2018 г.). Гиперпролактинемия. Медицинская эндокринология. Доступно на сайте https://emedicine.medscape.com/article/121784-overview. Доступ 9.08.18.
Kattah, J. et. al. (Обновлено 11 июня 2018 г.). Опухоли гипофиза.Медицинская неврология. Доступно на сайте https://emedicine.medscape.com/article/1157189-overview. Доступ 9.08.18.
Коренблюм, Б. (обновлено 17 апреля 2018 г.). Заболевание гипофиза и беременность. Медицинская эндокринология. Доступно на сайте https://emedicine.medscape.com/article/127650-overview. Доступ 9.08.18.
(© 1995– 2018). Пролактин, сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/85670.Доступ 9.08.18.
Genzen, J. et. al. (Июнь 2018 г., обновлено). Аменорея. ARUP Consult. Доступно на сайте https://arupconsult.com/content/amenorrhea. Доступ 9.08.18.
Wisse, B. et. al. (7 августа 2016 г., обновлено). Анализ крови на пролактин. Медицинская энциклопедия MedlinePlus. Доступно на сайте https://medlineplus.gov/ency/article/003718.htm. Доступ 9.08.18.
Schlechte J. Проблема макропролактина. Журнал клинической эндокринологии и метаболизма , том 87, выпуск 12, 1 декабря 2002 г., страницы 5408–5409.Доступно на сайте https://doi.org/10.1210/jc.2002-021617. По состоянию на февраль 2019 г.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Merck. Функция передней доли гипофиза. Руководство Merck по диагностике и терапии [он-лайн информация].Доступно в Интернете по адресу http://www.merck.com/pubs/mmanual/section2/chapter6/6c.htm.
(обновлено 17 февраля 2002 г.). Пролактин. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003718.htm.
(24 июля 2002 г., обновлено). Пролактинома — самцы. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000337.htm.
Гипофиз: Обзор. The Hormone Foundation [Он-лайн информация].Доступно в Интернете по адресу http://www.hormone.org/learn/pituitary_1.html.
Гипофиз: секреторные опухоли. The Hormone Foundation [Он-лайн информация]. Доступно в Интернете по адресу http://www.hormone.org/learn/pituitary_2.html.
Пролактиновый тест. Hendrick Health System, Библиотека медицинской информации AccessMed [онлайн-информация]. Доступно в Интернете по адресу http://www.hendrickhealth.org/healthy/00062060.html.
ARUP. Пролактин. Руководство ARUP по клиническому лабораторному тестированию [он-лайн информация].Доступно в Интернете по адресу http://www.aruplab.com/guides/clt/tests/clt_150b.htm#1145504.
Merck. Общий. Руководство компании Merck по диагностике и терапии, раздел 2. Эндокринные и метаболические расстройства, глава 6. Гипоталамо-гипофизарные отношения [онлайн-информация]. Доступно в Интернете по адресу http://www.merck.com/pubs/mmanual/section2/chapter6/6a.htm.
Грюнебаум, А. (23 апреля 2001 г.). Большая роль крошечной железы в беременности. WebMD Health Information [онлайн-информация]. Доступно в Интернете по адресу http: // my.webmd.com/content/article/3607.442.
Справочник по импотенции (1998). Лабораторные исследования эректильной дисфункции. WebMD Health Information [онлайн-информация]. Доступно в Интернете по адресу http://my.webmd.com/content/article/1680.50141.
Шпенглер, Р. (22 февраля 2001 г., обновлено). Пролактин. WebMD Health Information [онлайн-информация]. доступно в Интернете по адресу http://my.webmd.com/printing/article/4118.253.
Принципы внутренней медицины Харрисона, Каспер и др., 16-е издание, МакГроу Хилл, 2005 г., стр. 2084.
Экман, А. (Обновлено 14 октября 2009 г.). Пролактин. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003718.htm. По состоянию на апрель 2010 г.
Eckman, A. (Обновлено 23 ноября 2009 г.). Пролактинома. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000336.htm. По состоянию на апрель 2010 г.
(май 2009 г.). Пролактинома. Национальная информационная служба по эндокринным и метаболическим заболеваниям [он-лайн информация].Доступно в Интернете по адресу http://www.endocrine.niddk.nih.gov/pubs/prolact/prolact.htm. По состоянию на апрель 2010 г.
Шененбергер Д. (Обновлено 12 марта 2010 г.). Гиперпролактинемия. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/121784-overview. По состоянию на апрель 2010 г.
Персонал клиники Мэйо (6 марта 2010 г.). Пролактинома. MayoClinic.com [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayoclinic.com/health/prolactinoma/DS00532. По состоянию на апрель 2010 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. Стр. 767-768.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. С. 354-355.
Ву, А. (© 2006). Клиническое руководство Tietz по лабораторным испытаниям, 4-е издание: Saunders Elsevier, Сент-Луис, Миссури. ПП 900-901.
Фэхи-Уилсон, М. (2003). При гиперпролактинемии необходимо тестирование на макропролактин, Clinical Chemistry .2003; 49: 1434-1436. Доступно в Интернете по адресу http://www.clinchem.org/cgi/content/full/49/9/1434. По состоянию на июнь 2010 г.
(май 2007 г.) Фахи-Уилсон М. Макропролактин. Новости клинической лаборатории Том 33, номер 5. Доступно в Интернете по адресу http://www.aacc.org/publications/cln/2007/may/Pages/series_0507.aspx. По состоянию на июнь 2010 г.
Сулиман А.М., Смит Т.П., Гибни Дж., Маккенна Т. Джозеф. Частая неправильная диагностика и неправильное ведение пациентов с гиперпролактинемией до введения скрининга макропролактина: применение нового строгого лабораторного определения макропролактинемии. Clin Chem 2003; 49: 1504-1509.
Гремида А. и Лин Дж. (Обновлено 22 марта 2013 г.). Пролактин. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2089400-overview#showall. По состоянию на октябрь 2013 г.
Benson, C. (Обновлено 6 марта 2013 г.). Дефицит пролактина. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/124526-overview#showall. По состоянию на октябрь 2013 г.
Шененбергер, Д.(Обновлено 21 марта 2013 г.). Гиперпролактинемия. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/121784-overview. По состоянию на октябрь 2013 г.
Meikle, A. W. и Miller, C. (обновлено в июле 2013 г.). Аменорея. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу http://www.arupconsult.com/Topics/Amenorrhea.html?client_ID=LTD#tabs=0. По состоянию на октябрь 2013 г.
Белак К. и Попат В. (Обновлено 5 июня 2012 г.). Аменорея. Справочник по Medscape [Он-лайн информация].Доступно в Интернете по адресу http://emedicine.medscape.com/article/252928-overview. По состоянию на октябрь 2013 г.
Liou, L. (Обновлено 17 сентября 2012 г.). Пролактин. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003718.htm. По состоянию на октябрь 2013 г.
(© 1995–2013). Пролактин. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8690.По состоянию на октябрь 2013 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник по диагностическим и лабораторным испытаниям Мосби, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 790-792.
Определение роли пролактина как гормона-супрессора инвазии в раковых клетках молочной железы
Реферат
Гормон пролактина (ПРЛ) хорошо охарактеризован как фактор терминальной дифференцировки эпителиальных клеток молочной железы и как аутокринный фактор роста / выживания в клетках рака груди.Однако эта функция ПРЛ может не полностью отражать его роль в онкогенезе молочной железы. Рак — это сложное многоступенчатое прогрессирующее заболевание, возникающее не только из-за дефектов роста клеток, но и из-за их дифференцировки. Действительно, дедифференцировка опухолевых клеток теперь признана решающим событием в инвазии и метастазировании. PRL играет критическую роль в индукции / поддержании дифференцировки эпителиальных клеток молочной железы, предполагая, что передача сигналов PRL может служить для ингибирования прогрессирования опухоли. Мы показываем здесь, что в клетках рака молочной железы PRL и Janus-активированная киназа 2, основная киназа, участвующая в передаче сигналов PRL, играет критическую роль в регуляции эпителиально-мезенхимальной трансформации (EMT), важного процесса, связанного с метастазированием опухоли.Активация рецептора PRL (PRLR), достигаемая путем восстановления передачи сигналов PRL / JAK2 в мезенхимальных клетках рака молочной железы, MDA-MB-231, подавляла их мезенхимальные свойства и уменьшала их инвазивное поведение. Блокируя аутокринную функцию ПРЛ в эпителиоподобных клетках рака молочной железы, T47D с использованием фармакологических и генетических подходов индуцировал мезенхимальные фенотипические изменения и усиливал их склонность к инвазии. Более того, наши результаты показывают, что блокирование передачи сигналов PRL привело к активации митоген-активируемой протеинкиназы (регулируемая внеклеточными сигналами киназа 1/2) и пути передачи сигналов трансформирующего фактора роста-β / Smad, двух основных путей прометастазирования.Кроме того, наши результаты показывают, что после ингибирования PRL / JAK2 активация ERK1 / 2 предшествует и требуется для активации Smad2 и индукции EMT в клетках рака молочной железы. Вместе эти результаты выдвигают на первый план ПРЛ как критический регулятор пластичности эпителия и указывают на ПРЛ как гормон-супрессор инвазии при раке молочной железы. (Cancer Res 2006; 66 (3): 1824-32)
- пролактин
- рецептор пролактина
- Янус-киназа-2
- митоген-активированная протеинкиназа
- трансформирующий фактор роста бета
- белок Smad
Введение
Пролактин был описан как наиболее универсальный гормон передней доли гипофиза, проявляющий биологическую активность, связанную с воспроизводством, поведением и иммуномодуляцией ( 1).Гормон пролактина (ПРЛ) наиболее известен своим влиянием на развитие молочной железы. Он необходим для лобулоальвеолярного формирования протоков молочных желез во время беременности, терминальной дифференцировки эпителиальных клеток молочных желез и для синтеза компонентов молока во время лактации ( 2). Связывание PRL со своим рецептором, рецептором PRL (PRLR), членом семейства цитокиновых рецепторов класса I, индуцирует димеризацию рецептора и активацию цитоплазматических тирозинкиназ ( 3). Мыши с нокаутом PRL, его рецептора и компонентов Janus-активированной киназы-2 (JAK2) / сигнального преобразователя и активатора транскрипции-5a (STAT5a), основного сигнального каскада ниже PRLR, подтвердили критическую роль ПРЛ в альвеолярном росте / дифференцировке молочной железы, поскольку эти мыши демонстрируют ограниченный альвеолярный рост и неспособны к лактации ( 4– 7).В то время как ПРЛ является мощным фактором дифференцировки эпителия молочной железы, в настоящее время признано, что при карциномах молочной железы аутокринный / паракринный ПРЛ способствует жизнеспособности опухолевых клеток ( 8– 10). И гормон, и его рецептор экспрессируются в опухолях молочной железы и клеточных линиях рака молочной железы, тем самым создавая аутокринные / паракринные механизмы действия ПРЛ ( 11– 13). Вмешательство в аутокринную / паракринную петлю ПРЛ в клетках рака молочной железы с использованием ПРЛ ( 14– 16) и антагонисты PRLR ( 17) привело к ингибированию роста клеток и индукции апоптоза.Кроме того, в модельных системах трансгенных мышей аутокринный ПРЛ приводил к образованию опухоли молочной железы ( 18). Кроме того, было показано, что ПРЛ играет разрешающую роль в опухолях молочной железы, индуцированных онкогенами ( 19). Вместе эти результаты указывают на проонкогенный эффект ПРЛ при раке груди. Однако эта функция ПРЛ не может полностью объяснить его роль в канцерогенезе молочной железы, особенно в процессах, связанных с прогрессированием опухоли, приводящим к метастазированию.
Рак в настоящее время признан многоступенчатым заболеванием, возникающим в результате нарушений в процессах, связанных с ростом и дифференцировкой клеток ( 20).Действительно, эпителиальная пластичность, фундаментальное свойство эпителиальных клеток, первоначально описанное во время эмбриогенеза, также способствует метастазированию многих эпителиальных опухолей, включая рак молочной железы ( 21, 22). Во время прогрессирования эпителиальных опухолей клетки подвергаются сложному процессу дедифференцировки, обозначенному как эпителиально-мезенхимальная трансформация (EMT), что приводит к потере эпителиальной полярности и приобретению мезенхимального фенотипа, что в конечном итоге приводит к увеличению миграционного / инвазионного потенциала опухолевых клеток.Отличительной чертой EMT является подавление белков адгезионных соединений, таких как E-кадгерин, и усиление различных мезенхимальных белков, таких как виментин, что приводит к появлению фибробластоидно-инвазивного фенотипа. Сигнальные пути, регулирующие подвижно-инвазивный фенотип эпителиальных опухолей, полностью не охарактеризованы. Однако недавние исследования явно указали на сильную активацию Ras / митоген-активируемой протеинкиназы [MAPK; регулируемый внеклеточным сигналом путь киназы 1/2 (ERK1 / 2)] и путь трансформирующего фактора роста-β (TGF-β) / Smad в индукции EMT in vitro и метастазов in vivo ( 23– 26).
Здесь мы показываем, что ПРЛ, посредством активации его нижестоящей киназы JAK2, играет критическую роль в регуляции морфогенной программы клеток рака молочной железы, приводя к подавлению их способности к инвазии. Более того, мы показываем, что PRL регулирует эти переменные эпителиальной пластичности путем негативной регуляции прометастатических путей, путей MAPK (ERK1 / 2) и Smad. Наши результаты указывают на двойную активность ПРЛ в канцерогенезе молочной железы в качестве проонкогенного фактора и фактора, подавляющего прогрессирование опухоли.
Материалы и методы
Плазмидные конструкции, антитела и реагенты. Плазмида экспрессии , кодирующая длинную форму PRLR NH 2 крысы с -концевой меткой FLAG, была подарком доктора Доминика Девоста (Университет Макгилла, Монреаль, Канада). Экспрессионная плазмида, кодирующая киназно-неактивную форму JAK2, была получена от доктора Дуэйна Барбера (Онкологический институт Онтарио, Торонто, Канада). Конструкция репортера 3TP-Luc была подарком д-ра Джоан Массаг (Мемориальный онкологический центр Слоуна-Кеттеринга, Нью-Йорк).Поликлональные антитела (pAb) против фосфо- (ERK1 / 2) -T202 / Y204 и ERK1 / 2 (New England Biolabs, Пикеринг, Онтарио, Канада), фактора транскрипции IID (TBP; SI-1; Santa Cruz Biotechnology, Санта-Крус, США). CA), PRL и JAK2 (Upstate Biotechnology, Charlottesville, VA), phospho-Smad2 (любезно предоставленный доктором Арисом Мустакасом, Институт исследования рака Людвига, Швеция). Моноклональные антитела (mAb) против фосфо-STAT5Y-694 (Intermedico, Маркхэм, Онтарио, Канада), виментина, E-кадгерина, STAT5 (BD Transduction Laboratories, Онтарио, Канада), FLAG-M2 и β-тубулина (Sigma-Aldrich , Онтарио, Канада).Козья антимышиная пероксидаза (HRP) и козья антимышиная пероксидаза HRP были от Santa Cruz Biotechnology. Козий антимышиный Rhodamine Red X был от Jackson ImmunoResearch Laboratories (West Grove, PA). Овечий пролактин (oPRL) был от Sigma-Aldrich. Человеческий пролактин (hPRL) был подарком д-ра Винсента Гоффена [Национальный институт Санте и де ла Recherche Medicale (INSERM), отделение 344, Париж, Франция]. Человеческий TGF-β1 был получен от PeproTech, Inc. (Rocky Hill, NJ). Фосфоротиоатные олигодезоксинуклеотиды были из Alpha DNA (Квебек, Канада).PD98059 был от Cell Signaling Technology, а AG490 от Calbiochem (Калифорния). Диски с фильтрами Transwell (8 мкм) для анализа миграции Corning были от Fisher Scientific (Nepean, Онтарио, Канада). Реагент LipofectAMINE 2000 и краситель Hoechst 33258 были от Invitrogen (Онтарио, Канада). Гиперпленка с усиленной хемилюминесценцией и гранулы протеин А-сефарозы были от Amersham Biosciences / GE Healthcare (Квебек, Канада).
Клеточные культуры и трансфекции. Клеточные линии рака груди человека, MDA MB-231, T47D и MCF7 и клетки яичника китайского хомячка (CHO) выращивали в среде DMEM, содержащей 10% фетальной бычьей сыворотки (FBS), и разводили в среде DMEM, не содержащей фенолового красного.Фазово-контрастные изображения получали с помощью микроскопа Zeiss Axiovision 135 (Carl Zeiss Canada, Ltd., Торонто, Онтарио, Канада) с объективом × 10. Клетки MDA-MB-231, T47D и CHO трансфицировали с помощью LipofectAMINE 2000, следуя инструкциям производителя. Клетки T47D также трансфицировали электропорацией.
Лечение антисмысловыми олигодезоксинуклеотидами. Использовали антисмысловые фосфоротиоированные олигодезоксинуклеотиды (ASO) к мРНК hPRL 5′-TGGCGATCCTTTGATGTTCAT-3 ‘и контрольные фосфоротиоатные олигодезоксинуклеотиды 5′-GATGAATTACGTAACTGGCCCGCCC-3’.Клетки T47D обрабатывали 200 мкмоль / л ASO для hPRL или контрольных олигодезоксинуклеотидов в среде голодания.
Лизис клеток, иммунопреципитация и вестерн-блоттинг. Для лизатов цельных клеток и иммунопреципитации клетки лизировали в буфере для лизиса для анализа радиоиммунопреципитации, как описано ранее ( 27). Для экстрактов ядер клетки лизировали в гипотоническом буфере, а осадки ядер лизировали буфером с высоким содержанием соли, как описано ранее ( 27). Иммунопреципитацию проводили в течение 3 часов при 4 ° C с использованием pAb к JAK2 и гранул протеина A-сефарозы.Белки обрабатывали с помощью SDS-PAGE и переносили на нитроцеллюлозную мембрану для вестерн-блоттинга с использованием соответствующих антител.
Эксперименты по иммуноокрашиванию. Клетки помещали на покровные стекла, предварительно покрытые поли-1-лизином, в 24-луночный планшет. После различных обработок клетки фиксировали в 2% PFA / PBS, блокировали в 5% бычьем сывороточном альбумине (BSA) / PBS и инкубировали с различными антителами в 5% BSA / PBS. В качестве вторичных антител использовали козий антимышиный Rhodamine Red X.Для окрашивания ядра использовали краситель Hoechst. Покровные стекла наблюдали под конфокальным микроскопом (лазерный сканирующий микроскоп Zeiss LSM-510 META, Carl Zeiss, Йена, Германия) с использованием масляной иммерсионной линзы × 60. Фотографии анализировали с помощью программного обеспечения LSM.
Анализ инвазии. Для анализа инвазии камеры Бойдена клетки высевали в планшеты с 24 лунками, покрытые матригелем (100 мкг / см 2 ; VWR, Монреаль, Квебек, Канада). После 24 часов обработки (как описано для различных экспериментов) мигрировавшие клетки подсчитывали с использованием пяти полей в трех повторностях для каждой экспериментальной точки с использованием микроскопа Zeiss Axiovision 135 (Carl Ziess Canada, Ltd., Торонто, Онтарио, Канада) с объективом × 10 и программой Northern Eclipse версии 6.0 (Empix Imaging, Миссиссауга, Онтарио, Канада).
Люциферазный анализ. Активность люциферазы измеряли, как описано ранее (см. 28; EG&G Berthold Microplate Luminometer LB96V) в относительных световых единицах.
Желатиновая зимография. Активность желатиназы определяли, как описано ранее ( 29). Вкратце, клетки MDA MB-231 трансфицировали LipofectAMINE 2000 в течение 5 часов при соотношении ДНК / реагент 1: 3 в бессывороточной среде.Клетки выделяли в 5% FBS DMEM в течение периода O / N. На следующий день клетки стимулировали 2 мкг / мл oPRL в 2% FBS DMEM в течение периода O / N. Кондиционированную среду (500 мкл) собирали и смешивали с невосстанавливающим 2-кратным загрузочным буфером. 8% гель SDS-PAGE готовили, как обычно, с конечной концентрацией желатина 1 мг / мл. Образцы обрабатывались с использованием обычного рабочего буфера. Гель ренатурировали в буфере для ренатурации зимограммы в течение 1 часа при комнатной температуре и проявляли в буфере для анализа зимограммы O / N при комнатной температуре.На следующий день гель окрашивали 0,5% масс. / Об. Кумасси синим R-250 в течение 1 часа при комнатной температуре. Гель обесцвечивали до появления белых полос на темно-синем фоне.
Результаты и обсуждение
На основе экспрессии рецептора эстрогена, клеточного фенотипа (т. Е. Эпителиальный, в отличие от экспрессии мезенхимальных маркеров) и инвазионной способности линии клеток рака молочной железы можно разделить на эпителиоподобные клетки с низкой инвазионной способностью, такие как T47D и MCF-7, или мезенхимоподобные клетки, обладающие высокой способностью к инвазии, такие как MDA-MB-231 ( 30).Благодаря хорошо известным эффектам ПРЛ на индукцию и поддержание дифференцированного эпителиального фенотипа в клетках молочной железы, мы исследовали, может ли ПРЛ играть роль в регуляции эпителиального фенотипа и, следовательно, способности клеток рака молочной железы к инвазии. Недавно было показано, что в клетках MDA-MB-231 отсутствует экспрессия PRLR из-за гиперметилирования промотора гена ( 31). Используя эту клеточную систему, мы рассмотрели, изменит ли восстановление передачи сигналов PRLR мезенхимальный инвазивный фенотип этих клеток.Мы восстановили передачу сигналов PRLR путем временной совместной сверхэкспрессии PRLR и JAK2, поскольку не только эти клетки не могут экспрессировать PRLR, но и уровень экспрессии JAK2 слабее по сравнению с эпителиально-подобными клетками рака молочной железы T47D и MCF-7 (данные не показаны). . Как показано в Рис.1 A , в то время как клетки MDA-MB-231 не реагировали на PRL, явное лиганд-зависимое увеличение фосфорилирования JAK2 наблюдалось в клетках, сверхэкспрессирующих PRLR и JAK2, как было обнаружено вестерн-блоттингом с использованием специфических антител к фосфо-JAK2 (Y1007 / 1008 ) обнаруживая активацию JAK2.Кроме того, чтобы исследовать уровень фосфорилирования PRLR после восстановления экспрессии PRLR / JAK2 в этих клетках, PRLR подвергали иммунопреципитации и иммунокомплексы подвергали блоттингу с помощью mAb к фосфотирозину. Как и ожидалось, в клетках MDA / PRLR / JAK2 были обнаружены два фосфорилированных белка, соответствующие PRLR и JAK2, по сравнению с клетками MDA / pcDNA3 ( Рис.1 B ). В совокупности эти результаты показывают, что избыточной экспрессии PRLR и JAK2 в клетках MDA-MB-231 достаточно для восстановления активации PRLR / JAK2.
Рисунок 1.Восстановление передачи сигналов PRLR / JAK2 подавляет мезенхимальный фенотип и потенциал инвазии клеток MDA-MB-231. A, клетки MDA-MB-231 временно котрансфицировали плазмидами, кодирующими длинную форму PRLR с меткой FLAG (10 мкг) и JAK2 (10 мкг) или одним вектором (20 мкг). Затем клетки инкубировали в DMEM (2% FBS) в течение периода O / N и стимулировали или не стимулировали oPRL (2 мкг / мл) в течение 10 минут. Клеточные лизаты подвергали иммунодетекции с использованием pAb к фосфо-JAK2.Мембрану перепробировали с помощью pAb на JAK2, а затем с помощью mAb к β-тубулину. B, трансфекций и клеточных обработок, аналогичных ( A ). Лизаты клеток подвергали иммунопреципитации с использованием mAb к эпитопу FLAG и проводили иммуноблоттинг с mAb к фосфотирозину. Мембрану перепробировали с помощью pAb на JAK2 ( средний ), а затем с помощью mAb к эпитопу FLAG ( снизу ). C, трансфекций аналогично ( A ). Клетки стимулировали или нет oPRL (2 мкг / мл) в DMEM (2% FBS) в течение 24 часов.Иммунодетекцию проводили на лизатах клеток с использованием mAb к виментину. Мембрану повторно зондировали mAb к β-тубулину ( нижний ). D, трансфекций аналогично ( A ). На следующий день клетки стимулировали oPRL (2 мкг / мл) в DMEM (2% FBS) в течение 24 часов. Для зимографии обрабатывали равные объемы кондиционированной среды. Клетки E, MDA-MB-231 котрансфицировали, как в ( A ), и инкубировали в питательной среде в течение 24 часов. На следующий день клетки обрабатывали трипсином и равное количество клеток высевали на 24 часа в присутствии oPRL (2 мкг / мл) для анализа инвазии.Столбцы , среднее значение трех разных экспериментов. Микроскопические изображения репрезентативного поля пораженных клеток ( слева, ).
Чтобы затем исследовать, изменит ли восстановление активации PRLR / JAK2 мезенхимальный фенотип клеток MDA-MB-231 агрессивного рака молочной железы, мы исследовали эффекты восстановления передачи сигналов PRLR / JAK2 на уровень экспрессии мезенхимального маркера виментина. Клетки MDA-MB-231, сверхэкспрессирующие PRLR / JAK2 или нет, инкубировали в 2% сыворотке и стимулировали или не стимулировали PRL в течение 24 часов.Затем клеточные лизаты подвергали Вестерн-блоттингу с использованием mAb к виментину. Как показано в Фиг. 1 C , уровни экспрессии виментина были значительно снижены в клетках, сверхэкспрессирующих PRLR и JAK2, и этот эффект был дополнительно отмечен при стимуляции клеток PRL. Другой отличительный признак инвазивных клеток рака молочной железы отражается в увеличении экспрессии и активности матриксных металлопротеиназ (ММП), которые способствуют их инвазионному потенциалу ( 32). Поэтому затем мы исследовали, будет ли восстановление экспрессии PRLR / JAK2 в клетках MDA-MB-231 модулировать их активность ММП, используя анализ желатиназы ( 33).Как видно на Фиг.1 D , клетки MDA-MB-231 дикого типа (трансфицированные только вектором) проявляли основную активность желатиназы при 72 кДа. Однако в клетках, сверхэкспрессирующих PRLR / JAK2, наблюдалось заметное снижение этой активности. Затем мы определили, связаны ли эти фенотипические изменения, вызванные PRLR, с изменениями инвазионной способности клеток MDA-MB-231, с помощью анализов инвазии Matrigel. Как показано в Рис. 1 E , окрашивание клеток кристаллическим фиолетовым выявило, что восстановление PRLR / JAK2 в этих клетках резко изменяет их способность к инвазии.После подсчета клеток, которые мигрировали через матригель, наши результаты показали, что на самом деле восстановление передачи сигналов PRLR / JAK2 снижает на 50% инвазионную способность клеток MDA-MB-231 ( Рис.1 E, справа ). В целом, эти результаты показывают, что восстановление передачи сигналов PRL сильно подавляет мезенхимальный / инвазивный фенотип агрессивных клеток рака молочной железы, выделяя путь PRLR / JAK2 как негативный регулятор процесса EMT и клеточной инвазии.
В отличие от MDA-MB-231, клетки рака молочной железы человека T47D все еще сохраняют эпителиоподобные свойства и считаются имеющими слабый инвазивный фенотип ( 30).Кроме того, известно, что эти клетки экспрессируют как ПРЛ, так и его рецептор, тем самым создавая аутокринную / паракринную петлю роста и выживания для ПРЛ ( 8). Используя эту клеточную систему, мы исследовали, может ли блокирование петли ПРЛ приводить к фенотипическим изменениям, типичным для процесса EMT, и увеличивать инвазивную способность этих клеток. Для блокирования киназы JAK2 мы использовали фармакологический ингибитор AG490 ( 34). Как показано в Рис.2 A , обработка клеток T47D с помощью AG490 в течение 24 часов в концентрации (50 мкмоль / л), достаточной для значительного ингибирования PRL-индуцированного фосфорилирования STAT5 ( Инжир.2 A, нижний ), приводили к изменениям в морфологии клеток, от роста эпителия / куба в виде плотных колоний до мезенхимального / фибробластного фенотипа, растущего в виде диспергированных колоний. Кроме того, было обнаружено, что это связано с потерей мембранного E-кадгерина ( Фиг.2 B ) и повышенная экспрессия мезенхимального маркера виментина ( Рис.2 C ), что также свидетельствует о ЕМТ. Анализы инвазии с использованием покрытых матригелем планшетов с транслуночками доказали, что эти фенотипические изменения сопровождались повышенной инвазивной способностью клеток T47D при обработке ингибитором JAK2 по сравнению с контрольными клетками (190% от контроля; Инжир.2 D ). Таким образом, наши данные показывают, что блокирование активности киназы JAK2 приводит к эпителиально-мезенхимальным фенотипическим изменениям и увеличению инвазивной способности клеток T47D.
Рисунок 2.Блокирование PRLR / JAK2 приводит к EMT в клетках T47D. A, вверху, фазово-контрастные микроскопические изображения клеток T47D, обработанных ДМСО или AG490 (50 мкмоль / л) в течение 24 часов. Внизу , клетки T47D обрабатывали ДМСО или AG490 (50 мкмоль / л) в среде голодания в течение 24 часов перед стимуляцией hPRL (100 нг) в течение 10 минут.Затем клетки лизировали, и общие клеточные лизаты анализировали с использованием mAb к фосфо-STAT5 Y694. Мембрану повторно зондировали mAb к STAT5. B, вверху, иммуноокрашивание с использованием mAb к E-кадгерину ( красный ). Внизу, иммуноокрашивание mAb к виментину ( красный ) клеток T47D, обработанных либо AG490 (50 мкмоль / л), либо ДМСО в течение 24 часов. C, равное количество клеток T47D высевали на 24-луночные планшеты, покрытые матригелем, и обрабатывали AG490 (50 мкмоль / л) или ДМСО в течение 24 часов и определяли количество пораженных клеток.Столбцы , среднее значение трех отдельных экспериментов. Микроскопические изображения поля пораженных клеток ( слева, ). Клетки D, T47D временно трансфицировали пустым вектором или экспрессионной плазмидой, кодирующей JAK2KI. Клеточные лизаты подвергали иммуноблоттингу с использованием mAb к E-кадгерину. Мембрану повторно зондировали mAb к β-тубулину ( средний ). Лизаты от той же трансфекции подвергали иммунопреципитации с использованием pAb к JAK2 и иммунодетектировали тем же антителом (, нижний ).Клетки E, T47D обрабатывали ASO для hPRL или контрольным олигодезоксинуклеотидом в указанные моменты времени. Клеточные лизаты подвергали иммунодетекции с использованием mAb к E-кадгерину ( верхний ) или pAb к PRL ( средний ). Равную нагрузку контролировали с помощью pAb к ERK1 / 2 ( нижний ).
Чтобы еще раз подтвердить, что блокирование JAK2 приводит к EMT, мы сверхэкспрессировали неактивную киназой форму JAK2 (JAK2KI), в которой предсказанный мотив фосфотрансферазы типа VIII в COOH-концевом киназном домене Jh2 JAK2 был мутирован ( 35).Как видно на Фиг. 2 D , экспрессия эпителиального маркера E-кадгерина была заметно снижена в клетках T47D, сверхэкспрессирующих JAK2KI, по сравнению с контрольными клетками. Аналогичные результаты были получены на другой линии клеток неагрессивного рака молочной железы человека MCF7 при сверхэкспрессии киназно-неактивной формы JAK2 (данные не показаны). Вместе эти результаты показывают, что блокирование активности киназы JAK2 в клетках рака молочной железы приводит к индукции процесса EMT и клеточной инвазии. Хотя JAK2 является ключевой киназой в передаче сигналов PRL в клетках молочной железы, она также может активироваться факторами роста, отличными от PRL ( 36).Таким образом, мы затем определили, может ли сам гормон ПРЛ регулировать EMT аналогично JAK2. Как показано в Рис. 2 E , подавление аутокринных уровней ПРЛ в этих клетках явно привело к значительной потере экспрессии E-кадгерина, что еще больше усилило наши предыдущие результаты и подтвердило роль самого ПРЛ в этом процессе. Хотя функциональность автокринной петли РРЛ была установлена ранее ( 8– 10), предполагает, что пути передачи сигналов PRL, такие как JAK2 и STAT5a, являются конститутивно активными; однако в наших экспериментальных условиях, предусматривающих сывороточное голодание в сочетании с возможным ограничением в обнаружении, мы не наблюдаем конститутивной активации этого пути, измеряемой по фосфорилированию STAT5a, и действительно, фосфорилирование STAT5a происходит при экзогенной стимуляции ПРЛ, как показано в Инжир.2 А . В целом, эти результаты показывают, что ингибирование аутокринной петли PRL в эпителиоподобных клетках рака молочной железы приводит к EMT и увеличивает их инвазионный потенциал.
Путь MAPK (ERK1 / 2) является ключевым путем, участвующим в эпителиальной пластичности (EMT), что приводит к прогрессированию / метастазированию рака молочной железы ( 21, 37, 38). Поскольку наши результаты показали, что блокирование киназы JAK2 также приводит к EMT и клеточной инвазии, мы затем исследовали, могут ли эти эффекты быть опосредованы активацией пути MAPK (ERK1 / 2).Интересно, что блокирование киназы JAK2 с помощью AG490 в клетках T47D ( Рис.3 A, верх ) или в ячейках MCF-7 ( Рис.3 A, внизу ) привело к заметному увеличению базальной активации MAPK ( 3 A , сравните образцы, обработанные ДМСО, с образцами, обработанными AG490). Кроме того, наши результаты показывают, что в то время как ПРЛ способен стимулировать активацию MAPK (ERK1 / 2), как было описано ранее ( 39, 40), однако активация MAPK, вызванная ПРЛ, значительно усиливалась после ингибирования JAK2 ( Инжир.3 А ). Более того, как показано на Фиг. 3 B , в отличие от PRL, обработка AG490 клеток T47D приводила к активации ERK1 / 2, аналогичной тому, что наблюдалось в клетках, обработанных эпидермальным фактором роста, известным митогеном для клеток рака молочной железы. Кроме того, активация ERK1 / 2 также наблюдалась через 5-10 минут обработки клеток T47D с помощью AG490 ( Рис.3 C ). Вместе эти результаты показывают, что в клетках рака молочной железы человека JAK2 оказывает отрицательный регуляторный эффект на путь MAPK и что JAK2 может ограничивать PRL-зависимую активацию каскада MAPK (ERK1 / 2).
Рисунок 3.Блокирование аутокринной петли ПРЛ индуцирует активацию ERK1 / 2 в клетках рака молочной железы. Клетки A, T47D ( вверху, ) или MCF7 ( внизу, ) обрабатывали ДМСО или AG490 (50 мкмоль / л) в течение 24 часов перед стимуляцией hPRL (100 нг / мл) в указанные моменты времени. Клетки B, T47D обрабатывали ДМСО, hPRL (100 нг / мл), AG490 (50 мкмоль / л), AG490 (50 мкмоль / л) и hPRL (100 нг / мл) или эпидермальным фактором роста ( EGF ; 10 нг / мл) в течение 24 часов.Клетки C, T47D обрабатывали AG490 (50 мкмоль / л) в указанные моменты времени. Клетки D, T47D или MCF-7 временно трансфицировали пустым вектором или экспрессионной плазмидой, кодирующей JAK2KI. Клетки E, T47D обрабатывали ASO для hPRL или контрольного олигодезоксинуклеотида в течение 48 и 72 часов. A-E, лизаты клеток были подвергнуты иммунодетекции с использованием фосфоспецифических pAb к ERK1 / 2 ( вверху ). Мембраны повторно зондировали pAb на ERK1 / 2 ( нижний ). E, Иммуноблот PRL проводили с использованием pAb на PRL ( средний ).
Затем мы подтвердили эти ингибирующие эффекты JAK2 на активацию MAPK с использованием киназодефицитной формы JAK2 (JAK2KI). Сверхэкспрессия JAK2KI в клетках T47D или в клетках MCF-7 приводила к значительному увеличению базальной активации / фосфорилирования пути ERK1 / 2 ( Рис.3 B ). Эти результаты показывают, что блокирование киназы JAK2 в клетках рака груди приводит к активации пути MAPK.Чтобы конкретно рассмотреть роль ПРЛ в этом процессе, мы затем заблокировали аутокринную / паракринную функцию ПРЛ в клетках T47D, используя ген ASO to hPRL . Как видно на Фиг. 3 C , блокирование экспрессии ПРЛ в клетках T47D привело к заметному увеличению пути MAPK (ERK1 / 2) после 48 и 72 часов обработки по сравнению с контрольными клетками, инкубированными со скремблированными олигодезоксинуклеотидами. Вместе эти результаты показывают, что блокирование экспрессии PRL или передачи сигналов PRLR путем ингибирования активности киназы JAK2 приводит к устойчивой и длительной активации пути MAPK (ERK1 / 2) в клетках рака молочной железы, предполагая, что путь PRL / JAK2 служит для передачи негативных регуляторных сигналов. к MAPK и, как следствие, клеточной инвазии.
Другой критический путь передачи сигналов (TGF-β / Smad) также недавно было показано, вносит вклад в EMT и метастазирование опухолей молочной железы (как описано во Введении). Было обнаружено, что в различных эпителиальных клетках, включая клетки молочной железы, взаимодействие между путями Ras-MAPK (ERK1 / 2) и TGF-β индуцирует EMT ( 23). Поскольку блокирование PRL / JAK2 индуцирует путь ERK1 / 2 и EMT, поэтому мы далее исследовали, будет ли блокирование передачи сигналов PRL в дополнение к активации пути ERK1 / 2 также активировать путь TGF-β.Как показано в Рис.4 A и B , обработка клеток T47D с помощью AG490 в разные моменты времени или сверхэкспрессия киназно-неактивной формы JAK2 приводила к активации Smad2, что измерялось вестерн-блоттингом с использованием специфического фосфо-Smad2-антитела, распознающего два COOH-концевых остатка серина, фосфорилированных активированными рецепторами I типа суперсемейство TGF-β. Более того, блокирование активности JAK2 в клетках рака молочной железы MCF-7 также привело к активации Smad2 ( Рис.4 C ).Чтобы дополнительно подтвердить активацию белков Smad, мы исследовали эффекты блокирования функции JAK2 на транскрипционную активность Smad2. Для этого клетки СНО трансфицировали TGF-β / Smad-зависимой репортерной конструкцией 3TP-luc и обрабатывали или не обрабатывали AG490 в разные моменты времени. Как показано в Рис. 4 Обработка клеток D , AG490 привела к заметному увеличению активности люциферазы. Аналогично, как показано на Фиг. 4 E , блокирование активности JAK2 за счет сверхэкспрессии неактивной киназе мутантной формы JAK2, JAK2KI, как в клетках CHO, так и в MCF-7, также приводило к значительному увеличению активности репортера 3TP-luc.Вместе эти результаты показывают, что блокирование JAK2 ведет к усилению фосфорилирования Smad и транскрипционной активности, опосредованной Smad. Таким образом, ингибирование передачи сигналов PRL / JAK2 индуцирует активацию двух хорошо охарактеризованных прометастатических путей ERK1 / 2 и TGF-β / Smad и способствует высокой инвазионной способности клеток рака молочной железы человека.
Рисунок 4.Блокировка JAK2 приводит к активации Smad2. Клетки A, T47D обрабатывали ДМСО или AG490 (50 мкмоль / л) в указанные моменты времени.Ядерные экстракты подвергали иммунодетекции с использованием pAb к фосфо-Smad2 ( вверху ). Мембрану повторно зондировали pAb на TBP ( нижний ). Клетки B, T47D трансфицировали электропорацией одним вектором (10 мкг) или экспрессионной плазмидой, кодирующей JAK2KI (10 мкг). Ядерные экстракты подвергали иммунодетекции с использованием pAb к фосфо-Smad2 ( вверху ). Мембрану повторно зондировали pAb на TBP ( средний ). Лизаты клеток параллельной трансфекции были приготовлены для иммунопреципитации с использованием pAb к JAK2 и подвергнуты иммунодетекции с использованием того же антитела (, нижний ). C, MCF-7 клетки трансфицировали вектором (2 мкг) или JAK2KI (2 мкг) с использованием LipofectAMINE 2000, либо клетки обрабатывали AG490 (50 мкмоль / л) в течение 8 часов или TGF-β1 (0,5 нмоль / л). ) в течение 15 минут. Клеточные лизаты подвергали иммунодетекции с использованием pAb к фосфо-Smad2. Клетки D, CHO трансфицировали репортерным геном 3TP-Luc (1,5 мкг). На следующий день клетки обрабатывали ДМСО или AG490 (50 мкмоль / л) в указанные моменты времени и проводили люциферазные анализы. Столбцы , средние нормализованные световые единицы люциферазы трех экспериментов. E, слева, клетки CHO котрансфицировали конструкцией 3TP-Luc (1,0 мкг), экспрессионной плазмидой для β-галактозидазы (0,25 мкг) и киназно-неактивным JAK2 (JAK2KI) или pcDNA3, как указано, и через 24 часа после анализа люциферазы. были сделаны. Колонки , среднее нормализованных световых единиц люциферазы семи экспериментов ( P <0,001, статистический анализ ANOVA). Справа, клеток MCF-7 котрансфицировали конструкцией 3TP-Luc (2 мкг), плазмидой экспрессии для β-галактозидазы (0.5 мкг) и неактивный к киназе JAK2 (JAK2KI) или pcDNA3, как указано, и 48 часов спустя были проведены анализы люциферазы. Колонки , среднее значение нормализованных световых единиц люциферазы из четырех экспериментов ( P <0,001, статистический анализ ANOVA).
Механизм, с помощью которого путь Ras кооперируется с TGF-β / Smad, чтобы индуцировать EMT, все еще полностью не охарактеризован. Ранее было показано, что в эпителиальных клетках, трансформированных Raf, аутокринная продукция TGF-β приводит к Raf-индуцированной EMT ( 41).Кроме того, на клетках плоскоклеточной карциномы кератиноцитов мышей было показано, что активация Ras приводит к накоплению ядер Smad2, и этот эффект требуется для EMT и метастазирования ( 42). Кроме того, недавно было показано, что активация тирозинкиназы рецептора RON индуцирует активацию Smad2 через ERK1 / 2-зависимый механизм, приводящий к EMT в эпителиальных клетках ( 43), предполагая, что пути MAPK (ERK1 / 2) и TGF-β / Smad могут вносить вклад в EMT и клеточную инвазию последовательным и временным образом.Поэтому мы затем исследовали, необходим ли путь ERK1 / 2 для активации Smad2 и индукции EMT после инактивации каскада PRL / JAK2 в клетках рака молочной железы. Для этого мы заблокировали активацию ERK1 / 2 с помощью PD98059, химического ингибитора киназы MAP / ERK-киназы-1 (MEK-1). Как показано в Рис.5 A Индуцированная AG490 активация ERK1 / 2 блокировалась в присутствии PD98059. Интересно, что PD98059 также ингибировал вызванную AG490 активацию Smad2 ( Рис.5 B ). Кроме того, вызванные AG490 изменения морфологии эпителия и мезенхимы и потеря экспрессии E-кадгерина были обращены в присутствии PD98059 ( Инжир.5 C и D ) в клетках T47D.
Рисунок 5.Блокирование JAK2 приводит к активации ERK1 / 2, что приводит к активации Smad2 и EMT. Клетки T47D обрабатывали ДМСО, AG490 (50 мкмоль / л), PD98059 (10 мкмоль / л) или AG490 и PD98059 в течение ночи. A, лизаты клеток подвергали иммуноблоттингу с pAb на фосфо-ERK1 / 2 ( вверху, ), и мембрану повторно зондировали pAb на ERK1 / 2 ( внизу, ). B, ядерных экстрактов подвергали иммуноблоттингу с использованием pAb на фосфо-Smad2 ( вверху, ), и мембрану повторно зондировали с pAb на TBP ( внизу, ). C, фазово-контрастные микроскопические изображения. D, флуоресцентные изображения иммуноокрашенных клеток с mAb к E-кадгерину. Клетки E, T47D временно трансфицировали пустым вектором (10 мкг) или экспрессионной плазмидой, кодирующей JAK2KI (10 мкг). Через двадцать четыре часа после трансфекции клетки обрабатывали или не обрабатывали PD98059 в течение ночи. Ядерные фракции определяли иммунодетекцией с использованием pAb к фосфо-Smad2. Мембрану повторно зондировали pAb на TBP ( средний ). Выполняли параллельные трансфекции, и клетки использовали для иммунопреципитации с использованием pAb к JAK2 и проводили иммуноблоттинг с использованием того же антитела ( нижний ).Клетки F, T47D временно трансфицировали одним вектором (3 мкг) или экспрессионной плазмидой, кодирующей JAK2KI (3 мкг). На следующий день клетки либо обрабатывали, либо не обрабатывали PD98059 в течение ночи. Мембрану подвергали иммунодетекции с использованием mAb к E-кадгерину ( top ). Мембрану повторно зондировали mAb к β-тубулину ( нижний ).
Использование киназно-неактивной формы JAK2 подтвердило эти результаты. Как показано в Фиг. 5 E , JAK2KI-индуцированное фосфорилирование Smad2 заметно блокировалось в присутствии ингибитора MEK-1.Кроме того, потеря экспрессии E-кадгерина в клетках, сверхэкспрессирующих JAK2KI, была обращена в присутствии PD98059 ( Рис.5 F ). В совокупности эти результаты показывают, что индукция ЕМТ в ответ на потерю передачи сигналов PRL / JAK2 является многоэтапным процессом и что после ингибирования PRL / JAK2 активация Smad2 и индукция ЕМП опосредуются посредством ERK1 / 2-зависимого механизма. .
PRL давно известен как важный фактор в регуляции роста и дифференцировки эпителиальных клеток молочных желез.Более того, сейчас принято считать, что ПРЛ функционирует как аутокринный фактор, способствующий росту / выживанию клеток рака груди. Наши исследования здесь впервые описывают новую функцию гормона PRL и его нижестоящей сигнальной киназы JAK2 в качестве критических регуляторов EMT и инвазии клеток рака молочной железы путем негативной регуляции биохимических путей, участвующих в инвазии и метастазировании опухоли. В соответствии с нашим исследованием, STAT5a, нижестоящий медиатор ПРЛ в клетках молочной железы, недавно показал способность подавлять инвазию при раке молочной железы ( 44).Следовательно, в свете текущего исследования гормон ПРЛ и его основные нижестоящие эффекторные молекулы JAK2 и STAT5a являются критическими регуляторами инвазии клеток рака груди человека и предполагают, что ПРЛ может подавлять инвазию посредством множества механизмов.
Мы предлагаем новую модель роли ПРЛ в канцерогенезе груди. ПРЛ необходим как фактор роста и выживания в нормальных эпителиальных клетках молочной железы и при раке молочной железы, но действует как гормон-супрессор инвазии / метастазирования, блокируя прометастатические пути MAPK (ERK1 / 2) и TGF-β / Smad ( Инжир.6 ).
Рисунок 6.Двойная роль пролактина в онкогенезе молочной железы. Развитие опухоли до метастатического фенотипа происходит в результате сложных процессов, возникающих не только в результате неконтролируемого роста клеток, но и в результате дедифференцировки. В этой модели мы выдвигаем концепцию, согласно которой ПРЛ играет двойную роль в канцерогенезе молочной железы как фактор роста и выживания (проонкогенный), но также как гормон-супрессор инвазии / метастазирования, влияя на MAPK (ERK1 / 2) и TGF- β / Smad пути.
Метастазирование опухоли в значительной степени способствует смерти больных раком. Хотя были определены точные критерии для классификации онкогенов / протоонкогенов и генов-супрессоров опухолей, таких переменных не существует, чтобы охарактеризовать гены / пути-супрессоры метастазов. Недавно на основе идентификации нескольких генов-супрессоров метастазов, таких как NM23 и KAI-1 , были предложены определенные критерии для генов / путей-супрессоров метастазов ( 45, 46).Интересно, что PRL выполняет эти переменные. Предполагается, что гены-супрессоры метастазов участвуют в регуляции / поддержании дифференцировки клеток-мишеней, и действительно, PRL известен как фактор дифференцировки в эпителиальных клетках молочных желез. Кроме того, предполагается, что уровень экспрессии генов-супрессоров метастазов снижается / теряется при агрессивном раке по сравнению с неагрессивным раком. Точно так же потеря экспрессии PRLR была показана в агрессивных клетках рака молочной железы ( 31). Наконец, функционально эти гены-супрессоры метастазов влияют на пути, которые, как известно, являются прометастатическими.Активность по ингибированию метастазов NM23 и KAI-1 была связана с их способностью негативно регулировать путь MAPK (ERK1 / 2) ( 47, 48). Аналогичным образом, наши данные, представленные здесь, ясно показывают отрицательную роль киназы PRL и JAK2 в активации MAPK и Smad в клетках рака молочной железы. Таким образом, сигнальный каскад PRL / JAK2 теперь может быть включен в растущий список путей подавления метастазов.
Кроме того, на основании наших результатов очевидно, что PRL / JAK2 ограничивает активацию ERK1 / 2 в клетках рака молочной железы.Мы можем предположить, что эта активность PRL / JAK2 классифицирует PRL как негативный регулятор потенциально многих онкогенных сигналов, которые действуют через каскад Ras-ERK1 / 2. Следовательно, важно определить механизмы, с помощью которых PRL негативно регулирует путь MAPK. Действительно, множественные киназы, фосфатазы и белки каркаса регулируют активацию ERK1 / 2 ( 49, 50). В дополнение к гидролизу GTP с помощью GTPase-активирующего белка (Ras / GAP) для преобразования Ras из GTP-связанной активной формы в GDP-связанную неактивную форму и инактивации ERK1 / 2 фосфатазами MAPK (MKP-1 и MKP-3; исх.51) существует несколько других негативных регуляторов пути Ras / MAPK. Например, белок-1, взаимодействующий с Ras (RIN-1), конкурирует с Raf за связывание с Ras, тем самым блокируя активацию MAPK (ERK1 / 2) ( 52), протеин-ингибитор киназы Raf (RIKP) конкурентно нарушает взаимодействие между киназами Raf и MEK, что приводит к подавлению активации MAPK ( 53), а белок препятствует распространению митогенного сигнала (IMP; исх. 54) блокирует функциональную сборку киназ MEK и Raf через супрессор киназы Ras (KSR).Другие исследования показали, что адаптерные белки, такие как sprouty (spry), sprouty-like protein spred ( 55, 56), и члены семейства белков Ras / GAP-ассоциированного p62 ниже тирозинкиназы (Док; ссылки. 57, 58) также ингибируют путь MAPK. Ранее было показано, что один механизм, с помощью которого JAK2 ингибирует активацию ERK2 ниже гормона ангиотензина II, заключается в модуляции уровней экспрессии MAPK-фосфатазы MKP-1 ( 59). Механизм, с помощью которого ПРЛ негативно регулирует путь MAPK в клетках молочной железы и рака груди, неизвестен и в настоящее время исследуется.
Более того, наши результаты также подчеркивают важную роль киназы JAK2 в отрицательной регуляции ЕМП и клеточной инвазии. Были описаны хромосомные транслокации и, недавно, активирующие мутации с участием JAK2, которые, как было установлено, вызывают миелопролиферативные заболевания ( 60). Кроме того, активация JAK2 связана не только с молочной железой, но и с солидными опухолями, такими как яичники и простата ( 61). Поэтому усилия прилагаются к мишени JAK2 для лечения рака ( 62).В свете нашего исследования будет важно определить, будет ли JAK2-индуцированная передача сигналов также модулировать эпителиальную пластичность и инвазию в эти типы опухолей.
Таким образом, наши результаты определяют новый механизм контроля инвазивности / метастазирования клеток рака груди через путь PRL / JAK2, который может быть использован для терапевтических манипуляций.
Благодарности
Грантовая поддержка: Канадские институты исследований в области здравоохранения гранты MOP-13681 (S.Али) и MOP-53141 (Дж. Дж. Лебрен), студенческую премию FRSQ (Э. Коколакис) и Канадское онкологическое общество (С. Али и Дж. Дж. Лебрен).
Расходы на публикацию этой статьи были частично покрыты за счет оплаты страницы. Таким образом, данная статья должна быть помечена как реклама в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания этого факта.
Мы благодарим докторов наук. Доминик Девост; Дуэйну Барберу, Винсенту Гоффину, Джоан Массагу и Арису Мустакасу за предоставленные нам различные реагенты, использованные в этом исследовании, и Эрику Лизотту за техническую помощь в конфокальной микроскопии (основной объект подразделения исследования гормонов и рака).
Footnotes
- Получено 29 июня 2005 г.
- Исправление получено 31 октября 2005 г.
- Принято 15 ноября 2005 г.
- © 2006 Американская ассоциация исследований рака.
Каталожные номера
- ↵
Николл CS. Онтогенез и эволюция функций пролактина. Fed Proc 1980; 39: 2563–6.
- ↵
Орманди С.Дж., Нейлор М., Харрис Дж. И др.Изучение изменений транскрипции, лежащих в основе функциональных дефектов молочных желез мышей с нокаутом рецепторов пролактина. Недавнее Prog Horm Res 2003; 58: 297–323.
- ↵
Боле-Фейсот С., Гоффин В., Эдери М., Бинарт Н., Келли П.А. Пролактин (PRL) и его рецептор: действия, пути передачи сигнала и фенотипы, наблюдаемые у мышей с нокаутом рецептора PRL. Endocr Rev 1998; 19: 225–68.
- ↵
Horseman ND, Zhao W., Montecino-Rodriguez E, et al.Дефектный маммопоэз, но нормальный гемопоэз у мышей с целевым нарушением гена пролактина. EMBO J 1997; 16: 6926–35.
Орманди С.Дж., Камю А., Барра Дж. И др. Нулевая мутация гена рецептора пролактина вызывает множественные репродуктивные дефекты у мышей. Genes Dev 1997; 11: 167–78.
Вагнер К.Ю., Кремплер А., Триплетт А.А. и др. Нарушение альвеологенеза и поддержания секреторных эпителиальных клеток молочной железы у мышей с условным нокаутом Jak2.Mol Cell Biol 2004; 24: 5510–20.
- ↵
Лю Х, Робинсон Г.В., Вагнер К.Ю., Гарретт Л., Виншоу-Борис А., Хеннигхаузен Л. Stat5a является обязательным для развития молочной железы и лактогенеза у взрослых. Genes Dev 1997; 11: 179–86.
- ↵
Clevenger CV, Furth PA, Hankinson SE, Schuler LA. Роль пролактина при раке молочной железы. Endocr Rev 2003; 24: 1–27.
Бен-Джонатан Н., Либи К., МакФарланд М., Зингер М.Пролактин как аутокринный / паракринный фактор роста при раке человека. Тенденции метаболизма эндокринола 2002; 13: 245–50.
- ↵
Vonderhaar BK. Пролактин: забытый гормон рака груди человека. Pharmacol Ther 1998; 79: 169–78.
- ↵
Ginsburg E, Vonderhaar BK. Синтез и секреция пролактина клетками рака груди человека. Рак Res 1995; 55: 2591–5.
Клевенджер CV, Чанг В.П., Нго В., Паша Т.Л., Монтоне К.Т., Томашевски Дж.Экспрессия пролактина и рецептора пролактина при карциноме груди человека. Доказательства наличия аутокринной / паракринной петли. Am J Pathol 1995; 146: 695–705.
- ↵
Турень П., Мартини Дж. Ф., Зафрани Б. и др. Повышенная экспрессия гена рецептора пролактина, оцененная с помощью количественной полимеразной цепной реакции в опухолях молочной железы человека по сравнению с нормальными тканями молочной железы. J Clin Endocrinol Metab 1998; 83: 667–74.
- ↵
Chen WY, Ramamoorthy P, Chen N, Sticca R, Wagner TE.Антагонист пролактина человека, hPRL-G129R, ингибирует пролиферацию клеток рака груди за счет индукции апоптоза [ссылка в процессе]. Clin Cancer Res 1999; 5: 3583–93.
Chen NY, Holle L, Li W, Peirce SK, Beck MT, Chen WY. In vivo исследования противоопухолевых эффектов антагониста пролактина человека, hPRL-G129R. Int J Oncol 2002; 20: 813–8.
- ↵
Schroeder MD, Brockman JL, Walker AM, Schuler LA.Ингибирование индуцированных пролактином (PRL) пролиферативных сигналов в клетках рака молочной железы молекулярным имитатором фосфорилированного PRL, S179D-PRL. Эндокринология 2003; 144: 5300–7.
- ↵
Fuh G, Wells JA. Антагонисты рецепторов пролактина, подавляющие рост клеточных линий рака груди. J Biol Chem 1995; 270: 13133–7.
- ↵
Rose-Hellekant TA, Arendt LM, Schroeder MD, Gilchrist K, Sandgren EP, Schuler LA.Пролактин вызывает ERalpha-положительный и ERalpha-отрицательный рак молочной железы у трансгенных мышей. Онкоген 2003; 22: 4664–74.
- ↵
Вомачка А.Дж., Пратт С.Л., Локкефир Дж.А., Всадник Н.Д. Нарушение гена пролактина останавливает развитие молочной железы и замедляет индуцированный Т-антигеном рост опухоли. Онкоген 2000; 19: 1077–84.
- ↵
Mareel M, Leroy A. Клинические, клеточные и молекулярные аспекты инвазии рака.Physiol Rev 2003; 83: 337–76.
- ↵
Grunert S, Jechlinger M, Beug H. Разнообразные клеточные и молекулярные механизмы способствуют пластичности эпителия и метастазированию. Нат Рев Мол Cell Biol 2003; 4: 657–65.
- ↵
Thiery JP. Эпителиально-мезенхимальные переходы при опухолевой прогрессии. Нат Рев Рак 2002; 2: 442–54.
- ↵
Янда Э, Леманн К., Киллиш И. и др.Ras и TGFβ кооперативно регулируют пластичность эпителиальных клеток и метастазирование: рассечение сигнальных путей Ras. J Cell Biol 2002; 156: 299–313.
Тан Б., Ву М., Букер Т. и др. TGF-бета переключается с опухолевого супрессора на прометастатический фактор в модели прогрессирования рака груди. J Clin Invest 2003; 112: 1116–24.
Siegel PM, Shu W, Cardiff RD, Muller WJ, Massague J.Передача сигналов трансформирующего фактора роста бета нарушает индуцированный Neu онкогенез молочной железы, одновременно способствуя легочным метастазам. Proc Natl Acad Sci U S A 2003; 100: 8430–5.
- ↵
Muraoka RS, Koh Y, Roebuck LR, et al. Повышенная злокачественность опухолей молочной железы, индуцированных Neu, сверхэкспрессирующих активный трансформирующий фактор роста бета1. Mol Cell Biol 2003; 23: 8691–703.
- ↵
Али С., Али С.Рецептор пролактина регулирует фосфорилирование тирозина Stat5 и ядерную транслокацию двумя отдельными путями. J Biol Chem 1998; 273: 7709–16.
- ↵
Али С., Чен З., Лебрун Дж. Дж. И др. PTP1D является положительным регулятором сигнала пролактина, приводящего к активации промотора бета-казеина. EMBO J 1996; 15: 135–42.
- ↵
Лиотта Л.А., Stetler-Stevenson WG. Металлопротеиназы и инвазия рака.Семин Рак Биол 1990; 1: 99–106.
- ↵
Лакруа М., Леклерк Г. Актуальность клеточных линий рака молочной железы как моделей опухолей молочной железы: обновление. Лечение рака груди Res 2004; 83: 249–89.
- ↵
Ballestar E, Paz MF, Valle L и др. Связывающие метил-CpG белки идентифицируют новые участки эпигенетической инактивации при раке человека. EMBO J 2003; 22: 6335–45.
- ↵
Даффи MJ, Maguire TM, Hill A, McDermott E, O’Higgins N.Металлопротеиназы: роль в канцерогенезе, инвазии и метастазировании молочной железы. Рак молочной железы Res 2000; 2: 252–7.
- ↵
Полетт М., Навроцкий-Раби Б., Жиль С., Клавель С., Бирембаут П. Инвазия опухоли и матриксные металлопротеиназы. Crit Rev Oncol Hematol 2004; 49: 179–86.
- ↵
Левицки А. Тирозинкиназы как мишени для терапии рака. Eur J Рак 2002; 38 Дополнение 5: S11–8.
- ↵
Чжуанг Х., Патель С.В., Хе ТК, Сонстеби СК, Ню З., Войховски Д.М. Ингибирование эритропоэтин-индуцированного митогенеза с помощью киназодефицитной формы Jak2. J Biol Chem 1994; 269: 21411–4.
- ↵
Леонард У. Дж., О’Ши Дж. Jaks и STATs: биологические последствия. Анну Рев Иммунол 1998; 16: 293–322.
- ↵
Santen RJ, Song RX, McPherson R и др.Роль митоген-активированной протеинкиназы (MAP) в развитии рака груди. J Стероид Биохим Мол Биол 2002; 80: 239–56.
- ↵
Редди К.Б., Набха С.М., Атанаскова Н. Роль MAP-киназы в прогрессии и инвазии опухоли. Раковые метастазы Rev 2003; 22: 395–403.
- ↵
Акоста Дж. Дж., Муньос Р. М., Гонсалес Л. и др. Src опосредует пролактин-зависимую пролиферацию клеток T47D и MCF7 через активацию киназы очаговой адгезии / Erk1 / 2 и пути фосфатидилинозитол-3-киназы.Мол Эндокринол 2003; 17: 2268–82.
- ↵
Gutzman JH, Rugowski DE, Schroeder MD, Watters JJ, Schuler LA. Множественные каскады киназ опосредуют сигналы пролактина для активации протеина-1 в клетках рака груди. Мол Эндокринол 2004; 18: 3064–75.
- ↵
Lehmann K, Janda E, Pierreux CE, et al. Raf индуцирует продукцию TGFbeta, блокируя его апоптотические, но не инвазивные реакции: механизм, ведущий к увеличению злокачественности в эпителиальных клетках.Genes Dev 2000; 14: 2610–22.
- ↵
Oft M, Akhurst RJ, Balmain A. Метастазирование вызывается последовательным повышением уровней H-ras и Smad2. Nat Cell Biol 2002; 4: 487–94.
- ↵
Ван Д, Шен Кью, Чен Иьюй, Ван МХ. Совместная деятельность белка, стимулирующего макрофаги, и трансформирующего фактора роста-бета1 в индукции перехода эпителия в мезенхиму: роль тирозинкиназы рецептора RON.Онкоген 2004; 23: 1668–80.
- ↵
Sultan AS, Xie J, LeBaron MJ, Ealley EL, Nevalainen MT, Rui H. Stat5 способствует гомотипической адгезии и подавляет инвазивные характеристики клеток рака груди человека. Онкоген 2005; 24: 746–60.
- ↵
Steeg PS. Супрессоры метастазов изменяют передачу сигнала раковых клеток. Нат Рев Рак 2003; 3: 55–63.
- ↵
Шевде Л.А., Велч ДР.Пути подавления метастазов: развивающаяся парадигма. Рак латыш 2003; 198: 1–20.
- ↵
Hartsough MT, Morrison DK, Salerno M, et al. Nm23-h2 — супрессор метастазов, фосфорилирование киназного супрессора Ras через гистидиновый протеинкиназный путь. J Biol Chem 2002; 277: 32389–99.
- ↵
Одинцова Е., Сугиура Т., Бердичевский Ф. Ослабление передачи сигналов рецептора EGF супрессором метастазов, тетраспанином CD82 / KAI-1.Curr Biol 2000; 10: 1009–12.
- ↵
Моррисон Д.К., Дэвис Р.Дж. Регуляция модулей передачи сигналов киназы MAP белками каркаса у млекопитающих. Анну Рев Селл Дев Биол 2003; 19: 91–118.
- ↵
Sebolt-Leopold JS, Herrera R. Нацеливание каскада митоген-активируемых протеинкиназ для лечения рака. Нат Рев Рак 2004; 4: 937–47.
- ↵
Фарук А., Чжоу ММ.Структура и регуляция MAPK фосфатаз. Сотовый сигнал 2004; 16: 769–79.
- ↵
Wang Y, Waldron RT, Dhaka A, et al. Эффектор RAS RIN1 напрямую конкурирует с RAF и регулируется 14–3–3 белками. Mol Cell Biol 2002; 22: 916–26.
- ↵
Йунг К., Зейтц Т., Ли С. и др. Подавление активности киназы Raf-1 и передачи сигналов киназы MAP с помощью RKIP. Природа 1999; 401: 173–7.
- ↵
Матени С.А., Чен С., Кортум Р.Л., Разидло Г.Л., Льюис Р.Э., Уайт М.А. Ras регулирует сборку митогенных сигнальных комплексов через эффекторный белок IMP. Природа 2004; 427: 256–60.
- ↵
Hanafusa H, Torii S, Yasunaga T, Nishida E. Sprouty1 и Sprouty2 обеспечивают механизм контроля для пути передачи сигналов Ras / MAPK. Nat Cell Biol 2002; 4: 850–8.
- ↵
Вакиока Т., Сасаки А., Като Р. и др.Spred — связанный со Sprouty супрессор передачи сигналов Ras. Природа 2001; 412: 647–51.
- ↵
Карпино Н., Вишневски Д., Страйф А. и др. p62 (dok): постоянно фосфорилированный тирозином, GAP-ассоциированный белок в клетках-предшественниках хронического миелогенного лейкоза. Клетка 1997; 88: 197–204.
- ↵
Yamanashi Y, Baltimore D. Идентификация Abl- и rasGAP-ассоциированного белка 62 кДа в качестве стыковочного белка, Док.Клетка 1997; 88: 205–11.
- ↵
Sandberg EM, Ma X, VonDerLinden D, Godeny MD, Sayeski PP. Тирозинкиназа Jak2 опосредует зависимую от ангиотензина II инактивацию ERK2 посредством индукции митоген-активируемой протеинкиназы фосфатазы 1. J Biol Chem 2004; 279: 1956–67.
- ↵
Шеннон К., Ван Эттен РА. JAK вызывает кроветворную пролиферацию. Раковая клетка 2005; 7: 291–3.
- ↵
Verma A, Kambhampati S, Parmar S, Platanias LC. Семейство киназ Jak при раке. Раковые метастазы Rev 2003; 22: 423–34.
- ↵
Luo C, Laaja P. Ингибиторы JAK / STAT и киназ: возможный новый кластер лекарств. Drug Discov сегодня 2004; 9: 268–75.
Ваши гормоны | Фонд гипофиза
Вы здесь:
Гормоны — это химические вещества, которые циркулируют в кровотоке и распространяются по телу, чтобы передавать сообщения или сигналы различным частям тела.
Название «гормон» происходит от греческого слова «гормон», означающего «я возбуждаю», и относится к тому факту, что каждый гормон возбуждает или стимулирует определенную часть тела, известную как железы-мишени.
Гормоны вырабатываются эндокринными железами и передаются из клеток железы непосредственно в кровь, протекающую через железу. Как правило, чем выше количество гормона в крови, тем сильнее его воздействие.
Гормоны, вырабатываемые гипофизом
Две части гипофиза вырабатывают ряд разных гормонов, которые действуют на разные железы или клетки-мишени.
Передняя доля гипофиза
- Адренокортикотропный гормон (АКТГ)
- Тиреотропный гормон (ТТГ)
- Лютеинизирующий гормон (ЛГ)
- Фолликулостимулирующий гормон (ФСГ)
- Пролактин (PRL)
- Гормон роста (GH)
- Меланоцит-стимулирующий гормон (МСГ)
Задний гипофиз
- Антидиуретический гормон (АДГ)
- Окситоцин
Таблица гормонов гипофиза
| Гормон | Цель (и) | Функция |
| ACTH | Надпочечники | Стимулирует надпочечники для выработки гормона кортизола.АКТГ также известен как кортикотропин. |
| TSH | Щитовидная железа | Стимулирует щитовидную железу к выработке собственного гормона, называемого тироксином. ТТГ также известен как тиреотрофин. |
| LH и FSH | Яичники (женщины) Яичек (мужчины) | Управляет репродуктивной функцией и половыми признаками. Стимулирует выработку эстрогена и прогестерона в яичниках, а в яичках — выработку тестостерона и спермы.ЛГ и ФСГ вместе известны как гонадотропины. ЛГ также называют гормоном, стимулирующим интерстициальные клетки (ICSH) у мужчин. |
| PRL | Грудь | Стимулирует выработку молока в груди. Этот гормон выделяется в больших количествах во время беременности и кормления грудью, но всегда присутствует как у мужчин, так и у женщин. |
| GH | Все клетки тела | Стимулирует рост и восстановление.В настоящее время проводятся исследования для определения функций GH во взрослой жизни. |
| MSH | Точная роль у человека неизвестна. | |
| ADH | Почки | Контролирует уровень жидкости и минералов в крови в организме, влияя на задержку воды почками. Этот гормон также известен как вазопрессин или аргениновый вазопрессин (AVP). |
| Окситоцин | Матка Грудь | Влияет на сокращение матки во время беременности и родов и последующее выделение грудного молока. |
Контроль выработки гормонов постоянно контролируется и регулируется с помощью контуров обратной связи.
Вы можете найти веб-сайт Общества эндокринологов «Твои гормоны», чтобы узнать больше: http://www.yourhormones.info/
Гормоны, вырабатываемые гипоталамусом
Секреция гормонов передней долей гипофиза контролируется выработкой гормонов гипоталамусом. Хотя существует ряд различных гормонов, их можно разделить на два основных типа:
- гормоны, которые заставляют гипофиз включить выработку гормона (рилизинг-гормона)
- гормонов, которые приказывают гипофизу выключить выработку гормона (ингибирующего гормона).
Гормоны, секретируемые задней долей гипофиза, производятся в гипоталамусе и затем передаются по трубке между гипоталамусом и гипофизом (гипофизарный стебель), а затем секретируются в кровь.
Гормоны, вырабатываемые другими железами в организме
Всего было открыто более 200 гормонов или гормоноподобных веществ. Помимо гормонов, перечисленных в таблице выше, пять из этих гормонов контролируются гормонами, выделяемыми гипофизом.
| Гормон | Орган | Функция |
| Кортизол | Надпочечники | Кортизол выполняет ряд функций. Он способствует нормальному обмену веществ, поддерживает уровень сахара в крови и артериальное давление, обеспечивает устойчивость к стрессу и действует как противовоспалительное средство. Он также играет роль в регулировании баланса жидкости в организме. |
| Тироксин | Щитовидная железа | Тироксин контролирует многие функции организма, включая частоту сердечных сокращений, температуру и обмен веществ.Он также играет роль в метаболизме кальция в организме. |
| Эстроген | Яичники | Эстроген способствует росту тканей половых органов и других тканей, связанных с воспроизводством. Эстроген также укрепляет кости и оказывает защитное действие на сердце. |
| Прогестерон | Яичники | Прогестерон способствует изменениям в матке, которые происходят при подготовке к имплантации оплодотворенной яйцеклетки, и подготавливает грудь к производству молока. |
| Тестостерон | Тесты | Тестостерон отвечает за характеристики мужского тела, включая рост волос на лице и теле и развитие мышц. Тестостерон необходим для производства спермы, а также укрепляет кости. |
Для получения дополнительной информации о железах и гормонах, а также образовательных ресурсов посетите веб-сайт Общества эндокринологов «Вы и ваши гормоны»
Анализ крови на пролактин: нормальный диапазон + высокий и низкий уровни
Вы можете знать пролактин как гормон лактации, но этот лабораторный маркер может многое рассказать о вашем здоровье — включая мужчин! В этой статье мы подробно рассмотрим анализ крови на пролактин и обсудим естественные способы улучшения репродуктивного здоровья.Читать дальше!
Что такое пролактин?Пролактин (PRL) — гормон гипофиза, который стимулирует выработку грудного молока у женщин после родов. Он также поддерживает иммунную систему, психическое здоровье и обмен веществ у обоих полов. Чтобы узнать больше о его роли и факторах, контролирующих его секрецию, прочитайте первую часть этой серии.
Анализ крови на пролактин Когда это заказывать?Беременные и кормящие женщины обычно имеют высокий уровень пролактина.
Аномальные уровни у небеременных женщин и мужчин могут вызывать различные признаки и симптомы, включая аномальные выделения из сосков и проблемы с фертильностью. У женщин это может привести к нерегулярным или отсутствующим менструациям. У мужчин это может привести к эректильной дисфункции или снижению либидо [1].
Врач может назначить тест, чтобы выяснить, вызывает ли высокий или низкий пролактин симптомы . Тест может также выявить опухолей гипофиза и медицинских состояний с нарушенной передачей сигналов дофамина.
Пролактин может быть частью обычного исследования половых гормонов, наряду с:
Как подготовиться к тестуЭксперты предлагают сделать анализ крови на пролактин через 3-4 часа после пробуждения . Избегайте стимуляции груди, половых сношений, физических осмотров и стресса накануне и этим утром. Это также означает, что вам не следует проходить обследование груди непосредственно перед забором крови — ошибка, которая иногда случается в загруженных кабинетах врачей [2, 3, 4].
Ваш врач может посоветовать взять еще один образец крови через 30 минут, чтобы минимизировать воздействие стресса и других внешних факторов [5, 6].
В случае отклонения от нормы вам может потребоваться повторить тест, чтобы получить наиболее точные показания [2, 3].
Нормальные уровниНормальные уровни пролактина в крови различаются между полами: они колеблются между 4-23 нг / мл (мкг / л) у взрослых небеременных женщин и 3-15 нг / мл у мужчин [7, 3].
| Мужчины | 3-15 нг / мл (мкг / л) |
| Небеременные женщины | 4-23 нг / мл (мкг / л) |
| 34-386 нг / мл (мкг / л) | |
| Дети | 3.2-20 нг / мл (мкг / л) |
У женщин уровень пролактина незначительно меняется в зависимости от фазы менструального цикла. Во время беременности уровень повышается и может достигать 20x нормальных значений до родов [8].
С другой стороны, уровень пролактина у здоровых мужчин остается постоянным и немного снижается с возрастом. Они могут достигать пика в ответ на стресс и другие факторы, обсуждаемые ниже [9].
Высокий уровень пролактинаУровень пролактина является показателем репродуктивного здоровья.Низкий или высокий уровень не обязательно указывает на проблему, если нет никаких симптомов или если ваш врач говорит вам не беспокоиться об этом.
ПричиныВысокий уровень пролактина в крови (> 25 нг / мл) или гиперпролактинемия в основном поражает молодых женщин (25-34 лет). Это может быть нормальным явлением из-за [10, 11]:
- Беременность
- Грудное вскармливание
- Стимуляция груди и сосков
- Стресс
Лекарства, опухоли гипофиза и другие заболевания могут вызывать аномальную гиперпролактинемию, что может потребовать медицинского вмешательства. внимание [3].
1) Беременность и кормление грудьюУровни пролактина повышаются во время беременности в ответ на стимуляцию эстрогенами, и они могут быть в 10-20 раз выше, чем обычно (до 500 нг / мл) [8, 12].
После родов высокий уровень пролактина позволяет женщинам вырабатывать грудное молоко [13].
Когда начинается кормление, сосание становится основным стимулом для секреции пролактина и поддерживает производство молока; стимуляция сосков и груди вызывает всплески пролактина во время кормления грудью.Повышенный уровень пролактина также предотвращает овуляцию и новую беременность вскоре после родов [14, 15, 16].
2) СтрессНаш мозг вырабатывает пролактин (ПРЛ) в ответ на стресс, и это частая причина высокого пролактина, особенно у мужчин [17].
Если вы чувствуете стресс во время забора крови, ваш уровень ПРЛ может временно повыситься. Это известно как гиперпролактинемия , связанная со стрессом, . Чтобы этого избежать, врачи предлагают брать несколько образцов в полном покое [5].
3) Опухоли гипофизаПролактиномы — это пролактин-секретирующие опухоли гипофиза. Основываясь на размере опухоли, двумя наиболее распространенными типами являются микропролактинома (<10 мм) и макропролактинома (> 10 мм). Врачи до сих пор не знают точную причину этих доброкачественных опухолей [18].
Ожидаемые уровни пролактина в крови при пролактиноме более 250 нг / мл . Человек также может испытывать головные боли и проблемы со зрением, если опухоль давит на определенные области мозга.Врач порекомендует сделать КТ или МРТ, чтобы подтвердить или исключить это состояние [3].
Большинство пролактином хорошо реагируют на препараты, блокирующие секрецию пролактина, и не требуют химиотерапии или облучения. Они являются наиболее частой причиной повышенного ПРЛ, связанной с заболеванием, и обычно поражают более молодых женщин [19, 20].
4) Сниженная активность щитовидной железыГормоны щитовидной железы обычно работают в рамках отрицательной обратной связи, которая начинается в головном мозге: ТРГ (из гипоталамуса) увеличивает ТТГ и пролактин.ТТГ, в свою очередь, увеличивает гормоны щитовидной железы. Чтобы избежать собственного избытка, гормоны щитовидной железы будут блокировать TRH, как только они достигнут нормального уровня [21].
При недостаточной активности щитовидной железы гормонов щитовидной железы недостаточно высоки, чтобы блокировать ТРГ, приводит к высокому уровню пролактина [22, 23].
В то же время гипотиреоз не позволяет организму избавляться от пролактина [21].
5) МакропролактинемияПри макропролактинемии антитела против ПРЛ связывают молекулы пролактина и создают большие белковые комплексы, называемые «большим пролактином».Это значительно увеличивает уровень ПРЛ в крови (более 500 нг / мл) [24, 25].
Около 10-25% людей с повышенным уровнем пролактина страдают макропролактинемией; большинство из них не имеют симптомов и не требуют лечения [26].
6) ЛекарстваНекоторые лекарства могут повышать уровень пролактина (обычно до 100 нг / мл), подавляя его основной ингибитор дофамин. Этот побочный эффект наиболее характерен для нейролептиков, таких как [27, 28]:
- Галоперидол (Галдол)
- Хлорпромазин (Ларгактил, Торазин)
- Тиоридазин (Мелларил или Меллерил)
- Рисперидалон 47 снижают активность дофамина в головном мозге (блокируя рецепторы D2) [29].
Следующие препараты также могут повышать уровень пролактина [30, 31, 32]:
- Эстрогены (включая противозачаточные)
- Антиандрогены (ципротерона ацетат / Диана)
- Лекарства от тошноты (метоклопрамид) Антидепрессанты
Лекарства от артериального давления (метилдопа, резерпин и верапамил) - Лекарства от кислотного рефлюкса (циметидин и ранитидин)
Если врачи подозревают лекарственную гиперпролактинемию, они предложат замену лекарства, которая не повлияет на секрецию пролактина.
7) ДругоеСледующие условия также могут вызывать высокий уровень пролактина:
Признаки и симптомыЕсли у вас высокий уровень пролактина, ваш врач обсудит с вами результаты. Они могут провести дополнительные тесты, чтобы определить первопричину вашего высокого уровня.
Повышенный уровень пролактина (гиперпролактинемия) может снизить фертильность и либидо у обоих полов, в то время как аномальное выделение грудного молока (галакторея) гораздо чаще встречается у женщин [11, 40].
Высокий уровень пролактина у женщин также может вызывать [3, 22]:
- Нерегулярные циклы
- Сухость влагалища
- Усталость
- Угри
- Головные боли
Дополнительные признаки и симптомы у мужчин включают [11, 40, 41].
Сопутствующие состояния и последствия для здоровья 1) Снижение фертильностиВысокий уровень пролактина во время грудного вскармливания вызывает временное снижение фертильности , что защищает мать от новой беременности [11, 42].
У женщин, пытающихся зачать ребенка, высокий уровень пролактина предотвращает овуляцию, снижает уровень половых гормонов и снижает вероятность беременности. Лечение, снижающее пролактин, значительно увеличивало эстрадиол у 32 женщин с бесплодием [43, 44].
Во время беременности аномально высокий уровень пролактина может увеличить риск самопроизвольных выкидышей. У 352 беременных с этой проблемой пролактин-снижающий препарат увеличил шанс на успешную беременность на 33% ; женщины, у которых случился выкидыш, имели значительно более высокий ПРЛ. Меньшее исследование не подтвердило эту связь [45, 46].
2) Увеличение весаПролактин увеличивает аппетит и потребление пищи, вызывая резистентность к лептину. Этот эффект предназначен для обеспечения дополнительной энергии и питательных веществ во время беременности, но он может происходить в любых условиях с высоким уровнем пролактина [47, 48, 49, 50].
Повышенная секреция инсулина и чувствительность к глюкозе из-за высокого уровня пролактина может способствовать увеличению веса [9, 51, 52, 53].
Ожирение коррелировало с высоким уровнем пролактина у 78 человек с пролактин-секретирующими опухолями или пролактиномами . Как только у них нормализовался уровень пролактина, 70% смогли похудеть [54].
Небольшое исследование показало, что многие люди с пролактиномами страдают ожирением. Однако на этот раз снижение уровня пролактина не повлияло на потерю веса [51].
3) Аутоиммунные заболеванияОптимальный уровень пролактина укрепляет вашу иммунную систему. При гиперпролактинемии этот эффект преувеличен и может играть роль в различных аутоиммунных заболеваниях, таких как [55, 56, 57, 58]:
В некоторых случаях препараты, снижающие уровень пролактина, могут улучшить симптомы и остановить прогрессирование заболевания [58, 59 ].
Люди с волчанкой часто имеют высокий уровень пролактина. Чем больше у них повышается уровень пролактина, тем более серьезные симптомы они испытывают.Связь особенно сильна у беременных [60, 59, 61].
Доминирующая роль пролактина у женщин может также объяснить, почему женщины с большей вероятностью страдают аутоиммунными заболеваниями [62].
4) Колебания настроения и поведениеНормальный уровень пролактина борется со стрессом и поддерживает психическое здоровье, особенно во время и после беременности. Однако его превышение может вызвать перепады настроения и усугубить психические расстройства [63, 64, 65].
Согласно обзору клинических испытаний, высокий уровень пролактина (ПРЛ) может повышать риск тревоги и депрессии как у мужчин, так и у женщин.Снижение высоких уровней ПРЛ значительно улучшило симптомы у некоторых пациентов [66].
У 25 пациентов с депрессией некоторые симптомы, такие как чувство отстраненности, коррелировали с уровнем пролактина. Однако два исследования с участием 160 пациентов не обнаружили связи между этим гормоном и депрессией [67, 68, 69].
Молекулы, образованные путем расщепления пролактина на более мелкие кусочки (называемые вазоингибинами — подробнее о них ниже), вызвали тревогу и депрессию у крыс [70].
Высокий уровень пролактина может сделать женщин враждебными , вероятно, как средство защиты своих детей любой ценой. Похоже, что на мужчин это не оказывает такого же воздействия [71].
Таким образом, высокий уровень пролактина может нарушить настроение и поведение, но исследования слишком ограничены, чтобы делать какие-либо выводы.
5) Рак молочной железыПо данным наблюдательного исследования с участием более 6000 женщин, высокие уровни пролактина коррелируют с 50% повышением частоты рака груди.Связь была наиболее сильной у женщин в постменопаузе с эстроген-рецептор-положительными (ER +) и метастатическими опухолями [72].
Два исследования с участием 2000 женщин пришли к такому же выводу и обнаружили 30–60% повышенных показателей для самых высоких и самых низких значений пролактина (> 17,6 нг / мл против <9,8 нг / мл) [73, 74].
6) Потеря костной массыПосле родов высокий уровень пролактина увеличивает уровень ПТГ, чтобы высвободить кальций из костей, делая его доступным для производства грудного молока.В случае хронической гиперпролактинемии это может привести к потере костной массы и увеличить риск переломов у обоих полов [75, 76, 77].
7) МигреньПо данным двух небольших клинических испытаний (56 пациентов), высокий уровень пролактина (150 нг / мл) может быть связан с приступами мигрени. Лечение, снижающее уровень пролактина, улучшило симптомы и снизило частоту мигрени у некоторых пациентов [78, 79].
8) Кровяное давление и болезни сердцаНаше тело расщепляет молекулы пролактина на вазоингибинов , пептиды меньшего размера, которые уменьшают рост и негерметичность кровеносных сосудов [80].
Гиперпролактинемия и окислительный стресс увеличивают вазоингибины, нарушают рост кровеносных сосудов, а повышают риск сердечных заболеваний после беременности . Препараты, снижающие уровень пролактина, показали многообещающие результаты у животных с этим заболеванием [81, 82].
Согласно исследованию на мышах, избыток вазоингибинов может также повышать кровяное давление, блокируя выработку оксида азота [83].
Однако некоторые исследователи подчеркнули, что вазоингибины не всегда коррелируют с пролактином в крови, и предложили напрямую контролировать их уровни [84].
9) ДругоеНаблюдательное исследование с участием более 7000 субъектов изучало влияние гиперпролактинемии на общую смертность. Исследователи обнаружили связь между уровнем смертности и высоким уровнем пролактина (> 47 нг / мл), вызванным [85]:
- Гипотиреоз
- Более крупные пролактин-секретирующие опухоли (макропролактиномы)
- Лекарства
Однако они отметили, что высокий уровень пролактина не оказывает прямого влияния на чьи-либо шансы умереть. Вместо этого, скорее всего, сказывается основное заболевание.
Пациенты с лекарственной гиперпролактинемией также имели более высокие показатели:
- Диабет
- Болезнь сердца
- Инфекции
- Переломы костей
Уровни пролактина являются маркером репродуктивного здоровья. Высокий уровень не обязательно указывает на проблему, если нет никаких симптомов или если ваш врач говорит вам не беспокоиться об этом.Снижение уровня пролактина не обязательно приведет к улучшению репродуктивного здоровья.
Ниже приводится список вариантов лечения и дополнительных подходов для улучшения репродуктивного здоровья, которые также могут уравновесить высокий уровень пролактина. Хотя исследования показывают, что различные факторы питания и образа жизни могут снизить уровень пролактина, необходимы дополнительные крупномасштабные клинические испытания.
Не забудьте поговорить со своим врачом, прежде чем вносить какие-либо серьезные изменения в свой распорядок дня.
Медикаментозное лечение
В некоторых случаях гиперпролактинемии требуется медикаментозное лечение. Поскольку дофамин является основным блокатором пролактина, врач может назначить агонист дофамина , такой как бромокриптин или каберголин [86, 87].
Эти препараты могут помочь при аномальных выделениях из сосков, аутоиммунных заболеваниях, мигрени, бесплодии и других состояниях, вызванных повышенным уровнем пролактина [88, 89, 45, 79].
Дополнительные подходы
Добавки, которые могут повысить фертильность и либидо (измеряемые по снижению пролактина), включают:
Низкие уровни пролактинаУровни пролактина являются маркером репродуктивного здоровья.Низкий или высокий уровень не обязательно указывает на проблему, если нет никаких симптомов или если ваш врач говорит вам не беспокоиться об этом.
Аномально низкий уровень пролактина (гипопролактинемия) случается редко и обычно не требует медицинской помощи [101].
Причины 1) ЛекарстваВышеупомянутые агонисты дофамина могут вызывать гипопролактинемию, наряду с алкалоидами спорыньи и атипичными нейролептиками (арипипразолом) [102, 103].
2) Заболевания гипофизаСнижение активности гипофиза (гипопитуитаризм) — еще одна частая причина низкого пролактина [101].
Первичный гипопитуитаризм — редкое заболевание с пониженной выработкой пролактина, гормона роста и половых гормонов. Он задерживает рост и половое развитие у детей и вызывает преждевременное старение у взрослых [104, 105].
Синдром Шихана — еще одно заболевание гипофиза, при котором снижается уровень пролактина. Это может произойти из-за массивной кровопотери во время родов, которая нарушает кровоснабжение гипофиза [106].
3) ДругоеОжирение у беременных может снизить уровень пролактина и нарушить лактацию [107, 108].
Хотя секреция пролактина достигает пика во время сна, аномальные уровни мелатонина (от ежедневного воздействия) могут снижать ее [109].
Признаки и симптомыЕсли у вас низкий уровень пролактина, ваш врач обсудит с вами результаты. Они могут провести дополнительные тесты, чтобы выявить первопричину вашего низкого уровня.
Основным признаком низкого уровня пролактина после родов является недостаточная выработка молока . У небеременных женщин он может вызывать дисфункцию яичников и нерегулярные / отсутствующие циклы [110, 111].
Недостаток пролактина у молодых мам также может вызывать беспокойство и повышать риск диабета [63, 112].
У мужчин гипо- и гиперпролактинемия имеет похожие симптомы, такие как [113, 114, 115]:
- Эректильная дисфункция
- Пониженное либидо
- Бесплодие
- Преждевременная эякуляция
- Метаболический синдром Низкий
Женщины с недостаточной лактацией часто ищут естественные способы повысить уровень пролактина.Добавки, которые могут стимулировать выработку молока (галактагоги), включают:
Высокий уровень окситоцина после родов также важен для увеличения пролактина и стимуляции выделения молока. Следующие факторы способствуют лактации за счет повышения уровня окситоцина матери [122, 123]:
- Интимный контакт с ребенком
- Слышать крик ребенка о еде
- Любовные мысли о ребенке
- Поддержка и комфорт со стороны ее окружения
следующие виды деятельности могут повысить уровень пролактина, но клиническое значение этого эффекта неясно [3, 124, 125, 126, 127, 128]:
В редких случаях аномально низкий уровень пролактина может иметь более серьезные последствия, такие как бесплодие и Таким образом, требуется медицинская помощь .
Take-Away
Стресс, опухоли гипофиза, низкий уровень гормонов щитовидной железы и лечение шизофрении могут чрезмерно повысить уровень пролактина. Сопутствующие признаки и симптомы включают выделения из сосков, низкое либидо, бесплодие, нерегулярные циклы, увеличение веса, перепады настроения и мигрень.
Добавки, которые могут повысить фертильность и либидо (измеряемые по снижению пролактина), включают целомудренное дерево, мукуну, женьшень, ашвагандху и цинк). Увеличение количества диетического белка и полезных жиров также может помочь, но имеющихся доказательств недостаточно.
Высокий уровень пролактина (> 25 нг / мл) обычно наблюдается во время беременности и кормления грудью. Женщины с низким уровнем пролактина после родов не производят достаточно грудного молока. Травяные добавки (фенхель, пажитник, силимарин, моринга), благоприятная среда и интимный контакт матери и ребенка могут увеличить производство молока.
Низкий уровень пролактина также может быть следствием приема некоторых лекарств или нарушений гипофиза, что может привести к сексуальной дисфункции и снижению иммунитета.




