Протаргол вред: Аптека Ригла – забронировать лекарства в аптеке и забрать самовывозом по низкой цене в Москва г.
Протаргол-лор таблетки №2 д/р-р 2%+р-ль10 мл
Характеристики
| Зарегистрировано как | Лекарственное средство |
Инструкция по применению
Действующие вещества
Протеинат серебраФорма выпуска
Капли
Состав
Состав на одну таблетку Действующее вещество: серебра протеинат (протаргол) — 200,0 мг. Вспомогательное вещество: гидроксипропилметилцеллюлоза — 10,0 мг.
Фармакологический эффект
Механизм действия основан на том, что ионы серебра на поврежденной слизистой оболочке осаждают белки и образуют защитную пленку.
Фармакокинетика
При местном применении практически не абсорбируется.
Показания
Симптоматическая терапия острого назофарингита (насморка), синусита.
Противопоказания
Меры предосторожности
Повышенная чувствительность к компонентам препарата, атрофический ринит, беременность, период грудного вскармливания, детский возраст до 3 лет (для данной дозировки). Применение при беременности и в период грудного вскармливания Противопоказано применение препарата при беременности и в период грудного вскармливания.
Применение при беременности и в период грудного вскармливания Противопоказано применение препарата при беременности и в период грудного вскармливания.
Способ применения и дозы
Взрослым и детям старше 6 лет по 2-3 капли в каждый носовой ход 3 раза в день Детям от 3 до 6 лет: по 1-2 капли в каждый носовой ход 3 раза в день в течение 5-7 дней Основное действие препарата будет
Побочные действия
-Аллергические реакции: кожный зуд, раздражение слизистой, крапивница; -ощущение жжения и онемения; -сухость во рту; -покраснение глаз; -анафилактический шок; -отек Квинке; -атопический дерматит. При усугублении любых из указанных в инструкции побочных эффектов препарат следует отменить. Если любые из указанных в инструкции побочных эффектов усугубляются ши Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Симптомы: при рекомендуемом способе применения передозировка маловероятна.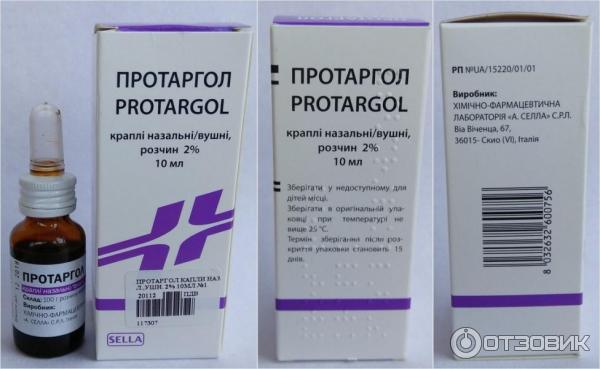 Возможно усиление побочных эффектов. При случайном проглатывании большого количества препарата может возникнуть раздражение желудочно-кишечного тракта. При длительном бесконтрольном применении препарата теоретически возможно появление очень редкого заболевания — аргироза (окрашивание в серый или синеватый цвет кожи и слизистых). При соблюдении рекомендованного режима дозирования, риск возникновения аргироза маловероятен. Лечение. При сильном раздражении, жжении, зуде глаз, кожу, слизистые оболочки промыть большим количеством воды в течение 15 минут. Лечение симптоматическое.
Возможно усиление побочных эффектов. При случайном проглатывании большого количества препарата может возникнуть раздражение желудочно-кишечного тракта. При длительном бесконтрольном применении препарата теоретически возможно появление очень редкого заболевания — аргироза (окрашивание в серый или синеватый цвет кожи и слизистых). При соблюдении рекомендованного режима дозирования, риск возникновения аргироза маловероятен. Лечение. При сильном раздражении, жжении, зуде глаз, кожу, слизистые оболочки промыть большим количеством воды в течение 15 минут. Лечение симптоматическое.
Особые указания
Возможно окрашивание отделяемого из носа в серый или синий цвет. Внимательно прочтите инструкцию по применению перед тем, как начать использование препарата. Сохраните инструкцию, она может понадобиться вновь. Если у Вас возникли вопросы, обратитесь к врачу. Лекарственное средство, которым Вы лечитесь, предназначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред далее при наличии тех же симптомов, что и у Вас.
Протаргол-лор таб. д/приг. р-ра д/местн. прим. 200мг в комплекте с флаконом и крышкой-пипеткой с бесплатной доставкой на дом из «ВкусВилл»
242 руб / шт 242 242
от партнера «Сердце России»
Выбратьлюбимым Выбран
любимым
Описание
Круглые, плоскоцилиндрические таблетки от коричневого до темно-коричневого или почти черного цвета с синеватым оттенком с неравномерной окраской поверхности, с фаской и риской.
Показания к применению
Симптоматическая терапия острого назофарингита (насморка), синусита.
Состав На одну таблеткуДействующее вещество: серебра протеинат (протаргол) — 200,0 мг.Вспомогательное вещество: гидроксипропилметилцеллюлоза — 10,0 мг.
Местно в виде 2% раствора.Способ приготовления 2% раствора:1. Поместить одну таблетку Протаргол-ЛОР во флакон из темного стекла.2. Влить во флакон 10 мл (до уровня плечиков — сужения флакона) кипяченой воды (предварительно охлажденной до комнатной температуры) или воды для инъекций.3. Закрыть флакон крышкой-пипеткой, интенсивно встряхивать в течение 5 минут, затем оставить на 10 минут и затем снова интенсивно встряхивать в течение 5 минут. Таблетка должна раствориться полностью.Готовый раствор хранить не более 30 дней в защищенном от света месте при температуре не выше 25 С.Перед применением препарата Протаргол-ЛОР рекомендуется промыть и очистить носовые ходы. Взрослым и детям старше 6 лет по 2-3 капли в каждый носовой ход 3 раза в день Детям от 3 до 6 лет: по 1-2 капли в каждый носовой ход 3 раза в день в течение 5-7 дней.Основное действие препарата будет проявляться только через 2-3 дня после первого использования.При сохранении или усугублении симптомов более 5-7 дней, рекомендуется обратиться к врачу. Применяйте препарат только согласно тому способу применения и в тех дозах, которые указаны в инструкции по применению.В случае необходимости, пожалуйста, проконсультируйтесь с врачом перед применением лекарственного препарата.
Взрослым и детям старше 6 лет по 2-3 капли в каждый носовой ход 3 раза в день Детям от 3 до 6 лет: по 1-2 капли в каждый носовой ход 3 раза в день в течение 5-7 дней.Основное действие препарата будет проявляться только через 2-3 дня после первого использования.При сохранении или усугублении симптомов более 5-7 дней, рекомендуется обратиться к врачу. Применяйте препарат только согласно тому способу применения и в тех дозах, которые указаны в инструкции по применению.В случае необходимости, пожалуйста, проконсультируйтесь с врачом перед применением лекарственного препарата.
Возможно окрашивание отделяемого из носа в серый или синий цвет. Внимательно прочтите инструкцию по применению перед тем, как начать использование препарата. Сохраните инструкцию, она может понадобиться вновь. Если у Вас возникли вопросы, обратитесь к врачу.Лекарственное средство, которым Вы лечитесь, предназначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред далее при наличии тех же симптомов, что и у Вас.
Внимательно прочтите инструкцию по применению перед тем, как начать использование препарата. Сохраните инструкцию, она может понадобиться вновь. Если у Вас возникли вопросы, обратитесь к врачу.Лекарственное средство, которым Вы лечитесь, предназначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред далее при наличии тех же симптомов, что и у Вас.
— Аллергические реакции: кожный зуд, раздражение слизистой, крапивница,- ощущение жжения и онемения,- сухость во рту,- покраснение глаз,- анафилактический шок,- отек Квинке,- атопический дерматит.При усугублении любых из указанных в инструкции побочных эффектов препарат следует отменить. Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Повышенная чувствительность к компонентам препарата, атрофический ринит, беременность, период грудного вскармливания, детский возраст до 3 лет (для данной дозировки).
Условия хранения В оригинальной упаковке, при температуре не выше 25 С. Готовый раствор в защищенном от света месте, при температуре не выше 25 С. Хранить в недоступном для детей месте.
Готовый раствор в защищенном от света месте, при температуре не выше 25 С. Хранить в недоступном для детей месте.
Данный товар может поставляться сразу несколькими производителями. По этой причине информация отличаться. Соответствующие конкретному товару данные всегда представлены на этикетке. Внешний вид продукта в магазине также может отличаться от изображения на фото.
О вездесущем чудо-протарголе. Для размышлений вам. Так как…
О вездесущем чудо-протарголе. Для размышлений вам.Так как назначением препаратов коллоидного серебра в основном грешат ЛОР врачи, статья от ЛОР врача, Анатолий Власенко, Винница.

И расскажет она о совместимости протаргола и мира доказательности:
Речь о «Протарголе». 👉🏻Также можно встретить в других обличиях: серебра протеинат, коллоидное серебро. По уверениям многих коллег – незаменимый антисептик, абсолютно безвредный (это же серебро, еще наши бабушки держали серебряную ложку в банке с водой, и именно благодаря этому дожили до ста лет!). Извиняюсь за излишний пафос, наболело.
‼️В общем – один из “мифов нашей медицины”.
👉🏻На данный момент коллоидное серебро в качестве лекарственного препарата не используется в мире доказательной медицины. 👉🏻В фармакопеи США последнее упоминание коллоидного серебра встречается в 1975 году. 🚨После чего оно было исключено из списка медицинских препаратов. Теперь давайте разберемся, почему так получилось.
 Компании производящие БАД с серебром утверждают его эффективность против СПИДа, рака, инфекционных болезней, гельминтозов, хронической усталости, болезней кожи, геморроя, доброкачественной гиперплазии предстательной железы и многих других патологических состояний. 👉🏻Однако на эксперименте серебро демонстрирует не бактерицидный (не убивает бактерии), а бактериостатический(останавливает размножение бактерий). 🔬И
Компании производящие БАД с серебром утверждают его эффективность против СПИДа, рака, инфекционных болезней, гельминтозов, хронической усталости, болезней кожи, геморроя, доброкачественной гиперплазии предстательной железы и многих других патологических состояний. 👉🏻Однако на эксперименте серебро демонстрирует не бактерицидный (не убивает бактерии), а бактериостатический(останавливает размножение бактерий). 🔬И 👉🏻А теперь поговорим о безопасности применения( ведь любая рекомендация к использованию это результат сравнения пользы и вреда).
✅Серебро – метал, причем довольно тяжелый, атомная масса 107,8 а.е.м. По российскому СанПин 2.1.4.1074-01(Питьевая вода) серебру присвоен класс 2: «высокоопасные вещества», по украинскому – допустимая концентрация сопоставима с концентрацией свинца и формальдегида в питьевой воде.

Аргироз (аргирия) – болезнь провоцируемая накоплением солей серебра в организме. 🔺Проявляется изменением цвета кожи, ногтей, слизистых, они сереют. 🔺Также встречаются местные формы заболевания, наиболее частый вариант – посерение кожи вокруг глаз. 🔺И что самое неприятное – пигментация (изменение цвета) необратима.
✅Количество серебра, которое должно накопится для проявления симптомов аргирии, неизвестно.
Вот пару интересных статей по вышеизложенной теме:
Colloidal Silver: Risk Without Benefit (Stephen Barrett, M. D.)Аргироз. Обзор литературы и описание случая
D.)Аргироз. Обзор литературы и описание случая
#дм_протаргол
#отдоказательныхврачей
экспериментальные препараты и особая еда
Всемирная организация здравоохранения предупреждает: лучший способ избежать встречи с коронавирусом — мыть руки с мылом или обрабатывать их антисептиком на основе 60—70% спирта и соблюдать социальную дистанцию.
Даниил Давыдов
разобрался с сомнительными лекарствами
Профиль автораЯ пишу эту статью 22 мая 2020 года. На сегодня лекарства от коронавирусной инфекции не существует. А поскольку клинические испытания любого препарата занимают до 10 лет, то в ближайшее время панацея вряд ли появится.
Зато в интернете уже вовсю советуют якобы рабочие способы победить коронавирус. Самостоятельно покупать и использовать описанные в статье и любые другие лекарственные препараты и народные средства в лучшем случае бесполезно, а в худшем — опасно для здоровья.
Самые важные вопросы про коронавирус
Я собрал список лекарств, покупать которые не стоит.
Будьте внимательны к источникам информации о здоровье — и сходите к врачу
Эта статья — о коронавирусной болезни, или COVID-19. Во всех статьях о коронавирусной болезни мы придерживается позиции Всемирной организации здравоохранения, или ВОЗ. Прежде чем читать дальше, рекомендуем ознакомиться с позицией ВОЗ относительно COVID-19.
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам.
Гидроксихлорохин
Что это такое. Гидроксихлорохин — препарат для лечения малярии и аутоиммунных заболеваний.
Сколько стоит. Гидроксихлорохин есть в перечне жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), то есть цены на него регулирует государство. Предельная отпускная цена производителя — 916,48 Р.
Предельная отпускная цена производителя — 916,48 Р.
В России препарат с международным непатентованным наименованием (МНН) «гидроксихлорохин» зарегистрировали четыре фармацевтических компании-производителя. Препарат известен под двумя торговыми именами: «Плаквенил» и «Иммард»
Как это должно работать. В начале 2020 года китайское правительство отчаянно искало средство от коронавирусной болезни. Китайские врачи попытались использовать хлорохин и другие его соединения — и пришли к выводу, что противомалярийные лекарства способны подавлять размножение вирусов SARS-CoV-2 в пробирке.
Затем группа китайских ученых сообщила, что усовершенствованная версия хлорохина — гидроксихлорохин — работает так же, как хлорохин, но действует мягче и безопаснее. Хотя результат был получен в лабораторных условиях, а более поздние эксперименты показали, что лекарство не работает на живых мышах и людях, заявления оказалось достаточно, чтобы правительства многих государств, в том числе США и России, сочли лекарство перспективным и разрешили применять его для экспериментального лечения пациентов с коронавирусной болезнью.
Почему не стоит покупать. Международные рекомендации советуют не использовать гидроксихлорохин вне стен больниц. Крупных клинических испытаний лекарства в отношении коронавируса пока никто не проводил, так что лечение считается экспериментальным. Непонятно, работает ли оно вообще — и если все-таки работает, то как именно: малярию, против которой препарат эффективен, вызывают одноклеточные паразиты, а не вирусы. У гидроксихлорохина бывают серьезные побочные эффекты — от головной боли, отеков и поноса до потери слуха и утраты ночного зрения. Кроме того, если раскупят весь препарат, он не достанется тем, кому действительно нужен и помогает: пациентам с ревматоидным артритом, системной красной волчанкой и фотодерматитом.
Руководство по лечению коронавирусной болезни — Национальные институты здравоохранения США
Лучше быть здоровым и богатым
Рассказываем, как выбрать хорошего врача и не платить за лишние анализы. Дважды в неделю — в вашей почте вместе с другими статьями о деньгах. Подпишитесь, это бесплатно
Подпишитесь, это бесплатно
Другие экспериментальные препараты. Все остальные лекарства против коронавирусной болезни тоже экспериментальные: надежных клинических испытаний, подтверждающих их безопасность и эффективность, пока нет. Врачи применяют их в надежде помочь тяжелобольным.
Это относится, например, к ремдесивиру (Remdesivir), ингибиторам интерлейкина-6 — в том числе сарилумабу (Sarilumab) и силтуксимабу (Siltuximab), интерферонам (IFN-α2β и IFN-β1b) и плазме переболевших коронавирусной болезнью людей.
Серьезных научных работ, подтверждающих эффективность препарата «Арбидол» против коронавирусной болезни, тоже нет. Предыдущие испытания, подтверждающие противовирусную активность этого препарата, международное медицинское сообщество сочло недостаточно убедительными.
В рекомендациях ВОЗ какие-либо лекарства от COVID-19 отсутствуют.
Блокатор вирусов
Что это такое. Бейдж или значок, внутри которого находится саше, пропитанное диоксидом хлора или хлоритом натрия. Попросту говоря, это бейджик с хлоркой.
Попросту говоря, это бейджик с хлоркой.
Сколько стоит. 900—2000 Р за штуку.
Блокаторы вирусов выпускают российские и японские компании. Состав и принцип действия у них один и тот жеКак это должно работать. Хлорка — хороший дезинфектант и может разрушать оболочки вирусов. На этом принципе основан антисептический эффект отбеливателя. При этом хлорка работает не только в виде раствора, но и в виде газа.
В 2008 году японские исследователи провели интересный эксперимент. Они взяли две группы по 10 мышей и рассадили их по двум камерам. В одну камеру подавали взвесь из вирусов гриппа типа А, а во вторую — взвесь из вирусов и газообразный диоксид хлора (ClO2) в безопасной для человека концентрации. В результате все «хлорированные» мыши выжили, а 7 из 10 контрольных мышей погибли от гриппа. Из этого авторы сделали вывод, что газообразный ClO2 уменьшает количество вирусных частиц в окружающей среде, поэтому им стоит обрабатывать общественные места во время эпидемии гриппа.
Эту идею подхватили производители блокаторов — в том числе российские. Одна из компаний-производителей утверждает, что благодаря испарениям хлорки их бейдж «эффективно обеззараживает личное воздушное пространство объемом 1 метр кубический» — причем защита держится в течение 30 дней.
Почему не стоит покупать. Коронавирусы рассеиваются на 1—2 метра с частицами слюны, когда больной кашляет, чихает или смеется. Люди заражаются, вдыхая вирусный аэрозоль или прикасаясь к вещам, которые потрогал больной. Теоретически бейдж мог бы подействовать двумя путями: защищая вдыхаемый воздух и обеззараживая поверхности вокруг человека.
На практике это не работает: газообразный диоксид хлора тяжелее воздуха. Если прицепить бейджик к пиджаку или кофте, вся хлорка из него «утечет» на пол, так что висящий на высоте лица аэрозоль с вирусами обезвредить не получится. Вирусы на предметах хлор из бейджа убить тоже не сможет, потому что при взаимодействии с воздухом диоксид хлора быстро распадается. Да и само «защитное облако» нестойкое: производитель пишет, что «на открытом воздухе эффективность может быть ниже из-за влияния ветра». Это значит, что для обеззараживания предметов блокатор не годится.
Да и само «защитное облако» нестойкое: производитель пишет, что «на открытом воздухе эффективность может быть ниже из-за влияния ветра». Это значит, что для обеззараживания предметов блокатор не годится.
Газообразная хлорка защитила мышей от гриппа, потому что исследователи посадили их в непроницаемую для воздуха камеру, в которую подавали порцию диоксида хлора сверху, как из душа. Мышам волей-неволей приходилось им дышать. Ветер ClO2 не сдувал, так что концентрация и эффективность обеззараживающего облака были гораздо выше, чем у бейджа на открытом воздухе.
Красная стрелка показывает, что газообразный хлор из генератора поступает в мышиную камеру сверху и облако накапливается у мордочки животного. Источник: microbiologyresearch.orgПродукты с коллоидным серебром
Что это такое. Коллоидное серебро — взвесь из мельчайших частиц серебра в какой-нибудь жидкости, обычно в воде или этиловом спирте. На его основе делают пищевые добавки, растворы для полоскания и закапывания в нос и даже зубную пасту.
Сколько стоит. От 120 до 3500 Р в зависимости от объема.
Помимо дорогих биодобавок в нашей стране популярен дешевый препарат «Протаргол». Хотя в инструкции написано, что в состав «Протаргола» входит «протеинат серебра», по сути это все то же коллоидное сереброКак это должно работать. По заявлению производителя, коллоидное серебро — эффективный антисептик: «подавляет жизнедеятельность патогенных бактерий, вирусов и грибков и паразитов». Для профилактики коронавирусной болезни коллоидное серебро советуют закапывать в нос 2—3 раза в день. А еще рекомендуют полоскать им горло при простуде.
Почему не стоит покупать. Коллоидное серебро никакой противовирусной активностью не обладает. FDA предупреждает: ни один продукт с коллоидным серебром коронавирусную болезнь не лечит, а те, кто утверждает обратное, — мошенники.
Коллоидное серебро в принципе не годится для профилактики и лечения болезней. От него нет пользы для здоровья, но может быть вред: со временем серебро накапливается в коже и придает ей серо-голубой оттенок — это называется «аргирия». Обычно это никак не вредит, но у некоторых людей с аргирией серебро повреждает почки и провоцирует судороги.
Обычно это никак не вредит, но у некоторых людей с аргирией серебро повреждает почки и провоцирует судороги.
БАДы с витаминами и минералами
Что это такое. БАД — биологически активная добавка к пище. Пищевые добавки бывают разного состава: в основном в БАДы входят витамины и микроэлементы.
Сколько стоит. 150—500 Р за упаковку, цена зависит от состава.
БАД — не лекарство, поэтому продавать БАДы можно в любом онлайн-магазинеКак это должно работать. Согласно заявлениям некоторых экспертов и СМИ, прием витаминов А и Е укрепляет слизистую, так что туда не могут проникнуть коронавирусы, витамин С и цинк «усиливают иммунитет», способствуя противовирусной защите, а добавки со смесью витаминов и минералов в принципе укрепляют здоровье.
Почему не стоит покупать. Ни один БАД не предназначен для диагностики, лечения или предотвращения заболеваний — строго говоря, это еда, а еда болезни не лечит и с вирусами не борется.
Все продукты, в которых содержатся вещества с доказанными противовирусными свойствами, уже превратились в лекарства. Все, что не превратилось, фармацевтическая промышленность считает бесперспективным: это касается лекарственных трав вроде эхинацеи и женьшеня, лимона и других продуктов с витамином С, имбиря и чеснока.
(PDF) Улучшение техники импрегнации серебром с использованием синтезированного in situ протаргола
Улучшенная пропитка протарголом 117
Опыт исследователей по окрашиванию нервной ткани
дает хорошие результаты для инфузорий. Однако синтез такого порошкообразного протаргола требует времени
(48 ч), трудоемок и требует специальных лабораторных условий, а также использования опасных химикатов (ацетон, боеприпасы
nia).Кроме того, этот метод дает небольшое количество продукта nal
, но дает большое количество серебряных отходов.
Кроме того, подходят не все марки пептона.
Таким образом, прямой синтез протаргола непосредственно перед применением
(т.е. in situ) в виде готового к использованию раствора
можно рассматривать как простую альтернативу.
В настоящей работе идея такого синтеза была
, также взятой из метода окрашивания нервных тканей
(Peters 1958), поскольку автор предположил стабильность результатов
, полученных с помощью раствора протеинат серебра.
, полученные непосредственно из белковосодержащих веществ
и нитрата серебра в щелочной среде.В отличие от формулы
, предложенной Петерсом, формула была изменена путем замены яичного белка или казеина
на более доступный пептон
и использования гидроксида натрия вместо калиноборатного буфера al-
. Концентрация ингредиентов
была скорректирована, чтобы получить раствор, соответствующий
приблизительно 1% раствору коммерческого протаргола
, содержащего около 8% серебра в сухом весе (как обычно —
, заявленное производителями).Три различных сорта
пептона с разным сроком годности и от разных производителей
, а также сухой коммерческий препарат
сыворотки из крови человека были протестированы с одинаковым успехом
.
Таким образом, можно ожидать, что широкий спектр коммерчески доступных белковых продуктов может быть подходящим для
предлагаемого способа.
Благодарности. Хочу выразить огромную благодарность двум анонимным рецензентам
за тщательное изучение рукописи
и ценные критические замечания.Также, я хотел бы поблагодарить г-жу Ga-
lina Hollands (Великобритания) и г-на Владимира Василенко (Канада) за im-
, подтверждающие английский проект.
ССЫЛКИ
Боррор А. К., Хилл Б. Ф. (1995) Отряд Euplotida (Ciliophora):
Таксономия с разделением Euplotes на несколько родов. J. Eu-
кариот. Microbiol. 42: 457–466
Dieckmann J. (1995) Улучшенная пропитка протарголом для ресничек
дает воспроизводимые результаты.Europ. J. Protistol. 31: 372–
382
Драгеско Дж. (1996) Infraciliature et morphométrie de cinq espèces
de ciliés mésopsammiques méditerranéens. Да. Биол. Mar. 37:
261–293
Fernandez-Galiano D. (1976) Импрегнация серебром реснитчатого прото-
zoa: процедура, дающая хорошие результаты с методом карбоната пиридинового серебра
. Пер. Являюсь. Microsc. Soc. 95: 557–560
Фернандес-Галиано Д. (1994) Аммиачный метод карбоната серебра
как общая процедура при изучении простейших из сточных вод
(и других).Wat. Res. 28: 495–495
Foissner W. (2014) Обновление «основных световых и сканирующих электронных микроскопических методов
для таксономических исследований реснитчатых прото-
zoa». Int. J. System. Evol. Microbiol. 64: 271–292
Фойсснер В., Бергер Х., Блаттерер Х., Кохманн Ф. (1995) Tax-
onomische und ökologische Revision der Ciliaten des Sapro-
biensystems. Группа IV: Gymnostomatea, Loxodes, Suctoria.
— Informationsberichte des Bayerischen Landesamtes für Was-
serwirtschaft, 1/95: 1–540
Foissner W., Wilbert N. (1981) Сравнительное исследование инфра-
инфузорий и серебряной системы пресноводных scuticociliates
Pseudocohnilembus putrinus (Kahl, 1928) nov. comb., P. pu-
sillus (Quennerstedt, 1869) nov. comb., морская форма
P. marinus Thompson, 1966. J. Protozool. 28: 291–297
Foley J. O. (1943) Метод протаргола для окрашивания нервных волокон в замороженных или целлоидиновых срезах
. Stain Techn. 18: 27–33
Ху Х., Song W. (2003) Переописание морфологии и деления на морфогенез морского гипотриха Pseudokahliella
marina (Foissner et al., 1982) из воды для выращивания морских гребешков
Северного Китая. J. Nat. Hist. 37: 2033–2043
Янковский А.В. (1967) Систематик рода Chilodonella и
предложенный новый род Trithigmostoma gen. п. Zool. J. 46:
1247–1250 (на русском языке с резюме на английском языке)
Каль А. (1930–1935) Urtiere oder Protozoa.I: Wimpertiere oder
Ciliata (Infusoria), eine Bearbeitung der freilebenden und ec-
tocommensalen Infusorien der Erde, unter Ausschluss der
marinen Tintinnidae. В F. Dahl (Ed.), Die Tierwelt eutschlands
(Pt.18 (1930 год), 21 (1931), 25 (1932), 30 (1935)). Йена:
Г. Фишер: 1–886
Кляйн Б. М. (1958) «Сухой» метод серебра и его собственное
использования. J. Protozool. 5: 99–103
Линн Д. (1992) Окрашивание протарголом.В: Протоколы в протозоологии
(ред. Дж. Дж. Ли и А. Т. Сольдо). Общество протозоологов, Al-
len Press Inc .: C4.1–4.8
Lynn DH, Montagnes DJS, Dale T., Gilron GL, Strom SL
(1991) Переоценка рода Strombidinopsis (Cilioph-
)ora, Choreotrichida) с описанием четырех новых планктонных видов
и замечаниями по их систематике и филогении. J. Mar.
Biol. Жопа. Великобритания 71: 597–612
млн лет назад H., Чой Дж. К., Сонг В. (2003) Улучшенная пропитка карбонатом серебра
для морских реснитчатых простейших. Acta Protozool. 42:
161–164
Montagnes D. J. S., Lynn D. H. (1987) Количественное окрашивание протарголом
(QPS) для инфузорий: описание метода и проверка его количественной природы
. Marine Microb. Food Webs 2: 83–93
Pan X., Bourland W. A., Song W. (2013) Синтез протаргола: внутренний протокол
. J. Eukaryot. Microbiol.60: 609–614
Peters A. (1958) Окрашивание нервной ткани смесью протеина и серебра —
туров. Stain Techn. 33: 47–53
Петц В. (1999) Ciliophora. В: Зоопланктон Южной Атлантики I, (Ред.
Деметрио Болтовского). Backhuys Publishers, Leiden: 265–319
Schewiakoff W. T. (1886) Организация и систематизация инфузорий
Aspirotricha (Holotricha auctorum) // Proc. Императорский Акад. Sc.
Санкт-Петербург, 4: 1–395
Силва-Нето И.D. da (2000) Усовершенствование техники импрегнации серебром
(протаргол) для получения морфологических характеристик инфузорий, жгутиконосцев и опалинатов про-
тистов Rev. Brasil. Биол. 60:
451–459
Frontiers | Сезонность планктонных пресноводных инфузорий: коррелируют ли анализы, основанные на участках V9 гена 18S рРНК, с количеством морфоспидов?
Введение
В озерах умеренного пояса сезонные смены фито- и метазоопланктона часто демонстрируют прогнозируемую динамику, которая описывалась в концептуальной структуре, модели Plankton Ecology Group (PEG) (Sommer et al., 1986). За последние 30 лет экологические исследования расширили понимание механизмов, ответственных за сезонность, с ключевым выводом о том, что динамику гетеротрофных протистов следует рассматривать отдельно от структуры зоопланктона многоклеточных животных (Sommer et al., 2012). Микрозоопланктон может составлять основную долю от общего выпаса на фитопланктоне, потребляя более 50% первичной продукции в определенные периоды года (Weisse et al., 1990; Straile, 1998). Во фракции водоядных простейших часто преобладают инфузории (Ciliophora), представляющие, например, e.g., первых и наиболее эффективных травоядных растений весеннего цветения фитопланктона (Geller et al., 1991; Sommaruga, Psenner, 1993; Tirok, Gaedke, 2007; Posch et al., 2015). Однако режимы питания инфузорий весьма разнообразны (бактериоядные, водоядные, всеядные, хищные), поэтому они составляют основную часть протистанского планктона в течение всего года (Mathes and Arndt, 1995; Straile, 1998). Инфузории могут даже быть доминирующими бактериоядными животными (Kisand, Zingel, 2000; Zingel et al., 2007) или потребителями автотрофного пикопланктона (Šimek et al., 1995) в некоторых озерах. Сезонные смены ассоциаций инфузорий и вовлеченных в них видов хорошо описаны для различных озер с умеренным климатом (Beaver, Crisman, 1989; Müller et al., 1991; Carrias et al., 1998; Sonntag et al., 2006; Zingel and Nõges, 2010). ; см. также обширный обзор литературы в Foissner et al., 1999). Эти исследования имеют одну общую черту — их результаты основаны на идентификации и количественной оценке морфологически четко определенных видов (morphospecies, Foissner et al., 1999) с помощью различных методов микроскопии. Подсчет морфологических видов позволяет количественно определять численность и биомассу на единицу объема воды, что является необходимым условием для изучения потоков энергии между трофическими объектами в озерах.
За 20 лет традиционные подходы, основанные на морфологии, были либо дополнены, либо даже заменены молекулярными методами в экологических исследованиях (Caron et al., 1999; Stoeck et al., 2006; Duff et al., 2008; Berdjeb et al., 2018). ). В настоящее время технологии высокопроизводительного секвенирования (HTS) произвели революцию в изучении протистанских сообществ в пресноводных экосистемах (Simon et al., 2015; Banerji et al., 2018; Bock et al., 2018; Михайлов и др., 2018). Среди прочего, HTS в окружающей среде дает возможность обнаружить загадочные и редкие виды, которые, скорее всего, не распознаются микроскопией (Amaral-Zettler et al., 2009; Nolte et al., 2010). Тем не менее, молекулярные методы анализа про- и эукариотических микробов должны иметь дело с множеством источников систематической ошибки. Прежде всего, ПЦР является основным источником ошибок из-за смещения праймеров и предпочтительной амплификации (Stoeck et al., 2006; Shakya et al., 2013; Трагин и др., 2018; Wear et al., 2018). Одной из основных проблем, возникающих из-за ПЦР и смещения праймеров, является критическое преобразование численности ампликонов в численность организма (Egge et al., 2013; Weber and Pawlowski, 2013; Stoeck et al., 2014), но решения см. Также Giner et al. (2016). К другим источникам ошибок относятся секвенирование (Huse et al., 2007), кластеризация ампликонов (Huse et al., 2010; Forster et al., 2016), а также неполнота и ошибки в справочных базах данных (Stoeck et al., 2014). Такие ошибки могут иметь обширные последствия для оценок разнообразия инфузорий, часто приводя к переоценке богатства операционных таксономических единиц (OTU) в окружающей среде.Кроме того, многие OTU все еще остаются неназначенными, а многочисленные морфовиды инфузорий еще не представлены в справочных базах данных (например, NCBI). Более того, высокое число копий генов 18S рРНК у инфузорий (Gong et al., 2013) и тот факт, что число копий сильно варьируется между видами, может сделать количественные результаты еще более ненадежными (Medinger et al., 2010). Таким образом, сомнительно, можно ли использовать только подходы HTS для ответа на экологические вопросы о видах инфузорий, таких как модели сукцессии и их значимость для функционирования экосистемы.В нескольких исследованиях использовалось сочетание молекулярных и морфологических методов для изучения разнообразия и динамики сообществ планктонных инфузорий как из морских (Bachy et al., 2013, 2014; Santoferrara et al., 2014, 2016), так и из пресноводных систем ( Medinger et al., 2010; Luo et al., 2011; Stoeck et al., 2014). Одновременная идентификация морфоспортов помимо секвенирования в окружающей среде помогает отличить значимые OTU от потенциальных ошибок секвенирования. Наконец, выделение и последующее секвенирование генов таксономических маркеров от идентифицированных видов инфузорий позволит нам связать данные секвенирования (OTU) с организмами и их известной аутэкологией.
В этом исследовании мы провели трехлетнюю кампанию по отбору проб в озере Цюрих (отбор проб раз в две недели, n = 74), чтобы установить значительный набор данных для оценки и улучшения данных HTS, специфичных для инфузорий. Оба метода, классический подсчет морфотипов с помощью количественной импрегнации серебром и секвенирование ампликона 18S рРНК, были использованы для исследования изменчивости сообщества инфузорий во времени. Чтобы проверить, совпадают ли два разных подхода друг с другом, мы сосредоточились на сезонных моделях двенадцати специфических морфовидов инфузорий.Эти виды были выделены непосредственно из воды озера, и большинство из них успешно культивировалось. Впоследствии их области V9 гена 18S рРНК были секвенированы и использованы в качестве семян для анализа HTS. Этот рабочий процесс привел к получению новой информации о последовательности для нескольких хорошо известных морфоспортов инфузорий, обитающих в пресноводных системах. Мы намеревались достичь следующих целей: (a) Коррелируют ли сезонные модели численности, а также редких и эфемерных видов инфузорий с помощью HTS с последовательностями, наблюдаемыми при подсчете морфоспецифических видов? (b) Позволяет ли HTS более точно описать сезонность редких и эфемерных видов инфузорий? (c) Есть ли связь между количеством считываний последовательностей и значениями клеточной численности или биомассы для видов инфузорий? (d) Отражает ли относительное количество считываний последовательностей количественную структуру сообщества, определенную путем подсчета морфоспецифических видов?
Материалы и методы
Место исследования, отбор проб и параметры окружающей среды
Цюрихское озеро (47 ° 19.3’N, 8 ° 33,9’E; Швейцария) — это предальпийское, олигомезотрофное и мономиктическое озеро, которое уже пять десятилетий является объектом интенсивных лимнологических исследований (Posch et al., 2012; Yankova et al., 2017). Основными морфометрическими дескрипторами являются: высота = 406 м над ур. Озеро служит резервуаром для питьевой воды более 1 миллиона человек. Пробы планктона отбирались каждые две недели с марта 2014 г. по 2017 г. ( n = 74 образца).Озерная вода была собрана с глубины 5 м с помощью пробоотборника Ruttner объемом 5 л. Объем воды в 5 л каждой пробы был разделен на 300 мл для метода подсчета морфологических видов и 4 л для HTS (см. Ниже), т. Е. Анализируемая вода поступала из одного и того же начального объема для обоих методов (см. Также схему рабочего процесса в Дополнительных документах). Рисунок S1). Кроме того, чистые уловы (размер ячеек 10 мкм) собирали в течение всего периода отбора проб с верхних 20 м для идентификации, выделения и культивирования живых особей.Сопутствующие абиотические параметры, то есть температура воды и концентрация кислорода, были измерены in situ для глубины отбора проб (5 м) с помощью многопараметрического зонда (6600 V2, Yellow Springs Instruments, США). Данные для описания трофического статуса, то есть концентрации общего фосфора (TP) и нитратов (NO 3 -N), а также общей численности фитопланктона, были получены от компании по водоснабжению Цюриха. Для подсчета бактерий 20 мл каждого 5 л образца консервировали формальдегидом (конечная концентрация 2%), окрашивали SYBR Green I (Sigma Aldrich) и оценивали с помощью проточной цитометрии (Cytoflex S, Beckman Coulter; Petrou and Nielsen, 2018).
Идентификация, численность и биомасса инфузорий
Определение живых инфузорий из уловов сети проводилось впоследствии после отбора проб в лаборатории с использованием микроскопа Zeiss Axio ImagerM1 (увеличение: от 100 × до 840 ×) и стереомикроскопа Zeiss Discovery.V8 (увеличение: от 10 × до 80 ×). Одиночные или множественные клетки идентифицированных инфузорий (таблица 1 и дополнительный рисунок S1) выделяли с помощью вытянутой стеклянной микропипетки и промывали 3-5 каплями стерильной фильтрованной озерной воды или среды (минеральная вода Volvic).Культуры поддерживали стерилизованными зернами пшеницы, поддерживающими рост бактерий для бактериоядных инфузорий, или штаммом Cryptomonas SAG 26.80 (коллекция культур водорослей Геттингенского университета, Германия), служащим источником пищи для водорослевых / всеядных видов. Культуры инфузорий хранили при 18 ° C и цикле 14 часов света (20 мкмоль м -2 с -1 ) / 8 часов темноты.
Таблица 1. Список из двенадцати видов инфузорий, которые были изолированы и частично культивированы в период исследования (март 2014–2017 гг.).
Для подсчета и расчета биомассы 300 мл озерной воды консервировали свежеприготовленным 15 мл раствора Буэна [содержащего 10,7 мл насыщенной пикриновой кислоты, 3,6 мл формальдегида (37% исходный раствор) и 0,7 мл ледяной уксусной кислоты; Скиббе, 1994]. Части образцов (100–150 мл) фильтровали через фильтры из нитрата целлюлозы с диаметром пор 0,8 мкм, снабженные счетными сетками (Sartorius, Германия). Затем был применен метод количественного окрашивания протарголом (протеинатом серебра) (QPS) в соответствии с протоколом Skibbe (1994) с небольшими изменениями после Pfister et al.(1999). После процедуры окрашивания инфузории на фильтрах, импрегнированные серебром, заливали канадским бальзамом (Merck, Германия), обеспечивая постоянные предметные стекла, сохраняющие свое качество в течение многих лет. Препараты анализировали при увеличении от 200 до 1600 с помощью микроскопа Zeiss Axio ImagerM1. Идентификацию живых и окрашенных видов инфузорий проводили согласно Foissner et al. (1991, 1992, 1994, 1995, 1999) и Sonntag et al. (2008). Мы следовали системам классификации Lynn (2008) и Gao et al.(2016) о таксономической принадлежности обнаруженных видов. Для каждого образца мы проверяли эквивалентную площадь фильтра до тех пор, пока не было определено и подсчитано не менее 400 клеток. Наконец, общая площадь фильтра была проверена на наличие редких видов, которые не были бы учтены нашей стандартной процедурой подсчета. Биомасса (т.е. сырой вес) для каждого идентифицированного вида инфузорий рассчитывалась путем умножения численности инфузорий на видоспецифичные коэффициенты пересчета, опубликованные Foissner et al. (1992, 1994, 1999). Эти опубликованные коэффициенты основаны на среднем размере клетки вида, геометрическом приближении формы клетки для расчета объема клетки и удельной плотности 1 пг мкм -3 (подробности см. В главе 2 в Foissner et al., 1992).
Секвенирование изолированных видов инфузорий
Неполные гены 18S рРНК, включая область V9, были секвенированы либо у культивируемых инфузорий, либо непосредственно у живых особей, собранных из уловов сети (таблица 1 и дополнительный рисунок S1). Клетки промывали, как описано выше, и голодали в течение ~ 24 часов в стерильной фильтрованной озерной воде или среде, чтобы гарантировать, что все потенциальные частицы пищи были переварены. Затем инфузории переносили в 1-2 мкл воды для ПЦР, которую затем использовали непосредственно в качестве матрицы для вложенной ПЦР с использованием праймеров от Marin et al.(2003; см. Дополнительный рисунок S2). В качестве альтернативы, праймеры Euk360F (Edgcomb et al., 2011) и Univ1492RE (Stoeck et al., 2006) были использованы для нашего стандартного протокола ПЦР (дополнительный рисунок S2).
Условия вложенной ПЦР были следующими: первая денатурация при 96 ° C в течение 1 мин, затем 30 циклов, каждый из которых состоит из 1 мин при 96 ° C, 2 мин при 55 ° C, 3 мин при 72 ° C, а затем заключительное удлинение в течение 10 минут при 72 ° C с использованием смеси GoTaq ® Green Master Mix (Promega). Эта процедура была успешно применена для вида Cinetochilum margaritaceum (таблица 1).Частичная 18S рДНК оставшихся одиннадцати видов была амплифицирована с использованием стандартного протокола ПЦР. Условия были следующими: первая денатурация при 94 ° C в течение 3 минут, затем 35 циклов, каждый из которых состоит из 1 минуты при 94 ° C, 1 минуты при 52 ° C и 2 минут при 72 ° C, с последующим окончательным удлинением. 5 мин при 72 ° C с использованием смеси GoTaq ® Green Master Mix (Promega). Продукты ПЦР очищали с помощью набора для очистки Agencourt AMPure XP PCR Purification Kit (Beckman Coulter) и секвенировали по Сэнгеру с помощью химии ABI BigDye на генетическом анализаторе ABI 3130x (Applied Biosystems).В некоторых случаях использовались дополнительные праймеры для секвенирования E528F (Marin et al., 2003) и SR10f (Nakayama et al., 1998) для секвенирования всей области V9.
Экстракция, амплификация и секвенирование ДНК
Пробы сырой воды (2 × 2 л) предварительно фильтровали через сетку 150 мкм для удаления более крупного зоопланктона, а затем фильтровали через мембранный фильтр 0,65 мкм (Durapore, Millipore) с использованием перистальтического насоса с низкой скоростью потока 50 мл / мин. -1 . Фильтры (дубликаты) непосредственно переносили в криопробирку, содержащую 1.5 мл RNAlater (QIAGEN), помещают в холодильник (~ 5 ° C) на ночь и, наконец, хранят при -80 ° C до дальнейшей обработки. Для экстракции ДНК каждый фильтр переносили в пробирку с лизирующим матриксом (Lysing Matrix E, MP Biomedicals) и добавляли 600 мкл буфера RLT и 6 мкл β-меркаптоэтанола. Оставшуюся жидкость в каждой криопробирке центрифугировали и выбрасывали. К остаточному осадку добавляли 200 мкл буфера RLT и 2 мкл β-меркаптоэтанола и перемешивали. Эту смесь добавляли в пробирку с лизирующим матриксом. Для разрушения и удаления клеток из фильтра каждую пробирку с матрицей подвергали отбиванию шариками в течение 45 с с частотой 30 Гц.Затем общую ДНК окружающей среды экстрагировали с использованием мини-набора AllPrep DNA / RNA Mini Kit (QIAGEN).
Гипервариабельный участок V9 (длиной около 150 п.н.) 18S рДНК амплифицировали из экстрагированной ДНК в соответствии с протоколом Stoeck et al. (2010). Прямой праймер был 1391F (5′-GTACACACCGCCCGTC-3 ‘; относится к положению 1629–1644 в ссылке Saccharomyces cerevisiae с номером доступа U53879 в GenBank NCBI; Lane, 1991) и обратным праймером EukB (5′-TGATAGCCTTCTTCG 3 ′; относится к позиции 1774–1797 в S.cerevisiae ; Medlin et al., 1988). В протоколе ПЦР для амплификации V9 использовалась начальная стадия денатурации при 98 ° C в течение 30 с, затем 30 циклов по 10 с при 98 ° C, 20 с при 61 ° C, 25 с при 72 ° C и последние 5 мин. удлинение при 72 ° C. Реакции проводили в объемах 50 мкл с использованием 0,5 мкл полимеразы Phusion (Biolabs), 10 мкл 5-кратного буфера Phusion GC (Biolabs), 1 мкл 10 мМ dNTP, 0,5 мкл матричной ДНК, 32,5 мкл чистой воды и 0,5 мкл прямой и 0,5 мкл обратных праймеров. Успешную амплификацию проверяли электрофорезом в агарозном геле с использованием 1.0 г агарозы (Carl Roth GmbH), 100 мл буфера TAE (1 ×) и 5 мкл бромистого этидия. Для каждого экстракта ДНК проводили трехкратные реакции ПЦР, чтобы минимизировать смещение ПЦР. Перед очисткой (набор Qiagen’s MinElute) были объединены реплики ПЦР, полученные из того же экстракта ДНК.
Из полученных продуктов ПЦР были созданы библиотеки секвенирования с использованием набора для подготовки библиотеки ДНК NEB Next ® Ultra TM для Illumina (NEB). Качество библиотек оценивали с помощью системы Agilent Bioanalyzer 2100.Восемнадцать образцов набора данных временных рядов (март 2014 г. — октябрь 2014 г.) были секвенированы на платформе Illumina NextSeq, сгенерировав считывания с парным концом 250 пар оснований. Все остальные образцы (ноябрь 2014 г. — март 2017 г.) секвенировали на платформе Illumina MiSeq, генерируя считывания парных концов длиной 300 пар оснований. Высокопроизводительное секвенирование было проведено компанией SeqIT GmbH & Co. KG (Кайзерслаутерн, Германия). Мы использовали по крайней мере 250 bp-чтений NextSeq, чтобы гарантировать максимально возможное качество последовательности (100% перекрытие последовательностей чтения 1 и чтения 2; обратите внимание: последовательности превышали длину 150 bp из-за мультиплексирования и адаптеров).
Предварительная и постобработка данных высокопроизводительного секвенирования
Парные чтения были объединены с помощью специального сценария. Качество данных HTS оценивалось следующим образом: на начальном этапе чрезмерные выступы праймеров были обрезаны с помощью CUTADAPT версии 1.18 (Martin, 2011). Затем чтения были отфильтрованы по качеству с помощью команды split.libraries.py в QIIME версии 1.8.0 (Caporaso et al., 2010). Сохранялись только такие считывания, которые имели точно совпадающие штрих-коды и праймеры, содержали исключительно однозначные нуклеотиды и имели минимальную длину 90 пар оснований.На заключительном этапе качественной фильтрации все чтения подверглись de novo химерному анализу в UCHIME v5.2.236 (Edgar et al., 2011).
Все высококачественные чтения были в конечном итоге реплицированы в ампликоны и сгруппированы в SWARM версии 2.2.2 (Mahé et al., 2015) с использованием d = 1. Это значение d относится к локальному порогу кластеризации вместо произвольный глобальный порог кластеризации. Кроме того, SWARM не зависит от порядка ввода. OTU растут итеративно, сравнивая каждое поколение назначенных ампликонов с оставшимися чтениями в наборе данных.OTU закрывается, когда OTU не может быть назначен новый ампликон с d или меньшим количеством различий. С помощью специального сценария была создана таблица непредвиденных обстоятельств OTU на основе выходных файлов SWARM (сценарий можно получить напрямую по запросу от Доминика Форстера, Университет Кайзерслаутерна).
Отнесение данных HTS к культивируемым видам инфузорий
Перед сравнением данных HTS с данными о последовательностях культивируемых видов инфузорий, таблица сопряженности OTU была нормализована до наименьшего числа последовательностей во всех образцах (110 100 последовательностей в образце 31 марта 2014 г.).Нормализация была выполнена в R версии 3.5.1 (R Development Core Team, 2008) с помощью команды rrarefy в пакете vegan . Из каждой OTU мы извлекли исходную последовательность как репрезентативную. Затем представители набора данных HTS сравнивали с последовательностями, полученными от двенадцати выбранных видов инфузорий, используя blastn в BLAST версии 2.6.0 (Altschul et al., 1990). Последовательности HTS должны были иметь общий фрагмент из не менее 90 последовательных нуклеотидов и сходство 97%, чтобы быть отнесенными к одной из этих двенадцати культивируемых инфузорий.Только те OTU, репрезентативные последовательности которых совпадают с нашими двенадцатью отобранными инфузориями (таблица 1), были извлечены из нормализованной таблицы сопряженности для дальнейшего анализа.
Статистический анализ: сравнение молекулярных и морфологических данных
Чтобы проверить, похожи ли модели сукцессии подсчета морфоспецифических видов на данные HTS, для каждого из двенадцати исследованных видов инфузорий был рассчитан коэффициент ранговой корреляции Спирмена. Поскольку мы выполнили несколько корреляционных тестов на одном и том же наборе данных, была применена поправка Бонферрони для защиты от инфляции альфа-уровня.Кроме того, подсчет клеток, значения биомассы и количество считываний последовательностей на дату отбора проб были использованы для составления трех матриц несходства (Брей Кертис) — по одной для каждого измерения. Корреляцию последовательности с количеством клеток или матрицей биомассы проверяли с помощью простого теста Мантеля с 10 000 перестановок. Все статистические анализы были выполнены с использованием R версии 3.4.4 (R Development Core Team, 2008).
Результаты
Сезонность скопления инфузорий с особым вниманием к двенадцати избранным видам
Цюрихское озеро мономиктично, и оборот воды обычно происходит ранней весной, т.е.е., с февраля по апрель. Параметры окружающей среды имели типичную сезонную закономерность, т. Е. В период исследований не было экстремальных климатических лет (рисунок 1). Температура воды на глубине отбора проб (5 м) достигала минимум 4,7 ° C зимой и максимум 23,7 ° C летом. Максимальные концентрации кислорода были измерены во время весеннего цветения фитопланктона (апрель – май). К концу года концентрация кислорода немного снизилась, однако значения на глубине 5 м все еще были выше 8.7 мг л -1 (насыщение> 70%) даже зимой. Концентрации общего фосфора и нитратов (NO 3 -N) снизились из-за поглощения автотрофами к концу года и увеличились в результате круговорота воды ранней весной. Максимальная численность фитопланктона была достигнута в летние месяцы, тогда как общее количество гетеротрофных бактерий увеличивалось весной и оставалось на высоком уровне (примерно 4 × 10 9 бактерий L -1 ) до осени. Общая численность инфузорий следовала типичному повторяющемуся годовому графику со слегка выраженными пиками в весеннее время и максимальными значениями (ок.60 × 10 3 клеток L -1 ) летом при самых высоких температурах воды (рисунок 1). В течение 3 лет исследований мы выявили 48 различных морфотипов инфузорий на основании микроскопических подсчетов, и 31 из этих морфотипов можно было четко отнести к уровню морфотипов (дополнительная таблица S1). Семнадцать морфотипов были отнесены только к уровню рода, частично (i) представляющие еще неописанные виды и (ii) морфотипы, которые не могли быть связаны с известными видами из-за методологических ограничений при оценке препаратов QPS.
Рис. 1. Экологические данные и общая численность инфузорий Цюрихского озера, определенные для 5-метрового слоя с марта 2014 по 2017 год (отбор проб раз в две недели, n = 74). (A) Температура воды (° C) и концентрация кислорода (мг л -1 ). (B) Концентрации общего фосфора (мкг л -1 ) и нитрата NO 3 -N (мкг л -1 ). (C) Общая численность фитопланктона (10 6 клеток L -1 ) и общая численность гетеротрофных бактерий (10 9 бактерий L -1 ). (D) Общая численность инфузорий (10 3 инфузорий L -1 ), определенная путем подсчета морфовидов у образцов, пропитанных протарголом.
С помощью нашего рабочего процесса выделения и культивирования (дополнительный рисунок S1) мы определили конкретные последовательности (включая области V9 гена 18S рРНК) для двенадцати видов инфузорий, отнесенных к пяти классам из озера Цюрих, которые были использованы в качестве семян для анализа HTS (Таблица 1, инвентарные номера: LR025746, LS999896, LS999898-LS999904, LS999906-LS999908).Пять из этих видов еще не были представлены в публичных генетических базах данных. Несколько очень распространенных и очень часто встречающихся видов можно охарактеризовать с помощью подсчета морфовидов, а также HTS (рис. 2). Сравнение обоих методологических подходов привело к следующим результатам: (i) Сезонные сукцессии для наиболее распространенных морфоспортов, основанные на подсчетах, показали замечательную корреляцию с данными HTS (см. Семь верхних панелей на Рисунке 2, Таблице 2 и Дополнительном Рисунке S3). Даже для видов с резкими колебаниями численности, например.g., Cinetochilum margaritaceum, Histiobalantium bodamicum , Pelagostrombidium mirabile , миксотрофный Coleps sp. и Rimostrombidium lacustris оба метода дали очень сопоставимую временную динамику. Однако корреляция считываний, специфичных для Balanion planctonicum , с количеством клеток была довольно низкой (см. Обсуждение возможных причин). Умеренная корреляция между двумя методами наблюдалась для второго по численности вида Halteria bifurcata . Halteria подсчета, вероятно, включали два едва различимых вида, а именно H. bifurcata и H. grandinella , что привело к потенциальным ошибкам при подсчете морфоспецифических видов. Тем не менее, были статистически значимые положительные корреляции (порядок рангов Спирмена) между микроскопическими подсчетами и данными HTS для одиннадцати из двенадцати выбранных инфузорий, но высокие коэффициенты> 0,6 были определены только для пяти видов (таблица 2). Для восьми видов значимые корреляции были обнаружены для всего набора данных за 3 года, но не в пределах каждого года (Таблица 2).(ii) Дивергенция между подсчетом HTS и морфологических видов была замечена для эфемерных и редких видов на основе морфологических исследований (например, Uroleptus willii , Stokesia vernalis ). Здесь HTS показались более точным методом описания сезонности, чем классический подход (Рисунки 2, 3 и Дополнительный Рисунок S3). Например, HTS продемонстрировал годовой внешний вид для Codonella cratera и Pelagodileptus trachelioides за все 3 года исследования, хотя эти виды можно было обнаружить только через 2 из 3 лет с помощью микроскопии.Наибольшее расхождение между обоими методами наблюдалось для Stentor roeselii . Мы обнаружили этот вид микроскопически только через 1 год (то есть на одном из 74 проанализированных слайдов, пропитанных протарголом), тогда как считывания ампликонов продемонстрировали появление на всех трехлетних исследованиях (рис. 2).
2 n = 74 для каждого вида и применяемого метода; глубина отбора проб = 5 м).Порядок видов отражает их среднюю численность, основанную на подсчете: самые многочисленные виды находятся вверху, а самые редкие представители — внизу. Наброски морфовидов инфузорий являются оригинальными рисунками Джанны Питч. Масштабные линейки: 40 мкм.Таблица 2. Анализ корреляции рангового порядка Спирмена для двенадцати выбранных видов инфузорий по сравнению с количеством прочтений для их конкретных последовательностей V9.
Рисунок 3. Обнаружение двенадцати отобранных видов во всех проанализированных образцах (100% = 74 образца) путем подсчета морфотипов и HTS.Соотношение числа считываний и числа появлений указано в таблице над панелью. Из-за ограничений, связанных с конкретным методом, общий объем исследуемой пробы при микроскопическом подходе составлял не более 150 мл. Данные HTS основаны на 4 л отфильтрованного объема пробы.
В целом, HTS показал более высокий процент встречаемости для всех, кроме одного вида инфузорий ( B. planctonicum ), чем при микроскопическом подсчете (рис. 3). Различия между двумя методами были разительны для некоторых инфузорий, например.g., специфические чтения для R. lacustris были зарегистрированы для всех исследованных образцов ( n = 74), но мы обнаружили этот вид только в 50% исследованных препаратов QPS. Основываясь на подсчете клеток, мы бы определили S. vernalis и C. cratera как действительно эфемерные виды, однако данные HTS показали их появление в 80 и 77% образцов соответственно (рис. 3).
Значения численности и биомассы в сравнении с числом считываний последовательности
Сначала мы определили порядок ранжирования семи наиболее распространенных видов на основе количества и определили, отражаются ли эти классификации также в биомассах и количестве считываний видоспецифичных последовательностей (рис. 4).Соответствие между числом считываний последовательностей и биомассой было заметно выше, чем между числом считываний последовательностей и численностью морфоспортов. Однако для некоторых видов мы обнаружили поразительную недооценку или переоценку их количественного значения в сообществе инфузорий с помощью HTS. Например, подсчеты идентифицировали небольшую B. planctonicum (∼20 × 15 мкм) как численно доминирующий вид на протяжении всего периода исследования, в то время как количество считываний последовательностей для этого конкретного таксона было низким по сравнению со всеми другими изученными инфузориями (рис. Дополнительная таблица S2).Противоположное соотношение было обнаружено, например, для более крупного вида R. lacustris (120 × 70 мкм), который характеризовался большим количеством считываний последовательностей, но низкой численностью подсчитанных особей (рисунки 2, 4 и дополнительная таблица S2). На протяжении всего исследования наибольшее количество считываний последовательностей было получено для H. bodamicum , вида, который также достиг высоких значений общей биомассы (рис. 4).
Рис. 4. Порядок ранжирования семи наиболее массовых видов инфузорий на основе численности по сравнению с их биомассой и количества видоспецифичных прочтений (HTS) за 3 года исследования ( n = 74 для каждого вида).Порядок ранжирования для конкретных методов указан в таблице над панелью. Столбцы показывают 25-й, 50-й и 75-й процентили, линии на каждом столбце показывают медианы, усы обозначают 10-й и 90-й процентили, а точки указывают 5-й и 95-й процентили. Белые линии в столбцах — средние значения.
Для окончательного обзора мы сравнили отношения двенадцати отобранных видов друг к другу по отношению к численности, биомассе и количеству считываний последовательностей за весь период исследования (Рисунок 5).Из-за различий в средних размерах клеток этих видов вклад в биомассу отличался от их доли в численности клеток. Например, B. planctonicum составлял 38% от совокупной численности двенадцати выбранных видов, но составлял только 11% кумулятивной биомассы и 0,5% считываний последовательностей, соответственно. Противоположная картина наблюдалась, например, для R. lacustris с вкладами 0,9, 7 и 19% в значения совокупной численности, биомассы и прочтений соответственно.Таким образом, отношения видоспецифичных считываний друг к другу лучше отражают состав сообщества на основе определения биомассы (рис. 5). Эта тенденция была подтверждена при сравнении расстояний Брея Кертиса между каждой парой образцов ( n = 74) с использованием подсчета клеток, биомассы и количества считываний последовательностей для каждого вида. Тест Мантеля показал более сильную корреляцию между расстояниями, основанными на количестве считываний последовательностей и биомассе на вид ( r = 0,425, p <0.001), а не на основе количества считываний последовательностей и количества клеток на вид ( r = 0,231, p <0,001).
Рис. 5. Отношение двенадцати выбранных видов друг к другу по отношению к численности (слева), биомассе (в центре) и количеству считываний (справа) за весь период исследования (в среднем 74 образца для каждого вида и примененных метод).
Обсуждение
Сильные и слабые стороны количественной оценки на основе морфологических видов
С тех пор, как впервые была формализована концепция микробной петли и ее значение для динамики пищевой сети (Azam et al., 1983), исследованиям роли инфузорий как внутренних компонентов морских и пресноводных пелагических систем уделяется значительное внимание. Сегодня мы можем извлечь пользу из «продолжительной» истории исследований в области анализа морфотипов инфузорий, уделяя особое внимание планктону. С 1990-х гг. Новые методологические подходы (Montagnes, Lynn, 1987; Skibbe, 1994) и отличные таксономические компиляции (Foissner, Berger, 1996; Foissner et al., 1999) позволили детально описать сукцессии комплексов инфузорий.Таким образом, сезонные закономерности некоторых ключевых планктонных видов хорошо описаны, включая данные о факторах окружающей среды (например, источниках пищи, температурных эффектах, нисходящем давлении выпаса скота), которые вызывают сукцессии инфузорий (см. Foissner et al., 1999; и ссылки в нем. ). Следовательно, для любого исследования планктонных инфузорий правильная идентификация морфовидов является предпосылкой для использования этих глубоких знаний. Здесь количественное окрашивание протарголом (QPS) оказалось предпочтительным инструментом для количественной оценки инфузорий в сочетании с относительно высоким таксономическим разрешением (Montagnes, Lynn, 1987; Jerome et al., 1993; Скиббе, 1994).
Благодаря нашему многолетнему опыту работы с этим методом (Pfister et al., 1999), мы можем определить его плюсы, а также недостатки и ограничения: (i) консервированные и окрашенные образцы концентрируются на фильтрах и заделываются в слой Сначала агар, а в конце — канадский бальзам, препараты имеют определенную толщину, что может отрицательно повлиять на оптическую оценку во время светлопольной микроскопии. Это особенно проблематично для идентификации очень крошечных видов, где незначительные различия, например.g., в их оральном или соматическом цилиарном паттерне, необходимо распознать. Например, трудно различить мелкие морфовиды в пределах родов Urotricha и Cyclidium на слайдах QPS (дополнительная таблица S1). Таким образом, неколичественные методы импрегнации серебром необходимы дополнительно для точной идентификации видов (Foissner, 2014). (ii) Вся рабочая процедура QPS является трудоемким методом, и обычно для окрашивания 8 образцов требуется 5 часов, а для оценки одного препарата обычно требуется несколько часов.Как следствие, у нас есть ограничения на выборочные кампании, нацеленные на высокое пространственное и временное разрешение динамики скоплений инфузорий. (iii) Все методы количественного определения планктонных инфузорий позволяют анализировать только ограниченный объем воды. Например, мы могли бы сконцентрировать максимум 150 мл на образец, чтобы получить хорошие препараты для олигомезотрофного озера Цюрих.
Два последних недостатка (ограничения на анализируемые образцы и объемы воды), кажется, затрудняют анализ эфемерных и редких видов с одной стороны, но также затрудняют описание динамики численности массовых и быстрорастущих представителей, с другой стороны.В более раннем исследовании динамики весеннего цветения в озере Цюрих мы обнаружили с помощью высокой частоты отбора проб (интервалы отбора проб 2–4 дня), что весенние пики численности многих видов продолжались всего несколько дней (Posch et al., 2015). Такая быстрая популяционная динамика наблюдалась в нескольких озерах (например, Müller et al., 1991; Šimek et al., 2014) и была связана с высокими темпами роста инфузорий, приводящими к временам удвоения на 1-2 дня (Müller and Geller, 1993 ; Macek et al., 1996). Следовательно, определенно необходимо исследовать большие объемы образцов с высоким временным разрешением (например,г., ежедневно в теплое время года) для выяснения динамики планктонных сообществ инфузорий. Здесь HTS, по-видимому, является многообещающим дополнительным подходом к методам, основанным на морфологических видах.
Выбор региона V9 в качестве маркера
Различные гипервариабельные области использовались для мониторинга сообществ эукариотического планктона в предыдущих исследованиях, и их полезность обсуждалась исследователями. Для обзора и сравнения мы ссылаемся на Tanabe et al. (2016). Среди трех наиболее популярных маркерных областей (V1 – V2, V4 и V9) мы выбрали область V9 по следующим причинам: (i) Хотя универсальность праймеров очень похожа для всех трех конкретных стандартных наборов праймеров, в настоящее время область V9 это лучший компромисс между охватом базы данных и таксономическим разрешением (изменчивость последовательностей; Tanabe et al., 2016). (ii) Кроме того, эта область заметно короче, чем области V1 – V2 и V4, и, таким образом, позволяет получить гораздо большую глубину последовательности при меньших затратах, что особенно актуально в исследованиях с большим количеством образцов. (iii) Наконец, в крупнейшем на сегодняшний день исследовании экологического секвенирования сообществ эукариотического планктона (Де Варгас и др., 2015) использовалась область V9, что позволило обеспечить хороший охват большинства (если не всех) основных таксономических линий эукариот. Будущие исследования метаданных экологических последовательностей эукариотического планктона выиграют от исследований, в которых уже использовался этот генетический маркер.
Корреляция данных HTS с подсчетом морфотипов
Преобразование численности ампликонов в наборах данных HTS в численность клеток — критическая проблема в молекулярной экологии и экологическом секвенировании. В более ранних исследованиях сообществ макетов протистана, в то время как все виды были обнаружены после секвенирования HTS, относительная доля типов последовательностей не коррелировала с численностью клеток в смесях клеток (Egge et al., 2013; Weber and Pawlowski, 2013). Кроме того, сравнительные исследования в природных экосистемах показали, что численность последовательностей и численность клеток часто несовместимы (Bachy et al., 2013; Сантоферрара и др., 2014; Stoeck et al., 2014). Однако эти исследования не являются окончательными, поскольку другие исследования поддерживают количественное использование данных HTS. Giner et al. (2016) сообщили об адекватной корреляции между микроскопическим количеством планктонных пикоэукариот и молекулярными сигналами после HTS. Это подтверждается более поздними исследованиями Forster et al. (2018) и Stoeck et al. (2018), показав, что анализ ассоциаций, основанный на данных обилия HTS инфузорий, отражает закономерности, полученные в результате морфологических исследований тех же образцов.Giner et al. (2016) утверждали, что ошибки ПЦР (Stoeck et al., 2006; Shakya et al., 2013; Tragin et al., 2018) и предполагаемые артефакты секвенирования (Huse et al., 2007) не влияют на корреляцию между относительным считыванием и изобилие клеток. Авторы продемонстрировали, что чем больше чтения, тем выше доля ячеек. По мнению этих авторов, использование относительного количества читателей в качестве показателя состава сообщества для целей сравнения оправдано. Противоречивые результаты упомянутых исследований демонстрируют, что относительная численность данных HTS может быть интерпретирована количественно, но также предупреждает о рассмотрении их как прямых заместителей численности клеток в естественных сообществах.Обстоятельства, при которых количественный анализ и интерпретация данных HTS возможны и надежны, еще предстоит определить.
В нашем исследовании оба метода показали четкую сезонную сукцессию для всех выбранных видов, а динамика популяций, основанная на HTS, в большинстве случаев заметно коррелировала с данными морфоспортов (рисунок 2 и дополнительный рисунок S3). До сих пор было всего несколько попыток сравнить временные наборы данных HTS с микроскопическим анализом пресноводных систем. Medinger et al.(2010) обнаружили значительную корреляцию между численностью клеток и данными о последовательности только для двух из пяти исследованных видов протистанов. Stoeck et al. (2014) провели исследование комплекса инфузорий из олигомезотрофного озера с помощью микроскопии и пиросеквенирования области V4 гена 18S рРНК. В последнем исследовании данные секвенирования вообще не отражали численность морфо-видов. Одной из основных причин этого несоответствия была неадекватность базы данных референсных генов с чрезвычайно низким охватом типичных пресноводных инфузорий.Авторы уже заявили, что дальнейшие инициативы по штрих-кодированию для пресноводных инфузорий (не только сосредоточенные на области V4) были срочно необходимы для полного использования потенциала HTS в экологических исследованиях пресноводных простейших. Кроме того, более глубокая стратегия секвенирования, достижимая с помощью пиросеквенирования, будет полезна для полного охвата разнообразия протистанского планктона в пресноводных средах (Stoeck et al., 2014).
Как показало наше исследование, динамика сукцессии инфузорий, основанная на численности прочитанных, была очень похожа на закономерности, выведенные из подсчета морфо-видов.Двумя шагами к лучшему согласованию паттернов, полученных с помощью микроскопии и секвенирования, являются (i) более глубокий охват последовательностей с помощью технологии секвенирования Illumina и (ii) доступность референсных последовательностей инфузорий, полученных от местных представителей сообщества. С помощью этого рабочего процесса HTS действительно помогли пролить свет на динамику популяций эфемерных и редких видов (рис. 2). Преимущество HTS перед микроскопией в этом контексте, безусловно, заключалось в возможности скрининга более высоких объемов образцов (HTS: 4 л, морфоспецифический анализ: макс.150 мл), что является необходимым условием для ответа на этот вопрос (Dolan and Stoeck, 2011). Поскольку в определенные периоды года редкие виды могут упасть ниже предела микроскопического обнаружения, считывания ампликонов все равно будут обнаруживаться HTS. И наоборот, секвенирование не позволяет различить клетки, проявляющиеся как активные трофозоиты или как покоящиеся цисты в пелагиали. Таким образом, популяционная динамика эфемерных и редких видов инфузорий остается предметом дальнейших исследований.
Balanion planctonicum представлял собой единственный вид, который был обнаружен в большем количестве образцов с помощью микроскопии, чем с помощью HTS (рис. 2, 3).Для интерпретации данных HTS мы могли использовать только одну эталонную последовательность, полученную из клонального штамма B. planctonicum (таблица 1). Однако этот морфовид может представлять комплекс видов, укрывающий криптические таксоны, которые не были бы обнаружены с помощью нашего рабочего процесса, и в будущем потребуется секвенирование большего количества клональных культур. Следующее наблюдение подтверждает наш тезис: установив порог идентичности 99% по сравнению с примененными 97%, мы получили очень похожее количество конкретных считываний для всех видов, за исключением B.planctonicum , который не может быть обнаружен с использованием более высокого порогового уровня (дополнительная таблица S2). Кроме того, наибольшее расхождение между морфологическими подсчетами и численностью считываний ампликонов наблюдалось в летние месяцы, когда общая численность инфузорий достигала максимальных значений. Поскольку количество считываний, специфичных для B. planctonicum , было per se маргинальным, сигналы ампликона, вероятно, терялись по сравнению с большим количеством считываний всех других инфузорий из-за процедур нормализации анализа HTS.
Взаимосвязь между числами считываний и значениями численности или биомассы
Мы проверили, отражают ли отношения прочтений между двенадцатью выбранными видами состав сообщества, выведенный из подсчета клеток (рис. 5). Можно ожидать расхождения между двумя методами (Santoferrara et al., 2014; Stoeck et al., 2014), поскольку, вероятно, все виды инфузорий имеют чрезвычайно высокое число копий оперона рДНК на индивидуальную клетку. Например, Gong et al. (2013) сообщили о величине ∼316000 (± 7100 стандартного отклонения) копий на клетку для перитрихозных инфузорий ( Vorticella sp.). Авторы также задокументировали, что количество копий рДНК на клетку заметно различается между (от 3385 до 315 786) и даже внутри 14 исследованных изолятов. Последнее изменение может быть связано с образованием или распадом макронуклеаров во время различных фаз роста и половой жизни клетки. В нашем исследовании видоспецифические вариации числа копий оперона рДНК могут быть причиной того, что некоторые, даже многочисленные, виды (например, B. planctonicum и C. margaritaceum ) характеризовались низким числом прочтений.Напротив, чтения H. bodamicum достигли наивысших значений на протяжении всего исследования, хотя и не были самым многочисленным видом. Систематическое недопредставление видоспецифичных считываний также может быть вызвано паттернами амплификации, специфичными для праймеров. Однако относительно высокая конгруэнтность составов сообществ, основанная на биомассах и количестве прочтений (рис. 5), скорее говорит о связи между размером клеток вида и числом копий рДНК. Такая связь ранее была показана для 18 штаммов водорослей, представляющих несколько классов эукариот (Zhu et al., 2005). Fu and Gong (2017) опубликовали единственное исследование, в котором изучалась связь между рДНК и количеством копий рРНК и фенотипическими признаками у инфузорий. Взаимосвязь между рДНК или рРНК и размером (объемом) клеток изучаемых инфузорий (масштабирование риботипа) согласуется как с метаболической теорией экологии, так и с гипотезой скорости роста, давая количественную основу для связи числа копий клеточной рРНК с размером клетки, ростом (активность) и стехиометрия биомассы. Эти результаты могут объяснить наблюдаемое соответствие между изобилием генов таксономических маркеров и клеточной биомассой в природных сообществах инфузорий.
Необходимость метабаркодирования планктонных пресноводных инфузорий
В этом методологическом исследовании мы не сосредотачивались на очевидных сильных сторонах HTS для анализа планктонных инфузорий, то есть (i) для выяснения бета-разнообразия в течение сезонного цикла, (ii) для получения указаний на загадочные, близкородственные виды, и (iii) обнаружить, вероятно, еще неизвестные и неописанные виды (Santoferrara et al., 2016). Нашей целью было сравнить данные HTS с подсчетом морфотипов в отношении сезонности как многочисленных, так и редких видов.Нам было известно, что информация о последовательностях (18S рДНК) для большинства известных морфотипов в озере Цюрих (Posch et al., 2015) не существовала в начале нашего исследования. Наш выбор двенадцати видов, которые были изучены более подробно, частично зависел от успешной изоляции и культивирования образцов. Основываясь на подсчете морфологических видов, мы обнаружили, что несколько видов в пределах рода Urotricha (Foissner and Pfister, 1997) были так же многочисленны, как B. planctonicum за 3 года исследований (дополнительная таблица S1).Однако нам не удалось выделить и секвенировать Urotricha spp., И, к сожалению, в общедоступной базе данных последовательностей нет ни одной записи, касающейся области V9 этого рода. Таким образом, мы не смогли извлечь Urotricha специфических прочтений из наших данных HTS, что свидетельствует о необходимости дальнейшего штрих-кодирования ДНК морфологически хорошо описанных планктонных пресноводных инфузорий. На основе подробного обзора литературы Foissner et al. (1999) предположили, что около 180 описанных морфологических видов действительно могут быть эупланктонными, и что общее количество планктонных видов в одном озере (альфа-разнообразие) может варьироваться от 50 до 100 (см. Также Sonntag et al., 2006; Зингель и Ныгес, 2010). Для озера Цюрих мы обнаружили 48 различных морфотипов инфузорий на основе микроскопических подсчетов для эпипелагической области в течение 3 лет исследований. Это число кажется довольно низким по сравнению с ожидаемым и частично описанным разнообразием почв или проточных вод (см. Таблицу 3.7 в Foissner et al., 1999). Однако инфузории в пелагических царствах нуждаются в особых адаптациях к планктонной жизни и уникальных стратегиях, чтобы встретить достаточное количество частиц пищи в окружающей среде, зачастую бедной питательными веществами.Принимая эти числа как приближение к разнообразию планктонных инфузорий, инициативы по штрих-кодированию ДНК возможны даже тогда, когда можно ожидать загадочных или все еще неописанных таксонов. Тем не менее, это остается сложной задачей, поскольку многие виды инфузорий демонстрируют очень выраженные сезонные изменения с отчетливыми максимумами популяции, длящимися всего несколько дней или недель и редкими в течение большей части года.
Наконец, оценка HTS зависит от обширной базы данных эталонных последовательностей. Связывая OTU с известными морфовидами, мы можем использовать обширные знания об аутэкологии этих видов.Этот аспект имеет решающее значение для науки и особенно для прикладных исследований, основанных на идентификации видов-индикаторов.
Авторские взносы
TP, TS, BS и GP разработали и разработали исследование. GP и EB провели подсчет морфологических видов и секвенирование выделенных / культивируемых видов. TS, ZQ и DF провели и оценили анализ HTS. Все авторы обсудили результаты и внесли свой вклад в концепцию рукописи. GP и TP написали рукопись и создали все рисунки и таблицы.
Финансирование
Это исследование финансировалось Швейцарским национальным научным фондом (SNF, проект: 31003A-182489 и 310030E-160603/1), Немецким исследовательским фондом (DFG, проект: STO 414 / 13-1), Австрийским научным фондом (FWF). , Project: I2238-B25) и исследовательский грант Фонда Карла Цейса для DF.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Томаса Прёшольда за разработку стратегии вложенной ПЦР для области V9. Мы также благодарим Себастьяна Диррена, Дебору Кнапп, Ойгена Лоэра, Дэниела Марти и Катю Пушкареву за их помощь в отборе проб и лабораторных работах. Мы также благодарны Барбаре Каммерландер, Микаэле Сальчер, Эдварду Митчеллу и Стефану Андрею за их критические комментарии к рукописи.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fmicb.2019.00248/full#supplementary-material
Сноски
- https://cran.ism.ac.jp/web/packages/vegan/vegan.pdf
Список литературы
Альтшул, С. Ф., Гиш, В., Миллер, В., Майерс, Э. У. и Липман, Д. Дж. (1990). Базовый инструмент поиска локального выравнивания. J. Mol. Биол. 215, 403–410. DOI: 10.1016 / S0022-2836 (05) 80360-2
CrossRef Полный текст | Google Scholar
Амарал-Цеттлер, Л.А., Макклимент, Э. А., Даклоу, Х. У., и Хьюз, С. М. (2009). Метод изучения разнообразия протистанов с использованием массового параллельного секвенирования гипервариабельных участков V9 малых субъединичных генов рибосомной РНК. PLoS One 4: e6372. DOI: 10.1371 / journal.pone.0006372
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Азам, Ф., Фенчел, Т., Филд, Дж. Г., Грей, Дж. С., Мейер-Рейл, Л. А., и Тингстад, Т. Ф. (1983). Экологическая роль микробов водяного столба в море. Mar. Ecol. Прог. Сер. 10, 257–263. DOI: 10.3354 / meps010257
CrossRef Полный текст | Google Scholar
Бачи, К., Долан, Дж. Р., Лопес-Гарсия, П., Дешам, П., и Морейра, Д. (2013). Точность оценок разнообразия протистов: морфология по сравнению с клонированием и прямым пиросеквенированием генов 18S рРНК и ITS-регионов с использованием заметных инфузорий тинтиннид в качестве примера. ISME J. 7, 244–255. DOI: 10.1038 / ismej.2012.106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бахи, К., Гомес, Ф., Лопес-Гарсия, П., Долан, Дж. Р., и Морейра, Д. (2012). Молекулярная филогения тинтиннид инфузорий (тинтинниды, цилиофоры). Protist 163, 873–887. DOI: 10.1016 / j.protis.2012.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бачи, К., Морейра, Д., Долан, Дж. Р., и Лопес-Гарсия, П. (2014). Сезонная динамика свободноживущих сообществ инфузорий тинтиннид, выявленная по экологическим последовательностям Северо-Западного Средиземного моря. FEMS Microbiol.Ecol. 87, 330–342. DOI: 10.1111 / 1574-6941.12224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Банерджи А., Бэгли М., Элк М., Пилигрим Э., Мартинсон Дж. И Санто-Доминго Дж. (2018). Пространственная и временная динамика сообщества пресноводного эукариотического планктона, выявленная с помощью метабаркодирования гена 18S рРНК. Hydrobiologia 818, 71–86. DOI: 10.1007 / s10750-018-3593-0
CrossRef Полный текст | Google Scholar
Берджеб, Л., Парада, А., Нидхэм, Д. М., Фурман, Дж. А. (2018). Краткосрочная динамика и взаимодействия сообществ морских протистов во время весенне-летнего перехода. ISME J. 12, 1907–1917. DOI: 10.1038 / s41396-018-0097-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бок К., Сальчер М., Дженсен М., Пандей Р. В. и Бенигк Дж. (2018). Синхронность планктонных сообществ эукариот и прокариот в трех австрийских озерах, где проводились сезонные пробы. Фронт. Microbiol. 9: 1290. DOI: 10.3389 / fmicb.2018.01290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Caporaso, J. G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F. D., Costello, E. K., et al. (2010). QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нат. Методы 7, 335–336. DOI: 10.1038 / nmeth.f.303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэрон, Д. А., Гаст, Р. Дж., Лим, Э. Л. и Деннет, М.Р. (1999). Структура сообщества протистана: молекулярные подходы к ответам на экологические вопросы. Hydrobiologia 401, 215–227. DOI: 10.1023 / A: 1003721923719
CrossRef Полный текст | Google Scholar
Карриас, Дж. Ф., Амблард, К., и Бурдье, Г. (1998). Сезонная динамика и вертикальное распределение планктонных инфузорий и их связь с микробными пищевыми ресурсами в олигомезотрофном озере Павин. Arch. Hydrobiol. 143, 227–255. DOI: 10.1127 / архив-гидробиол / 143/1998/227
CrossRef Полный текст | Google Scholar
Де Варгас, К., Audic, S., Henry, N., Decelle, J., Mahé, F., Logares, R., et al. (2015). Разнообразие эукариотического планктона в залитом солнцем океане. Наука 348: 6237. DOI: 10.1126 / science.1261605
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Долан Дж. Р. и Стоук Т. (2011). Повторный отбор проб показывает различную изменчивость в показателях видового богатства и состава сообществ планктонных простейших. Environ. Microbiol. Rep. 3, 661–666. DOI: 10.1111 / j.1758-2229.2011.00250.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дафф, Р. Дж., Болл, Х., Лаврентьев, П. Дж. (2008). Применение комбинированных морфолого-молекулярных подходов к идентификации планктонных простейших в пробах окружающей среды. J. Eukaryot. Microbiol. 55, 306–312. DOI: 10.1111 / j.1550-7408.2008.00328.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдгар, Р. К., Хаас, Б. Дж., Клементе, Дж.К., Айва К. и Найт Р. (2011). UCHIME улучшает чувствительность и скорость обнаружения химер. Биоинформатика 27, 2194–2200. DOI: 10.1093 / биоинформатика / btr381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эджкомб В., Орси В., Бунге Дж., Чон С., Кристен Р., Леслин К. и др. (2011). Микробная обсерватория Протистана в бассейне Кариако, Карибский бассейн. I. Пиросеквенирование и понимание Сэнгера видового богатства. ISME J. 5, 1344–1356.DOI: 10.1038 / ismej.2011.6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эгге, Э., Биттнер, Л., Андерсен, Т., Аудик, С., Де Варгас, К., и Эдвардсен, Б. (2013). 454 Пиросеквенирование для описания состава микробного эукариотического сообщества, разнообразия и относительной численности: тест на морские гаптофиты. PLoS One 8: e74371. DOI: 10.1371 / journal.pone.0074371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фойсснер, В.(2014). Обновленная версия «основных методов световой и сканирующей электронной микроскопии для таксономических исследований реснитчатых простейших». Внутр. J. Sys. Evol. Microbiol. 64, 271–292. DOI: 10.1099 / ijs.0.057893-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фойсснер В. и Бергер Х. (1996). Удобное руководство по инфузориям (Protozoa, Ciliophora), обычно используемым гидробиологами в качестве биоиндикаторов в реках, озерах и сточных водах, с примечаниями по их экологии. Freshw. Биол. 35, 375–482. DOI: 10.1111 / j.1365-2427.1996.tb01775.x
CrossRef Полный текст | Google Scholar
Фойсснер В., Бергер Х., Блаттерер Х. и Кохманн Ф. (1995). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа IV: гимнастоматея, локсодезы, суктории. informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/95: 540.
Google Scholar
Фойсснер В., Бергер Х. и Кохманн Ф. (1992).Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа II: перитрихии, гетеротрихиды, одонтостоматиды. informationsberichte des bayer. Landesamtes Wasserwirtschaft 5/92: 502.
Google Scholar
Фойсснер В., Бергер Х. и Кохманн Ф. (1994). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа III: гименостомы, простоматида, нассулида. informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/94: 548.
Фойсснер В., Бергер Х. и Шаумбург Дж. (1999). Идентификация и экология инфузорий лимнетического планктона. Informationsberichte des Bayer. Landesamtes Wasserwirtschaft Heft 3/99: 793.
Google Scholar
Фойсснер В., Блаттерер Х., Бергер Х. и Кохманн Ф. (1991). Taxonomische und ökologische revision der ciliaten des saprobiensystems. Группа I: циртофориды, олиготрихиды, гипотрихии, кольподеи. Informationsberichte des bayer. Landesamtes Wasserwirtschaft 1/91: 478.
Google Scholar
Фойсснер В. и Пфистер Г. (1997). Таксономическая и экологическая ревизия уротрих (Ciliophora, Prostomatida) с тремя или более каудальными ресничками, включая удобный ключ. Limnologica 27, 311–347.
Google Scholar
Форстер Д., Дантхорн М., Стоук Т. и Маэ Ф. (2016). Сравнение трех подходов к кластеризации для обнаружения нового микробного разнообразия окружающей среды. PeerJ 4: e1692. DOI: 10.7717 / peerj.1692
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Форстер Д., Филкер С., Кохемс Р., Брейнер Х.-В., Кордье Т., Павловски Дж. И др. (2018). Сравнение различных генов метабаркода инфузорий как биоиндикаторов для оценки воздействия на окружающую среду аквакультуры лосося. J. Eukaryot. Microbiol. doi: 10.1111 / jeu.12670 [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу Р. и Гонг Дж.(2017). Анализ отдельных клеток, связывающий количество копий рибосомной (r) ДНК и рРНК с размером и скоростью роста клетки, дает представление об экологии молекулярного протистана. J. Eukaryot. Microbiol. 64, 885–896. DOI: 10.1111 / jeu.12425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gao, F., Warren, A., Zhang, Q., Gong, J., Miao, M., Sun, P., et al. (2016). Основанная на данных эволюционная гипотеза реснитчатых протистов с пересмотренной классификацией филума Ciliophora (Eukaryota.Альвеолаты). Sci. Rep. 6: 24874. DOI: 10.1038 / srep24874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Геллер В., Берберович Р., Гаедке У., Мюллер Х., Паули Х. Р., Тильцер М. М. и др. (1991). Отношения между компонентами автотрофного и гетеротрофного планктона в сезонном цикле 1987 г. в Боденском озере. Верх. Междунар. Verein Limnol. 24, 831–836. DOI: 10.1080 / 03680770.1989.11898860
CrossRef Полный текст | Google Scholar
Гинер, К.Р., Форн, И., Ромак, С., Логарес, Р., Де Варгас, К., и Массана, Р. (2016). Секвенирование окружающей среды дает разумные оценки относительной численности конкретных пикоэукариот. Заявл. Environ. Microbiol. 82, 4757–4766. DOI: 10.1128 / aem.00560-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонг Дж., Донг Дж., Лю X. и Массана Р. (2013). Чрезвычайно высокое число копий и полиморфизм оперона рДНК, оцененный на основе анализа отдельных клеток инфузорий олиготрих и перитрих. Protist 164, 369–379. DOI: 10.1016 / j.protis.2012.11.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюз, С. М., Хубер, Дж. А., Моррисон, Х. Г., Согин, М. Л., и Уэлч, Д. М. (2007). Точность и качество массово-параллельного пиросеквенирования ДНК. Genome Biol. 8: R143. DOI: 10.1186 / GB-2007-8-7-r143
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюз, С. М., Велч, Д. М., Моррисон, Х. Г., и Согин, М.Л. (2010). Разглаживание морщин в редкой биосфере за счет улучшенной кластеризации OTU. Environ. Microbiol. 12, 1889–1898. DOI: 10.1111 / j.1462-2920.2010.02193.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джером, К. А., Монтань, Д. Дж. С., и Тейлор, Ф. Дж. Р. (1993). Влияние количественного окрашивания протарголом и фиксаторов Люголя и Буэна на размер клеток: более точная оценка биомассы видов инфузорий. J. Eukaryot. Microbiol. 40, 254–259. DOI: 10.1111 / j.1550-7408.1993.tb04913.x
CrossRef Полный текст | Google Scholar
Кисанд В., Зингель П. (2000). Преобладание поедания инфузорий бактериями весной в мелководном эвтрофном озере. Aquat. Microb. Ecol. 22, 135–142. DOI: 10.3354 / ame022135
CrossRef Полный текст | Google Scholar
Lane, D.J. (1991). «Секвенирование 16S / 23S» в Nucleic Acid Technologies in Bacterial Systematic , ред. Э. Стакебрандт и М.Гудфеллоу (Нью-Йорк, Нью-Йорк: Wiley), 115–175.
Google Scholar
Лю А., Йи З., Лин Х., Ху Х., Аль-Фаррадж С. А. и Аль-Рашейд К. А. С. (2015). Молекулярно-филогенетическое происхождение Plagiopogon и Askenasia (Protozoa, Ciliophora), выявленное по последовательностям их генов. J. Ocean Univ. Китай 14, 724–730. DOI: 10.1007 / s11802-015-2559-3
CrossRef Полный текст | Google Scholar
Луо, В., Бок, К., Ли, Х. Р., Падисак, Дж., и Krienitz, L. (2011). Молекулярное и микроскопическое разнообразие планктонных эукариот в олиготрофном озере Стехлин (Германия). Hydrobiologia 661, 133–143. DOI: 10.1007 / s10750-010-0510-6
CrossRef Полный текст | Google Scholar
Линн, Д. Х. (2008). Ресничные простейшие. Характеристика, классификация и руководство по литературе , 3-е изд. Берлин: Springer.
Google Scholar
Мацек, М., Шимек, К., Пернталер, Дж., Выхналек, В.и Р. Псеннер (1996). Темпы роста доминирующих планктонных инфузорий в двух пресноводных водоемах разной трофической степени. J. Plankt. Res. 18, 463–481. DOI: 10.1093 / планкт / 18.4.463
CrossRef Полный текст | Google Scholar
Марин Б., Палм А., Клингберг М. А. X. и Мелконян М. (2003). Филогения и таксономическая ревизия пластидсодержащих эвгленофитов на основе сравнения последовательностей рДНК SSU и синапоморфных сигнатур во вторичной структуре рРНК SSU. Protist 154, 99–145. DOI: 10.1078 / 143446103764928521
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин, М. (2011). Cutadapt удаляет последовательности адаптеров из операций чтения с высокой пропускной способностью. EMBnet.Journal 17, 10–12. DOI: 10.14806 / ej.17.1.200
CrossRef Полный текст | Google Scholar
Матес, Дж., И Арндт, Х. (1995). Годовой цикл протозоопланктона (инфузорий, жгутиконосцев и саркодинов) по отношению к фито- и метазоопланктону в озере Ноймюлер-Зее (Мекленбург, Германия). Arch. Hydrobiol. 134, 337–358.
Google Scholar
Medinger, R., Nolte, V., Pandey, R.V, Jost, S., Ottenwälder, B., Schlötterer, C., et al. (2010). Разнообразие в скрытом мире: потенциал и ограничения секвенирования следующего поколения для исследований молекулярного разнообразия эукариотических микроорганизмов. Мол. Ecol. 19, 32–40. DOI: 10.1111 / j.1365-294X.2009.04478.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Медлин, Л., Элвуд, Х. Дж., Стикель, С., и Согин, М. Л. (1988). Характеристика ферментативно амплифицированных областей, кодирующих 16S-подобную рРНК эукариот. Ген 71, 491–499. DOI: 10.1016 / 0378-1119 (88)
-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Михайлов И.С., Захарова Ю.Р., Букин Ю.С., Галачянц Ю.П., Петрова Д.П., Сакирко М.В. и др. (2018). Сети совместного возникновения среди бактерий и микробных эукариот озера Байкал во время весеннего цветения фитопланктона. Microb. Ecol. 77, 96–109. DOI: 10.1007 / s00248-018-1212-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монтань, Д. Дж. С., и Линн, Д. Х. (1987). Количественное окрашивание протарголом (QPS) для инфузорий: описание метода и проверка его количественной природы. Mar. Microb. Food Webs 2, 83–93.
Google Scholar
Мюллер, Х. и Геллер, В. (1993). Максимальные темпы роста водных реснитчатых простейших: пересмотр зависимости от размеров тела и температуры. Arch. Hydrobiol. 126, 315–327.
Google Scholar
Мюллер, Х., Шене, А., Пинто-Коэльо, Р. М., Швайцер, А., и Вайсс, Т. (1991). Сезонная гибель инфузорий в Боденском озере. Microb. Ecol. 21, 119–138. DOI: 10.1007 / BF02539148
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накаяма Т., Марин Б., Кранц Х. Д., Сурек Б., Хус В. А. Р., Иноуэ И. и др. (1998). Базальное положение чешуйчатых зеленых жгутиконосцев среди зеленых водорослей (Chlorophyta) выявляется путем анализа кодируемых ядром последовательностей рРНК SSU. Protist 149, 367–380. DOI: 10.1016 / S1434-4610 (98) 70043-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нольте, В., Пандей, Р. В., Йост, С., Мединджер, Р., Оттенвельдер, Б., Бенигк, Дж., И др. (2010). Контрастное сезонное разделение ниш между редкими и многочисленными таксонами скрывает степень разнообразия протистов. Мол. Ecol. 19, 2908–2915. DOI: 10.1111 / j.1365-294X.2010.04669.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петру, К., и Нильсен, Д. А. (2018). Поглощение диметилсульфониопропионата (DMSP) диатомовыми водорослями Thalassiosira weissflogii : модель для исследования клеточной функции DMSP. Биогеохимия 141, 265–271. DOI: 10.1007 / s10533-018-0507-1
CrossRef Полный текст | Google Scholar
Пфистер, Г., Зоннтаг, Б., и Пош, Т. (1999). Сравнение прямого подсчета живых организмов и улучшенного количественного окрашивания протарголом (QPS) при определении численности и клеточных объемов пелагических пресноводных простейших. Aquat. Microb. Ecol. 18, 95–103. DOI: 10.3354 / ame018095
CrossRef Полный текст | Google Scholar
Пош, Т., Эугстер, Б., Помати, Ф., Пернталер, Дж., Питч, Г., и Эккерт, Э. М. (2015). Сеть взаимодействий между инфузориями и фитопланктоном весной. Фронт. Microbiol. 6: 1289. DOI: 10.3389 / fmicb.2015.01289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Posch, T., Köster, O., Salcher, M. M., and Pernthaler, J.(2012). Вредные нитчатые цианобактерии, которым способствует снижение круговорота воды при потеплении озера. Нат. Клим. Изменить 2, 809–813. DOI: 10.1038 / nclimate1581
CrossRef Полный текст | Google Scholar
Сантоферрара, Л. Ф., Граттепанче, Ж.-Д., Кац, Л. А., и Макманус, Г. Б. (2014). Пиросеквенирование для оценки разнообразия эукариотических микробов: анализ данных о морских планктонных инфузориях и сравнение с традиционными методами. Environ. Microbiol. 16, 2752–2763.DOI: 10.1111 / 1462-2920.12380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантоферрара, Л. Ф., Граттепанче, Ж.-Д., Кац, Л. А., и Макманус, Г. Б. (2016). Паттерны и процессы в микробной биогеографии: дают ли молекулы и морфологии одинаковые ответы? ISME J. 10, 1779–1790. DOI: 10.1038 / ismej.2015.224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шакья, М., Айва, К., Кэмпбелл, Дж. Х., Янг, З. К., Шадт, К.W., and Podar, M. (2013). Сравнительная характеристика метагеномного и микробного разнообразия рРНК с использованием синтетических сообществ архей и бактерий. Environ. Microbiol. 15, 1882–1899. DOI: 10.1111 / 1462-2920.12086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шимек, К., Бобкова, Дж., Мацек, М., Недома, Дж., И Псеннер, Р. (1995). Выпас инфузорий на пикопланктоне в эвтрофном водоеме во время летнего максимума фитопланктона: исследование на уровне видов и сообществ. Лимнол. Oceanogr. 40, 1077–1090. DOI: 10.4319 / lo.1995.40.6.1077
CrossRef Полный текст | Google Scholar
Шимек, К., Недома, Дж., Значор, П., Касалицки, В., Езбера, Дж., Хорнак, К., и др. (2014). Точно настроенная симфония факторов модулирует микробную пищевую сеть пресноводного водоема весной. Лимнол. Oceanogr. 59, 1477–1492. DOI: 10.4319 / lo.2014.59.5.1477
CrossRef Полный текст | Google Scholar
Симон, М., Лопес-Гарсия, П., Дешам П., Морейра Д., Ресту Г., Бертолино П. и др. (2015). Выраженная сезонность и высокая пространственная изменчивость сообществ протистов в мелководных пресноводных системах. ISME J. 9, 1941–1953. DOI: 10.1038 / ismej.2015.6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скиббе, О. (1994). Улучшенное количественное окрашивание протарголом инфузорий и других планктонных протистов. Arch. Hydrobiol. 130, 339–347.
Google Scholar
Соммаруга, р.и Р. Псеннер (1993). Наноцилии отряда prostomatida: их значение в микробной пищевой сети мезотрофного озера. Aquat. Sci. 55, 179–187. DOI: 10.1007 / BF00877447
CrossRef Полный текст | Google Scholar
Зоммер, У., Адриан, Р., Де Сенерпонт, Домис, Л., Эльзер, Дж. Дж., Гаедке, У., Ибелингс, Б., и др. (2012). Помимо модели группы экологии планктона (ПЭГ): механизмы, управляющие сукцессией планктона. Annu. Rev. Ecol. Evol. Syst. 43, 429–448.DOI: 10.1146 / annurev-ecolsys-110411-160251
CrossRef Полный текст | Google Scholar
Зоммер, У., Гливич, З. М., Ламперт, В., и Дункан, А. (1986). PEG-модель сезонной сукцессии планктонных явлений в пресных водах. Arch. Hydrobiol. 106, 433–471.
Google Scholar
Зоннтаг, Б., Пош, Т., Кламмер, С., Тойбнер, К., и Псеннер, Р. (2006). Фаготрофные инфузории и жгутиковые в олиготрофном глубоком альпийском озере: контрастная изменчивость в зависимости от сезона и глубины. Aquat. Microb. Ecol. 43, 193–207. DOI: 10.3354 / ame043193
CrossRef Полный текст | Google Scholar
Sonntag, B., Strüder-Kypke, M.C., and Summerer, M. (2008). Uroleptus willii ноя. sp., эупланктонная пресноводная инфузория (Dorsomarginalia, Spirotrichea, Ciliophora) с водорослевыми симбионтами: морфологическое описание, включая филогенетические данные последовательности гена малой субъединицы рРНК и экологические примечания. Денис 23, 279–288.
Google Scholar
Стоук, Т., Басс, Д., Небель, М., Кристен, Р., Джонс, М. Д. М., Брейнер, Х.-В. и др. (2010). Секвенирование ДНК окружающей среды с множественными маркерами и параллельными метками показывает очень сложное сообщество эукариот в морской бескислородной воде. Мол. Ecol. 19, 21–31. DOI: 10.1111 / j.1365-294X.2009.04480.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоук Т., Брейнер Х.-В., Филкер С., Остермайер В., Каммерландер Б. и Зоннтаг Б. (2014). Морфогенетическое исследование планктона инфузорий из горного озера указывает на необходимость маркеров штрих-кода, специфичных для клонов, в микробной экологии. Environ. Microbiol. 16, 430–444. DOI: 10.1111 / 1462-2920.12194
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоук Т., Хейворд Б., Тейлор Г. Т., Варела Р. и Эпштейн С. С. (2006). Подход с использованием нескольких ПЦР-праймеров для доступа к разнообразию микроэукариот в образцах окружающей среды. Protist 157, 31–43. DOI: 10.1016 / j.protis.2005.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоук Т., Кочемс Р., Форстер, Д., Лейзерович, Ф., и Павловски, Дж. (2018). Метабаркодирование сообществ бентосных инфузорий показывает высокий потенциал экологического мониторинга в аквакультуре лосося. Ecol. Индийский. 85, 153–164. DOI: 10.1016 / j.ecolind.2017.10.041
CrossRef Полный текст | Google Scholar
Стрейле, Д. (1998). Распределение биомассы и поток углерода в пелагической пищевой сети Боденского озера. Arch. Hydrobiol. Спец. Проблемы Advanc. Лимнол. 53,545–563.
Google Scholar
Танабэ, А.С., Нагаи, С., Хида, К., Ясуике, М., Фудзивара, А., Накамура, Ю. и др. (2016). Сравнительное исследование пригодности трех регионов гена 18S-рРНК для мониторинга планктонного сообщества эукариот на основе массового параллельного секвенирования. Мол. Ecol. Ресурс. 16, 402–414. DOI: 10.1111 / 1755-0998.12459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тирок, К., Гаедке, У. (2007). Регулирование динамики и функционального состава планктонных инфузорий весной в Боденском озере. Aquat. Microb. Ecol. 49, 87–100. DOI: 10.3354 / ame01127
CrossRef Полный текст | Google Scholar
Трагин, М., Зингон, А., Вауло, Д. (2018). Сравнение состава прибрежного фитопланктона, оцененного по участкам V4 и V9 гена 18S рРНК, с акцентом на фотосинтетические группы и особенно Chlorophyta. Environ. Microbiol. 20, 506–520. DOI: 10.1111 / 1462-2920.13952
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wear, E.К., Уилбэнкс, Э. Г., Нельсон, К. Э., и Карлсон, К. А. (2018). Выбор праймера влияет на численность конкретной популяции, но не на динамику сообщества в ежемесячном анализе ампликона гена 16S рРНК во временном ряду прибрежного морского бактериопланктона. Environ. Microbiol. 20, 2709–2726. DOI: 10.1111 / 1462-2920.14091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вебер А.Т., Павловски Дж. (2013). Можно ли определить численность простейших на основании данных о последовательностях: на примере фораминифер. PLoS One 8: e56739. DOI: 10.1371 / journal.pone.0056739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weisse, T., Müller, H., Pinto-Coelho, R.M., Schweizer, A., Springmann, D., and Baldringer, G. (1990). Ответ микробной петли на весеннее цветение фитопланктона в большом предальпийском озере. Лимнол. Oceanogr. 35, 781–794. DOI: 10.4319 / lo.1990.35.4.0781
CrossRef Полный текст | Google Scholar
Янкова Ю., Нойеншвандер С., Кёстер, О., Пош, Т. (2017). Резкая остановка глубоководного круговорота с потеплением озера: тяжелые последствия для первичных продуцентов водорослей. Sci. Rep. 7: 13770. DOI: 10.1038 / s41598-017-13159-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу Ф., Массана Р., Нот Ф., Мари Д. и Вауло Д. (2005). Картирование пикоэукариот в морских экосистемах с помощью количественной ПЦР гена 18S рРНК. FEMS Microbiol. Ecol. 52, 79–92. DOI: 10.1016 / j.фемсек.2004.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зингель П., Агасильд Х., Ныгес Т. и Кисанд В. (2007). Инфузории являются основными травоядными на пико- и нанопланктоне в мелком, естественно высоко эвтрофном озере. Microb. Ecol. 53, 134–142. DOI: 10.1007 / s00248-006-9155-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zingel, P., and Nõges, T. (2010). Сезонная и годовая динамика численности инфузорий мелководного эвтрофного озера. Фонд. Прил. Лимнол. 176, 133–143. DOI: 10.1127 / 1863-9135 / 2010 / 0176-0133
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Extrusome — обзор | ScienceDirect Topics
3.3.3 Биогенез плотных сердцевинных секреторных везикул и транспортировка
Paramecium и TetrahymenaКак обычно с плотными сердцевинными секреторными пузырьками, биогенез «экструзом» инфузорий начинается в ER. Что касается прохождения элементов-предшественников трихоцисты через аппарат Гольджи, существуют разные доказательства.Во-первых, иммуно-ЭМ локализация основных белков содержимого предполагает транзит через транс-Гольджи в Paramecium (Garreau De Loubresse, 1993; Vayssié et al., 2001) и в Tetrahymena (Turkewitz et al., 1991). Во-вторых, антиген, соединяющий матрикс трихоцисты с мембраной органеллы, также может быть локализован в аппарате Гольджи (Momayezi et al., 1993). В-третьих, паттерн гликозилирования, полученный в результате исследований связывания лектина (Glas-Albrecht et al., 1990), особенно включение сайтов фукозилирования (Allen et al., 1988), предполагает такой путь.
В Paramecium мембрана трихоцисты, вероятно, снабжена v (R) -SNAREs, тип Pt Syb5 (Schilde et al., 2010), как обсуждается ниже. Небольшие G-белки также подвергались воздействию с помощью GTP-оверлеев, и сообщалось о различиях между секретирующими и несекретирующими клетками (Peterson, 1991). Однако любые молекулярные детали требуют изучения. В этом направлении необходимо учитывать не только способность стыковки и слияния, необходимую для экзоцитоза, но и множественные слияния везикул предшественников трихоцисты (Garreau De Loubresse, 1993; Gautier et al., 1994).
Поразительно, но трихоцисты содержат H + -АТФазу (Wassmer et al., 2005, 2006), хотя они не являются особенно кислыми компартментами (Garreau De Loubresse et al., 1994; Lumpert et al., 1992). Везикулы-предшественники также не являются кислыми (Garreau De Loubresse et al., 1994). Здесь протоны могут способствовать сборке белков матрикса трихоцисты (tmx, трихинины) в кристаллической форме, и это может быть связано с посттрансляционным процессингом, который, в свою очередь, обеспечивает стыковку с клеточной мембраной (Gautier et al., 1994). Фактически, обменник Me + / H + , монензин, блокирует созревание и транспорт трихоцист (Garreau De Loubresse et al., 1994). Всякий раз, когда у мутантов или в результате экспериментальных манипуляций протеолитическое расщепление протрихинина не удается, морфология трихоцист с помощью ЭМ является аберрантной, и доставка к клеточной мембране не происходит (Gautier et al., 1994; Pollack, 1974; Pouphile et al., 1986). Наиболее кислые трихинины (Tindall, 1986) могут улавливать протоны и, таким образом, скрывать их присутствие при анализе цвета.Обмен протонов на другие ионы также может иметь значение для сборки матрикса трихоцисты.
С плотными ядерно-секреторными пузырьками Tetrahymena («мукоцисты») можно было бы ожидать аналогичной ситуации, поскольку они также содержат кислые белки (Bowman et al., 2005a; Chilcoat et al., 1996) и созревают в результате протеолитического расщепления. также встречается (Turkewitz et al., 1991; Verbsky, Turkewitz, 1998). Фактически, несколько аспектов, относящихся к Paramecium , также актуальны для Tetrahymena (Bowman et al., 2005a; Брэдшоу и др., 2003; Туркевиц и др., 1991). Опять же доступны различные мутации (Bowman and Turkewitz, 2001; Orias et al., 1983). На этом фоне удивительно, что сборка белков ядра содержимого слизистых (Grl = решетка гранул) может подвергаться кристаллизации еще в ER (Cowan et al., 2005). Было бы интересно посмотреть, обладают ли мукоцисты аналогичным набором H + -АТФазы, как трихоцисты, и как это способствует переработке и конденсации содержимого.
В области кончика слизистой оболочки Tetrahymena накапливается независимая растворимая группа белков (Grt = кончик гранулы), определяемая С-концевым β / γ-кристаллиновым доменом (Bowman et al., 2005b; Rahaman et al., 2009 г.). Белки-гомологи также встречаются в Paramecium (неопубликованное наблюдение). В то время как белки кристаллического матрикса служат для быстрой деконденсации содержимого, вытесняя трихоцисты при стимуляции Ca 2+ -зависимым образом (раздел 7), функция кристаллиноподобных растворимых белков еще предстоит определить.Стоит отметить, что белки Grt описываются как липкие (Rahaman et al., 2009) и что кончики трихоцист содержат растворимые липкие секреторные лектины (Haacke-Bell and Plattner, 1987), пути переноса которых еще не проанализированы. В Tetrahymena , белки Grl и Grt, соответственно, как предполагается, сортируются по независимым путям (Rahaman et al., 2009).
Подкисление или pH-зависимое созревание компонентов секреторного матрикса — что определяет трафик? Чтобы решить этот вопрос, необходимо манипулировать компонентами H + -АТФазы и эндопептидазы (Collins and Wilhelm, 1981), ответственной за процессинг секреторного белка.Фактически, ингибирование протеаз семейства субтилизина или катепсина в T. thermophila вызывает задержку процессинга белков матрикса слизистой оболочки (Bradshaw et al., 2003). (Обратите внимание, однако, что Elde et al., 2007, напротив, предполагают отсутствие «конвертазы» у T. thermophila и P. tetraurelia , основываясь на поиске в базе данных.) Эндопротеазы субтилизинового типа являются установленными ферментами. для секреторного процессинга пропротеина в клетках млекопитающих (Rouillé et al., 1995).Примечательно, что в Tetrahymena катепсин следует секреторному пути (Раздел 4.2). Также пептид, отщепленный от белков Grl в Tetrahymena , проходит конститутивный экзоцитотический путь (Bowman et al., 2005a), как и в (β-) клетках поджелудочной железы млекопитающих (Arvan et al., 1991). Также в этом клеточном типе подкисление секреторной органеллой H + -АТФаза является обязательной для конверсии секреторного пропротеина → белок за счет активности кислотной эндопротеазы (Sun-Wada et al., 2006).Таким образом, ответ на вопрос вверху говорит о том, что и у инфузорий оба фактора важны, поскольку они обусловливают друг друга.
Биогенез зрелых хромаффинных гранул путем гомотипического слияния органелл-предшественников нуждается в синтаксине 6 (Urbé et al., 1998). Для Paramecium у нас есть убедительные доказательства релевантности Pt Syb5, основанные на том факте, что избыточная экспрессия в качестве слитого с GFP белка изменяет процессинг трихоцисты (Schilde et al., 2010) способом, напоминающим мутанты, описанные в Paramecium (Vayssié et al., 2001), а также в слизистых оболочках Tetrahymena (Bowman, Turkewitz, 2001).
У нас есть доказательства перекрестного взаимодействия между просветной и цитоплазматической сторонами трихоцист, некоторые детали представлены в Разделе 3.3.3. Какие могут быть сигналы? В клетках желез млекопитающих взаимодействие просвета с цитоплазматической стороной может быть опосредовано синколлином и люменальным GPI-заякоренным белком (Kalus et al., 2002) или трансмембранным белком, фогрином, а также различными белками просвета, заякоренными α-спираль (Dikeakos, Reudelhuber, 2007).В Paramecium некоторые моноклональные антитела после быстрого замораживания и замораживания-замещения распознают хрупкие периодические связи, расположенные между матрицей трихоцисты и мембраной (Momayezi et al., 1993), так что появляется возможность своего рода трансмембранных перекрестных помех. Когда предшественники трихинина не расщепляются, как в мутанте tl (без трихинина) (Pollack, 1974), они секретируются многочисленными небольшими везикулами-предшественниками трихинина по конститутивному пути (Madeddu et al., 1994).
Оглядываясь назад на транспортировку из отделения неотложной помощи через аппарат Гольджи и далее, мы подчеркиваем следующие важные открытия. По крайней мере, некоторые из SNAREs вместе с некоторыми SUs H + -ATPase вставляются в мембрану ER и сопровождаются к аппарату Гольджи с помощью очень интригующих молекулярных взаимодействий (еще не известных в деталях по инфузориям). Оттуда молекулы могут передаваться потоком везикул к другим частям пути переноса, включая секреторные компоненты.Хотя есть основания предполагать подобный сценарий для инфузорий, эти аспекты еще не были проанализированы подробно. В частности, от инфузорий мы знаем, что правильная обработка и сборка секреторного содержимого необходимы для доставки дальше по секреторному пути. В Paramecium это зависит от активности органеллярной H + -АТФазы. До сих пор существуют лишь косвенные доказательства наличия R-SNARE в мембране трихоцисты.
Lohmanniella oviformis Leegaard 1915 СМИ — Энциклопедия жизни
Рис. 1b Leegardiella sol Линейные рисунки клеток, окрашенных протарголом, показывающие кинети, структуры полости рта и ядра
Рис. 1a Leegardiella sol Линия окрашенных протарголом клеток
Рис.2 Фиксированная клетка Leegardiella sol Lugol, апикальная область
Рис.3 Фиксированная клетка Leegardiella sol Lugol, антапикальная область
Рис.4 Leegardiella sol — фиксированная клетка Люголя, вид сбоку
Рис. 5. Фиксированные и окрашенные DAPI клетки Leegardiella sol Lugol, иллюстрирующие форму ядра.
Рис. 6. Leegardiella sol — окраска протарголом, вид с апикального конца: окрашены реснички полости рта с поддерживающими структурами цитоскелета, микро- и макронуклеусы.
Рис. 7. Окраска Leegardiella sol протарголом, вид с апикального конца: окрашены реснички полости рта с поддерживающими структурами цитоскелета, микро- и макронуклеусы.
Рис. 8. Окраска Leegardiella sol протарголом.Апикальный вид, показывающий основания внешних поликинетид и поддерживающие структуры цитоскелета.
Рис. 9. Окраска Leegardiella sol протарголом. Апикальный вид EPks с видимыми внутренним (стрелка влево) и внешним (стрелка вправо) сегментами
Рис. 10. Фиксированная клетка Leegardiella sol Lugol, вид сбоку.
Рис. 1a: Линейный рисунок клетки, окрашенной протарголом Lohmanniella oviformis, демонстрирующий кинети, структуры ротовой полости и ядро
Рис. 1b: Линейные рисунки клеток, окрашенных протарголом Lohmanniella oviformis, демонстрирующие кинети, структуры ротовой полости и ядро
Рис.2: Фиксированная клетка Lohmanniella oviformis Lugol, вид сбоку
Рис.3: Фиксированная клетка Lohmanniella oviformis Lugol, вид сбоку
Рис.4: Фиксированная клетка Lohmanniella oviformis Lugol, аборальный вид
Рис. 6. Клетка, окрашенная протарголом Lohmanniella oviformis, вид сбоку, показаны EPZ и макронуклеусы.
Рис. 7. Клетка, окрашенная протарголом Lohmanniella oviformis, вид сбоку, показаны EPZ, соматические кинети и макронуклеусы.
Рис. 8. Клетка, окрашенная протарголом Lohmanniella oviformis, вид сбоку, показаны EPZ и макронуклеусы.
Рис.9: Клетка, окрашенная протарголом Lohmanniella oviformis, вид сбоку, показывая EPZ и макронуклеус
Рис.10: Фиксированная клетка Lohmanniella oviformis Lugol
Рис.11: Фиксированная клетка Lohmanniella oviformis Lugol
Рис.12: Фиксированная клетка Lohmanniella oviformis Lugol
Являются ли кишечные эукариоты полезными или полезными?
Образец цитирования: Лукеш Дж., Стенсволд CR, Йирко-Помайбикова К., Вегенер Парфри Л. (2015) Полезны ли кишечные эукариоты человека или комменсалы? PLoS Pathog 11 (8): e1005039.https://doi.org/10.1371/journal.ppat.1005039
Редактор: Лаура Дж. Нолл, Медицинская школа Университета Висконсина, США
Опубликовано: 13 августа 2015 г.
Авторские права: © 2015 Lukeš et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Финансирование: Эта работа была поддержана Чешское грантовое агентство P305 / 12/2261, соглашение о Modbiolin FP7 316304, награда Praemium Academiae для JL и исследовательский грант HFSP RGY0078 / 2015 для KJP и LWP.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Множественные биомы (виром, микробиом и эукариом) регулируют здоровье человека
С момента появления микробиологии было хорошо известно, что в каждом человеческом теле находится множество микробов. Масштабы нашей микробной системы лучше всего отражаются широко обсуждаемым соотношением одной человеческой клетки к десяти микробам.Действительно, люди и другие млекопитающие живут в консорциуме, состоящем из обширных массивов вирусов (их обычно называют виромами), архей и бактерий (то есть микробиома), а также грибов и других одноклеточных и многоклеточных эукариот (протистов и гельминтов, т. соответственно) исторически считались «паразитами». Появление секвенирования следующего поколения (NGS) впервые позволило глубже понять не только состав этого «микробного зоопарка», но и его динамику в зависимости от возраста, диеты, здоровья, пола и географического положения хозяина.Внимание сосредоточено в первую очередь на бактериальном микробиоме, который составляет наиболее многочисленный и разнообразный сегмент экосистемы кишечника человека. Однако мы утверждаем, что эукариоты играют важную, но в значительной степени непризнанную роль, и что мы можем многое выиграть, обратив наше внимание на эукариотических членов экосистемы кишечника.
Эукариома в первую очередь комменсальная
В кишечнике человека обитают разнообразные эукариоты, в том числе простейшие, грибы и гельминты [1,2], и мы предлагаем обозначение «эукариома» для этой коллекции, что кажется более практичным, чем ранее предложенный «эукариотом» »[3].Исторически любые виды протистов или гельминтов, обнаруженные у людей, считались паразитами и предполагалось, что они оказывают патогенное действие на организм-хозяин [2]. Патогенность, безусловно, является правилом для некоторых кишечных протистов, таких как Cryptosporidium spp. и Entamoeba histolytica , а также для гельминтов Ascaris lumbricoides и Strongyloides stercoralis , особенно при тяжелых инфекциях или у истощенных или ослабленных иммунитетом хозяев [4]. Однако критическая оценка литературы показывает, что для ряда связанных с человеком простейших и гельминтов трудно найти однозначные данные об их патогенности (см. Обзор [5]).
Новые данные свидетельствуют о том, что многие обычные эукариотические жители кишечника человека являются комменсальными или полезными, а не паразитическими, по крайней мере, в некоторых контекстах. Например, протист кишечника Blastocystis (рис. 1A), часто связанный в литературе с желудочно-кишечными заболеваниями, очень распространен и присутствует у 10–100% опрошенных (см. Обзор [6]). Интересно, что в нескольких недавних исследованиях было обнаружено, что Blastocystis часто встречается у здоровых людей [7], иногда с большей распространенностью, чем у лиц с желудочно-кишечными заболеваниями [8].Более того, имеющиеся данные предполагают, что другой протист, Dientamoeba fragilis (рис. 1E), играет аналогичную изменчивую экологическую роль в экосистеме кишечника человека, иногда связанную с заболеванием [9], но также широко распространенную у здоровых людей [7,8].
Рис. 1.
Типичные симбионты протистов, которые являются частью эукариома кишечника человека: (A) Stramenopile Blastocystis hominis ; (B) дипломонадид Enteromonas hominis ; (C) retortamonadid Retortamonas inventoryis ; (D) трихомонадид Pentratrichomonas hominis ; (E) tritrichomonadid Dientamoeba fragilis ; (F) ретортамонадид Chilomastix mesnili ; (G) амебозои Entamoeba hartmani ; (H) Endolimax nana ; (I) Entamoeba coli ; (J) Entamoeba dispar ; (K) кокцидий Isospora belli ; (L) амебозоан Iodamoeba buetschli ; (M) микроспоридиан Encephalitozoon cuniculi ; (N) аскомицет Candida albicans .Увеличение в том же масштабе (шкала = 5 мкм). Живые клетки (A, J – M), клетки, окрашенные протарголом (B – D, F), клетки, окрашенные трихромом (E), клетки, окрашенные по Гимзе (G), клетки, окрашенные йодом (H), и клетки, окрашенные трихромом Гомори (H), и клетки, окрашенные трихромом. окрашенная клетка (I). Фотографии любезно предоставлены К. Йирко-Помайбиковой (A, I, L), Иваном Чепичкой (B, C, E, F) (Карлов университет, Прага), Ярославом Кульда (D) (Карлов университет, Прага), Марианн Леббад (G, H) (Агентство общественного здравоохранения, Сольна, Швеция), Мартин Костка (I) (Университет Южной Богемии, Ческе-Будеевице), Иржи Вавра (K) (Карлов университет, Прага), Мартин Квач и Богуш Сак (M) (Институт паразитологии, Ческе-Будейовице) и Мирослав Коларжик (н.) (Институт микробиологии, Прага).
https://doi.org/10.1371/journal.ppat.1005039.g001
Что отличает патогенных эукариот (настоящих паразитов) от комменсалов и мутуалистов? Остается много вопросов, но, вероятно, важны организменные факторы, такие как продолжительность инфекции и / или колонизация и локализация в кишечнике. Организмы, вызывающие острое заболевание и провоцирующие иммунный ответ, который приводит к быстрому исчезновению и долгосрочному иммунитету (например, большинство Microsporidia (рис. 1M), Cryptosporidium spp., и Giardia Кишечник ) являются настоящими паразитами. На другом конце спектра мы находим полезных эукариот, которые на протяжении всей жизни устанавливают ассоциации со своим хозяином, включая переваривающих целлюлозу инфузорий и жгутиконосцев у травоядных [1]. Между ними существует множество эукариотических организмов, которые стабильно колонизируют кишечник в течение длительных периодов времени и, по-видимому, хорошо переносятся иммунной системой, в том числе Entamoeba coli , Blastocystis и Dientamoeba .Также важна локализация в кишечнике. Настоящие паразиты, такие как Entamoeba histolytica , проникают в ткани хозяина и мигрируют из кишечника, вызывая поражения, абсцессы и воспаления в кишечнике и по всему телу. Напротив, комменсальные отношения более вероятны для тех организмов, которые ограничены просветом кишечника, как показано на примере Escherichia coli , Blastocystis , Dientamoeba , Enteromonas hominis (рис. 1B) и Retortamonas. (Рис. 1C).Более того, природа взаимоотношений хозяин-эукариот будет меняться в зависимости от контекста хозяина и экосистемы кишечника, так что один и тот же организм может быть паразитическим в одних случаях и комменсальным в других. Статус питания и здоровье хозяина явно важны в этом уравнении. Например, симбионты будут по-разному влиять на здоровых людей с постоянным доступом к пище, богатой витаминами и микроэлементами (что характерно для граждан промышленно развитых стран), по сравнению с недоедающими людьми или людьми с ослабленным иммунитетом.
Полезна ли эукариома в целом? Мы не знаем, и явных случаев появления полезных эукариот в кишечнике человека немного. Тем не менее, новые открытия в различных областях предполагают, что мы можем игнорировать возможные полезные роли эукариома на свой страх и риск. Потенциальные преимущества эукариома могут быть связаны с увеличением разнообразия в целом или со способностью эукариот модулировать иммунную систему хозяина, каждая из которых может вызывать изменения физиологии хозяина и экосистемы кишечника в целом.
Разнообразие эукариом и экосистемы кишечника
Разнообразие эукариом в целом может быть полезным.Высокое разнообразие всех компонентов кишечной экосистемы, включая эукариому, связано со здоровыми людьми и более низкой частотой аутоиммунных и воспалительных заболеваний [10–12]. Эукариоты в кишечнике могут сигнализировать или даже стимулировать большее разнообразие в целом. Разнообразие бактерий выше в присутствии Entamoeba (рис. 1G, 1I и 1J) и некоторых нематод в кишечнике [13,14], но другие не заметили этого эффекта [15,16]. Однако разнообразие эукариом значительно ниже в промышленно развитых популяциях по сравнению с популяциями с традиционным образом жизни [7], как это было показано для бактерий [12,17].Это результат изменения образа жизни (например, повышение уровня гигиены), а также целенаправленного удаления. Как упоминалось выше, большинство эукариот, обнаруживаемых в нашем организме, исторически считались паразитами и предполагалось, что они оказывают негативное воздействие. Таким образом, врачи (почти всегда) обучаются их удалению даже у бессимптомных пациентов [18,19]. Эффективные лекарства, нарушающие их жизненные циклы, стоят за фактическим уничтожением большинства протистов и гельминтов в популяциях промышленно развитых стран [20], что считается успехом их медицинских систем.Однако истинная картина, возможно, намного сложнее, тем более, что устранение эукариот связано с увеличением числа иммуноопосредованных и воспалительных заболеваний [10,11,20,21]. Действительно, быстрое увеличение аутоиммунных и воспалительных заболеваний, включая болезнь Крона, язвенный колит, различные аллергии, ревматический артрит и другие, прочно связаны с изменениями микробиома кишечника [11,12,22]. На фоне этих изменений мы предполагаем, что общая редкость или даже отсутствие кишечных эукариот вносит значительный вклад в это негативное развитие.
Модуляция иммунной системы
Определенные эукариоты в экосистеме кишечника также могут иметь положительные эффекты, связанные с их способностью модулировать иммунную систему хозяина, что хорошо известно для гельминтов. Положительная роль гельминтов в эукариоме подтверждается отрицательной корреляцией между их присутствием и заболеваемостью иммуноопосредованным заболеванием, а также исследованиями, документально подтверждающими рост симптомов заболевания после избавления от паразитов [10,20]. Действительно, прямое введение гельминтов (терапия гельминтов) в качестве профилактического или терапевтического средства часто было успешным в предотвращении или лечении аутоиммунных и воспалительных заболеваний [10,11,20,21], с важными контрпримерами.Хотя в настоящее время не исследованы возможные иммуномодулирующие роли Blastocystis , Dientamoeba и других распространенных кишечных протистов, которые эволюционировали вместе с людьми, стоит тщательно изучить. Одним из механизмов действия является стимуляция выработки слизи с помощью цитокина IL-22, который облегчает симптомы колита, улучшая здоровье кишечника [23]. Такого рода косвенные эффекты могут быть более распространенными, чем принято сейчас считать, потому что мы не искали их. Возможно, Blastocystis чаще встречается у здоровых людей, поскольку помогает поддерживать здоровый слой слизи в кишечнике либо напрямую, либо посредством взаимодействия с полезными бактериями или иммунной системой.
Переосмысление термина «паразит»
В свете нашего развивающегося понимания эукариот, связанных с людьми и другими хозяевами, мы предлагаем называть их симбионтами, а не паразитами, чтобы уловить разнообразие их экологических ролей. Термин «симбионт» охватывает все организмы, связанные с хозяином, во всем спектре возможных взаимоотношений (полезных, вредных или нейтральных). Это изменение названия является частью общего отхода от рассмотрения эукариома как вредного по своей природе, отражая сдвиг во взглядах, который уже произошел для бактерий, когда мы узнали больше о жизненно важной и полезной роли бактериального микробиома в кишечнике человека [24].Многие кишечные эукариоты являются комменсальными [2,5] или полезными, например, инфузории и жгутиконосцы, расщепляющие целлюлозу (см. Обзор [1]).
Эукариома и ее связь с микробиомом
Эукариотические микробы эволюционировали вместе с млекопитающими на протяжении миллионов лет и являются нормальным компонентом микробиома с эволюционной точки зрения [7,11]. Многие из них являются стабильными, долгосрочными колонистами, а не временными захватчиками [25]. Эукариома может оказывать сильное влияние на состав и динамику микробиома [14], вероятно, с каскадными последствиями для нашего здоровья.Хотя живущие в кишечнике эукариоты менее многочисленны, чем бактерии, они намного крупнее и могут иметь непропорционально большое влияние, как и крупные животные в других экосистемах. Например, акулы на тропических рифах и волки в Йеллоустоне оказывают сильное влияние на всю экосистему, и удаление этих ключевых видов имеет широкие последствия. Стоит проверить, способствовало ли целевое удаление эукариот — потенциальных ключевых компонентов микробиома кишечника — в промышленно развитых странах непропорционально большой потере разнообразия, наблюдаемой в бактериальном микробиоме [12], и другим негативным последствиям для здоровья, о которых говорилось выше.Таким образом, существует много захватывающих перспектив для исследования потенциальных преимуществ эукариома человека, при этом следует помнить о хорошо задокументированном пагубном воздействии некоторых эукариотических симбионтов, особенно когда они присутствуют в больших количествах и у млекопитающих-хозяев, испытывающих ограничение в питании [26].
Перспективы на будущее
- Обращение к симбионтам кишечных эукариотических микробов — к которым относятся мутуалисты, комменсалы и паразиты — а не паразитами, свидетельствует о разнообразных взаимодействиях, которые они имеют с хозяевами, помимо патогенности.
- Существует необходимость изменить терапевтические стратегии, чтобы нацелить устранение только явно патогенных видов — настоящих паразитов — из организмов-хозяев, избегая при этом удаления безвредных или комменсальных видов.
- Сейчас подходящее время для определения разнообразия эукариотических микробов в здоровой человеческой популяции с помощью NGS и выяснения их взаимоотношений с бактериальными сообществами.
- Характеристика эукариотических микробов позволит нам связать наличие или отсутствие различных эукариотических микробов с заболеваниями человека.
- С целью вернуть некоторые из «потерянных» кишечных эукариот, необходимо провести контролируемую колонизацию комменсальными эукариотами у людей-добровольцев, чтобы подтвердить прогнозируемое положительное влияние на диверсификацию микробиома кишечника человека.
- В случае успеха, эти испытания должны сопровождаться контролируемыми инфекциями пациентов, например, с функциональными и органическими желудочно-кишечными заболеваниями, с целью информирования о новых подходах к лечению таких заболеваний.
Список литературы
- 1.Парфри Л. В., Уолтерс В. А., Найт Р. (2011). Микробные эукариоты в микробиоме человека: экология, эволюция и направления будущего. Микробиол фронтального заражения клеток 2: 1–6.
- 2. Богитш Б.Дж., Картер С.Е., Оельтманн Т.Н. (2012). Паразитология человека, 4-е издание. Elsevier Academic Press, Сан-Диего, США; 430 с.
- 3. Андерсен Л.О., Нильсен Х.В., Стенсволд CR (2013). В ожидании кишечного эукариотома человека. ISME J 7: 1253–1255. pmid: 23407309
- 4.Льютуэйт П., Гилл Г. В., Харт Калифорния, Бичинг, штат Нью-Джерси (2005). Желудочно-кишечные паразиты у лиц с ослабленным иммунитетом. Curr Opin Infect Dis 18: 427–35. pmid: 16148530
- 5. Лукеш Дж., Кухта Р., Шольц Т., Помайбикова К. (2014) (Само-) заражение паразитами: переосмысление в настоящее время. Тенденции Parasitol 30: 377–385. pmid: 25033775
- 6. Scanlan PD, Stensvold CR, Rajilic-Stojanovic M, Heilig HGHJ, De Vos WM, O’Toole PW, Cotter PD (2014) Микробный эукариот Blastocystis является распространенным и разнообразным членом здоровой кишечной микробиоты человека.FEMS Microb Lett 90: 326–330.
- 7. Парфри Л.В., Уолтерс В.А., Лаубер С.Л., Клементе Дж.С., Берг-Лайонс Д., Тейлинг С., Кодира С., Мохиуддин М., Брунель Дж., Дрисколл М., Фирер Н., Гилберт Дж. А., Найт Р. (2014). Сообщества микробных эукариот в кишечнике млекопитающих в контексте экологического эукариотического разнообразия. Front Microbiol 5: 298. pmid: 24995004
- 8. Россен Н.Г., Барт А., Верхаар Н., ван Нуд Е., Кутте Р., де Гроот П.Ф., Д’Хаенс Г.Р., Понсиоэн С.Ю., ван Гул Т. (2015).Низкая распространенность Blastocystis sp. У пациентов с активным язвенным колитом. Eur J Clin Microbiol Infect Dis 34: 1039–1044. pmid: 25680316
- 9. Барратт Дж. Л. Н., Харкнесс Дж., Марриотт Д., Эллис Дж. Т., Старк Д. (2011). Обзор носительства Dientamoeba fragilis у людей: несколько причин, по которым этот организм следует учитывать при диагностике желудочно-кишечных заболеваний. Кишечные микробы 2: 3–12. pmid: 21637013
- 10. Веласкес-Манофф М (2012).Эпидемия отсутствия. Нью-Йорк, Скрибнер.
- 11. Ладья GAW, Raison CL, Lowry CA (2014). «Старые друзья» микробов, иммунорегуляция и социально-экономический статус. Clin Exp Immunol 177: 1–12. pmid: 24401109
- 12. Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R (2012). Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа 489: 220–230. pmid: 22972295
- 13. Плиекатт Дж. Л., Динонпо Р., Малвенна Дж. П., Краузе Л., Срипа Б., Бетони Дж. М., Бриндли П. (2013) Инфекция канцерогенным печеночным двуустником Opisthorchis viverrini изменяет микробиом кишечника и желчных путей.FASEB J 27: 4572–4584. pmid: 23925654
- 14. Morton ER, Lynch J, Froment A, Lafosse S, Heyer E, Przeworski M, Blekhman R, Segurel L (2015) Изменчивость микробиомов кишечника сельских районов Африки в значительной степени определяется паразитизмом и диетой. http://biorxiv.org/content/early/2015/03/24/016949. По состоянию на 17 июля 2015 г.
- 15. Купер П., Уокер А.В., Рейес Дж., Чико М., Солтер С.Дж., Вака М., Паркхилл Дж. (2013) Патентные инфекции человека, вызывающие власоглав, Trichuris trichiura , не связаны с изменениями в фекальной микробиоте.PLoS One 8: e76573. pmid: 24124574
- 16. Cantacessi C, Giacomin P, Croese J, Zakrzewski M, Sotillo J, McCann L, Nolan MJ, Mitreva M, Krause L, Loukas A (2014). Влияние экспериментальной анкилостомической инфекции на микробиоту кишечника человека. Журнал Infect Dis 210: 1431–1434. pmid: 24795483
- 17. Schnorr SL, Candela M, Rampelli S, Centanni M, Consolandi C, Basaglia G, Turroni S, Biagi E, Peano C, Severgnini M, Fiori J, Gotti R, De Bellis G, Luiselli D, Brigidi P, Mabulla A, Marlowe F, Генри А.Г., Криттенден А.Н. (2014).Микробиом кишечника охотников-собирателей хадза. Nat Commun 5: 3654. pmid: 24736369
- 18. Комитет (1998). Dientamoeba fragilis : безвредный комменсал или легкий патоген? Педиатр Здоровье ребенка 3: 81–82. pmid: 20401204
- 19. Coyle CM, Varughese J, Weiss LM, Tanowitz HB (2012) Blastocystis : лечить или не лечить. Clin Infect Dis 54: 105–110. pmid: 22075794
- 20. Wiria AE, Djuardi Y, Supali T, Sartono E, Yazdanbakhsh M (2012).Гельминтная инфекция в популяциях, переживающих переходный эпидемиологический период: друг или враг? Семин иммунопатол 34: 889–901. pmid: 23129304
- 21. Elliott DE, Weinstock СП (2012). Где мы на червях? Curr Opin Gastroenterol 28: 551–556. pmid: 23079675
- 22. Клементе Дж. К., Урселл Л. К., Парфри Л. В., Рыцарь Р. (2012). Влияние микробиоты кишечника на здоровье человека: комплексный взгляд. Cell 148: 1258–1270. pmid: 22424233
- 23. Леунг Дж. М., Давенпорт М., Вольф М. Дж., Винс К. Э., Абиди В. М., Поляки М. А., Чо И., Ульман Т., Майер Л., Локе П. (2014).Клетки cd4 +, продуцирующие Il-22, истощаются в активно воспаленной ткани колита. Mucosal Immunol 7, 124–133. pmid: 23695510
- 24. Соммер Ф., Бакхед Ф. (2013) Микробиота кишечника — хозяева развития и физиологии. Nat Rev Microbiol 11: 227–38. pmid: 23435359
- 25. Scanlan PD, Стенсволд CR (2013). Blastocystis : разобраться с коварным гостем. Trends Parasitol 29: 523–529. pmid: 24080063
- 26. Graham AL, Hayward AD, Watt KA, Pilkington JG, Pemberton JM, Nussey DH (2010) Фитнес корреляты наследственной изменчивости реактивности антител у диких млекопитающих.Наука 330: 662–665. pmid: 21030656
| [1] | Беренс С., Рюланд С., Инасио Дж. И др. 2003. Доступность малых субъединиц рРНК членов доменов , бактерий , архей и эукариот для Cy3-меченных олигонуклеотидных зондов. Прикладная и экологическая микробиология, 69 (3): 1748–1758. DOI: 10.1128 / AEM.69.3.1748-1758.2003 |
| [2] | Борн Д.Г., Бойетт Х.В., Хендерсон М.Е. и др. 2008. Идентификация инфузорий (Oligohymenophorea: Scuticociliatia), связанных с болезнью коричневой полосы на кораллах Большого Барьерного рифа. Прикладная и экологическая микробиология, 74 (3): 883–888. DOI: 10.1128 / AEM.01124-07 |
| [3] | Chatton E, Lwoff A.1949. Recherches sur les ciliés thigmotriches. Archives de Zoologie Expérimentale et Générale, 86: 169–253 |
| [4] | Делонг Е. Ф., Викхэм Г. С., Пейс Н. Р. 1989. Филогенетические пятна: зонды на основе рибосомной РНК для идентификации отдельных клеток. Наука, 243 (4896): 1360–1363. DOI: 10.1126 / science.2466341 |
| [5] | |
| [6] | Джованнони С. Дж., Делонг Е. Ф., Ослен Дж. Дж. И др.1988. Филогенетические группоспецифичные олигодезоксинуклеотидные зонды для идентификации отдельных микробных клеток. Журнал бактериологии, 170 (2): 720–726. DOI: 10.1128 / JB.170.2.720-726.1988 |
| [7] | Людвиг В., Странк О, Вестрам Р. и др. 2004. ARB: программная среда для данных последовательности. Исследование нуклеиновых кислот, 32 (4): 1363–1371. DOI: 10.1093 / nar / gkh393 |
| [8] | Медлин Л., Элвуд Г. Дж., Стикель С. и др.1988. Характеристика ферментативно амплифицированных областей, кодирующих 16S-подобную рРНК эукариот. Джин, 71 (2): 491–499. DOI: 10.1016 / 0378-1119 (88) -2 |
| [9] | Пернталер Дж., Глёкнер Ф. П., Шёнхубер В. и др. 2001. Флуоресценция in situ гибридизация (FISH) с олигонуклеотидными зондами, нацеленными на рРНК. Методы в микробиологии, 30: 207–226. DOI: 10.1016 / S0580-9517 (01) 30046-6 |
| [10] | Раабе З.1970. Ordo Thigmotricha (Ciliata – Holotricha): II. Familia Hemispeiridae. Acta Protozoologica, 7: 117–180 |
| [11] | Стоук Т., Тейлор Г. Т., Эпштейн С. С. 2003. Новые эукариоты из постоянно бескислородного бассейна Кариако (Карибское море). Прикладная и экологическая микробиология, 69 (9): 5656–5663. DOI: 10.1128 / AEM.69.9.5656-5663.2003 |
| [12] | Уилберт Н.1975. Eine verbesserte Technik der Protargolimprägnation für Ciliaten. Микрокосмос, 64: 171–179 |
| [13] | Сюй Куйдун, Сун Вэйбо. 2003. Паразитические инфузории культивируемых моллюсков. В: Song Weibo, Zhao Yuanjun, Xu Kuidong, et al., Ред. Патогенные простейшие в марикультуре (на китайском языке). Пекин: Science Press, 115–144 |
| [14] | Сюй Куйдун, Сон Вейбо, Уоррен А.2015. Два новых и два малоизвестных вида Ancistrum (Ciliophora, Scuticociliatia, Thigmotrichida), паразитирующие на морских моллюсках из китайских прибрежных вод Желтого моря. Acta Protozoologica, 54 (3): 195–208 |
| [15] | Чжан Цзыфэн, Ли Цзюй, Сюй Куйдун. 2018. Обнаружение и количественная оценка двух паразитических инфузорий Boveria labialis и Boveria subcylindrica (Ciliophora: Scuticociliatia) с помощью флуоресценции гибридизации in situ . |