Резус конфликт матери и отца: 404 — Страница не найдена
Кровь за кровь: что может унаследовать ребенок от родителей | Статьи
В последнее время в России наблюдается рост заболеваний, передающихся по наследству. На тысячу новорожденных детей ими страдают приблизительно 35–40 детей. Врачи рассказали «Известиям», какие болезни и особенности внешности и развития может унаследовать ребенок.
Что может унаследовать ребенок?
Принципы передачи наследственных признаков от родителей детям были сформулированы более полутора столетий назад австрийским биологом, монахом Грегором Иоганном Менделем. Эксперименты Менделя были поняты и признаны лишь спустя полвека после его смерти. Таким образом, классическая генетика появилась в начале XX века, рассказывает «Известиям» терапевт, старший медицинский консультант сервиса «Теледоктор24» Дмитрий Окунев.
— Несмотря на это, сегодня родителей волнуют всё те же вопросы: на кого будет похож малыш, почему он стал обладателем чудесных кудряшек или квадратного подбородка. В этом месте уместно напомнить, что карий цвет глаз и щербинка между передними зубами обусловлены доминантным геном, а ген прямых волос — рецессивный, — объясняет врач.
Фото: Depositphotos/Paha_L
— Если говорить об особенностях наследственных заболеваний, то дочерям от матерей передается не только склонность к полноте и весь спектр характеристик месячного цикла, но даже такое грозное заболевание, как мигрень (связана с уровнем женских половых гормонов), депрессивные состояния, заболевание глаз глаукома и остеопороз, заболевание обмена веществ. При этом главной родительской фигурой для ребенка остается бабушка по материнской линии, — рассказывает собеседник «Известий».
По отцовской линии мальчикам передаются особенности функционирования мужской половой системы, степень облысения и уровень тестостерона. Кроме того, ребенку могут передаться заболевания сердца и зубов.
Группы крови и наследственность
В мире выделяют четыре группы крови, которым соответствуют генотипы: первая (I) 00, вторая (II) АА; А0, третья (III) ВВ; В0 и четвертая (IV) АВ.
— Группа крови и резус-фактор — это белки, которые находятся на поверхности клеток крови, — объясняет медицинский директор Lifetime+ Кирилл Ювченко. — Раньше их классифицировали только на четыре, затем вторую группу разделили на подгруппы A и B. Резус-фактор раньше делили на положительный и отрицательный, но потом стали учитывать еще ряд факторов. В нынешней классификации уже можно выделить 24 группы крови, но, если исходить из классического деления, их по-прежнему четыре.
Первая, или так называемая нулевая, группа не содержит специальных белков на поверхности эритроцитов, которые определяют группу крови. У второй группы крови есть белок типа А. У третьей белок типа B. В четвертой одновременно и белок типа А, и белок типа B.
Фото: РИА Новости/Павел Лисицын
— Вариантов наследования много, — рассказывает собеседник «Известий». — Если у обоих родителей первая группа крови, то у ребенка тоже будет первая группа крови.
В случае, если встречаются родители со второй и третьей группой, тоже возможны любые варианты, поясняет врач.
Наследование резус-фактора
По словам Дмитрия Окунева, принадлежность крови к каждой из групп (система АВО) и наличие резуса считается генетически обусловленной и неизменной.
— Еще во время пребывания малыша в роддоме в 1% случаев встречается гемолитическая болезнь новорожденных — грозное заболевание, сопровождающееся умиранием эритроцитов. Патогенез гемолитической болезни развивается при несовместимости крови матери и плода по резус-фактору и системе АВО, — говорит собеседник «Известий».
Патогенез гемолитической болезни развивается при несовместимости крови матери и плода по резус-фактору и системе АВО, — говорит собеседник «Известий».
Фото: ТАСС/Егор Алеев
Ранняя диагностика гемолитической болезни новорожденных происходит в дородовом периоде. При этом врачи исключают иммунный конфликт матери и плода, определив группу крови и резус-фактор матери и отца. При отрицательном резусе врачи выясняют про ранние беременности, аборты, переливания крови. Во время беременности трижды определяют наличие противорезусных антител и проводят УЗИ.
На что влияет группа крови?
Различие групп в первую очередь влияет на принятие решения по поводу переливания крови, говорит Кирилл Ювченко. В современной медицине не применяют цельную кровь: используют либо плазму, либо эритроцитарную массу. В первом случае группа не имеет значения, так как это жидкая часть крови, клеток в ней не содержится, поэтому неважно, кем был донор.
— А вот при переливании эритроцитов очень важна и группа крови, и резус-фактор, и индивидуальная совместимость. Даже при совпадении группы крови и резус-фактора образцы крови могут друг другу не подойти — просто потому что есть еще множество факторов, которые могут оказаться важны, чтобы появилась несовместимость, — говорит врач.
Фото: РИА Новости/Илья Питалев
Наследуемые болезни, внешность и особенности человека не связаны с группой крови, утверждает собеседник «Известий». Здесь скорее возможна косвенная связь: наследуя один признак (группу крови), человек перенимает от родителей и другие. Если в популяции какая-то группа крови распространена более других, то и другие гены, скорее всего, тоже распространены больше. В том числе и те, что связаны с устойчивостью к различным заболеваниям.
— ВОЗ распределяет факторы, влияющие на здоровье, следующим образом. Генетика — это 20%, внешние факторы среды и экологии — еще 20%, 10% — профилактика, 50% — образ жизни. Генетическая предрасположенность не гарантирует, что заболевание разовьется. Это значит лишь, что риск генетического заболевания у такого человека выше, чем у другого, — резюмирует врач.
Генетическая предрасположенность не гарантирует, что заболевание разовьется. Это значит лишь, что риск генетического заболевания у такого человека выше, чем у другого, — резюмирует врач.
Анализ крови на резус-фактор в Ростове-на-Дону
Что такое резус-фактор
Резус-фактор – это белок, который может содержаться на поверхности эритроцитов человека. Кровь тех, у кого он есть, называют резус-положительной, у кого нет – резус-отрицательной. Наличие или отсутствие этого белка является индивидуальной особенностью, а не патологией.
Особое значение резус-фактор имеет во время беременности. Если у матери положительный резус, то ее кровь будет в любом случае совместима с кровью ребенка, если отрицательный – возможны варианты: в том случае, когда у отца ребенка тоже отрицательный резус-фактор, кровь матери будет совместима с кровью плода, потому что и ребенок унаследует отрицательный резус, когда же у отца положительный резус-фактор, а у матери отрицательный, с вероятностью в 50 % может возникнуть несовместимость крови матери и ребенка – резус-конфликт, который грозит осложнениями.
Для чего используется этот анализ?
-
Для определения риска резус-конфликта между матерью и плодом.
-
Для определения совместимости крови донора и реципиента при переливании крови.
Подготовка к анализу
Для того, чтобы не возникло проблем со взятием крови на анализ, следует воздержаться от курения в течение тридцати минут до процедуры. Рекомендуется снизить употребление жиров за двадцать четыре часа до исследования, а сдавать кровь можно уже через три-четыре часа после легкого приема пищи.
В каких случаях необходимо определить резус-фактор
Перед хирургическими операциями.
При подготовке к переливанию крови или ее компонентов.
Во время беременности для определения совместимости крови матери и ребенка.Где выполняется анализ на резус-фактор в Ростове-на-Дону
Сдать анализ на резус-фактор в Ростове-на-Дону можно в клинико-диагностическом центре “Да Винчи”.
Отзывы об услуге
Резус-фактор, определение генотипа и статуса носительства
Резус-фактором называется антиген D системы группы крови Rhesus. Статус по этому антигену очень важен при переливании крови, беременности, пересадке органов. Белок, формирующий антиген D, кодируется геном RHD. Наличие этого гена даже на одной из двух гомологичных хромосом соответствует резус-положительному (Rh+) статусу. Примерно 85% населения Европы являются носителями этого гена и, соответственно, резус-положительны. При этом около половины всех жителей Европы и России несут одну копию этого гена, а 35% — две. При делеции гена 
При беременности резус-отрицательной женщины важно знать, какой резус-фактор у плода. Дело в том, что если в такой ситуации плод окажется Rh+, то существует вероятность развития резус-конфликта между матерью и плодом, который может привести к возникновению гемолитической болезни плода или новорожденного. Предсказать возможные варианты статуса плода по резус-фактору можно заранее, зная генотип родителей по гену RHD. Скрининговым методом определения резус-фактора является анализ крови на наличие антигена D на поверхности клеток, который позволяет оценить статус Rh+ или Rh-. Однако в случае, когда будущая мать резус-отрицательна, а отец – резус-положителен, для определения возможных вариантов (генотипов) резус-фактора у детей необходимо установить генотип отца по гену RHD. Так, если у отца ген RHD присутствует на обеих гомологичных хромосомах (т.е. отец – гомозигота), то все дети в такой супружеской паре будут резус-положительны. А если на одной из гомологичных хромосом ген RHD отсутствует (т. е. отец – гетерозигота), то в такой супружеской паре дети могут быть как резус-положительны, так и резус-отрицательны.
е. отец – гетерозигота), то в такой супружеской паре дети могут быть как резус-положительны, так и резус-отрицательны.
Также существуют мутации в гене RHD, которые приводят к особым статусам по резус-фактору: Weak D, DEL, Partial D. Такие варианты могут быть неверно или неоднозначно идентифицированы при обычном анализе крови на резус-фактор и могут быть выявлены с помощью генетического анализа гена RHD. Эти особые статусы встречаются очень редко, однако могут быть опасны из-за несоответствия полученного при обычном анализе крови результата реально существующему статусу резус-фактора.
В нашей лаборатории для генотипирования по резус-фактору используется современный метод MLPA, который позволяет выявить статус носительства 0, 1 или 2 копий гена RHD, а также идентифицировать особые мутантные формы этого гена с высокой надежностью и эффективностью.
Резус-фактор у беременной женщины. Плюс на минус? — Семейная Клиника
Есть те вещи, на которые мы можем повлиять, и те, на которые мы повлиять не можем.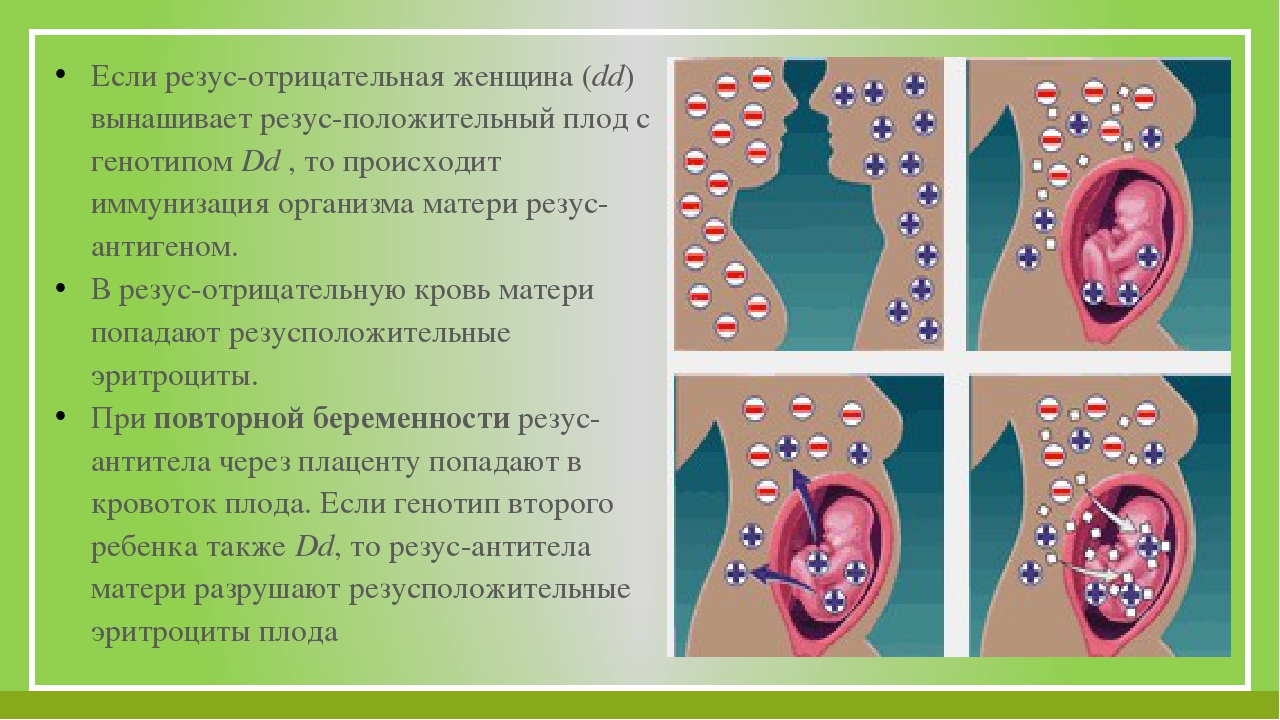
Повлиять на свой резус-фактор и резус-фактор своего ребенка мы не можем, но профилактировать осложнения при беременности и после родов, связанных с резус-конфликтом, мы обязаны.
Давайте по порядку, резус-фактор – это генетически наследуемый признак, наследуется он от родителей. Он может быть положительным и отрицательным. Это показатель присутствия неких антигенов в крови. Изначально определяется он с целью того, чтобы при переливании крови от человека к человеку правильно подбирать доноров, во избежание тяжёлых осложнений. Если вспомнить школьный курс биологии с задачками про горох, то это тот самый случай: когда у резус-положительных родителей, всё же в 25 процентах случаях может родиться резус-отрицательный ребёнок, и подвоха в этом нет, это называется аутосомно-рецессивный тип наследования, а родители гетерозиготы, то есть носители по данному признаку. Не будем углубляться в генетику, важно понимать, что с момента зачатия, как у нас, так и у наших деток многое предопределено: от пола ребёнка, цвета его глаз и темперамента до резус-фактора. И положительный резус-фактор или отрицательный, мы можем лишь констатировать постфактум.
И положительный резус-фактор или отрицательный, мы можем лишь констатировать постфактум.
Почему же такое пристальное внимание резус-фактору беременной? И надо ли ставить профилактические прививки, предупреждающие резус-конфликт, при беременности?.. Часто можно услышать: — «Моя подруга говорит, что при первой беременности пронесёт, можно не ставить». И тут, когда его совсем не ждали, возникает его величество — резус-конфликт.
В чем причина?
Если резус-фактор у беременной женщины положительный, то каким бы не был резус-фактор у плода, то конфликта не будет. Если у женщины резус-фактор отрицательный, а у отца резус-фактор положительный, то плод может унаследовать как положительный, так и отрицательный резус-фактор. Резус-положительный плод может подвергнуться иммунной атаке от резус-отрицательной матери, и это повлияет на его здоровье внутриутробно и после рождения. Это и называется резус-конфликт.
Что делать? В условиях 21 века есть чёткий алгоритм профилактики.
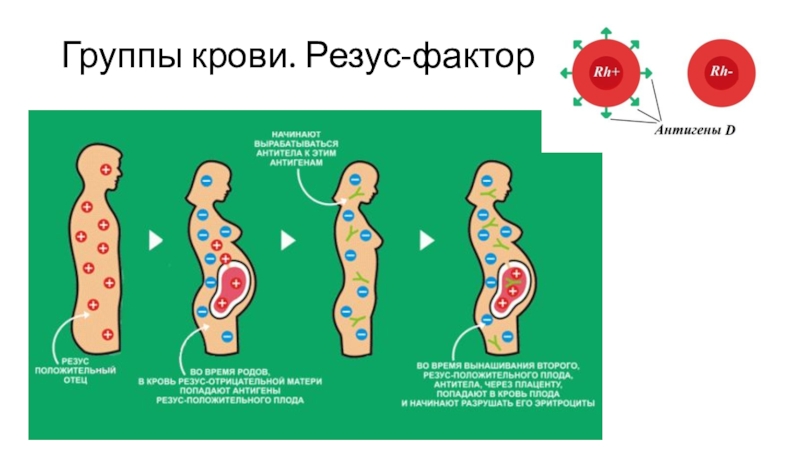
- При постановке на учёт у обоих супругов определяется группа крови и резус-фактор.
- При отрицательном резус-факторе у супруги и положительном резус-факторе у супруга, назначается определение специальных антител 1 раз в месяц.
- При отсутствии таких антител у матери, в 28 недель беременности и после родов женщине предлагают поставить безопасную прививку, которая профилактирует появление конфликта как во время этой, так и в последующие беременности. Поэтому крайне важно в первую беременность провести такое профилактическое мероприятие. Также при угрозе прерывания беременности, кровянистых выделениях в малые сроки беременности, тоже важно поставить такую прививку во избежание резус-осложнений при смешивании крови матери и плода (такого при беременности быть не должно, но возможно в некоторых акушерских ситуациях).
 Если и происходит иммунная атака от женщины к плоду, то это происходит лишь только после 22 недель беременности (даже если антитела, например, выявлены в 10 недель). Поэтому после 22 недели такой беременной женщине необходимо по результатам ультразвуковой диагностики оценивать показатели кровотоков и состояние плода. Необходимо тщательное наблюдение грамотного врача-акушера-гинеколога.
Если и происходит иммунная атака от женщины к плоду, то это происходит лишь только после 22 недель беременности (даже если антитела, например, выявлены в 10 недель). Поэтому после 22 недели такой беременной женщине необходимо по результатам ультразвуковой диагностики оценивать показатели кровотоков и состояние плода. Необходимо тщательное наблюдение грамотного врача-акушера-гинеколога.50 лет назад была сделана первая прививка беременной для внутриутробной профилактики резус-конфликта у плода. Уже 50 лет человек может профилактировать много осложнений, связанных с данной проблемой. Мы не можем повлиять на резус-фактор плода, но можем избежать осложнений резус-конфликта.
Ну и на десерт: Помните стихотворение Сергея Михалкова: «От кареты до ракеты. До чего дошёл прогресс». В настоящее время появились новые возможности определения резус-фактора у плода, начиная с 9 недель беременности, — неинвазивное определение резус-фактора у плода. По венозной крови матери (обычный забор крови из вены у матери) можно по фетальной ДНК плода уже после 9 недель беременности определить какой резус-фактор унаследовал плод. И это, конечно, помогает при определении дальнейшей тактики ведения беременности.
И это, конечно, помогает при определении дальнейшей тактики ведения беременности.
Такую насыщенную терминами, генетическими понятиями информацию важно обсудить с вашим акушером-гинекологом. Без лишней паники, советов подруг и интернет-форумов. Действия во время беременности должны быть проверенными и обоснованными. Также и информация от доктора должна быть понятной и доступной для будущей мамы.
Врачи акушеры-гинекологи СЕМЕЙНОЙ КЛИНИКИ имеют большой опыт ведения беременных женщин, в том числе, с резус-конфликтной беременностью. И мы уже много раз с большой радостью поздравляли наших пациенток с рождением долгожданных и здоровых малышей.
Определение пола ребенка — VMC Verte medical clinic
Определение пола будущего ребенка и его резус фактор интересует практически каждую беременную женщину. Казалось бы, какая разница в том, какого пола будет малыш, ведь самое главное, чтобы младенец родился здоровым. Тем не менее, даже, несмотря на банальную любознательность, определение пола будущего ребенка для матери, является очень важным фактором. В особенности это касается тех женщин, которые могут быть потенциальными носителями всякого рода генетических болезней, которые связаны с полом ребёнка. Что касается определения резус фактора плода, то такие данные необходимы для женщин с резус-отрицательной группой крови, у которых может быть вероятность появления гемолитической болезни плода. Стоит заметить, что процесс определения пола ребенка по родительской крови возможен и к тому же, совсем не сложен.
Тем не менее, даже, несмотря на банальную любознательность, определение пола будущего ребенка для матери, является очень важным фактором. В особенности это касается тех женщин, которые могут быть потенциальными носителями всякого рода генетических болезней, которые связаны с полом ребёнка. Что касается определения резус фактора плода, то такие данные необходимы для женщин с резус-отрицательной группой крови, у которых может быть вероятность появления гемолитической болезни плода. Стоит заметить, что процесс определения пола ребенка по родительской крови возможен и к тому же, совсем не сложен.
В наши дни нахождение ДНК плода в составе материнской крови относится к категории достоверных и безопасных методов определения пола будущего малыша. Данный метод заключается в анализе, устанавливающем присутствие или же отсутствие, так называемого гена SRY, являющимся характерным для плода мужского пола. Другими словами, обнаружение данного гена свидетельствует о мужском начале будущего ребёнка.
Будущая мать может пройти тестирование, связанное с определение пола будущего ребёнка, начиная с 8-ой недели беременности, а для установления резус фактора плода потребуется дождаться 10-ой недели. Стоит отметить, высокую точность данного метода определения пола ребенка. Итоги данных тестирований могут быть получены уже через неделю. Связано это с тем, что каждый анализ необходимо провести дважды, дабы получить максимально достоверный результат.
Медицинская клиника “Здоровая семья” предоставляет профессиональную помощь в данном вопросе, посредством популярного метода определения пола и резус фактора ребенка по крови матери (родителей). Наши высококвалифицированные медицинские работники проведут такого рода тестирование, определяющее пол, а также резус фактор ребенка на высоком профессиональном уровне, посредством использования высокотехнологичного оборудования.
Определение пола плода, является порой необходимым процессом, который зачастую сопровождается различного рода сложными расчетами, к примеру, с помощью специальных календарей, УЗИ и т. д. Некоторые родители готовы платить любые деньги за точное определение пола будущего ребенка. Зачастую прогнозы такого рода попадают в “десятку”. Однако, на сегодняшний день, официальная наука не признаёт данные способы определение пола ребенка максимально верными. Поскольку, с логической точки зрения процент совпадений составляет 50%.
д. Некоторые родители готовы платить любые деньги за точное определение пола будущего ребенка. Зачастую прогнозы такого рода попадают в “десятку”. Однако, на сегодняшний день, официальная наука не признаёт данные способы определение пола ребенка максимально верными. Поскольку, с логической точки зрения процент совпадений составляет 50%.
Точный результат анализа на определение пола плода и резус-фактора будущего ребёнка, на протяжении нескольких последних лет успешно проводится в медицинской клинике “Здоровая семья”. Наша клиника гарантирует высокую точность данных результатов. В основе своей, такого рода тестирование неинвазивно и осуществляется при помощи анализа крови матери будущего ребёнка. Проведение данного метода посредством анализа ДНК становится возможным, начиная с 8-ой недели беременности.
Неинвазивное тестирование, определяющее пол и резус-фактор плода через ДНК материнской крови разработали в 2008 году ученые Евросоюза под эгидой Еврокомиссии. Данное тестирование применяют многие европейские клиники. В практике современной медицины этот способ, является единственным научно доказанным методом неинвазивного и безопасного определения резус фактора будущего малыша на ранних периодах беременности. Наша клиника предоставляет свои услуги в этом вопросе с высокой точностью результата.
В практике современной медицины этот способ, является единственным научно доказанным методом неинвазивного и безопасного определения резус фактора будущего малыша на ранних периодах беременности. Наша клиника предоставляет свои услуги в этом вопросе с высокой точностью результата.
Отрицательный резус-фактор крови беременной матери может спровоцировать возникновение резус-конфликта с кровью плода, что в свою очередь может привести к определённым последствиям для новорождённого ребенка. Современной медициной были разработаны специальные методы, предотвращающие возникновение резус-конфликта. К тому же, установление резус фактора плода, является очень важным для женщин, имеющих отрицательный резус крови, у которых может быть предрасположенность к гемолитической болезни плода.
С результатами тестирования на определение пола ребенка, а также резус-фактором плода Вы сможете ознакомиться уже по истечении 10-и рабочих дней. Наши медицинские специалисты проконсультируют Вас по любым интересующим вопросам. Для того чтобы провести тестирование, необходимо поставить в известность наших специалистов, заблаговременно записавшись на приём.
Китайский календарь определения пола
Предлагаем вам обратиться к китайскому календарю определения пола ребенка. Институт наук Пекина утверждает, что достоверность данного метода достигает 97%.
| Возраст матери на момент зачатия | Месяц зачатия | |||||||||||
| I янв | II фев | III март | IV апр | V май | VI июн | VII июл | VIII авг | IX сент | X окт | XI нояб | XII дек | |
| 18 | Д | М | Д | М | М | М | М | М | М | М | М | М |
| 19 | М | Д | М | Д | М | М | М | М | М | Д | М | Д |
| 20 | Д | М | Д | М | М | М | М | М | М | Д | М | М |
| 21 | М | Д | Д | Д | Д | Д | Д | Д | Д | Д | Д | Д |
| 22 | Д | М | М | Д | М | Д | Д | М | Д | Д | Д | Д |
| 23 | М | М | Д | М | М | Д | М | Д | М | М | М | Д |
| 24 | М | Д | М | М | Д | М | М | Д | Д | Д | Д | Д |
| 25 | Д | М | М | Д | Д | М | Д | М | М | М | М | М |
| 26 | М | Д | М | Д | Д | М | Д | М | Д | Д | Д | Д |
| 27 | Д | М | Д | М | Д | Д | М | М | М | М | Д | М |
| 28 | М | Д | М | Д | Д | Д | М | М | М | М | Д | Д |
| 29 | Д | М | Д | Д | М | М | Д | Д | Д | М | М | М |
| 30 | М | Д | Д | Д | Д | Д | Д | Д | Д | Д | М | М |
| 31 | М | Д | М | Д | Д | Д | Д | Д | Д | Д | Д | М |
| 32 | М | Д | М | Д | Д | Д | Д | Д | Д | Д | Д | М |
| 33 | Д | М | Д | М | Д | Д | Д | М | Д | Д | Д | М |
| 34 | Д | Д | М | Д | Д | Д | Д | Д | Д | Д | М | М |
| 35 | М | М | Д | М | Д | Д | Д | М | Д | Д | М | М |
| 36 | Д | М | М | Д | М | Д | Д | Д | М | М | М | М |
| 37 | М | Д | М | М | Д | М | Д | М | Д | М | Д | М |
| 38 | Д | М | Д | М | М | Д | М | Д | М | Д | М | Д |
| 39 | М | Д | М | М | М | Д | Д | М | Д | Д | Д | Д |
| 40 | Д | М | Д | М | Д | М | М | Д | М | Д | М | Д |
| 41 | М | Д | М | Д | М | Д | М | М | Д | М | Д | М |
| 42 | Д | М | Д | М | Д | М | Д | М | М | Д | М | Д |
| 43 | М | Д | М | Д | М | Д | М | Д | М | М | М | М |
| 44 | М | М | Д | М | М | М | Д | М | Д | М | Д | Д |
| 45 | Д | М | М | Д | Д | Д | М | Д | М | Д | М | М |
Использование данных этой таблицы:
- Если вы планируете ребенка, то в строке таблицы, соответствующей вашему возрасту, необходимо выбрать месяцы, в которых рождение мальчика или девочки наиболее вероятно, а затем вычесть 9 месяцев, определив именно тот, в котором вам следует зачать малыша.
- Если вы уже беременны, то найдите в таблице место пересечения своего возраста и месяца зачатия (или ожидаемого месяца появления ребенка), и вы узнаете, какого пола он родится.
Логической закономерности в таблице не найдено, или она пока просто не определена. Но как ни странно, в большинстве случаев она показывает верные результаты.
Сдать анализ крови на резус-фактор- цены в Москве в ИНВИТРО
Метод определения Магнитизация эритроцитов, метод гель-фильтрации с использованием моноклональных антител. Автоматические анализаторы QWALYS (Diagast), IH-1000 (Bio-Rad).
Исследуемый материал Цельная кровь (с ЭДТА)
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Анализ крови на резус-фактор; Резус-принадлежность; Резус-фактор крови; Резус. Rh; Rh type; Rh typing; Rh-factor; Rhesus factor.
Краткое описание исследования Резус-принадлежность
В системе резус различают пять основных антигенов. Антиген Rh (D) − основной (наиболее иммуногенный) поверхностный эритроцитарный антиген системы резус. Именно его обычно подразумевают под названием «резус-фактор». Примерно у 85% людей эритроциты несут этот белок, поэтому их относят к резус-положительным (позитивным). У 15% людей его нет, они резус-отрицательны (негативны). Наличие резус-фактора не зависит от групповой принадлежности по системе АВ0, от внешних причин и не изменяется в течение жизни. Резус-фактор появляется на ранних стадиях внутриутробного развития, и у новорожденного уже обнаруживается в существенном количестве. Определение резус-принадлежности крови применяется в общей клинической практике при переливании крови и ее компонентов, а также в гинекологии и акушерстве при планировании и ведении беременности. Несовместимость крови по резус-принадлежности при переливании крови возникает тогда, когда в эритроцитах донора имеется Rh-агглютиноген, а реципиент является резус-отрицательным. В этом случае у резус-отрицательного реципиента начинают вырабатываться антитела, направленные против резус-антигена. Эти антитела разрушают эритроциты. Поэтому переливать эритроциты, плазму крови и особенно цельную кровь от донора к реципиенту нужно строго соблюдая совместимость не только по группе крови, но и по резус-принадлежности. Присутствие и титр уже имеющихся в крови антител к резус-фактору и других аллоиммунных антител можно определить с помощью теста № 140. Определение группы крови, резус-принадлежности, наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребенка, который может приводить к гемолитической болезни новорожденных (см. тест № 140). Возникновение резус-конфликта и развитие гемолитической болезни новорожденных возможно, если беременная резус-отрицательна, а плод − резус-положителен. Если у матери Rh+ (положительный), а у плода Rh- (отрицательный), опасности возникновения гемолитической болезни у плода нет. В настоящее время существует возможность медицинской профилактики развития резус-конфликта и гемолитической болезни новорожденных. Все резус-отрицательные женщины в период беременности должны находиться под наблюдением врача. Необходимо также контролировать в динамике уровень резус-антител. Есть небольшая категория резус-положительных лиц, способных образовывать анти-резус антитела. Это лица, на поверхности эритроцитов которых значительно снижена экспрессия нормального антигена Rh («слабый» D, Dweak) или экспрессируется измененный антиген Rh (частичный D, Dpartial). Эти слабые варианты антигена D в лабораторной практике объединяют в группу Du, популяционная частота которой составляет около 1%. Реципиенты, содержащие антиген Du, должны быть отнесены к резус-отрицательным, и им должна переливаться только резус-отрицательная кровь, так как нормальный антиген D может вызвать у таких лиц иммунный ответ. Доноры с антигеном Du квалифицируются как резус-положительные, так как переливание их крови может вызвать иммунный ответ у резус-отрицательных реципиентов, а в случае предшествующей сенсибилизации к антигену D − тяжелые трансфузионные реакции.
Наследование резус-принадлежности крови
В основе закономерностей наследования лежат следующие понятия. Ген, кодирующий резус-фактор D (Rh), является доминантным, аллельный ему ген d − рецессивным (резус-положительные люди могут иметь генотип DD или Dd, резус-отрицательные − только генотип dd). Человек получает от каждого из родителей по одному гену − D или d, и у него, таким образом, возможны три варианта генотипа − DD, Dd или dd. В первых двух случаях (DD и Dd) анализ крови на резус-принадлежность даст положительный результат. Только при генотипе dd человек будет иметь отрицательный резус. Некоторые варианты сочетания генов, определяющих резус-принадлежность родителей и ребенка. У отца резус положительный (гомозигота, генотип DD), у матери резус отрицательный (генотип dd): в этом случае все дети будут резус-положительными (вероятность 100%). Отец резус-положительный (гетерозигота, генотип Dd), мать − резус-отрицательная (генотип dd): в этом случае вероятность рождения ребенка с отрицательным или положительным резусом одинакова и равна 50%. Отец и мать − гетерозиготы по данному гену (Dd), оба резус-положительны: в этом случае возможно (с вероятностью около 25%) рождение ребенка с отрицательным резусом.
В случае, когда резус-принадлежность будущего ребенка требует определения, необходимо использовать генеалогический или генетический метод (см. тест № 7207).С какой целью определяют Резус-принадлежность
Оценка резус-принадлежности при беременности или подготовке к беременности, а также контроль наличия аллоиммунных антиэритроцитарных антител, включая антитела к RhD-антигену (см. тест № 140), важны для правильного ведения беременности резус-отрицательных женщин. Риск развития гемолитической болезни плода и новорожденного при повторных беременностях можно предотвратить своевременным введением Rh-иммуноглобулина.Тест предназначен для определения резус-принадлежности потенциальных реципиентов (обследование перед госпитализацией) и беременных или планирующих беременность женщин.
Что может повлиять на результат теста Резус-принадлежность
Проблемы в определении резус-принадлежности Большая часть резус-положительных лиц экспрессируют достаточное количество антигенных детерминант, содержащих все эпитопы. В этом случае при определении резус-принадлежности, вне зависимости от используемых тест-систем, проблем не возникает, и резус-принадлежность четко определяется как положительная. Однако у ряда лиц (не более 1% в европейской популяции) при определении резус-принадлежности могут возникать сложности по следующим причинам:
- Количество антигенных детерминант снижено в 3-10 раз, но структурно они не изменены. Такой вариант антигена называется слабым, D weak. Степень снижения количества детерминант разная, поэтому реакция агглютинации у таких пациентов может проходить с разной степенью выраженности.
- Количество антигенных детерминант может быть обычным, но они структурно изменены. На детерминантах антигена D отсутствуют некоторые эпитопы (одновременно может отсутствовать до пяти эпитопов). Такой вариант антигена называется неполным, вариантным или частичным, D partial. У человека выявлено более 10 таких форм антигена D. Наиболее часто встречаемым является вариант антигена DVI (встречаемость не более 0,1% в европейской популяции).
- Вариант резус-антигена D el характерен для азиатской популяции, встречаемость составляет до 30%. Проявляется очень низкой экспрессией антигена D на поверхности эритроцитов. Чаще всего обычными методами определяется как резус-отрицательный. С клинической точки зрения эти варианты важно отличать, особенно у женщин детородного возраста и при планировании переливания крови. При «неполном» варианте (D partial) возможно формирование антител к «полному» D антигену при переливании резус-положительной крови или гемокомпонентов. При «слабом» варианте (D weak) образование резус-антител маловероятно. Подход к выполнению исследования и к интерпретации результатов резус-принадлежности потенциальных реципиентов и потенциальных доноров отличается.
Резус-конфликт. Закономерности наследования ребенком группы крови и резус-фактора. Группа крови ребенка. Резус конфликт
Содержание
Общие принципы наследования признаков.
Упрощенно каждый признак в организме (цвет волос, глаз, группа крови, резус-фактор.) кодируется двумя генами. Реально количество генов, определяющих признак, значительно больше. По каждому признаку один ген ребенок получает от матери, другой — от отца. В генетике выделяют доминантные и рецессивные гены. Доминантный ген обозначается заглавной буквой латинского алфавита, и в его присутствии рецессивный ген, как правило, не проявляет свои свойства. Рецессивный ген обозначается прописной буквой латинского алфавита. Если по какому-то признаку организм содержит два одинаковых гена (два рецессивных, либо два доминантных), то он называется гомозиготой по данному признаку. Если же организм содержит один доминантный и один рецессивный ген, то он называется гетерозиготным по данному признаку и при этом проявляются те свойства признака, которые кодируются доминантным геном.
Например:
А — доминантный ген,определяющий карий цвет глаз
а — рецессивный ген,определяющий голубой цвет глаз
Возможные варианты генотипа:
АА — гомозигота, карие глаза
Аа — гетерозигота, карие глаза
aа — гомозигота, голубые глаза
Пример 1:
жена АА — гомозигота, карие глаза, оба гена доминантны
муж аа — гомозигота, голубые глаза, оба гена рецессивны
При образовании половых клеток (яйцеклетка и сперматозоид) в каждую половую клетку (гамету) идет по одному гену, т.е. в данном случае женский организм образует две гаметы, содержащие по одному доминантному гену, а мужской организм — две гаметы, содержащие по одному рецессивному гену. При слиянии половых клеток зародыш получает по данному признаку один материнский и один отцовский ген.
жена АА + муж аа
Гаметы: А А а а
Ребенок: Аа Аа Аа Аа
Таким образом, в данной ситуации в 100% дети будут иметь карие глаза и являться гетерозиготами по этому признаку.
Пример 2:
жена Аа — гетерозигота, карие глаза
муж Аа — гетерозигота, карие глаза
жена Аа + муж Аа
гаметы: А а А а
ребенок: АА , Аа, Аа, аа
В данном случае вероятность рождения детей в 25% с карими глазами(гомозиготы), в 50% с карими глазами гетерозиготы, в 25% голубые глаза(гомозиготы).
Пример 3:
жена Аа — гетерозигота, карие глаза
муж аа — гомозигота, голубые глаза
Жена Аа + муж аа
Гаметы: А а а а
Ребенок: Аа , Аа, аа , аа
В данном случае 50% детей имеют карие глаза и являются гетерозиготами и 50% имеют голубуе глаза (гомозиготы)
Закономерности наследования группы крови и резус-фактора.
Наследование группы крови контролируется аутосомным геном. Локус этого гена обозначают буквой I, а три его аллеля буквами А, В и 0. Аллели А и В доминантны в одинаковой степени, а аллель 0 рецессивен по отношению к ним обоим. Существует четыре группы крови. Им соответствуют следующие генотипы:
Первая (I) 00
Вторая (II) АА ; А0
Третья (III) ВВ ; В0
Четвертая (IV) АВ
Пример 1:
жена имеет первую группу крови (00)
муж имеет вторую группу крови и является гомозиготой (АА)
жена 00 + муж АА
гаметы: 0 0 А А
ребенок: А0 А0 А0 А0
Все дети имеют вторую группу крови и являются гетерозиготами по данному признаку.
Пример 2:
жена имеет первую группу крови (00)
муж имеет вторую группу крови и является гетерозиготой (А0)
жена 00 + муж А0
гаметы: 0 0 А 0
ребенок: А0 А0 00 00
В данной семье в 50% возможно рождение ребенка, имеющего вторую группу крови, и в 50% группа крови ребенка окажется первой.
Наследование резус-фактора кодируется тремя парами генов и происходит независимо от наследования группы крови. Наиболее значимый ген обозначается латинской буквой D. Он может быть доминантным — D, либо рецессивным — d. Генотип резус-положительного человека может быть гомозиготным — DD, либо гетерозиготным — Dd. Генотип резус-отрицательного человека может быть — dd.
Пример 1:
жена имеет отрицательный резус-фактор (dd)
муж имеет положительный резус-фактор и является гетерозиготой(Dd)
жена dd + муж Dd
гаметы: d d D d
ребенок: Dd Dd dd dd
В данной семье вероятность рождения резус-положительного ребенка составляет 50% и вероятность рождения резус-отрицательного ребенка также составляет 50%.
Пример 2:
жена имеет отрицательный резус-фактор (dd)
муж имеет положительный резус-фактор и является гомозиготой по данному признаку (DD)
жена dd + муж DD
гаметы: d d D D
ребенок: Dd Dd Dd Dd
В данной семье вероятность рождения резус-положительного ребенка составляет 100%.
Особенности течения беременности при несовместимости по резус-фактору. Резус-конфликт.
Гемолитическая болезнь плода и новорожденного это состояние, возникающее в результате несовместимости крови матери и плода по некоторым антигенам. Наиболее часто гемолитическая болезнь новорожденного развивается вследствие резус-конфликта. При этом у беременной женщины резус-отрицательная кровь, а у плода резус-положительная. Во время беременности резус-фактор с эритроцитами резус-положительного плода попадает в кровь резус-отрицательной матери и вызывает в ее крови образование антител к резус-фактору (безвредных для нее, но вызывающих разрушение эритроцитов плода). Распад эритроцитов приводит к повреждению печени, почек, головного мозга плода, развитию гемолитической болезни плода и новорожденного. В большинстве случаев заболевание быстро развивается после рождения, чему способствует поступление большого количества антител в кровь ребенка при нарушении целостности сосудов плаценты.
Реже гемолитическая болезнь новорожденного вызывается групповой несовместимостью крови матери и плода (по системе АВ0). При этом за счет агглютиногена (А или В), имеющегося в эритроцитах плода, но отсутствующего у матери, в материнской крови происходит образование антител к эритроцитам плода. Чаще иммунная несовместимость проявляется при наличии у матери I группы крови, а у плода — II, реже III группы крови.
Процесс иммунизации беременной женщины начинается с момента образования антигенов в эритроцитах плода. Поскольку антигены системы резус содержаться в крови плода с 9-10й недели беременности, а групповые антигены — с 5-6й недели, то в некоторых случаях возможна ранняя сенсибилизация организма матери. Проникновению антигенов в материнский кровоток способствуют инфекционные факторы, повышающие проницаемость плаценты, мелкие травмы, кровоизлияния и другие повреждения плаценты. Как правило, первая беременность у резус-отрицательной женщины при отсутствии в прошлом сенсибилизации организма протекает без осложнений. Сенсибилизация организма резус-отрицательной женщины возможна при переливаниях несовместимой крови (проводимых даже в раннем детском возрасте), при беременностях и родах (если у плода резус-положительная кровь), после абортов, выкидышей, операций по поводу внематочной беременности. По данным литературы после первой беременности иммунизация возникает у 10% женщин. Если женщина с резус-отрицательной кровью избежала резус-иммунизации после первой беременности, то при последующей беременности резус-положительным плодом вероятность иммунизации вновь составляет 10%. Поэтому после любого прерывания беременности у женщины с резус-отрицательной кровью с профилактической целью необходимо введение антирезус-иммуноглобулина. В течении беременности у женщины с резус-отрицательной кровью обязательно необходимо определение титра резус-антител в крови в динамике.
Наиболее часто задаваемые вопросы.
Вопрос 1:
Обязательно ли у ребенка должна быть папина или мамина группа крови и резус, или эти показатели могут достаться ему, к примеру, от родственников?
Ответ: Наследование группы крови и резус-фактора подчиняется законам генетики. Ребенок может иметь группу крови и резус-фактор, несовпадающий с родительскими. Наследование группы крови и резус-фактора осуществляется независимо друг от друга.
Вопрос 2:
У меня отрицательный резус-фактор. Недавно я сделала аборт. Смогу ли я иметь детей? Есть ли вероятность того, что при следующей беременности ребенок будет больным?
Ответ: Наличие отрицательного резус-фактора непосредственно на зачатие не влияет. Во время аборта (если он был произведен на сроках 9-10 недель беременности) существовала вероятность возникновения сенсибилизации организма к резус-фактору. До планируемой беременности желательно сделать анализ крови на наличие антител к резус-фактору.
Вопрос 3:
Какая доза антирезус-иммуноглобулина и в какие сроки вводится женщине с резус-отрицательной кровью после родов? Правда ли, что вводимая доза препарата должна быть увеличена после операции кесарево сечение?
Ответ: Женщинам с резус-отрицательной кровью после родов с профилактической целью вводится антирезус-иммуноглобулин в количестве 1-1.5 мл (200-300мкг) не позднее 24-48 часов после родов. При оперативных вмешательствах трансплацентарное кровотечение может увеличиваться, и поэтому вводимую дозу антирезус-иммуноглобулина увеличивают в 1,5 раза.
Вопрос 4:
Действительно ли, что резус-конфликт может возникнуть только в случае, когда женщина имеет отрицательный резус-фактор, а мужчина — положительный. Есть ли вероятность возникновения конфликта в обратном случае, когда женщина имеет положительный резус-фактор, а мужчина — отрицательный?
Ответ: Вероятность резус-конфликта при таком соотношении очень невелика. Однако в некоторых случаях возникновение конфликта возможно при любом несовпадении резус-фактора у беременной женщины и плода. Во многих клиниках на Западе проводится обследование на наличие антирезус-антител всех женщин независимо от резус-принадлежности.
Частые вопросы
Теги: беременностьRh Disease — обзор
Antenatal
Пациенты должны пройти скрининг во время первого дородового визита на предмет наличия резус-и не-резус-антител. На рис. 2-2 показана схема дородового лечения резус-инфекции. Если в сыворотке крови матери обнаруживаются иммунные антитела, правильное лечение включает следующее:
Рисунок 2-2. Схема дородового лечения резус-болезни.
* Забор крови из чрескожной пуповины.
** Анализ околоплодных вод менее надежен до 26-й недели беременности, поэтому рекомендуется PUBS.IUIVT, Внутриматочное внутривенное переливание.
- •
Прошлый акушерский анамнез и исход предыдущих беременностей. История предыдущих переливаний крови
- •
Тест на группу крови и непрямой антиглобулиновый тест (для определения наличия и титра нерегулярных антител). Большинство нерегулярных антител могут вызвать эритробластоз плода; поэтому важен скрининг материнской сыворотки. Титры следует определять на разных неделях беременности (рис. 2-2).Частота зависит от первоначального или последующего повышения титров. Теоретически любой антиген группы крови (за исключением Lewis и I, которых нет на эритроцитах плода) может вызвать эритробластоз плода. Anti-Le a , Le b , M, H, P, S и I являются антителами класса IgM и редко, если вообще когда-либо, вызывают эритробластоз плода и не должны вызывать беспокойства
- •
Зиготность отца: Если у матери отрицательный резус-фактор, а у отца положительный резус-фактор, зиготность отца становится критической.Если он гомозиготный, все его будущие дети будут резус-положительными. Если отец гетерозиготен, существует 50% -ная вероятность того, что у плода будет отрицательный резус-фактор и он не будет затронут. Генотип Rh можно точно определить с помощью полимеразной цепной реакции (ПЦР) ткани ворсинок хориона, амниотических клеток и крови плода, когда отец гетерозиготен или его зиготность неизвестна. Матери, у плода которых был обнаружен отрицательный резус-фактор (dd), можно успокоить, и можно избежать дальнейших серологических тестов и инвазивных процедур.Таким образом, зиготность плода можно определить молекулярно-генетическими методами. Генотипирование Rh D плода может быть выполнено быстро на материнской плазме во втором триместре беременности без вторжения в кровообращение плода. Это выполняется путем извлечения ДНК из материнской плазмы и анализа ее на ген Rh D с помощью флуоресцентного ПЦР-теста, достаточно чувствительного для обнаружения гена Rh D в отдельной клетке. Преимущество этого теста заключается в том, что ни мать, ни плод не подвергаются риску амниоцентеза или взятия проб ворсинок хориона
- •
Исследование околоплодных вод для спектрофотометрического анализа билирубина.Прошлый акушерский анамнез и титр антител являются показаниями для серийного амниоцентеза и спектрофотометрических анализов околоплодных вод для определения состояния плода. Анализ околоплодных вод хорошо коррелирует с гемоглобином и гематокритом при рождении ( r равно; 0,9), но не позволяет предсказать, потребуется ли плоду обменное переливание крови после рождения. Ниже приведены показания для амниоцентеза:
- •
История предыдущего резус-заболевания, достаточно серьезного, чтобы потребовать обменного переливания крови или вызвать мертворождение
- •
Материнский титр анти-D, анти-c или анти -Келл (или другие нерегулярные антитела) от 1: 8 до 1:64 или больше по результатам непрямого теста на антиглобулин или титрования альбумина и в зависимости от предыдущего анамнеза.Оценка разницы оптической плотности при 450 мкм (ΔOD 450 ) при данном сроке беременности позволяет обоснованно прогнозировать исход для плода (рис. 2-3). Выбор подходящего лечения зависит от ΔOD 450 околоплодных вод, результатов оценки биофизического профиля плода и оценки наличия или отсутствия гидропс плода (наблюдаются на УЗИ) и определения амниотических фосфолипидов (профиль легких). *
Рисунок 2-3. Оценка прогноза плода методами Лили и Фреды.Метод предсказания Лили.
Зона 1A : Состояние отчаянное, требуются немедленные роды или внутриматочная трансфузия, в зависимости от срока гестации. Зона 1B : Гемоглобин менее 8 г / дл, срочные роды или внутриматочная трансфузия, в зависимости от срока гестации. Зона 2A : гемоглобин 8–10 г / дл, роды на сроке 36–37 недель. Зона 2B : гемоглобин 11,0–13,9 г / дл, роды на сроке 37–39 недель. Зона 3 : Без анемии, роды в срок. Метод предсказания Фреды: Зона 4 +: неизбежная гибель плода, немедленные роды или внутриматочное переливание крови, в зависимости от срока беременности. Зона 3 +: Плод в опасности, смерть в течение 3 недель, роды или внутриутробное переливание крови как можно скорее, в зависимости от срока гестации. Зона 2 +: Выживаемость плода не менее 7–10 дней, показан повторный амниоцентез, возможное показание для внутриматочного переливания, в зависимости от срока гестации. Зона 1 +: Плод не подвергается непосредственной опасности.
Откуда: Робертсон Дж. Оценка представленных методов интерпретации спектрофотометрических записей анализа околоплодных вод при изоиммунизации резуса.Am J Obstet Gynecol 1966; 95: 120, с разрешения.
| Характеристики профиля легких | Незрелый плод | Зрелый плод | ||||
|---|---|---|---|---|---|---|
| Соотношение лецитин / сфингомиелин | < 2,0 | > 2,0 | ||||
| Ацетон-осаждаемая фракция | < 45% | > 50% | ||||
| Фосфатидилинозитол | Отсутствует | Присутствует (небольшие количества) | ||||
| Фосфатидилглицерин | Отсутствует | 7 Присутствует (заметно) |
| Генотип (ДНК) | Группа крови |
|---|---|
| АО или AA | Группа крови |
| AB | AB группа крови |
| BO или BB | Группа крови B |
| OO | O группа крови |
Например, два родителя с группой крови O могут произвести на свет ребенка только с O группа крови.Двое родителей с группой крови А могут произвести на свет ребенка с либо группы крови А, либо О. Два родителя с группой крови B могут произвести ребенок с группой крови B или O. Один родитель с А, а другой с B может произвести на свет ребенка с группами крови A, B, AB или O. Если у одного из родителей есть У A и другого есть AB, они могут произвести ребенка с A, B или AB. группы крови. Если у одного родителя есть A, а у другого O, они могут либо родить ребенка с группой крови A или O.
Фактор Rh (+/-) наследуется отдельно от групп крови ABO.Подобно маскирующему эффекту гена O в группах крови ABO, резус-фактор отрицательный (Rh-) ген также маскируется наличием положительного резус-фактора (Rh +) генотип. Следовательно, человек может иметь группу крови Rh + и может все еще есть резус-ген (см. таблицу ниже). Более того, 2 родителя с резус-группой крови можно иметь ребенка с резус-группой крови.
| Генотип (ДНК) | Группа крови |
|---|---|
| (+, -) или (+, +) | Rh + |
| (-, -) | Rh — |
Крупнейшая национальная ежедневная газета Канады
The Globe and Mail, одна из 2 национальных газет Канады, Статья содержит информацию о детских мошенничество с личными данными в больнице для больных детей № в Торонто, Канада.14 декабря 2002 г.
Включает интервью с сотрудниками Детской больницы в Торонто, Онтарио, Канада, которые признают они отказывают в информации о личности детей мужьям / партнерам-мужчинам матерей, которые хотят скрыть настоящие личность их ребенка, потому что у них был роман. Конвенция ООН о правах ребенка специально поддерживает право ребенка на отношения с обоими его / ее биологическими родителями. В Кроме того, эта статья является доказательством того, что The Hospital for Sick Children («Sick Kids») поддерживает мошенничество с отцовством.
Далее «Sick Kids» поддерживает только права матери, которые они видят, заменяет права трех других людей, а именно права биологического отца, права партнера / мужа матери и ребенка права на личность. Подробнее ..
О больнице для больных детей в Торонто, Канада .
Нежно называемый «Sick Kids», это один из крупнейших педиатрических академических медицинских научных центров в мире, с международной репутацией за выдающиеся достижения в области здравоохранения, исследований и обучения.
роль преимплантационной генетической диагностики в лечении тяжелой резус-аллоиммунизации: первая незатронутая беременность: клинический случай | Репродукция человека
Абстрактные
Резус (Rh) D аллоиммунизация может вызвать гемолитическую болезнь плода и новорожденного, если резус-фактор плода положителен. Хотя частота тяжелой аллоиммунизации RhD снизилась при профилактическом введении анти-D иммуноглобулина во время и после беременности, сенсибилизация все еще происходит в небольшой группе женщин.У таких женщин резус-инфекция по-прежнему будет серьезной проблемой для их младенцев, которые могут пострадать. Преимплантационная генетическая диагностика (ПГД) может использоваться, чтобы избежать несовместимости групп крови плода и матери у женщины с сенсибилизированным RhD. Биопсия отдельной клетки эмбрионов на ранней стадии дробления, скрининг на RhD-отрицательные эмбрионы, позволяет переносить в матку только RhD-отрицательные эмбрионы. Это позволяет избежать каких-либо осложнений, связанных с гемолитической болезнью плода и новорожденного. В этой статье описывается первый зарегистрированный случай незатронутой беременности с использованием ПГД при резус-болезни.ЭКО и перенос эмбриона привели к клинической беременности и рождению здоровой девочки, у которой была подтверждена отрицательная RhD-группа крови. ПГД в парах с гетерозиготным RhD-положительным партнером-мужчиной дает возможность избежать гемолитической болезни новорожденных у матерей с аллоиммунизацией RhD.
Введение
Rhesus (Rh) D аллоиммунизация, проявляющаяся при гемолитической болезни плода и новорожденного, может вызвать перинатальную заболеваемость, смертность и длительную инвалидность.У RhD-отрицательной женщины могут развиваться анти-D-антитела при контакте с RhD-положительным плодом во время или после беременности. Хотя различные антигены эритроцитов причастны к гемолитической болезни новорожденных, антиген RhD является наиболее распространенным и иммуногенным (NHMRC, 1999; Avent and Reid, 2000). В результате разрушения эритроцитов у плода развивается гемолитическая анемия, которая в тяжелых случаях приводит к водянке плода, внутриутробной гибели плода или к обоим сразу.
Система групп крови Rh очень полиморфна и состоит из ≥45 независимых антигенов.Экспрессия антигена D осуществляется белком RhD, в то время как белок RhCE экспрессирует антигены C или c вместе с антигенами E или e того же белка (Mouro et al. , 1993; Blunt et al. , 1994; Avent et al. др. , 1996; Смайт и др. , 1996). Хотя белки RhD и RhCE имеют высокую степень гомологии, белок RhD не экспрессирует антигены C / c или E / e, а белок RhCE не экспрессирует антиген D.
Белки RhD и RhCE кодируются двумя высокогомологичными генами, RHD и RHCE соответственно, которые картированы в хромосомной позиции 1p34.3–1p36.13 (Cherif-Zahar et al. , 1991; MacGeoch et al. , 1992). Каждый из двух генов состоит из 10 экзонов, которые в тандеме охватывают 69 килобаз ДНК (Avent and Reid, 2000). Ген, кодирующий полипептид D, присутствует у резус-положительных людей и отсутствует у резус-отрицательных субъектов (Colin et al. , 1991).
Примерно 57% RhD-положительной европеоидной популяции является гетерозиготной по присутствию гена RhD (Lewis et al. , 1971).Примерно 83% женщин европеоидной расы имеют RhD-положительный результат, что означает, что около 17% беременных женщин будут RhD-отрицательными. Из этих RhD-отрицательных женщин около 60% будут иметь RhD-положительного ребенка во время первой беременности (NHMRC, 1999). Если женщина станет сенсибилизированной во время первой беременности, все последующие RhD-положительные дети будут подвержены риску гемолитической болезни плода и новорожденного. У плода есть 50% шанс быть гетерозиготным резус-положительным и 50% -ный шанс быть резус-отрицательным, если резус-отрицательная женщина беременеет от гетерозиготного резус-положительного отца.В последнем случае плод сможет избежать любых потенциальных неблагоприятных последствий аллоиммунизации RhD матери.
Тяжелая аллоиммунизация RhD сегодня встречается редко, в основном из-за разработки анти-D иммуноглобулина и его использования в клинической практике. Рекомендуется дородовая и послеродовая профилактика с помощью анти-D иммуноглобулина (NHMRC, 2003). Несмотря на явное сокращение наличия и использования анти-D у пораженных женщин, аллоиммунизация RhD все еще имеет место (Bowman and Pollock, 1987; Crowther and Middleton, 2004).У этих сенсибилизированных женщин резус-гемолитическая болезнь будет продолжать оставаться серьезной проблемой и для их детей, которые страдают от этого заболевания.
У женщин, которые перенесли неоднократные потери беременности, инвазивные вмешательства, такие как серийные внутриутробные переливания крови или пораженный плод или новорожденный, перспектива повторной беременности со всеми ее осложнениями может показаться слишком большой. У таких женщин вместо того, чтобы рисковать родить еще одного ребенка с гемолитической болезнью новорожденного, они могут предпочесть избегать дальнейших беременностей.Даже при тщательном наблюдении за сенсибилизированными беременными женщинами с целью раннего выявления анемии плода и своевременного проведения внутриматочной трансфузии, существует значительный уровень смертности плода (Abdalla et al. , 2004). Хотя риск гибели плода в результате кордоцентеза относительно невелик, потеря плода, связанная с процедурой, была документально подтверждена (Daffos et al. , 1985). Эти процедуры также связаны с риском потенциального увеличения продукции материнских антител к RhD из-за вторичного фето-материнского кровотечения (Nicolini et al., 1988 г .; MacGregor et al. , 1991).
PGD был разработан для предотвращения генетических нарушений у потомков пар из группы повышенного риска. С момента своего появления в 1990 году ПГД в основном использовалась для выявления одногенных заболеваний, таких как кистозный фиброз, или для скрининга хромосомных нарушений (Руководящий комитет консорциума ESHRE PGD, 2002). Совсем недавно появилось сообщение об использовании PGD для определения социального пола и соответствия HLA (Verlinsky et al. , 2001; Руководящий комитет консорциума ESHRE PGD, 2002).Этика такого использования выходит за рамки данной статьи и не будет обсуждаться. ПГД обязательно предполагает ЭКО. После ЭКО ранний эмбрион проверяется на наличие заболевания перед переносом соответствующего эмбриона в матку матери. При резус-болезни это позволяет переносить резус-отрицательные эмбрионы обратно RhD-аллоиммунизированной матери, избегая потенциальных осложнений и заболеваемости гемолитической болезнью плода и новорожденного.
Хотя использование ПГД для лечения резус-инфекции было опубликовано ранее, клиническая беременность до сих пор не достигнута (Avner et al., 1996). Тем не менее, PGD для генотипа Kell была успешно проведена для предотвращения тяжелой аллоиммунизации, происходящей в паре из группы риска (Verlinsky et al. , 2003). Насколько нам известно, мы сообщаем о первом случае, когда у матери с RhD-аллоиммунизацией с использованием ПГД родился здоровый RhD-отрицательный ребенок. Мы обсуждаем роль PGD в управлении аллоиммунизацией RhD в выбранных парах, где сенсибилизированная женщина и ее гетерозиготный партнер RhD могут избежать потенциальных заболеваний и смертности, связанных с RhD-положительным плодом.
История болезни
27-летняя замужняя женщина, сенсибилизированная RhD-антителами, обратилась за консультацией до зачатия относительно возможных вариантов попытки будущей беременности. У них с мужем было двое детей, второй из которых страдал гемолитической болезнью новорожденного. Обе эти беременности достигли срока и родились естественным путем.
У второго ребенка развилась гипербилирубинемия и желтуха новорожденных, потребовавшая фототерапии, а также значительная гемолитическая анемия, не потребовавшая переливания крови.Пик сывороточного билирубина составил 425 ммоль / л, а самый низкий зарегистрированный уровень гемоглобина составил 75 г / л. Группа крови новорожденного была «A» RhD-положительной с положительным прямым тестом Кумба при рождении.
Через шесть недель после родов уровень материнских анти-D-антител был повышен при количественном определении анти-D-антител 157 МЕ / мл. Уровень материнских анти-D антител оставался значительно повышенным через 6 месяцев после родов до уровня 70 МЕ / мл. Группа крови мужа была RhD-положительной, а его серологически определенным RhD-фенотипом был cDEe.Он был генотипирован и оказался RhD-гетерозиготным.
Актуальные вопросы, касающиеся аллоиммунизации RhD и будущих потенциально более серьезных беременностей, были обсуждены с парой. Пару посоветовали, что скрининг RhD перед имплантацией с использованием PGD может позволить селективный перенос только RhD-отрицательных эмбрионов и, таким образом, избежать любой возможности несовместимости крови матери и плода при этой беременности. Пара согласилась на вспомогательную репродукцию и ПГД для переноса RhD-отрицательного эмбриона в матку.
Женщина прошла плановую стимуляцию яичников и оплодотворение ИКСИ. Девятнадцать ооцитов были аспирированы, и 17 были пригодны для ИКСИ. В день 1 12 считались оплодотворенными. Биопсия на 3-й день, амплификация ПЦР и анализ выявили девять RhD-положительных эмбрионов, два RhD-отрицательных эмбриона и один с профилем однопородной амплификации. Два эмбриона (10-клеточный эмбрион и уплотняющаяся морула) были перенесены на 5-й день. Это привело к клинической беременности.
ПГД выполняли с ЭКО с использованием ИКСИ (для уменьшения постороннего загрязнения ДНК), анализом ДНК отдельных биопсированных бластомеров из эмбрионов на стадии расщепления и мультиплексной ПЦР.Олигонуклеотидные праймеры, амплифицирующие части обоих генов RHD и RHCE, были сконструированы путем выравнивания двух последовательностей генов [идентификация доступа в GenBank NT_030571 (ген RHCE) и NT_004391 (ген RHCE)] с использованием BioManager (ANGIS, Австралия) и выбора регионов, где RHCE и RHD гены различались по длине последовательности между идентичными фланкирующими последовательностями ДНК. Было разработано в общей сложности 12 различных пар праймеров, нацеленных на разные области выравнивания, что привело бы к продукту амплификации, различающемуся по размеру между генами RHCE и RHD (Primer Express; Applied Biosystems, Австралия).После тестирования три пары праймеров дали как надежную амплификацию, так и различимые различия ампликонов и были пригодны для дальнейшего использования. Кроме того, последний мультиплекс включал два локуса с короткими тандемными повторами (STR), один из которых примыкает к гену RHCE (D1S2674), а другой немного дальше (D1S199), в качестве монитора для постороннего загрязнения ДНК и подтверждения профиля гена ( RhD-положительный или RhD-отрицательный) по сцеплению (Таблица I).
ПГД выполняли с использованием прямой ПЦР-амплификации выделенных / нейтрализованных щелочью бластомеров с анализом капиллярным электрофорезом флуоресцентно меченных ампликонов (Cui et al., 1989). Амплификацию проводили в двухэтапной ПЦР: 94 ° C в течение 30 с и 60 ° C в течение 120 с в течение 43 циклов.
Определены генотипы RhD 12 эмбрионов. Присутствие гена RHD в эмбрионе привело к двойному пику для каждой выбранной области амплификации; ампликон гена RHD и контрольный ампликон гена RHCE (рис. 1). В сочетании с маркерами STR точность теста для пациента может составлять> 99%.
Регулярное ультразвуковое исследование плода на протяжении всей беременности не показало никаких признаков анемии плода или водянки плода.Материнский уровень анти-D антител также регулярно контролировался и оставался стабильным, хотя и значительно повышенным, на протяжении всей беременности (диапазон 21,0–28,0 МЕ / мл). Роды были вызваны на 39 неделе беременности. Группа крови ребенка была отрицательной по RhD «A», а прямой тест Кумба был отрицательным. Не было отмечено никаких осложнений в ближайшем неонатальном периоде или после него.
Обсуждение
Частота аллоиммунизации RhD снизилась после введения анти-D профилактики во время и после беременности (Bowman, 2003; Bowman and Pollock, 1987; Crowther and Middleton, 2004).Тем не менее тяжелая аллоиммунизация RhD все еще имеет место и может иметь серьезные последствия для беременности с гемолитической анемией, которая в крайних случаях вызывает заболеваемость плода, мертворождение или перинатальную смертность. После значительного нарушения беременности пары, у которых присутствует аллоиммунизация RhD, часто сталкиваются с дилеммой: пытаться ли дальнейшую беременность и с потенциальными неблагоприятными последствиями. Тенденция к ухудшению резус-инфекции с каждой последующей беременностью, несовместимой с резус-фактором, у сенсибилизированной женщины также играет важную роль в процессе принятия решений.В представленном выше случае такой сценарий существовал. Вероятность беременности сенсибилизированной женщины от RhD-положительной гетерозиготы, имеющей RhD-положительный плод, составляет 50%. В таких парах использование ПГД для типирования RhD позволяет избирательно переносить только RhD-отрицательные эмбрионы, тем самым избегая любых осложнений, связанных с несовместимостью матери и плода. Представленный случай, насколько нам известно, является единственным циклом ПГД, приведшим к успешной беременности.
ПГД была введена в 1990 году с первой установленной беременностью у двух пар, которые, как известно, подвержены риску передачи рецессивных Х-сцепленных заболеваний (Handyside et al., 1990). С тех пор его обычно предлагают при трех основных категориях заболеваний: связанных с полом, дефектов одного гена и хромосомных нарушений. Некоторые практикующие врачи также использовали PGD для определения пола по социальному признаку и определения соответствия HLA. ПГД позволяет парам из группы риска избежать возможных осложнений или других неприятных событий при будущих беременностях.
ПГД обязательно включает вспомогательные репродуктивные методы, при которых требуется стимуляция яичников и ЭКО для получения in vitro нескольких эмбрионов, чтобы выбрать здоровые для переноса.Это означает, что даже плодородные пары должны проходить процессы вспомогательной репродукции. Также необходимо учитывать финансовые затраты, связанные с ЭКО и ПГД. Однако экономические затраты на последующее наблюдение и лечение типичной беременности и новорожденного, страдающего тяжелым RhD, немаловажны вместе с психологическим и физическим бременем (van den Veyver et al. , 1995).
Этот случай демонстрирует, что PGD можно использовать для определения статуса RhD эмбрионов на ранней стадии дробления с помощью анализа отдельных клеток.Это позволяет избирательно переносить только RhD-отрицательные эмбрионы, избегая развития гемолитической болезни у плода. Хотя беременность с повышенным риском, выявленная пренатальной диагностикой, можно лечить с помощью внутриутробного переливания крови, потенциальные осложнения, включая гибель плода, не всегда можно полностью предотвратить даже после этой процедуры. Прерывание беременности также может быть неприемлемым для пары. Фактически, генетический риск и возражения против прерывания беременности по-прежнему являются наиболее важными причинами для пар, обращающихся за ПГД, при этом примерно у четверти пар есть один или несколько пострадавших детей (Руководящий комитет Консорциума ESHRE PGD, 2002).ПГД можно рассматривать как профилактическую меру лечения в парах, затронутых аллоиммунизацией RhD и мужской резус-положительной гетерозиготой.
PGD был разработан для выявления генетических дефектов, но, как показывает этот случай, может использоваться для пар из группы риска с аллоиммунизацией RhD. Это дает избранным парам подход, позволяющий избежать риска рождения детей с гемолитической болезнью плода и новорожденного.
Рис. 1.
Электрофореграмма, демонстрирующая: ( a ) RhD-отрицательную мать; ( b ) RhD-положительный отец; ( c ) RhD-отрицательный эмбрион и ( d ) RhD-положительный эмбрион.CE представляет собой генные продукты RHCE. D представляет продукт гена RHD. Идентификаторы ампликона, как показано в таблице 1, указаны на каждой панели.
Рис. 1.
Электрофореграмма, демонстрирующая: ( a ) RhD-отрицательную мать; ( b ) RhD-положительный отец; ( c ) RhD-отрицательный эмбрион и ( d ) RhD-положительный эмбрион. CE представляет собой генные продукты RHCE. D представляет продукт гена RHD. Идентификаторы ампликона, как показано в таблице 1, указаны на каждой панели.
Таблица I.Парные праймеры для генов резуса и короткие тандемные повторы
| Локус . | Прямая грунтовка . | Обратный праймер . | Размер ампликона a (bp) . 90 088 | |||
|---|---|---|---|---|---|---|
| D1S199 б | 6FAM-CCTGGGTGACAGAGTGAGACC | TTTTCCCCTTCTCCCCTCC ~140 | ||||
| D1S2674 б | NED-CCAAAATCAACTGTCTCTGTAACAGTAA | TCCAGCCTGGGAAACAGAAT ~240 | ||||
| Rh48446d6 гр | 6FAM-TCTGGGTGTTGGTTATGTGGG | GCAGTCAGCAGGTTTGGGTT | 162 (CE) / 168 (D) | |||
| Rh51712d4 c | VIC-CCCTATG86 CATGATG | VIC-CCCTATG86 CATGAGACT Rh58925d3 c | VIC-CAGGCGCCAGAGATCATTACT | TCGTATTTCCCTTTCGTGGTG | 109 (D) / 112 (CE) |
| Locus . | Прямая грунтовка . | Обратный праймер . | Размер ампликона a (bp) . + | |||
|---|---|---|---|---|---|---|
| D1S199 б | 6FAM-CCTGGGTGACAGAGTGAGACC | TTTTCCCCTTCTCCCCTCC ~140 | ||||
| D1S2674 б | NED-CCAAAATCAACTGTCTCTGTAACAGTAA | TCCAGCCTGGGAAACAGAAT ~240 | ||||
| Rh48446d6 гр | 6FAM-TCTGGGTGTTGGTTATGTGGG | GCAGTCAGCAGGTTTGGGTT | 162 (CE) / 168 (D) | |||
| Rh51712d4 c | VIC-CCCTATG86 CATGATG | VIC-CCCTATG86 CATGAGACT Rh58925d3 c | VIC-CAGGCGCCAGAGATCATTACT | TCGTATTTCCCTTTCGTGGTG | 109 (D) / 112 (CE) |
Парные праймеры для генов резуса и короткие тандемные повторы
| Локус . | Прямая грунтовка . | Обратный праймер . | Размер ампликона a (bp) . 90 088 | |||
|---|---|---|---|---|---|---|
| D1S199 б | 6FAM-CCTGGGTGACAGAGTGAGACC | TTTTCCCCTTCTCCCCTCC ~140 | ||||
| D1S2674 б | NED-CCAAAATCAACTGTCTCTGTAACAGTAA | TCCAGCCTGGGAAACAGAAT ~240 | ||||
| Rh48446d6 гр | 6FAM-TCTGGGTGTTGGTTATGTGGG | GCAGTCAGCAGGTTTGGGTT | 162 (CE) / 168 (D) | |||
| Rh51712d4 c | VIC-CCCTATG86 CATGATG | VIC-CCCTATG86 CATGAGACT Rh58925d3 c | VIC-CAGGCGCCAGAGATCATTACT | TCGTATTTCCCTTTCGTGGTG | 109 (D) / 112 (CE) |
| Locus . | Прямая грунтовка . | Обратный праймер . | Размер ампликона a (bp) . + | |||
|---|---|---|---|---|---|---|
| D1S199 б | 6FAM-CCTGGGTGACAGAGTGAGACC | TTTTCCCCTTCTCCCCTCC ~140 | ||||
| D1S2674 б | NED-CCAAAATCAACTGTCTCTGTAACAGTAA | TCCAGCCTGGGAAACAGAAT ~240 | ||||
| Rh48446d6 гр | 6FAM-TCTGGGTGTTGGTTATGTGGG | GCAGTCAGCAGGTTTGGGTT | 162 (CE) / 168 (D) | |||
| Rh51712d4 c | VIC-CCCTATG86 CATGATG | VIC-CCCTATG86 CATGAGACT Rh58925d3 c | VIC-CAGGCGCCAGAGATCATTACT | TCGTATTTCCCTTTCGTGGTG | 109 (D) / 112 (CE) |
Мы благодарим профессора Роберта Флауэра за советы экспертов относительно системы групп крови резус.Все процедуры ЭКО и ПГД проводились в Сиднейском ЭКО.
Список литературы
Abdalla MGK, Beattie B и Alfirevic Z (
2004
) Методы внутриматочной трансфузии у плодов с несовместимостью резус (Протокол Кокрановского обзора). В Кокрановской библиотеке,, выпуск 2,
. John Wiley & Sons Ltd, Чичестер, Великобритания,9
стр.Avent ND и Reid ME (
2000
) Система групп крови Rh: обзор.Кровь
95
,375
–387.Авент Н.Д., Лю В., Уорнер К.М., Моуби В.Дж., Джонс Дж. В., Риджвелл К. и Таннер М.Дж. (
1996
) Иммунохимический анализ полипептидов Rh эритроцитов человека.J Biol Chem
271
,14233
–14239.Avner R, Reubinoff BE, Simon A, Zentner B, Friedmann A, Mitrani-Rosenbaum S и Laufer N (
1996
) Управление изоиммунизацией резуса с помощью преимплантационной генетической диагностики.Mol Hum Reprod
2
,60
–62.Blunt T, Daniels G и Carritt B (
1994
) Переключение серотипа в частично удаленном гене RHD.Vox Sang
67
,397
–401.Bowman J (
2003
) Тридцать пять лет профилактики резус-фактора.Переливание
43
,1661
–1666.Bowman JM и Pollock JM (
1987
) Неудачи внутривенной профилактики резус-иммуноглобулином: анализ причин таких неудач.Transfus Med Ред.
1
,101
–112.Cherif-Zahar B, Mattei MG, le Van Kim C, Bailly P, Cartron JP и Colin Y (
1991
) Локализация структуры гена группы крови Rh человека в области 1p34.3–1p36.1 хромосомы in situ гибридизация.Hum Genet
86
,398
–400.Colin Y, Cherif-Zahar B, Le Van Kim C, Raynal V, Van Huffel V и Cartron JP (
1991
) Генетическая основа полиморфизма RhD-положительных и RhD-отрицательных групп крови, определенная с помощью саузерн-анализа.Кровь
78
,2747
–2752.Crowther C и Middleton P (
2004
) Введение анти-D после родов для предотвращения резус-аллоиммунизации (Кокрановский обзор). В Кокрановской библиотеке, выпуск 2, 2004 г. John Wiley & Sons Ltd, Чичестер, Великобритания.Cui XF, Li HH, Goradia TM, Lange K, Kazazian HH Jr, Galas D и Arnheim N (
1989
) Типирование одного сперматозоида: определение генетической дистанции между локусами G-гамма-глобина и паратироидного гормона с помощью полимеразная цепная реакция и аллель-специфические олигмеры.Proc Natl Acad Sci USA
86
,9389
–9393.Даффос Ф., Капелла-Павловский М. и Форестье Ф. (
1985
) Взятие пробы крови плода во время беременности с использованием иглы под контролем ультразвука: исследование 606 последовательных случаев.Am J Obstet Gynecol
153
,655
–660.Руководящий комитет Консорциума ESHRE PGD (
2002
) Консорциум по преимплантационной генетической диагностике: сбор данных III (май 2001 г.).Hum Reprod
17
,233
–246.Handyside AH, Kontogianni EH, Hardy K и Winston RML (
1990
) Беременности от предимплантационных человеческих эмбрионов, взятых после биопсии, с разбивкой по полу с помощью Y-специфической амплификации ДНК.Природа
344
,768
–770.Льюис М., Кайта Х. и Чоун Б. (
2000
) Наследование резус-групп крови: частота в 1000 неродственных кавказских семьях, состоящих из родителей и 2806 детей.Vox Sang
20
,500
–508.MacGeoch C, Mitchell CJ, Carritt B, Avent ND, Ridgwell K, Tanner MJ и Spurr NK (
1992
) Назначение хромосомного локуса человеческого 30-kDal Rh (резус) связанного с антигеном белка группы крови ( Rh40A) в область хромосомы 1p36.13 – p34.Cytogenet Cell Genet
59
,261
–264.MacGregor SN, Silver RK и Sholl JS (
1991
) Повышенная сенсибилизация после кордоцентеза у беременных с резус-изоиммунизацией.Am J Obstet Gynecol
165
,382
–383.Mouro I, Colin Y, Cherif-Zahar B, Cartron JP и Le Van Kim C. (
1993
) Молекулярно-генетическая основа системы групп крови резуса человека.Нат Генет
5
,62
–65.NHMRC (
1999
) Руководство по профилактическому применению иммуноглобулина Rh D (анти-D) в акушерстве.NHMRC (
2003
) Руководство по профилактическому применению иммуноглобулина Rh D (анти-D) в акушерстве.Nicolini U, Kochenour NK, Greco P, Letsky EA, Johnson RD, Contreras M и Rodeck CH (
1988
) Последствия кровотечения из матери и матери после внутриматочного переливания.Br Med J
297
,1379
–1381.Smythe JS, Avent ND, Judson PA, Parsons SF, Martin PG и Anstee DJ (
1996
) Экспрессия продуктов генов RHD и RHCE с использованием ретровирусной трансдукции клеток K562 устанавливает молекулярную основу антигенов группы крови Rh.Кровь
87
,2968
–2973.van den Veyver IB, Chong SS, Cota J, Bennett PR, Fisk NM, Handyside AH, Cartron JP, Le van Kim C, Colin Y, Snabes MC et al. (
1995
) Плод-плацента-новорожденный: одноклеточный анализ группы крови RhD для использования в предимплантационной диагностике для профилактики тяжелой гемолитической болезни новорожденных.Am J Obstet Gynecol
172
,533
–540.Верлинский Ю., Речицкий С., Скулкрафт В., Стром С. и Кулиев А. (
2001
) Преимплантационная диагностика анемии Фалькони в сочетании с HLA-сопоставлением.J Am Med Assoc
285
,3130
–3133.Верлинский Ю., Речицкий С., Озен С., Маскиангело С., Айерс Дж. И Кулиев А. (
2003
) Преимплантационная генетическая диагностика генотипа Kell.Fertil Steril
80
,1047
–1051.Заметки автора
1 Отделение акушерства, Сиднейский университет, Королевская больница Северного побережья, Отделение акушерства, Госпиталь Королевского Северного побережья, Сидней, Австралия 2065, и 3 Сиднейское ЭКО и 4 ЭКО Австралия, Сидней, Австралия 2000
Репродукция человека Том.20 № 3 © Автор 2005; все права защищены
| | КРАСИВОЕ ТЕЛО Я слышал, что определенные комбинации групп крови у родителей не могут привести к определенным группам крови у их потомства — действительно, в нескольких пьесах и рассказах это использовалось как сюжетный прием, чтобы в какой-то момент выявить, что социальная принадлежность человека отец не мог быть его / ее биологическим отцом.Это правда или миф? И если это правда, то каковы «невозможные» комбинации? Питер Уордли-Репен, Эшфорд-ин-зе-Уотер, Великобритания
|
Желтуха новорожденных | Герцог Здоровье
Патологическая желтуха, однако, связана с более высоким уровнем билирубина и требует лечения для ускорения удаления билирубина. Это может произойти у любого новорожденного с тяжелой формой физиологической (нормальной) желтухи. Существуют также факторы риска, которые могут помочь врачам выбрать, за какими детьми следует следить более внимательно.
Одним из факторов риска является недоношенность: у детей, рожденных более чем за две недели до срока родов, повышен уровень билирубина. Чем более недоношенным ребенок, тем менее зрелая его печень на момент рождения и тем труднее ему начать выведение билирубина.
Несовместимость группы крови матери и ребенка также является поводом для более тщательного отслеживания желтухи новорожденного. Это происходит, когда мать имеет группу крови O (и, следовательно, имеет антитела против клеток A и B), а ее новорожденный — группы крови A или B.Это может вызвать более быстрое разрушение красных кровяных телец новорожденного из-за материнских антител, которые просочились в кровоток ребенка.
Несовместимость по группе крови также существует, если у матери группа крови с отрицательным резус-фактором, а у новорожденного — положительный резус-фактор. Это была частая причина тяжелой неонатальной желтухи, но сейчас это очень редко, потому что резус-иммуноглобулин (Rhoham) назначают матерям из группы риска перед родами.
Хотя грудное вскармливание также считается фактором риска, на самом деле именно отсутствие эффективного грудного вскармливания является фактором риска.Вероятность проблем с грудным вскармливанием сводится к минимуму, если кормить новорожденного грудью как можно скорее после рождения и продолжать кормить грудью 8–12 раз в день в течение первых нескольких дней. Грудное молоко — идеальная пища для младенцев, и желтуха обычно не является поводом для добавления смеси в рацион.
Другие факторы риска патологической желтухи включают чрезмерное образование синяков у новорожденного, наличие брата или сестры, которому требовалось лечение желтухи, и принадлежность к восточноазиатской расе.
Желтуха в первые 24 часа жизни никогда не бывает физиологической и всегда требует обследования.
Конфликт между родителями и потомками в JSTOR
АбстрактныйКогда отношения родитель-потомок у видов, воспроизводящихся половым путем, рассматриваются с точки зрения потомства, а также с точки зрения родителя, конфликт рассматривается как ожидаемая черта таких отношений. В частности, ожидается, что родители и потомки будут расходиться во мнениях относительно того, как долго должен длиться период родительских вложений, по поводу суммы родительских вложений, которые должны быть предоставлены, а также по поводу альтруистических и эгоистических тенденций потомства, поскольку эти тенденции влияют на других родственников.Кроме того, при определенных условиях ожидается, что родители и потомки не смогут прийти к согласию по поводу предпочтительного пола потенциального потомства. В целом, ожидается, что конфликт между родителями и потомством усилится в период родительской опеки, и ожидается, что потомство будет использовать психологическое оружие, чтобы соревноваться со своими родителями. Подробные данные об отношениях матери и потомства у млекопитающих согласуются с представленными аргументами. Ожидается, что конфликт у некоторых видов, включая человеческий, распространится на взрослую репродуктивную роль потомства: при определенных условиях ожидается, что родители попытаются превратить потомство, вопреки его лучшим интересам, в навсегда непродуктивного.
Информация об издателеOxford University Press — это отделение Оксфордского университета. Издание во всем мире способствует достижению цели университета в области исследований, стипендий и образования. OUP — крупнейшая в мире университетская пресса с самым широким присутствием в мире. В настоящее время он издает более 6000 новых публикаций в год, имеет офисы примерно в пятидесяти странах и насчитывает более 5500 сотрудников по всему миру. Он стал известен миллионам людей благодаря разнообразной издательской программе, которая включает научные работы по всем академическим дисциплинам, библии, музыку, школьные и университетские учебники, книги по бизнесу, словари и справочники, а также академические журналы.
Привязанность на протяжении всей жизни
Некоторые из самых полезных событий в жизни людей связаны с развитием и поддержанием близких отношений. Например, одними из величайших источников радости является влюбленность, создание семьи, воссоединение с дальними близкими и обмен опытом с близкими. И неудивительно, что некоторые из самых болезненных переживаний в жизни людей связаны с разрывом важных социальных связей, например, разлукой с супругом, потерей родителя или оставлением любимого человека.
Почему близкие отношения играют такую важную роль в человеческом опыте? Теория привязанности — это один из подходов к пониманию природы близких отношений. В этом модуле мы рассмотрим истоки теории, основные теоретические принципы и некоторые способы, которыми привязанность влияет на человеческое поведение, мысли и чувства на протяжении всей жизни.
Тесные отношения являются основой общества и являются неотъемлемой частью поддержания нашего вида. [Изображение: CC0 Public Domain, https: // goo.gl / m25gce]Теория привязанности была первоначально разработана в 1940-х годах Джоном Боулби, британским психоаналитиком, который пытался понять сильные страдания, испытываемые младенцами, разлученными со своими родителями. Боулби (1969) заметил, что младенцы идут на все, чтобы не допустить разлуки с родителями или восстановить близость с пропавшим родителем. Например, он отметил, что дети, разлученные со своими родителями, часто плакали, звали своих родителей, отказывались есть или играть и стояли у дверей в отчаянном ожидании возвращения своих родителей.Во время первых работ Боулби писатели-психоаналитики считали эти выражения проявлением незрелых защитных механизмов, которые подавляли эмоциональную боль. Однако Боулби заметил, что такие проявления являются общими для самых разных видов млекопитающих, и предположил, что эти реакции на разделение могут служить эволюционной функции (см. Центральную тему 1).
Основная тема 1:
Исследование Харлоу о комфорте контакта
Когда Боулби изначально разрабатывал свою теорию привязанности, существовали альтернативные теоретические взгляды на то, почему младенцы эмоционально привязаны к своим основным опекунам (чаще всего к своим биологическим матерям).Боулби и другие теоретики, например, считали, что в отзывчивости и контакте, обеспечиваемом матерями, есть что-то важное. Другие теоретики, напротив, утверждали, что младенцы чувствуют эмоциональную связь со своими матерями, потому что матери удовлетворяют более основные потребности, такие как потребность в пище. То есть ребенок начинает чувствовать себя эмоционально связанным с матерью, потому что она связана со снижением основных влечений, таких как голод, а не со снижением влечений, которые могут иметь реляционный характер.
В классическом наборе исследований психолог Гарри Харлоу поместил молодых обезьян в клетки, в которых содержались две искусственные суррогатные «матери» (Harlow, 1958). Одним из этих суррогатов была простая конструкция из проволоки; другой — проволочное приспособление, покрытое тканью. Обе суррогатные матери были оснащены зондом для кормления, так что Харроу и его коллеги имели возможность разрешить суррогатной матери рожать или не рожать молоко. Харлоу обнаружил, что молодые макаки проводят непропорционально много времени с тканевым суррогатом, а не с проволочным суррогатом.Более того, это было правдой даже тогда, когда младенцев кормил суррогат по проволоке, а не суррогат из ткани. Это говорит о том, что сильная эмоциональная связь, которую младенцы формируют со своими основными опекунами, коренится не только в том, обеспечивает ли опекун пищу как таковую. В настоящее время исследование Харлоу рассматривается как одна из первых экспериментальных демонстраций важности «контактного комфорта» в установлении связи между младенцем и опекуном.
Опираясь на теорию эволюции, Боулби (1969) утверждал, что такое поведение является адаптивной реакцией на разлуку с основной фигурой привязанности — опекуном, который обеспечивает поддержку, защиту и заботу.Поскольку человеческие младенцы, как и другие младенцы млекопитающих, не могут прокормиться или защитить себя, их выживание зависит от ухода и защиты «более старших и более мудрых» взрослых. Боулби утверждал, что в ходе эволюционной истории младенцы, которые были способны поддерживать близость к фигуре привязанности, с большей вероятностью дожили бы до репродуктивного возраста.
Согласно Боулби, система мотивации, которую он назвал системой поведения привязанности, постепенно «создавалась» естественным отбором для регулирования близости к фигуре привязанности.Система крепления работает так же, как термостат, который непрерывно контролирует температуру окружающей среды в комнате, сравнивая эту температуру с желаемым состоянием и соответствующим образом регулируя поведение (например, активируя печь). В случае системы прикрепления Боулби утверждал, что система непрерывно контролирует доступность основной фигуры прикрепления. Если ребенок воспринимает фигуру привязанности как находящуюся поблизости, доступную и внимательную, тогда ребенок чувствует себя любимым, защищенным и уверенным, и в поведенческом плане он, вероятно, будет исследовать свое окружение, играть с другими и быть общительным.Однако, если ребенок воспринимает фигуру привязанности как недоступную, ребенок испытывает тревогу и поведенчески, вероятно, будет демонстрировать поведение привязанности, варьирующееся от простого визуального поиска на низком уровне до активного поиска, следования и голосовых сигналов с другого. Такое поведение привязанности продолжается либо до тех пор, пока ребенок не сможет восстановить желаемый уровень физической или психологической близости к фигуре привязанности, либо до тех пор, пока ребенок не исчерпает себя или не сдастся, что может случиться в контексте длительного разлуки или потери.
Подумайте о своем самом раннем воспоминании, касается ли оно только вас или ваших близких, вашей семьи и опекунов? [Изображение: CC0 Public Domain, https://goo.gl/m25gce]Хотя Боулби считал, что эта базовая динамика отражает то, как работает система привязанности у большинства детей, он признал, что существуют индивидуальные различия в том, как дети оценивают доступность фигуры привязанности и того, как они регулируют свое поведение привязанности в ответ на угрозы. Однако только когда его коллега Мэри Эйнсворт начала систематически изучать разделение младенцев и родителей, появилось формальное понимание этих индивидуальных различий.Эйнсворт и ее ученики разработали методику, названную странной ситуацией, — лабораторное задание для изучения привязанности младенца к родителю (Ainsworth, Blehar, Waters, & Wall, 1978). В странной ситуации 12-месячных младенцев и их родителей доставляют в лабораторию и в течение примерно 20 минут систематически отделяют друг от друга и воссоединяют друг с другом. В этой странной ситуации большинство детей (около 60%) ведут себя так, как предполагает нормативная теория Боулби. В частности, они расстраиваются, когда родитель покидает комнату, но, когда он или она возвращается, они активно ищут родителя, и он или она легко их утешает.Детей, демонстрирующих такую модель поведения, часто называют защищенными. Другие дети (около 20% или меньше) сначала чувствуют себя неуютно, а после разлуки становятся крайне подавленными. Важно отметить, что при воссоединении со своими родителями этим детям трудно успокоиться, и они часто демонстрируют противоречивое поведение, которое предполагает, что они хотят утешения, но также хотят «наказать» родителя за то, что он ушел. Таких детей часто называют тревожно-устойчивыми. Третий образец привязанности, который задокументировали Эйнсворт и ее коллеги, часто называют избеганием.Избегающие дети (около 20%) не всегда ведут себя так, как будто они испытывают стресс из-за разлуки, но после воссоединения активно избегают поиска контакта со своими родителями, иногда обращая свое внимание на игры с предметами на полу лаборатории.
Работа Эйнсворт была важна как минимум по трем причинам. Во-первых, она предоставила одну из первых эмпирических демонстраций того, как поведение привязанности организовано в незнакомых контекстах. Во-вторых, она представила первую эмпирическую таксономию индивидуальных различий в моделях привязанности младенцев.Согласно ее исследованиям, существует по крайней мере три типа детей: те, кто в безопасности в отношениях с родителями, те, кто устойчив к тревоге, и те, кто избегает тревог. Наконец, она продемонстрировала, что эти индивидуальные различия коррелировали с взаимодействиями младенца и родителя в семье в течение первого года жизни. Например, у детей, которые кажутся безопасными в странной ситуации, как правило, есть родители, чуткие к их потребностям. Дети, которые кажутся неуверенными в странной ситуации (т.д., устойчивые к тревоге или избегающие) часто имеют родителей, которые нечувствительны к их потребностям, непоследовательны или отвергают заботу, которую они предоставляют.
Является ли стиль привязанности несколькими поколениями? Как стиль привязанности одного человека влияет на то, как он взаимодействует со своими детьми? [Изображение: CC0 Public Domain, https://goo.gl/m25gce]За годы, прошедшие после новаторского исследования Эйнсворт, исследователи изучили множество факторов, которые могут помочь определить, развиваются ли у детей безопасные или небезопасные отношения со своими первичные вложения фигур.Как упоминалось выше, одной из ключевых детерминант моделей привязанности является история чутких и отзывчивых взаимодействий между опекуном и ребенком. Короче говоря, когда ребенок неуверен или находится в стрессе, способность опекуна оказывать ему поддержку имеет решающее значение для его или ее психологического развития. Предполагается, что такое поддерживающее взаимодействие помогает ребенку научиться регулировать свои эмоции, дает ему уверенность в изучении окружающей среды и предоставляет ребенку безопасное убежище в стрессовых обстоятельствах.
Доказательства роли чуткого ухода в формировании моделей привязанности получены в результате лонгитюдных и экспериментальных исследований. Например, Grossmann, Grossmann, Spangler, Suess и Unzner (1985) изучали взаимодействие родителей и детей в домах 54 семей до трех раз в течение первого года жизни ребенка. В 12-месячном возрасте младенцы и их матери оказались в странной ситуации. Гроссманн и ее коллеги обнаружили, что дети, которые были классифицированы как безопасные в странной ситуации в возрасте 12 месяцев, с большей вероятностью, чем дети, классифицированные как небезопасные, имели матерей, которые заботливо заботились о своих детях в домашней обстановке.
Ван ден Бум (1994) разработал методику вмешательства, направленную на усиление чувствительной реакции матери. Когда младенцам было 9 месяцев, матери в группе вмешательства были оценены как более отзывчивые и внимательные во взаимодействии с младенцами по сравнению с матерями в контрольной группе. Кроме того, их младенцы были оценены как более общительные, успокаивающие себя и более склонные исследовать окружающую среду. В 12-месячном возрасте дети из группы вмешательства с большей вероятностью были классифицированы как безопасные, чем незащищенные в странной ситуации.
Исследователи привязанности изучили связь между моделями привязанности детей и их адаптацией с течением времени. Например, исследователи выяснили, что дети, которые в странной ситуации классифицируются как безопасные, с большей вероятностью будут иметь хорошие отношения со сверстниками, будут положительно оценены учителями и с большим усердием будут настойчиво выполнять сложные задания. Напротив, неуверенно избегающих детей с большей вероятностью будут считать «хулиганами» или им будет трудно строить и поддерживать дружеские отношения (Weinfield, Sroufe, Egeland, & Carlson, 2008).
Хотя Боулби был в первую очередь сосредоточен на понимании природы взаимоотношений между младенцем и опекуном, он считал, что привязанность характеризует человеческий опыт на протяжении всей жизни. Однако только в середине 1980-х исследователи начали серьезно относиться к возможности того, что процессы привязанности могут иметь отношение к взрослой жизни. Хазан и Шейвер (1987) были двумя из первых исследователей, которые исследовали идеи Боулби в контексте романтических отношений. Согласно Хазану и Шейверу, эмоциональная связь, которая развивается между взрослыми романтическими партнерами, частично является функцией той же системы мотивации — поведенческой системы привязанности, которая порождает эмоциональную связь между младенцами и их опекунами.Хазан и Шейвер отметили, что в обоих типах отношений люди (а) чувствуют себя в безопасности, когда рядом присутствует другой человек; (б) обращаться к другому человеку во время болезни, стресса или страха; (c) использовать другого человека как «надежную базу» для исследования мира; и (г) разговаривать друг с другом на уникальном языке, который часто называют «моферез» или «детский лепет». (См. Центральную тему 2)
Основная тема 2:
Вложения и социальные сети
Веб-сайты социальных сетей и услуги мобильной связи начинают играть все более важную роль в жизни людей.Многие люди используют Facebook, например, чтобы поддерживать связь с семьей и друзьями, сообщать своим близким о том, что происходит в их жизни, и встречаться с людьми, которые разделяют схожие интересы. Более того, современные сотовые технологии позволяют людям общаться со своими близкими намного проще, чем это было возможно всего 20 лет назад.
С точки зрения привязанности, эти инновации в коммуникационных технологиях важны, потому что они позволяют людям оставаться на связи виртуально со своими фигурками, независимо от физического расстояния, которое может существовать между ними.Недавние исследования начали изучать, как процессы привязанности проявляются при использовании социальных сетей. Олдмидоу, Куинн и Коверт (2013), например, изучили разнообразную выборку людей и оценили безопасность их привязок и использование Facebook. Олдмидоу и его коллеги обнаружили, что использование Facebook может выполнять функции привязки. Например, люди чаще сообщали об использовании Facebook для связи с другими, когда испытывали негативные эмоции. Кроме того, исследователи обнаружили, что люди, которые больше беспокоились о своей ориентации на привязанность, с большей вероятностью использовали Facebook часто, но люди, которые были более избегающими, использовали Facebook меньше и были менее открыты на сайте.
На основе этих параллелей Хазан и Шейвер (1987) утверждали, что взрослые романтические отношения, такие как отношения между младенцем и опекуном, являются привязанностями. По словам Хазана и Шейвера, по мере развития люди постепенно передают функции, связанные с привязанностью, от родителей к сверстникам. Таким образом, хотя маленькие дети, как правило, используют своих родителей в качестве основных фигур привязанности, по мере того, как они достигают подросткового и юношеского возраста, они начинают больше полагаться на близких друзей и / или романтических партнеров в выполнении основных функций, связанных с привязанностью.Таким образом, хотя маленький ребенок может обратиться к своей матери за утешением, поддержкой и советом, когда он расстроен, напуган или болен, молодые люди с большей вероятностью обратятся к своим романтическим партнерам с этими целями в аналогичных ситуациях.
Хазан и Шейвер (1987) попросили разнообразную выборку взрослых прочитать три абзаца ниже и указать, какой из них лучше всего характеризует их образ мышления, чувств и поведения в близких отношениях:
- Мне несколько неудобно быть рядом с другими ; Мне трудно полностью доверять им, трудно позволить себе полагаться на них.Я нервничаю, когда кто-то подходит слишком близко, и часто другие хотят, чтобы я был более близким, чем я чувствую себя комфортно.
- Мне относительно легко сближаться с другими людьми, и мне комфортно зависеть от них, и когда они зависят от меня. Меня не волнует, что меня бросят или кто-то подойдет ко мне слишком близко.
- Я считаю, что другие не хотят подходить так близко, как мне хотелось бы. Я часто беспокоюсь, что мой партнер не любит меня на самом деле или не захочет оставаться со мной. Я хочу сблизиться со своим партнером, и это иногда отпугивает людей.
Концептуально эти описания были разработаны, чтобы представить то, что Хазан и Шейвер считали взрослыми аналогами типов привязанности, описанных Эйнсворт в странной ситуации (избегающей, безопасной и тревожной, соответственно). Хазан и Шейвер (1987) обнаружили, что распределение трех паттернов было похоже на то, что наблюдалось в младенчестве. Другими словами, около 60% взрослых отнесли себя к категории защищенных (параграф B), около 20% назвали себя избегающими (параграф A) и около 20% назвали себя устойчивыми к тревоге (параграф C).Более того, они обнаружили, что люди, которые, например, считали себя защищенными, с большей вероятностью сообщали о теплых и доверительных отношениях со своими родителями, когда они росли. Кроме того, они чаще относились к романтическим отношениям положительно. Основываясь на этих выводах, Хазан и Шейвер (1987) пришли к выводу, что те же типы индивидуальных различий, которые существуют в младенческой привязанности, существуют и во взрослой жизни.
Исследование привязанности в зрелом возрасте
Теория привязанности вдохновила большое количество литературы по социальной, личностной и клинической психологии.В следующих разделах я даю краткий обзор некоторых основных вопросов исследования и того, что исследователи узнали о привязанности в зрелом возрасте.
Кто с кем кончает?
Люди, у которых в детстве были относительно надежные привязанности, становятся более надежными романтическими привязанностями. [Изображение: CC0 Public Domain, https://goo.gl/m25gce]Когда людей спрашивают, какие психологические или поведенческие качества они ищут в романтическом партнере, подавляющее большинство людей указывают, что ищут кого-то, кто доброта, забота, доверие и понимание — вот те качества, которые характеризуют «надежного» человека, осуществляющего уход (Chappell & Davis, 1998).Но мы знаем, что люди не всегда заканчивают тем, что соответствуют их идеалам. Неужели у защищенных людей больше шансов оказаться с надежными партнерами — и, наоборот, у незащищенных людей больше шансов оказаться с незащищенными партнерами? Большинство исследований, проведенных на сегодняшний день, предполагают, что ответ — «да». Фрейзер, Байер, Фишер, Райт и ДеБорд (1996), например, изучили паттерны привязанности более чем 83 гетеросексуальных пар и обнаружили, что, если мужчина был относительно безопасен, женщина, вероятно, также была в безопасности.
Один важный вопрос заключается в том, существуют ли эти результаты, потому что (а) защищенные люди с большей вероятностью будут привлечены к другим защищенным людям, (б) защищенные люди могут со временем создать безопасность у своих партнеров или (в) некоторая комбинация эти возможности. Существующие эмпирические исследования решительно поддерживают первую альтернативу. Например, когда у людей есть возможность взаимодействовать с людьми, которые различаются по уровню безопасности в контексте быстрого знакомства, они проявляют больший интерес к тем, у кого безопасность выше, чем к тем, кто более небезопасен (McClure, Lydon, Baccus, & Baldwin , 2010).Однако есть также некоторые свидетельства того, что стили привязанности людей взаимно формируют друг друга в близких отношениях. Например, в ходе лонгитюдного исследования Хадсон, Фрэйли, Викари и Брамбо (2012) обнаружили, что, если у одного человека в отношениях произошло изменение в безопасности, его или ее партнер, скорее всего, испытает изменение в том же направлении.
Отношения Функционирование
Исследования неизменно демонстрируют, что люди, которые относительно безопасны, с большей вероятностью, чем незащищенные люди, будут иметь хорошо функционирующие отношения — отношения, которые более удовлетворительны, более устойчивы и менее характеризуются конфликтом.Например, Фини и Ноллер (1992) обнаружили, что незащищенные люди с большей вероятностью, чем безопасные люди, испытают разрыв своих отношений. Кроме того, безопасные люди с большей вероятностью сообщают об удовлетворительных отношениях (например, Collins & Read, 1990) и с большей вероятностью будут оказывать поддержку своим партнерам, когда их партнеры испытывают стресс (Simpson, Rholes, & Nelligan, 1992).
Формирует ли ранний опыт привязанность взрослых?
Совместная еда, праздники и традиции — это один из способов, с помощью которых мы с раннего возраста устанавливаем надежную привязанность с нашими близкими.[Изображение: iwona_kellie, https://goo.gl/B406LK, CC BY-NC-SA 2.0, https://goo.gl/Toc0ZF]Большинство исследований по этой проблеме ретроспективно, то есть основано на рассказы взрослых о том, что они вспоминают о своем детском опыте. Такой вид работы предполагает, что безопасные взрослые с большей вероятностью будут описывать свой ранний детский опыт общения с родителями как поддерживающий, любящий и добрый (Hazan & Shaver, 1987). Появляется ряд лонгитюдных исследований, которые демонстрируют предполагаемую связь между ранним опытом привязанности и стилями привязанности взрослых и / или межличностным функционированием во взрослом возрасте.Например, Fraley, Roisman, Booth-LaForce, Owen, and Holland (2013) обнаружили на выборке из более чем 700 человек, изученных от младенчества до взрослого возраста, что материнская чувствительность в процессе развития перспективно предсказывала безопасность в 18 лет. Simpson, Collins, Tran, и Хейдон (2007) обнаружили, что безопасность привязанности, оцениваемая в младенчестве в странной ситуации, предсказывала компетентность сверстников в 1-3 классах, что, в свою очередь, предсказывало качество дружеских отношений в возрасте 16 лет, что, в свою очередь, предсказывало выражение положительных и отрицательных эмоций во взрослых романтических отношениях в возрасте от 20 до 23 лет.
На основании таких результатов легко уйти, приняв ошибочное предположение, что ранний опыт «определяет» более поздние результаты. Чтобы было ясно: теоретики привязанности предполагают, что связь между ранним опытом и последующими результатами является вероятностной, а не детерминированной. Предполагается, что наличие благоприятного и отзывчивого опыта общения с опекунами в раннем возрасте закладывает основу для позитивного социального развития. Но это не означает, что образцы привязанности высечены в камне. Короче говоря, даже если у человека далеко не оптимальный опыт в раннем возрасте, теория привязанности предполагает, что для этого человека возможно развитие хорошо функционирующих взрослых отношений с помощью ряда корректирующих опытов, включая отношения с братьями и сестрами, другими членами семьи, учителями.