За что отвечает антимюллеров гормон у женщин: Анализы на Антимюллеров гормон, цены в лаборатории KDL
Программы и акции ФНКЦ ФМБА
Овариальный резерв представляет собой запас яйцеклеток в организме. Он отвечает за репродуктивную функцию женщины. Определение овариального резерва выполняется с помощью комплекса диагностических процедур, что дает возможность оценить количество, характер, стадию зрелости яйцеклеток, предположить возможность успешного оплодотворения, а также выявить отклонения от нормы.
Для кого подходит программа
Программа предназначена для тех, кто в будущем планирует стать родителями, чтобы определить возможность успешного зачатия, а также для пар, которые уже столкнулись с репродуктивными проблемами.
Оценка овариального резерва в этом случае — один из этапов диагностического поиска проблемы.
Что входит в программу
Программа включает сдачу крови на ключевые половые гормоны, выполнение ультразвукового исследования, консультацию врача-гинеколога-эндокринолога.
Как проходит программа
Сначала вы сдаёте лабораторные анализы. Взятие крови проводится натощак.
Цель исследования – определить содержание следующих гормонов в крови:
· Исследование уровня фолликулостимулирующего гормона (ФСГ). Этот гормон координирует работу всех половых желез, изменение его содержания незамедлительно отражается на состоянии половой системы.
· Исследование уровня лютеинизирующего гормона (ЛГ). Наравне с ФСГ, ЛГ необходим для оптимальной работы репродуктивной системы.
· Исследование антимюллерова гормона. Антимюллеров гормон вырабатывается фолликулами яичников, дает прямое представление об овариальном резерве.
· Исследование уровня общего эстрадиола. По содержанию этого гормона можно судить о работе яичников.
Далее выполняется УЗИ органов малого таза.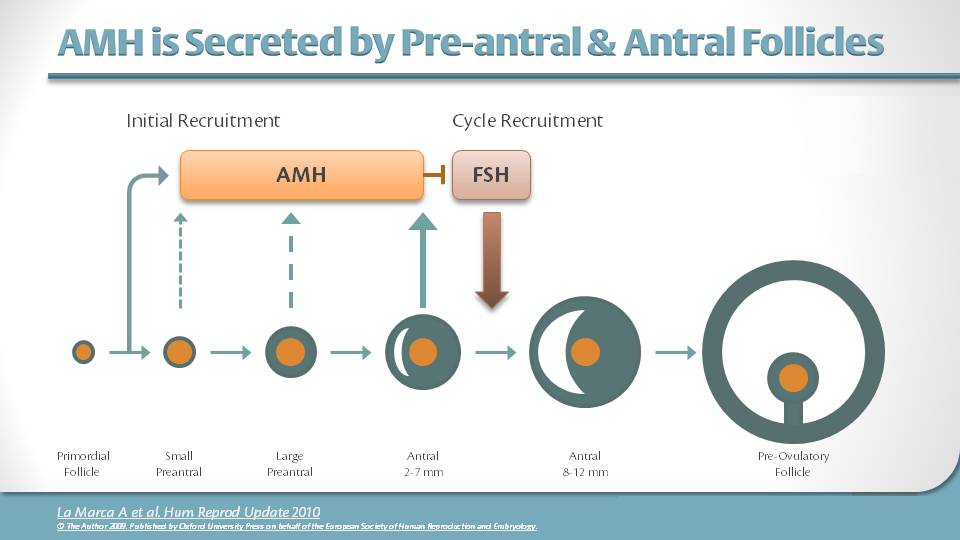 Данный метод позволяет оценить состояние органов половой системы, врожденные особенности, патологические изменения, которые характерны для того или иного заболевания.
Данный метод позволяет оценить состояние органов половой системы, врожденные особенности, патологические изменения, которые характерны для того или иного заболевания.
С результатами исследований Вы отправляетесь на консультацию врача-гинеколога-эндокринолога. Врач проведет опрос, осмотр, оценит результаты лабораторных и инструментальных исследований.
В зависимости от цели сдачи анализов, врач даст общие рекомендации в случае хороших результатов, ответит на интересующие вопросы. В случае выявления отклонений по результатам анализов врач определит индивидуальный план лечения.Стоимость программы
7000 ₽
*Программа рассчитана для стандартного клинического случая. Могут быть рекомендованы дополнительные обследования при наличии соответствующих показаний. Скидки предусмотренные программой не суммируется с другими скидками и специальными предложениями в ФГБУ ФНКЦ ФМБА России, дополнительные медицинские услуги оплачиваются в обычном порядке.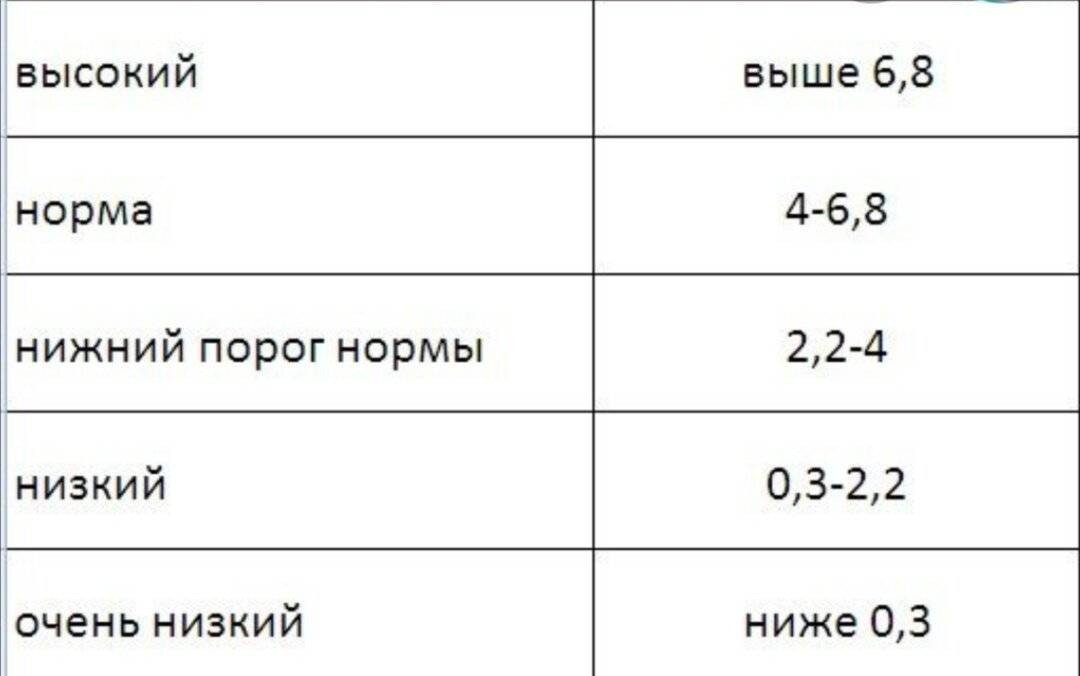
Описание анализа Антимюллеров гормон в Макеевка
Код: 01-015
Цена: 1700 руб
Описание
Функции АМГ у мужчин.
У мужчин особое значение Антимюллеров гормон имеет в период эмбрионального и полового созревания. Начиная вырабатываться еще в эмбриональном периоде, отвечает за обратное развитие мюллеровых протоков — зачаточных образований будущих половых органов.
После рождения Антимюллеров гормон синтезируется до периода полового созревания мужскими яичками. Затем синтез гормона прогрессивно снижается и сохраняется на очень низком уровне.
Нарушение выработки Антимюллерова гормона вызывает у мальчиков формирование крипторхизма (неопущение яичка в мошонку к рождению), паховых грыж и нарушения в репродуктивной функции, иногда это дает ложный гермафродитизм. У мужчины в условиях низкого гормонального фона выявляется бесплодие, несмотря на то, что яички сформированы нормально.
Функции АМГ у женщин.
У женщин Антимюллеров гормон вырабатывается с внутриутробного периода и до момента угасания половой функции. Но до наступления периода половой зрелости уровень АМГ низкий.
Если уровень Антимюллерова гормона у женщин снижен, нарушается репродуктивная функция и созревание фолликулов. При дефиците этого гормона яйцеклетки не могут нормально вызревать. Это может стать причиной бесплодия.
Подготовка к анализу
Кровь для исследования сдается утром натощак после 8-12 часового ночного периода голодания (можно пить воду). Накануне перед сдачей крови следует исключить из рациона жирную пищу.
Требования
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом.
Референсные значения (норма):
Антимюллеров гормон, нг/мл | 0. | Мужчины |
| Женщины: | |
0.02 – 11.0 | любой д.м.ц. | |
0.62 – 11.0 | 3-5 д.м.ц. 11-20 лет | |
0.01 – 10.39 | 3-5 д.м.ц. 16-30 лет | |
0.14 – 10.40 | 3-5 д.м.ц. 31-40 лет | |
0.01 — 6.35 | 3-5 д.м.ц. 41-50 лет | |
0.00 — 0.4 | менопауза |
Повышенный уровень Антимюллерова гормона:
- Опухоли в гранулёзных клетках яичников
- Задержка полового развития
- Дефекты рецептора ЛГ
- Билатеральный крипторхизм (мутации АМГ рецептора)
- Нормогонадотропное ановуляторное бесплодие
- Поликистоз яичников
- Мониторинг антиандрогенной терапии
Сниженный уровень Антимюллерова гормона:
- Снижение овариального резерва
- Ожирение в позднем репродуктивном возрасте
- Менопауза
- Дисгенезия гонад
- Гипогонадотропный гипогонадизм
- Анорхизм
- Преждевременное половое развитие
Антимюллеров гормон — рассмотрим таблицу его нормы в организме у женщин.
 Повышение и понижение уровня.
Повышение и понижение уровня.В теле женщины с самого ее непосредственного рождения находится жизненно необходимый антимюллеров гормон, который на протяжении все ее жизни держит определенную планку своего количества, и только когда ее организм переходит в так называемый
Основным направлением его деятельности является контроль яйцеклеток.
Стоит отметить, что не у всех женщин можно определить количество гормона, но об этом и многом другом, вы узнаете с данной статьи. Также в статье вы сможете узнать отчего наблюдается понижение или повышение уровня гормона, и как с этим бороться. Итак, приступим к рассмотрению вопросов.
За что отвечает гормон у женщин?
Как мы уже говорили, что в женском организме он отвечает за количество яйцеклеток. К тому же он производит непосредственное воздействие на определенного рода факторы, которые отвечают за 
Так же немаловажным является то, что нормальную норму этих клеток невозможно определить именно в тот период, когда происходит непосредственное созревание подростка в половом отношении, а также во время его развития.
Его количество подвергается значительному увеличению именно в период репродуктивный, а именно в середине его развития.
Так же антимюллеров гормон практически не меняет своих показателей, в то время когда у женщины наблюдается менструальный цикл. Более того нормативные показатели гормона указывают на возможный спад фертильности у женщин, за достаточно долгий период как нерегулярными становятся месячные.
Именно по этой причине женщины, которые не могут долгое время забеременеть либо выносить малыша просто обязаны сдать соответствующие анализы на непосредственное определение количества этого гормона в организме.
Так как такого рода проблемы напрямую связаны со сбоем функциональности данных клеток, стоит иметь это в виду.
Норма Антимюллерового гормона у женщин
| Мкг/л | Нмоль/л | |
| Фаза фолликулиновая | 0.31-1.52 | 0.98-4.83 |
| Овуляция | 0.75-3.0 | 2.39-9.54 |
| Фаза лютеиновая | 5.1-27 | 16.2-85.9 |
| Постменопауза | 0.1-079 | 0.32-2.51 |
| Первый триместр беременности | 4.7-34 | 14.9-108.1 |
| Второй триместр беременности | 19.4-50 | 61.7-159 |
| Третий триместр беременности | 5.45-160 | 17.3-508.8 |
Когда наблюдается повышение его уровня?
В первую очередь, на чем бы хотелось поставить акцент так это на том, что значительный рост уровня данного гормона именно у женщин является причиной таких заболеваний как поликистоз яичников и опухоль в области яичников, у которой нормонадотропный характер.
Более того такого рода отклонения качающиеся нормы гормона могут свидетельствовать о бесплодии, а именно эндокринном нормогонадотропном, либо задержке непосредственного развития полового характера.
Но стоит отметить, что повышение клеток не во всех случаях указывает непосредственно на наличие каких-то заболеваний. Так как во время сдачи анализов немаловажное значение имеет именно общее состояние человека.
Потому что если он в данный период находится в стрессовом состоянии, обладает какими-то заболеваниями острой формы, непосредственно перед манипуляцией подвергал свой организм физическим нагрузкам, то в таких случаях достаточно частым явлением являются ошибочные данные.
Стоит запомнить это и в случае чего иметь в виду этот вариант. Но всегда стоит учитывать, что только хороший специалист определит точный диагноз и скажет, что предпринимать дальше.
Как понизить гормон в организме женщины?
Несомненно когда женщина узнает о том что норма гормона не находится в необходимом количестве, а достаточно низка. То естественно она занимается поиском путей, посредством которых можно такого рода уровень повысить.
Но не стоит забывать, что данные клетки являются своеобразным показателем того в каком состоянии находятся фолликулы. Именно они и представляют собой «недуг», который необходимо вылечить.
Так как посредством максимальной нормализации их количества и качества достаточно просто поднять уровень гормона. Сделать это можно принимая витамин D3 и DHEA. Так же немаловажным является то, что степень нормализации клеток в летний период на восемнадцать процентов выше, нежели в зимнее время года.
Данная особенность наблюдается благодаря воздействию на организм витамина D3.
Посредством его непосредственного воздействия клетки (гранулезные) стремительно начинают процесс выработки антимюллерового гормона, тем самым провоцируя значительное повышение в крови его количества.
Причины понижения уровня
Если у человека в значительной степени пониженный показатель антимюллерового гормона, в таком случае это может говорить только о том, что в его организме происходит развитие заболеваний.
Это может быть спад резерва (овариального), менопауза, половое развитие, которое началось раньше срока, ожирение, в особенности в репродуктивном возрасте, недостаточность в области яичников.
Так же немаловажным является то, что такого рода сбои являются свидетельством того, что женщина не может иметь детей, то есть у нее бесплодие.
Но стоит отметить, что не нужно опускать руки и отчаиваться таким женщинам, так как низкий уровень данных клеток обязан быть в сочетании с высоким уровнем ФСГ. Поэтому если такого рода показатели отсутствуют, тогда проблема сбоя в другом.
Как повысить низкий показатель гормона?
Самое главное чтобы вы понимали, что непосредственный тест на определение количества гормона в вашей крови является попросту своеобразным маркером, который в полной степени показывает то, в каком состоянии находятся ваши яичники.
Учитывая тот факт, что степень клеток в жизненный период женщины происходят изменения количества гормонов исключительно вниз.
То даже низкие показатели АМГ вы должны воспринимать как своеобразное пробуждение непосредственно к тому или иному действию. Но, тем не менее, вы должны смириться с низким уровнем гормонов в вашем организме, так как на сегодняшний день медицина не может его повысить.
Как правильно подготовиться к сдаче анализов?
Стоит отметить, что такого рода анализ сдается исключительно на третий или пятый день менструального цикла. К тому же непосредственно перед манипуляцией, а именно за три часа нельзя принимать еду, а за два дня перед сдачей анализов прекратить применения гормонов тиреоидного и стероидного характера.
Более того нужно избегать нервозности, а непосредственно перед сдачей анализа не пить напитки содержащие алкоголь и не курить. К тому же не желательно в ближайшее время после вашей какой-либо болезни или существенных физических нагрузок проводить такого рода манипуляцию.
К качестве материала проверки у вас непосредственно из вены возьмут кровь, посредством которой определят степень гормона в организме.
Роль антимюллерова гормона в патофизиологии, диагностике и лечении синдрома поликистозных яичников: обзор
Определение
Синдром поликистозных яичников (СПКЯ) является наиболее частой причиной хронической ановуляции и гиперандрогении у молодых женщин и затрагивает от 5 до 10% женского населения [42, 43]. СПКЯ — это диагноз исключения и определяется по Роттердамской классификации (2003 г.) [44], требующей по крайней мере 2 из 3 следующих характеристик: (i) нарушение цикла, (ii) клинический или биологический гиперандрогенизм, (iii) избыток антральных фолликулов. на УЗИ ≥ 12 фолликулов от 2 до 9 мм на яичник и / или объем яичника ≥ 10 мл.Нарушения обмена веществ часто связаны с СПКЯ (до 50%), включая повышенный уровень инсулинорезистентности, независимо от ожирения [45]. Таким образом, СПКЯ ложится значительным экономическим бременем на национальные системы здравоохранения [46]. СПКЯ почти наверняка является генетическим заболеванием, но точные причины гиперандрогении и ановуляции, которые не всегда связаны, все еще исследуются [47, 48].
Патофизиология
СПКЯ характеризуется повышенным количеством фолликулов на всех стадиях роста [49–51].Это увеличение особенно заметно в преантральных и малых антральных фолликулах, которые в первую очередь продуцируют АМГ [52, 53]. Таким образом, повышенный уровень АМГ в сыворотке как отражение запаса преантральных и малых антральных фолликулов у женщин с СПКЯ в 2-4 раза выше, чем у здоровых женщин [54-57], и обнаруживается во всех популяциях СПКЯ [21, 22]. ].
Это увеличение сывороточного АМГ первоначально предполагалось только из-за большего количества преантральных и малых антральных фолликулов. Однако было обнаружено, что продукция AMH гранулезными клетками in vitro в 75 раз выше при ановуляторном СПКЯ и в 20 раз выше при нормовуляторном СПКЯ, чем в нормальных яичниках [55].Это предполагает, что повышенные уровни АМГ в сыворотке крови при СПКЯ также могут отражать внутреннюю дисрегуляцию клеток гранулезы, в которой сам АМГ может быть вовлечен, поскольку также была продемонстрирована избыточная экспрессия рецептора АМГ типа II (AMHRII) [58, 59]. .
Причина такой высокой продукции AMH в антральных фолликулах из PCO в настоящее время неизвестна, но есть данные, подтверждающие роль андрогенов. Действительно, сообщалось о положительной корреляции между уровнями андрогенов в сыворотке и АМГ, и избыточная продукция андрогенов может быть внутренним дефектом текальных клеток при СПКЯ [21, 22, 60–62].
Исследования показали противоречивые результаты относительно регуляции АМГ гонадотропинами. По мнению некоторых авторов, гонадотропины (особенно ФСГ) ингибируют продукцию АМГ в сыворотке крови in vivo в нормальных яичниках [63, 64]. Pellat et al. [55] также продемонстрировали снижение продукции АМГ в клетках гранулезы у женщин с СПКЯ, стимулированное ФСГ, но у «нормальных» женщин такого эффекта не обнаружено. Напротив, другие продемонстрировали стимулирующий эффект ФСГ на экспрессию АМГ в нормальных яичниках, а также при СПКЯ [65].Недавнее открытие, что E2 ингибирует экспрессию AMH, может согласовать эти разные результаты [66]: FSH может напрямую стимулировать AMH в небольших антральных фолликулах, если они не экспрессируют ароматазу. Но в более крупных фолликулах, увеличивая продукцию E2 с привлечением доминантного фолликула, FSH будет оказывать косвенное ингибирующее действие на экспрессию AMH через отрицательную обратную связь E2 (рис.).
Схематическая диаграмма регуляции AMH с помощью FSH и E2 в GC малых и больших антральных фолликулов.По материалам Grynberg M et al. JCEM, 2012 [65]. До малой антральной стадии секреция АМГ стимулируется различными факторами, такими как ФСГ. Продукция эстрадиола (E2) под влиянием ФСГ нарушается из-за ингибирующего действия АМГ на ароматазу. Когда концентрация эстрадиола достигает определенного порога в больших антральных фолликулах, он способен полностью подавлять экспрессию АМГ через ERβ, который преобладает в растущих фолликулах, преодолевая, таким образом, стимуляцию ФСГ. В больших фолликулах от PCO отсутствие вызванной ФСГ продукции E2 и высокий уровень AMH нарушают переход от AMH к тону E2, что приводит к остановке фолликулов
Также было продемонстрировано, что AMH значительно снижает не только экспрессия рецептора ФСГ, но также экспрессия ароматазы яичников [18].Это позволяет защитить маленькие фолликулы от преждевременной экспрессии ароматазы. Однако, когда этот защитный эффект превышает его физиологическую роль из-за избытка АМГ и / или из-за того, что он длится дольше, чем должен, в более крупных фолликулах, это может привести к нарушению выбора доминирующего фолликула, вызывая, таким образом, так называемое «нарушение». фолликулярный арест ». Тот факт, что АМГ ингибирует ФСГ-зависимые факторы, необходимые для доминирования фолликулов, придает большое значение высокой экспрессии АМГ в сыворотке, обнаруживаемой при СПКЯ, и делает АМГ предполагаемым центральным звеном «остановки фолликулов».В хорошем согласии клинические исследования показали связь между высоким уровнем АМГ и нарушением овуляции [55]. Точно так же ЛГ, по-видимому, стимулирует продукцию АМГ клетками гранулезы у женщин с СПКЯ [55]. Приобретение рецепторов ЛГ клетками гранулезы происходит раньше при СПКЯ [67]. Кроме того, некоторые авторы продемонстрировали, что ЛГ снижает экспрессию AMHRII в лютеиновых клетках гранулезы в нормальных яичниках и у женщин с нормоовуляторным СПКЯ, тогда как он не может этого сделать у женщин с ановуляторным СПКЯ [65, 68].Помимо стимулирующего эффекта ЛГ на экспрессию АМГ, это отсутствие индуцированного ЛГ подавления экспрессии AMHRII у женщин с ановуляторным СПКЯ может способствовать ановуляции. Следовательно, преждевременное действие ЛГ также может способствовать «остановке фолликулов» через механизм, включающий систему АМГ [67, 69].
Подводя итог, можно сказать, что при СПКЯ существует множество аномалий фолликулогенеза: (i) увеличенное количество маленьких растущих фолликулов [50], (ii) ингибирование роста терминальных фолликулов [51], что приводит к отсутствию отбора доминантного фолликула, так называемая «остановка фолликула» [70], и (iii) дефект апоптоза фолликула, усугубляющий избыток растущих фолликулов [71, 72].
Сывороточный АМГ в диагностике СПКЯ
Учитывая его сильное значение в патофизиологии СПКЯ, сывороточный АМГ может считаться «золотым стандартом» в диагностике СПКЯ. Несмотря на то, что сывороточный АМГ теоретически более точен, чем AFC, поскольку он также отражает избыток мелких фолликулов, невидимых на УЗИ [25, 6, 73] (рис.), Все же считается преждевременным делать этот диагностический переход.
Обоснование использования сывороточного анализа AMH в качестве зонда для PCOM.Dewailly, D., et al., Hum Reprod Update, 2014 г. [24]. a Все растущие фолликулы секретируют АМГ, но сывороточный АМГ отражает только секрецию более крупных фолликулов, находящихся в контакте с сосудистым руслом. Поскольку количество фолликулов на всех стадиях роста сильно связано друг с другом, считается, что сывороточный AMH отражает сумму растущих фолликулов, но не количество примордиальных фолликулов, которые не секретируют AMH. b При PCO количество всех растущих фолликулов увеличивается, что приводит к заметному увеличению уровня АМГ в сыворотке.АМГ можно рассматривать как более глубокий и более чувствительный зонд для определения избытка фолликулов, чем количество фолликулов с помощью ультразвука (U / S), поскольку он оценивает больше классов фолликулов (синие стрелки)
Устойчивая связь между AMH и AFC привела некоторых авторов к сравнить их эффективность при диагностике СПКЯ [74]. Однако результаты современной литературы неоднородны [11]. Частично эта неоднородность связана с отсутствием четко определенной популяции. В частности, некоторые авторы использовали определение СПКЯ, принятое в 2003 г. на конференции в Роттердаме, с использованием 12 фолликулов диаметром 2–9 мм на яичник для определения морфологии поликистозных яичников (PCOM) [75].Это ограничение во многом зависит от ультразвукового оборудования и навыков оператора, как продемонстрировали Dewailly et al. [76]. Таким образом, с последним поколением ультразвука порог изменился и теперь составляет 19 или 25 [73, 77, 78]. Этот порог, вероятно, будет продолжать расти по мере разработки новых ультразвуковых технологий и оборудования. Кроме того, существуют критические вопросы относительно того, какие группы населения включены или исключены из нормативной совокупности. Наконец, существуют технические проблемы, связанные с анализом сывороточного АМГ, что приводит к еще большей неоднородности результатов в литературе.
Поэтому пока невозможно предложить согласованный и универсальный диагностический порог для сывороточного AHM в прогнозировании СПКЯ. Однако, по нашему опыту, пороговое значение 35 пмоль / л (4,9 нг / мл) с помощью иммуноферментного анализа AMH-EIA (набор EIA AMH / MIS) («Immunotech», ref A16507), предоставленного Beckman Coulter (Франция), привело к хорошая специфичность (97%) и лучшая чувствительность, чем AFC (92%), чтобы отличить женщин с СПКЯ от нормальных женщин [73]. Этот результат был получен после исключения женщин с бессимптомным PCO из контрольной группы с помощью кластерного анализа, математической процедуры, которая позволяет избежать использования заранее определенных пороговых значений для AMH и AFC.Этот подход был воспроизведен в других условиях [77]. Pigny et al. (неопубликованные данные) также сравнили пять анализов сывороточного AMH (как описано выше) для диагностики СПКЯ. Они предложили с помощью ручных анализов ELISA более высокое пороговое значение 5,6 нг / мл (40 пмоль / л) в качестве биологических критериев, указывающих на PCOM, что соответствует 95 -м процентилям «чистых» контролей. Они также предложили пороговое значение 4,2 нг / мл (30 пмоль / л) для автоматических анализов (неопубликованные данные). В случае подтверждения с помощью новых автоматизированных анализов сывороточного AMH или сверхчувствительного анализа, высокий уровень AMH в сыворотке может стать надежным и точным маркером PCOM и в конечном итоге заменить AFC, который также является предметом больших споров в литературе.Поскольку «повышенный уровень AMH в сыворотке» не относится к морфологии яичников, аббревиатура «PCOM» не подходит, и поэтому мы предложили термин «PCO-подобная аномалия» (т.е. PCOM и / или повышенный уровень AMH в сыворотке) в качестве третьего элемент Роттердамской классификации, а не «PCOM» [79, 74].
Уровень АМГ в сыворотке также коррелирует с тяжестью симптомов СПКЯ [68] и выше при гиперандрогении [62, 80] или олиго-ановуляции [21, 55, 81]. Анализ главных компонентов показал, что высокий уровень АМГ в сыворотке может рассматриваться как маркер гиперандрогении и может также использоваться в качестве замены этого пункта в Роттердамской классификации [82].
Это позволит согласовать различные классификации, доступные в настоящее время для СПКЯ, поскольку некоторые требуют гиперандрогении как необходимого критерия [56]. Таким образом, мы предлагаем следующую стратегию: для диагностики СПКЯ необходимо сначала провести диагностику гиперандрогении и олигоановуляции после исключения всех альтернативных диагнозов. Если он отсутствует, вместо него можно использовать высокий уровень AFC или / и AMH.
У подростков и молодых женщин с СПКЯ иногда бывает трудно оценить яичники при УЗИ.Также бывает сложно оценить долю физиологических и патологических, касающихся угревой сыпи и нарушений цикла. Таким образом, анализ сывороточного АМГ является реальной альтернативой, поскольку он рекомендован Американской ассоциацией клинических эндокринологов [83]. Подростки с СПКЯ имеют более высокие уровни АМГ в сыворотке с пороговым значением 30 пмоль / л [84], что находится в диапазоне значений, найденных в литературе для пожилых женщин с СПКЯ [85, 86].
Однако следует отметить, что пороговые значения для чрезмерного AFC или высокого уровня АМГ в сыворотке должны быть пересмотрены и утверждены во всем мире, поскольку недавние технические разработки в области ультразвука и анализов могут привести к их модификации.А пока рекомендуется, чтобы каждый центр устанавливал свои собственные пороговые значения.
Антимюллеровы гормоны и резерв яичников: обновленная информация об оценке функции яичников | Журнал клинической эндокринологии и метаболизма
Абстрактные
Контекст
Антимюллеров гормон (АМГ) вырабатывается гранулезными клетками небольших растущих фолликулов яичника. Уровни АМГ в сыворотке сильно коррелируют с количеством растущих фолликулов, поэтому АМГ привлекает все большее внимание как маркер резерва яичников.В этом обзоре обобщены недавние открытия и ограничения в применении сывороточного АМГ для оценки резерва яичников.
Получение доказательств
Был проведен поиск в PubMed с целью найти недавнюю литературу по измерениям и использованию сывороточного АМГ в качестве маркера овариального резерва.
Evidence Synthesis
Уровни AMH в сыворотке измеряются для оценки «функционального резерва яичников», термина, который предпочтительнее «резерва яичников», поскольку уровни AMH отражают пул растущих фолликулов, которые потенциально могут овулировать.Уровни АМГ в сыворотке используются в индивидуальных протоколах дозирования фолликулостимулирующего гормона и могут прогнозировать риск плохого ответа или синдрома гиперстимуляции яичников, но имеет ограниченное значение для прогнозирования продолжающейся беременности. Уровни АМГ в сыворотке крови изучаются для прогнозирования естественного возраста менопаузы или возраста, связанного с заболеванием. Исследования показывают, что темпы снижения АМГ в зависимости от возраста у женщин различаются. Обобщенная реализация измерения АМГ в сыворотке также привела к увеличению количества диагностических тестов, в том числе автоматизированных.Однако прямое сравнение результатов остается проблематичным.
Заключение
Сывороточный АМГ остается предпочтительным маркером резерва яичников. Однако отсутствие международного стандарта для сравнения AMH ограничивает между анализами AMH. Кроме того, мало что известно об эндогенных и экзогенных факторах, влияющих на уровни АМГ в сыворотке, что ограничивает правильную интерпретацию значений АМГ в клинических условиях.
Введение
Антимюллеров гормон (АМГ) является членом семейства трансформирующих факторов роста бета, получившего свое название от его роли в дифференцировке по мужскому полу, вызывая регрессию мюллерова протоков.На сегодняшний день AMH наиболее известен как сывороточный маркер функции яичников с оценкой уровней AMH на обоих концах спектра, то есть яичникового резерва и синдрома поликистозных яичников. В яичнике АМГ экспрессируется клетками гранулезы растущих фолликулов от первичной до малой антральной стадии. После фолликулостимулирующего гормона (ФСГ) -зависимого отбора экспрессия АМГ исчезает, хотя некоторая экспрессия остается в кумулюсных клетках преовуляторных фолликулов. Кроме того, в атретических фолликулах и желтых телах экспрессия АМГ теряется.Это окно выражения в значительной степени сохраняется среди видов и в яичниках взрослого человека. Повышение уровня экспрессии AMH обнаруживается в фолликулах размером до 8 мм, а в фолликулах размером более 8 мм экспрессия отсутствует. Этот паттерн экспрессии положительно согласуется с концентрациями АМГ в фолликулярной жидкости, показывая самые высокие уровни в фолликулах размером до 8 мм с последующим резким падением (рис. 1А) (1).
Рисунок 1.
Экспрессия и концентрация антимюллерова гормона в зависимости от фолликулогенеза и овариального резерва.( A ) Экспрессия антимюллерова гормона (AMH) увеличивается от вторичной стадии до стадии малого антрального фолликула. В преовуляторных фолликулах АМГ экспрессируется только в гранулезных клетках кумулюса, окружающих ооцит (темно-розовый слой). ( B ) С возрастом функциональный резерв яичников уменьшается в результате истощения пула примордиальных фолликулов. Это приводит к уменьшению количества мелких антральных фолликулов и, как следствие, к снижению уровня АМГ в сыворотке, достигая неопределяемого уровня в период менопаузы. Рисунок, созданный с помощью Biorender.
Рисунок 1.
Экспрессия и концентрация антимюллерова гормона в зависимости от фолликулогенеза и овариального резерва. ( A ) Экспрессия антимюллерова гормона (AMH) увеличивается от вторичной стадии до стадии малого антрального фолликула. В преовуляторных фолликулах АМГ экспрессируется только в гранулезных клетках кумулюса, окружающих ооцит (темно-розовый слой). ( B ) С возрастом функциональный резерв яичников уменьшается в результате истощения пула примордиальных фолликулов.Это приводит к уменьшению количества мелких антральных фолликулов и, как следствие, к снижению уровня АМГ в сыворотке, достигая неопределяемого уровня в период менопаузы. Рисунок, созданный с помощью Biorender.
Поскольку AMH экспрессируется растущими фолликулами до ФСГ-зависимого отбора и, как было показано, обнаруживается в кровотоке, сывороточный AMH приобрел импульс в качестве маркера функции яичников, в частности, при оценке количественного аспекта яичников. резерв, которому и посвящен данный обзор.По определению, яичниковый резерв состоит из качества и количества примордиальных фолликулов, которые с возрастом уменьшаются (2). Количество растущих фолликулов, взятых из пула примордиальных фолликулов, отражает количество примордиальных фолликулов. Поскольку не существует сывороточного маркера, который напрямую может измерить количество примордиальных фолликулов, маркер, отражающий количество растущих фолликулов, в настоящее время является лучшим показателем количественного аспекта резерва яичников. Первоначальные исследования, проведенные почти два десятилетия назад, показали, что уровни АМГ в сыворотке действительно сильно коррелируют с количеством растущих фолликулов и оба снижаются с возрастом (3).На основании этих первоначальных исследований сывороточный AMH был быстро выдвинут в качестве косвенного маркера яичникового резерва, несмотря на ограниченные знания о факторах, регулирующих экспрессию AMH в яичниках, и отсутствие стандартизированных анализов AMH.
Поскольку сывороточный АМГ является лишь косвенным маркером, это привело к путанице или даже неправильному толкованию термина овариальный резерв. Чтобы провести четкое различие между пулом покоящихся примордиальных фолликулов и пулом растущих фолликулов, был предложен термин функциональный резерв яичников (FOR) (4).FOR представляет собой пул фолликулов диаметром от 2 до 5 мм, из которых 1 фолликул должен быть выделен ФСГ и овулировать (4, 5). Этот пул растущих фолликулов известен как фолликулы, продуцирующие АМГ, и поэтому уровни АМГ в сыворотке напрямую отражают ФОР (рис. 1В). Поэтому при клиническом применении сывороточного АМГ для оценки овариального резерва более точным будет использование термина «ЗА». Важность различения овариального резерва и FOR при интерпретации уровней AMH иллюстрируется исследованиями на мышах и немногочисленными исследованиями на людях, в которых определялось количество примордиальных фолликулов.У мышей уровни АМГ оставались постоянными в более молодом возрасте, несмотря на уменьшение количества примордиальных фолликулов. Только в более старшем возрасте уровни АМГ отражали количество примордиальных фолликулов, тогда как во всех возрастах уровни АМГ в сыворотке коррелировали с количеством растущих фолликулов (6). Подобные результаты наблюдались в исследованиях на людях, в которых плотность первичных и первичных фолликулов определялась непосредственно в яичниках, удаленных по доброкачественным гинекологическим показаниям или перед гонадотоксической терапией. У более молодых женщин уровни АМГ не коррелировали, тогда как у женщин позднего репродуктивного возраста значимая корреляция наблюдалась с плотностью примордиальных фолликулов (7-10).Эти исследования показывают, что в любом возрасте уровни АМГ в сыворотке отражают ФОР, и только в более старшем репродуктивном возрасте уровни АМГ могут также отражать резерв яичников. Поэтому в этом обзоре мы будем использовать термин FOR, чтобы обсудить недавние открытия и ограничения в использовании сывороточного АМГ для прогнозирования возраста менопаузы у здоровых женщин и при болезненных состояниях.
Уровни АМГ в сыворотке у населения в целом
Уровни АМГ в сыворотке отрицательно коррелируют с возрастом у взрослых женщин.Однако исследования, направленные на получение нормативных данных для AMH, также показали, что эта корреляция зависит от анализируемой возрастной категории. С момента рождения уровень АМГ повышался до плато примерно в возрасте 25 лет (11, 12). До возраста примерно 16 лет уровни АМГ явно положительно коррелировали с возрастом. Эта положительная корреляция может отражать повышенную скорость рекрутирования примордиальных фолликулов, наблюдаемую от рождения примерно до 14 лет (13). Начиная с 25 лет, уровни АМГ начинают снижаться до неопределяемых уровней в период менопаузы, и только с этого возраста может наблюдаться отрицательная корреляция между уровнями АМГ и возрастом (11, 12).Эта закономерность в зависимости от возраста, по-видимому, одинакова для разных этнических групп (14–16). Однако исследования показывают, что в любом возрасте уровни АМГ в сыворотке значительно варьируются (14, 17, 18). Таким образом, аналогично тому, что наблюдалось при подсчете антральных фолликулов (AFC), существуют большие индивидуальные различия в уровнях AMH (19, 20). Этническая принадлежность может способствовать этому изменению и должна приниматься во внимание при интерпретации ценностей AMH. Хотя пиковые уровни АМГ в возрасте 25 лет были выше у китайских женщин по сравнению с европейскими женщинами, возрастное снижение у китайских женщин было более значительным, что привело к снижению уровней АМГ на 28% и 80% в возрасте 30 и 45 лет соответственно (21).Кроме того, у афроамериканских женщин уровень АМГ в сыворотке был ниже, чем у белых женщин, но с более медленным снижением в зависимости от возраста (22, 23).
Уровни АМГ в сыворотке обычно измеряются на ранней фолликулярной фазе, как и другие гормональные маркеры функции яичников, такие как ФСГ, эстрадиол и ингибин В. Однако возник вопрос, можно ли объяснить вариации уровней АМГ в сыворотке различия во время менструального цикла. В то время как первоначальные исследования предполагали, что уровни АМГ относительно стабильны во время менструального цикла (24), более поздние исследования показывают, что уровни АМГ демонстрируют значительные внутрицикловые вариации до 20.7% (25-27). Хотя небольшое количество людей, проанализированных в этих исследованиях, является ограничением, четкой картины менструального цикла, очевидной для ФСГ или эстрадиола, не было. Скорее, изменение уровней АМГ отражает изменение АФК во время менструального цикла, согласно исследованию Overbeek и соавторов, у женщин, регулярно курсирующих на велосипеде (28). В этом исследовании также было показано, что у женщин с более высоким базальным уровнем АМГ, в основном более молодых женщин, были относительно более высокие уровни АМГ в течение менструального цикла (28).Кроме того, исследования показали, что межцикловые вариации AMH могут составлять от 28% до 163%, в зависимости от используемого анализа AMH (27, 29). Это внутриличностное изменение предполагает, что одно измерение AMH может привести к неточной оценке FOR, что может иметь клинические последствия, когда значение AMH используется в индивидуальном протоколе стимуляции яичников.
Измерение сывороточного АМГ
AMH продуцируется как гомодимер с дисульфидной связью (proAMH) массой 140 кДа, состоящий из ковалентно связанных мономеров, каждая из которых состоит из 560 аминокислот (а.о.) (30).Пропротеин AMH требует расщепления в его одноосновном сайте расщепления на aa451 для образования димера N-концевой прорегиона 110 кДа (AMH N ) и димера зрелой области 25 кДа (AMH C ), которые вместе образуют стабильный нековалентно связанный комплекс (AMH N, C ) (31-33). Исследования in vitro с использованием семенников и клеточных линий плодов крысы показывают, что протеолитическое расщепление АМГ происходит после секреции и необходимо для того, чтобы он стал биологически активным (32). Дополнительный сайт расщепления на aa229, влияние которого на функцию AMH еще предстоит определить, генерирует потенциально 3 дополнительных изоформы AMH, а именно более короткий N-концевой пептид (AMH N, 229 ), среднюю область (AMH M ) и область средней зрелости (AMH M, C ) (рис.2А).
Рисунок 2.
Возможные изоформы антимюллерова гормона (АМГ) и характеристики анализа на АМГ. ( A ) Иллюстрация возможных изоформ AMH, присутствующих в кровотоке. Черные пунктирные линии представляют сайты расщепления по аминокислотам 229 и 451 соответственно. N-концевой прорегион показан зеленым, а С-концевой зрелый регион показан красным. ( B ) Отображает характеристики различных анализов AMH. Захватывающее антитело показано фиолетовым цветом, а детекторное антитело — оранжевым.Тип анализа, предел обнаружения и диапазон измерения различных анализов AMH показаны в таблице ниже. Рисунок создан с помощью Biorender .
Рисунок 2.
Возможные изоформы антимюллерова гормона (АМГ) и характеристики анализа на АМГ. ( A ) Иллюстрация возможных изоформ AMH, присутствующих в кровотоке. Черные пунктирные линии представляют сайты расщепления по аминокислотам 229 и 451 соответственно. N-концевой прорегион показан зеленым, а С-концевой зрелый регион показан красным.( B ) Отображает характеристики различных анализов AMH. Захватывающее антитело показано фиолетовым цветом, а детекторное антитело — оранжевым. Тип анализа, предел обнаружения и диапазон измерения различных анализов AMH показаны в таблице ниже. Рисунок создан с помощью Biorender .
Клиническая важность измерения AMH привела к разработке нескольких тестов AMH. Часто используемые в настоящее время ручные анализы включают модифицированный анализ Gen II (Beckman Coulter) и сверхчувствительный иммуноферментный анализ AMH (ELISA) и анализ picoAMH (оба Ansh Labs), в которых используются антитела, отличные от анализа AMH Gen II (рис. .2Б). ELISA picoAMH имеет улучшенную чувствительность в нижнем диапазоне, что приводит к пределу обнаружения 1,3 пг / мл по сравнению с 0,08 нг / мл для анализа Gen II (рис. 2B). Эта разница в чувствительности может иметь клиническое значение при оценке сывороточного уровня АМГ, особенно в случаях, когда подозревается низкий овариальный резерв. Кроме того, в настоящее время доступны два автоматизированных анализа AMH: Access AMH (Beckman Coulter) и Elecsys AMH (Roche). В этих автоматизированных анализах используется та же пара антител, что и в анализе Gen II (рис.2Б). Тем не менее, прямое сравнение значений AMH, полученных с помощью этих анализов, все еще проблематично. Различия в значениях можно объяснить использованием разных пар антител (для ручных анализов), что может привести к обнаружению различных изоформ АМГ. Также могут иметь значение нестабильность образца или матричный эффект, который влияет на межлабораторную воспроизводимость. Разработка автоматизированных анализов повысила точность, воспроизводимость и скорость измерений и, следовательно, превосходит ручные анализы.
В нескольких исследованиях сравнивали ручные и автоматические анализы и представляли уравнения регрессии, позволяющие сравнивать уровни АМГ в сыворотке, измеренные различными анализами (34–38). Однако, как показано в таблице 1, в зависимости от исследования и уровня AMH степень и направление конверсии значительно меняются. Например, уровень АМГ, равный 1 нг / мл, показал отклонение от –12,8% до –25,2% при сравнении автоматического анализа Elecsys с ИФА Gen II в различных исследованиях.Однако уровень АМГ 5 нг / мл дает разброс от –24% до + 45% (34–36). Сходные результаты были получены при сравнении ИФА Gen II с автоматическим анализом Access (36-38). Корреляция варьировала от –9% до + 34% и от –19,4% до + 7% для 1 нг / мл и 5 нг / мл АМГ, соответственно. Хотя влияние этой вариации на абсолютные значения АМГ может показаться не таким большим, эти изменения повлияют на пороговые значения АМГ и последующее принятие клинических решений при лечении бесплодия.
Таблица 1.Сравнение уравнений регрессии между анализами антимюллерова гормона
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . |
|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0,81 * Gen II — 0,046 | 1 | 0.76 (–24%) | |
| 5 | 4,00 (–20%) | |||
| Hyldgaard et al, 2015 | Elecsys16 0,769 9016 * Поколение II + 1 | 1,45 (+ 45%) | ||
| 5 | 4,17 (–16,6%) | |||
| Nelson et al II, 2015 | Elecs 0,087 | 1 | 0.82 (–18%) | |
| 5 | 3,74 (–25,2%) | |||
| Van Helden et al, 2015 | Elecsys = 0,88 9016 * Поколение II — | 1 | 0,84 (–16%) | |
| 5 | 4,36 (–12,8%) | |||
| Nelson II et al., 2015 г. | 90 = 0,78 + 0,1281 | 0.91 (–9%) | ||
| 5 | 4,03 (–19,4%) | |||
| Van Helden et al, 2015 | Доступ = 0,91 * Поколение II — 0,033 1 | 0,88 (–12%) | ||
| 5 | 4,52 (–9,6%) | |||
| Pearson et al, 2016 | II Access = 1.00 | 1 | 1.34 (+ 34%) | |
| 5 | 5,35 (+ 7%) |
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . |
|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0.81 * Поколение II — 0,046 | 1 | 0,76 (–24%) | |
| 5 | 4,00 (–20%) | |||
, Hyldgaard и др.| Elecsys = 0,68 * Поколение II + 0,769 | 1 | 1,45 (+ 45%) | | |
| 5 | 4,17 (–16,6%) | |||
| Elecsys = 0.73 * Поколение II + 0,087 | 1 | 0,82 (–18%) | ||
| 5 | 3,74 (–25,2%) | |||
| Van Helden et al. | Elecsys = 0,88 * Поколение II — 0,039 | 1 | 0,84 (–16%) | |
| 5 | 4,36 (–12,8%) | Доступ = 0.78 * Поколение II + 0,128 | 1 | 0,91 (–9%) |
| 5 | 4,03 (–19,4%) | |||
| Ван Хелден и др. | Доступ = 0,91 * Поколение II — 0,033 | 1 | 0,88 (–12%) | |
| 5 | 4,52 (–9,6%) | Доступ = 1.00 * Поколение II + 0,341 | 1 | 1,34 (+ 34%) |
| 5 | 5,35 (+ 7%) |
уравнений сравнения между анализами на антимюллеровы гормоны
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . | ||||
|---|---|---|---|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0,81 * Поколение II — 0,046 | 1 | 0,76 (–24%) | |||||
| 20%) | ||||||||
| Hyldgaard et al, 2015 | Elecsys = 0,68 * Gen II + 0,769 | 1 | 1,45 (+ 45%) | |||||
| 4.17 (–16,6%) | ||||||||
| Nelson et al, 2015 | Elecsys = 0,73 * Поколение II + 0,087 | 1 | 0,82 (–18%) | |||||
| 5 | 3,74 (–25,2%) | |||||||
| Van Helden et al, 2015 | Elecsys = 0,88 * Gen II — 0,039 | 1 | 0,84 (–16%) | |||||
| 5 | 4.36 (–12,8%) | |||||||
| Nelson et al, 2015 | Доступ = 0,78 * Поколение II + 0,128 | 1 | 0,91 (–9%) | |||||
| 5 | 4,03 (–19,4%) | |||||||
| Van Helden et al, 2015 | Доступ = 0,91 * Поколение II — 0,033 | 1 | 0,88 (–12%) | |||||
| 5 | 4.52 (–9,6%) | |||||||
| Pearson et al, 2016 | Доступ = 1,00 * Поколение II + 0,341 | 1 | 1,34 (+ 34%) | |||||
| 5,35 (+ 7%) |
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . | ||||
|---|---|---|---|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0,81 * Поколение II — 0,046 | 1 | 0,76 (–24%) | |||||
| 20%) | ||||||||
| Hyldgaard et al, 2015 | Elecsys = 0,68 * Gen II + 0,769 | 1 | 1,45 (+ 45%) | |||||
| 4.17 (–16,6%) | ||||||||
| Nelson et al, 2015 | Elecsys = 0,73 * Поколение II + 0,087 | 1 | 0,82 (–18%) | |||||
| 5 | 3,74 (–25,2%) | |||||||
| Van Helden et al, 2015 | Elecsys = 0,88 * Gen II — 0,039 | 1 | 0,84 (–16%) | |||||
| 5 | 4.36 (–12,8%) | |||||||
| Nelson et al, 2015 | Доступ = 0,78 * Поколение II + 0,128 | 1 | 0,91 (–9%) | |||||
| 5 | 4,03 (–19,4%) | |||||||
| Van Helden et al, 2015 | Доступ = 0,91 * Поколение II — 0,033 | 1 | 0,88 (–12%) | |||||
| 5 | 4.52 (–9,6%) | |||||||
| Pearson et al, 2016 | Доступ = 1,00 * Поколение II + 0,341 | 1 | 1,34 (+ 34%) | |||||
| 5,35 (+ 7%) |
Эти различия между анализами в зависимости от уровней AMH остаются загадочными и вносят вклад в противоречивые результаты в клинических исследованиях по оценке AMH. Отсутствие международного стандарта AMH, даже через 20 лет после разработки первого анализа AMH ELISA, является одной из основных проблем, препятствующих сравнению результатов анализа AMH.Отсутствие единообразно откалиброванных анализов ограничивает разработку стандартизированных пороговых значений AMH, необходимых для повышения безопасности пациентов и предотвращения неправильной интерпретации клиницистами, не знающими об этой вариабельности между анализами.
Различия можно частично объяснить большим разбросом характеристик населения. Некоторые исследования включали женщин, проходящих курс экстракорпорального оплодотворения (ЭКО), в то время как другие включали женщин, подвергшихся лапароскопической стерилизации или образцы с неясным клиническим статусом, связанным с фертильностью.Кроме того, размер выборки был относительно невелик (от 23 женщин до 142 женщин), а возрастной диапазон был весьма различным (23-56 лет). Следовательно, необходимы дополнительные исследования, чтобы обеспечить надлежащее сравнение различных анализов с использованием более крупных, четко определенных когорт, стратифицированных по возрасту.
Кроме того, при разработке международного стандарта AMH важно раскрыть существование и клиническую значимость различных изоформ AMH. Современные анализы обнаруживают проАМГ и АМГ N, C .Однако мало что известно о присутствии и концентрации других изоформ AMH в кровотоке. Хотя фрагмент AMH C является биологически активной формой AMH, Панкхерст и др. Предполагают, что он не обнаруживается в кровотоке (39). Это может указывать на то, что AMH C образуется только после связывания рецептором изоформы AMH N, C , как показано in vitro (40). В недавнем исследовании Wissing et al (41) было показано, что количество нерасщепленного АМГ (проАМГ) у нормовулирующих женщин составляет всего 3% от общего числа промозирующих изоформ (проАМГ и АМГ N, C ).Этот результат был получен с помощью ELISA Ansh Labs, в которых либо используется другая пара антител, либо обработка образца для различения разных изоформ (41). Это предполагает, что большая часть сывороточных уровней АМГ представляет собой расщепленный АМГ. Однако результаты следует интерпретировать с осторожностью, поскольку матричные эффекты могут изменить конформацию изоформы, ограничивая прямое сравнение значений.
В настоящее время неизвестно, различается ли обработка AMH с возрастом, клиническим состоянием или даже среди женщин.Таким образом, остается определить, улучшило ли измерение различных изоформ AMH или их соотношения клиническую значимость по сравнению с общим AMH, как оценивается с помощью текущих анализов.
Факторы, влияющие на сывороточный АМГ
Для правильной интерпретации уровней АМГ в сыворотке критически важно знать факторы, влияющие на уровни АМГ. Большинство женщин репродуктивного возраста используют гормональные противозачаточные средства (ГК), однако данные о влиянии ГК на уровень АМГ в сыворотке противоречивы.В систематическом обзоре, проведенном Amer et al. (42) по результатам 15 исследований, был сделан вывод о том, что уровни АМГ в сыворотке у нормовулятивных женщин снижались при использовании ГК в течение как минимум года, и в большинстве исследований этот эффект был обратимым после прекращения использования ГК. . Однако степень снижения варьировала от 14% до 55%, что можно объяснить различиями в типе использования HC, продолжительности использования, времени измерения AMH во время менструального цикла и используемых анализах AMH. Действительно, Landersoe et al (43) показали в ретроспективном исследовании, что уровни АМГ в сыворотке были на 30-40% ниже у женщин, принимающих оральные контрацептивы или таблетки, содержащие только прогестерон, в то время как у женщин, использующих внутриматочную спираль, только на 17% ниже. % наблюдалось.Кроме того, оба исследования сообщили о снижении AFC (42, 43), что убедительно свидетельствует о том, что изменение уровней AMH в сыворотке, вызванное использованием HC, является результатом изменения динамики фолликулов, а не прямого воздействия на регуляцию гена AMH. Однако нельзя исключать прямое влияние измененной среды гонадотропинов и половых стероидов на экспрессию АМГ.
Несколько исследований показали, что индекс массы тела (ИМТ) отрицательно влияет на уровень АМГ. В исследовании Мослехи и др. (44), в котором повторно анализировалось 26 исследований, пациенты были разделены на фертильную группу без синдрома поликистозных яичников (СПКЯ), группу бесплодия без СПКЯ и группу СПКЯ.Авторы обнаружили отрицательную корреляцию между ИМТ и АМГ во всех группах со статистикой Z Фишера –0,15 (95% доверительный интервал [ДИ] от –0,20 до –0,11) в общей популяции. Однако ИМТ не коррелировал с AFC, предполагая, что ИМТ может напрямую влиять на уровни AMH, а не FOR. Хотя точный механизм еще предстоит выяснить, предполагается, что лептин играет определенную роль. Merhi et al (45) продемонстрировали на культивируемых клетках гранулезы человека, выделенных как из маленьких фолликулов (SF; <14 мм), так и из крупных фолликулов (LF; ≥14 мм), что обработка рекомбинантным лептином значительно подавляла рибонуклеиновый мессенджер AMH и рецептора AMH II. кислотные (мРНК) уровни.Обработка ингибитором JAK2 / STAT3 предотвращала индуцированное лептином подавление экспрессии мРНК AMH, предполагая прямое участие сигнального пути лептина. Напротив, более недавнее исследование продемонстрировало, что ингибирование передачи сигналов лептина посредством трансфекции культивируемых клеток гранулезы человека малой интерферирующей РНК лептина (сиЛептин) значительно снижает секрецию АМГ (46). Вполне вероятно, что лептин по-разному влияет на экспрессию и секрецию АМГ. Тем не менее точный механизм еще предстоит выяснить.
Было обнаружено, что витамин D (VitD) влияет на уровень АМГ. Уровни VitD демонстрируют сезонные колебания с более высокими уровнями летом по сравнению с зимой. Деннис и др. (47) продемонстрировали, что уровни АМГ у женщин репродуктивного возраста также демонстрируют сезонные колебания, при этом уровни зимой на 18% ниже, чем летом. В последующем исследовании здоровые нормоовуляторные женщины были рандомизированы для получения однократной пероральной дозы 1,25-дигидроксивитамина D (VD3), активного метаболита VitD или плацебо (48).В течение 24 часов после лечения VD3 уровни АМГ в сыворотке резко выросли до 15,8 ± 1,1 нмоль / л по сравнению с 1,2 ± 0,7 нмоль / л у контрольных участников. Однако остается вопрос, увеличивает ли VD3 концентрацию АМГ в сыворотке напрямую через регуляцию экспрессии АМГ или косвенно через изменение количества клеток гранулезы. Чтобы ответить на этот вопрос, Xu et al (49) исследовали влияние лечения VD3 на развитие фолликулов и концентрацию AMH у макак путем культивирования растущих фолликулов в присутствии VD3.Анализ показал, что VD3 увеличивал выживаемость преантральных фолликулов, а уровни AMH были значительно выше по сравнению с контролем (49). В течение первых 2 недель культивирования лечение VD3 не влияло на развитие фолликулов или гормональную среду. Однако в течение 3–5 недель воздействие VD3 увеличивало выживаемость антрального фолликула и концентрацию АМГ, в то время как уровни мРНК АМГ и рецептора АМГ II оставались неизменными (50). Эти данные свидетельствуют о том, что VD3 предотвращает апоптоз гранулезных клеток, а не напрямую регулирует экспрессию AMH, как также предположили Merhi et al (51).В их исследовании лечение VitD не влияло на экспрессию мРНК AMH, а скорее подавляло индуцированную AMH передачу сигналов. Это может привести к ускоренному созреванию фолликулов, что может объяснить наблюдаемую отрицательную корреляцию между уровнями VitD в фолликулярной жидкости и экспрессией мРНК AMH (51). Однако нельзя исключить прямое влияние на экспрессию AMH, поскольку ответный элемент VDR был картирован с промотором AMH (52).
Эти исследования показывают, что при консультировании женщин по поводу их FOR на основе уровней AMH важно понимание факторов, которые влияют на экспрессию AMH, а также на динамику фолликулов.Остается определить, приводят ли изменения в экспрессии АМГ к изменениям количества примордиальных фолликулов, то есть резерва яичников, и имеют ли такие изменения то же направление. Это подчеркивает использование FOR сверх овариального резерва по отношению к оценке AMH.
Использование уровней АМГ в сыворотке для прогнозирования возраста менопаузы
В западном мире возраст, в котором женщина решает родить первого ребенка, увеличился, а значит, и риск возрастного непроизвольного бесплодия (53).Учитывая сильную корреляцию между возрастным снижением количества примордиальных фолликулов, количеством растущих фолликулов и уровнями АМГ в сыворотке, в нескольких исследованиях было изучено, может ли АМГ в сыворотке помочь в прогнозировании возраста менопаузы. Метаанализ, проведенный Depmann et al (54), в котором повторно анализировались уровни AMH из 6 исследований, пришел к выводу, что сывороточный AMH может предсказать время наступления менопаузы. Однако по сравнению с возрастом женщины добавленная стоимость сывороточного АМГ была ограничена, так как статистика C увеличилась только с 84% до 86%.Кроме того, оказалось, что сывороточный АМГ имеет ограниченную точность на индивидуальном уровне. Сообщалось о противоречивых результатах в прогнозировании наступления менопаузы у женщин позднего репродуктивного возраста. В недавнем популяционном исследовании, в котором большинство женщин страдали избыточным весом или ожирением, было показано, что женщины в возрасте от 45 до 49 лет с неопределяемым уровнем АМГ имели 60% вероятность наступления менопаузы в течение 5 лет (55). Кроме того, AMH действительно улучшил прогноз наступления менопаузы по сравнению с одним только возрастом (C-статистика 91% против 83%) (55).Недавнее мультиэтническое исследование, в которое вошли 1537 женщин в пре- или ранней перименопаузе на исходном уровне и с последующим наблюдением до 12 месяцев аменореи (исследование SWAN), проанализировало прогноз заключительной менструации (FMP) по уровням АМГ. Хотя АМГ оценивался серийно в небольшой подгруппе этой когорты, несколько выборок отдельных женщин были независимо использованы в статистических моделях для прогнозирования FMP. В сочетании с возрастом и ИМТ АМГ имел лучшую прогностическую ценность для FMP, чем ФСГ. У женщин моложе 48 лет значение АМГ <10 пг / мл имело 51% положительную прогностическую ценность для прогнозирования достижения FMP в течение 12 месяцев, которая увеличивалась до 78% при достижении FMP в течение 36 месяцев.У женщин в возрасте ≥51 года эти значения составили 79% и 97% соответственно. Важно отметить, что продление прогноза FMP с 12 месяцев до 36 месяцев значительно снизило чувствительность AMH. Напротив, у женщин в возрасте <45 лет АМГ <10 пг / мл имел низкую чувствительность и низкую положительную прогностическую ценность при прогнозировании FMP (56). Таким образом, объединение этих двух последних исследований позволяет предположить, что у женщин позднего репродуктивного возраста оценка АМГ может помочь в прогнозировании возраста менопаузы. Однако можно утверждать, что предсказание возраста менопаузы в более молодом возрасте клинически более актуально для отдельной женщины, как и предсказание ранней менопаузы, то есть менопаузы в возрасте до 45 лет.
В рассмотренном выше метаанализе Depmann et al (54) по сравнению с одним только возрастом AMH увеличил статистику C с 52% до 80% при прогнозировании ранней менопаузы. В недавнем проспективном исследовании с вложенным дизайном случай-контроль, содержащим 327 случаев, было подтверждено использование сывороточного АМГ для прогнозирования ранней менопаузы. Снижение АМГ на 0,10 нг / мл увеличивало риск ранней менопаузы на 14% (95% ДИ, 1,10–1,18). По сравнению с уровнем АМГ 2,0 нг / мл отношение шансов (ОШ) для ранней менопаузы составляло 23 для женщин с уровнем АМГ 0.5 нг / мл (57).
Большинство моделей прогнозирования основаны на одном измерении АМГ и предполагают сопоставимую картину снижения у каждой женщины. Недавние исследования, анализирующие продольные измерения AMH, показывают, что AMH может не следовать равномерной траектории снижения. Анализ популяционного когортного исследования Doetinchem с данными, доступными из 5 посещений в течение 20-летнего периода наблюдения, показал возрастное снижение уровня АМГ, которое значительно варьировалось для отдельных женщин. Кроме того, было показано, что скорость снижения изменялась с возрастом, ускоряясь после 40 лет (58).Следовательно, было высказано предположение, что использование индивидуальных моделей снижения АМГ может улучшить прогноз возраста менопаузы. Однако повторный анализ данных 2432 женщин из когортного исследования Doetichem показал, что только скорость снижения АМГ или в сочетании с возрастным АМГ не имеет особой дополнительной ценности (59). Напротив, иранское исследование, в котором анализировались продольные данные 959 женщин за период наблюдения в течение 14 лет, из которых 55% достигли менопаузы, действительно показало, что серийные измерения АМГ улучшили прогноз возраста менопаузы, поскольку добавление скорости снижения АМГ к модель увеличила статистику C до 78% по сравнению с 70% для одного только AMH (60).В меньшей подгруппе этой когорты (n = 266) с более коротким периодом наблюдения (в среднем 6,5 лет с 3-летними интервалами) авторы ранее подтвердили, что скорость снижения АМГ была специфической для каждой женщины (61). Важно отметить, что авторы также показали, что скорость снижения зависит от возраста, что поднимает вопрос о том, в каком возрастном интервале и как часто следует измерять АМГ, чтобы точно предсказать возраст менопаузы.
Хотя исследование Ramezani Tehrani et al (60) специально не анализировало прогнозирование ранней менопаузы, авторы показали, что прогностическая добавленная ценность скорости снижения АМГ была последовательной при анализе женщин моложе или старше 40 лет.Основываясь на их модели, женщины со значением АМГ 0,1 нг / мл в возрасте 30 лет имеют прогнозируемый средний возраст менопаузы 43,18 (37,56-46,33) лет с пятым процентилем снижения АМГ и 95 процентилем. , это прогнозируется на уровне 33,63 (29,25-36,08) года (60). Как и в случае с возрастом менопаузы, в статистических моделях de Kat et al (59) скорость снижения АМГ не улучшала прогноз ранней менопаузы. Фактически, у женщин моложе 30 лет уровни АМГ могут фактически недооценивать риск ранней менопаузы (59).Хотя этот результат, по-видимому, противоречит исследованиям, обсужденным выше, при подтверждении он может иметь клинические последствия, поскольку, в частности, женщины этой возрастной категории могут решать, откладывать ли деторождение или нет.
На основании текущих исследований прогностическая ценность сывороточного АМГ для возраста менопаузы остается спорной. В большинстве этих исследований анализировались различные возрастные диапазоны, продолжительность наблюдения и анализы AMH, что затрудняло прямое сравнение исследований. Также остается неясным, могут ли текущие результаты, полученные у женщин, регулярно ездящих на велосипеде, быть перенесены на бесплодных женщин, у которых может быть нарушен яичниковый резерв.Потенциальное влияние этнической принадлежности на темпы снижения АМГ также подробно не анализировалось. Таким образом, требуются валидационные исследования, включающие дополнительные переменные, для определения конкретных пороговых значений АМГ для прогнозирования возраста наступления менопаузы.
Использование уровней АМГ для прогнозирования ответа на контролируемую стимуляцию яичников
Предыдущие исследования также показали, что уровни AMH могут помочь в прогнозировании ответа яичников на протоколы контролируемой гиперстимуляции яичников (COH).Низкие уровни АМГ коррелируют с низким ответом, определяемым как извлечение менее 5 ооцитов или отмена цикла. В настоящее время широко используются 2 различных подхода к стимуляции яичников: агонист гонадотропин-рилизинг-гормона или антагонист гонадотропин-рилизинг-гормона в сочетании с рекомбинантным или мочевым ФСГ (62). Чтобы улучшить реакцию на COH, используются алгоритмы для расчета индивидуальной дозировки FSH. Недавно измерение АМГ в сыворотке было добавлено к списку факторов, который включает возраст, ИМТ, продолжительность субфертильности, базальный уровень ФСГ и AFC.Алгоритмы, которые включают измерение ФСГ, AFC и AMH, называются тестами яичникового резерва (ORT).
Точный и надежный расчет индивидуальной дозировки важен, поскольку как недостаточная, так и чрезмерная стимуляция могут привести к отмене цикла. Кроме того, чрезмерная реакция может привести к развитию синдрома гиперстимуляции яичников, потенциально опасного для жизни состояния. Однако неясно, улучшает ли использование этих клинических характеристик прогнозирование ответа яичников и клинических исходов.Broer et al. Выполнили 2 метаанализа, чтобы изучить дополнительную ценность ОРТ для характеристик пациентов, таких как возраст, ИМТ и продолжительность субфертильности (63, 64). Из этих 6 измеренных характеристик пациентов AMH и AFC имели самую высокую точность в прогнозировании чрезмерного ответа яичников, определяемого как выход более 15 ооцитов, и в прогнозировании плохого ответа яичников. Регрессионный анализ характеристик работы приемника для прогнозирования чрезмерного отклика показал, что площадь под кривой (AUC) равна 0.81 (95% ДИ, 0,76–0,87) для AMH и 0,79 (95% ДИ, 0,74–0,84) для AFC, соответственно. Объединение этих двух тестов немного улучшило модель (AUC 0,85). При прогнозировании плохого ответа яичников были получены сопоставимые результаты с AUC 0,78 (95% ДИ, 0,72–0,84) и 0,76 (95% ДИ, 0,70–0,82), соответственно (64). Основываясь на этих исследованиях, AMH и AFC являются лучшими параметрами для прогнозирования плохой или чрезмерной реакции яичников на COH.
Остается вопрос, улучшает ли индивидуализация лечения на основе этих параметров клинические исходы.На основании исследований Broer et al., Как AMH, так и AFC показали очень низкую прогностическую ценность для частоты наступления беременности после ЭКО, с AUC всего 0,50 и 0,55 соответственно (63, 64). В более позднем метаанализе этот результат был исследован путем повторной оценки 20 рандомизированных контролируемых испытаний (65). В согласии с исследованиями Broer et al (63, 64) авторы пришли к выводу, что изменение дозировки стимулирующих препаратов на основе индивидуальных ПРТ, включая АМГ, существенно не увеличивает шансы на беременность и живорождение.
Фрисс Петерсен и др. (66) исследовали влияние одного АМГ в индивидуальном алгоритме дозирования ФСГ на предполагаемый забор ооцитов (5–14 ооцитов) и клинические исходы пациентов, перенесших ЭКО. Сравнение дозировки ФСГ на основе АМГ со стандартной дозировкой показало, что процент непреднамеренных ответов (<5 ооцитов или> 15 ооцитов) был сопоставим, как и клинические исходы с точки зрения частоты беременностей и живорождений. Следовательно, хотя AMH является хорошим предиктором реакции яичников на COH, он не улучшает частоту наступления беременности и частоту живорождений.Однако важно отметить, что у женщин, у которых прогнозируется чрезмерный ответ, индивидуализированное лечение, основанное на ОРТ, действительно привело к небольшому снижению вероятности развития синдрома гиперстимуляции яичников с OR 0,58 (95% ДИ, 0,34-1,00) на основе по 4 исследованиям (65).
Выводы, основанные на этих выводах, остаются сложными, поскольку в большинстве этих исследований использовались разные пороговые значения для ОРТ и различные анализы AMH. Таким образом, клиническое применение уровней АМГ для адаптации дозы на основе ОРТ еще предстоит продемонстрировать.
Оценка FOR при аутоиммунных заболеваниях
Женщины с аутоиммунными заболеваниями подвержены риску ранней менопаузы и, следовательно, повышенному риску бесплодия и заболеваний, связанных с менопаузой, таких как остеопороз и сердечно-сосудистые заболевания. Таким образом, в нескольких исследованиях анализировались уровни АМГ в сыворотке для оценки ФОР у женщин с аутоиммунными заболеваниями.
Недавний метаанализ 19 исследований, в которых анализировались пациенты с системной красной волчанкой, показал, что уровни АМГ в сыворотке крови были значительно ниже у пациентов с системной красной волчанкой по сравнению со здоровыми участниками контрольной группы (объединенные стандартизованные средние различия -0.79; 95% ДИ, от -1,41 до -0,18). Кроме того, уровни АМГ дополнительно снижались иммунодепрессантом циклофосфамидом (объединенные стандартизованные средние различия -0,58; 95% ДИ, от -0,87 до -0,30) (67).
У женщин с недавно начавшимся ревматоидным артритом (РА) уровни АМГ были сопоставимы со здоровыми участниками контрольной группы, и использование метотрексата не влияло на уровни АМГ (68). Однако в последующем исследовании более низкие уровни АМГ до зачатия наблюдались у женщин с РА, пытающихся забеременеть. Авторы предположили, что это различие может быть объяснено продолжительностью заболевания.В согласии с этим, другие исследования также сообщили о снижении уровня АМГ в 1,3 раза у женщин с РА, имеющих продолжительность заболевания> 6 лет (69, 70). У пациентов с ювенильным идиопатическим артритом уровни АМГ были почти в 2 раза ниже (71).
У женщин с аутоиммунным заболеванием щитовидной железы (ATD) сообщалось о противоречивых результатах. Девочки-подростки, у которых впервые был поставлен диагноз АТД, имели нормальный или более высокий уровень АМГ по сравнению с контрольными участниками, соответствующими возрасту и ИМТ (72–74). У взрослых женщин в большинстве исследований сообщалось о скромных, но значительно более низких уровнях АМГ у женщин с дисфункцией щитовидной железы или подтвержденным АТД, хотя в одном исследовании наблюдалось повышение уровня АМГ (75).Однако прямая связь между измененными уровнями гормонов щитовидной железы и уровнями АМГ при ATD с добавлением левотироксина или без него остается неопределенной из-за противоречивых результатов (76-81). Если ATD влияет на FOR, степень в лучшем случае кажется скромной. Однако пока нельзя исключать влияние на исход COH. Хотя наличие ATD не ухудшало еще больше реакции на COH у женщин с низким уровнем AMH, оно действительно ухудшало реакцию COH у женщин с нормальным уровнем AMH (82).
Предполагается, что женщинам с диабетом 1 типа (СД1) наступит менопауза в более раннем возрасте (83), хотя в последнее время это ставится под сомнение.У женщин с СД1 старше 33 лет наблюдались в 2 раза более низкие уровни АМГ, а также процент наличия уровней АМГ в менопаузальном диапазоне был почти в 5 раз выше по сравнению с участниками контрольной группы (84). Напротив, хотя более низкие концентрации АМГ также наблюдались в большой когорте женщин с СД1 в общинах, это было только у женщин моложе 35 лет (85). Наконец, в поперечном исследовании, проведенном под контролем пациентов, не наблюдалось никаких различий в уровнях АМГ, процентном соотношении уровней АМГ в менопаузальном диапазоне и возрасте наступления менопаузы (86, 87).Эти противоречивые результаты могут быть частично объяснены тем фактом, что СД1 также имеет высокую распространенность СПКЯ, что связано с повышенным уровнем АМГ. Таким образом, присутствие женщин с сочетанием СПКЯ и СД1 потенциально может оказывать замаскированное влияние на уровни АМГ.
В целом, эти недавние исследования показывают, что связь между аутоиммунными заболеваниями и снижением FOR, по оценке AMH, остается непоследовательной. Необходимы дополнительные хорошо контролируемые исследования для анализа влияния начала заболевания, продолжительности и терапии на уровни АМГ.
Оценка состояния после лечения рака
Известно, что химиотерапия оказывает неблагоприятное воздействие на функцию яичников и увеличивает риск постобработки первичной недостаточности яичников (ПНЯ). В последние годы в ряде исследований анализировались уровни АМГ до и после лечения у больных раком, особенно раком груди, который является наиболее распространенным раком у женщин во всем мире. Исследования сходятся во мнении, что после химиотерапии уровень АМГ быстро снижается до (почти) неопределяемого уровня (88, 89).Это быстрое снижение можно объяснить немедленным устранением растущих фолликулов, продуцирующих АМГ. Последующее восстановление функции яичников зависит от женщины. Чтобы улучшить консультирование пациентов с онкологическими заболеваниями относительно их будущей фертильности, были изучены уровни АМГ до и после лечения для выявления женщин с риском неудачного восстановления яичников. У пациентов с раком груди, у которых развился ПНЯ, уровень АМГ перед лечением был ниже, чем у тех, у кого возобновилась менструация (89–91). Действительно, уровни АМГ перед лечением были прогностическими для ПНЯ, вызванного химиотерапией, у пациенток с раком груди в пременопаузе.В исследовании Anderson et al (89) пороговый уровень АМГ перед лечением <7,3 пмоль / л (1,022 нг / мл) дал AUC 0,77 с чувствительностью 95% и специфичностью 49%, в то время как в исследовании Xue et al., Пороговое значение AMH 0,965 нг / мл дало немного более высокую AUC 0,84 с чувствительностью 74% и специфичностью 82% (90, 91). Аналогичным образом, уровни АМГ до лечения могут прогнозировать восстановление яичников, выраженное как уровень АМГ ≥1 нг / мл через 12 месяцев после химиотерапии (скорректированный OR 1,659; ДИ 95%, 1,261-2.182), хотя обнаруженное значение было умеренным после 2 лет наблюдения (скорректированный OR 1,275; ДИ 95%, 1,141–1,426) (92). Однако индивидуальные различия в восстановлении яичников могут ограничивать прогностическую ценность АМГ. Decantere et al. Показали, что молодые пациенты с раком груди, у которых возобновились менструации через 6 месяцев после лечения, показали более раннее и более быстрое повышение уровня АМГ, чем у пациентов с медленным восстановлением, несмотря на то, что у них были аналогичные уровни АМГ перед лечением и они получали тот же протокол химиотерапии (93). Интересно, что в группе медленного восстановления уровни АМГ после лечения были ниже по сравнению с группой быстрого восстановления (93).Действительно, более низкие уровни АМГ после лечения также увеличивали риск ПНЯ, вызванного химиотерапией (89, 94). Хотя прогностическая ценность АМГ не зависит от возраста, исследования сходятся во мнении, что у женщин моложе 40 лет уровень АМГ после лечения выше (89, 94). У выживших после рака, по-видимому, наблюдается такая же скорость снижения АМГ, как и у женщин контрольной группы, несмотря на более низкие уровни АМГ после лечения (95). Это говорит о том, что у выживших после рака истощение FOR не ускоряется. Однако прогнозирование их репродуктивной продолжительности жизни остается сложной задачей и потребует дополнительных продольных исследований, контролируемых в зависимости от типа рака, возраста диагноза рака и схемы лечения.Недавнее исследование Su et al (96), посвященное анализу выживших после рака груди, рака щитовидной железы и лимфомы, является одним из первых исследований, направленных на устранение этих ограничений. Траектории АМГ действительно различались в зависимости от гонадотоксического эффекта лечения. В то время как лечение в более молодом возрасте приводило к более высоким траекториям АМГ, этот защитный эффект был сведен на нет при лечении высокогонадотоксичными агентами (96).
У женщин, лечившихся от дифференцированного рака щитовидной железы, лечение радиоактивным йодом (RAI) было предложено для индукции ранней менопаузы.Хотя влияние послеоперационного лечения RAI на уровни АМГ кажется менее серьезным, чем химиотерапия, уровни АМГ снизились как минимум на 50% и показали лишь частичное восстановление (97–99). Кроме того, влияние лечения RAI на уровни АМГ было более выражено у пациентов в возрасте> 35 лет (97, 99). Таким образом, как и у пациентов с раком груди, яичниковый резерв может быть относительно защищен, если рак щитовидной железы диагностируется в более молодом возрасте. Однако, учитывая сильное снижение уровня АМГ у молодых женщин, в том числе при раке щитовидной железы, требуются дополнительные проспективные исследования с достаточным последующим наблюдением.
Заключение
Улучшенная чувствительность и автоматизация анализов AMH усилили роль сывороточных уровней AMH как маркера FOR. Оценка уровней АМГ в сыворотке для прогнозирования ответа яичников на КГ и возраста менопаузы, будь то естественная или ятрогенная, может быть полезной. Однако появились и ограничения. Для правильной интерпретации уровней AMH необходимы дополнительные знания об эндогенных и экзогенных факторах, которые регулируют экспрессию AMH.Исследования также предполагают, что существует неоднородность траекторий АМГ, что может препятствовать применению при индивидуальном консультировании пациентов. За последние годы количество тестов для измерения АМГ увеличилось. Однако между анализами существуют различия. Поэтому срочно необходим международный стандарт для AMH, чтобы установить пороговые значения, не зависящие от анализа.
Сокращения
aa
AFC
AMH
AMH C
25kDa Терминал для C-терминала
9104 9104 9103 9104ATD
аутоиммунное заболевание щитовидной железы
AUC
ИМТ
CI
COH
контролируемая гиперстимуляция яичников
контролируемая гиперстимуляция яичников 9103 иммуноферментный анализFOR
Функциональный резерв яичников
ФСГ
фолликулостимулирующий гормон
HC
IVF
- 04
- синдром 9 0005
POI
первичная недостаточность яичников
proAMH
Дисульфидно-связанный гомодимер 140 кДа
RA
RAI
3RAI
00VitD
Сокращения
Благодарности
Финансовая поддержка: Финансирование получено не было.
Дополнительная информация
Краткое раскрытие информации: L.M.E.M. не имеет конфликта интересов. J.A.V. получил гонорары за анализы AMH, выплаченные институту / лаборатории без какой-либо личной финансовой выгоды.
Доступность данных
Совместное использование данных не применимо к этой статье, так как в ходе текущего исследования наборы данных не создавались и не анализировались.
Список литературы
1.Jeppesen
JV
,Anderson
RA
,Kelsey
TW
и др.Какие фолликулы вырабатывают у человека больше всего антимюллерова гормона? Доказательства резкого снижения продукции АМГ во время отбора фолликулов
.Mol Hum Reprod.
2013
;19
(8
):519
—527
. 2.te Velde
ER
,Scheffer
GJ
,Dorland
M
,Broekmans
FJ
,Fauser
BC
.Аспекты развития и эндокринные аспекты нормального старения яичников
.Mol Cell Endocrinol.
1998
;145
(1-2
):67
—73
. 3.Dewailly
D
,Andersen
CY
,Balen
A
и др.Физиология и клиническое применение антимюллерова гормона у женщин
.Обновление Hum Reprod.
2014
;20
(3
):370
—385
.4.Gleicher
N
,Weghofer
A
,Barad
DH
.Определение резерва яичников для лучшего понимания старения яичников
.Репрод Биол Эндокринол.
2011
;9
:23
.5.Findlay
JK
,Hutt
KJ
,Hickey
M
,Anderson
RA
.Что такое «яичниковый резерв»?
Fertil Steril.
2015
;103
(3
):628
—630
.6.Кевенаар
ME
,Meerasahib
MF
,Kramer
P
и др.Уровни антимюллерова гормона в сыворотке крови отражают размер пула примордиальных фолликулов у мышей
.Эндокринология.
2006
;147
(7
):3228
—3234
. 7.Hansen
KR
,Hodnett
GM
,Knowlton
N
,Craig
LB
.Корреляция тестов яичникового резерва с гистологически определенным номером примордиального фолликула
.Fertil Steril.
2011
;95
(1
):170
—175
.8.von Wolff
M
,Roumet
M
,Stute
P
,Liebenthron
J
.Концентрация антимюллерова гормона (АМГ) в сыворотке имеет ограниченное прогностическое значение для плотности примордиальных и первичных фолликулов, что ставит под сомнение ее как точный параметр для овариального резерва
.Maturitas.
2020
;134
:34
—40
.9.Liebenthron
J
,Reinsberg
J
,van der Ven
K
,Saenger
N
,Kruessel
JS
,von
,von
,von
Концентрация антимюллерова гормона в сыворотке и плотность фолликулов на протяжении репродуктивной жизни и при различных заболеваниях, влияющих на сохранение фертильности
.Hum Reprod.
2019
;34
(12
):2513
—2522
.10.Sermondade
N
,Sonigo
C
,Sifer
C
и др.Сывороточный антимюллеров гормон связан с количеством ооцитов, созревших in vitro, и с плотностью примордиальных фолликулов у кандидатов на сохранение фертильности
.Fertil Steril.
2019
;111
(2
):357
—362
.11.Kelsey
TW
,Wright
P
,Nelson
SM
,Anderson
RA
,Wallace
WH
.Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы
.PLoS One.
2011
;6
(7
):e22024
.12.Ли Фонг
S
,Visser
JA
,Welt
CK
и др.Уровни антимюллерова гормона в сыворотке у здоровых женщин: номограмма от младенчества до зрелого возраста
.J Clin Endocrinol Metab.
2012
;97
(12
):4650
—4655
. 13.Уоллес
WH
,Келси
TW
.Яичниковый резерв человека от зачатия до менопаузы
.PLoS One.
2010
;5
(1
):e8772
.14.Du
X
,Ding
T
,Zhang
H
и др.Возрастной нормальный референсный диапазон сывороточного антимюллерова гормона у здоровых китайских ханьских женщин: общенациональное популяционное исследование
.Reprod Sci.
2016
;23
(8
):1019
—1027
. 15.Okunola
OT
,Ajenifuja
OK
,Loto
MO
и др.Возрастные номограммы для фолликулостимулирующего гормона и антимюллерова гормона: пилотное исследование в Иле-Ифе, Нигерия
.Int J Reprod Biomed (Йезд).
2016
;14
(12
):777
—782
. 16.Тегерани
FR
,Мансурния
MA
,Солаймани-Додаран
M
,Азизи
F
.Возрастные уровни антимюллерова гормона в сыворотке: оценки по большой выборке среди населения
.Климактерический.
2014
;17
(5
):591
—597
. 17.Nelson
SM
,Messow
MC
,McConnachie
A
и др.Внешнее подтверждение номограммы снижения уровня антимюллерова гормона в сыворотке крови у женщин: популяционное исследование 15 834 пациенток с бесплодием
.Reprod Biomed Online.
2011
;23
(2
):204
—206
.18.Nelson
SM
,Messow
MC
,Wallace
AM
,Fleming
R
,McConnachie
A
.Номограмма снижения уровня антимуллерного гормона в сыворотке: популяционное исследование 9601 пациента с бесплодием
.Fertil Steril.
2011
;95
:736
—741
. 19.Bozdag
G
,Calis
P
,Zengin
D
,Tanacan
A
,Karahan
S
.Возрастная нормограмма количества антральных фолликулов в общей популяции и сравнение с предыдущими исследованиями
.евро J Obstet Gynecol Reprod Biol.
2016
;206
:120
—124
.20.Loy
SL
,Cheung
YB
,Fortier
MV
и др.Возрастные номограммы для определения количества антральных фолликулов и антимюллерова гормона у субфертильных китаянок в Сингапуре
.PLoS One.
2017
;12
(12
):e0189830
. 21.Nelson
SM
,Aijun
S
,Ling
Q
и др.Этнические несоответствия в сыворотке крови антимюллерова гормона у здоровых женщин: популяционное исследование из Китая и Европы
.Reprod Biomed Online.
2020
;40
(3
):461
—467
. 22.Bleil
ME
,Gregorich
SE
,Adler
NE
,Sternfeld
B
,Rosen
MIMP
,Кедры
.
Расовые / этнические различия в репродуктивном возрасте: исследование оценок резерва яичников по четырем расам / этническим группам здоровых, регулярно ездящих на велосипеде женщин
.Fertil Steril.
2014
;101
(1
):199
—207
. 23.Schuh-Huerta
SM
,Johnson
NA
,Rosen
MP
,Sternfeld
B
,Cedars
MI
000Re
jo.Генетические варианты и факторы окружающей среды, связанные с гормональными маркерами овариального резерва у женщин европеоидной расы и афроамериканок
.Hum Reprod.
2012
;27
(2
):594
—608
. 24.Tsepelidis
S
,Devreker
F
,Demeestere
I
,Flahaut
A
,Gervy
Ch
, Engler.Стабильные уровни антимюллерова гормона в сыворотке крови во время менструального цикла: проспективное исследование на нормоовуляторных женщинах
.Hum Reprod.
2007
;22
(7
):1837
—1840
. 25.Горкем
У
,Тогрул
С
.Есть ли необходимость изменить время измерения антимюллерова гормона во время менструального цикла?
Geburtshilfe Frauenheilkd.
2019
;79
(7
):731
—737
. 26.Lambert-Messerlian
G
,Plante
B
,Eklund
EE
,Raker
C
,Moore
RG
.Уровни антимуллеровых гормонов в сыворотке крови при нормальном менструальном цикле
.Fertil Steril.
2016
;105
:208
—213 e201
.27.Melado
L
,Lawrenz
B
,Sibal
J
и др.Антимюллеров гормон во время естественного цикла имеет значительные вариации внутри и между циклами при измерении с помощью полностью автоматизированного анализа
.Front Endocrinol (Лозанна).
2018
;9
:686
,28.Overbeek
A
,Broekmans
FJ
,Hehenkamp
WJ
и др.Внутрицикловые колебания антимюллерова гормона у здоровых женщин с регулярным циклом: повторный анализ
.Reprod Biomed Online.
2012
;24
(6
):664
—669
. 29.Bungum
L
,Tagevi
J
,Jokubkiene
L
и др.Влияние биологической изменчивости или эффективности анализа на измерения AMH: проспективное когортное исследование с AMH, протестированным на трех аналитических платформах
.Front Endocrinol (Лозанна).
2018
;9
:603
.30.Cate
RL
,Mattaliano
RJ
,Hession
C
и др.Выделение генов крупного рогатого скота и человека на вещество, ингибирующее мюллериан, и экспрессию человеческого гена в клетках животных
.Ячейка.
1986
;45
(5
):685
—698
. 31.Пепинский
РБ
,Sinclair
LK
,Чоу
EP
и др.Протеолитический процессинг вещества, ингибирующего мюллериан, дает бета-подобный фрагмент трансформирующего фактора роста
.J Biol Chem.
1988
;263
(35
):18961
—18964
. 32.Nachtigal
МВт
,Ingraham
HA
.Биоактивация вещества, ингибирующего мюллериан, во время развития гонад с помощью kex2 / субтилизин-подобной эндопротеазы
.Proc Natl Acad Sci U S A
1996
;93
:7711
—7716
.33.Донахью
ПК
.Вещество, ингибирующее Мюллерова репродуктивную функцию и рак
.Mol Reprod Dev.
1992
;32
(2
):168
—172
. 34.Гасснер
D
,Юнг
R
.Первый полностью автоматизированный иммуноферментный анализ на антимюллеровый гормон
.Clin Chem Lab Med.
2014
;52
(8
):1143
—1152
.35.Hyldgaard
J
,Bor
P
,Ingerslev
HJ
,Tørring
N
.Сравнение двух различных методов измерения антимюллерова гормона в клинической серии
.Репрод Биол Эндокринол.
2015
;13
:107
,36.Нельсон
SM
,Пастушек
E
,Клосс
G
и др.Два новых автоматизированных, по сравнению с двумя иммуноферментными тестами на антимуллериновые гормоны
.Fertil Steril
.2015
;104
:1016
—1021 e1016
.37.Pearson
K
,Long
M
,Prasad
J
,Wu
YY
,Bonifacio
M
.Оценка анализа Access AMH как автоматизированной высокопроизводительной замены ручного ELISA
AMH поколения II.Репрод Биол Эндокринол.
2016
;14
:8
,38.van Helden
J
,Weiskirchen
R
.Эффективность двух новых полностью автоматизированных иммуноанализов на антимюллеровы гормоны по сравнению с клиническим стандартным анализом
.Hum Reprod.
2015
;30
(8
):1918
—1926
. 39.Pankhurst
MW
,McLennan
IS
.Кровь человека содержит как нерасщепленный предшественник антимюллерова гормона, так и комплекс Nh3- и COOH-концевых пептидов
.Am J Physiol Endocrinol Metab.
2013
;305
(10
):E1241
—E1247
.40.di Clemente
N
,Jamin
SP
,Луговской
A
и др.Процессинг антимюллерова гормона регулирует активацию рецептора по механизму, отличному от TGF-бета
.Мол Эндокринол.
2010
;24
(11
):2193
—2206
. 41.Wissing
ML
,Mikkelsen
AL
,Kumar
A
и др.Ассоциации различных молекулярных форм антимуллерного гормона и биомаркеров синдрома поликистозных яичников и нормальных женщин
.Fertil Steril
.2019
;112
:149
—155 e141
.42.Amer
SAKS
,James
C
,Al-Hussaini
TK
,Mohamed
AA
.Оценка циркулирующего антимюллерова гормона у женщин, использующих гормональные контрацептивы: систематический обзор
.J Womens Health (Larchmt).
2020
;29
(1
):100
—110
. 43.Landersoe
SK
,Forman
JL
,Береза Петерсен
K
и др.Маркеры резерва яичников у женщин, использующих различные гормональные контрацептивы
.евро J Contracept Reprod Health Care.
2020
;25
(1
):65
—71
. 44.Moslehi
N
,Shab-Bidar
S
,Ramezani Tehrani
F
,Mirmiran
P
,Azizi
F
.Связан ли овариальный резерв с индексом массы тела и ожирением у женщин репродуктивного возраста? Мета-анализ
.Менопауза.
2018
;25
(9
):1046
—1055
. 45.Merhi
Z
,Buyuk
E
,Berger
DS
и др.Лептин подавляет экспрессию гена антимюллерова гормона посредством пути JAK2 / STAT3 в лютеинизированных клетках гранулезы женщин, подвергающихся ЭКО
.Hum Reprod.
2013
;28
(6
):1661
—1669
.46. Ding
X
,Kou
X
,Zhang
Y
,Zhang
X
,Cheng
G
,T
9.Лептин siRNA способствует апоптозу гранулезных клеток яичников и влияет на стероидогенез, увеличивая экспрессию рецептора NPY2
.Gene.
2017
;633
:28
—34
. 47.Деннис
NA
,Houghton
LA
,Jones
GT
,van Rij
AM
,Morgan
K
,McLennan IS
.Уровень сывороточного антимюллерова гормона коррелирует со статусом витамина D у мужчин и женщин, но не у мальчиков
.J Clin Endocrinol Metab.
2012
;97
(7
):2450
—2455
. 48.Деннис
NA
,Houghton
LA
,Pankhurst
MW
,Harper
MJ
,McLennan
IS
.Острые добавки с высокими дозами витамина D3 повышают уровень антимюллерова гормона в сыворотке крови у молодых женщин
.Питательные вещества
.2017
;9
(7): 719,49.Xu
J
,Hennebold
JD
,Seifer
DB
.Прямое действие витамина D3 на фолликулы макаки-резус в трехмерной культуре: оценка выживаемости, роста фолликулов, выработка стероидов и антимуллерианских гормонов
.Fertil Steril
.2016
;106
:1815
—1820 e1811
.50.Xu
J
,Lawson
MS
,Xu
F
и др.Витамин D3 регулирует развитие фолликулов и внутрифолликулярный биосинтез витамина D и передачу сигналов в яичниках приматов
.Front Physiol.
2018
;9
:1600
.51.Merhi
Z
,Doswell
A
,Krebs
K
,Cipolla
M
.Витамин D изменяет гены, участвующие в развитии фолликулов и стероидогенезе в клетках гранулезных кумулюсов человека
.J Clin Endocrinol Metab.
2014
;99
(6
):E1137
—E1145
. 52.Кришнан
AV
,Морено
J
,Nonn
L
и др.Новые пути, которые способствуют антипролиферативной и химиопрофилактической активности кальцитриола при раке простаты
.J Стероид Biochem Mol Biol.
2007
;103
(3-5
):694
—702
. 53.Balasch
J
,Gratacós
E
.Задержка деторождения: влияние на фертильность и исход беременности
.Fetal Diagn Ther.
2011
;29
(4
):263
—273
. 54.Depmann
M
,Eijkemans
MJC
,Broer
SL
и др.Влияет ли AMH на время наступления менопаузы? Результаты метаанализа индивидуальных данных пациента
.J Clin Endocrinol Metab.
2018
; 103: 3593-3600.55.Kim
C
,Slaughter
JC
,Wang
ET
и др.Антимюллеров гормон, фолликулостимулирующий гормон, количество антральных фолликулов и риск менопаузы в течение 5 лет
.Maturitas.
2017
;102
:18
—25
.56.Finkelstein
JS
,Lee
H
,Karlamangla
A
и др.Антимуллеровый гормон и приближающаяся менопауза в позднем репродуктивном возрасте: исследование здоровья женщин в стране
.Дж Клин Эндокринол Метаб
.2020
;105
: 1862-1871. 57.Bertone-Johnson
ER
,Manson
JE
,Purdue-Smithe
AC
и др.Уровни антимюллерова гормона и частота ранней естественной менопаузы в проспективном исследовании
.Hum Reprod.
2018
;33
(6
):1175
—1182
. 58.de Kat
AC
,van der Schouw
YT
,Eijkemans
MJ
, et al.Назад к основам старения яичников: популяционное исследование продольного снижения уровня антимюллерова гормона
.BMC Med.
2016
;14
(1
):151
. 59.de Kat
AC
,van der Schouw
YT
,Eijkemans
MJC
,Broer
SL
,Verschuren
WMM
0005Можно ли улучшить прогнозирование менопаузы с помощью нескольких измерений AMH? Результаты проспективного когортного исследования Doetinchem
.J Clin Endocrinol Metab.
2019
;104
(11
):5024
—5031
.60.Рамезани Тегерани
F
,Бидхенди Яранди
R
,Солаймани-Додаран
M
,Тохиди
M
,9000 9000 Firouzi 9000 9000 Firouzi
Улучшение прогноза возраста в период менопаузы с использованием множественных измерений антимюллерова гормона: Тегеранское липидно-глюкозное исследование
.Дж Клин Эндокринол Метаб
.2020
;105
: 1589-1598.61.Gohari
MR
,Ramezani Tehrani
F
,Chenouri
S
,Solaymani-Dodaran
M
,Azizi
F
F
.Индивидуальные прогнозы времени до менопаузы с использованием нескольких измерений антимюллерова гормона
.Менопауза.
2016
;23
(8
):839
—845
.62.Alper
MM
,Fauser
BC
.Протоколы стимуляции яичников при ЭКО: лучше лучше, чем меньше?
Reprod Biomed Online.
2017
;34
(4
):345
—353
0,63.Broer
SL
,Dolleman
M
,van Disseldorp
J
и др.Прогнозирование чрезмерного ответа при экстракорпоральном оплодотворении на основе характеристик пациенток и тестов яичникового резерва и сравнение в подгруппах: метаанализ индивидуальных данных пациента
.Fertil Steril.
2013
;100
:420
—429 e427
.64.Broer
SL
,van Disseldorp
J
,Broeze
KA
и др. ;ИМПОРТ исследовательская группа
.Дополнительные преимущества тестирования яичникового резерва на характеристиках пациенток при прогнозировании реакции яичников и продолжающейся беременности: индивидуальный подход к данным пациента
.Обновление Hum Reprod.
2013
;19
(1
):26
—36
.65.Lensen
SF
,Wilkinson
J
,Leijdekkers
JA
, et al.Индивидуальный подбор дозы гонадотропина с использованием маркеров овариального резерва для женщин, подвергшихся экстракорпоральному оплодотворению плюс интрацитоплазматическая инъекция сперматозоидов (ЭКО / ИКСИ)
.Кокрановская база данных Syst Rev
.2018
;2
:CD012693
.66.Friis Petersen
J
,Lokkegaard
E
,Andersen
LF
и др.Рандомизированное контролируемое исследование индивидуализированного дозирования ФСГ на основе АМГ в протоколе антагонистов ГнРГ для ЭКО
.Hum Reprod Open
.2019
;2019
:hoz003
.67.Luo
W
,Mao
P
,Zhang
L
,Chen
X
,Yang
Z
.Оценка овариального резерва с помощью сывороточного антимюллерова гормона у пациентов с системной красной волчанкой: метаанализ
.Ann Palliat Med.
2020
;9
(2
):207
—215
0,68.Brouwer
J
,Laven
JS
,Hazes
JM
,Schipper
I
,Dolhain
RJ
.Уровни сывороточного антимюллерова гормона, маркера резерва яичников, у женщин с ревматоидным артритом
.Arthritis Care Res (Хобокен).
2013
;65
(9
):1534
—1538
.69.Henes
M
,Froeschlin
J
,Taran
FA
и др.Изменения резерва яичников у женщин в пременопаузе с хроническими воспалительными ревматическими заболеваниями: влияние ревматоидного артрита, болезни Бехчета и спондилоартрита на уровни антимюллерова гормона
.Ревматология (Оксфорд).
2015
;54
(9
):1709
—1712
.70.Eudy
AM
,McDaniel
G
,Hurd
WW
,Clowse
MEB
.Фертильность и яичниковый резерв у женщин с ревматоидным артритом
.J Rheumatol.
2019
;46
(5
):455
—459
. 71.Феррейра
GRV
,Tomioka
RB
,Aikawa
NE
и др.Яичниковый резерв у молодых пациентов с ювенильным идиопатическим артритом
.Mod Rheumatol.
2019
;29
(3
):447
—451
.72.Erol
O
,Parlak
M
,Ellidağ
HY
и др.Уровни антимюллерова гормона в сыворотке у эутиреоидных девочек-подростков с тиреоидитом Хашимото: связь с антиоксидантным статусом
.евро J Obstet Gynecol Reprod Biol.
2016
;203
:204
—209
,73.Özalp Akın
E
,Aycan
Z
.Оценка овариального резерва у подростков с тиреоидитом Хашимото с использованием сывороточных уровней антимюллерова гормона
.J Clin Res Pediatr Endocrinol.
2018
;10
(4
):331
—335
0,74.Pirgon
O
,Sivrice
C
,Demirtas
H
,Dundar
B
.Оценка овариального резерва у эутиреоидных подростков с тиреоидитом Хашимото
.Гинекол Эндокринол.
2016
;32
(4
):306
—310
.75.Tuten
A
,Hatipoglu
E
,Oncul
M
и др.Оценка овариального резерва при тиреоидите Хашимото
.Гинекол Эндокринол.
2014
;30
(10
):708
—711
,76.Kuroda
K
,Uchida
T
,Nagai
S
и др.Повышенный уровень тиреотропного гормона в сыворотке крови связан со снижением уровня антимюллерова гормона у бесплодных женщин репродуктивного возраста
.J Assist Reprod Genet.
2015
;32
(2
):243
—247
0,77.Weghofer
A
,Barad
DH
,Darmon
S
,Kushnir
VA
,Gleicher
N
.Что влияет на функциональный резерв яичников, функцию щитовидной железы или аутоиммунитет щитовидной железы?
Репрод Биол Эндокринол.
2016
;14
(1
):26
.78.Bahri
S
,Tehrani
FR
,Amouzgar
A
, et al.Сверхурочная динамика гормонов щитовидной железы, аутоиммунитета щитовидной железы и яичникового резерва: продольное популяционное исследование с 12-летним наблюдением
.BMC Endocr Disord.
2019
;19
(1
):47
0,79.Chen
CW
,Huang
YL
,Tzeng
CR
,Huang
RL
,Chen
CH
.Идиопатический низкий резерв яичников связан с более частыми положительными антителами к тироидной пероксидазе
.Щитовидная железа.
2017
;27
(9
):1194
—1200
.80.Rao
M
,Wang
H
,Zhao
S
и др.Субклинический гипотиреоз связан с более низким овариальным резервом у женщин в возрасте 35 лет и старше
.Щитовидная железа.
2020
;30
(1
):95
—105
.81.Kuroda
M
,Kuroda
K
,Segawa
T
и др.Добавка левотироксина улучшает сывороточные уровни антимюллерова гормона у бесплодных пациентов с тиреоидитом Хашимото
.J Obstet Gynaecol Res.
2018
;44
(4
):739
—746
.82.Magri
F
,Schena
L
,Capelli
V
и др.Антимюллеров гормон как прогностический фактор овариального резерва в протоколах ВРТ: скрытая роль аутоиммунитета щитовидной железы
.Репрод Биол Эндокринол.
2015
;13
(1
):106
,83.Dorman
JS
,Steenkiste
AR
,Foley
TP
и др.;Исследование семейных аутоиммунных заболеваний и диабета (FAD)
.Менопауза у женщин с диабетом 1 типа: преждевременна?
Диабет.
2001
;50
(8
):1857
—1862
.84.Soto
N
,Iñiguez
G
,López
P
, et al.Уровни антимюллерова гормона и ингибина B как маркеры преждевременного старения яичников и перехода к менопаузе при сахарном диабете 1 типа
.Hum Reprod.
2009
;24
(11
):2838
—2844
.85.Kim
C
,Karvonen-Gutierrez
C
,Kong
S
и др.Антимуллеров гормон среди женщин с диабетом 1 типа и без него: исследование эпидемиологии вмешательств и осложнений диабета и Мичиганское исследование здоровья костей и метаболизма
.Fertil Steril.
2016
;106
(6
):1446
—1452
.86.Yarde
F
,Spiering
W
,Franx
A
и др. ;Исследовательская группа OVADIA
.Связь между здоровьем сосудов и старением яичников при сахарном диабете 1 типа
.Hum Reprod.
2016
;31
(6
):1354
—1362
. 87.Yarde
F
,van der Schouw
YT
,de Valk
HW
и др.;Исследовательская группа OVADIA
.Возраст наступления менопаузы у женщин с сахарным диабетом 1 типа: исследование OVADIA
.Hum Reprod.
2015
;30
(2
):441
—446
0,88.Чжун
Y
,Lin
Y
,Cheng
X
и др.GnRHa для защиты яичников и связь между AMH и функцией яичников во время адъювантной химиотерапии рака груди
.J Рак.
2019
;10
(18
):4278
—4285
, 89.Андерсон
RA
,Mansi
J
,Coleman
RE
,Адамсон
DJA
,Леонард
RCF
.Применение антимюллерова гормона в диагностике и прогнозировании потери функции яичников после химиотерапии при раннем раке груди
.евро J Рак.
2017
;87
:58
—64
.90.Xue
C
,Wei
W
,Sun
P
и др.Номограмма, основанная на антимюллеровом гормоне перед лечением, позволяет прогнозировать менструальный статус после химиотерапии у женщин в пременопаузе с положительным по рецепторам гормона ранним раком молочной железы
.Лечение рака груди.
2019
;173
(3
):619
—628
.91.Passildas
J
,Collard
O
,Savoye
AM
и др.Влияние менопаузы, вызванной химиотерапией, у женщин детородного возраста с неметастатическим раком груди — предварительные результаты исследования MENOCOR
.Clin рака груди.
2019
;19
(1
):e74
—e84
.92.Lee
DY
,Park
YH
,Lee
JE
,Choi
D
.Прогнозирование восстановления функции яичников у молодых пациентов с раком груди после защиты агонистом гонадотропин-рилизинг гормона во время химиотерапии
.Лечение рака груди.
2018
;171
(3
):649
—656
0,93.Декантер
C
,Cloquet
M
,Dassonneville
A
,D’Orazio
E
,Mailliez
A
, P,P
,Различные модели восстановления яичников после лечения рака предполагают различную индивидуальную восприимчивость яичников к химиотерапии
.Reprod Biomed Online.
2018
;36
(6
):711
—718
.94.Kim
HA
,Choi
J
,Park
CS
и др. ;Исследователи ASTRRA
.Уровень антимюллерова гормона в сыворотке после химиотерапии позволяет прогнозировать восстановление функции яичников
.Endocr Connect.
2018
;7
(8
):949
—956
0,95.Cameron
K
,Sammel
MD
,Prewitt
M
,Gracia
C
.Различная скорость изменения показателей резерва яичников у молодых выживших после рака на протяжении репродуктивной жизни
.J Clin Endocrinol Metab.
2019
;104
(5
):1813
—1822
.96.Su
HI
,Kwan
B
,Whitcomb
BW
и др.Моделирование вариаций продолжительности репродуктивной жизни женщин-подростков и молодых людей, переживших рак, с использованием AMH
.Дж Клин Эндокринол Метаб
.2020
; 105 (8) .97.Yaish
I
,Azem
F
,Gutfeld
O
и др.Однократное лечение радиоактивным йодом оказывает пагубное влияние на резерв яичников у женщин с раком щитовидной железы: результаты проспективного пилотного исследования
.Щитовидная железа.
2018
;28
(4
):522
—527
0,98.Evranos
B
,Faki
S
,Polat
SB
,Bestepe
N
,Ersoy
R
,000 Cakir0004.Влияние терапии радиоактивным йодом на яичниковый резерв: проспективное пилотное исследование
.Щитовидная железа.
2018
;28
(12
):1702
—1707
.99.van Velsen
EFS
,Visser
WE
,van den Berg
SAA
и др.Продольный анализ влияния радиойодтерапии на яичниковый резерв у женщин с дифференцированным раком щитовидной железы
.Щитовидная железа.
2020
;30
(4
):580
—587
.© Endocrine Society 2020.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), который разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.Демографические, образ жизни и репродуктивные детерминанты уровней сывороточных антимюллеровых гормонов у взрослых женщин репродуктивного возраста в Илорине, Северо-Центральная Нигерия | Журнал Middle East Fertility Society Journal
В целом, из всех факторов, проанализированных в этом исследовании, возраст, этническая принадлежность, ИМТ, продолжительность цикла и половой состав имели значительную связь с сывороточным АМГ, несмотря на поправку на влияние всех значимых факторов.
Демографические факторы
Мы обнаружили, что с увеличением возраста на единицу сывороточный уровень АМГ снижался на 3,5%. Это похоже на результаты предыдущих исследований, которые предполагают, что сывороточный уровень АМГ снижается с возрастом и, следовательно, является надежным маркером старения яичников [19, 20]. Однако при многофакторном анализе наблюдалось снижение процентного снижения сывороточного АМГ с возрастом на 0,4%. У женщин 35 лет и старше уровень АМГ в сыворотке с возрастом снижался в 6 раз по сравнению с возрастом менее 35 лет.
У женщин йоруба в этом исследовании уровень АМГ в сыворотке крови был на 15,5% выше, чем у женщин других этнических групп. Это похоже на результаты предыдущих исследований, которые продемонстрировали значительные этнические и расовые различия в сывороточных уровнях АМГ у женщин в той же популяции [15, 16]. Это могло быть связано с определенным образом жизни и генетическими вариациями среди этих этнических групп [17]. Однако, учитывая отсутствие адекватного представительства основных этнических групп в этом исследовании, популяционное исследование с большим размером выборки с лучшим представлением различных этнических групп даст лучшее понимание влияния этнической принадлежности на уровень АМГ в сыворотке крови у этнических групп. разнообразное население, как Нигерия.
Факторы образа жизни
Все женщины, включенные в это исследование, были некурящими (активными). Однако около 9,9% исследуемой популяции сообщили о воздействии вторичного курения. Не было значимой связи между пассивным курением и уровнем АМГ в сыворотке крови. Это согласуется с выводами Plante et al. и далее подтверждает их вывод о том, что влияние курения на яичниковый резерв, скорее всего, является прямым влиянием активного и текущего курения [21].Однако, учитывая небольшую долю участников, подвергшихся пассивному курению, более крупное исследование с большей долей вторичных курильщиков лучше отобразит степень воздействия, которое это оказывает на резерв яичников.
Не было обнаружено никакой связи между потреблением алкоголя и уровнем АМГ в сыворотке, аналогично тому, что было обнаружено в предыдущих исследованиях [9, 22]. Хотя это противоречило выводам Бресслера и др., Которые обнаружили снижение АМГ на 26% у лиц, злоупотребляющих алкоголем, среди афроамериканских женщин [10]. Это противоречие, вероятно, связано с тем, что большинство женщин, сообщивших о потреблении алкоголя в нашем исследовании, являются пьяницами в обществе и сообщают о нечастом приеме алкоголя.Следовательно, влияние алкоголя на АМГ, вероятно, зависит от количества.
Не было значимой связи между потреблением кофеина и уровнем АМГ в сыворотке. Этот вывод согласуется с исследованием, проведенным Kinney et al. где не было обнаружено связи между потреблением кофеина и AFC, FSH, эстрадиолом и ингибином [22]. Однако важно отметить, что наше исследование не дало более объективной количественной оценки количества кофеина, потребляемого этими женщинами. Объективная оценка количества кофеина, потребляемого каждой женщиной, будет лучшим предиктором влияния кофеина на уровень АМГ в сыворотке крови.
Однако мы обнаружили положительную взаимосвязь между ИМТ и АМГ в сыворотке, при этом увеличение ИМТ приводит к соответствующему увеличению уровней АМГ в сыворотке. После поправки на возраст, этническую группу, продолжительность цикла и паритетность единичное увеличение ИМТ привело к увеличению сывороточного АМГ на 1,4%. Это противоречит результатам предыдущих исследований на юго-западе Нигерии, в которых исследователи не обнаружили значимой связи между ИМТ и сывороточным АМГ [14, 23]. Freeman et al. обнаружили отрицательную взаимосвязь у женщин позднего репродуктивного возраста за пределами Нигерии [13].Расхождения между этими данными, вероятно, связаны с включением в это исследование женщин с синдромом поликистозных яичников (СПКЯ), который часто ассоциируется с высоким ИМТ и высоким уровнем АМГ в сыворотке [24]. Также согласно субанализу по возрастным группам, ИМТ оставался значимым только у женщин моложе 35 лет.
Репродуктивные факторы
В этом исследовании не было продемонстрировано никакой связи между возрастом начала менархе и уровнем АМГ в сыворотке, что согласуется с результатами исследования Dólleman et al. [9].Однако Брэгг и соавт. сообщили, что независимо от возраста, курения и индекса массы тела; женщины с ранним возрастом в период менархе имели значительно более высокий уровень АМГ в молодом возрасте [10], тогда как другое исследование показало, что бесплодные женщины с ранним возрастом менархе имеют значительно более высокий риск снижения резерва яичников в долгосрочной перспективе [11]. Противоречие между этими исследованиями и нашими, скорее всего, связано с различиями в популяции, поскольку первоначальное исследование было сосредоточено больше на молодых взрослых женщинах, чем на женщинах в пределах всего репродуктивного возраста, тогда как последнее проводилось только на бесплодных женщинах.
В исследуемой популяции наблюдалась значимая положительная взаимосвязь между продолжительностью цикла в днях и уровнем АМГ в сыворотке. Увеличение продолжительности цикла на день было связано с увеличением сывороточного АМГ на 3,6% независимо от возраста, этнической принадлежности, ИМТ и половой принадлежности. Скорее всего, это связано с включением в исследуемую группу женщин с СПКЯ. У ановуляторных женщин с СПКЯ продолжительность цикла относительно велика с относительно высокими случайными уровнями АМГ в сыворотке [24]. Однако при субанализе по возрастным группам эта взаимосвязь не была статистически значимой у женщин в возрасте 35 лет и старше.
Регулярность цикла не была связана с сывороточным АМГ, что противоречит выводам Dólleman et al. где нерегулярность цикла была связана со значительно меньшим уровнем АМГ в сыворотке [9]. Это открытие является неожиданным, поскольку нерегулярные менструальные циклы обычно обнаруживаются у женщин с СПКЯ, у которых это связано с высоким уровнем АМГ в сыворотке, или у пожилых женщин с нарушениями, связанными с менопаузой, у которых с большей вероятностью будет низкий уровень АМГ. Женщины в этом исследовании, которые сообщили о нерегулярном менструальном цикле, имели средний возраст 30 лет; следовательно, вероятна нерегулярность цикла, а не нарушения, связанные с менопаузой.
Однако наличие дисменореи не было связано с сывороточными уровнями АМГ в этой популяции. Это противоречит предыдущему исследованию, в котором у женщин с тяжелой дисменореей уровень АМГ в сыворотке был значительно ниже [25]. Их результаты могут быть связаны с эндометриозом, который, по мнению некоторых исследований, может значительно снизить уровень АМГ в сыворотке крови, а также может проявляться тяжелой дисменореей [26]. Отсутствие связи в нашем исследовании могло быть связано с отсутствием ответственности за тяжесть дисменореи, с которой столкнулись женщины в этом исследовании.Кроме того, из истории болезни ни у одной из набранных женщин не было диагностировано эндометриоз.
Кроме того, наблюдалась отрицательная взаимосвязь между четностью и сывороточным АМГ, при этом повышение четности ассоциировалось со снижением сывороточного АМГ на 5,3% после поправки на возраст, этническую принадлежность, ИМТ и продолжительность цикла. Это противоречит выводам Dólleman и его коллег, которые обнаружили, что увеличение возрастного АМГ было связано с увеличением паритета [9]. Однако аналогичные результаты были получены Bragg et al.которые обнаружили, что у женщин с двумя, тремя и более родами уровень АМГ в сыворотке крови был значительно ниже по сравнению с нерожавшими женщинами [10]. Однако, когда анализ был скорректирован по возрасту, отрицательная взаимосвязь сохранилась в многомерной регрессии и субанализе женщин моложе 35 лет и женщин 35 лет и старше. Кроме того, учитывая, что женщины, которые в настоящее время принимали противозачаточные средства, были исключены из этого исследования, этот эффект, вероятно, не связан с более высокой вероятностью использования противозачаточных средств женщинами с более высоким паритетом.
Наличие в анамнезе бесплодия не имело значимой связи с уровнями АМГ в сыворотке в этом исследовании. Это похоже на результаты Hvidman et al. которые сообщили об отсутствии различий в количестве AMH и антральных фолликулов у фертильных и бесплодных женщин аналогичных возрастных групп [27]. В этом нет ничего неожиданного, поскольку за бесплодие у женщин ответственны различные факторы, помимо их внутреннего резерва яичников. Однако существует значительная отрицательная взаимосвязь между продолжительностью бесплодия и уровнем АМГ в сыворотке, что означает, что с увеличением продолжительности бесплодия в годах происходит соответствующее снижение уровней АМГ в сыворотке.Это противоречит выводам Oke et al. на юго-западе Нигерии, авторы которой не сообщили о статистической значимости [23]. Наш вывод, вероятно, связан с влиянием возраста на уровень АМГ в сыворотке крови, так как женщины старшего возраста с большей вероятностью страдают бесплодием в течение более длительного периода. Об этом свидетельствует потеря статистической значимости после поправки на возраст в регрессионном анализе.
Наконец, в этом исследовании использование гормональных контрацептивов в прошлом не было связано с уровнем АМГ в сыворотке крови. Хотя в различных исследованиях сообщалось о снижении АМГ при использовании гормональных контрацептивов, это свидетельствует о том, что использование гормональных контрацептивов в прошлом не влияет на овариальный резерв навсегда [28,29,30].Это похоже на выводы Van den Berg et al. которые обнаружили 23% повышение уровня АМГ в сыворотке после прекращения приема оральных контрацептивов [31].
Сильные стороны и ограничения
Сила этого исследования заключается в оценке 11 независимых переменных и их связи с сывороточным АМГ в той же выборке нигерийских женщин в клинических условиях, где результаты наиболее применимы.
Хотя размер выборки был статистически адекватным для целей данного исследования, большое проспективное популяционное исследование имеет важное значение для лучшего изучения демографических, образа жизни и репродуктивных факторов, которые связаны с сывороточным АМГ как маркером овариального резерва и функционирует.Относительная однородность с точки зрения этнической принадлежности и больничного характера этого исследования не позволяет определить истинную степень, в которой эти факторы влияют на AMH в культурно и этнически разнообразном населении, таком как Нигерия.
Кроме того, исследование не измеряло объективно количество потребляемого алкоголя и кофе и не документировало тяжесть дисменореи у женщин, участвовавших в этом исследовании. Это могло способствовать отсутствию продемонстрированной ассоциации; Следовательно, будущие исследования должны быть нацелены на объективную квалификацию и количественную оценку этих факторов, чтобы прийти к лучшему заключению.
Кроме того, нельзя было должным образом исключить эндометриоз, так как лапароскопия и гистология обычно не выполняются у женщин, у которых было бесплодие, хотя в анамнезе и записях не было выявлено никаких свидетельств наличия эндометриоза у женщин в этом исследовании.
10 основных фактов об уровнях антимюллерова гормона и тестировании яичникового резерва
Антимюллеров гормон (АМГ) — это вещество, которое отвечает за разрушение мюллеровых протоков (женских репродуктивных органов) в развивающихся мужских эмбрионах…
- Антимюллеров гормон (АМГ) — это вещество, которое отвечает за разрушение мюллериановых протоков (женских репродуктивных органов) при развитии мужских эмбрионов. Важным открытием стал синтез AMH клетками гранулезы (клетки, окружающие зрелую яйцеклетку), за которым последовала разработка точных анализов крови для измерения AMH. В течение последних 20 лет важность AMH в отношении функции яичников широко изучалась.
- AMH продуцируется в наибольших количествах антральными фолликулами размером <6 мм.Фолликулы> 8 мм в диаметре, клетки теки и атретические фолликулы имеют практически неопределяемый уровень АМГ. Считается, что АМГ препятствует переходу от примордиальных фолликулов к растущим антральным фолликулам. Во время индукции овуляции наблюдается снижение уровня АМГ. Этого следовало ожидать, поскольку более крупные преовуляторные фолликулы производят меньше АМГ.
- Уровни АМГ снижаются с возрастом. Снижение уровня АМГ может быть самым ранним маркером старения яичников. За этим следует снижение уровня ингибина B, а затем повышение уровня ФСГ.Есть исследования, которые предполагают, что уровни АМГ могут (в ближайшем будущем) быть полезными для прогнозирования наступления менопаузы у женщины.
- У женщин с ожирением средний уровень АМГ на 65% ниже, чем у женщин без ожирения. Это говорит о том, что ожирение может быть связано со снижением резерва яичников.
- Уровни АМГ не сильно меняются в течение менструального цикла. В отличие от уровней ФСГ (которые следует измерять во 2, 3 или 4 дни цикла), уровни АМГ можно измерять в любой день цикла. Таким образом, он может служить уникальным бессрочным маркером овариального резерва!
- Уровни АМГ позволяют прогнозировать ответ яичников при ЭКО.Более высокие уровни АМГ связаны с большим количеством извлеченных яиц. С другой стороны, более низкие уровни АМГ (<0,5 нг / мл) предсказывают плохой ответ яичников с чувствительностью 85% и специфичностью 82,3%.
- Уровни АМГ> 3,5 нг / мл связаны с повышенной частотой синдрома гиперстимуляции яичников. Поэтому уровни АМГ можно использовать в качестве ориентира при выборе дозы препаратов для стимуляции овуляции. У пациентов с высоким уровнем АМГ дозу следует снизить, и обратное верно для пациентов с низким уровнем АМГ.
- На уровни АМГ НЕ влияют противозачаточные таблетки, беременность или агонисты ГнРГ (например, ацетат лейпролида, лупрон).
- У онкологических больных, прошедших химиотерапию или лучевую терапию, уровни АМГ могут быть маркером повреждения яичников.
- Комбинация возраста, уровня АМГ, уровня ФСГ и ультразвуковых маркеров, таких как объем яичников и количество антральных фолликулов, может использоваться для оценки резерва яичников. В InVia Fertility Specialists мы используем уровни AMH для проверки наших потенциальных анонимных доноров яйцеклеток.Мы предпочитаем доноров с уровнем АМГ> 1,5 нг / мл.
Чтобы обратиться к специалисту по фертильности, который является сертифицированным врачом с отличными показателями успешности, запишитесь на прием в одну из четырех клиник лечения бесплодия InVia в Чикаго.
Что такое нормальный уровень AMH?
Много говорят о гормоне под названием антимюллеров гормон или АМГ.
Понять, что такое AMH, может быть так же сложно, как и понять свой цикл, особенно когда так много разных голосов выдвигают противоречивые сообщения в Интернете и в других местах.
На этой неделе LetsGetChecked хочет рассказать вам все, что вам нужно знать об АМГ, чтобы вы могли лучше понять свой цикл и общее состояние здоровья.
Независимо от того, интересуетесь ли вы своим гормональным здоровьем или надеетесь создать семью, АМГ — один из самых важных гормонов, который нужно понимать, когда вы идете по этому пути.
На этой неделе LetsGetChecked расскажет вам все, что вам нужно знать об уровнях AMH, что они могут означать и как их проверить, если вас беспокоят определенные признаки и симптомы.
Содержание
Что такое AMH?
AMH означает антимюллеров гормон. Антимюллеровы гормоны — это гликопротеиновые гормоны, которые вырабатываются гранулезными клетками яичников.
Хорошо, это медицинское определение, которое сбивает с толку. Давайте разберемся с этим.
Фолликулы образуются в яичниках, по мере того как фолликулы развиваются в яйца, которые транспортируются по фаллопиевым трубам, они секретируют антимюллеров гормон.
Женщины рождаются с миллионами яиц «про запас». Девочка начинает свою жизнь с двумя миллионами крошечных фолликулов в яичниках, которые производят и выделяют АМГ. Вот почему AMH хорошо показывает, сколько яиц у вас «в запасе». Чем больше у вас фолликулов, тем больше яиц и AMH вы сможете вырабатывать.
Количество яиц, которые у вас есть, с возрастом постоянно уменьшается в количестве и качестве. Антимюллеров гормон может указывать на то, сколько яйцеклеток у вас осталось для жизнеспособной беременности. Важно отметить, что АМГ не скажет вам, насколько хорошее качество ваших яйцеклеток, он измеряет количество.
В нормальных условиях женщина будет носить эти яйца всю оставшуюся жизнь. Невозможно замедлить истощение яиц, поскольку они уменьшаются с каждым циклом, и нет способа естественным образом увеличить количество яйцеклеток в яичниках.
Здесь не о чем беспокоиться, однако знание и понимание своих гормонов может существенно помочь вам понять свое тело и общее состояние здоровья.
Количество AMH в вашей крови покажет вам:
- Сколько яиц у вас осталось.
- Насколько вероятно, что вы ответите на лечение ЭКО.
- На какой стадии репродуктивного цикла вы находитесь.
Количество АМГ в крови вам не скажет:
- Качество ваших яиц.
- Когда вы можете забеременеть.
Как ваше тело вырабатывает АМГ и яйца?
Ваш организм вырабатывает АМГ во время производства фолликулов яичников. Фолликулы яичников отвечают за секрецию основных гормонов, которые выделяются во время менструального цикла, а также за питание ооцитов перед овуляцией.
Когда дело доходит до размышлений о яйцеклетках, в том числе о том, сколько у вас продуктов и сколько вы теряете каждый месяц, кажется вполне разумным думать: «Я теряю одну яйцеклетку, потому что только одна яйцеклетка будет оплодотворена, если она срастется со спермой».
На самом деле это не так. Каждый месяц вы теряете чуть более 1000 яиц. Не паникуйте. Это совершенно нормально и здорово.
Единственное яйцо, о котором вы думаете, — это удачливый кандидат, который пережил период, известный как фолликулогенез.Давайте пройдем через эти этапы, чтобы понять, как связаны AMH и ваши яйца.
Фолликулогенез относится к созреванию фолликула яичника. Фолликул яичника заполнен клетками, производящими незрелую яйцеклетку, которая позже будет выпущена из яичника в процессе, известном как овуляция.
Перед овуляцией незрелая яйцеклетка находится в мешочках, заполненных жидкостью, пока они не станут достаточно зрелыми, чтобы пройти процесс овуляции. Яйца, жизнеспособные для этого процесса, будут состоять из четырех этапов.
Первородный фолликул
Первичные фолликулы — это маленькие и плоские спящие клетки, покрытые одним тонким слоем защитных клеток.
Первичный фолликул
При стимуляции примордиального фолликула он превращается в первичный фолликул. Фолликулы на начальной стадии начинают делиться, что позволяет продолжать рост клеток в яичниках.
Преантральный фолликул
Преантральные фолликулы также широко известны как вторичные фолликулы.На данный момент они имеют два или более слоя клеток гранулезы, окружающих их, с продолжающимся делением клеток. Этот рост клеток поддерживает рост фолликулов в яйцеклетку или яйцеклетку.
Антральный фолликул
Антральные фолликулы или вторичные фолликулы могут расти настолько, насколько позволяет фолликулостимулирующий гормон. Антральные фолликулы — это зрелые фолликулы яичников, которые удерживают и питают незрелую яйцеклетку, которая позже прорывается через стенку яичника и перемещается по фаллопиевой трубе.
Все это может показаться немного странным, но именно высвобождение этих фолликулов позволяет производить прогестерон и эстроген, которые контролируют время и симптомы менструального цикла и менструального цикла в целом. Теперь давайте перейдем к важному вопросу о том, каким должен быть ваш уровень AMH в зависимости от вашего возраста.
«Нормальный уровень АМГ может зависеть от вашего возраста, состояния здоровья и фертильности и может варьироваться от случая к случаю.Не паникуйте, если вы увидите, что ваш уровень АМГ находится за пределами диапазона, указанного на диаграмме ниже.
Что такое нормальный уровень AMH?
Гормоны обычно измеряются в нанограммах на миллилитр, потому что относительно, они циркулируют в крови в крошечных количествах. Гормоны измеряются в лабораториях по образцам крови.
Нормальный уровень АМГ зависит исключительно от вашего возраста, потому что, как описано, количество наших фолликулов и развивающихся яйцеклеток отвечает за количество циркулирующего АМГ в нашей крови.
Важно также отметить, что, хотя девочки рождаются примерно с 2 000 000 яйцеклеток, это число уменьшится до 400 000 к тому времени, когда девочка достигнет половой зрелости. С первого периода у девочки она начнет терять около 1000 яиц в месяц. Поэтому неудивительно, что уровень АМГ также начнет снижаться с возрастом.
Вот почему часто начало менопаузы также можно предсказать с помощью анализа AMH.
- На этой диаграмме показаны нормальные диапазоны АМГ для каждой возрастной группы.
Опять же, важно отметить, что тестирование AMH не даст вам понимания качества яйцеклеток в вашем яичниковом резерве. Чтобы измерить качество ваших яиц, вам нужно будет пройти ультразвуковое исследование.
В этом ключе также важно отметить, что у вас может быть низкое значение АМГ, но это не обязательно означает, что вы не сможете забеременеть. Для здоровой беременности требуется всего одна яйцеклетка и один сперматозоид. Тогда вы должны рассматривать AMH как хороший индикатор того, где вы находитесь в репродуктивном возрасте.
По словам Авы, после 3 месяцев попыток зачать ребенка вероятность забеременеть в возрасте 25 лет составляет 18%, в возрасте 35 лет этот показатель снижается до 12%, а в возрасте 40 лет — 7%. а пониженный АМГ означает более низкие шансы на успешное зачатие.
AMH не только влияет на репродуктивную функцию, но также указывает на другие состояния, которые могут объяснить нерегулярные или болезненные периоды.
Что еще может объяснить AMH, когда речь идет о вашем здоровье?
Важно знать, что уровни AMH и их значение зависят от ряда переменных, в первую очередь от вашего возраста.В целом уровни АМГ могут указывать на ряд состояний.
Низкий АМГ обычно является признаком:
- Нижний резерв яичников
- Преждевременная недостаточность яичников (ПНЯ)
- Эндометриоз
- Волчанка
- Болезнь Крона
- Аутоиммунное заболевание щитовидной железы
Нерегулярный АМГ обычно является признаком:
Высокий АМГ обычно является признаком:
- Синдром поликистозных яичников (СПКЯ)
- Эндометриоз
Стоит ли проверять свой AMH?
Да! Вам следует проверить свой уровень AMH.Высокий АМГ у молодых женщин указывает на то, что у вас может быть синдром поликистозных яичников (СПКЯ), нерегулярный АМГ у пожилых женщин может указывать на то, что вы переживаете менопаузу, а низкий АМГ у женщин детородного возраста может указывать на ряд проблем с фертильностью, включая снижение Яичниковый резерв (DOR). Тестирование AMH также скажет вам, ответите ли вы на лечение ЭКО.
Вам следует пройти тест AMH, также известный как тест резерва яичников, если:
- У вас есть симптомы СПКЯ, которые могут включать прыщи, увеличение веса и рост волос на лице.
- Вам поставили диагноз эндометриоз.
- Вам поставили диагноз: опухоль или киста яичника.
- Вы думаете о создании семьи.
- Вам сказали, что вам может потребоваться лечение ЭКО.
- Вы приближаетесь к менопаузе.
- У вас нерегулярные или болезненные менструации.
LetsGetChecked предоставляет тест AMH, который предложит вам не только результаты вашего AMH, но и поддержку и рекомендации медицинской бригады LetsGetChecked на каждом этапе пути.Чтобы узнать больше о тесте, посетите Letsgetchecked.com, где вы можете поговорить с медперсоналом в чате или по телефону.
Автор Ханна Кингстон | Медицинское одобрение доктора Доминика Роули
Эмбриология, фактор, ингибирующий мюллериан, артикул
[1]
Xu HY, Zhang HX, Xiao Z, Qiao J, Li R, Регулирование антимюллерова гормона (AMH) у мужчин и ассоциации сывороточного AMH с нарушениями мужской фертильности.Азиатский андрологический журнал. 2019 март-апрель; [PubMed PMID: 30381580]
[2]
Гринспон Р.П., Рей Р.А., Антимюллеров гормон и функция клеток Сертоли в педиатрическом мужском гипогонадизме. Гормональные исследования в педиатрии. 2010; [PubMed PMID: 201]
[3]
Hiort O, Дифференциальная роль андрогенов в раннем половом развитии человека.BMC медицина. 2013 24 июня; [PubMed PMID: 23800242]
[4]
Купман П. Хрупкое равновесие между мужскими и женскими путями, определяющими пол: возможность нарушения ранних этапов полового развития. Международный журнал андрологии. 2010 Apr; [PubMed PMID: 19845801]
[5]
Josso N, Clemente Nd, Путь трансдукции антимюллерова гормона, полоспецифичного члена семейства TGF-бета.Тенденции в эндокринологии и метаболизме: ТЕМ. 2003 Mar; [PubMed PMID: 125]
[6]
Josso N, Rey RA, Picard JY, Антимюллеров гормон: ценное дополнение к инструментарию детского эндокринолога. Международный журнал эндокринологии. 2013; [PubMed PMID: 24382961]
[7]
Dewailly D, Andersen CY, Balen A, Broekmans F, Dilaver N, Fanchin R, Griesinger G, Kelsey TW, La Marca A, Lambalk C, Mason H, Nelson SM, Visser JA, Wallace WH, Anderson RA, Физиология и клиническое применение антимюллеровского гормона у женщин.Обновление репродукции человека. 2014 май-июнь; [PubMed PMID: 24430863]
[8]
Josso N, Belville C, di Clemente N, Picard JY, Дефекты рецепторов AMH и AMH при персистирующем синдроме мюллерова протока. Обновление репродукции человека. Июль-август 2005 г .; [PubMed PMID: 15878900]
[9]
Broer SL, Broekmans FJ, Laven JS, Fauser BC, Антимюллеров гормон: исследование яичникового резерва и его потенциальные клинические последствия.Обновление репродукции человека. 2014 сентябрь-октябрь; [PubMed PMID: 24821925]
[10]
Belville C, Van Vlijmen H, Ehrenfels C, Pepinsky B, Rezaie AR, Picard JY, Josso N, di Clemente N, Cate RL, Мутации гена антимюллерова гормона у пациентов с постоянным синдромом мюллерова протока: биосинтез, секреция, и обработка аномальных белков и анализ с использованием трехмерной модели. Молекулярная эндокринология (Балтимор, Мэриленд.). 2004 Mar; [PubMed PMID: 14673134]
[11]
Джамил З., Фатима С.С., Ахмед К., Малик Р., Антимюллеровский гормон: выше и выше обычных маркеров резерва яичников. Маркеры заболеваний. 2016; [PubMed PMID: 26977116]
[12]
Келси Т.В., Райт П., Нельсон С.М., Андерсон Р.А., Уоллес У.Х., Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы.ПлоС один. 2011; [PubMed PMID: 21789206]
[13]
Oh SR, Choe SY, Cho YJ, Клиническое применение сывороточного антимюллеровского гормона у женщин. Клиническая и экспериментальная репродуктивная медицина. 2019 июн; [PubMed PMID: 31181872]
[14]
Гринспон Р.П., Готтлиб С., Бедекаррас П., Рей Р.А., Антимюллеров гормон и функция яичек у мальчиков препубертатного возраста с крипторхизмом.Границы эндокринологии. 2018 [PubMed PMID: 29
5]Какова роль тестирования гормонов AMH и MIS в диагностике гранулезно-клеточных опухолей (GCT) яичников
Коттаратил В.Д., Энтони М.А., Наир И.Р., Павитран К. Последние достижения в области гранулезно-клеточных опухолей яичников: обзор. Индийский Дж. Сург Онкол . 2013 марта, 4 (1): 37-47. [Медлайн]. [Полный текст].
Шах С.П., Кобель М., Сенз Дж., Морин Р.Д., Кларк Б.А., Виганд К.С..Мутация FOXL2 в гранулезно-клеточных опухолях яичника. N Engl J Med . 2009, 25 июня. 360 (26): 2719-29. [Медлайн].
Анттонен М., Пихлайоки М., Андерссон Н. и др. FOXL2, GATA4 и SMAD3 кооперативно модулируют экспрессию генов, жизнеспособность клеток и апоптоз в опухолевых клетках гранулезных клеток яичников. PLoS Один . 2014. 9 (1): e85545. [Медлайн]. [Полный текст].
Lappohn RE, Burger HG, Bouma J, Bangah M, Krans M, de Bruijn HW.Ингибин как маркер гранулезно-клеточных опухолей. N Engl J Med . 1989 21 сентября. 321 (12): 790-3. [Медлайн].
Робертсон Д.М., Стефенсон Т., Пруизер Э. Характеристика форм ингибина и их измерение с помощью ELISA на альфа-субъединицу ингибина в сыворотке от женщин в постменопаузе с раком яичников. Дж Клин Эндокринол Метаб . 2002 Февраль 87 (2): 816-24. [Медлайн].
Миллер Б.Э., Бэррон Б.А., Ван Дж. Факторы прогноза при гранулезно-клеточной опухоли яичника у взрослых. Рак . 1997 15 мая. 79 (10): 1951-5. [Медлайн].
Али Хель-С, Китахара Г., Нибе К., Ямагути Р., Хории Ю., Заабель С. и др. Плазменный антимюллеров гормон как биомаркер опухолей из клеток гранулезотека крупного рогатого скота: сравнение с иммунореактивным ингибином и концентрациями стероидов в яичниках. Териогенология . 2013 ноябрь 80 (8): 940-9. [Медлайн].
Лейн А.Х., Ли М.М., Фуллер А.Ф. Младший. Диагностическая ценность определения вещества, ингибирующего Мюллеров, у пациентов с первичными и рецидивирующими опухолями гранулезных клеток. Гинеколь Онкол . 1999 апр. 73 (1): 51-5. [Медлайн].
Long WQ, Ranchin V, Pautier P. Определение минимальных уровней сывороточного антимюллеровского гормона во время наблюдения за пациентами с опухолью из гранулезных клеток яичника с помощью высокочувствительного иммуноферментного анализа. Дж Клин Эндокринол Метаб . 2000 Февраль 85 (2): 540-4. [Медлайн].
Анттонен М., Ункила-Каллио Л., Леминен А., Буцов Р., Хейкинхеймо М. Высокая экспрессия GATA-4 связана с агрессивным поведением, тогда как низкая экспрессия антимюллерова гормона связана с потенциалом роста опухолей гранулезных клеток яичников. Дж Клин Эндокринол Метаб . 2005 декабрь 90 (12): 6529-35. [Медлайн].
Янг Р.Х., Скалли RE. Опухоли полового канатика, стромы, стероидные клетки и другие опухоли яичников с эндокринными, парандокринными и паранеопластическими проявлениями. Курман Р.Дж., изд. Патология женских половых путей Блаустейна . 4-е изд. Нью-Йорк, штат Нью-Йорк: Спрингер-Верлаг; 1994. 783-847.
Вольф Дж. К., Маллен Дж., Эйфель П. Дж.. Лучевая терапия запущенной или рецидивирующей гранулезно-клеточной опухоли яичника. Гинеколь Онкол . 1999 апр. 73 (1): 35-41. [Медлайн].
Hauspy J, Beiner ME, Harley I, Rosen B, Murphy J, Chapman W. Роль адъювантной лучевой терапии при гранулезно-клеточных опухолях яичника. Int J Radiat Oncol Biol Phys . 2011 г. 1. 79 (3): 770-4. [Медлайн].
Коломбо Н., Парма Г., Зананьоло В., Инсинга А. Управление опухолями стромальных клеток яичников. Дж Клин Онкол . 2007 10 июля. 25 (20): 2944-51. [Медлайн].
Сигл Б.Л., Энн П., Батлер С., Шахаби С.Гранулезно-клеточная опухоль яичников: исследование Национальной базы данных рака. Гинеколь Онкол . 2017 Август 146 (2): 285-291. [Медлайн].
Uygun K, Aydiner A, Saip P. Гранулезно-клеточная опухоль яичника: ретроспективный анализ 45 случаев. Ам Дж. Клин Онкол . 2003 октября, 26 (5): 517-21. [Медлайн].
Zanagnolo V, Pasinetti B, Sartori E. Клинический обзор 63 случаев стромальных опухолей полового канатика. евро J Gynaecol Oncol . 2004 г.25 (4): 431-8. [Медлайн].
Браун Дж., Суд А.К., Диверс М.Т., Милоевич Л., Гершенсон Д.М. Типы метастазов при опухолях полового тяжа и стромы яичника: можно ли отказаться от плановой промежуточной лимфаденэктомии? Гинеколь Онкол . 2009 Апрель 113 (1): 86-90. [Медлайн].
Тралл М.М., Пейли П., Пизер Э, Гарсия Р., Гофф Б.А. Закономерности распространения и рецидивов опухолей полового тяжа и стромы яичника. Гинеколь Онкол . 2011 августа 122 (2): 242-5.[Медлайн]. [Полный текст].
van Meurs HS, Buist MR, Westermann AM, Sonke GS, Kenter GG, van der Velden J. Эффективность химиотерапии при измеримых гранулезно-клеточных опухолях: ретроспективное исследование и обзор литературы. Int J Гинекольный рак . 2014 марта, 24 (3): 496-505. [Медлайн].
Homesley HD, Банди BN, Hurteau JA. Комбинированная терапия блеомицином, этопозидом и цисплатином гранулезно-клеточных опухолей яичников и других злокачественных новообразований стромы: исследование группы гинекологической онкологии. Гинеколь Онкол . 1999 Февраль 72 (2): 131-7. [Медлайн].
Пекорелли С., Вагенаар ХК, Верготе IB. Комбинированная химиотерапия цисплатином (P), винбластином (V) и блеомицином (B) при рецидивирующих или запущенных гранулезных (-тека) клеточных опухолях яичника. Совместное исследование гинекологической онкологической группы EORTC [опечатка опубликована в Eur J Cancer 1999 Dec ;. евро J Рак . 1999 Сентябрь 35 (9): 1331-7. [Медлайн].
Zambetti M, Escobedo A, Pilotti S, De Palo G.Комбинированная химиотерапия цис-платина / винбластин / блеомицин при запущенных или рецидивирующих гранулезно-клеточных опухолях яичника. Гинеколь Онкол . 1990 Mar.36 (3): 317-20. [Медлайн].
Colombo N, Parma G, Franchi D. Режим активной химиотерапии для запущенных опухолей полового пуповины яичников и стромы. Гинеколь Онкол . 1999 Февраль 72 (2): 129-30. [Медлайн].
Тао X, Суд А.К., Диверс М.Т., Шмелер К.М., Ник А.М., Коулман Р.Л. Антиангиогенезная терапия бевацизумабом у пациентов с опухолями гранулезных клеток яичников. Гинеколь Онкол . 2009 Сентябрь 114 (3): 431-6. [Медлайн].
Бриасулис Э., Каравасилис В., Павлидис Н. Активность мегестрола в рецидивирующей гранулезно-клеточной опухоли яичника взрослого типа. Энн Онкол . 1997 8 августа (8): 811-2. [Медлайн].
Корах Дж., Перри Т., Байнер М., Дэвидзон Т., Фридман Э., Бен-Барух Г. Многообещающий эффект ингибиторов ароматазы на рецидивирующие опухоли гранулезных клеток. Int J Гинекольный рак . 2009 июл.19 (5): 830-3. [Медлайн].
Lamm W, Schiefer A, Nöbauer IM, Horvat R, Speiser P, Köstler WJ. Терапия ингибиторами ароматазы как эффективное средство спасения у пациента с тамоксифен-резистентной метастатической гранулезно-клеточной опухолью яичника. Дж Клин Онкол . 2014 16 июня [Medline].
Shim SH, Lee SJ, Kim DY, Kim J, Kim SN, Kang SB и др. Долгосрочное последующее исследование 91 случая с опухолями гранулезных клеток яичников. Противоопухолевое лечение .2014 Февраль 34 (2): 1001-10. [Медлайн].
Mom CH, Engelen MJ, Willemse PH, Gietema JA, ten Hoor KA, de Vries EG. Гранулезно-клеточные опухоли яичника: клиническое значение сывороточных уровней ингибина А и В в большой одноцентровой когорте. Гинеколь Онкол . 2007 май. 105 (2): 365-72. [Медлайн].
van Meurs HS, Schuit E, Horlings HM, van der Velden J, van Driel WJ, Mol BW и др. Разработка и внутренняя проверка прогностической модели для прогнозирования безрецидивной выживаемости у пациентов с гранулезно-клеточными опухолями яичника у взрослых. Гинеколь Онкол . 2014 сентябрь 134 (3): 498-504. [Медлайн].
Zhang M, Cheung MK, Shin JY, Kapp DS, Husain A, Teng NN и др. Прогностические факторы, ответственные за выживаемость при опухолях стромы полового канатика яичника — анализ 376 женщин. Гинеколь Онкол . 2007 февраль 104 (2): 396-400. [Медлайн].
Bryk S, Färkkilä A, Bützow R, Leminen A, Tapper J, Heikinheimo M, et al. Характеристики и исход рецидива при молекулярно-определяемых опухолях гранулезных клеток яичников взрослого типа. Гинеколь Онкол . 2016 декабрь 143 (3): 571-577. [Медлайн].
Браун Дж., Шварцман Х.С., Диверс М.Т. Активность таксанов по сравнению с блеомицином, этопозидом и цисплатином при лечении опухолей полового тяжа и стромы яичников. Гинеколь Онкол . 2005 Май. 97 (2): 489-96. [Медлайн].
Cronje HS, Niemand I, Bam RH. Гранулезные и теа-клеточные опухоли у детей: отчет о 17 случаях и обзор литературы. Акушерское гинекологическое обследование .1998 апр. 53 (4): 240-7. [Медлайн].
Cronje HS, Niemand I, Bam RH. Обзор опухолей из клеток гранулезы из реестра опухолей яичников Эмиля Новака. Am J Obstet Gynecol . 1999 февраль 180 (2 Pt 1): 323-7. [Медлайн].
East N, Alobaid A, Goffin F, Ouallouche K, Gauthier P. Опухоль из гранулезных клеток: рецидив через 40 лет после первоначального диагноза. Банка J Obstet Gynaecol . 2005 апр. 27 (4): 363-4. [Медлайн].
Evans AT 3rd, Gaffey TA, Malkasian GD Jr.Клинико-патологический обзор 118 гранулезных и 82 тека-клеточных опухолей. Акушерский гинекол . 1980 Февраль 55 (2): 231-8. [Медлайн].
Фишман А., Куделка А.П., Тресукосол Д. Ацетат леупролида для лечения рефрактерной или стойкой опухоли из гранулезных клеток яичников. Дж Репрод Мед . 1996 июн. 41 (6): 393-6. [Медлайн].
Freeman SA, Modesitt SC. Терапия анастрозолом при рецидивирующих опухолях зрелых гранулезных клеток яичников: сообщение о 2 случаях. Гинеколь Онкол . 2006 ноябрь 103 (2): 755-8. [Медлайн].
Гершенсон Д.М., Хартманн Л.С., Янг Р.Х. Стромальные опухоли полового канатика яичника. Хоскинс В.Дж. и др., Ред. Принципы и практика гинекологической онкологии . 4-е изд. Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс; 2005. 1011-34.
Джеймисон С., Фуллер П.Дж. Лечение гранулезно-клеточной опухоли яичника. Curr Opin Oncol . 2008 Сентябрь 20 (5): 560-4. [Медлайн].
Ko SF, Wan YL, Ng SH. Опухоли из гранулезных клеток яичников у взрослых: спектр результатов сонографии и КТ с патологической корреляцией. AJR Ам Дж. Рентгенол . 1999 Май. 172 (5): 1227-33. [Медлайн].
La Marca A, Volpe A. Антимюллеров гормон (АМГ) в женской репродуктивной системе: полезно ли измерение циркулирующего АМГ ?. Клин Эндокринол (Oxf) . 2006 июн. 64 (6): 603-10. [Медлайн].
Lack EE, Perez-Atayde AR, Murthy AS.Опухоли из клеток гранулезной теки у девочек в пременархальном периоде: клиническое и патологическое исследование десяти случаев. Рак . 1981, 15 октября. 48 (8): 1846-54. [Медлайн].
Ли В.Л., Юань СС, Лай ЧР. Гемоперитонеум — это начальное проявление рецидивирующих гранулезно-клеточных опухолей яичника. Дж. Клин Онкол . 1999 29 октября (10): 509-12. [Медлайн].
Макэвой Г.К., изд. Информация о лекарствах AHFS . Бетесда, Мэриленд: Американское общество фармацевтов систем здравоохранения; 2000 г.
Mom CH, Engelen MJ, Willemse PH, Gietema JA, ten Hoor KA, de Vries EG. Гранулезно-клеточные опухоли яичника: клиническое значение сывороточных уровней ингибина А и В в большой одноцентровой когорте. Гинеколь Онкол . 2007 май. 105 (2): 365-72. [Медлайн].
Page R. Химиотерапевтические средства. Паздур Р., Хоскинс WH, Вагман Л., ред. Лечение рака: мультидисциплинарный подход . 4-е изд. Мелвилл, штат Нью-Йорк: PRR Incorporated; 2000 г.971-80.
Пауэлл Дж. Л., Отис Си. Лечение запущенной ювенильной гранулезно-клеточной опухоли яичника. Гинеколь Онкол . 1997 Февраль 64 (2): 282-4. [Медлайн].
Rey RA, Lhomme C, Marcillac I. Антимуллеровый гормон как сывороточный маркер гранулезно-клеточных опухолей яичника: сравнительное исследование с сывороточным альфа-ингибином и эстрадиолом. Am J Obstet Gynecol . 1996 Март 174 (3): 958-65. [Медлайн].
Робинсон Дж. Б., Им Д. Д., Логан Л.Экстраовариальная гранулезно-клеточная опухоль. Гинеколь Онкол . 1999 июл.74 (1): 123-7. [Медлайн].
Rubin SC, Sabbatini P, Randall ME. Рак яичников. Паздур Р., Хоскинс WH, Вагман Л., ред. Лечение рака: мультидисциплинарный подход . 4-е изд. Мелвилл, штат Нью-Йорк: PRR Incorporated; 2000. 409-28.
Сигал Р., ДеПетрилло А.Д., Томас Г. Клинический обзор взрослых гранулезно-клеточных опухолей яичника. Гинеколь Онкол . 1995 Март.56 (3): 338-44. [Медлайн].
Сехули Дж., Дрешер Ф.С., Мустеа А. Гранулезно-клеточная опухоль яичника: данные 10-летнего наблюдения за 65 пациентами. Противоопухолевое лечение . 2004 март-апрель. 24 (2С): 1223-9. [Медлайн].
Spencer HW, Mullings AM, Char G. Гранулезно-текаклеточная опухоль яичников. Поздняя метастазирующая опухоль. Вест-Индская медицина J . 1999 Март 48 (1): 33-5. [Медлайн].
Villella J, Herrmann FR, Kaul S, Lele S, Marchetti D, Natiella J.Клинико-патологические прогностические факторы у женщин с гранулезно-клеточной опухолью яичника взрослого типа.
